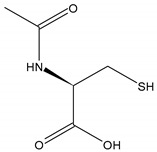
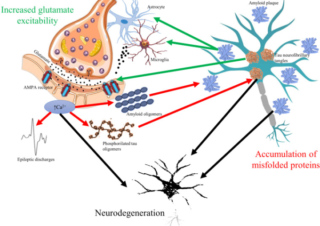
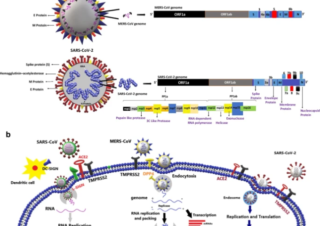
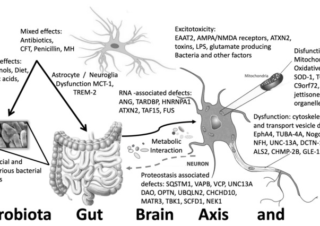
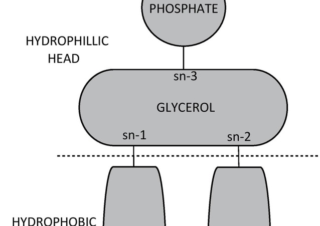
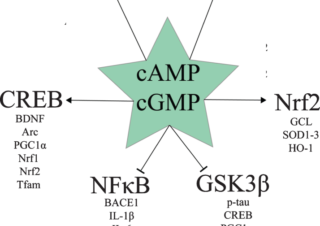
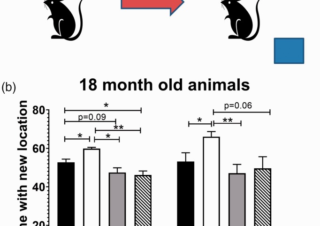
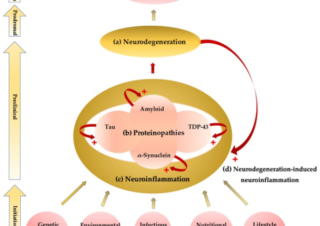
オフラベル、再利用薬
『苦しんでいる人は、低用量ナルトレキソン(LDN)についてよく知っている。なぜそのことを教えてくれないのか?』』
古くからある薬であり、論争の的になっている治療法である。 なぜそのことを知らないのか?なぜ提供されないのか?
Those Who Suffer Much Know Much about Low Dose Naltrexone (LDN) Why weren’t you told? an old drug a controversial treatment benefiting immun