Contents
The neurological sequelae of pandemics and epidemics
link.springer.com/article/10.1007%2Fs00415-020-10261-3?s=03
要旨
パンデミックにおける神経学的症状は、しばしば見落とされがちな短期的および長期的な影響を引き起こす。感染症の治療法が進歩しているにもかかわらず、神経系の関与は依然として課題であり、利用できる治療法は限られていることが多い。
神経学的症状の過小認識は、急性疾患の負担増や長期的な影響を伴う二次合併症の増加につながる可能性がある。パンデミック時の神経系の感染や機能不全は一般的であり、特に脆弱な人々の間では、その永続的な影響が忘れ去られていることが多い。
パンデミック時の神経障害のメカニズムを理解し、起こりうる症状の認識を高めることは、将来のアウトブレイクに対処する際に洞察をもたらすための基本的なことである。この知識のギャップを埋めるために、我々は、神経学的症状が明らかな人類史上の大規模かつ重要な伝染病であるパンデミックをすべてレビューし、それらの病原体によって引き起こされた、または誘発された有害な後遺症につながる可能性のある生理学的プロセスを説明した。
序論
パンデミックとは、世界的に、あるいは少なくとも広い地理的範囲で、罹患率や死亡率の過剰な増加を引き起こし、社会経済的混乱につながる感染症の大規模な発生である。世界的な旅行の増加、都市化、気候変動、環境悪化、野生動物の移動および消費は、前世紀の間にパンデミックの可能性を高めた要因であると考えられている[79]。アウトブレイクの原因となる病原体の大部分は神経学的疾患を引き起こす可能性があり、これらはしばしば見落とされ、報告されず、診断も不十分である。先進国の第三次医療センターでさえ、中枢神経系感染症の患者の最大30%は病因診断を受けておらず [135]、診断ツールを持たない低リソースの環境では、神経学的症状の特徴が乏しいことが多い。関連する死亡率とは別に、感染症の神経学的関与は、入院期間の長期化を招き、退院後のリハビリテーション時間や長期ケアの必要性を著しく増大させ [135]、広範囲に及ぶ社会経済的負担をもたらす可能性がある。
世界がSARS-CoV2パンデミックに対処するにつれ、神経学的症状の報告が増加している。過去のパンデミックの神経学的合併症、およびその背景にある病態生理学的メカニズムを理解することは、現在の状況を視野に入れ、現在の急性感染の波が治まった後の永続的な結果に対処するための基本的なものである。この叙述的レビューは、現在のパンデミックの理解を助け、将来のパンデミックに備えるために、過去および現在のパンデミックの神経学的症状を評価するものである。
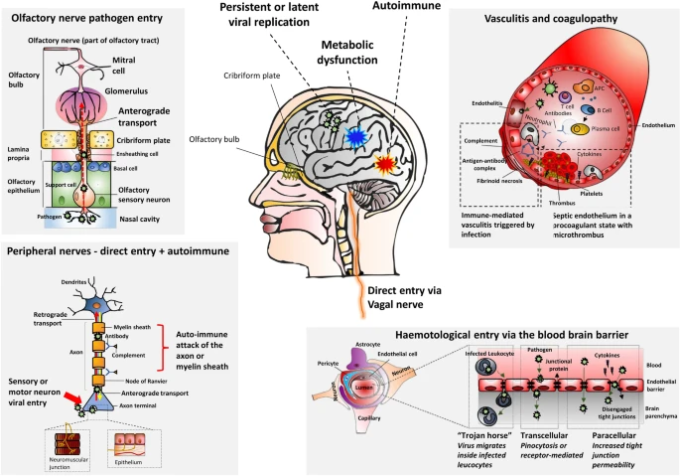
病原体が媒介する神経疾患のメカニズム
病原体は複数のメカニズムを介して神経系の障害を引き起こす可能性がある。直接感染と複製があり、脳炎、髄膜炎、髄膜炎の臨床症候群につながることがある[65]。敗血症や代謝機能障害に関連するものや凝固障害などの超感染性合併症は、脳症や血管イベントにつながる可能性がある。感染はまた、ギラン・バレー症候群(GBS)や急性播種性脳脊髄炎(ADEM)に見られるように、中枢神経系と末梢神経系の両方で間接的な免疫介在性攻撃を引き起こす可能性がある[32]。最後に、いくつかのウイルスは、中枢神経系(中枢神経系)または末梢神経節に突然変異または潜伏した状態で持続する可能性があり、潜在的な晩期再活性化および臨床疾患につながる可能性がある。さらなる詳細は、表1;図1を参照されたい。
表1 病原体誘発性神経障害のメカニズム
| メカニズム | 説明 | 神経学的症状 |
|---|---|---|
| 直接侵入 | ||
| 血液脳関門(BBB)(血液学的エントリ) | (急性宿主炎症反応に関連するBBB破壊が浸潤を促進する可能性がある)を介した内皮バリアの 浸透:経細胞浸透(飲作用または受容体媒介性侵入を使用) 傍細胞侵入(密着結合を破壊することによる) 末梢循環から中枢神経系への感染白血球の侵入を介して(トロイの木馬メカニズム)[ 28、65 ] |
脳炎 髄膜脳炎 髄膜炎 前方脊髄炎 脳症 |
| 末梢神経(シナプス間拡散) | 病原体: 逆行性(軸索終末から細胞体へ)または順行性(細胞体から軸索終末へ)輸送を介して末梢神経に沿って移動 する嗅神経および迷走神経を含む感覚、自律および運動ニューロンの軸索上の受容体に結合することによって末梢神経系に侵入する[ 68、77、84、116、142 ] |
|
| 準感染性 | ||
| 敗血症関連 | びまん性敗血症の全身性炎症反応の結果としての脳機能の妨害[ 45、148 ] 障害注意および覚醒[として現れる165 ] BBB及び脳微小循環の両方に影響を与える炎症性メディエーターの放出[ 120 ](「サイトカインストーム」) |
脳症 急性出血性白質脳炎(AHL) |
| 代謝機能障害に続発する | 分離するか、敗血症および臓器不全の状況で: 重度の低酸素 ショック誘発性低灌流 代謝障害 電解質の不均衡(低ナトリウム血症または高ナトリウム血症、低カルシウム血症または高カルシウム血症) |
発作 脳症 びまん性虚血 |
| 凝固障害および血管炎に続発する | 凝固及び血栓状態にSIRS及び敗血症リードにおける過剰炎症 直接病原体侵入の両方および内皮損傷に対する敗血症リードの炎症誘発性状態[ 144 ]、凝固促進状態にその後移行および血管透過性[増加している57、126 ] 感染を引き起こす可能性が病原体の侵入、免疫反応の誇張、または細菌毒素または抗原によって引き起こされる免疫調節不全のいずれかによる血管炎[ 136 ]。 |
脳卒中 脳静脈血栓症 頭蓋内出血 末梢神経障害 |
| 感染後 | ||
| 自己免疫 | 特にウイルスによって 引き起こされ、抗原刺激として働き、病原体と軸索膜表面の分子、ランヴィエ絞輪[ 150 ]のグリア膜、または宿主のミエリンタンパク質との間の分子模倣に関連する末梢神経系および中枢神経系の病変を引き起こす。これはT細胞の活性化と自己免疫反応につながる[ 106 ] |
ギランバレー症候群 急性散在性脳脊髄炎(ADEM) 横断性脊髄炎 急性運動性軸索ニューロパチー(AMAN) 急性炎症性脱髄性多発神経障害(AIDP) |
| ウイルス感染の持続性と潜伏性 | 神経系への直接侵入後 持続性ウイルス感染:継続的なウイルス複製 潜伏性ウイルス感染:ウイルス物質の産生が最小限またはまったくない休眠状態[ 84 ]。宿主の免疫抑制により再活性化でき、先天性免疫系と適応免疫系の両方の活性化が可能中枢神経系ホメオスタシスを破壊する[ 65 ] |
神経認知障害(HIV) 亜急性硬化性全脳炎(はしか) |
図1 神経系の傷害のメカニズム
パンデミックと歴史上の重要な伝染病の原因となった病原体
病原体は、主な感染様式(媒介性、水・食物を媒介するもの、感染者との直接・間接感染)によって分けられている。その特徴は、注目すべきパンデミック、非神経学的および神経学的症状を含めて、図2および表2に示されている。画像検査所見と検査所見を表3にまとめた。神経学的症状のより完全な説明は以下の通りである。
表2 神経学的症状が報告されたパンデミックと特定の伝染病
| 病気(病原体) | イベント/配布 | 送信モード | 潜伏期間 | 非神経学的特徴 | 神経学的症状 | 神経損傷のメカニズム | 処理 |
|---|---|---|---|---|---|---|---|
| 腺ペスト(Yersinia pestis) | 541:ユスティニアヌスの疫病—ユーラシア 1347:腺ペスト—ユーラシア 1855:第三世界の疫病—中国、インド、香港 現在:アフリカ(主にマダガスカル)での季節的パンデミック |
感染したげっ歯類のノミの咬傷感染した 体液、パラメーターとの直接接触、および感染した呼吸器飛沫の吸入 |
1〜7日 | 初期症状は、発熱、倦怠感、筋肉痛である。リンパ節炎は、ノミに刺された場所(横痃)の近くで発症し、腺ペストの形態を特徴づけます(最も一般的)。他の形態は敗血症および肺ペストです | 髄膜炎(抗生物質を服用している患者でも、病気の経過の後半に現れる可能性がある) | 直接侵入 | ペスト性髄膜炎の場合のクロラムフェニコールによる抗生物質療法。他の形態では、ゲンタマイシンまたはドキシサイクリンまたはシプロフロキサシンを使用することができる |
| ウエストナイル(ウエストナイルウイルス) | 1990年代後半:ルーマニア、ロシア、イスラエル 1999〜 2003年:南北アメリカ |
ウイルスを運ぶアカイエカに刺される。鳥は自然の貯水池です | 3〜14日 | ほとんどの感染者は無症候性である。20〜40%は、発熱、頭痛、倦怠感、筋肉痛、皮膚の発疹、胃腸の症状を伴うインフルエンザ様の病気を発症する | 髄膜炎 脳炎 前部脊髄炎 |
直接侵入 | 支持療法。特定の薬の有効性をテストすることに成功した対照試験はない |
| 日本脳炎(日本脳炎ウイルス)* | 熱帯の東南アジアと西太平洋の24か国で パンデミックしているアジアの温帯地域で2〜15年ごとに大パンデミック |
ウイルスを運ぶアカイエカに刺される。ウイルスは鳥と蚊の間のパンデミックのサイクルで存在し、ブタは増幅宿主であり、ヒトは行き止まりの宿主である。 | 5〜15日 | 感染症の大部分は無症候性または非常に軽度である。存在する場合、症状には自己限定的な発熱と最終的な鼻炎および/または下痢が含まれる | 脳炎 前部脊髄炎 GBS 横断性脊髄炎 ADEMNMDA 脳炎に関連 |
感染 後の直接浸潤—自己免疫 | 急性期の支持療法。感染後の自己免疫状態は、その状態の標準的な免疫調節治療を受ける |
| ジカ(ジカウイルス) | 2007年:ヤップ島(西太平洋) 2013年:フランス領ポリネシア 2014 年から 2016年:南北アメリカ2016年:シンガポール、ベトナム、タイ、ギニアビサウ、アンゴラ 2018年:インド |
ウイルスを媒介するネッタイシマカの咬傷、性的関係、輸血。妊娠中に垂直感染 | 3〜14日 | 感染した成人は、無症候性(50〜80%)であるか、軽度のインフルエンザ様症状(発熱、発疹、関節痛、結膜炎、筋肉痛)がある。母体と胎児の感染は症例の20〜30%で発生し、そのうち4〜7%が胎児の喪失につながる | 先天性ジカ症候群:小頭症、皮質下石灰化、脳梁、皮質奇形、網膜の変化 髄 膜脳炎横断性脊髄炎 GBS |
感染 後の直接浸潤—自己免疫 | 急性期の支持療法。感染後の自己免疫状態は、その状態の標準的な免疫調節治療を受ける |
| チクングニア熱(チクングニアウイルス) | 1960年代:アジア 2005–2007:ケニア、インド洋諸島、インド、東南アジア 2007:イタリア 2014:フランス 2014–現在:アメリカ 2017–現在:パキスタン |
ウイルスを媒介する蚊、主にネッタイシマカと低温気候耐性のヒトスジシマカに刺されます。他の形態には、血液感染、第2トリメスター中の垂直感染、出産中に母親がウイルス血症である場合の分娩時感染が含まれる。 | 3〜7日 | 発熱、多関節痛(通常は両側性および対称性)頭痛、筋肉痛、結膜炎、関節炎、悪心、嘔吐、斑状丘疹状発疹、7〜10日間。一部の患者は、急性疾患後数ヶ月から数年の間関節痛を持続する | 急性脳炎 髄膜脳炎 GBS(ミラーフィッシャー症候群およびビッカースタッフ症候群を含む) 横断性脊髄炎骨髄 神経 根炎 ADEM 視神経症 |
感染 後の直接浸潤—自己免疫 | 急性期の支持療法。感染後の自己免疫状態は、その状態の標準的な免疫調節治療を受ける |
| マラリア(熱帯熱マラリア原虫)** | アフリカ、中南米、アジア(世界人口のほぼ半分)の91の熱帯および亜熱帯の国々での地域発生がパンデミックしている。1975年にヨーロッパから排除された 気候変動に関連する気温の上昇とともにエピデミックの可能性が高まると予想される |
感染性のメスのハマダラカの蚊に刺された。また、輸血、臓器移植、針の共有使用、妊娠中の垂直 | 9〜14日 | 発熱、頭痛、発汗、悪寒、倦怠感、筋肉痛、胃腸症状 古典的な(しかしめったに観察されない)マラリア発作は6〜10時間続き、寒冷期(震え)高温期(発熱、頭痛、嘔吐)および発汗段階(発汗および疲労) |
脳症 発作 |
副感染性-赤血球の脳血管への隔離、サイトカインの放出、BBB透過性および代謝機能障害に続発する | 代謝機能障害の矯正を含む急性期の支持療法 |
| 黄熱病(黄熱病ウイルス)* | 19世紀 のアフリカ、南アメリカ、中央アメリカの47か国でパンデミック:アメリカ、ヨーロッパ(大西洋の港)カリブ海、中央アメリカ 2016年–現在:アフリカと南アメリカの非パンデミック地域への拡大 |
蚊に刺さヤブカとHaemogogus種。サルも感染しており、ジャングル地域の貯水池です | 3〜6日 | 発熱、筋肉痛、悪寒、腰痛、頭痛、食欲不振、吐き気、3〜4日間の嘔吐。一部は無症候性である。感染者の15〜25%が、発熱、嘔吐、心窩部痛、腎不全、出血性素因、トランスアミナーゼ、および深部黄疸を伴う直接ビリルビン上昇を伴う第2毒性期に入る。 | 急性期の熱性けいれん(幼児) 脳炎 脳症 黄熱ワクチン関連神経向性疾患:髄膜炎、脳炎、脊髄炎、GBSおよびADEM |
直接侵入 感染後-自己免疫(黄熱病17Dワクチンに関連) 副感染-代謝機能障害に続発 |
代謝機能障害の矯正を含む急性期の支持療法 感染後の自己免疫状態は、その状態の標準的な免疫調節治療を受ける |
| デング熱(デング熱ウイルス)* | 1970年代の散発的な症例から、世界100か国以上でパンデミックし、新しい地域で爆発的な発生が発生した。 | ウイルスを媒介する蚊、主にネッタイシマカと低温気候耐性のヒトスジシマカに刺される。周産期感染は、母親が出産近くに感染したときに発生する。母乳や血液感染も可能です | 4〜10日 | 40〜80%は無症候性である。自己制限的な症状は5〜7日間続き、高熱、頭痛(特に眼窩後部)筋肉痛、関節痛、発疹などがある。約5%は重度の疾患であり、出血の有無にかかわらず、血管透過性の増加による血漿漏出があり、ショックや重度の臓器病変を引き起こす可能性がある解熱期間(1週目以降)に現れる。 | 脳症 脳炎 無菌性髄膜炎 ADEM 横断性脊髄炎 GBS 脳神経の単神経 障害視神経症 筋肉機能障害 頭蓋内出血 |
直接侵入 副感染性—代謝機能障害に続発する ?準感染性—凝固障害および血管炎に続発する 感染後—自己免疫 |
急性期および寄生虫感染症の症状に対する支持療法。感染後の自己免疫状態は、その状態の標準的な免疫調節治療を受ける |
| ポリオ(ポリオウイルス) | 19世紀の終わり— 1955年:北欧と米国での夏の大規模な周期的発生 2008年:ナイジェリアと西アフリカ |
汚染された水または食物の摂取による口腔-糞便経路。ウイルスは中咽頭および腸粘膜で増殖し、そこから中枢神経系を含む標的臓器に広がる。 | 7〜10日 | ほとんどの感染症は無症候性であるか、発熱疲労、頭痛、嘔吐などの軽度のインフルエンザ様症状を伴う | 前部脊髄炎 髄膜炎 脳炎 ポリオ後症候群 |
直接侵入 | 支持療法。慢性期のリハビリテーション |
| エンテロウイルス-71(エンテロウイルス-71)* | 2〜3年ごとのアジア太平洋地域での周期的なパンデミック 1970年代:日本、ブルガリア、ハンガリー 1980年代:香港、オーストラリア 1997〜1998:マレーシア、日本、台湾 2008〜中国 |
汚染された水または食物の摂取による口腔-糞便経路。ウイルスは中咽頭および腸粘膜で増殖し、そこから中枢神経系を含む標的臓器に広がる。 | 3〜10日 | 小児では、手足口病を引き起こす可能性がある。発熱を伴う小児発疹、手のひらと足裏の丘疹小胞性発疹、口腔潰瘍、上気道感染症や胃腸炎としても現れる。大人はしばしば無症候性です | 脳炎、主に脳幹 無菌性髄膜炎 脳脊髄炎 小脳性運動失調 前部脊髄炎 横断性脊髄炎 GBS ミオクローヌス-オプソクローヌス |
感染 後の直接浸潤—自己免疫 | 急性期の支持療法。感染後の自己免疫状態は、その状態の標準的な免疫調節治療を受ける |
| 変異型クロイツフェルト・ヤコブ病(牛海綿状脳症[BSE]プリオン) | 1985年:牛海綿状脳症(BSE)の説明 1995年:英国で始まり、13か国に広がる |
汚染された食品(特に牛の肉)の摂取、まれに輸血や臓器移植による摂取 | 15〜20年 | 症状は中枢神経系感染症と顕著に関連している | 精神症状:うつ病、妄想、幻覚 感覚障害、特に痛み 認知症 運動失調 運動障害:ミオクローヌス、舞踏病、振戦 |
直接侵入 | 神経精神障害の対症療法。病気の容赦ない最終段階での緩和ケア |
| コレラ(Vibrio cholerae) | 1817〜 1824年:第1回コレラパンデミック—アジア、中東、カスピ海盆地 1829〜 1837年:第2回コレラパンデミック—ヨーロッパ、エジプト、北アメリカ 1846〜 1860年:第3回コレラパンデミック—ヨーロッパ、北アメリカ、アジア、中東 1863〜1875 :第4回コレラパンデミック—アジア、ヨーロッパ、アフリカ、北アメリカ 1881–1896:第5回コレラパンデミック—ヨーロッパ、日本、ペルシャ、エジプト 1899–1923:第6回コレラパンデミック—ロシア、オスマン帝国、フィリピン、米国 1961–1975:第7コレラパンデミック—インドネシア、バングラデシュ、ソビエト連邦、北アフリカ、イタリア 1991–94:南アメリカ、DRC(当時はザイール) 2010年-ハイチ、ドミニカ共和国 2011年-2018年-ナイジェリア、DRC、ガーナ、シエラレオーネ、ガーナ、タンザニア、ソマリア、アルジェリア、ジンバブエク 2017年-現在:イエメン |
汚染された食品または水の摂取による口腔-糞便経路 | 12時間〜5日 | ほとんどの感染者は無症候性であるが、それでも細菌の糞便排出を示する。症状は軽度から重度までさまざまで、水様性下痢や嘔吐などがある。便は、粘液の薄片があり、魚臭がする米の水に似ている。熱はない。脱水症状が急速に起こり、血液量減少性ショックにつながる可能性がある | 電解質障害に続発する発作 末梢神経障害— 2013年の発生時に報告された |
準感染性—代謝機能障害に続発する | 積極的な水分補給と電解質障害の矯正(経口および静脈内の両方)中等度および重度の患者に対するドキシサイクリン(成人の1行目)またはアジスロマイシン(子供と妊婦の1行目)による抗生物質療法、亜鉛補給(子供の間) |
| インフルエンザ(インフルエンザウイルス) | 1889年:ロシア風邪—シベリアとカザフスタン(H3N8)で始まり、ヨーロッパとアジアに広がりました 1918–1920:スペイン風邪(H1N1)—ヨーロッパとアメリカで最初に観察されてからグローバルになった 1957年:アジア風邪(H2N2)—香港で始まる、中国、米国、ヨーロッパに広がる 1968年:香港風邪(H3N2)-グローバル 2009年:豚風邪(H1N1 pdm09)-グローバル |
感染した人やパラメータからの呼吸器飛沫との直接接触 | 1〜4日 | 一般的な症状には、発熱、悪寒、咳、喉の痛み、鼻水、筋肉痛、頭痛、倦怠感、胃腸症状(子供に多く見られる)が含まれる。合併症には、肺炎、心筋炎、敗血症などがある。妊娠中の女性、5歳未満または65歳以上で、基礎となる健康状態にある女性は、合併症のリスクが高くなる | 無菌性髄膜炎 脳炎 脳症 脳卒中 急性壊死性脳炎 クライン・レビン症候群 GBS 横断性脊髄 炎ライ症候群の 脳症状態脳炎レサルギカ 脳炎後パーキンソニズム |
?直接浸潤 副感染性-敗血症関連 副感染性-代謝機能障害に 続発性副感染性-凝固障害に続発 性感染後-自己免疫 |
支持療法。オセルタミビルと高用量コルチコステロイドの両方を急性期に使用することができる。感染後の自己免疫状態は、その状態の標準的な免疫調節治療を受ける |
| コロナウイルス(SARS-CoV、MERS-CoV、SARS-Cov2) | 2002–03:SARS-CoV—グローバル(30か国)中国で開始 2012:MERS-CoV 22か国、中東で開始 2019:SARS-Cov2—グローバル |
感染した人の呼吸器飛沫またはパラメータとの直接接触 | 2〜14日 | 一部は無症候性である。これらのコロナウイルスのほとんどは、咳、喉の痛み、コリザ、発熱、悪寒、倦怠感、筋肉痛、頭痛の吐き気などの軽度の上気道症状を発症する。小包は重度の肺炎と呼吸不全で進化する | 脳症 髄膜脳炎 急性壊死性脳炎 視神経炎 脳卒中 ミオパチー GBS(ミラーフィッシャー症候群およびビッカースタッフ症候群を含む) 脳神経の単神経障害 ADEM |
直接浸潤 副感染性-敗血症関連 副感染性-代謝機能障害に 続発性副感染性-凝固障害および血管炎に続発 性感染後-自己免疫 |
急性期の支持療法。感染後の自己免疫状態は、その状態の標準的な免疫調節治療を受ける |
| エボラ(エボラウイルス) | 1976:スーダン、DRC(当時はザイール) 1995–1997:ガボン、DRC(当時はザイール) 2001–2003:ウガンダ、ガボン、コンゴ共和国 2007–2009:DRC、ウガンダ 2013–2016:ギニア、リベリア、シエラレオーネ、ナイジェリア、マリ、セネガル、イタリア、アメリカ、スペイン、イギリス 2018-現在:DRC、ウガンダ |
ウイルスを運ぶコウモリ(メイン貯水池)または感染した野生動物(中間宿主)との接触。体液やパラメータとの直接接触によって簡単に広がる(病気の世話や死亡した患者の取り扱いは特にリスクが高くなる)性的接触によっても伝染する(急性感染後12か月まで) | 2〜21日 | 初期症状には、3日間の高熱、倦怠感、体の痛みが含まれ、吐き気、大量の下痢、7〜10日間の嘔吐などの胃腸症状に発展する。この段階で、一部の患者はショック状態になり、出血性症状(結膜、胃腸および粘膜の出血)を呈する可能性がある。 | 髄膜 脳炎脳症 エボラ症候群後:記憶喪失、頭痛、生存者の筋肉痛 |
直接侵入 副感染性—敗血症関連の 準感染性—代謝機能障害に続発する |
早期の水分補給、電解質障害の矯正、二次感染の治療による支持療法 |
| はしか(はしかウイルス)* | 1963年まで:ワクチンが開発されるまで、2〜3年ごとに大規模な世界的発生、世界中で症例数が減少 2019年–現在:世界のすべての地域での発生(症例数の増加と最後のヨーロッパと米国の地域での復活10) |
感染した人やパラメータからの呼吸器飛沫やエアロライズされた粒子との直接接触。エアロライズされた粒子は、最大2時間空気中に留まる可能性がある | 7〜14日 | 高熱と、鼻炎、咳、結膜炎の3つの症状のうちの1つ以上から始まる。コプリック斑(小さな白い斑点)は、症状が現れてから2〜3日後に口の中に現れる。斑状丘疹状発疹は、症状の発症から3〜4日後に現れる | 急性脳炎(原発性麻疹脳炎) 急性麻疹後脳炎 麻疹封入体脳炎(MIBE) 亜急性硬化性全脳炎(SSPE) ADEM |
直接侵入 感染後-持続感染または潜伏感染感染後 -自己免疫 |
かわいい段階でのサポートケア。急性麻疹後脳炎はコルチコステロイドで治療することができ、静脈内IgGは可能な二次治療である。MIBE治療は支持的であり、リバビリンは有益であると報告されている。SSPE患者は緩和ケアを受け、症状をコントロールする |
| エイズ(ヒト免疫不全ウイルス-HIV) | 1981年–現在:グローバル | 血液、母乳、精液、膣分泌物など、感染した人々からの体液の交換。ウイルスは妊娠中や出産時にも垂直感染する | 最初の急性感染症の症状は2〜6週間 エイズの発症まで2〜15年 |
急性感染症は、発熱、喉の痛み、体の発疹、倦怠感、筋肉痛、リンパ節腫脹を伴うインフルエンザ様の病気として1〜2週間現れる。何年にもわたる慢性感染の症状は、免疫系の損傷に関連して現れ、その後の日和見感染に関連している。それらには、体重減少、慢性下痢、発熱、皮膚病変、および日和見感染に関連する臓器損傷に関連するその他の症状が含まれる。 | 無菌性髄膜炎 亜急性脳炎 神経 認知障害 末梢神経障害 GBS真空 脊髄症 脳卒中 筋萎縮性側索硬化症様 ミオパチー 再活性化ウイルスによる二次感染の素因:進行性多巣性白質脳症(PML)(JCウイルス)原発性中枢神経系リンパ腫(エプスタインバーウイルス)神経陰窩ネオフォルマンス)ニューロトキソプラズマ症(Toxoplasma gondii) |
直接浸潤 副感染性-凝固障害および血管炎に続発 感染後-自己免疫 感染後-持続感染または潜伏感染(他の潜伏ウイルスの二次再活性化を含む) |
HIVに対するARTの早期開始は、ウイルスの直接的な影響と日和見感染に続発する合併症の両方に対して効果的である。また、疾患に関連する認知障害の進行を遅らせることも示されている。 末梢神経障害の治療には、ARTを開始するか、ART関連の末梢神経障害を一時停止することにより、痛みの緩和と進行の防止の両方が含まれる。 |
| 天然痘(天然痘ウイルス) | 古代以来のアジアの 風土病さまざまな発生を 伴う11世紀以降のヨーロッパの風土病165AD:アントニン疫病—ローマ 735–737:日本16-17 世紀:南北アメリカ—18世紀の先住民の減少 :米国 |
患者の痛み、パラメータ、感染者の呼吸器飛沫からの液体との直接接触 | 7〜19日 | 2〜4日間の発熱、筋肉痛、頭痛、倦怠感、そして最終的な嘔吐の後。舌と口の初期の発疹が始まり、その後に全身性の皮膚の発疹が続く。それは6日目頃に膿疱性発疹に進行し、それからクラストとかさぶたを形成する。発疹が始まってから3週間後、ほとんどのかさぶたが落つ | 感染後脳脊髄炎 ワクチン接種後脳脊髄炎 |
感染後—自己免疫 | 支持療法 |
表3 各パンデミック疾患の画像と検査室の特徴
| 疾患 | イメージング | 実験室 |
|---|---|---|
| ペスト[ 8、34、35、82、109、158 ] | Y. pestis(ただし陰性培養) の脳脊髄液でPCRが陽性で、MRIが正常 である小児ペストの文献での症例報告は1回だけです。 | 脳脊髄液:中等度の好中球髄液細胞増多、タンパク質の増加、低グルコース。リンパ球性髄液細胞増多症と正常なブドウ糖も一部の患者で報告されている血液 :好中球性白血球増加 症 |
| 西ナイルウイルス[ 29、123、131、147 ] | 脳CTは通常正常である。存在する場合、脳MRI異常は、第1週に見られる可能性が高く、軟髄膜の増強、脳室周囲領域のT2 / Flair高信号病変、深部脳構造(視床、大脳基底核、赤核、大脳脚、黒質)および近心が含まれる。側頭葉。DWIシーケンスはT2 / FLAIRの前に病変を検出する可能性がある ほとんどのAFP症例は正常な画像を持っているが、前角と根に異常を示すものもある |
脳脊髄液:髄液細胞増多症。これは、好中球性またはリンパ球性、正常なブドウ糖、および脳炎または髄膜炎におけるタンパク質の上昇である可能性がある。AFPでも同様の所見があるが、タンパク質レベルが上昇している。 血液:白血球増加症、AST、ALT、血清リパーゼの上昇が一般的に説明されている |
| 日本脳炎[ 131、140、145 ] | CT:両側視床低密度。出血性であり、MRIでのみ視覚化される可能性がある。MRIの変化には、視床、中脳、橋、小脳、大脳基底核、大脳皮質の高信号病変が含まれる。 | 脳脊髄液:通常はリンパ球性多細胞症(無細胞の場合もある)正常なタンパク質およびグルコースレベル 血液:好中球増加症および低ナトリウム血症が頻繁に見られる |
| Zikaウイルス[ 7、90、93、94、105 ] | 症候性先天性ジカ症候群の脳MRI異常は、白質と灰白質の両方に影響を及ぼし、重度の小頭症、脳室肥大、頭蓋骨崩壊、華やかな灰白質界面の石灰化、脳梁異常、大脳皮質の菲薄化、異常なジャイラルパターン、橋萎縮、小脳形成不全、脈絡網膜萎縮、小眼球症、白質および視神経萎縮。非特異的で正常な脳炎の成人症例の神経画像。最も一般的に報告されている所見は、非対称の皮質下T2 /フレア高信号病変です(DWIでも見られる) | 脳脊髄液:中等度の髄液細胞増多症と軽度に上昇したタンパク質、髄膜脳炎ではほとんど正常なブドウ糖。GBSでは、通常は正常なWBCとタンパク質レベルの上昇 血液:白血球減少症、血小板減少症、トランスアミナーゼレベルの上昇 |
| チクングンヤ熱[ 19、41、42、86、146 ] | 脳のCTとMRIは、脳炎の場合でも正常である可能性がある。両方の画像診断法は、急性期に大脳のさまざまな領域で非特異的な浮腫と出血を示す可能性がある。ADEMの症例は、脱髄と一致するT2 / FLAIR高信号の典型的なコンフルエントな領域を示する。骨髄障害患者は、患部に脊髄T2 / Flair高信号病変を有する | 脳脊髄液:髄液細胞増多症(非常に軽度または正常である可能性がある)および髄膜脳炎および骨髄神経根炎におけるタンパク質の上昇 血液:リンパ球減少症(ほとんど常に存在)血小板減少症、ASTおよびALTの上昇および低カルシウム血症 |
| マラリア[ 78、107、111、153 ] | 脳画像所見は寄生虫血症とは相関せず、正常である可能性がある。CTは、特に後脳、視床の虚血性低密度、および小脳白質が関与する血管原性浮腫を示すことがある。脳MRIは、視床、脳室周囲白質、脳梁、後頭皮質下および大脳基底核に非特異的なT2WI高信号を示する。 | 脳脊髄液:非常に軽度の髄液細胞増多症、低グルコースおよびタンパク質レベルの上昇 血液:貧血、高ビリルビン血症(溶血による)血小板減少症、血色素尿症、およびトランスアミナーゼの上昇は、通常、さまざまな重症度で見られる。幼児や妊婦は低血糖症や代謝性アシドーシスを患っている可能性がある |
| 黄熱[ 85、89 ] | 黄熱病関連脳炎のMRI研究は不足している。症例報告では、大脳脚、延髄、脊髄、および大脳白質における非特異的T2WI高信号病変を伴う黄熱病17Dワクチン接種のまれな合併症に関連する病変が報告されている。 | 文献に黄熱病の脳脊髄液に関する情報はほとんどあり ません。血液:白血球減少症(相対的な好中球減少症を伴う)血小板減少症、アミノトランスフェラーゼとビリルビンレベルの上昇、プロトロンビン時間(PT)の増加、アルブミン尿 |
| デング熱[ 17、49、129 ] | 脳CTは出血の実質内病巣を明らかにするかもしれない。髄膜脳炎の脳MRIは、視床、大脳基底核、皮質灰白質、皮質下白質の両方でT2WIとDWIに高信号を示すことがよくある。点状出血とびまん性脳浮腫が一般的です | 脳脊髄液:ほとんどの脳炎の場合はしばしば正常である。デング熱脊髄炎、脳炎、または髄膜炎には、タンパク質レベルが正常または上昇した中程度のリンパ球性多細胞症が存在する可能性がある。 血液:白血球減少症、血小板減少症、ヘマトクリット値の上昇 |
| ポリオ[ 38、58、63、81 ] | MRIは、脊髄と運動皮質の両方でT2W高信号腹側運動路を示している | 脳脊髄液:髄液細胞増多症(1日目に好中球増加し、その後リンパ球に進行する)タンパク質レベルの軽度の上昇、急性期の正常なブドウ糖 |
| エンテロウイルス-71 [ 59、67、100、125、130、133 ] | 脳炎患者では、脳幹が最も影響を受ける部位である。脳MRIは、中脳、歯状核、橋の背側(橋被蓋)大脳基底核、延髄にT2W高信号を示する。通常、テント上への関与はない | 脳脊髄液:軽度のリンパ球性多細胞症(正常かもしれないが)通常は急性脳炎患者のタンパク質およびグルコースレベルは正常です血液 :白血球増加症、主に好中球増加症、特に中枢 性病変のある患者 |
| 変異型クロイツフェルト・ヤコブ病[ 15、88 ] | vCJDのほとんどの症例の脳MRIは、特徴的な「肺胞徴候」を示している。これは、他の領域ではなく、視床後部のT2Wで信号が高い領域である。関与する可能性のある他の領域には、背内側視床核および中脳水道周囲灰白質が含まれる。尾状核、被殻、皮質領域のT2Wand DWIの高信号は、sCJDに特徴的に関与しており、vCJD患者にも影響を与える可能性がある。 | 脳脊髄液:通常は正常であるが、総タンパク質の上昇が中程度の場合もある。脳脊髄液 14-3-3は、vCJD患者の半数でのみ陽性です |
| インフルエンザ[ 1、18、30、44、51 ] | 脳炎患者は正常な画像を呈することがある。特定の脳炎症候群がこれらの患者で報告されており、板状骨の兆候(脳梁の脾臓におけるT2およびDWIの高信号)に分けられている。ANEパターン(急性壊死性脳炎-視床、中脳、橋、小脳、半卵円中心のT2WIにおける高信号); PRESパターン(半卵円中心のT2WIの高信号、後方でより顕著)。悪性脳浮腫(びまん性脳浮腫)。感染後の小脳炎は、脳幹の圧迫と水頭症を伴う、小脳のT2WI高信号画像を表示する。嗜眠性脳炎の患者は、中脳、腹側視床、視床下部のニューロンの喪失を示した。ウイルス性パーキンソン症候群後の被験者は、黒質と青斑核の色素脱失があった | 脳脊髄液:正常または髄液細胞増多を伴う、タンパク質が頻繁に上昇する、正常なブドウ糖、脳炎の場合血液 :変動する、正常に近い場合がある。頻繁なリンパ球減少症、血小板減少症、AST、CRPの上昇 |
| コロナ[ 55、66、70、102、162、163、165 ] | SARS-Cov1およびMERS-CoVに感染した患者の脳画像に関する情報はほとんどないが、最近の研究では、SARS-Cov2に続発する神経症状のある患者の病変の変化が報告されており、新しい情報が毎日出てく。記載されている病変の多くの中で、最も頻繁に報告されるのは、主に脾臓、皮質近傍のU線維および主な白質路に影響を与えるSWI異常(卵形または管状の形状)T2WIおよびDWI関連の非コンフルエントな白質高信号病変出血性病変ではなく、しばしば脳梁および中小脳脚、浮腫を伴う対称視床病変、ペテチアル出血およびANEと互換性のある壊死(脳幹への可変拡張を伴う、脳および小脳白質路)他に記載されている病変には、視神経くも膜下腔の隆起、内側側頭葉および嗅球の異常、実質内病変、軟髄膜および脳神経のコントラスト増強が含まれる。一部の患者はまた、脳室周囲領域および脊髄にT2WIの高信号を発症し、脱髄を示唆しており、COVID19患者のADEM適合性病変が報告されている。 | 脳脊髄液:正常または髄液細胞増多症、さまざまな程度のタンパク性出血および一般的に正常なブドウ糖血液 :さまざま。頻繁な所見は、リンパ球減少症、好酸球の減少、アルブミンの減少、CRPの上昇、LDHの増加、インターロイキン-6の増加である。 |
| エボラ[ 10、21、22、60、80、115 ] | エボラ髄膜脳炎と推定される患者はめったにスキャンされない。症例報告は、皮質下白質、脳梁および第四脳室周囲の点状のT2WI高信号病変を記載しており、微小血管病変と互換性がある | 脳脊髄液:ウイルスの遺伝物質を検出するためにのみ評価された少数の症例報告 血液:白血球減少症(疾患の初期)または白血球増加症、血小板減少症、トランスアミナーゼ上昇(AST> ALT)。疾患に関連する容積減少を伴う電解質障害:低/高ナトリウム血症、低カリウム血症、低カルシウム血症および低マグネシウム血症。凝固異常が発生する可能性がある |
| 麻疹[ 6、16、39、47、74、124 ] | 急性期および急性麻疹後脳炎では、脳MRIは、大脳半球の両方で多発性高信号T2WI、背側線条体および皮質浮腫の関与を示する。MIBEは、脳幹、小脳、多発性皮質および皮質下灰白質病変(大脳基底核および視床を含む)にT2WIおよびDWIの高信号病変を示し、コントラストの増強 はない。SSPEは進行性の経過をたどり、最初は白質のT2WIに斑状の非対称高信号病変がある。頭頂葉と側頭葉の両方の。それは脳梁と大脳基底核を含むように進行し、全身性脳軟化症で最高潮に達する |
脳脊髄液:急性脳炎および急性麻疹後脳炎:高タンパク質および軽度の低グルコース MIBEを伴うリンパ球性髄液細胞症-脳脊髄液は通常正常であるが、髄液細胞増多症およびタンパク質の上昇を示す場合がある。SSPE-高力価のはしか抗体のみ 血液:急性感染時の白血球減少症、血小板減少症、T細胞血球減少症 |
| HIV [ 54、95、110、132 ] [ 5、24、99、117、118、127、134、161 ] | HIV関連脳症は通常、対称性のT2WI高信号病変を呈し、主に脳室周囲および深部白質に影響を及ぼし、関連する脳軟化症を伴い、質量効果または増強はない。HIV関連の脳血管障害は、くも膜下または実質内出血または塞栓性梗塞を引き起こす可能性のある、大および中動脈の複数の結節性および紡錘状動脈瘤を引き起こす可能性がある。HIV関連の空胞性脊髄症は脊髄萎縮(主に胸部レベルであるが、頸髄が影響を受ける可能性がある)を呈し、頻繁な両側対称後柱の関与を伴う AIDS患者における中枢神経系日和見感染症はその薬剤に依存する特徴がある。 -神経トキソプラズマ症は、通常、大脳基底核および1〜3cmの皮質髄質接合部および病変周囲浮腫に結節性病変を引き起こす。脳MRIは、コントラストリング後の増強を伴うT2WIの低/高および等強度の同心円状の交互ゾーンを示する-CMV 脳炎は、脳室周囲白質に非特異的なT2WI高信号を示し、質量効果および増強はない -神経クリプトコッカス症は通常、ほとんど増強されていない病変を引き起こし、大脳基底核および大脳半球、脳幹、小脳の白質の血管周囲腔に沿って広がる。拡張した血管周囲腔は、T2WIで高い信号を発するゼラチン状の偽嚢胞(「シャボン玉」)に合体する可能性がある。クリプトコッカスは通常、脳実質のT2WI高強度結節性病変であり、さまざまな増強が見られる。髄膜疾患は通常、軟髄膜および髄膜の増強を示する -PMLは通常、多病巣性で非対称であり、脳室周囲および皮質下の脱髄病変、特に頭頂後頭領域の皮質下U線維を伴う。関与する領域の周りの複数の点状の高いT2信号病変(「乳白色の道の兆候」)は、それを複数の硬化症病変と 区別する-中枢神経系リンパ腫は、古典的にテント上腫瘤病変として現れる。上衣下の伸展と脳梁の交差 |
脳脊髄液:HIV無菌性髄膜炎:高または正常なタンパク質および正常なグルコースレベルを伴う単球性またはリンパ球性髄膜炎 特定の日和見因子がさまざまな脳脊髄液パターンをもたらす血液 :リンパ球減少症および血小板減少症は、HIV感染の急性期(曝露後数日から数週間)に頻繁に見られる |
図2 重要な神経学的合併症を含む重要なパンデミックの年表
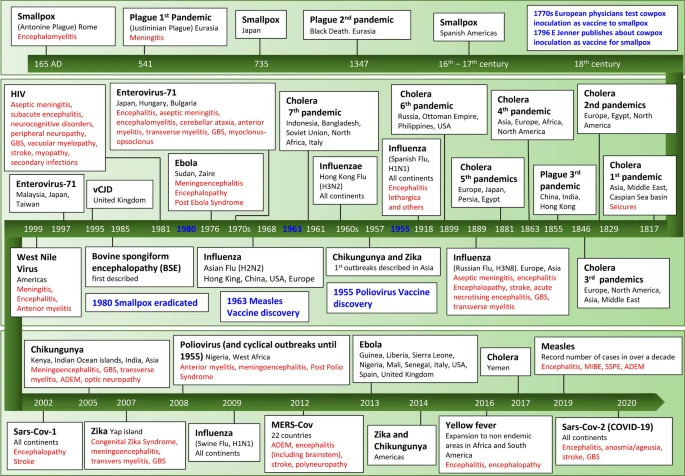
これらは、感染症によって引き起こされた最初のパンデミックについて記載されている。
ベクター媒介
泡状ペスト
最初のペストの大パンデミックは、ユスティニアヌスのペストとして知られ、6世紀に発生し、ローマ帝国の終焉を早めることになったと考えられている。第二次世界大戦は「黒死病」と呼ばれる大パンデミックで始まり、1億人以上の死者を出したと推定されており、歴史上のパンデミックの中では最高の規模となっている。現在、ほとんどのヒトの症例はアフリカにあり、毎年のパンデミックはマダガスカルで報告されている[156]。髄膜炎は全患者の最大7%で報告されており、典型的にはブボニック型の治療が不完全または遅延した患者では1週間目以降に報告されている。若い患者ほどイェルシニア髄膜炎の発生率が高い(小児の約11%) [8, 14, 82]。イェルシニア髄膜炎は細菌性髄膜炎として発症し、脳脊髄液中に好中球性多球症を伴う。診断のための標準は、血液、喀痰、ブボ吸引液、または脳脊髄液中のY. pestisの培養であるが、免疫クロマトグラフィーアッセイまたはポータブルサーモサイクラー中の定量PCRを用いたポイントオブケアテストを用いて細菌を検出することもできる [35,158]。
西ナイルウイルス(WNV)
このウイルスは、1937年にウガンダの西ナイル州で初めて同定された [122]。1999年にニューヨークで発生した大パンデミックは南北アメリカ大陸の他の地域にも広がり、西半球で報告された髄膜炎または脳炎の史上最大のパンデミックをもたらした [69]。感染者の1%未満が神経侵襲性疾患を発症したが、65歳以上の人で発症率が高く、死亡率も高い。神経学的症候群は、髄膜炎、髄膜脳炎、および前骨髄炎に続発する急性弛緩性麻痺に重複して分けられることがあり、典型的には急性期に発症する。急性期には錐体外路徴候が一部の脳炎症例にみられ、一過性のものや、病気が治まってから数ヶ月後に持続するものもある。発作や脳症も報告されている[123]。
日本脳炎
日本脳炎ウイルス(JEV)の大パンデミックは、東南アジアと西太平洋地域で2~15年ごとに発生し、世界で最も多く診断されるパンデミック性脳炎となっている(~70,000件/)。節足動物を媒介とするウイルスの中でも、JEVは神経学的な後遺症が多いため、障害調整後の生命年数の損失が最も大きいとされている。感染の大部分は無症状または軽度であるが,0.1~1%は主に小児に脳炎を引き起こす。急性期に発症する。症状としては、意識障害、頭痛、嘔吐、痙攣などがある。錐体外路徴候や錐体外路徴候、頭蓋神経の関与、眼球運動異常、前骨髄炎などが記載されている。同様の神経学的特徴は成人でも認められる。他の免疫学的症状としては、ウイルス性疾患の発症から数週間後に、GBS、ADEM、横隔膜炎、N-メチル-D-アスパラギン酸(NMDA)受容体脳炎がみられる。JEV脳炎患者の約5分の1が死亡し、神経学的な病変を持つ患者の44%が不完全な回復を示している[140]。
ジカ
ジカウイルスは1947年にウガンダで報告され、アジアや太平洋地域でパンデミックを引き起こしている。2014~2016年にはブラジル北東部で新生児の間で小頭症のパンデミックを引き起こした[31]。先天性ジカ症候群は、感染した母親の妊娠の5~14%に発生し、重度の小頭症、頭蓋虚脱、皮質下石灰化、胼胝体異常、白質減少、脳室巨大症、大脳皮質の菲薄化、異常な回旋パターン、四半規管低形成、絨毛網膜萎縮、網膜の焦点性色素斑、視神経萎縮、先天性拘縮を含む[90,94]。ジカウイルス関連GBS(軸索性および脱髄性の両方)は、急性疾患の5~15日後に報告されている [94]。
チクングニヤ熱
チクングニヤウイルスは、1952年のタンザニアでの発生時に分離され、世界中で重大な伝染病が記述されてきた。最も最近のパンデミックは2013年に始まり、米国南部、メキシコ、中南米に影響を与え、200万人以上の感染が報告されている[146]。幼い子供や高齢者は合併症のリスクが高く、感染者の約1%に影響を及ぼす可能性がある。脳症および脳炎は、ウイルスの直接侵入によって引き起こされ、感染中の早期に発現する[19]。髄膜炎は、急性期に発生することもあれば、病気の経過の後半に発生することもある。自己免疫性と考えられる遅発性の感染後合併症としては、ADEM、視神経障害、GBS、脳幹脳炎、Bickerstaff脳炎-Miller-Fisher重複などがある[19]。
水または食物を媒介とする
エンテロウイルス
エンテロウイルスは、10歳未満の小児におけるウイルス性髄膜炎の90%以上を引き起こし、最も多いのはエコーウイルスとコクサッキーBである[77]。パンデミックと顕著な神経学的症状を引き起こした2つのエンテロウイルスを以下に詳述する。
ポリオウイルス
ポリオ脊髄炎は19世紀末まで散発的に報告されていたが、北米およびヨーロッパで大規模な夏季伝染病が毎年発生し始めた [96]。1955年以降のワクチン接種プログラムの開発と実施により、発生率は劇的に減少したが、発生はアフリカとアジアで今も発生しており、ナイジェリア、アフガニスタン、パキスタンでパンデミックしている。150回の感染のうち約1回は麻痺性ポロミエレン炎になる [96]。ウイルスが中枢神経系に到達すると、髄膜炎期を経て脊髄性ポロミエレン炎となり、感染の初期に前骨髄炎に続発する二次性の急性弛緩性麻痺が発症する。神経機能が安定した期間(15年以上)を経て、ポリオ生存者の30~40%は、進行性で持続性の新しい筋力低下と疲労感の増大を呈し、ポリオ後症候群の特徴となっている。病因は完全には解明されていないが、さらなる脱神経を伴う脱神経・再神経平衡の乱れに関連していると考えられている。2016年には、世界で1,500万~2,000万人のポリオ生存者がいると推定されている[76]。
エンテロウイルス-71(EV71)
このウイルスは1969年に分離され、小児の手足口病の一般的な原因となっている。アジア太平洋地域では2~3年ごとに周期的に大規模なパンデミックが発生し、それ以外の地域では低レベルで循環し、ヨーロッパ、北米、およびアフリカでは小規模なパンデミックが見られる[130]。小児では、発症から3~5日後に中枢神経系の症状が現れることがある [100]。マレーシアで発生したアウトブレイクでは、入院した小児の10~30%に神経学的症状が見られ、無菌性髄膜炎、脳炎、および前骨髄炎、GBS、横骨髄炎に続発する急性弛緩性麻痺が含まれてた [59]。最も一般的な中枢神経系の症状は脳幹脳炎であり、髄質に重篤な影響を与え、心機能障害および神経性肺水腫へと頻繁に進展する。2歳未満の小児では発作が起こることがある。脳炎の場合はミオクロニック・ジャークが頻発する。重度の神経学的症状を呈する小児の5分の1までが後遺症を有しており、脳幹脳炎と心肺不全を有する小児の4分の1しか神経学的に完全に回復していない[20]。
変異型クロイツフェルト・ヤコブ(vCJD)
ウシ海綿状脳症(BSE)は1985年に初めて記述され、1992/1993年にピークを迎えた。ヒトにおけるvCJDの最初の症例は1995年に英国で報告され[149]、BSEのプリオンが原因であることが判明した[26]。潜伏期間は15~20年と長い場合もある [27]。vCJDの初期段階では、うつ病、短期間の妄想、幻覚が最も一般的であり、精神医学的特徴が顕著である[15]。60%以上の患者が持続的な疼痛性感覚症状を呈し、しばしば側方化している。大多数の患者は発症から4~6ヵ月後に小脳の特徴を呈する。筋攣縮は発症から6ヵ月以上経過した後期の特徴であり、この段階ではコレア、振戦、ジストニアも一般的である。眼球運動障害および複視の訴えが患者の半数にみられることがある [15]。すべての患者が認知障害(初期症状は見当識障害と記憶力低下)を発症し、最終的には認知症に至る。死に至るまでの進行は、発症から平均14ヵ月後に起こる。
感染者との直接または間接的な接触
インフルエンザ
インフルエンザウイルスは季節性とパンデミックに分けられる。季節性インフルエンザAウイルス(H3N2およびH1N1)は、毎年のパンデミックを引き起こすが、インフルエンザのパンデミックは、種を超えた感染の結果であり、それに続いてヒトへの適応が起こる[77]。中枢神経系はインフルエンザ感染症の呼吸器外合併症の最も一般的な部位です[77]。熱性発作と脳症は最も頻繁に起こる神経学的症状で、主に小児に影響を与える[137]。その他の急性神経学的症状には、髄膜炎、脳炎(急性壊死性脳症および急性出血性白質脳症を含む)および虚血性脳卒中の頻度の増加があるが、これらはすべて急性疾患中のものである[11, 137]。インフルエンザはまた、薬剤(特にアスピリン)が引き金となり、ミトコンドリア機能障害と肝代謝不全を伴う急性脳症であるレイ症候群と関連している可能性もある[121]。
インフルエンザの感染後後期の神経学的合併症は広範囲に報告されており、成人ではより頻繁に発生している。これらには、GBS、小脳炎、クライン・レヴィン症候群、筋炎、横隔膜炎などが含まれる[137,150]。リーサルギカ脳炎(フォン・エコノ病)とインフルエンザAとの関連性は、1918年のインフルエンザ大パンデミックの後に発生したリーサルギカ脳炎の症例から示唆されている[56]。急性期には、患者は過度の眠気、眼球運動障害、発熱、運動障害を呈し、しばしばインフルエンザ様症状が先行した。慢性期は典型的には急性期から1~5年後に発症するが、最大で45年遅れている。症状には、精神症状、異常な眼球運動、発話異常、痙縮および活発な反射を伴うパーキンソン病が含まれる;神経学者オリバー・サックスが著書「Awakenings」[114]の中で記憶に残るように記述した一連の症状群である。リーサルギカ脳炎がインフルエンザウイルスによる直接的な中枢神経系の侵襲によって引き起こされるのか、それともウイルス関連の自己免疫現象であるのかについては論争が続いている [56]。リーサルギカ脳炎とは関係のない脳炎後パーキンソン病の他の症例が、インフルエンザ感染後に報告されている [61]。
コロナウイルス
21世紀に入ってから 2003年の重症急性呼吸器症候群(SARS-CoV1)2012年の中東呼吸器症候群(MERS-CoV)2019年のSARS-CoV2(COVID-19としても知られている)という3つのコロナウイルス(CoV)がパンデミックの原因となっている。ほとんどのヒトコロナウイルスは軽度の呼吸器症状を引き起こすだけで、4つの株が世界的にパンデミックしており、免疫不全者の上気道感染の最大3分の1を占めている。HCoV-229E、-OC43,-NL63および-HKU1 [32]。
コロナウイルスは中枢神経系に侵入することができ、脱髄性疾患 [4]、視神経炎 [33]、パーキンソン病 [37] を含む多くの神経学的後遺症と関連している。HCov-OC43は、ADEMの1例[160]、免疫不全児の致死的な脳炎[91]、および脳炎を発症した中国の小児のサブセット[75]と関連していた。
SARS-CoV1
2002-2003 年のパンデミックでは、30 カ国で 8000 人以上が感染し、そのうち 10%が死亡した [71]。SARS-Cov1 は、発作 [72] や視神経炎を含む症状を呈する脳症患者の 脳脊髄液 サンプルおよび脳組織から検出され、急性期に発現した [157]。大動脈虚血性脳卒中は2.4%で報告されている [141]。重症患者では、筋萎縮症や軸索性運動ニューロパチーを含む神経筋障害が、病状の経過の後期に報告されている。しかし、これがウイルス性中枢神経系の直接感染の結果なのか、宿主の炎症反応の結果なのか、免疫学的プロセスの結果なのかは明らかではない [139]。
MERS-CoV
MERSは2012年の最初の報告以来、継続的なパンデミックであり、すでに>2500人が感染し、そのうち35%が死亡している[155]。サウジアラビアでは、急性期に発作が報告されており、患者の8%以上で発作が、25%以上で錯乱が報告されている[113]。ADEM、脳炎、脳卒中(血管炎によるものと思われる)も報告されている [3]。注目すべきことに、これらの疾患のいずれも脳脊髄液からMERS-CoVが検出されなかった。韓国の研究では、感染後数週間でMERS患者のBickerstaff脳幹脳炎と多発神経障害が報告されている[64]。
SARS-CoV-2
2019年12月、中国の武漢で新たなコロナウイルスが出現した。現在世界的に大規模なパンデミックが発生しており 2020年9月末時点で600万人の症例が記録され、100万人以上が死亡している[62]。この病気の神経学的合併症が報告されており、そのメカニズムは現在も科学界で精査されている[36]。214人の入院患者を対象とした中国のレトロスペクティブ研究では、コホートの3分の1強にめまい、頭痛、意識障害などの神経学的特徴が報告されている[83]。58人の重症患者からなるフランスのコホートでは、脳症と皮質脊髄徴候が報告された。13人の患者で脳MRIが実施されたが、そのうち8人はレプトメニンジア増強を認め、2人は急性虚血性病変を認めた[55]。COVID患者で菱形脳炎[151]と髄膜脳炎[159]の報告があり、中には脳脊髄液中にSARS-CoV2陽性のものもあり[92]、そのほとんどが痙攣と脳症を呈していた。急性出血性白質脳炎 [108]、脱髄性病変 [162]、ADEM [102]、急性骨髄炎も報告されている [2]。末梢神経系の症状としては、感染者の80%以上にみられる無感覚/ageusia[73]、GBS(脱髄性病変と軸索性病変の両方)[138]、Miller-Fisher症候群(MFS)孤立性脱臼性麻痺[48]などが報告されている。COVID患者における急性脳血管イベントの頻度の増加が報告されている[101]が、敗血症患者の先行研究[12]と同様の頻度である。これは、ウイルス感染または宿主の反応[97]に関連した高凝固状態[164]の結果であると考えられる。
感染後3ヵ月以上続く長期的な症候群に苦しむ多くの患者の報告が増加しており、これは “long COVID “と呼ばれている。神経認知障害、うつ病などの精神疾患、末梢神経障害、筋力低下などの神経学的タイプの症状 [46]。これは、この症候群を報告している患者の大多数が入院していないため、重症後天性の衰弱や、ポスト集中治療症候群[9]に記載されている神経認知的後遺症とは区別される。
エボラ
1976年に初めて記述されたエボラは、アフリカ諸国を中心に数回のアウトブレイクを引き起こしており 2014年から 2016年にかけて最大となった。神経学的合併症は、患者が脳症、発作(おそらく代謝異常によるものと思われる)髄膜炎、髄膜脳炎を併発しうる後期に始まる[21]。急性期における神経学的合併症の正確な有病率は不明である。中枢神経系はエボラウイルスの貯蔵庫である可能性がある;エボラウイルスは患者の回復から9ヵ月後に髄膜脳炎と根尖炎を発症したエボラ生存者の脳脊髄液から(血液よりも高濃度で)回収された [60]。長期的な神経学的後遺症は生存者の間では珍しくなく、最大40%の記憶喪失、3分の1の頭痛、13%の筋肉痛である [128]。
麻疹
減衰型麻疹ワクチンが導入されるまで,麻疹は年間200万~300万人を死亡させてた[154]。麻疹に関連した死亡率は、21世紀初頭に広範なワクチン接種プログラムが実施されて以来、着実に減少した。しかし 2016年以降、ワクチン接種率の低下は、米国や西ヨーロッパのような以前に麻疹に侵されていた地域を含む、WHOのすべての地域でパンデミックをもたらした[104]。肺炎が主な死因であるが、重度の中枢神経系の症状が現れることもある。原発性麻疹脳炎(PME)は、痙攣、意識障害、焦点性徴候を伴う中枢神経系への直接侵襲により、前頭症の間に発現する。このような患者のうち最大15%が死亡し、4分の1は永久的な神経学的損傷を受ける[16]。麻疹の最も頻度の高い中枢神経系合併症は急性麻疹後脳炎で、感染後2~30日で発症し、麻疹感染後の子供の約0.1%が罹患する。もう一つの合併症は麻疹誘発性ADEMで、発疹が治まってから数週間から数ヵ月後に発症する[16, 47]。予後はPMEよりも良好である。麻疹封入体脳炎(MIBE)はもう一つの合併症で、麻疹ウイルスの脳内感染が進行し、細胞免疫が低下した患者に影響を与え、一次感染から1年以内に発症する。意識の変化、難治性の発作、および焦点性の徴候として現れる。死亡率は75%である [16, 47]。亜急性硬化性全脳炎(SSPE)は急性麻疹感染から4~15年後に発症し、5歳以前に発症した小児では発症率が高くなる [47]。SSPEは一次感染が完全に治癒しなかった後の突然変異型麻疹ウイルスの持続によって引き起こされ、最初は行動の変化と認知機能の低下として現れ、その後ミオクロニー性痙攣、ジスキネジア、運動失調が続き、昏睡と死へと進行する[16, 47]。麻疹ワクチン接種はSSPEの発症率を低下させる。
HIV/AIDS
1980年代にパンデミックが始まって以来、7,500万人がHIVに感染し、3,200万人が死亡している[152]。抗レトロウイルス併用療法(cART)の導入により、後天性免疫不全症候群(AIDS)や日和見感染症(ORI)の死亡率や罹患率は減少したが、長期的なHIV感染とその治療に関連した合併症の有病率は増加しており、特に神経学的なものが増加している[95]。急性HIV感染は、無菌性髄膜炎に続発する頭痛や頸部のこわばりを引き起こすことがある[119]。
最も一般的な中枢神経系 OIは、結核性髄膜脳炎、神経トキソプラズマ症、クリプトコッカス髄膜炎、サイトメガロウイルス症、JCウイルスに続発する進行性多巣性白質脳症(PML)である[95]。その他には、原発性中枢神経リンパ腫(エプスタイン-バーウイルスと関連)および水痘帯状疱疹血管炎があり、脳症、頭蓋神経麻痺、脳卒中および痙攣を伴う [119]。
免疫再構成炎症性症候群(IRIS)は、免疫不全状態からの回復後、数週間から数ヵ月後に発症することがある。cART開始前のCD4の低さはIRISの最も強い予測因子である。IRISはあらゆる臓器に影響を及ぼす可能性があり、中枢神経系-IRISの有病率は約1%で、死滅する日和見薬(クリプトコッカスまたはPMLに関連することが多い)に反応して、またはCD8 + T細胞の浸潤に伴う劇症脳炎として発生する [95]。
HIV患者の最大50%が、無症状から認知症に至るHIV関連神経認知障害(HAND)の影響を受ける可能性がある [52]。HANDは皮質下の認知障害であり、精神運動遅滞、実行機能障害、作業記憶、検索、判断力、注意力、インパルス制御の障害を呈し、感染の長期合併症として現れる。cART時代にはHIV関連認知症の発生率は5%以下に減少しており[95]、HIV疾患マーカーは認知障害と密接な関係はなくなり[50]、cARTを受けている患者はcARTを受けていない患者よりも認知機能が優れている[52]。このことは、認知機能障害の病態生理が中枢神経系におけるウイルスの存在下で起こる炎症過程に関連している可能性を示唆している。
HIV感染は遠位対称性多発神経障害を引き起こす可能性があり、これは神経毒性のある抗レトロウイルス薬とウイルス感染自体の両方に関連している可能性があり、小線維に影響を与え、しびれや痛みを伴う遠位四肢の症状を引き起こす。多ニューロパチーはHIV患者の30~70%が罹患しており、免疫抑制はもはやその重症度を予測するものではない[103]。多神経症は、ウイルスの複製に伴う二次的な神経毒性、または免疫の再構成機構に関連しており、末梢神経を損傷し、通常は慢性期に発症する [95]。GBS(主に脱髄性)は、感染のごく初期にHIVと関連している[54]。
HIVは独立して脳卒中のリスクの増加と関連しており、これは内皮機能障害、血管障害、血管拡張症に対する二次的なウイルスの影響であると考えられている[103]。抗レトロウイルス薬として使用されるプロテアーゼ阻害薬もまた、血管内皮機能に悪影響を及ぼす可能性がある。
液胞性筋症は慢性AIDSで発現する [119]。筋萎縮性側索硬化症様症候群が報告されており、cARTの開始後に消失することがある [95,119]。ミオパシーはHIV感染の経過に関係なく起こり得、直接的なウイルス病変、炎症反応、またはART(ジドブジン)と関連している[95]。
その他の疾患および潜在的脅威
世界的な気温の上昇と気候の変化は、蚊を含む様々な病気の媒介者にとって有益な環境適応をもたらす可能性がある。これらの蚊はマラリアの主要な媒介蚊であり、この病気をコントロールしていた影響を受けやすい熱帯国(高地にまで広がっている)ではパンデミックの可能性が高まるか、あるいは以前に蚊を排除していた温帯気候では再導入されるべきである。マラリアの最も重篤な形態(および年間50万人の死亡原因)は脳性であり [107]、急性期には主に幼い子どもに影響を及ぼす。
別の蚊が媒介するウイルスである黄熱は、20世紀初頭まで人間の健康に対する大きな脅威であり、北米、カリブ海諸国、およびヨーロッパのパンデミック地域から離れた都市で複数の伝染病と死亡を引き起こしていた [89]。この病気が非パンデミック地域にまで拡大したことは、ワクチンを接種していない感染可能な集団が新たな伝染病にかかりやすくなったことを意味している。ウイルスはまれに中枢神経系に侵入し、感染の初期に脳炎や髄膜炎を引き起こすことがある。また、脳症は、重症化して肝不全に陥った場合にもよく見られる。極めてまれではあるが、黄熱ワクチンに関連した神経栄養疾患が報告されており、脳炎、GBS、およびADEMを引き起こす [89]。
蚊が媒介するデングウイルスは、1970年代に9カ国で発生した散発性疾患から、100カ国以上でパンデミックするまでに拡大しており、現在では世界の半分が危険にさらされている。神経学的合併症はどの段階でも起こりうる。デング脳症は最も一般的で、発症後10日間はショック状態に伴う意識障害、肝不全、電解質障害を伴う。まれではあるが、ウイルスの中枢神経系への侵入による髄膜炎や脳炎の可能性もあり、急性期には意識レベルの低下、頭痛、めまい、痙攣、焦点性徴候を呈する。デング熱後の免疫介在性合併症としては、回復期のGBS、横隔膜炎、ADEM、頭蓋神経の単神経障害、視神経障害、筋機能障害、頭蓋内出血などがある[17]。
戦争、紛争、自然災害はコレラのような病気の蔓延を促進する可能性がある。コレラは過去2世紀に7回のパンデミックを引き起こしている。重度の下痢と急性脱水に続く電解質障害と低血糖(主に小児)は、症候性発作を引き起こす可能性がある[23]。栄養不良の避難民の間で、コレラと末梢神経障害の同時発生が、この病気の亜急性期に報告されている [112]。
最近、一部の地域でMMR(麻疹、おたふくかぜ、風疹)ワクチンの接種率が低下したことも、風疹およびおたふくかぜの症例の増加につながっている。おたふくかぜは、初期には無菌性髄膜炎や脳炎を、後期には感染後合併症としてADEMを発症することがある[6]。風疹の主要な神経学的症状は、妊娠中に母親が感染した胎児における先天性風疹症候群(CRS)である。CRSには、脳症、小頭症、および感音性難聴が含まれる。脳炎もまた、前駆期に報告されている[6]。
天然痘は、1980年代に世界的な予防接種プログラムによって撲滅されるまで、大規模な伝染病の原因となっていた。今日の生活者のほとんどが天然痘に対するワクチン接種を受けておらず、生菌性のヴァリオラウイルスはいまだに2つの最大安全保障研究所に保管されているため [87]、バイオテロリストの攻撃に使用される可能性があると懸念されている。天然痘の神経学的合併症は珍しく、これまであまり研究されてこなかったが、記述は急性疾患から5~16日後の脱髄性/炎症性脳脊髄炎に対応している[13]。ワクチン接種後の脳脊髄炎もまた、主に幼児で記述されている[13]。
結論:将来に備えて
パンデミックや伝染病は何千年も前から存在し、歴史の中で極めて重要な役割を果たしていた。これまでは、急性疾患そのものに焦点が当てられていたが、神経学的な後遺症による社会的、人的、経済的な影響については、ほとんど注目されてこなかった。しかし、これらの後遺症は、しばしばかなりの量の死亡率と長期的な罹患率につながるものである。
神経学的症状が十分に認識されていないということは、過去のパンデミックでは神経学的合併症を理解し、治療し、予防するための研究がほとんど行われていないことを意味し、二次的合併症の負担はさらに大きくなる。最近の画像診断の進歩により、中枢神経疾患の病態に関する新たな情報が得られるようになり、感染症の神経学的症状の適切な診断に役立つ可能性がある。しかし、先進国でさえ、診断検査は限られており、治療法はしばしば不十分であるか、または存在しないことが多く、長期的な経済的・医療的影響が大きい。したがって、診断検査や治療へのアクセスが悪い低・中所得国では、これらの疾患による神経学的関与が経済的影響をより大きくすると予想するのが妥当である。長期的な運動障害や認知障害を残すことで、将来の人的資本を制限する可能性がある。
パンデミックの短期および長期的な後遺症にもっと注意を払う必要性は、短期的な後遺症の多くの報告があり、長期的な問題に対する認識が高まっているCOVID-19によって、急に焦点が当てられるようになった。COVID-19の神経学的影響をよりよく理解するために、国際的な共同研究が形成されており、世界的に活動する必要性があるという認識が高まっている[53]。これらには、CoroNerve Study Group [143]、European Academy of NeurologyのEAN Neuro-COVID Registry Consortium(ENERGY)[98]、およびGlobal Consortium Study of Neurological Dysfunction in COVID-19(GCS-NeuroCOVID)[40]が含まれる(ただし、これらに限定されるものではない)。
しかし、予後を理解し、予後を改善するための対応を計画するためには、過去のパンデミックから学ぶことも重要である。過去に発生したことに関するこの知識は、そのような後遺症を見逃さないようにするために警戒すべき症状や徴候を強調するのに有用である。例えば、ウイルス感染症、特に1918-19年のインフルエンザ大パンデミックの後には、レスアルギカ脳炎や脳炎後パーキンソニズムが見られている[43]。実際、COVID-19後の患者のパーキンソニズムの症例が報告されており、プータミナにおける両側の18F-フルオロドパ取り込み量の減少を含む[25]。
新しい感染症が出現し続けると、新しいパンデミックは確実に起こるだろう。前世紀の感染症治療の進歩にもかかわらず、神経系に影響を及ぼす感染症は依然として困難である。神経障害の病態生理を理解し、その起こりうる症状を認識することが、新しい治療法や管理戦略を開発するための基本となる。
パンデミックや伝染病における神経学的関与は一般的であり、影響を受けた人々の間で壊滅的な結果を引き起こす可能性がある。現在のSARS-CoV-2の発生を含むパンデミックでは、この問題により良く対処することが急務となっている。
