Contents
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8231753/
2021 Jun 25 : 1-16.
Rodolfo Furlan Damiano,corresponding author1 Bruno F. Guedes,2 Cristiana Castanho de Rocca,1 Antonio de Pádua Serafim,1 Luiz Henrique Martins Castro,2 Carolina Demarchi Munhoz,3 Ricardo Nitrini,2 Geraldo Busatto Filho,1 Eurípedes Constantino Miguel,1 Giancarlo Lucchetti,4 And Orestes Forlenza1

概要
近年、感染症がヒトの認知機能に与える影響の重要性が注目されている。感染症後の認知機能の低下を説明するために、また、ヒトの認知症、特にアルツハイマー病の病因を理解するために、いくつかの理論が提案されている。本稿では、新型コロナウイルス019年感染症(COVID-19)に伴う認知機能低下の可能性を探るための基礎資料として、急性ウイルス感染症がヒトの認知機能に及ぼす影響に関する最新の知見をレビューすることを目的とする。この目標を達成するために、我々は6つの急性ウイルス感染症と、COVID-19とそのヒトの認知への影響に関する現在の知識を体系化したナラティブレビューを行った。最近の知見では、COVID-19が認知機能に短期的および長期的な影響を与える可能性が示唆されており、これは脳機能障害への直接的および間接的な経路によって説明される可能性がある。このシナリオを理解することは、臨床医や医療関係者が、COVID-19のパンデミックや他の急性ウイルス感染症の後に生じる可能性のある神経精神医学的問題にうまく対処し、世界中のこれらの感染症による認知機能の後遺症を軽減するのに役立つかもしれない。
キーワード 認知、アルツハイマー病、ウイルス、認知症、COVID-19,予防
はじめに
認知機能障害は、世界中で重要な医療問題となっている。人口調査によると、65歳以上の高齢者の3〜19%が軽度認知障害(MCI)の基準を満たしていることがわかっている[1, 2]。そのうち、50%以上が認知症を発症すると言われている[2]。世界の人口における認知症の有病率は1.3%、65歳以上の高齢者では7.3%となっており[3]、これはラテンアメリカの人口で見られるものと同様である[4]。多くの研究で、ウイルス感染が認知機能、特にMCIや認知症の発症に直接影響することが示されている[5-7]。両疾患の高い有病率と重複は、認知症の病因におけるウイルス感染の役割をより深く理解することの重要性を強調している[8, 9]。
ウイルス感染症は、世界の医学・神経学的疾患に大きな影響を与えている[8]。ここ数十年、認知機能障害におけるウイルス感染の役割が広く議論されてきた[5]。ヘルペスウイルス,サイトメガロウイルス,ヒト免疫不全ウイルス(HIV),帯状疱疹ウイルス(VZV),エプスタインバーウイルス(EBV),C型肝炎ウイルスなどのウイルスが,アルツハイマー病の発症に関与していると考えられている[7, 10]。これらの疾患におけるウイルスの病因となるメカニズムには、直接的なウイルスの影響や、炎症、エピジェネティックな変化、血液凝固性の変化などの間接的なメカニズムが含まれ、健康な人や認知機能が低下した人の脳の構造や機能に影響を及ぼす可能性がある[6, 11-15]。これまでのレビューでもこのテーマは取り上げられてきたが,その多くは急性ウイルス感染症に特化したものではなく[6],一部のウイルス感染症(ヘルペスウイルスなど)に限定したものであったり[7],または編集者への手紙に限定されている[5]。
このような背景から、新興感染症、特にパンデミック規模で人口に影響を与える感染症は、精神神経系の危害の可能性をモニタリングする必要がある。これは、高い死亡率と臨床症状の重さだけでなく、認知機能障害などの非定型で予期しない臨床症状の出現[16]によって、現在、医師や医療専門家を悩ませている新型コロナウイルス感染症(COVID-19)の場合も同様であろう。アルツハイマー病協会をはじめとする世界各地の専門家 [18] は、この潜在的な関連性の研究に関心を持ち、このテーマに関する最新のエビデンスを検討し、認知機能障害やその他の神経精神医学的訴えを訴える人々を評価するための異文化間の前向き研究を提案している [19] 。しかし、この問題をさらに議論し、将来の介入研究の指針とするためには、特に複数の専門家によるアプローチを用いた、さらなる理論的研究が必要とされている。
この問題を解決するために,我々は,異なる専門家(神経科医,老年医学者,精神科医,神経心理学者)による包括的な文献レビューを実施し,最もパンデミックしている急性ウイルス感染症後の認知機能低下の発生を調査した利用可能な研究を取り上げた。さらに、他のウイルス感染症後の認知障害の病態生理を理解することは、COVID-19生存者における神経認知症状の出現をよりよく理解するのに役立つ。post-COVIDの認知機能障害は、この疾患の重要な臨床的特徴を表している可能性があり、特に高齢者においては、精神的・認知的な問題を中心に、追加的かつ長期的な負担を強いる可能性がある。COVID-19後の認知機能障害を認識することは、予防や治療のための介入を促進し、世界中の臨床医がこの症状を認識して治療するために不可欠であると考えられる。このナラティブレビューは、このギャップを埋めることを目的としており、ウイルス感染が認知に与える影響についての文献を紹介するとともに、COVID-19が中枢神経系機能にどのような影響を与え、認知障害を引き起こすかについての理論的枠組みを構築することを目的としている。
方法
ナラティブレビューを書くための国際的なガイドライン[20, 21]に従って、文献のナラティブレビューを行った。まず,2名の著者が3つのデータベース(PubMed,Scielo,EMBASE)を以下のキーワードで検索した。”Cognition”, “Cognitive Impairment”, “Cognitive Decline”, “Dementia”, Alzheimer’s Disease”, “Virus”, “Acute”, “Viral Infection”, “Infection”, “Infectious Disease “の3つのキーワードを用いて,タイトル,アブストラクト,キーワードを制限して検索した。さらに疾患に特化したパラメータ(「Herpes simplex type 1」,「varicella-zoster」,「West Nile virus」,「Influenzae」,「Japanese encephalitis」,「aseptic meningitis」,「Acute respiratory distress syndrome」)を選択し,パラメータ名を追加してブール検索を行った。選択された論文は、参考文献も検索した。英語,スペイン語,イタリア語,ポルトガル語の論文のみを採用した。選定された論文は、全著者と協議の上、レビューに加えた。
ウイルス感染後の認知機能障害の病態生理とタイプ
まず、認知機能低下(または認知機能障害)軽度認知機能障害、認知症、アルツハイマー病について、それぞれ明確に定義することが重要だ。認知機能の低下とは、認知機能が低下することと理解できる。それは、直線的で自然なものである場合もあれば、非直線的で加速度的な損失の特性を持つ場合もある[22]。後者は、日常生活の活動に影響を及ぼさない場合、軽度認知障害(MCI)と呼ばれるが、認知症は日常生活に顕著な支障をきたする[2]。認知症の最も一般的な原因は、アルツハイマー病であり、脳内にアミロイドβ(Aβ)とタウタンパク質が蓄積することを特徴とする慢性神経変性疾患と定義されている[23]。認知機能障害は、中枢神経系への直接的な侵襲を伴うウイルス感染によって引き起こされる場合もあれば、通常は中枢神経系感染を引き起こさない全身感染の間接的な影響(サイトカインストーム、神経炎症、血液凝固亢進など)として引き起こされる場合もある[11, 24]。
さらに、脳炎は、神経学的機能障害を伴う脳実質の炎症と定義されており、通常、発作、脳症、局所的な神経学的徴候や症状で臨床的に現れる。2013年には、国際脳炎コンソーシアムが脳炎の標準的な定義を発表し、現在では広く普及している。脳炎の診断には、24時間以上持続する精神状態の変化(または意識レベルの変化、嗜眠、人格の変化)を示し、脳炎の可能性については少なくとも2つのマイナーな基準(発熱、新たに発症した発作、局所症状、CSF多血症、神経画像上の実質的な異常、または典型的な脳波所見)を、脳炎の可能性については3つのマイナーな基準を組み合わせる必要がある[25]。無菌性髄膜炎については、ブライトン・コラボレーションの症例定義が広く用いられている。無菌性髄膜炎を診断するには、髄膜炎の臨床的証拠(発熱、頭痛、嘔吐、硬直)およびCSF多血症、およびCSF培養陰性が必要である[26]。髄膜炎と脳炎を区別することは、疾患のメカニズムが共通しており、臨床的にも重複していることから、しばしばとらえどころがない。このような混乱を避けるために、より包括的な用語である「髄膜脳炎」が、髄膜炎および脳炎と互換的に使用されることが多い。
以下では、急性感染症を引き起こす6つのウイルスとその認知への影響について、最も重要な知見をまとめる。
単純ヘルペスウイルス1型
分子生物学・疫学
単純ヘルペスウイルス1型(HSV-1)は、ヘルペスウイルス科に属する二本鎖DNAウイルスである。世界中で急性感染性脳炎の主要な原因となっている[27-29]。HSVEの発症率は2〜4例/100万人と推定されており、明確な地域差はない[30, 31]。
感染のメカニズム
HSVの一次感染では皮膚や粘膜が侵される。一次感染後,ウイルスは軸索輸送を介して感覚ニューロンに感染し,最終的には後根神経節にも感染する。潜伏期間が長くなると、ウイルスは三叉神経や嗅覚神経を介して逆行性に運ばれ、中枢神経系に到達することがある [32]。嗅覚神経と大脳辺縁系の間には強い結合性があることから、間側頭葉および大脳辺縁系が侵されやすいことが説明できる[33]。
臨床症状
急性単純ヘルペス脳炎は、一般的に発熱や呼吸器症状などの前駆症状を呈し、数日後には脳症、局所的な神経学的徴候および発作へと進行する[32, 34]。神経画像では、内側側頭葉、眼窩前頭葉、島皮質、前帯状皮質に、特徴的ではあるが程度の異なる拡散制限、T2/FLAIR増感、および造影剤による増強が見られ、多くの場合、両側性で非対称性である[32, 34]。典型的な髄液所見には、軽度から中等度の多血球(10~200WBC/mm3)軽度の蛋白上昇(50~100mg/dL)正常なグルコースが含まれる[32]。
認知への影響
ヘルペスウイルス科のウイルスは、おそらくアミロイドβの増加に起因して、後期発症のアルツハイマー病の病態に関与することができる[35, 36]。アシクロビルが登場する前の初期の報告では、生存しているHSV-1患者において両側の海馬の損傷による重度の前向性健忘症が報告されている[38]。長期にわたって追跡調査を行った少数の患者[39-46]では、両側海馬障害の特徴である遠隔地の記憶は比較的保たれているものの、重度の前向性健忘と逆向性健忘が持続する。HSV-1患者における逆行性健忘症の重症度は、側頭極や側頭新皮質領域を含む側頭葉構造の大きな関与と関連している可能性がある[43]。
記憶障害の重症度は内側側頭葉の病変の程度と相関しており、HSV脳炎の最も重要な晩期所見である[47]。両側の病変は、意味記憶障害や視覚障害を含む、より重篤な認知障害と関連する[42, 48]。HSV-1脳炎では、眼窩前頭皮質および前帯状皮質の損傷に起因すると思われる遂行機能障害も認められる[49]。
HSV-1生存者は時間の経過とともに認知機能の改善を示すことがあるが、認知機能障害は脳損傷の長期にわたる永続的な結果である。脳炎の1年後には40~58%の患者に重度の記憶障害が認められ[50-52]、急性エピソードの3年後には80%の患者に軽度の認知障害が持続する[53]。1980年代後半にアシクロビルが登場したことで、HSV-1脳炎の予後はかなり改善された[54-56]。死亡率は20%以下に低下した[34, 57]。しかし、認知機能障害は、アシクロビル治療を受けた患者では依然として非常に一般的である[52]。
水痘帯状疱疹ウイルス
分子生物学および疫学
水痘帯状疱疹ウイルス(VZV)は,ヘルペスウイルス科のヒト専用DNAウイルスで,世界的に脳炎の第2の原因となっている[27, 29, 58]。
感染のメカニズム
一次感染後、VZVは頭蓋、後根、自律神経節に潜伏する[59]。医原性免疫抑制薬と高齢により、細胞介在性免疫が低下し、VZVの再活性化と神経学的合併症を引き起こす。 [60]. VZVの再活性化はHSV-1の再活性化と多くのメカニズムを共有しており、感覚ニューロン内の逆行性軸索輸送が重要な役割を果たしている[61]。
臨床症状
VZVは、髄膜炎、脳炎、脊髄炎、中枢神経系血管障害などの様々な中枢神経系疾患を引き起こす可能性があり、これらは頻繁に重なり合っている[60]。ほとんどの場合、VZVは帯状疱疹として再活性化し、感染は末梢神経系に限定され、数週間で発疹が消失する。時折、特に免疫力の低下した患者では、髄膜脳炎が起こる。臨床症状は他の脳炎症候群と類似しており、程度の差こそあれ、脳症、発作、頭痛を呈する。髄液検査では、50~300 WBC/mm3,40~150 mg/dLのタンパク質という、ウイルス性髄膜脳炎の典型的なプロフィールが見られる[62, 63]。脳炎の症例では、神経画像診断では頭蓋内血管炎の徴候とほぼ同じ頻度で脳の異常が見られる[62]。
認知機能への影響
ポスト・アシクロビル時代にハードエンドポイントを用いて予後を評価した研究では、急性エピソード後、退院時に20~60%、1ヵ月後に55%、3ヵ月後に51%、1年後に71%の患者に神経学的障害が認められた [62, 65]。最近では、急性神経症候群を伴わないヘルペスウイルス感染が認知機能に及ぼす長期的影響の可能性が注目されている。中枢神経系におけるウイルスの存在は、アルツハイマー病(AD)などの神経変性疾患に関連する病原体のメカニズムを阻害する可能性がある[7, 10]。「ADのウイルス仮説」によると、この相互作用は、アミロイドカスケードの二次的な構成要素である炎症反応や酸化ストレスのアップレギュレーションと非特異的に関連している可能性がある。また、この相互作用は、中核的な病因の中の特定のメカニズムを通じて作用し、アミロイドの過剰生産を早めるかもしれない[10, 12]。
日本脳炎
分子生物学と疫学
日本脳炎(JE)は,アジアで最も一般的な脳炎の原因であり,主に小児が罹患する。成人例の報告も増えている[66]。日本脳炎は西太平洋地域でも脳炎の原因となっており、オーストラリアでも日本脳炎の症例が報告されている[67]。この病気は,蚊が媒介するフラビウイルス科の一本鎖RNAウイルスである日本脳炎ウイルス(JEV)によって引き起こされる。この病気は通常、ブタ-蚊-ヒトの経路でヒトに感染する[68]。
感染メカニズム
皮下接種後、JEウイルスは脳の様々な部位に感染することから、血液学的な感染経路が示唆されている。これは、内皮細胞への感染とそれに続く脳実質へのトランスセルラー輸送、損傷した血液脳関門または血液-CSF関門を介したパラセルラー漏出によって説明できる[69]。
臨床症状
症状を呈するのは、25~1000人に1人の割合である [70]。患者は通常、発熱と脳症を呈し、しばしば痙攣と中等度の髄液多量分泌を伴う。神経画像診断では、症例の22%で視床下部に特異的な異常が認められることがある[71]。
認知への影響
生存者の約45~64%が退院時に神経学的な後遺症を示している [72-74]。50人のJE患者を対象とした中国のレトロスペクティブシリーズ[66]では、12%が入院中に死亡し、75%が退院時に大きな機能的制限を受け、生存者の39%が18ヵ月後に大きな制限を受けた。
これらの所見は、日本で実施された初期の研究で、脳炎エピソードから1年後に29%の患者が「検出可能な神経学的後遺症」を有していたという結果と一致している[75]。また、インドと日本で実施された最近の研究では、退院時に100%の患者が神経学的障害を有しており[76]、脳炎後1~2年後に44%の患者が少なくとも1つの神経学的中枢神経系後遺症を有していた[74]。認知障害、特に知的障害と記憶喪失は、ラットの記憶学習と同様に、子供と大人の両方で発表されている[72, 74]。
ウエストナイルウイルス脳炎
分子生物学と疫学
ウエストナイルウイルス(WNV)は,フラビル科の一本鎖RNAウイルスである。主な宿主は鳥類で,ヒトは蚊の媒介によって感染する。WNVは、アフリカ、ヨーロッパ、アジアでパンデミックしているほか、米国でもパンデミックしており、1999年から 2010年の間に300万人以上が感染している[78]。パンデミック地域では、脳炎症例のかなりの割合をWNVが占めている[28, 79]。米国では 2000年から 2010年の間にWNVがウイルス性脳炎の第2の原因となっている[28]。また、WNVは世界中で大規模なアウトブレイクを引き起こす可能性がある[80]。ヨーロッパでは 2018年にWNV疾患の発生率が7倍(前年比)に上昇し、合計181人が死亡した[81]。また、ルーマニアでも深刻なアウトブレイクが発生し、1996年の1年間で発生率が1.5/100,000とピークに達した。
感染のメカニズム
正確な病気のメカニズムは不明であるが、現在の仮説では、WNVは血液脳関門を通過した後に血行性に中枢神経系に侵入し、内皮の複製によって、あるいは嗅覚神経や末梢体性神経内の経神経軸索輸送によって感染すると考えられている[82]。
臨床症状
ほとんどの症例は軽度または無症状である。神経系の病変(髄膜炎、脳炎、急性弛緩性麻痺)は患者の1%に見られる。急性のWNV脳炎(WNE)患者は、通常、発熱と脳症を呈する。ミオクローヌスやパーキンソニズムなどの運動障害、および運動性衰弱が一般的である[83]。死亡率は15~20%と高く、高齢者ではリスクが高くなる[84]。
認知への影響
WNE患者は、急性感染後の初期数カ月間に大きな罹患率を経験する。ほとんどの症例はリハビリテーションを必要とする[85,86]。運動障害は数カ月から数年にわたって持続する[83, 87-91]。WNE患者の80%が、感染後1年経ってもWNV関連の症状が続いていると報告している。
包括的な神経心理学的評価ツールを用いて、[88]は、神経侵襲性WNV疾患の患者は、即時記憶と遅延記憶において軽度の認知障害を示し、磁気共鳴画像では対照群よりも顕著な皮質の菲薄化を示したことを示した[88]。これらの知見は、カナダで行われた別の研究でも支持されている[89]。
無菌性髄膜炎
分子生物学および疫学
多くの場合,正確な原因は不明であるが,ウイルス性髄膜炎は世界的に無菌性髄膜炎(AM)の主要な原因となっている.ウイルス性髄膜炎は,無菌性髄膜炎の全症例の約40%を占める[92,93]。原因となる病原体、特にウイルスの検出率は、より多くの分子・免疫学的検査が行われるようになると増加し[94]、AMを引き起こすウイルスの多様性はますます高まっている[95]ため、多くの医師は原因不明のAMをウイルス性の病因と推定している[96]。エンテロウイルス、VZVおよび単純ヘルペスウイルス2型が一般的な原因物質である。
感染のメカニズム
無菌性髄膜炎では、感染のメカニズムは関連する基礎的な感染に特有である。単純ヘルペスやVZVに関連した無菌性髄膜炎は、通常、上述のように再活性化とその関連メカニズムに関連している。世界的な無菌性髄膜炎の主な原因であるヒトエンテロウイルスは、主に糞便-口腔または糞便-手指-口腔の経路で感染する(時折、口腔内の分泌物がエアロゾル化して感染することもある)。中咽頭での感染後、ウイルスは消化管に広がる。その後のウイルス血症は、時折、血行性伝播によって中枢神経系に侵入することがある[97, 98]。ウイルスが脳脊髄液に入ると、炎症細胞の蓄積を誘発し、インターロイキン(IL)-1B、IL-6,腫瘍壊死因子(TNF)-αなどの炎症性サイトカインが放出され、血液脳関門の伝染性が高まり、さらに炎症が起こり、典型的な髄膜の炎症症状を引き起こす[97]。
臨床症状
AMは、頭痛や項部硬直などの髄膜炎の臨床的および実験的徴候を有する患者を含む臨床症候群を包含し、そのために髄膜炎の細菌性原因が除外される[26]。髄膜炎のこれらの症状は、関連する感染症に特有の前駆的な全身症状(VZV-diseaseでは帯状疱疹、エンテロウイルスD68では呼吸器症状、その他のヒトエンテロウイルスでは下痢や手足口症候群)に続くことが多い[99]。AMを脳炎と区別する特徴は、脳炎の主要な診断基準である精神状態の変化がないことであり、これは通常、神経画像検査や脳波検査で実質的な異常がないことを伴っている[25]。
認知機能への影響
急性AMは通常、長期の神経学的後遺症を伴わない良性の疾患と考えられている。急性細菌性髄膜炎(BM)や急性ウイルス性脳炎(VE)の影響が広く認識されているのに比べて、この疾患におけるQOLや神経認知のアウトカムを評価した研究が少ないことから、良性と思われている経過は、実際には急性ウイルス性髄膜炎における認知障害の過小評価を反映しているかもしれない[100]。
AMにおける縦断的研究では、長期的に見て有意な罹患率は報告されていない[24, 100, 101]。精神状態と認知に関する包括的なツールを含めると、AM患者は健常対照者と比較して、微妙な視覚記憶と認知処理速度の障害を呈し[24]、グローバルな精神健康状態が悪化する可能性があることが明らかになった。[101, 102].
インフルエンザウイルス
分子生物学および疫学
インフルエンザウイルスは、オルソミクソウイルス科の一本鎖RNAウイルスである。B型とC型のインフルエンザはヒトに感染するが、通常はパンデミックを起こしない。A型インフルエンザウイルスは、他の哺乳類や鳥類に感染することがあり、その場合、遺伝物質が混ざり合い、ナイーブな集団でパンデミックすることがある。最も一般的なA型(H1N1)A型(H3N2)B型(ビクトリア)B型(山形)を含むインフルエンザウイルスは、ヒトの急性下気道感染症の一般的な原因であり[103]、前世紀に少なくとも4回の大規模なパンデミックを起こしている[104]。インフルエンザ感染の重要な合併症として、急性呼吸窮迫症候群(ARDS)があり、米国では毎年200,000人の患者が発症し、ICU入室者全体の10%以上を占め、病院での死亡リスクは30~40%とされている[105]。
感染のメカニズム
インフルエンザウイルスは、主に吸入により気道内の上皮細胞に感染することで感染する。その後、ウイルスは上・下気道に広がり、インフルエンザやウイルス性肺炎を引き起こす。ANEとインフルエンザに伴う脳症の発症メカニズムはよくわかっていない。脳症における脳感染の直接的な役割を示唆する研究者もいるが、CSFや脳のサンプルからウイルス粒子が回収されることはほとんどない[106]。あるいは、脳症患者は血清およびCSFのサイトカインが高値を示すことが多く、サイトカインを介した炎症/サイトカインストームが原因である可能性が示唆されている[107-109]。
臨床症状
インフルエンザは、大部分の症例で合併症のないインフルエンザを引き起こす。インフルエンザウイルスは、ヒトまたは動物モデルにおいて感染性脳炎を引き起こすことは一貫して示されていないが、時折脳症を引き起こすことがあり、通常は正常なCSFプロファイルを呈する[110]。まれに、インフルエンザに感染すると、昏睡、神経画像上の広範な異常、高い死亡率を伴う重度の脳症に至ることがあり、これは急性壊死性脳症と呼ばれる症候群で、主に小児に発症するが、成人にも発症する[111]。
認知への影響
マウスの嗅球にA型インフルエンザウイルスを注入すると、感染から14~20週間後に認知障害が起こり[112]、海馬の形態変化も見られたという実験結果がある[113]。A型インフルエンザ感染後に海馬の画像異常を伴う重度の健忘症を発症した例が報告されている[114]。他の研究では、アミロイドβタンパク質には抗菌作用があり[115]、特にインフルエンザAに対する抗菌作用があることが示されている[116]。さらに、インフルエンザワクチンの接種は、慢性疾患を持つ患者の認知症リスクを低下させる可能性があり[117, 118]、ヒトの認知症におけるインフルエンザの潜在的な役割を強調している。
さらに、ARDS生存者には認知障害が非常によく見られる。ARDS患者の70〜100%は退院時に、46〜80%は退院後1年後に、20%は5年後に認知機能が低下している[119, 120]。さらに、退院後1年間、ARDS生存者は高い確率で不安、抑うつ、実行機能障害、心的外傷後ストレス障害を示す[121, 122]。2年後の追跡調査では、持続的な認知障害が報告されており、およそ半数の患者が認知障害の兆候を示していた[123]。ARDS患者の長期的な認知障害の基礎となる生物学的メカニズムとしては、低酸素症、サイトカインを介した損傷、脳のオートレギュレーションの乱れ、血液脳関門の損傷に伴うアミロイドβクリアランスの減少などが考えられている[124]。
コロナウイルスとCOVID-19
我々の知る限り、中東呼吸器症候群(MERS)や重症急性呼吸器症候群-コロナウイルス-1(SARS-CoV-1)の後の認知機能低下・障害を調査した論文はない。重症急性呼吸器症候群-コロナウイルス-2(SARS-CoV-2)に関連した精神神経症状を報告した研究はいくつかあるが[13, 125]、SARS-CoV-2がヒトの認知に与える影響についての証拠はまだ少ない。コロナウイルス感染症2019(COVID-19)は,コロナウイルス科のRNAウイルスによって引き起こされるもので,当初は重症急性呼吸器症候群関連コロナウイルス(SARS-CoV)の病原体として認識されていた[126]。COVID-19は当初、呼吸器系に影響を与え、時折、消化器系の症状を伴うと考えられてたが[127]、その後の報告では、COVID-19は、腎、心血管、中枢神経系(CNS)などの他の主要な身体器官にも影響を与える可能性があることが示されている[16, 125, 128]。
COVID-19は 2020年3月初旬に世界保健機関によってパンデミックの影響を持つ疾患として認識された[129]。それ以降、世界223カ国で約2億人が感染し、260万人以上が死亡している[130]。特にブラジルなどの低・中所得国では、ワクチンがないために、この数字は今も増え続けている[130]。さらに、SARS-CoV-2の新しい変異株に対するワクチンの効果については、ほとんど知られていない[131]。
入手可能な文献のレビューに基づき、一部の著者は、COVID-19パンデミック後に、うつ病、不安、心的外傷後ストレス障害などの精神疾患の発生率が高くなると予測している[132]。感情的な症状は、主要なライフイベントや心理社会的なストレス要因との相互作用によってCOVID-19に関連することもあれば [133-135]、脳機能の障害や神経組織の損傷から生じることもある [17, 136]。COVID-19による二次的な神経精神障害のリスクに焦点を当てた最近の報告では、SARS-CoV-2感染が神経学的・精神医学的症状の無視できない発生率と関連していることが示されており、神経精神症状や認知症状はウイルスによる直接的な中枢神経系感染としても生じる可能性があるという証拠が示されている[17, 136]。
SARS-CoV-2感染後の認知機能の変化に関する研究のほとんどは、急性の変化、主に急性脳症に焦点を当てている[137-139]。COVID-19感染による持続的な認知障害の発生はまだ不明である。総合的な神経心理学的評価を用いたCOVID-19患者の回復期の予備的研究では、感染後2~4週間で認知障害が見られた。注意力の低下が最も関連する変化であった[140, 141]。最近の集団ベースの研究では、COVID-19による神経精神障害者の26%が認知症様症候群であり、患者年齢の中央値は71歳であった[136]。別の研究では、軽度または無症状のCOVID-19患者の28~56%に認知機能障害(主に注意力と遂行機能の障害)が報告されており、これは右直回や言語関連領域の皮質の厚さの減少と相関していた[17]。最近の論文では、中等度/重度のCOVID-19患者から回復した57名のコホートにおいて、ワーキングメモリ、セットシフト、分割注意、処理速度に変化が見られ、挿管期間、精神科的診断、臨床診断との関連は見られなかった[142]。
MRI 研究では、COVID-19 患者における脳の構造的・微細構造的変化が示されており [143-146]、例えば、急性壊死性脳症 [145]、皮質の信号強度異常、側頭葉内側の片側 FLAIR または拡散過多 [144, 146]、海馬の異常 [143, 147]などが挙げられている。急性脳症を発症したCOVID-19患者の小規模なケースシリーズでは、この疾患が、せん妄における通常の所見とは異なる、FDG-PETにおける特定の前頭部の代謝低下パターンと関連している可能性が示唆されている[148]。これらの異常は脳炎と関連しており、COVID-19の認知障害を少なくとも部分的には説明できるかもしれない。
SARS-CoV-2は、血液凝固性亢進状態、神経炎症、免疫学的変化、エピジェネティックな変化など、様々な間接的メカニズムによって精神神経症状を引き起こす可能性がある[132]。いくつかの研究では、血液脳関門の破壊が脳症と関連していることが示唆されており、神経炎症説が有力視されている[150, 151]。この説のメカニズムとしては、P2X7受容体の過剰活性化とそれに伴うNLRP3インフラマソームの刺激が、炎症カスケードの引き金となる可能性がある[152]。死亡した患者の脳組織からコロナウイルスのRNAが検出されたことから、直接的な脳損傷メカニズムの可能性が浮上した[153]。この観察結果は,前頭葉組織の神経細胞や内皮細胞にウイルスが検出されたこと[154],感染者の脳脊髄液にウイルスが検出されたこと[147, 155, 156]によって裏付けられた。さらに、脳に損傷を受けた死亡患者全員のアストロサイトからSARS-CoV-2が検出され、脳がSARS-CoV-2の聖域となっている可能性が強調されている[17]。最近の論文では、脳の病変が非特異的で、SARS-CoV-2病変に直接起因するとは言えないにもかかわらず、COVID-19で死亡した人の脳組織の53%からSARS-CoV-2ウイルスが検出された[157]。しかし、SARS-CoV-2 RNAはCOVID-19患者のCSFサンプルではほとんど確認されておらず[158]、COVIDに関連した神経症状のほとんどの症例は、脳症患者を含めてCSF-RT-PCR陰性である[128, 137, 159]。神経症状を持つ患者のCSF分析では、SARS-CoV-2の免疫反応が見られたが、これは髄腔内での抗体産生ではなく、血清抗体のCSFへの漏出に起因するものである[150, 160]。
他のCoVのパンデミック(SARS-CoVとMERS-CoV)から得られた知見は、神経侵襲経路の可能性を示唆している。上気道と嗅覚神経上皮は、匂いを識別するための最初のステップとなる[161, 162]。嗅細胞は、アンジオテンシン変換酵素アイソフォーム2(ACE-2)およびII型セリンプロテアーゼ(TMPRSS-2)を発現しており、これが中枢神経系へのウイルス侵入口となる可能性がある[163]。いくつかのRNAウイルスは、さまざまな脳構造に軸索輸送され、急性脳炎を引き起こす[164-166]。最近の研究では、SARS-CoV-2が中枢神経系に侵入する可能性のあるポートとして、嗅覚粘膜の神経-粘膜界面が指摘されている[167]。最後に、サイトカインストーム理論は、中枢神経系におけるSARS-CoV-2の炎症反応は、IL1b、IL-6,IFN I-IIIなどのグリア細胞のサイトカインの大量放出によって媒介されると提唱している[168, 169]。ACE-2の低い発現は、神経細胞とグリア細胞の両方で認められる[170]。
K18-hACE2変異マウス(ACE-2のヒト型を持つ)にSARS-CoV-1(SARS-CoV-2と80%の相同性を持つ)を経鼻接種すると、中枢神経系全体にウイルスが存在することになり、局所的な炎症メディエーター、呼吸器系の機能障害、軽度の肺感染のみで高い死亡率となった[171, 172]。これらの知見は、ウイルスによる進化と呼吸器合併症における中枢神経系メカニズムの重要性を示唆している。中枢神経系の細胞におけるACE-2の発現は、感染しやすさを単独で説明することはできない。肺や腸では通常、ウイルス感染や炎症の顕著な兆候が見られるが、これは肺細胞や腸細胞におけるACE-2レベルの高さと関連しているのかもしれない。しかし、内皮細胞も高いACE-2レベルを発現しているが、それに対応してSARS-CoVの感染レベルが高くなることはない[173]。
鼻の神経上皮を通過するルートに加えて、下気道の通過とは無関係に、ウイルスが最初に末梢神経末端に感染し、シナプスを経由して中枢神経系に侵入することを示唆する証拠が蓄積されている[174]。シナプスを経由する経路は,HEV67 [175, 176]や鳥類気管支炎ウイルス [177, 178]など,さまざまなコロナウイルス(CoV)で報告されている.ラットの後根神経節に直接感染すると,中枢神経系にSARS-CoVが存在することが確認された[176].電子顕微鏡のデータでは、神経細胞の小胞にウイルスが存在することが確認された。中枢神経系へのウイルス侵入は,迷走神経を介したシナプス移行ルート,すなわちインフルエンザウイルスの鼻腔内接種によって起こりうる[177].部分的(同側)に迷走神経を切断した動物にウイルスを接種したところ,両側の根神経節にウイルスが存在した。迷走神経の損傷後は,ウイルスが迷走神経とは反対側の神経節に最初に到達したことから,迷走神経の損傷後はウイルスの移行がうまくいかないことが示唆された。SARS-CoV-2では、経鼻的および経シナプス的メカニズムにより、ウイルスは嗅球と脳幹に侵入する可能性があり、両者は中枢神経系への侵入の初期部位となる可能性がある[179]。ウイルスが中枢神経系に侵入すると、ニューロン、ミクログリア、オリゴデンドロサイト、特にアストロサイトに影響を与え、ニューロンの生存率を低下させる[17, 179, 180]。
Abateら[18]は、SARS-CoV-2感染がアルツハイマー病(AD)のリスクを高める可能性のあるさまざまなメカニズムをレビューしているが、これは他の認知疾患にも外挿できる可能性がある。上記の仮説のようにウイルスが直接神経に侵入し、脳内、特にグリア細胞でのACE-2の発現と関連することで、ミクログリアとアストロサイトの両方が活性化し、一酸化窒素(NO)の産生が増加することで、酸化ストレスと神経細胞の損失につながる可能性がある。[181, 182]. SARS-CoV-2がアストロサイトに感染し[17]、アミロイドβ(Aβ)の沈着に関与しているという知見は、COVID-19の感染とADとの関連性の可能性を強調するものである。また、Aβは、免疫学的なメカニズムで過剰生産される可能性のある抗菌ペプチドとして作用することが示されている[115]。さらに、ApoE3対立遺伝子を持つ人は、COVID-19感染症の重症型に罹患しやすい可能性がある[183]。ApoE4遺伝子型、神経炎症、およびADの病理学との関連は、さらに調査されるべきである[184]。さらに、凝固性亢進状態は、微小血管疾患を誘発し、血管性認知症やADを誘発する可能性がある[185]。図1は、SARS-CoV-2の認知に対する神経生物学的影響をまとめたものである。
図1 SARS-CoV-2感染がヒトの認知に与える影響の病態生理学的メカニズムの提案
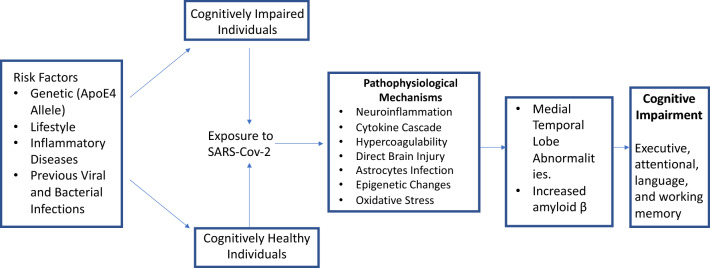
まず、遺伝、生活習慣、炎症性疾患、過去のウイルス・細菌感染などの危険因子が、認知機能が健常な人と障害のある人の両方の脳において、SARS-CoV-2への曝露と相互作用する可能性がある。SARS-CoV-2に感染すると、神経炎症、サイトカインカスケード、血液凝固性亢進、脳の直接損傷、アストロサイトの感染、エピジェネティックな変化、酸化ストレスなど、いくつかの異なるメカニズムが誘発され、これらが相まって、医学的側頭葉の異常やアミロイドβの増加を引き起こす可能性がある。これらの異なる経路により、主に遂行能力、注意力、言語、作業記憶などの認知機能障害が誘発されると考えられる
臨床的意義
中枢神経系、特に認知におけるCOVID-19の潜在的な影響を医療関係者が認識することは重要だ。COVID-19は、認知障害のある高齢者だけでなく、認知障害の影響を受けやすい健常者にも影響を与える可能性がある。これらの影響を受けやすい人を特定し、病気の重症度との関係や、この障害の病態生理学的なメカニズムを明らかにするとともに、認知障害の長期的な影響を理解するために、さらなる研究を行う必要がある。また、健康管理者は、医師やその他の医療従事者がこれらの新たな問題を認識し、対処できるようなキャンペーンや継続的な教育プログラムを推進すべきである。
さらに、これらの認知障害に対処するためのアプローチが緊急に必要とされている。認知リハビリテーション技術の普及は、効果的であることが示されており、いくつかの異なる認知障害や病因に対して使用することができるため、不可欠である[186]。また、ウイルス感染後の認知障害を予防・治療するための治療薬の使用が最近提案されている。WozniakとItzhaki [187]は、叙述的なレビューの中で、ADに抗ウイルス剤の使用を開始する時が来たのかどうかという挑発的な疑問を投げかけている。以前の研究では、抗ヘルペス薬の開発がポジティブな影響を与え、ADの発生率を低下させたことがわかっている[56]。現在のランダム化比較試験(RCT)では、ADの治療における抗ウイルス療法の効果が検討されている[188]。抗菌療法もまた、老人性痴呆症の治療の代替手段として提案されている[10]。
一部の著者は、抗炎症作用があるため、抗マラリア薬が精神神経系のCOVID-19合併症の予防に使用できると示唆している[189]。さらに、抗コリン剤は、サイトカインストームとAβ沈着を減少させることが提案された[190]。さらに、アダマンタン系薬剤は、認知機能障害患者の神経認知保護効果を発揮する可能性が示唆された[191]。今のところ,これらの薬剤がSARS-CoV-2感染による死亡率や罹患率を減少させることは証明されていない.
制限事項
この論文にはいくつかの制限がある。第一に、このレビューは叙述的な性質を持っているため、論文の選択に偏りがある。第二に、いくつかの異なる急性ウイルス感染症やウイルス関連症候群のうち、6つだけを選んだ。我々の意図は、世界中で病気を引き起こすユビキタスなウイルス(HSV-1,VZV、Influenzae)と、地域的に関連性の高いウイルス(WNV、JEV)の両方を含む幅広いシナリオを提供することであった。第三に、COVID-19は現在進行形のダイナミックなパンデミックである。日々、多くの新しい論文が発表されており、変化し続けるこの分野のレビューは困難を極める。例えば、認知機能に関する長期的な研究がほとんど行われていないため、我々はCOVID-19後についての予測を行った。これらの予測が、現在進行中の研究から得られたオリジナルのデータとすぐに向き合うことになることを期待している。
結論
以上のように、いくつかのウイルス性病原体が、異なる病原体メカニズムによってヒトの認知機能に影響を与えることが示されている。これらの病原体の中には、中枢神経系への直接感染による脳実質の損傷や、凝固亢進状態や神経炎症などの脳機能の障害につながる間接的なメカニズムにより、長期的な認知障害を引き起こすものもある。最近では、COVID-19が精神神経系の問題、特に認知機能の低下を引き起こす可能性があることが多くの証拠によって示されている。しかし、その病態生理学的なメカニズムについてはほとんど知られていない。したがって、急性ウイルス感染の認知機能への影響を理解し、それをCOVID-19による中枢神経系の臨床的障害の理解にどのように組み込むことができるかを理解することは非常に重要である。このような知識は、COVID-19の長期的な認知的転帰の可能性を理解し、予測するのに役立ち、患者と医療従事者の双方が、いまだに未知のこの病気にうまく対処するのに役立つだろう。
宣言
利害の衝突
著者は利益相反のないことを宣言する。
