SARS-CoV-2 spike protein interactions with amyloidogenic proteins: Potential clues to neurodegeneration
www.ncbi.nlm.nih.gov/pmc/articles/PMC7988450/
オンラインで2021年3月24日に公開
ダニッシュ・イドリース(Danish Idrees) ビジェイ・クマブ(Vijay Kumarb)
概要
COVID-19の感染後には、神経変性を含む無数の神経症状が現れる。脳内でのタンパク質の凝集は、神経変性の重要な理由の1つと考えられる。SARS-CoV-2 Spike S1タンパク質受容体結合ドメイン(SARS-CoV-2 S1 RBD)は、ヘパリンおよびヘパリン結合タンパク質と結合する。さらに、ヘパリン結合は、脳内に存在する病的なアミロイドタンパク質の凝集を促進する。
この論文では、SARS-CoV-2 S1 RBDが、Aβ、α-シヌクレイン、タウ、プリオン、TDP-43 RRMなど、凝集を起こしやすい多くのヘパリン結合タンパク質と結合することを示している。これらの相互作用は、S1タンパク質のヘパリン結合部位が、アミロイドタンパク質のウイルス表面への結合を助け、その結果、これらのタンパク質の凝集を開始し、最終的に脳の神経変性を引き起こす可能性を示唆している。
この結果は、この結合と凝集のプロセスを標的とすることで、将来の神経変性の結果を防ぐのに役立つであろう。
キーワード
COVID-19,ヘパリン、ヘパリン結合タンパク質、神経変性、タンパク質凝集、SARS-CoV-2
1. はじめに
COVID-19の長期感染後の合併症は、神経変性疾患の神経症状を伴うことがある。COVID-19の主な危険因子としては、年齢、心臓病、糖尿病、高血圧などが挙げられる[1]。いくつかの研究では、SARS-CoV-2感染が神経変性疾患のリスクを高めることが示唆されている[[2], [3], [4], [5]]。SARS-CoV-2の中枢神経系への侵入と、COVID-19感染時に顕著なサイトカインストーム、代謝変化、腸内細菌叢の変化、神経内分泌軸、低灌流が、神経系で観察される様々な神経障害の原因と考えられている[[5][6][7]]。ヒト免疫不全ウイルス(HIV),ウエストナイルウイルス,単純ヘルペスウイルス1型(HSV-1),H1N1インフルエンザAウイルス,呼吸器合胞体ウイルスなどの感染は,脳炎,タンパク質凝集,神経変性,パーキンソン病やアルツハイマー病のような症状を含む,いくつかの神経学的症状を引き起こすことが示されている[8].α-シヌクレインを発現しているドーパミン神経細胞にH1N1を感染させると,α-シヌクレインが凝集し,オートファジーが阻害されるため,神経変性が起こりやすくなることがわかっている[9]。
ごく最近、Tavassolyらは、SARS-CoV-2によるシードタンパクの凝集が、神経変性を含む長期的な感染後の合併症に起因するという見解を提案した[4]。彼らは、SARS-CoV-2のスパイクタンパク質S1領域が、脳内に存在するヘパリンやヘパリン結合タンパク質(HBP)と結合することで、自己組織化、凝集、線維化のプロセスが起こりやすくなることを示唆した。また、Sタンパク質由来のペプチド(S-CoV-ペプチド:約150aa)は、既知の凝集傾向のあるタンパク質よりも凝集形成傾向が強いことから、このペプチドが機能性アミロイドとして作用し、毒性のある凝集体を形成しやすいことが示唆された。このように、S1タンパク質のヘパリン結合性と凝集傾向は、S1がアミロイドや毒性のある凝集体を形成する能力があることを示唆している。この凝集体は、多くの誤って折り畳まれた脳タンパク質を凝集させる種として働き、最終的には神経変性を引き起こす可能性がある。SARS-CoV-2の感染は、タンパク質合成装置を制御することによって中枢神経系に侵入し、小胞体やミトコンドリアの機能を阻害し、ミスフォールドしたタンパク質の蓄積を増加させ、それによってタンパク質の凝集、ミトコンドリアの酸化ストレス、アポトーシス、神経変性を活性化させることが示唆されている[3,5,10]。
興味深いことに,HSV-1のスパイクタンパク質はヘパリンと結合し,その表面のスパイク上でアミロイドβ(Aβ42)ペプチドの凝集を増加させることが示されている[11]。この研究は,スパイクタンパク質のヘパリン結合部位がAβ42ペプチドの結合部位として働き,その結果,ウイルス表面にドッキングしてAβ42の凝集を触媒する可能性を示唆している。SARS-CoV-2のスパイク糖タンパク質のS1サブユニット内にあるRBD(receptor binding domain)にはいくつかのヘパリン結合部位があることから[[12], [13], [14]]、COVID-19の脳内感染でも同様にAβ, α-シヌクレイン, タウ, プリオン, TDP-43などの神経変性を引き起こすタンパク質の凝集のメカニズムが観察される。
本研究では、SARS-CoV-2のS1 RBDと、Aβ、α-シヌクレイン、タウ、プリオン、TAR DNA binding protein-43 (TDP-43)などの異なるアミロイド形成タンパク質との相互作用を調べた。また、S1 RBDとヘパリンとの結合や、脳内に存在する異なるアミロイド形成タンパク質との複合体についても調べている。これらの知見は、神経変性で観察されるヘパリン結合によるHBPの結合の増加を理解するのに役立ち、また、この結合プロセスを標的とすることで、将来の神経変性の結果を防ぐことができるであろう。
2. 研究方法
SARS-CoV-2のS RBD (PDB ID:6M0J) とタンパク質Aβ (PDB ID:1Z0Q), α-シヌクレイン (PDB ID:1XQ8), タウ (PDB ID:6QJH), プリオン (PDB ID:1U5L), TDP-43のRNA認識モチーフ (PDB ID:4BS2) とのタンパク質-タンパク質ドッキングは、HDOCKサーバー (hdock. phys.hust.edu.cn/)を用いて行った。HDOCKサーバーは、テンプレートベースのモデリングと第一原理フリードッキングのハイブリッドアルゴリズムに基づいている[15]。HDOCKサーバーは、高速フーリエ変換(FFT)ベースのアルゴリズムを用いて、2つのタンパク質間で可能なすべての結合モードをグローバルにサンプリングする[16]。そして,サンプリングされたすべての結合モードは,知識ベースのスコアリング関数 ITScorePP [17]を用いて反復的に評価される。最後に,高分子の結合モードを結合エネルギーで評価し,ドッキングエネルギーに応じてランク付けした。
ドッキングエネルギースコアが最も低く、リガンドの二乗平均平方根偏差(RMSD)が最も高い構造モデルを選択し、PRODIGYサーバー[18]を用いて結合エネルギースコア(Kd)を解析した。PRODIGYは、タンパク質の結合親和性を計算するために、タンパク質-タンパク質相互作用の構造的特性、界面接触の数、非相互作用面を利用する堅牢な予測システムである[19]。
さらに、PDBSUMサーバー(http://www.ebi.ac.uk/pdbsum)を用いて、タンパク質複合体の3次元モデルの残留相互作用を分析した。蛋白質-蛋白質間の相互作用のうち、結合している残基と結合していない残基を調べた。
3. 結果と考察
タンパク質の多くの生物学的機能は、タンパク質-タンパク質間の相互作用の形成に依存している。HDOCKサーバー[15]を用いて,アミロイド形成タンパク質(Aβ,α-Syn,タウ,プリオン,TDP-43)とSARS-CoV-2 S1 RBDとの間の潜在的な相互作用を推定した。このサーバーは、考えられるタンパク質-タンパク質(ペプチド)相互作用の理論モデルを100個生成し、ドッキングエネルギーに基づいてスコアリングする。ドッキングエネルギースコアが最も高く、リガンドRMSDが最も低いモデル1を選択した。ドッキングの結果を図1とTable1,Table2にまとめた。
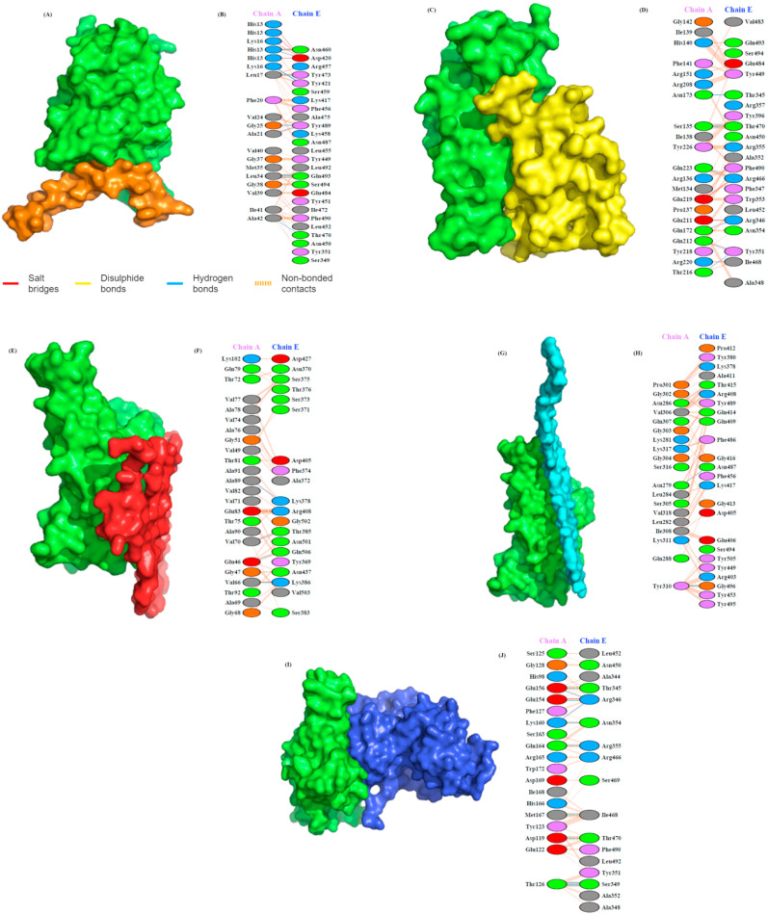
図1 SARS-CoV-2スパイクタンパク質S1のRBDドメインとアミロイド形成HBPとの相互作用
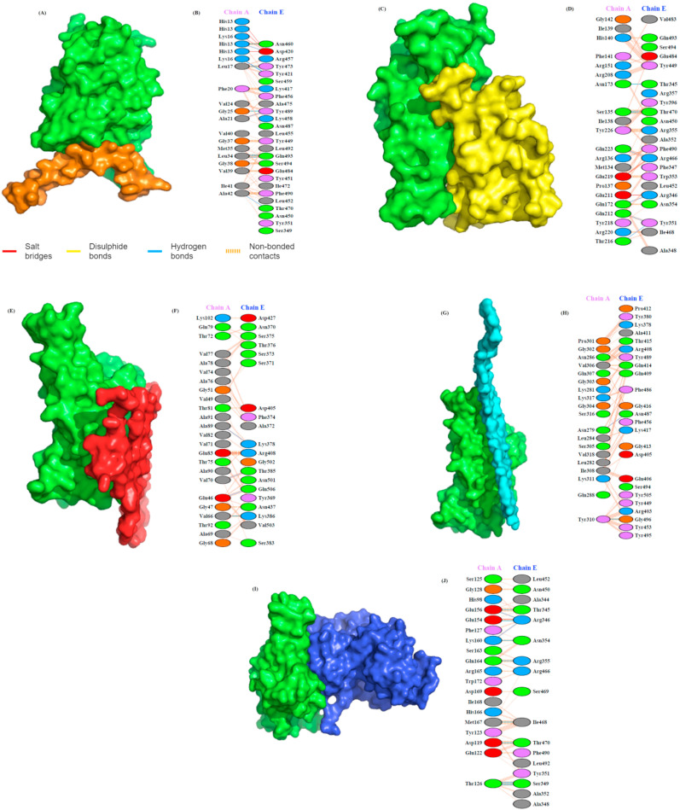
(A) スパイクタンパク質のS1(緑)とAβ(茶)のヘパリン結合ドメインの相互作用のドッキングモデル。(B) PDBsumによって推定されたS1(E鎖)とAβ(A鎖)の残基間の詳細な分子間相互作用。(C)S1(緑)とプリオン(黄)の相互作用を示すドッキングモデル。(D) S1(E鎖)とプリオンタンパク質(A鎖)の分子間相互作用。(E)S1(緑)-α-Syn複合体(赤)モデルの表面図と(F)この複合体の残留相互作用。(G)S1(緑)-タウ複合体の構造モデルと(H)タウ(鎖A)とスパイクタンパク質S1のヘパリン結合ドメイン(鎖E)との間の分子相互作用を示す。(I)S1(緑)とTDP-43のRRM(青)との相互作用を示すドッキングモデル、(J)スパイクタンパク質S1(E鎖)とRRM(A鎖)との間の詳細な分子間相互作用。残基間の主要な相互作用は点線で示した。主要な相互作用は、塩橋(赤)ジスルフィド結合(黄)水素結合(青)非結合性接触(オレンジ)と色分けされている。線の数は、潜在的な結合の数を示す。非結合性の接触については、縞模様の線の幅が潜在的な接触の数を示す。
表1 HDOCKサーバーで決定したSARS-CoV-2 S1 RBDドメインとアミロイド形成タンパク質との分子ドッキング
| Protein-protein complex | Docking score | ΔG (kcal mol−1) | Kd (M) at 25.0 °C/40.0 °C |
|---|---|---|---|
| S1-Aβ | −262.91 | −12.4 | 8.5E-10/2.3E-09 |
| S1-PRION | −285.39 | −12.8 | 3.9E-10/1.1E-09 |
| S1-α-Syn | −230.93 | −13.1 | 2.3E-10/6.6E-10 |
| S1-TAU | −258.39 | −11.5 | 3.5E-09/8.8E-09 |
| S1-RRM | −238.26 | −12.3 | 9.7E-10/2.6E-09 |
| S1-FGF2 | −242.75 | −13.2 | 2.2E-10/6.4E-10 |
表2 ヘパリンとヘパリン結合タンパク質の分子ドッキングスコアと、SARS-CoV-2 S1-ヘパリン複合体のアミロイド形成タンパク質に対するドッキングスコアとの比較
| Protein-heparin complex | Docking score | S1-heparin (S1–H)-Protein complex | Docking score |
|---|---|---|---|
| S1-Heparin | −282.57 | ||
| Aβ-Heparin | −235.28 | S1H-Abeta | −323.21 |
| Prion-Heparin | −276.48 | S1H-Prion | −310.39 |
| α-Syn-Heparin | −214.57 | S1H-α-Syn | −323.02 |
| TAU-Heparin | −233.68 | S1H-Tau | −257.20 |
| RRM-Heparin | −256.50 | S1H-RRM | −340.03 |
| FGF-Heparin | −220.74 |
SARS-CoV-2 S1のタンパク質に対する結合親和性は、ドッキングエネルギースコアが高いほど良好であることが示唆された。ドッキングスコアに基づいて、S1に対するタンパク質の親和性の高さを以下のように整理した。プリオン>Aβ>タウ>RRM>α-Syn(Table 1)。興味深いことに、ヘパリンとS1タンパク質の相互作用も強く、ドッキングスコアは-282.57で、プリオンタンパク質を除くすべての研究対象タンパク質よりもはるかに高い。PDBSumは、タンパク質複合体の相互作用する残基を決定するために使用される。図1に相互作用面と結合残基を示す。
ドッキングの結果、S1とAβ(ドッキングスコア:-262.91)の相互作用は、5つの水素結合と1つの塩橋によって強く媒介されていることがわかった。図1Bは、AβがS1タンパク質のAsp420,Tyr421,Asn460,Thr470,Tyr473,Tyr489,Gln493と、His13,Lys16,Leu17,Ala21,Gly25,Leu34,Ala42 Ala42残基を介して8つのH結合を形成していることを示している。AβのHis13とLys16,Lys16はS1のAsp420と4つの塩橋を形成している。プリオン蛋白質は、S1蛋白質と7つのH結合と2つの塩橋を形成している(ドッキングスコア:-285.39)(図1D)。プリオン蛋白質がH結合に関与している残基は、Asn173,Gln172,Gln212,Thr216,Gln223,Ser135とS1蛋白質のThr345,Arg346,Tyr351,Arg466,Thr470である。プリオンタンパク質のGlu211とGlu219は、S1タンパク質のArg346とArg466と塩橋を形成する。
S1-α-Syn複合体(ドッキングスコア:-230.93)では、4つのH結合と1つの塩橋が形成されている(図1F)。H結合は、Synタンパク質のAla89,Val70,Val66,およびGlu46と、S1タンパク質のLys378,Thr385,Lys386,およびGln506の間に形成されている。唯一、Glu83とArg408の間に塩橋が形成されている。Tau-S1タンパク質複合体(ドッキングスコア:-258.39)の場合は、2つのH結合が形成される(図1H)。タウのAsn279,Tyr310とS1タンパク質のAsn487,Gly496の間にH結合が形成されている。TDP-43のRRM(RRM1とRRM2)はS1タンパク質と11個のH結合と1個の塩橋を形成し、ドッキングスコアは-238.26であった(図1J)。RRMのGlu156,Lys160,Glu154,Thr126,Lys160,Gln164,met167,Asp119とS1タンパク質のThr345,Arg346,Ser349,Asn354,Arg355,Ile468,Thr470の間にH結合が形成されている。また、RRMのGlu154とS1タンパク質のArg346の間には、唯一の塩橋が形成されていた。
さらに、ヘパリン結合タンパク質としてよく知られているFGF2とS1タンパク質との相互作用では、ドッキングスコアが-242.75となり、Aβ、プリオン、タウタンパク質よりも有意に小さく、α-SynやTDP-43 RRMよりも大きかった。
また、SARS-CoV-2のS1とアミロイド形成HBPのヘパリン(PDB ID: 1HPN)との相互作用を解析し、ヘパリンとの結合相互作用と親和性を調べた(Table 2)。ドッキングの結果、S1とヘパリンの相互作用(ドッキングエネルギースコア:-282.57)は、Asn354,Arg355,Lys356,Asn394,Tyr396,Arg466の各残基が形成するH結合によって強く媒介されることがわかった(図2)。興味深いことに、ドッキングスコアは、S1がすべてのアミロイド形成タンパク質と比較してヘパリンと強く相互作用することを示唆している。ドッキングスコアに基づいて、タンパク質とヘパリンの間の相互作用を順番に並べると、以下のようになる。S1-ヘパリン>プリオン-ヘパリン>RRM-ヘパリン>Aβ-ヘパリン>タウ-ヘパリン>α-Syn-ヘパリンの順であった(Table 2)。また、FGF2-ヘパリンのドッキングスコア(-220.74)は、これらのタンパク質のどれよりも小さく、神経変性を引き起こすタンパク質やSARS-CoV-2のS1タンパク質が、ヘパリンとより強く結合していることがわかる。
図 2 SARS-CoV-2スパイクタンパク質S1のRBDドメインとヘパリンとの相互作用
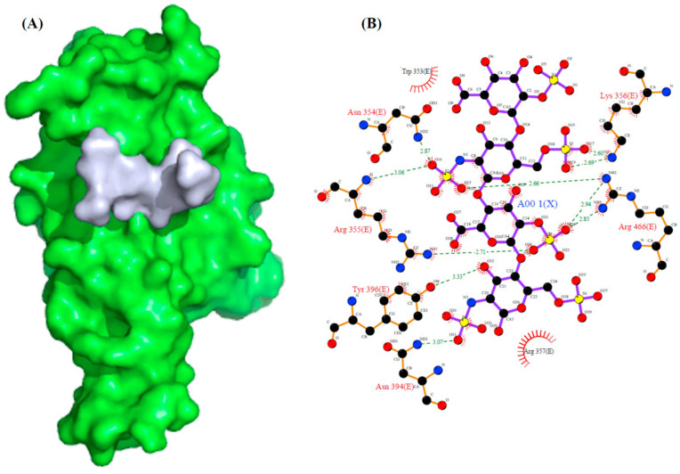
(A) スパイクタンパク質S1のヘパリン結合ドメイン(緑)とヘパリン(灰色)の相互作用のドッキングモデル。(B) PDBsumで観測された、S1とヘパリンの詳細な分子間相互作用を示すLigplot図。
次に、S1-ヘパリン複合体とアミロイドを形成するHBPとの相互作用を調べた(表2)。興味深いことに、SARS-CoV-2のS1-ヘパリン複合体は、S1-HBP複合体のドッキング強度と比較して、これらのHBPとより強く結合している。この結果は、ヘパリンがS1タンパク質に結合することで、アミロイドを形成するHBPがS1タンパク質により強く結合することを明確に示唆している。ドッキングスコアは、α-synがS1-ヘパリン複合体とより強く結合することを示しており、次いでRRM>Aβ>Prion>Tauの順であった(表2)。
次に、PRODIGYサーバー[18]を用いて、ドッキングした構造の結合親和性(Kd)を計算した(Table 1)。S1複合体の結合親和性を見ると、S1-α-Syn複合体が他の複合体よりも強い結合親和性(2.3×10-10M)を持ち、次いでS1-prion(3.9×10-10M)S1-Aβ(8.5×10-10M)S1-RRM(9.7×10-10M)S1-tau(3.5×10-9M)の順であった。これは、α-SynがSARS-CoV-2のS1タンパク質に対してより好ましい結合親和性を持つことを示している。また、FGF2に対するS1の結合親和性は、Kdが2.2×10-10Mと好ましい結合を示している。
さらに、S1複合体の結合エネルギースコア(Kd)を温度の関数として予測した。SARS-CoV-2のS1タンパク質複合体は、25℃から40℃への温度上昇に伴ってKdが明らかに増加し、結合親和性が低下した。また、温度が高くなると、α-SynはS1タンパク質(6.6×10-10M)に対してより強い結合親和性を示すようになり、次いでプリオン(1.1×10-9M)Aβ(2.3×10-9M)RRM(2.6×10-9M)タウタンパク質(8.8×10-9M)の順であった。
さらに、S1-α-SynおよびS1-tau複合体の予測Kdは、Aβ、プリオン、RRMとは対照的に、25℃から40℃に温度が上昇しても影響を受けにくかった。通常、温度の上昇はタンパク質-タンパク質複合体間の非共有結合を破壊するが、α-SynとS1の複合体では、温度による結合親和性の低下はそれほど顕著ではなかった。このことは、α-シヌクレインとSARS-CoV-2のS1タンパク質との間に安定した相互作用があることを示唆している。
4. 結論
要約すると、今回報告された知見は、SARS-CoV-2のスパイクタンパク質がヘパリン結合性のアミロイド形成タンパク質と相互作用できるという仮説を支持するものである。この結果は、S1タンパク質がこれらの凝集しやすいタンパク質と安定して結合していることを示しており、これが脳タンパク質の凝集を開始し、神経変性を促進する可能性がある。これらの結果は、COVID-19に関連する神経学的障害の可能性を説明するものである。したがって、SARS-CoV-2スパイクタンパク質と脳内タンパク質との相互作用を標的とすることは、COVID-19患者の凝集プロセス、ひいては神経変性を抑制する適切な方法であると考えられる。