コンテンツ
Increased Age-Adjusted Cancer Mortality After the Third mRNA-Lipid Nanoparticle Vaccine Dose During the COVID-19 Pandemic in Japan

公開日:2024年04月08日
DOI:10.7759/cureus.57860 査読あり
日本におけるCOVID-19パンデミック時のmRNA-脂質ナノ粒子ワクチン3回目投与後の年齢調整がん死亡率の増加。Cureus 16(4): e57860.
AI によるまとめ
この論文は、日本における2020年から2022年のCOVID-19パンデミック期間中のがんによる死亡率の変化について調査したものである。主な内容は以下の通りである。
- 1. 2020年にはがん死亡率の増加はほとんど見られなかったが、2021年以降、特に2022年には全がん死亡率が統計的に有意に増加した。
- 2. 特に卵巣がん、白血病、前立腺がん、口唇・口腔・咽頭がん、膵臓がん、乳がんによる死亡率が2021年から2022年にかけて顕著に増加した。
- 3. この死亡率の増加は、COVID-19感染そのものやロックダウンによるがん治療の減少だけでは説明できない可能性がある。
- 4. SARS-CoV-2 mRNA-LNPワクチンの複数回接種が、いくつかのメカニズムを通じてがんによる死亡率の増加に関与している可能性が示唆された。その機序として、以下のようなものが考えられる。
- スパイクタンパク質とLNPによる血栓形成の促進
- がん免疫サーベイランスの抑制
- エストロゲン受容体αを介したがん発症の促進
- ワクチンmRNAのゲノムへの組み込みによるがんリスクの増加
この論文は、COVID-19パンデミック中のがん死亡率の変化とmRNA-LNPワクチン接種との関連性について、いくつかの可能性を提示している。ただし、これらの関連性を確認するためには、より詳細な調査と研究が必要であると著者は強調している。
要旨
COVID-19パンデミック期間中、高齢化が急速に進む日本では、がんを含む過剰死亡が懸念されている。 そこで本研究では、COVID-19パンデミック期間中(2020-2022)に、日本におけるさまざまな種類のがんの年齢調整死亡率(AMR)がどのように変化したかを評価することを目的とした。日本の公式統計を用いて、観察された年間および月ごとのAMRを、ロジスティック回帰分析を用いてパンデミック前(2010~2019)の数値に基づく予測率と比較した。パンデミックの最初の年(2020)には、有意な過剰死亡は観察されなかった。しかし、1回目と2回目のワクチン集団接種後の2021年には、いくつかのがんによる過剰死亡が観察され、2022年の3回目のワクチン集団接種後には、すべてのがんといくつかの特定のがん種(卵巣がん、白血病、前立腺がん、口唇・口腔・咽頭がん、膵臓がん、乳がんを含む)で有意な過剰死亡が観察された。死亡者の多い4つのがん(肺がん、大腸がん、胃がん、肝臓がん)のAMRは、パンデミック初年度の2020年までは減少傾向を示したが、2021年と2022年には減少率が鈍化した。本研究では、こうした年齢調整がん死亡率の上昇について考えられる説明を考察する。
はじめに
COVID-19のパンデミックは2019年12月に中国の武漢で始まり、2020年1月に日本で初めて検出された。これを受けて、感染拡大を抑制するため、さまざまな医療・社会経済的規制が実施された。2021年2月以降、mRNA-脂質ナノ粒子(mRNA-LNP)ワクチンが緊急用として使用可能となり、生後6カ月以上のすべての人、特にリスクの高い人に推奨されている。2023年3月時点で、日本人の80%が1回目と2回目の接種を受け、68%が3回目の接種を受け、45%が4回目の接種を受けている[1]。こうした国の対策にもかかわらず、2023年4月末までに日本では3380万人が感染し、74,500人がCOVID-19が原因で死亡した。さらに、がんによる死亡[7-10]など、COVID-19以外の原因による過剰死亡がさまざまな国で報告されており[2-6]、日本も例外ではない[11,12]。がんは日本における主要な死因であり、死亡者全体の4分の1を占めている。したがって、パンデミックが2020年から2022年までのがんの死亡率に及ぼす影響を把握することが不可欠である。特にがんのように高齢者に発症しやすい疾患では、正確な評価には年齢調整が必要である。日本には、人口が1億2,300万人と多いこと、公的統計が利用できること、剖検調査による死亡診断書の正確率が80%と高いことなど、パンデミックががん死亡率に及ぼす影響を分析するのに理想的な特徴がいくつかある[13]。
材料と方法
統計データ
本分析で使用したデータは、すべて公表されている国内データである。死亡数は人口動態統計[14]から入手したもので、原因別、性別、年齢別(5歳階級)の月次および年次死亡数を含む。がん死亡は20の小分類に分けられている。日本在住の日本人のみを対象とした。年齢調整分析に必要な年齢階級別の推計人口も国のデータから入手した[15]。 COVID-19感染確定者数は厚生労働省のウェブサイトから入手した[16]。年齢階級別のワクチン接種率は首相官邸と厚生労働省のウェブサイトから入手した[1,17]。
年齢別死亡率(ASMR)
年間の粗死亡者数は、死亡者数の少ない0~39歳では10歳ごとに、死亡者数の多い40~89歳では5歳ごとにグループ分けした。ただし、サンプル数が少ないため、90歳以上は1つのグループにまとめた。
ASMR(10万人当たり)=di÷pi×100,000=di÷pi×100,000
di=その年齢層の粗死亡数、pi=観察された集団におけるその年齢層の数
直接標準化による年齢調整
ASMRはすべてのがんの死亡率の概観を提供するには詳細すぎるため、要約された指標として直接標準化による年齢調整死亡率(AMR)を用いた。経時的な死亡率の比較のために、本研究と同様に、すべてのデータは日本人集団全体のものであり、数も年齢構成も比較可能なほど多い。年齢群ごとの具体的な死亡率がわかっているので、直接標準化が適切である[18]。日本の厚生労働省は、2015年の標準人口データ(1億2,532万人)を平滑化した直接標準化を用いていると報告されており[19]、本研究でも同じ方法を用いた。計算式は以下の通り:
年齢調整死亡数=∑(d i÷p i×ps i )=∑(di÷pi×psi)
年齢調整死亡率(AMR) (人口10万人当たり)=∑(d i÷p i×ps i)÷∑ps i×100,000=∑(di÷pi×psi)÷∑psi×100,000
i=年齢群、di=その年齢群における死亡数、pi=観察集団におけるその年齢群の数、psi=標準集団におけるその年齢群の数。
性特異的がんの年齢調整は、「性特異的平滑化標準集団データセット1」[20]を用いて行った。うるう年は366日に死亡していたため、年齢調整した年間死亡数とAMRに365/366を乗じて補正した。 うるう年の2月の死亡数と死亡率も月次解析用に補正した。
COVID-19パンデミック時の過剰死亡率
この研究における過剰死亡率は以下のように定義された:
=Do-Dp=Do-Dp
Do=観察された死亡数、Dp=対応する年または月の予測死亡数
超過死亡率(%) =(Ro-Rp)÷Rp×100 =(Ro-Rp)÷Rp×100
Ro=観察率、Rp=対応する年または月の予測率(率はASMRまたはAMR)
COVID-19パンデミック前の2010~2019年の期間に基づく予測率は、ロジスティック回帰分析を用いて算出した[5]。統計解析にはR(バージョン4.3.1;R Development Core Team、ウィーン、オーストリア)を使用した。
予測率の信頼区間(CI)と予測区間(PI)は、以下の式を用いてロジット変換した値を逆変換して算出した。
残留分散 (σ2)=∑(V o i-V p i ) 2÷(n-p-1)=∑(Voi-Vpi)2÷(n-p-1)
ロジット変換信頼区間(l-)の標準誤差(SEi)CI)=σ 2×(1 n +(x i-x¯ ) 2÷∑(x i-x¯ ) 2 )————-xml-ph-0033@deepl.inte
ロジット変換予測区間(l-)の標準誤差(SEi)。PI)=σ 2×(1+1 n +(x i-x¯ ) 2÷∑(x i-x¯ ) 2 )————-xml-ph-0033@deepl.in
ロジット変換 CI(l-CI)または PI(l-PI)=Vpi±tn-p-1(確率)×S E i ×SEi
Voi=ロジット変換されたASMRまたはAMR,Vpi=ロジット変換された予測ASMRまたはAMR, n =オブザベーションの数(ここでは10;2010年から2019年まで), p =説明変数の数(ここでは1、x i=現在の年(ここでは、2010,2011,・・・,2022のうちの1つ), x¯=∑xi÷nx¯=∑xi÷n,tn-p-1(確率)=自由度(n-p-1)でのtの値。
結果
全死因および全がんによる死亡率
表1は、全死因、全がん、各がん種の粗死亡数、年齢調整死亡数、過剰死亡数を、2020年、2021年、2022年のパンデミック時の過剰死亡率とともに示したものである。各がん種は2022年の死亡数の多い順に記載されている。パンデミック中の2020年、2021年、2022年の年齢調整死亡数は、それぞれ全死因で1,206,126人、1,244,976人、1,320,768人、全がんで345,248人、345,625人、344,114人であった。パンデミックの最初の年である2020年には、全死因で有意な欠損死亡率(<99%下部PI)がみられ、全がんでは過剰死亡率はみられなかった。しかし2021年には、全死因で2.1%(上限PI99%以上)、全がんで1.1%(上限PI95%以上)の有意な過剰死亡がみられた。2022年には、超過死亡率は全死因で9.6%(PI値上限99%超)、全がんで2.1%(PI値上限99%超)に増加した。2022年の過剰死亡数は、全死因で115,799人(95%CI:106,018人、125,501人)、全がんで7,162人(95%CI:4,786人、9,522人)であった。20の下位分類のうち、死亡数の多い5つのがん(肺がん、大腸がん、胃がん、膵臓がん、肝臓がん)が全がんによる死亡数の61%を占めた。各がん種の死亡数の順位は、2020年から2022年までほぼ横ばいであった。
| 死因とICD-10コード | 粗死亡者数 | 年齢調整死亡数 | 過剰死亡数(年齢調整後) | 過剰死亡率(年齢調整後) | |||||||||
| 2020 | 2021 | 2022 | 2020 | 2021 | 2022 | 2020 | 2021 | 2022 | 2020 | 2021 | 2022 | ||
| 全死因死亡 | 1,372,648 | 1,439,809 | 1,568,961 | 1,206,126 | 1,244,976 | 1,320,768 | -28,126 | 25,453 | 115,799 | -2.3%‡ | 2.1%⁑ | 9.6%⁑ | |
| 悪性新生物 C00-C97 | 378,356 | 381,497 | 385,787 | 345,248 | 345,625 | 344,114 | -1,379 | 3,870 | 7,162 | -0.4% | 1.1%* | 2.1%⁑ | |
| 下位分類 | 気管、気管支および肺の悪性新生物 C33-C34 | 75,581 | 76,212 | 76,664 | 68,721 | 68,832 | 68,292 | -352 | 672 | 1,033 | -0.5% | 1.0% | 1.5% |
| 結腸・S状結腸・直腸の悪性新生物 C18-C20 | 51,784 | 52,416 | 53,088 | 47,303 | 47,498 | 47,338 | -859 | -380 | -259 | -1.8% | -0.8% | -0.5% | |
| 胃の悪性新生物 C16 | 42,318 | 41,624 | 40,711 | 38,388 | 37,458 | 35,940 | -199 | 366 | 286 | -0.5% | 1.0% | 0.8% | |
| 膵臓の悪性新生物 C25 | 37,674 | 38,578 | 39,468 | 34,590 | 35,249 | 35,593 | 296 | 651 | 688 | 0.9%* | 1.9%⁑ | 2.0%⁑ | |
| C00-C97のその他の残りの悪性新生物 | 28,592 | 28,934 | 29,646 | 26,024 | 26,065 | 26,273 | -115 | 149 | 579 | -0.4% | 0.6% | 2.3% | |
| 肝および肝内胆管の悪性新生物 C22 | 24,839 | 24,102 | 23,621 | 22,561 | 21,708 | 20,960 | -42 | 161 | 421 | -0.2% | 0.7% | 2.0% | |
| 胆嚢および胆道その他の悪性新生物 C23-C24 | 17,772 | 18,172 | 17,758 | 15,810 | 15,990 | 15,303 | -255 | 333 | 43 | -1.6% | 2.1% | 0.3% | |
| 乳房の悪性新生物 C50 | 14,650 | 14,803 | 15,911 | 14,089 | 14,185 | 15,109 | -558 | -631 | 122 | -3.8%† | -4.3%† | 0.8% | |
| 悪性リンパ腫 C81-C86 | 13,995 | 13,997 | 14,230 | 12,591 | 12,507 | 12,437 | 239 | 64 | -98 | 1.9% | 0.5% | -0.8% | |
| 前立腺の悪性新生物 C61 | 12,758 | 13,216 | 13,440 | 10,775 | 10,981 | 10,835 | 131 | 547 | 604 | 1.2% | 5.3%* | 5.9%* | |
| 食道の悪性新生物 C15 | 10,978 | 10,958 | 10,918 | 10,298 | 10,248 | 10,105 | -381 | -226 | -170 | -3.6% | -2.2% | -1.7% | |
| 白血病 C91-C95 | 8,983 | 9,120 | 9,758 | 8,280 | 8,397 | 8,868 | -16 | 143 | 656 | -0.2% | 1.7% | 8.0%* | |
| 膀胱の悪性新生物 C67 | 9,166 | 9,443 | 9,597 | 8,060 | 8,196 | 8,114 | -181 | -68 | -171 | -2.2% | -0.8% | -2.1% | |
| 口唇、口腔および咽頭の悪性新生物 C00-C14 | 7,826 | 8,000 | 8,429 | 7,257 | 7,364 | 7,636 | -46 | 92 | 395 | -0.6% | 1.3% | 5.5%* | |
| 子宮の悪性新生物 C53-C55 | 6,806 | 6,818 | 7,156 | 6,568 | 6,589 | 6,877 | -73 | -86 | 168 | -1.1% | -1.3% | 2.5% | |
| 卵巣の悪性新生物 C56 | 4,875 | 5,081 | 5,182 | 4,732 | 4,928 | 4,989 | 114 | 347 | 442 | 2.5% | 7.6%⁑ | 9.7%⁑ | |
| その他のリンパ系、造血系等の悪性新生物C88-C90、C96 | 4,295 | 4,351 | 4,391 | 3,857 | 3,888 | 3,850 | -136 | -45 | -22 | -3.4% | -1.1% | -0.6% | |
| 中枢神経系の悪性新生物 C70-C72, C75.1-C75.3 | 2,847 | 3,054 | 3,106 | 2,729 | 2,944 | 2,966 | -165 | -46 | -120 | -5.7% | -1.5% | -3.9% | |
| 皮膚の悪性腫瘍 C43-C44 | 1,707 | 1,718 | 1,806 | 1,532 | 1,512 | 1,546 | 8 | 1 | 47 | 0.6% | 0.1% | 3.2% | |
| 喉頭の悪性新生物 C32 | 781 | 795 | 798 | 714 | 721 | 707 | -62 | -27 | -15 | -8.0% | -3.6% | -2.1% | |
表1:2020年、2021年、2022年のパンデミック期間中の全死因、全がん、各がん種における粗死亡、年齢調整死亡、過剰死亡の観察値
各がん種は、2022年の死亡者数の多い順に記載されている。
過剰死亡率 = (観察されたAMR – 予測されたAMR) / 予測されたAMR * 100 (%)。(パンデミック前の2010年から2019年に基づく予測AMRは、ロジスティック回帰を用いて算出した)。
記号⁑は99%以上、*は95%以上、‡<99%、†<95%下予測区間(PI)
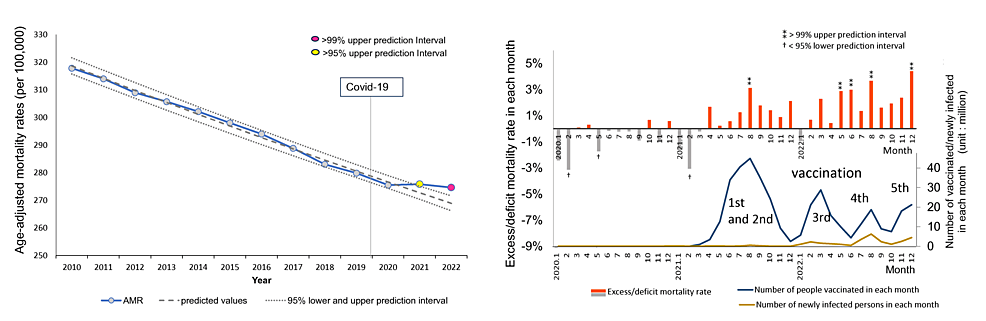
図1は、COVID-19パンデミック(2020-2022)期間中の全癌の経年的な年間AMRと各月の超過死亡率を示したものである。AMRは2020年(AMR275.5/人口10万人)までは減少傾向にあったが、2021年以降は減少が止まり、2021年(AMR275.8/人口10万人)にはPI95%上限を超え、2022年(AMR274.6/人口10万人)にはPI99%上限を超えた。右図に示すように、月別の超過死亡率(%)は、1回目と2回目の集団予防接種のピークと重なる2021年8月に初めて99%上限PIを超え、3回目の集団予防接種のピークから2カ月後の2022年5月から再び上昇し、12月までの4カ月間、再び99%上限PIを超えた。
図1:経時的な年齢調整死亡率(AMR)と各月の超過死亡率:全がん
(左側)年齢調整死亡率(AMR)の観測値(人口10万人当たり)をマーク付きの青線、ロジスティック回帰分析による予測傾向を破線、95%予測区間(PI)を点線で表す。印はPI上限の95%を超えた年を黄色、PI上限の99%を超えた年をピンク色で示した。 縦線はCOVID-19の日本上陸を示す。2020年までは減少傾向であったが、2021年以降は減少が止まり、2021年にはPI値95%上限を、2022年にはPI値99%上限(線は表示せず)を超えている。
(右側)横軸は2020年、2021年、2022年のパンデミック期間中の各月を示し、左側の縦軸は超過死亡率(%)を示し、(観測されたAMR-該当月の予測AMR)/該当月の予測AMR*100として算出した。COVID-19パンデミック前の2010年から2019年の期間に基づく予測AMRは、ロジスティック回帰分析により推定された。
記号⁑はPI値上限99%以上、†はPI値下限95%未満を示す。右側の縦軸はCOVID-19に起因する国内ワクチン接種数と死亡数を示す。
月ごとの超過死亡率は、1回目と2回目の集団予防接種のピークと重なる2021年8月に初めてPI値99%上限を超え、3回目の集団予防接種のピークから2カ月後の2022年5月からは再びPI値99%上限を4カ月間超えた。
全癌の年齢別死亡率
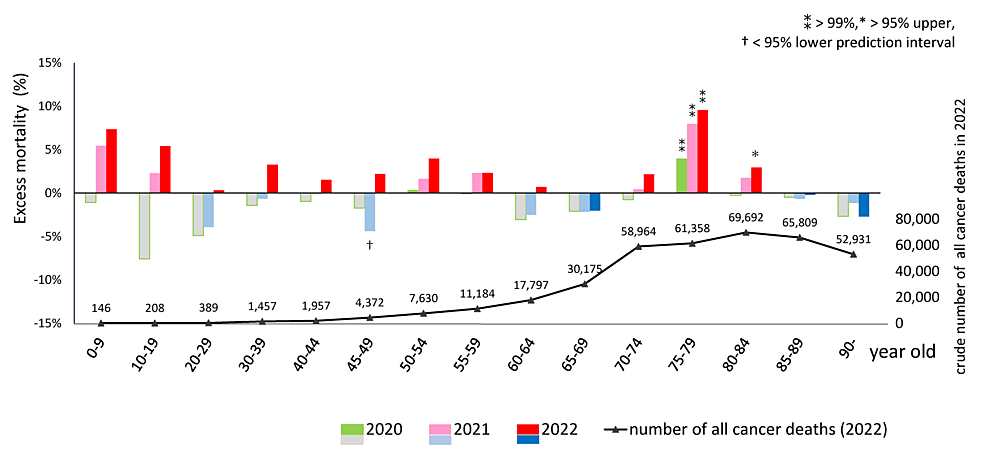
パンデミック前(2010-2019)には、すべての種類のがんの年齢別粗死亡率は、90歳以上の年齢層を除くすべての年齢層で減少傾向にあった(データは示していない)。2020年には、75~79歳を除くほとんどの年齢層で死亡率の不足が観察された。しかし、これは2021年には徐々に超過死亡率に移行し、2022年には65-69歳と85歳以上の群を除くほとんどすべての年齢群でエスカレートした。75-79歳群では、超過死亡率は2020年に3.9%(95%CI:2.6,5.3)、2021年に7.9%(6.4,9.5)、2022年に9.5%(7.8,11.80~84歳では、2022年の超過死亡率は2.9%(1.4, 4.5)であり、95%PIを上回った。死亡者数の少ない若年層では統計的有意性は検出されなかった。下のグラフは、すべてのがんによる死亡者数が80~84歳群で最も多いことを示している(図2)。表2によると、70歳以上の90%以上が3回目のワクチン接種を受けている[1,17]。厚生労働省の報告によると、投与された製剤の99.9%以上がmRNA-LNPであり、1価ワクチンで3回目までの投与では、BNT162b2が78.1%、mRNA-1273が21.8%を占めている[17]。
図2:各年齢層における2020年、2021年、2022年のパンデミック時の超過死亡率(上)と2022年の粗がん死亡数(下)
年齢別過剰死亡率=(観察されたASMR-予測されたASMR)/予測されたASMR*100(%)。COVID-19パンデミック前の2010年から2019年の期間に基づく予測ASMRは、ロジスティック回帰を用いて算出した。記号⁑は99%以上、*は95%以上、†は95%未満を示す。2020年には、75~79歳を除くほとんどの年齢層で死亡率の不足が観察された。しかし、2021年には死亡率が徐々に増加し、2022年には65-69歳と85歳以上の年齢層を除くほとんどすべての年齢層で死亡率が顕著に増加した。75-79歳群では、超過死亡率は2020年に3.9%(95%CI:2.6, 5.3)、2021年に7.9%(95%CI:6.4, 9.5)、2022年に9.5%(95%CI:7.8, 11.4)となり、99%の上限PIを超えた。80~84歳群では、2022年の超過死亡率は2.9%(1.4, 4.5)で、95%上限PIを上回った。死亡者数の少ない若年層では統計的有意性は検出されなかった。下のグラフは、すべてのがんによる死亡数が80~84歳群で最も多いことを示している。
| 年齢層(歳) | 6カ月~4カ月 | 5-11 | 12-19 | 20-29 | 30-39 | 40-49 | 50-59 | 60-69 | 70-79 | 80-89 | 90- |
| 初回と2回目の投与 | 3.1% | 16.2% | 67.4% | 80.2% | 80.5% | 82.9% | 90.7% | 91.5% | 93.7% | 97.7% | 99.3% |
| 3回目 | 0.9% | 8.1% | 42.8% | 56.1% | 58.8% | 65.0% | 79.0% | 86.5% | 91.1% | 95.1% | 96.0% |
表2:2023年3月時点の年齢層別ワクチン接種率
70歳以上の90%以上が3回目のワクチン接種を受けている。
癌の種類別死亡率
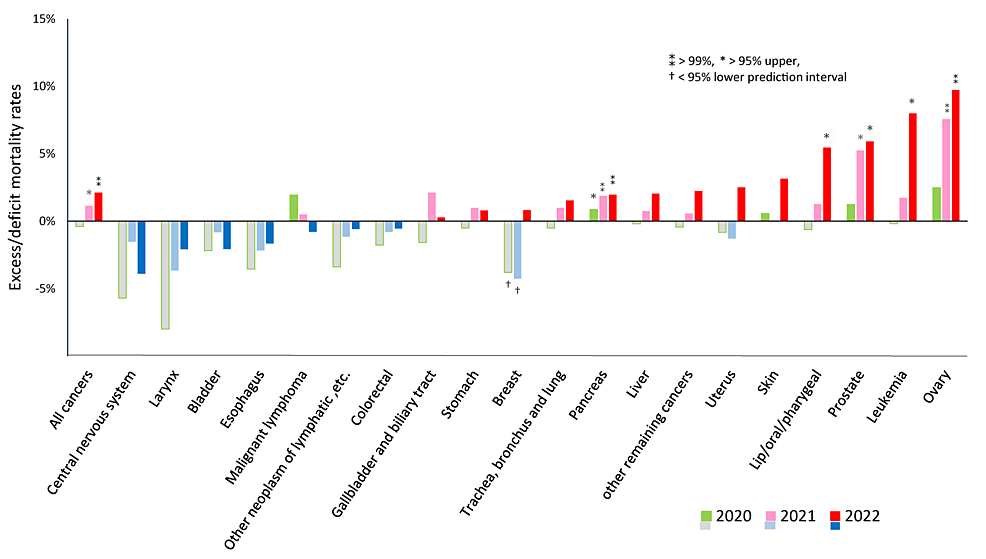
図3は、がんの種類ごとの超過死亡率を示している。2020年には、膵臓がんのみが95%上限PIをわずかに上回った。しかし、2021年には20種類中3種類のがんで、2022年には20種類中5種類のがんで、統計的に有意な過剰死亡が観察された。AMRが予測値を上回ったのは、卵巣がんで2021年に7.6%(95%CI:5.6, 9.5)、2022年に9.7%(7.5, 12.0)、膵臓がんで1.7%(-2.1,5.7)および8.0%(3.4,12.8)、前立腺がんでは5.3%(2.7,7.9)および5.9%(3.0,8.9)、1.3%(-1.4,4.1)、口唇・口腔・咽頭がんが5.5%(2.3,8.7)、膵臓がんが1.9%(0.4,3.4)、2.0%(0.3,3.7)であった。乳がんは2020年と2021年に有意な欠損死亡率を示し、2022年には統計的有意差はないが過剰死亡率に転じた。
図3:2020年、2021年、2022年のパンデミックにおける各がん種の過剰死亡率
過剰死亡率 = (観察されたAMR – 予測されたAMR) / 予測されたAMR * 100 (%)。
パンデミック前の2010年から2019年の期間に基づく予測AMRは、ロジスティック回帰を用いて算出された。記号⁑はPI値上限99%以上、*はPI値上限95%以上、†はPI値下限95%未満を示す。
左端に示すように、2021年と2022年にはすべてのがんによる過剰死亡率が観察され、それぞれ95%または99%の上限PIを超えた。20種類のがんのうち、有意な過剰死亡率を示したのは5種類で、2022年の数値から低い順に卵巣がん、白血病、前立腺がん、口唇・口腔・咽頭がん、膵臓がんであった。乳がんは2020年と2021年に有意な欠損死亡率を示し、その後統計的有意差はないものの過剰死亡率に転じた。
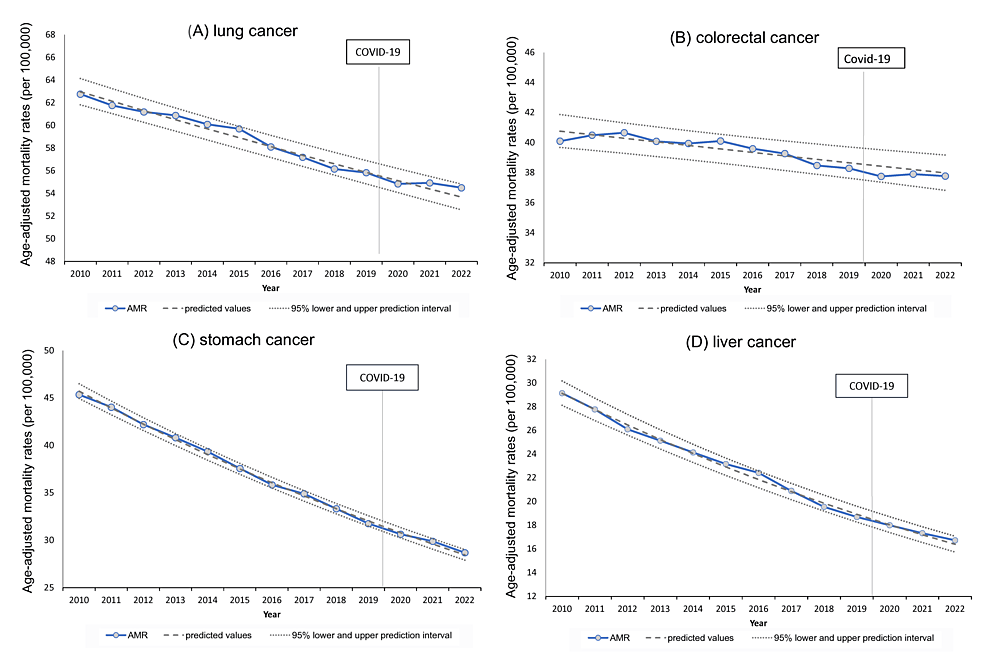
死亡者の多い4つのがん(肺がん、大腸がん、胃がん、肝臓がん)のAMRは、パンデミック初年度の2020年までは減少傾向を示したが、2021年と2022年には減少率が鈍化した。それでもAMRは95%PIの範囲内にとどまっている(図4)。
図4:主要がん(肺がん、大腸がん、胃がん、肝臓がん)の年齢調整死亡率の経年変化
肺がん、大腸がん、胃がん、肝臓がんはすべて、年齢調整死亡率(AMR)で同様の減少傾向を示した。しかし、この減少は鈍化し、大腸がんを除くすべてのがんにおいて、2021年と2022年にAMRは徐々に予測値を上回った。死因の第4位である膵がんについては後述する。
2021年および2022年に死亡率が過剰となるがん種の傾向
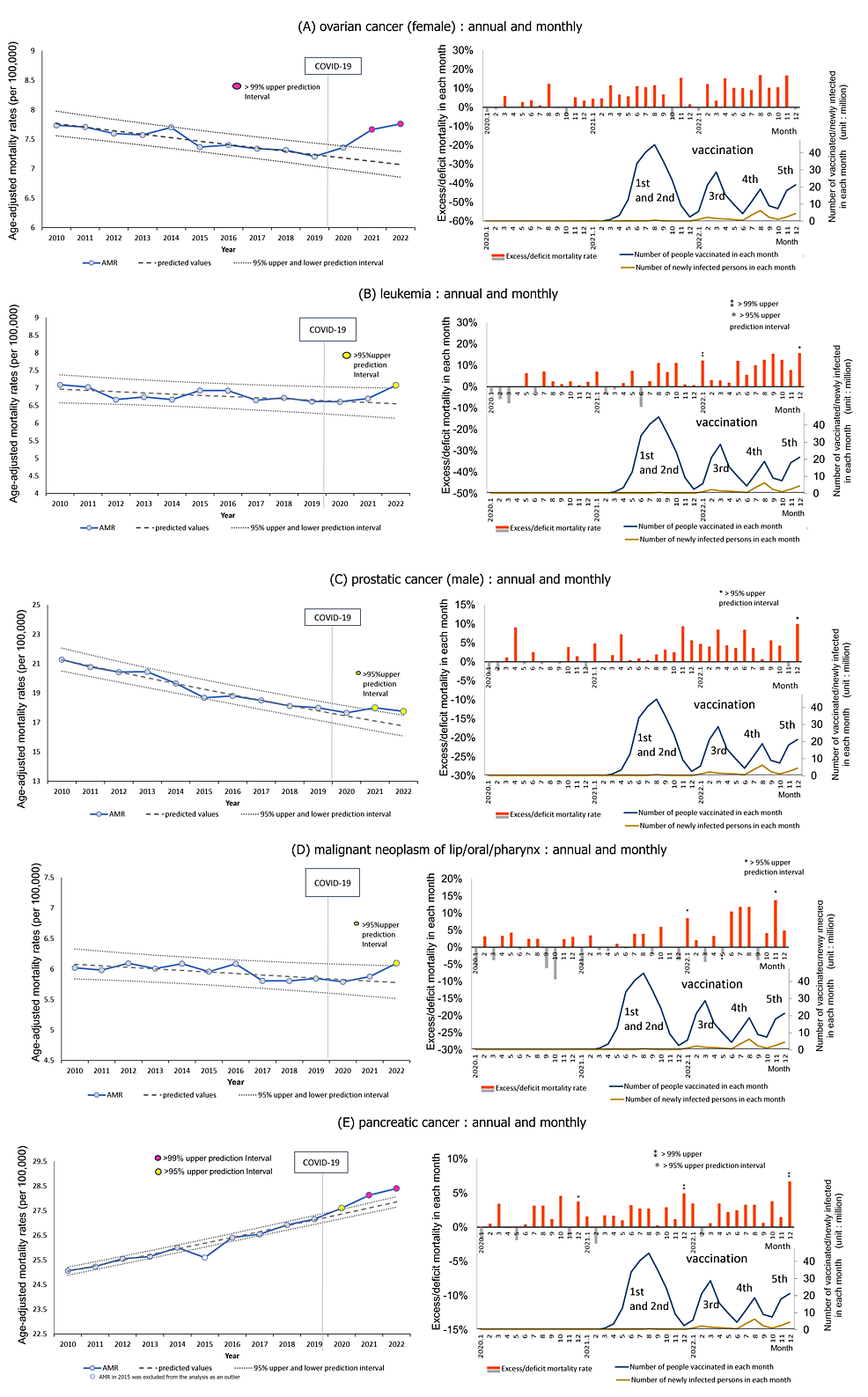
卵巣がん、白血病、前立腺がん、口唇・口腔・咽頭がん、膵臓がんの5つのがん種で、2021年および/または2022年にAMRが予測値を上回った。図5は、これらのがんの年別・月別の傾向を示したものである。4つのがん種は緩やかな減少傾向を示したが、膵臓がんは経時的に増加傾向を示した。2021年には卵巣がん、前立腺がん、膵臓がんがPI値95%上限を超え、2022年には5つのがん種すべてがPI値95%上限を超えた。 2021年から2022年にかけて、これらのがんの月別過剰死亡率は2020年に比べて徐々に上昇した。
図5:経時的な年齢調整死亡率(AMR)と、2021年と2022年に死亡率が過剰となるがんの各月の過剰死亡率
グラフの軸、単位、その他の要素についての説明は図1を参照のこと。
(A)卵巣がん
2010年からは緩やかな減少傾向にあり、2020年からはわずかに増加し、2021年から2022年にかけては大幅に増加し、2021年と2022年にはAMRがPI値99%の上限を超えた。毎月の過剰死亡数は2021年と2022年にかけて徐々に増加した。
(B)白血病
白血病の年間AMRは、2010年から徐々に減少または停滞したが、2022年には有意に増加し、95%上限PIを超えた。月ごとのAMRは、2022年1月に99%上限PIを、12月に95%上限PIを超えた。
(C)前立腺がん
年間AMRは2010年から徐々に減少傾向にあったが、2021年から増加し、2021年と2022年には95%上限PIを超えた。毎月の超過死亡数は2021年と2022年まで徐々に増加し、2022年12月には95%上限PIを超えた。
(D) 口唇・口腔・咽頭がん
年間AMRは経時的に緩やかな減少傾向にあったが、2022年に増加し、95%上限PIを超えた。月ごとの超過死亡数は、2022年のCOVID-19の3回目の集団予防接種後にさらに明確に増加し、2022年1月と12月に95%上限PIを超えた。
(E) 膵臓がん
2015年のAMRは、原因不明の明らかな異常値であったため、分析から除外された。
膵臓がんの年間AMRは2010年から増加し、2020年に95%上限PIを超え始め、2021年から2022年にかけてさらに乖離して増加し、99%上限PIを超えた。月ごとの超過死亡率は2020年から上昇し、2020年12月には95%PIを上回り、2021年12月と2022年12月にはさらに上昇し、99%PIを上回った。
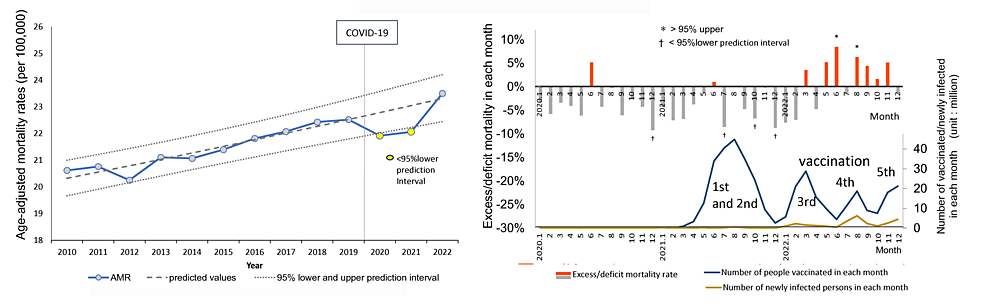
毎月の死亡率が高いがん種:乳がん
年間AMRが95%PIを上回らなかった残りの15がん種のうち、月間AMRが95%PIから1年間に複数回乖離したがん種は女性の乳がんのみであった。女性の乳がんの年間AMRは、2020年と2021年には95%PIの下限を下回り、2022年には上昇したが95%PIの範囲内にとどまった(図6左側)。毎月の統計的に有意な過剰死亡率は、3回目の集団予防接種のピークから数ヵ月後に現れ、2022年に2回95%上限PIを超えた(右側)。
図6:経時的な年齢調整死亡率(AMR)とパンデミック期間中の各月の超過死亡率:乳がん
グラフの軸、単位、その他の要素についての説明は図1を参照のこと。
女性の乳がんの年間AMRは、2020年と2021年に95%PI下限を下回り、2022年に増加したが、統計的有意差はなかった(左側)。月間過剰死亡数は、3回目の集団予防接種の数ヵ月後に現れ、2022年に2回95%PI上限を上回った(右側)。
考察
Scherbらは、2020年、2021年、2022年の日本におけるCOVID-19パンデミック時の全死因の粗超過死亡率をそれぞれ-2.84%(95%CI:-4.46、-1.25)、0.80%(-0.83,2.40)、8.37%(6.74,9.97)であった[5]。本研究では、2010年から2019年までの予測を用いてロジスティック回帰により年齢調整過剰死亡率を推定し、それぞれ-2.3%(-2.7、-1.9)、2.1%(1.6,2.6)、9.6%(9.0,10.2)と算出した。 これらの結果は一致していると思われる。すべてのがんについて、超過死亡率はそれぞれ-0.4%(-0.9,0.1)、1.1%(0.5,1.8)、2.1%(1.4,2.8)と推定され、2020年には超過はなく、2021年と特に2022年には統計的に有意に増加することが示された。
2020年、パンデミック初年度の調査結果
すべてのがんによる死亡率は2020年には増加しなかった。2020年の予測から統計的に有意に乖離したのは、75~79歳の年齢層における全がん死亡の3.9%の超過、膵がん死亡のごくわずかな超過(0.9%)、乳がん死亡の3.8%の赤字のみであった(乳がん死亡の4.3%の赤字は2021年にも観察された)。2020年にはSARS-CoV-2の強毒株が日本に入ってきたが、日本ではCOVID-19に起因する死亡は比較的少なかった[21]。2021年9月までにパンデミック緊急事態宣言が3回発令され、COVID-19患者の社会的隔離と入院の確保が要請された。 パンデミックががん死亡率に及ぼす影響を推定するためのモデル研究がいくつかの国で実施された[7,8]。実際、2020年3月と4月にベルギーで発生したCOVID-19の第1波では、2013年から2018年に予測された死亡数と比較して、がんによる死亡数がそれぞれ10%と33%増加した[9]。南インドの都市マドゥライでは、ロックダウンの最初の数週間で、がんに起因する死亡が109%増加した[10]。ブラジルでは、2020年3月から5月にかけての第一波の間、生検、大腸内視鏡検査、マンモグラフィ、腫瘍外科手術の件数は、パンデミック前に比べてそれぞれ29%、57%、55%、9%減少した。その結果、がんによる入院患者数は21%減少したが、がんによる入院患者の死亡率は14%増加した[22]。日本では、地域における胃がん、肺がん、大腸がん、乳がん、子宮がんの検診件数は、2020年には24.4%減少し(職場ではわずか0.9%)、2021年には元の傾向に戻ったようである[23]。 消化器がんに対する重要な手術件数は、2020年には6.2%減少し、2021年には5.このようながん治療の減少は、本研究で2020年に観察された75~79歳の年齢層におけるがん死亡率の過剰と膵臓がん死亡のわずかな増加を説明する可能性がある。2020~2021年の乳がん死亡の減少の理由は不明である。
パンデミック2年目と3年目の2021年と2022年の調査結果
2021-2022年のがん死亡に関する統計所見をまとめると以下のようになる。
全がん死亡:2021年に統計的に有意な過剰が出現し、2022年にはさらに増加した。さらに、2021年8月以降に毎月の死亡率の有意な過剰が観察されたが、一般集団への集団予防接種が始まったのは2021年4月頃であった。 ほとんどの年齢層でがん死亡の過剰傾向がみられた。しかし、これらの傾向は、がん死亡率が最も高い年齢層、すなわち2021年の75~79歳、2022年の75~84歳においてのみ統計的に有意であった。 70歳以上の90%以上が3回目のワクチン接種を受けている。
がんの種類:最も一般的ながんの種類(肺がん、結腸直腸がん、胃がん、肝臓がん)による死亡は、パンデミック前の時期には減少傾向を示し、パンデミック中も減少率は鈍化したが、95%PIの範囲内にとどまった。一方、20種類のがんのうち6種類(卵巣がん、白血病、前立腺がん、口唇・口腔・咽頭がん、膵臓がん、乳がん)では、2021年に統計的に有意な過剰死亡がみられ、2022年にはさらに増加した。ロックダウンによるがん検診や医療の減少は、どの種類のがんでも死亡を増加させる可能性がある。しかし、6つの特定のがん種の死亡数が有意に増加したことは、医療サービスの不足によって説明できるとは考えにくい。この期間の発生率に関しては、中核がん医療センターに登録された全患者の粗数値は、男性の前立腺がんと女性の乳がんで2021年、特に2022年に増加傾向を示した[24]。しかし、これらは年齢調整されておらず、増加とは判断できない。
mRNA-LNPワクチンの複数回投与の影響
国内のがん医療に関する報告書[23]や、2021年10月以降に緊急事態宣言が出なかったことから、2021年後半以降、がん検診や治療へのアクセス制限はかなり緩和されたようだ。1回目、2回目の集団接種は2021年春に開始され、接種率は2021年夏に80%とまもなくピークに達した。3回目の接種率は2022年春に68%とピークに達した。現在、日本は7回目の集団接種まで実施しており、最も接種率の高い国となっている。
研究者らは、SARS-CoV-2 mRNA-LNPワクチンが癌の発症や進行のリスクをもたらす可能性があると報告している[25-28]。さらに、いくつかの症例報告では、ワクチン接種後にがんが発症または悪化したことが報告されており、がんとmRNA-LNPワクチン接種との因果関係の可能性について議論されている[29-34]。
BNT162b2 mRNA(Pfizer-BioNTech)の分子量に基づくと、1回あたりのmRNA含量は13兆分子、mRNA-1273(モデルナ)では40兆分子と推定される[35,36]。 ヒトの細胞総数は37.2兆個[37]であり、mRNA-LNPの数は非常に多く、全細胞数の3分の1からそれに相当する数になる。 接種後、mRNA-LNPは様々な臓器、特に肝臓、脾臓、副腎、卵巣、骨髄に送達される[38]。ある研究では、2回目のmRNA-1273またはBNT162b2投与から7~60日後に、SARS-CoV-2 mRNAワクチン特異的プローブのハイブリダイゼーションにより、ワクチン接種者のリンパ節でワクチンmRNAが検出された[39]。N1-メチル-シュードウリジンで修飾されたmRNAは、大量のSARS-CoV-2スパイクプロテイン(S-タンパク質)を翻訳することができた[40]。S-proteinはワクチン接種者の血液中のエクソソーム表面に出現した[41]。ワクチン特異的組換えSタンパク質の断片は、ワクチン接種者の50%の血液検体から検出され、3~6カ月後も検出された。
一方、基本的に呼吸器感染症であるSARS-CoV-2感染の場合、ウイルスSタンパクは急性重症患者であっても10〜20日間しか血清中に検出されなかった[43-45]。日本では2022年初頭に弱毒化されたオミクロン株が出現し、その後様々な時点で流行している。図1、5、6のグラフに示すように、毎月のワクチン接種者数は新たに感染が確認された症例数の何倍も多く、2022年末までの累積接種者数(3億8000万人)は新たに感染が確認された症例数(3000万人)の13倍であった。
米国の医療機関で働く50,000人以上の従業員を対象とした研究では、26週間の間に接種したワクチンの回数(0回、1回、2回、3回、4回以上)に基づいてオミクロン変異株の流行発生率を観察し、接種したワクチンの回数とCOVID-19の累積発生率に正の相関があることを示した[46]。複数回のワクチン接種後のCOVID-19感染に対する感受性は、抗体依存性の増強[47]、免疫刷り込み[39,48]、免疫抑制[25-27]によって高まる可能性がある。この結果、複数回ワクチン接種を受けた人は、ワクチンのSタンパク質に加えてウイルスのSタンパク質にも暴露される危険性がある。これらのデータは、注射される大量のmRNA-LNP、特に特定の臓器への迅速かつ広範囲な分布、産生されるS-proteinの量、体内での長期持続性、感染に対する感受性の増加など、ワクチン接種者への重大な影響を示唆している。次に、mRNA-LNP SARS-CoV-2ワクチンがすべての癌およびいくつかの特定の癌種による死亡率を増加させることに関与していると考えられる各要因について考察する。
スパイクプロテインとLNPの血栓形成作用
がんはしばしば様々な機序で凝固の活性化を引き起こすため、がん患者における主要な死亡原因のひとつはがん関連血栓症(CAT)であり[49-51]、最も極端な形態では播種性血管内凝固(DIC)として現れる[52]。したがって、mRNA-LNPワクチンで認められた血栓形成傾向は、極めて危険であると考えるのが妥当である。SARS-CoV-2、特にオミクロン系統のウイルスおよびワクチンのS-タンパク質は、強固な電気陽性電位を持ち、赤血球(RBC)、他の血液細胞、内皮細胞の表面上の電気陰性糖鎖に結合する可能性がある[53]。SARS-CoV-2のSタンパク質は、アンジオテンシン変換酵素2(ACE2)と結合し、アンジオテンシンII受容体1型(AT1)シグナルを活性化することが報告されている。(AT1)シグナルを活性化し、インターロイキン-6(IL-6)トランスシグナルを促進し[54]、プロテインキナーゼの活性化を介して血管壁の肥厚を誘導し[55]、ミトコンドリア機能を障害し[56]、活性酸素種(ROS)を発生させる[57]。最近の研究で、Sタンパク質の特定のセグメントが、水に溶けない繊維状のタンパク質であるアミロイドの形成を誘導することが明らかになった。このタンパク質は血液凝固や線溶障害に重要な役割を果たしている[58]。 抗スパイクプロテイン抗体は、細胞表面に出現したSタンパク質に結合し、自己免疫炎症反応を誘発する[59-63]。さらに、LNPをマウスに注射すると強い炎症が起こることが報告されている[64]。 これらの所見から、COVID-19 mRNA-LNPワクチンは、がん患者において血栓症のリスクをもたらすことが示唆され、集団ワクチン接種後の過剰死亡を説明できるかもしれない。
がん免疫サーベイランスの抑制
がんの免疫監視に不可欠な役割を果たすI型インターフェロン(INF)応答が、SARS-CoV-2 mRNA-LNPワクチン接種後に抑制されることを示した研究もある[65,66]。大量のSタンパク質が翻訳された細胞からは、マイクロRNA(miRNA)-148aとmiRNA-590を含むエクソソームが大量に放出される、そしてそれぞれのmiRNAは、これらのエクソソームを内在化するミクログリアにおいて、ユビキチン特異的ペプチダーゼ33(USP33)-インターフェロン制御因子(IRF9)軸を抑制する[67]。総説の中で、Seneffらは、このことが、がん細胞に対する重要な因子であるI型IFNとBRCA2の機能を抑制すると説明している[26]。腫瘍微小環境におけるプログラム死リガンド1(PD-L1)/プログラム細胞死1(PD-1)の発現は、癌の免疫サーベイランスを深く抑制する[68]。ある研究では、Sタンパク質への暴露が、様々な免疫細胞や腫瘍細胞上のPD-L1やT細胞上のPD-1の表面発現を増加させ、CD4+やCD8+T細胞の癌細胞に対する活性を抑制することが示された[69]。別の研究では、非がん特異的IgG4が、がん特異的IgG1によって媒介される抗体エフェクター機能を阻害することを発見した。これは、非がん特異的IgG4の局所投与後に、移植された結腸直腸腫瘍、乳腺腫瘍、および発がん物質によって引き起こされた皮膚乳頭腫で観察された劇的な増殖促進によって証明されている[70]。すべてのがん、膵臓がん、リンパ腫におけるメタアナリシスによると、IgG4関連疾患(IgG4-RD)患者の一般集団に対する標準化発生率比(SIR)は、それぞれ2.57(95%CI:1.72,3.84)、4.07(1.04,15.92)、69.17(3.91,1,223.04)であった[71]。別の研究では、SARS-CoV-2 mRNAワクチン接種者の血清中の抗スパイクIgG4レベルは、2回目の接種後に上昇し、3回目の接種後にさらに上昇した[72]。IgG4に関する総説では、SARS-CoV-2 mRNAワクチンに見られるような、大量の特異的抗原への長期暴露が、IgG1やIgG3からIgG4へのクラススイッチを通じて、がん細胞の制御不能な増殖を引き起こす可能性について論じている。別の研究では、BNT162b2またはmRNA-1273の2回目の投与を受けたレシピエントの新鮮全血において、非特異的刺激によるIL-10放出が2週間以内に増加することが示された[74]。これらの所見は、すべての癌の過剰死亡、特に我々の研究における膵臓癌と乳癌の過剰死亡を説明するかもしれない。
SARS-CoV-2ワクチンは免疫抑制を引き起こし、場合によっては水痘帯状疱疹ウイルス(VZV、ヒトヘルペスウイルス3;HHV3)やヒトヘルペスウイルス8(HHV8)などの潜伏ウイルスの再活性化を引き起こすことが示されている[75,76]。HHV8は発がん性があると考えられており、カポジ肉腫を引き起こす可能性がある。口腔咽頭がんは、エブスタイン・バーウイルス(EBV、HHV4)またはヒトパピローマウイルス(HPV)によって引き起こされると報告されており[77]、これらもワクチン接種による免疫抑制の可能性によって再活性化される可能性がある。 これらの現象は、3回目以降の集団接種が行われていた2022年に、口唇・口腔・咽頭がんによる死亡が過剰になったことの説明にも役立つ可能性がある。
SARS-CoV-2 mRNAワクチンによるがん発症
われわれの研究では、卵巣がん、白血病、前立腺がん、口唇・口腔・咽頭がん、膵臓がん、乳がんのAMRが、特に2022年に、予測率を大幅に超えて増加した。これらのがんはすべて、エストロゲンおよびエストロゲン受容体α(ERα)感受性のがんとして知られている[78-83]。9,000以上のヒトタンパク質に対するSARS-CoV-2のSタンパク質の結合能に関するSolisらによる最近の研究で、Sタンパク質がERαに特異的に結合し、ERαの転写活性をアップレギュレートすることが示された。ヒト乳癌細胞にエストラジオール(E2)を添加すると癌細胞が増殖するが、選択的ERαモジュレーターであるラロキシフェンを添加すると増殖が抑制される。E2の代わりにSを添加すると乳癌細胞は増殖し、ラロキシフェンを添加すると増殖が抑制される。Solisらはまた、S-ERαの細胞質共局在の発見は、膜結合型ERαシグナル伝達の増強につながるかもしれないとも述べている[84]。膜結合型ERαは、細胞周期を促進し癌の発生に影響を与えるc-Mycの活性化を含む多くの経路に関与している[85]。
ERαが介在する転写は、ER感受性のがんにおいて内因性のDNA二本鎖切断(DSB)を誘発する可能性がある[86]。転写により活性化されたERαは、トポイソメラーゼIIや最近知られるようになったR-ループ/G-四重鎖構造形成によりDSBを誘導し、乳がん細胞におけるその修復のためにBRCA1の必要性を著しく増加させることが研究で示されている[87-89]。ある研究では、核局在シグナルを持つmRNAとSタンパク質の核内移行が示され[90]、in silicoバイオインフォマティクス解析では、Sタンパク質のS2サブユニットとBRCA1、BRCA2、P53との相互作用が示され[91]、その結果、それらの隔離と機能不全が生じた可能性がある。Sタンパク質と結合したERαを介して、活性化された転写によって引き起こされたDNA損傷を修復するBRCA1の高い要求性と、Sタンパク質によって隔離されたBRCA1の機能障害と併発している可能性があり、mRNA-LNP SARS-CoV-2ワクチン接種者のERα感受性細胞における発癌リスクの増大が懸念される。
上述したように、エクソソーム中の特定のmiRNAによる干渉を介したIRF9のダウンレギュレーション[26]や、ワクチン中のSタンパク質のS2サブユニットによる隔離の可能性を含むメカニズムを通じて、BRCA1だけでなく、重要ながん抑制遺伝子であるbrca2やP53の機能障害のリスクも大いに懸念されている[91]。BRCA1活性の低下は、女性では乳がん、子宮がん、卵巣がん、男性では前立腺がんのリスク上昇と関連し、男女ともに膵臓がんのリスクも中程度に上昇する[92]。BRCA2が関連するがんには、女性では乳がん、卵巣がん、男性では前立腺がん、乳がん、小児では急性骨髄性白血病がある[26]。 これらの所見は、われわれの結果と非常に一致している。
癌の発生に寄与すると思われるその他の要因についても研究が進められている。内因性の活性酸素は酸化的DNA損傷を引き起こすので[93]、S-protein[57]によるACE2のダウンレギュレーションに起因する過剰な酸化ストレスは、癌の発生に寄与する可能性がある。ある研究では、Mas受容体のダウンレギュレーションが上皮性卵巣がんの転移を促進することが示された[94]。mRNA-LNPワクチン接種後にS-proteinに結合したACE2受容体は、Mas受容体のダウンレギュレーションとその後の機能不全を直接引き起こし、おそらくワクチン接種を受けた卵巣がん女性における転移リスクの上昇につながる可能性がある。注射されたLNPが特に卵巣と骨髄に蓄積するという観察[38] は、2022年における卵巣がんと白血病による死亡率の超過というわれわれの所見をよりよく説明できるかもしれない。 頭頸部扁平上皮がん(HNSCC)における性ホルモン受容体に関する科学文献の分析によると、ERαはHNSCC、特に中咽頭がんの生物病理学において様々な役割を果たしている。これらには、DNAの超変異の促進、HPVの統合の促進、上皮成長因子受容体(EGFR)との協調などが含まれる[82]。このことは、本研究における口唇/口腔/咽頭がんの死亡率の増加を説明する可能性がある。
最近の研究では、SARS-CoV-2のRNAがDNAに逆転写され、試験管内試験でヒト細胞のゲノムに組み込まれることが示された[95]。別の研究では、BNT162b2に暴露されたヒト細胞内にトランスフェクトされたmRNAが、内在性のレトロトランスポゾンであるlong interspersed element-1(LINE-1)のサイレンシングを解除し、ワクチンmRNAの配列が核内のDNAに逆転写されることが報告されている[96]。細胞質にワクチンmRNAと逆転写されたDNA分子が蓄積されると、感受性の高い人において、慢性的な自己炎症、自己免疫、DNA損傷、がんリスクが引き起こされると予想される[97]。
米国食品医薬品局(FDA)は、感染症用ウイルスワクチン製造のためのガイダンスの中で、「残存DNAががん原性である可能性のあるメカニズムはいくつかあり、コード化されたがん遺伝子の統合と発現、あるいはDNA統合後の挿入突然変異誘発を含む」と述べている[98]。COVID-19のパンデミックの際、日本の特別緊急使用許可がFDAの承認に依存していたため、FDAのガイドラインは日本にとって不可欠である。最近、何人かの研究者が、ファイザー・BioNTechおよびモデルナのワクチンのいくつかのロットには、残留プラスミドベクター由来の二本鎖DNA断片が一定量含まれていることを報告している[100,101]。その中には、残存DNAの量がFDAが設定した残存DNAの規制値を超えていると述べたものもある。これらの報告とFDAの規制に関する声明を考慮すると、集団接種後に観察された過剰ながん死亡が、報告されたワクチン中の残留DNAと関連しているかどうかを判断するためには、さらなる調査が必要である。
制限事項
この研究は、公的な情報源からの記述統計を用いて行われたものであり、臨床的な検証は行われていない。ワクチン接種の有無によるさらなる分析統計の研究が必要である。
結論
日本人集団の3分の2がSARS-CoV-2 mRNA-LNPワクチンの3回目以降の接種を受けた後の2022年には、すべてのがん、およびいくつかの特定のがん、すなわち卵巣がん、白血病、前立腺がん、口唇・口腔・咽頭がん、膵臓がん、乳がんの年齢調整死亡率の統計学的に有意な増加が観察された。これらのERα感受性癌の死亡率が特に顕著に増加したのは、COVID-19感染そのものやロックダウンによる癌治療の減少ではなく、mRNA-LNPワクチン接種のいくつかのメカニズムに起因している可能性がある。 この可能性の重要性については、さらなる研究が必要である。
この論文は、2023年9月18日にZenodoリポジトリサーバーに投稿されたものです。