Contents
Estrogen, brain structure, and cognition in postmenopausal women
オンラインで2020年9月10日に公開
Christina P. Boyle, 1 , † Cyrus A. † Cyrus A. Raji, 2 , † Kirk I. Erickson, 3 Oscar L. Lopez, 4 James T. Becker, 3 , 4 , 5 H. Michael Gach, 6 Lewis H. Kuller, 7 William Longstreth, Jr, 8 Owen T. Carmichael, 9 Brandalyn C. Riedel, 1 , 10 and Paul M. Thompsoncorresponding author 1
概要
閉経前、閉経中、閉経後のエストロゲンレベルの低下は、記憶力やアルツハイマー病のリスクに影響を及ぼす可能性がある。ホルモンの変動による好ましくない副作用は、認知症の発症を遅らせるなどの効果が期待できるホルモン療法(ホルモン療法)の役割を強調しているが、知見は一致していない。ホルモン療法の効果は、脳内に存在するエストロゲン受容体が関与している可能性がある。また、その効果は、生活習慣、使用時期、遺伝的リスクなどにも依存すると考えられる。本研究では、認知機能に差のある高齢女性562名(71~94歳)を対象に、自己申告によるホルモン療法の使用が脳体積に及ぼす影響を、前述の要因を調整しながら検討した。16の予測因子を含むモデルを用いた共変調整済みのボクセル単位の線形回帰分析では、認知状態にかかわらず、ホルモン療法の使用は脳の局所体積と正の相関があることが示された。更年期障害、卵巣摘出、子宮摘出に関連する他の因子をモデルに加えると、それぞれ脳体積に正の効果があった。また、ホルモン療法xBMIという相互作用項を検討したところ、脳全体の体積と有意な負の相関が見られ、BMIのみの場合よりも脳体積の減少が大きいことが示唆された。ホルモン療法と脳の局所体積に関する主な結果は仮説通りであったが、いくつかの探索的な分析は既存の仮説と一致しなかった。研究によると、卵巣摘出や子宮摘出によるエストロゲンレベルの低下は脳容積にマイナスの影響を与え、ホルモン療法の追加はBMIと脳容積の関係をプラスに修正する。ホルモン療法の効果は評価する年齢層に依存する可能性があり、より広い年齢層を対象とした研究や無作為化デザインを行うことが望まれる。
キーワード アルツハイマー病、脳容積、ホルモン療法
概要
女性の更年期におけるエストロゲンレベルの低下は、記憶力やアルツハイマー病(AD)のリスクに影響を及ぼす可能性があり、ホルモン療法(ホルモン療法)の役割が強調されている。しかし、その効果は、生活習慣や心血管リスク、遺伝的体質、ホルモン療法を受ける時期や期間など、いくつかの要因によって異なる可能性がある。本研究では、認知機能が混在している高齢女性562名を対象に、自己申告によるホルモン療法を用いて、上記の要因を共分散させてこの仮説に取り組んだ。ボクセル単位の回帰では、認知状態にかかわらず、ホルモン療法の使用は高い脳体積と相関していた
1. 序論
2030年までに、世界の更年期および閉経後の女性の人口は12億人に増加し、毎年4700万人が新たに参入すると予測されている(Hill, 1996)。50歳を閉経の代用とすると、毎年約2,500万人の女性が閉経を迎えることになります(Hill, 1996)。更年期、閉経、閉経後のすべての時期は、多くの女性が更年期症状を治療するために共役馬エストロゲン(CEE)や他の形態の外因性ホルモン療法(ホルモン療法)の候補者と考えられてきた時期である。ホルモン療法は当初、閉経後の女性の心臓病、骨粗鬆症、認知症を予防する可能性があると考えられていた(Green & Simpkins, 2000; Mendelsohn, 2002)。CEEの処方は、大規模な多施設試験で効果が不明確であったり、有害な健康被害のリスクが増加するという否定的な報告がなされた後、急激に減少した(Kim er al 2005)。しかし、最近になって、ストレスの軽減、心血管の健康増進、認知機能の改善、認知症の発症の遅延など、ホルモン療法がもたらす可能性のある効果を再評価する研究が始まった(Herrera, Hodis, Mack, & Mather, 2017; Merlo, Spampinato, & Sortino, 2017; Speth, D’Ambra, Ji, & Sandberg, 2018)。
アルツハイマー病(AD)は、最も一般的な神経変性による認知症の原因であり、女性の性はADの重要な危険因子であり、特に閉経後、エストロゲンレベルが急激に低下します(Mosconi et al 2018,Riedel, Thompson, & Brinton, 2016)。エストラジオールは、閉経前に最も生理活性の高いエストロゲンであり(Fischer, Gleason, & Asthana, 2014)脳全体に見られるαおよびβ受容体に作用します(Barth, Villringer, & Sacher, 2015)(図1).1)。記憶は、エストロゲン受容体の相対的な発現がエストラジオールと相互作用することで影響を受けることを示唆する研究もある(Bean, Ianov, & Foster, 2014)。閉経後にエストラジオールやプロゲステロンなどの潜在的に有益なホルモンのレベルが低下することを考えると、ホルモン療法によってこれらのレベルを高めることが女性のADリスクを低減する可能性があるという一つの仮説がある。ホルモン療法の保護効果を最初に支持したのは、Kuopio Osteoporosis Risk Factor and Prevention studyなどの観察研究で、8,195人の女性を20年間追跡調査し、227例のADが発生した(Imtiaz er al)。) この研究では、長期的な閉経後のホルモン療法は、ADを含むあらゆる認知症診断のリスク低下と関連していた。このことは、女性をホルモン療法を受けるように無作為化し、認知症リスクに対するホルモン療法の効果を見いだせなかった前述の多施設共同試験とは対照的である(Grady et al 2002,Shumaker et al 2003,Shumaker et al 2004)。しかし、これらの効果は、ホルモン療法の使用期間やホルモン療法の開始時期が閉経に近いかどうかなど、リスクやベネフィットの量に影響を与える追加要因があるとして、最近再評価されている(Girard, Metereau, Thomas, er al 2017; Savolainen-Peltonen, Rahkola-Soisalo, Hoti, er al 2019)。
図1
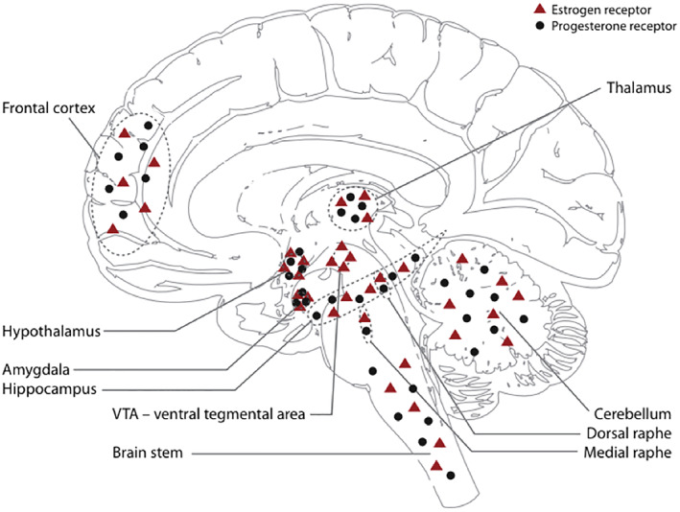
エストロゲン受容体は脳全体に存在し、小脳、腹側被蓋部(VTA)海馬、扁桃体、前頭皮質;および中脳の瀬状核に優位に存在している(Barth et al 2015)。扁桃体や視床下部などにはエストロゲンα受容体が集中しているのに対し、海馬ではエストロゲンβ受容体が優勢である。視床や小脳などの領域では、より均等に表現されている(Hedges, Ebner, Meisel, & Mermelstein, 2012; Osterlund & Hurd, 2001)。Julia Sacher博士の許可を得て引用している(Barth er al)。)
脳とADリスクに対するエストロゲンの影響が生物学的に複雑であることを考慮し、以下の仮説を検証した。エストロゲン使用歴が高齢女性に存在し保護的である場合、この変数はMRIを用いて測定されるより大きな脳体積と関連する可能性がある。この仮説に取り組むことは、ホルモン療法が脳の老化や認知機能にどのような影響を与えるかを理解するための重要なステップであり、おそらく臨床におけるADリスク低減のためのアプローチの動機となるだろう。
2. 研究方法
2.1. 参加者
Cardiovascular Health Study(CHS)は、65歳以上の人を対象とした冠状動脈性心臓病と脳卒中に関する多施設共同の住民ベースの縦断研究である(Fried er al)。) CHSの募集は、4つの地域のメディケア適格者リストに基づいて行われた。CHSの募集は、ノースカロライナ州フォーサイス郡、カリフォルニア州サクラメント郡、メリーランド州ワシントン郡、ペンシルバニア州ピッツバーグ(アレゲニー郡)の4つの地域のメディケア資格者リストに基づいて行われた。第一次評価では、研究のベースライン年(1989-1990)に5,201人の参加者が募集された。2回目の評価では、5年目(1992年~1993)に687人のアフリカ系アメリカ人が採用され、5,888人のコホートとなった。各施設の機関審査委員会は研究方法を承認し、すべての参加者は書面によるインフォームド・コンセントを得た。
参加者の属性を表11に示する。別の欄には,特定の変数について,一元配置のANOVA(連続)またはカイ二乗検定(カテゴリー)に基づいて,試験実施施設間で統計的に有意な差(p < 0.05)があるかどうかと,その効果の大きさを示した。また、民族、高校卒業、AD/MCIの診断、白質病変の重さで有意差が認められたように、社会経済的要因や健康関連要因の違いもサイト間の違いに含まれる。これらの要因が、研究間でのエストロゲン使用の有病率の違いに寄与している可能性がある(Council TWH, n.d.)。
表1 11年目(1998-1999)に使用可能なMRIを持っていたCHS記憶研究の女性参加者の特徴(CHSサイト別)
| ノースカロライナ州フォーサイス郡 | カリフォルニア州サクラメント郡 | メリーランド州ワシントン郡 | ペンシルベニア州アレゲニー郡 | 総サンプル | 調査サイトの差異 | |
|---|---|---|---|---|---|---|
| 分析されたMRIスキャンの数 | 7 | 185 | 108 | 262 | 562 | |
| 年齢 a |
82.4(2.6) |
79.7(4.2) | 78.9(4.0) | 79.2(4.3) | 79.4(4.2) | 2.24、0.08(0.01) |
| 民族性、白 b | 100(7) | 90.8(168) | 98.1(106) | 79(207) | 86.8(488) | 0.00(0.15) |
| >高校 b | 42.9(3) | 42.4(78) | 26.9(29) | 45.8(120) | 41.0(230) | 0.01(0.14) |
| ADまたはMCIの診断 b | 0(0) | 16.8(31) | 19.4(21) | 32.4(85) | 24.4(137) | 0.00(0.14) |
| 心臓病 b | 14.3(1) | 24.3(45) | 27.8(30) | 19.8(52) | 22.8(128) | 0.34(0.08) |
| 糖尿病 b | 0(0) | 5.5(10) | 12(13) | 11.1(29) | 9.3(52) | 0.12(0.10) |
| 高血圧 b | 42.9(3) | 51.9(96) | 50(54) | 50(131) | 50.5(284) | 0.95(0.03) |
| 白質病変≥3 B | 57.1(4) | 31.4(58) | 19.6(21) | 23.1(60) | 25.6(143) | 0.02(0.13) |
| ボディマス指数 a | 24.1(2.8) | 26.4(4.5) | 27.2(5.0) | 27.0(4.8) | 26.8(4.7) | 1.62、0.19(0.01) |
| 身体活動(ブロック/毎日) a | 40.0(45.9) | 33.5(56.8) | 27.4(53.7) | 29.1(38.7) | 30.3(48.3) | 0.51、0.67(0.00) |
| エストロゲン-(現在)、11年目、膣クリームを除く b | 42.9(3) | 26.4(48) | 10.5(11) | 15.2(38) | 18.4(100) | 0.00(0.18) |
| エストロゲン-(現在)、ベースライン、膣クリームを除く b | 28.6(2) | 24.9(43) | 5.6(6) | 10.9(24) | 14.8(75) | 0.00(0.22) |
| エストロゲン-(現在+過去)、6年目、膣クリームを除く b | 42.9(3) | 67(118) | 26.4(28) | 40.6(104) | 46.4(253) | 0.00(0.28) |
| プレマリン使用-(これまで)、ベースライン b | 42.9(3) | 51.6(82) | 19.6(20) | 36.8(78) | 38.1(183) | 0.00(0.24) |
| 閉経の年齢 A | 48.0(13.1) | 48.4(6.4) | 46.5(7.1) | 47.5(5.5) | 47.6(6.3) | 2.06、0.11(0.01) |
| 子宮摘出術 b | 42.9(3) | 40.8(69) | 37(40) | 38.8(85) | 39.2(197) | 0.93(0.03) |
| 卵巣摘出術 b | 33.3(2) | 30(48) | 27.6(29) | 26.8(55) | 28.2(134) | 0.91(0.03) |
| 民族性(DF = 9)と診断(DF = 6)を除くすべての人口統計について、自由度(DF)= 3。 | ||||||
aANOVA:1~4列目=平均値(SD),最後の列=F-stat,p値(部分的エタ二乗N p 2:0.01~sm,0.06~med,>0.14~lg)。
bChi-squared:1~4列目=Yes, %(n);最後の列=p値(Cramér’s phi φ c:0.1~sm, 0.3~med, 0.5~lg)。
バイアスの可能性を低減するために,サンプルサイズが小さい(N = 7)Forsyth Countyのコホートを除外し,人種が残りの参加者集団と異なる(白人でもアフリカ系アメリカ人でもない)2人の被験者を除外して感度分析を行った。有意性に影響はなく、これらの記録は全サンプルに残された。
対象となった562名のうち、528名のAPOE4遺伝子型が入手でき、そのうち143名(27.1%)が少なくとも1つのAPOE4ハプロタイプを保持していた(APOE4陽性)。このうち、10名はホモ接合、残りはヘテロ接合であった。APOE4遺伝子型を得るための完全な方法は、別のところで報告されている(Kuller et al 1998)。
2.2. CHS記憶研究
4年目(1991-1992)には、CHS登録者のうち3,608人がCHS記憶研究(CHS-MS)に参加し、全員が低解像度の脳MRI検査を受けた。研究の最終年である11年目(1998~1999)には、追跡調査の高解像度MRIスキャンと神経行動評価が、入手可能な存命中の参加者全員(n=2,101)に対して完了した(Kuller et al 2003;Riverol、Becker、Lopez et al 2015)。高解像度の3D T1強調表示のSPGR(Spoiled Gradient-Recalled Echo)MRIシーケンスがスキャンプロトコルに組み込まれるのが遅かったため、すべての参加者が高解像度の解剖学的画像を得られたわけではない。本研究では、品質管理基準を満たした高解像度のSPGR MRI検査を受けた562名の女性被験者(平均年齢:79.4±4.2歳、範囲:71~94歳)の脳MRIデータを解析した。
神経行動評価は、過去のCHS認知機能検査のスコア、主にModified Mini Mental State Examination (3MSE) (Teng & Chui, 1987)を入手した認知症の専門家で構成される裁定委員会が行った。また、CES-D(Center for Epidemiologic Studies Depression Scale)のスコア(Irwin, Artin, & Oxman, 1999)も入手した。参加者は、正常な認知状態、軽度認知障害(MCI)ADに分類され、MCIの特定のサブタイプはピッツバーグのセンターでのみ詳細に検討された(Lopez er al)。) 認知症の分類は、日常生活に影響を及ぼすほど重度の2つ以上の認知領域におけるパフォーマンスの低下と、認知異常が発生する前の正常な知的機能の履歴に基づいており、認知症の診断に記憶障害は必要なかった。また、委員会は、視力・聴力検査、アルコール摂取歴、日常生活動作質問票(Rosano et al, 2005)Informant Questionnaire on the Cognitive Decline of the Elderly (IQ-CODE) (Diesfeldt, 2007)、Dementia Questionnaire (Kawas, Segal, Stewart, Corrada, & Thal, 1994)、バイタルステータス、関連する場合は死亡日、入院歴、認知症治療のための薬剤、MRIスキャンの所見、神経心理学的評価の結果、病院の記録などのデータを検討した(Lopez, Jagust, DeKosky, et al 2003)。
2.3. ホルモン療法の評価
ホルモン療法は毎年評価され、現在および入手可能な場合は過去のエストロゲン使用を含み、「膣用クリームを除く。」この特定の種類の薬剤を除外する決定は、膣クリームは吸収が不規則なため、局所的な効果はあるが、全身的な効果はほとんどないという事実に基づいていた(Santen, Mirkin, Bernick, & Constantine, 2020)。さらに、これらのクリームの使用は一般的に断続的である。現在のエストロゲン使用者は、自己申告による過去の使用の有無にかかわらず、医療記録簿に記録された経口エストロゲンの処方箋を持つ女性と定義され、この情報はCHS調査の各年の時点でバイナリデータとして報告された。投与量は明らかにされなかった。過去のエストロゲン使用者とは、ほてりや更年期障害のその他の症状のためにプレマリンやその他のエストロゲンを服用したことがあると肯定的に答えた女性で、現在の処方箋を持っていない人を指す(Manolio et al 1993)。過去の使用状況は、4年目から6年目(1994-1996)のデータでのみ確認できた。プレマリンまたはCEEの過去および現在の使用については、ベースライン(1989-1990)でのみ報告され、エストロゲン使用と同様に収集された。
これらの分析では、11年目(1998-1999)に報告された非特異的なエストロゲンの使用を調べたが、これは高解像度MRIデータが取得された年と一致する。主解析の結果との整合性を考慮して、他の時点でのエストロゲン使用も評価した。これには、閉経年齢、子宮摘出、卵巣摘出などの他のの利用可能性に対応して、ベースライン(1989-1990)での現在のエストロゲン使用、6年目(1993-1994)での過去と現在の(組み合わせた)ホルモン療法使用、およびこれらのデータが利用可能な唯一のCHS研究の時点であるベースライン(1989-1990)でのプレマリン(これまで)またはCEEの使用が含まれた。
2.4. 構造的MRI
SPGR シーケンスを用いた脳の MRI は、1.5T スキャナーを用いて、4 つの施設で実施された(Bryan, Manolio, Scertz, er al)。) 11年目(1998-1999)に使用したスキャンプロトコルは、サジタルT1強調ローカライザーシーケンス、アキシャルT1強調プロトン密度、T2強調画像であった。軸方向の画像は5mmの厚さで、スライス間のギャップはなかった。小血管の虚血性疾患の画像上のマーカーである白質増感は,以前に説明したように,0(最も少ない)から10(最も多い)までの標準化された半定量的な10段階の白質等級(WMG)を用いて,視覚的に判定した(Longstreth er al)。,1996)。CHSの品質管理では,神経放射線科医によるスキャンの目視検査を行い,解析の妨げとなる大きな空間占有病変がないことを確認した(Bryanら,1997; Raji, Lopez, Kuller, Carmichael, & Becker, 2009)。また,テンソルベースモルフォメトリー(TBM)の画像処理において,スキャン視野からの脳組織の切り出しやMR画像の破損がないことを,独自に目視で確認した。脳画像の処理に用いたTBMの手法については,補足データS1
2.5. ボクセル単位の線形回帰
脳の各ボクセルにおいて,線形回帰モデル(Calabrese, Schneider, Paninski, et al 2011; Chu, Cui, & Dinov, 2009; Chu & Dinov, 2009)を当てはめて,脳の局所的な体積と関心のある特性,および脳の構造に影響を与えることが長期的に実証されているその他の要因との関係をモデル化した。分析の共変量には、今回分析したCHSコホートの男女混合スーパーセットにおいて、これらの変数と脳体積との間に有意な関係があることを確認した我々の過去の研究で定義・測定された体格指数(BMI)と身体活動が含まれている(Boyle er al)。) 我々の16の予測因子は以下の通りである。(1-3)データ取得部位(ダミー変数:x 1 , x 2 , x 3)(4)研究11年目の年齢(x 4)(5)民族性(白人vs. 非白人;x 5)(6)教育年数(≦/>高校;x 6)(7-8)臨床診断(ダミー変数。x 7 , x 8)(9)心疾患(x 9)(10)2型糖尿病(x 10)(11)高血圧(x 11)(12)白質病変(</≧WMG 3;x 12)(13)BMI9年目(x 13)(14)身体活動10年目(週単位の歩行ブロック;x 14)(15)APOE4状態(x 15)(16)エストロゲン使用11年目(x 16)。これらの共変量が、脳全体の体積の違いを予測することを、重回帰を用いて統計的に評価した。
ここで,yはボクセル単位の体積測定値,b oはy軸の切片,b kは各変数x k,iの回帰係数を表す。bは次式を用いて推定した。
ここで,B は b 係数の列ベクトルである。その後,ボクセルごとのモデルの寄与度と統計的有意性のパターンを可視化するために,パラメトリックマップと「p-value」マップを作成した。次に,偽陽性を抑制するために,脳全体のボクセルを対象とした多重比較のための標準的な偽発見率(FDR)補正を,従来から認められている偽陽性率5%(q = 0.05)を用いて実施した(Benjamini & Hochberg, 1995)。
この閾値を適用した後,オムニバスF統計を用いて,全体モデルが全分散の15%以上を占めている領域を特定することで,結果をさらに絞り込んだ。このようにして、回帰モデルが目的の形態学的指標の分散のかなりの割合を記述している脳領域に注目した。FSL Cluster (Jenkinson, Beckmann, Behrens, et al 2012) を用いて、Fマップで有意な領域のクラスタレベルの統計情報を取得した。次に,結果をレンダリングし,脳内の事前にラベル付けされた構造に対応する有意な領域を特定するために,地図をTalairachアトラスに合わせ,さらにMatlabで書かれたスクリプトを使用して,Montreal Neurological Institute(MNI)の座標をTalairachの座標に変換し,より正確な翻訳を行った。
モデル内の個々の変数についてStudent’s t-statisticalマップを作成し,多重比較を考慮してp = .05のFDRに対してp値のしきい値化(自由度n-k-1)も行った。全体のオムニバスF統計マスク内に含まれる有意なボクセルのみをさらに検討した。関心のある特性と有意に関連する脳領域は、ベータ回帰パラメータのt-マップを用いて視覚化し、各空間的位置における変化の方向(体積の拡大または縮小)を示した。
主解析に加えて、ベースライン(1989-1990)のエストロゲンを、閉経年齢、卵巣摘出および子宮摘出の有無、閉経年齢とホルモン療法開始年齢の差、すなわち「機会の窓」(Erickson, Voss, Prakash, Chaddock, & Kramer, 2010)など、ベースラインでしか得られない関連変数と合わせて検討した。
探索的分析では、すべての共変量を含むオリジナルの回帰モデルを使用したが、サンプルを認知状態によって、認知的に正常な被験者(n = 425)または認知的に障害のある被験者(MCIおよびAD; n = 137)のみに層別した。統計的な相互作用を伴う探索的な解析では、被験者全体を用いたが、元の回帰モデルに2つの目的の共変量を掛け合わせた項を追加した。特定の変数がエストロゲン使用と脳体積との関連性を緩和するかどうかを調べるために、現在のホルモン療法(11年目)を用いた相互作用項をモデル化した。また、年齢、BMI、糖尿病、高血圧、心臓病、白質等級、身体活動(身体活動)などが交絡因子として考えられた。
3. 結果
3.1. 脳構造への影響
16個の変数(上述)と562個の観測データがあれば、我々のモデルは、臨界オムニバスF閾値6.01,p < 2.85 × 10-12で有意であることがわかった。我々は、有意な関心領域のオムニバスFマップを提示し(Figure 図22参照)方向性に関係なく、その特定の変化領域(我々の15%閾値以上)の主要なクラスタと局所的な最大値を特定します(Table 表22参照)。
図2
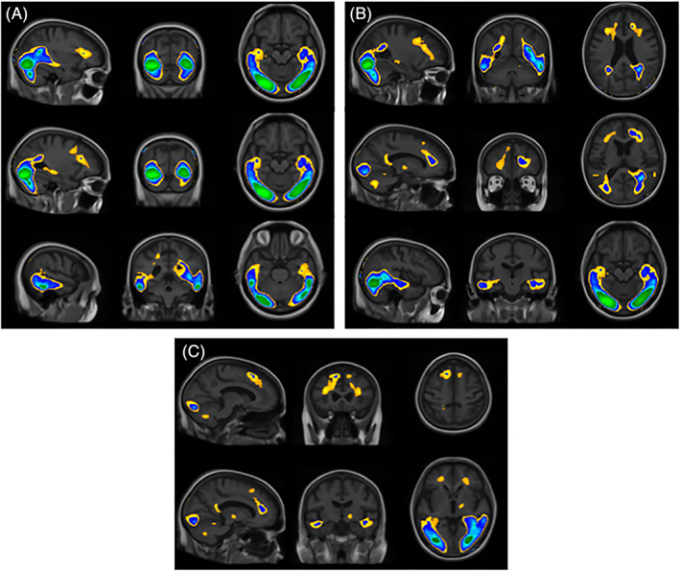
FSL-eyes可視化ツールを用いて可視化したオムニバスFマップは、我々のモデル全体が分散の15%以上を占めている地域を示している。有意なクラスターは、およそ15~25%の分散を示している。分散が25%以上の領域(パネルA;緑)20-25%の領域(パネルB;青)15-20%の領域(パネルC;黄)を中心に選択したスライス。ボクセルの主要なクラスター(最大強度[F値]と関連する座標を含む)はFSL Clusterを用いて特定し、地域領域はTalairach Daemon client(http://talairach.org/daemon.html)を用いて表表22のように定義した。
表2 Talairach Daemonクライアントを使用して定義されたクラスターと対応する地域領域は、Figure Figure22に示されたMNI空間に対応する
| パネル(図 。(図11)。 | クラスター内の優勢な領域 | F値(最大) | 分散への寄与 a | #ボクセル | ピーク位置(XYZ) | ||
|---|---|---|---|---|---|---|---|
| NS | 右後頭葉、下後頭葉、灰白質(両側性) | 22.5 | 35% | 11,068 | 27 | −87 | −14 |
| NS | 右側頭葉、紡錘状回、灰白質 | 15.3 | 27% | 249 | 49 | −48 | −19 |
| NS | 左小脳、後葉、塊茎 | 14.2 | 25% | 12 | −31 | −76 | −30 |
| NS | 右側頭葉、サブジャイラル、白質 | 11.2 | 21% | 121 | 24 | −58 | 21 |
| NS | 右側頭葉、紡錘状回、白質 | 10.7 | 20% | 26 | 46 | −34 | −17 |
| NS | 左辺縁葉、前帯状回、灰白質 | 10.6 | 20% | 4 | −16 | 37 | 17 |
| NS | 右前頭葉、上前頭回、白質 | 9.23 | 18% | 19,194 | 9 | 20 | 48 |
| NS | 左視床下核 | 8.23 | 16% | 485 | −14 | −17 | 2 |
注:X,Y,Z = MNI座標。
a有意なピーク領域について。
その結果、年齢や民族などの交絡因子を調整しても、我々の関心事である11年目(1998-1999)からのエストロゲン使用の有無が、脳全体の有意に高い体積(t[546] = 1.96, p = 0.05, r = 0.17)と関連していることがわかった(図3)3)。オムニバスFマップの統計的制約に限定すると、今回のサンプルでは、エストロゲンの使用に関連して灰白質や白質の体積が減少する有意な領域は見られなかった。
図3
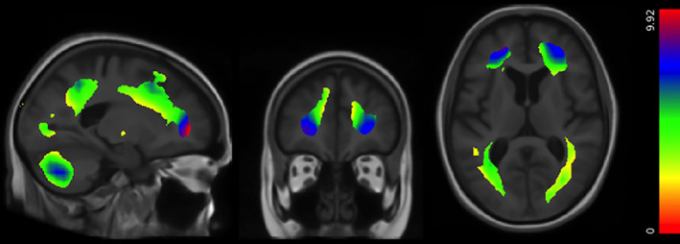
脳全体の3Dマップは、部位、年齢、性別、民族、教育水準、診断、BMIおよび様々な心血管疾患因子の影響を補正した後、より高い局所脳体積がエストロゲン使用(スキャン時に報告)と有意に関連する領域を示している(N = 562; t[546] = 1.96, p = 0.05, r = 0.17)。ベータマップは、多重比較のための標準的な補正後も有意であり、エストロゲン使用者と非使用者の各ボクセルにおける組織過剰の推定度合いをパーセンテージで表したものである。前頭葉には、エストロゲン使用者の方が相対的に10%以上高い領域があり、頭頂葉および後頭葉には、平均して5%に近い領域がある。
前述の理由により、結果の一貫性を保つために、他の利用可能なエストロゲン測定法を評価した。MRI前、ベースライン(1989-1990)および6年目(1993-1994)のエストロゲン使用量と脳体積を分析したところ、全脳において11年目(1998-1999,臨界p=0.008)と同様の結果が得られた(ベースライン、臨界p=0.005,6年目、臨界p=0.008)。特に、プレマリン(CEE)の過去および現在の使用は、全脳容積を有意に増加させるという点で一致していた(臨界p = 0.003)。
閉経年齢は、連続変数と二値変数(早期閉経と後期閉経)の両方で検討されたが、脳容積に対する独立した、統計的に検出可能な効果はなかった。また、「機会の窓」による脳体積への統計的に有意な影響も検出できなかった。両側卵巣摘出術と子宮摘出術の報告があった場合には、それぞれ脳室容積が減少し、頭頂部の脳容積が顕著に増加するという、脳容積に対するわずかに有意なプラスの効果が検出された(両側卵巣摘出術、臨界p=0.001,子宮摘出術、臨界p=0.002)。子宮摘出を行った1人を除いて、すべての研究参加者が両側卵巣摘出も行っていた。5年目(1992-1993)と6年目(1993-1994)にのみ得られたホルモン療法期間の効果を検出することはできなかった。
3.2. 探索的分析
認知機能が正常な女性参加者では、11年目(1998-1999)のエストロゲン使用の有無が脳構造の有意な予測因子として残っていた。エストロゲンとの正の関係は、脳全体で臨界p = 0.003となり、前頭葉(p = 0.004)および頭頂葉(p = 0.0002)領域で顕著な有意性を示した。認知機能障害者では、エストロゲンの使用は、脳容積との有意な関連性を維持し(脳全体で臨界p = 0.002)認知機能正常者の層と同様に前頭領域で顕著な有意性を示した。これらの結果は、エストロゲンの使用と脳体積との関連は、参加者が認知機能障害を持っているかどうかに左右されないことを示唆しており、我々の分析がそのような依存性を検出するには力不足であったことを裏付けている。このことを確認するために、エストロゲンの使用と診断の間の相互作用を正式に検証したところ、統計的に有意な結果は得られなかった。
BMIとエストロゲンの交互作用は、脳全体の体積、特に前頭葉で有意(臨界p = 0.0006)を示し、BMIの影響を受けない領域はBMIのみの場合よりも体積の減少が大きいという緩和効果が示唆された(図5)5)。他の相互作用は統計的に有意ではなく、エストロゲンの使用が脳構造に及ぼす影響は、身体活動を含む他の変数の関数としては有意に変化しないことが示された。身体活動の交互作用モデルでは、ホルモン療法の使用と身体活動の両方が独立して有意であり(ホルモン療法, critical p = 0.009; 身体活動, critical p = 0.0003, r = 0.17)各効果はFDR補正に耐えた。エストロゲンの使用に関連して相対的に体積が大きくなるパターンは、図図33と一致していた。ちなみに、オムニバスマップの統計的制約を受けて、身体活動と脳体積の有意性マップ(t[545] = 1.96, p = 0.05, r = 0.17)も掲載している(図4)4)。身体活動に関連して脳組織の体積が大きく、心室の体積が小さいというパターンは、以前に発表された研究で見られたものと一致した(Erickson er al)。)
図4
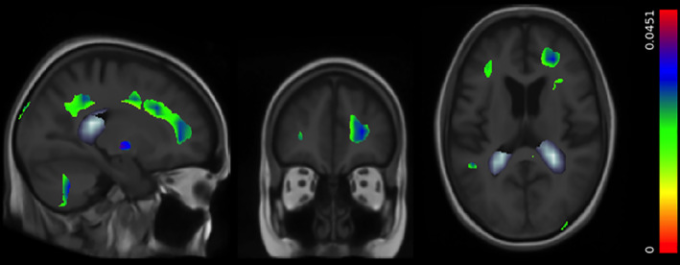
我々の探索的分析では、エストロゲン使用量を含むいくつかの関連因子を調整したにもかかわらず、身体活動効果の存続的な有意性が示された。脳の局所体積の増加は、身体活動と有意に関連していた(歩いた週ブロック数で報告、N = 562; t[546] = 1.96, p = 0.05, r = 0.17)。ベータマップは、多重比較のための標準的な補正後も有意であり、各ボクセルにおける組織過剰の推定度合いを、歩くブロック数が増えるごとにパーセンテージで表している。この図では、歩くブロック数が増えるごとに~0.05%まで広がる脳内の領域を示しており、平均的な効果は0.025%程度である。側脳室の後角に見られる白っぽい灰色の部分は、運動量の増加に伴う脳室の減少が見られる負の値を示しており、1週間歩くごとに約-0.1%となっている。
図5

我々の相互作用分析では、BMIとエストロゲン使用量の主効果を含むいくつかの要因をコントロールした後に、エストロゲン-BMI効果の有意性が示されている。エストロゲンとBMIの相互作用効果では、前頭葉の重なる領域でより大きな体積減少が見られた(左パネル、N = 533,FDR、臨界p = 0.0006)。ベータマップは、多重比較のための標準的な補正後も有意であり、各ボクセルにおける組織欠損の推定度合いを、BMI単独およびホルモン療法使用と組み合わせた場合の単位増加あたりのパーセンテージで表している。脳全体の効果は、BMIの主効果では-1.5%まで広がり、平均効果は~-0.5%であった。ホルモン療法との併用では、前頭部領域の効果が平均-1~-1.5%となった。注:ここで示したベータマップは、モデル全体の有意性による統計的制約を受けていない。
最近の研究(de Lange, Barth, Kaufmann, et al 2019)を踏まえて、APOE4と脳体積との関係、およびエストロゲンの脳への影響のモデレーターとしての役割の可能性について検討した。事前に定義したモデルとボクセルごとの回帰を用いて、APOE4陽性の状態だけで、共変量を調整した後の心室の体積(FDR; critical p < .05)のわずかに有意な増加、すなわち心室の膨張と関連していた。しかし、最近報告されたホルモン療法使用とAPOE4の脳体積に対する相互作用を確認することはできなかった(de Lange et al 2019)。
最後に、事後検定として、媒介効果の検定を行ったが、心臓病、高血圧、BMI、身体活動については、ホルモン療法と脳体積の関係に寄与する有意な媒介は検出されなかった。
4. 考察
本論文の主な発見は、大規模な高齢女性コホートにおけるエストロゲン使用歴が、前頭葉、側頭葉、頭頂葉などの認知機能に関連する脳領域の灰白質および白質体積の増加と関連していたことである。これらの所見は、エストロゲン使用歴の時期、心血管リスク因子、遺伝的構成、身体活動(Erickson、Raji et al 2010)や肥満(Raji et al 2010)などの既往のライフスタイル因子にかかわらず、統計的に有意であった。
これらの結果は、エストロゲンと脳構造との関係を示す先行研究の多くと比較して、比較的大きな女性グループから得られたものである。今回の結果と同様に、閉経後の健康な女性40名を対象とした研究では、17名がエストロゲンを使用しているか使用歴があったが、海馬を含む前頭葉、側頭葉、頭頂葉の構造的MRIにおいて、ボクセルベースモルフォメトリーによる灰白質体積の増加が認められた(Boccardi er al)。) 46人の被験者(性差による影響を調べるために男性15人、治療による影響を調べるために健康な閉経後の女性31人)を対象とした研究では、エストロゲンの使用量が増えると、前頭葉の灰白質体積は大きくなるが、海馬は萎縮することが示されたが、これは今回の結果と一致しない(Lord, Engert, Lupien, & Pruessner, 2010)。我々の結果と一致する先行研究としては、エストロゲン補充療法を受けている、または受けたことのある30人の女性を対象とした研究がある。この研究では、エストロゲンの使用と使用期間の長さの両方が、エストロゲンの使用歴のない女性と比較して、前頭葉、側頭葉、頭頂葉の灰白質体積の増加と相関していた(Erickson er al)。) より最近の研究では、複雑な結果が示されている。UK Biobankの16,000人の女性を対象とした大規模コホートでは、機械学習を用いて、「脳年齢」(MRIから得られる脳の老化の複合指標)と外因性エストロゲンの使用、すなわちホルモン療法の使用との間に関連性があることが示され、ホルモン補充療法の早期開始がAPOE e4キャリアのみで明らかな脳の老化が少ないことと関連していた(de Lange er al 2019)。今回も、APOE4陽性の状態が、ホルモン療法の脳への影響に対するポジティブなモデレーターとして機能することを示すことで、この知見を裏付けることはできなかった。我々の分析は、両方の形質を持つ被験者が少なかったため、力不足であったと考えられる。
ホルモン療法はいくつかの経路を介して脳の構造に影響を与える可能性がある。1つの可能なメカニズムは、エストロゲン受容体の発現における遺伝的または他の自然発生的な変化によるものである。外因性エストロゲンへの継続的な暴露は、エストロゲン受容体の発現を促進し続けるかもしれない。まだ発見されていないものも含めて、遺伝的な変異が、女性の脳に対するエストロゲンのさまざまな影響を媒介しているのかもしれない。さらに、もう一つの重要な要因は、エストロゲンを使用するタイミングと期間である。過去に行われた複数の動物実験を検討した結果、脳の構造と機能を維持するためにエストロゲンの使用が有益となる重要な時期があることが示唆された(Daniel, 2013)。正常な内因性ホルモンの機能が停止する時期にエストロゲンを投与すると、脳の健康に最大限の効果があった。一方、内因性エストロゲンの産生から外因性投与までの時間が長すぎる場合、エストロゲンの脳に対する有益な効果は認められなかった。このような間隔が人間の集団にどのように反映されるのか、また、どのような遺伝的または環境的要因がそのような間隔を調節するのかについては、不確実性が残っている(Wang, Mishra, & Brinton, 2020)。今回の研究では、このような間隔の有意な影響を検出することができなかった。これは、ベースライン(1989~1990)でのデータが限られており、11年目(1998~1999)に得られた高解像度MRIデータに近接していないことに起因すると考えられる。
エストロゲンの使用期間については、認知機能の向上(Erickson et al 2007)から神経変性疾患のリスク増加(Kang, Weuve, & Grodstein, 2004)まで、さまざまな研究で矛盾が指摘されており、関心を集めている。また、データが限られていることや、高解像度のMRIに比べてデータ収集のタイミングが悪かったこともあり、使用期間に特有の効果を検出することはできなかった。別の小規模な研究では、長期使用(10年以上)で効果が薄れることを発見し、フィットネスレベルが高ければ、ホルモン治療の期間が短くてもプラスの効果が得られ、ホルモン治療の長期化に伴う衰えが改善されると報告している(Erickson er al)。) この結果は、エストロゲンが身体活動やBMIなどのライフスタイル因子と相互作用することを裏付けている。我々の分析では、ホルモン療法xBMIという相互作用項との関連が示されており、相互作用の効果により、どちらかの変数を単独で使用した場合よりもボリュームの減少が大きくなることが示唆された。脳の孤立した前頭葉領域では、ホルモン療法の存在がBMIの脳体積への負の影響を悪化させるか、BMIの存在がホルモン療法の脳への正の影響を否定するように見えた。これはいくつかの研究と矛盾するが(Zsido et al 2019年)高BMIに加えてホルモン療法に存在する過剰なエストロゲンは、脳の健康を含む健康全般(Cleary & Grossman 2009)(乳がんなど)への悪影響に寄与している可能性がある。我々のモデルでは、年齢、糖尿病、高血圧、心臓病、白質等級、身体活動(身体活動)など、他の統計的に有意な相互作用は確認できなかった。しかし、エストロゲンと身体活動の相互作用を調べたところ、統計モデルではエストロゲンと身体活動の両方が存続しており、脳の構造との独自の独立した関係が強化されていた。今回のコホートは年齢層が高く、加齢による著しい萎縮と、加齢に伴う合併症の増加が見られた。これらの混同は、エストロゲンが脳に及ぼす様々な影響の重要な要因となる可能性がある(Wnuk, Korol, & Erickson, 2012)。
動物実験では、エストラジオールが海馬の機能維持に最も関連するエストロゲンであることが示唆されている(Vedder, Bredemann, & McMahon, 2014)。他の研究では、循環エストロゲンはこれまで考えられていたほど重要ではなく、閉経後は脳内の局所的なエストロゲン合成と活動が循環エストロゲンからますます独立することが示唆されている(Li, Cui, & Shen, 2014)。この観察結果は、脳容積に対する早期閉経の影響を見いだせなかったことを裏付けているかもしれない。しかし、卵巣摘出と子宮摘出の有無については、それぞれ独立してモデルに加えたところ、関連性が認められた。それぞれの変数は、脳室容積の減少を含め、脳容積に有意な正の効果を示した。これらの知見は、内因性エストロゲンの減少(Rocca, Grossardt, & Shuster, 2010)が脳に悪影響を及ぼすとする研究と矛盾しているように見えるかもしれない。しかし、この種の手術は、高齢になってから行っても認知機能に悪影響を及ぼさず、むしろ有益であることが一般的に指摘されている(Koebele er al)。) ADのマウスモデルでは、エストロゲン合成の重要な酵素であるアロマターゼの活性低下がADの病理の増加に関係していた(Li et al 2014)。また、エストロゲンは、エストロゲン療法を継続するように無作為化された女性では、エストロゲン療法を中止するように無作為化された女性と比較して、2年間という長期間にわたって適切なグルコース代謝を維持することによって、脳構造を保護または維持するように作用する可能性がある(Rasgon et al 2014)。このように、エストロゲンが脳に及ぼす最終的な影響は、複雑な生化学的プロセスの合流点であり、その中で循環エストロゲンは1つの要因にすぎない。エストロゲンと脳の関連性は、認知状態の機能としては変化しなかった。我々の知る限り、正常な認知状態とMCIからADの範囲の両方で、脳構造に対するエストロゲン使用の履歴を同時に評価した先行研究はない。
本研究の主な強みは、サンプルサイズが大きいこと、高解像度の構造画像、多変量解析の手法である。しかし、この研究の複雑さを考慮すると、結果の解釈には注意が必要である。過去のエストロゲン使用は自己申告によってよく特徴づけられたが、今後の研究では、遺伝的、酵素的、および定量的な循環ホルモン変数の知識を用いて、エストロゲンとその脳構造との関連を分類することが理想的である。今回の研究ではそのようなデータは得られなかったので、結果は慎重に解釈しなければならない。この研究のもう一つの問題は、エストロゲンの使用とエストロゲン・プロゲスチンの併用に強い選択バイアスがかかっていることである。観察研究と臨床試験の違いは、このことに起因しているかもしれない。また、経口エストロゲンは脳卒中のリスクを高め、脳血管障害にも悪影響を及ぼす可能性がある。高血圧、静脈血管疾患、一過性脳虚血発作(TIA)を発症した女性は、CHSに参加する前にエストロゲンまたはエストロゲン・プロゲスチン併用療法を中止した可能性が高い。それでも、エストロゲンがヒトの認知やADリスクに関与していることを裏付ける研究は他にもあり、そのような影響は今回示されたように脳構造への影響によって媒介される。エストロゲンがADのリスクにどのように影響するかを理解するには、無作為化デザインによる追加研究が必要である。同様の結論は、画期的でありながら議論を呼んだWomen’s Health Initiativeの結果に基づいて示唆された(Harman, Naftolin, Brinton, er al)。) このように複雑な問題を抱えているにもかかわらず、エストロゲンの脳への影響をより深く理解するための今後の研究は、健康的な脳の加齢とAD予防のための新たな手がかりを提供するかもしれない。
