コンテンツ
- 要旨
- 1. はじめに
- 2. ALSと難治性神経疾患
- 3. ALSおよび神経変性のための抗生物質、共生薬および化学療法薬
- 4. ALSに対する抗生薬物使用の歴史
- 5. 抗生物質の作用機序
- 6. ALSの発症メカニズム
- 7. ALSにおける酸化ストレス、興奮毒性、炎症
- 8. 酸化ストレス誘発神経変性におけるミトコンドリアの関与
- 9. 農薬と毒性のある興奮性および中枢神経系を損傷する化合物
- 10. 代替薬、化合物および抗生物質がALSを助けるかもしれない
- 11. 抗生物質の興奮剤、タイミングと代替メカニズム
- 12. ALSをはじめとする神経変性疾患におけるミクログリアとアストロサイトの活性化
- 13. ALSに関与する神経栄養因子およびその他の因子
- 14. 神経変性とALSに対抗する工学的アプローチ
- 15. 結論
The Role of the Microbiota–Gut–Brain Axis and Antibiotics in ALS and Neurodegenerative Diseases
オンラインで公開2020年5月23日
要旨
ヒトの腸には、消化管と大腸の壁に並ぶ微生物の生態系(マイクロバイオータ)と呼ばれる多種多様な微生物が生息しており、消化性食物と難消化性食物の共代謝を行い、多様な生物学的機能を持つ多くの生化学的化合物を提供している。腸内微生物が神経学的プロセスに及ぼす影響は、まだほとんど解明されていない。しかし、いわゆるリーキーガット、リーキーブレイン症候群に関する最近のデータは、腸内微生物叢、炎症、宿主の共代謝との間に潜在的な関連性があることを示唆しており、微生物が発見された部位から局所的にも遠方的にも神経病理学に影響を及ぼす可能性がある。本原稿の焦点は、神経変性疾患、その治療、診断、管理における腸内細菌叢-腸-脳(MGB)軸、抗生物質、「BUGS AS DRUGS」の使用との関連を描き、アルツハイマー病、筋萎縮性側索硬化症(ALS)気分障害、統合失調症、自閉症スペクトラム障害などの脳・神経疾患に対する代替作用機序について、現在と過去の医薬品と抗生物質の効果を比較することである。これらの疾患は、微生物相の未知の側面が大きく影響していることを示唆するパラダイムシフトである。したがって、トランスレーショナルで個別化された医療成果を向上させるために、微生物、化学生物学的、化学療法的アプローチを適用する未来が存在する。特にCRISPR技術や組換えDNA技術などの微生物修飾アプリケーションは、腸内マイクロバイオータ(GM)やマイコバイオータが関与するパラダイムシフトのテーマを反映しており、難治性の神経疾患に対する腸主導の治療法の可能性につながると考えられる。
キーワード
筋萎縮性側索硬化症、ALS、ケモバイオティクス、プロバイオティクス、シンバイオティクス、神経変性、アルツハイマー病、アルツハイマー病、ホロビオータ、ホロバイオーム、マイクロバイオータ、マイクロバイオーム、マイクロバイオータ-腸-脳軸、セフトリアキソン
1. はじめに
ヒトの “マイクロバイオータ “またはより斬新な名前 “ホロバイオータ “は、微生物、マイコバイオータ、寄生虫、病原体、常在菌、ウイルス、ビロイド、寄生原虫、それらの個々のおよび集団ゲノム、コード化および非コード化核酸、および人間の腸内または他の場所に住んでいるこれらの外因性微生物のいずれかの間の共同代謝の全体と多様なコレクションを構成すると考えられている。微生物相は、病気を引き起こす生物と病気を予防する生物の両方を含んでおり、パブリックドメイン、すなわち、私たちの集合的な腸のすべてにある間、微生物は、政府の規制当局によって薬物とみなされ、それらが実際になる可能性がある有望なプロバイオティクスではない。彼らは “薬としてのバグ “または私たちの消化器系の無害な共生体であるかどうか、彼らは理解し、標準的な医学と現代の実践に知られている最もとらえどころのない病気をリンクすることによって、私たちの健康と病気の傾向を操作するための鍵を握っている腸内細菌のプロファイルに。これは、難治性疾患、特に神経変性疾患のための変革的な概念である。
ホロバイオームに関しては、重要な環境因子である腸内細菌が症状に影響を与えるという報告が増えており、最小の割合、すなわち1%を占める割合が病気に不釣り合いに大きな影響を与えることが報告されている[1]。最近の研究では、特にアルツハイマー病、多発性硬化症、パーキンソン病、筋萎縮性側索硬化症などの神経変性疾患では、特定のマイクロバイオームプロファイルを持っているか、または選択された微生物の間に格差があることが明らかになっていた。多くの治療法が提案されているのは、糞便移植、抗生物質、または精神生物学的製剤の投与により、正常な腸内細菌叢を回復させるという考えに基づいている。抗生物質がこれらの相関関係において果たす役割は、神経学的研究において最近注目されている。腸の完全性が損なわれ、腸のホメオスタシスが低下していることが、ALSやその他の神経疾患では、標準治療が最も困難な疾患に積極的な役割を果たしているのではないかという仮説が立てられている。これは、人間の生理が第二のゲノムを軽視していることと、微生物が生化学に貢献していることが一因ではないかと推測している。
神経変性疾患は、中枢神経系や脳の異なる部位で発生する神経細胞、神経細胞の構造、細胞機能の低下が進行することを特徴とする多様な疾患である。中でも、最も一般的な神経変性疾患であるアルツハイマー病は、特に壊滅的な症状を呈する。多くの神経変性疾患と同様に、進行性であり、人間の本質を奪う性質を持ち、認知能力の低下をもたらし、認知症の多面性を伴い、最終的には死に至る。アルツハイマー病の発症メカニズムはまだ解明されていないが、新たな傾向として、ウイルスとGMが疾患発症の主役であることが指摘されている。特定の微生物の範囲を殺すために使用される広範な抗生物質の乱用に反して、プロバイオティクス、およびそれらの微生物は、まだ開発されたか、または人間への使用のために承認されていない、薬と考えることができる -aptly「薬としてのバグ」と見なされる。特定の菌株を含むプロバイオティクスは、ほとんどの人の腸内に存在していても、治療効果があるように設計されており、ヒトへの使用には安全性の要素を持っている。
健康な消化管内の常在菌の主要な機能は、我々が植民地化抵抗性と呼んでいる、内部に含まれる潜在的に病原性のある微生物の植民地化と増殖に抵抗することである[3]。プロバイオティクスの安全な使用は、重く私たちの内因性微生物は、特に神経疾患に関連して、個人の健康に大きな役割を果たす方法を示す様々な研究によってサポートされている。新しい研究では、微生物の特定の株は、プロバイオティクスや共生体として機能するときに、肯定的な結果を示すことができることを示している。最近の動物実験では、乳酸菌またはビフィズス菌は、プロバイオティクスの能力を調査するために採用されており、神経学的および他の疾患の治療にいくつかの有効性を示している[4]。これらの菌株は、脳の記憶形成領域で脳のシグナル伝達に関連するγ-アミノ酪酸(GABA)とグルタミン酸の産生を調節することが示されている[5]。微生物とGABA阻害性神経伝達物質は精神神経疾患で役割を果たし、不安や抑うつにつながる可能性がある[5]。パーキンソン病(PD)やアルツハイマー病の治療や予防のためのプロバイオティクスの使用は、まだほとんど解明されていない。しかし、プロバイオティクスが保護的な低分子産生を介して、炎症反応の調節を介して、アルツハイマー病とパーキンソン病に有益な効果をもたらすことは非常に信憑性が高い[6]。
脆弱なニューロンへの攻撃は頻繁に起こり、その後の炎症は創傷治癒反応の一部である。しかしながら、サイトカインストレスは損傷に寄与する。これらのプロ炎症性免疫応答は、ナチュラルキラー細胞の循環と免疫応答機構の改変に関連しており、特定のサイトカイン産生につながり、プロバイオティクスはマクロファージ、顆粒球、T細胞の免疫細胞バランスを改善する[4]。病原性細菌は、例えばリポ多糖(LPS)を産生するプロ炎症性成分やGMの変動を産生し、これが全身の炎症を助長し、LPS負荷の増加をもたらす。LPSが免疫障壁を越えて炎症を引き起こすことが知られている[7]が、これはまた、我々の免疫特権障壁の伝染性の増加を促進する。広範な生物学的異常は、アルツハイマー病やパーキンソン病などの神経変性疾患の特徴であるが、それにもかかわらず、過剰に成長した集団は、腸の炎症を引き起こし、腸の伝染性の増加につながるALSのMGB軸を横断する病原性に大きく寄与している可能性がある[8]。特にグラム陰性菌は細胞膜を持っており、その一部は内毒素性LPSで構成されており、腸管細胞と相互作用して炎症性サイトカインの放出を引き起こす。このカスケードはまた、脳内に酸化状態を作り出し、神経変性を進行させる[9]。後ほど詳しく説明するが、脳の免疫細胞であるミクログリアもLPSによって活性化され、アストロサイトの変換に関与し、炎症性分子を放出することでサイトカインストレスに寄与する[10,11]。
これらの保護システムは、網膜内の神経細胞構造に沿って移動し、免疫モニタリングから逃れることが発見されたエボラウイルスのように、免疫上の特権を示す多くの病原体によって回避され、回避されることがある。同様に、細菌、スピロヘータおよび他の病原体は、感染に対する完全な免疫応答が敏感な脳および眼球組織に有害であると考えられるため、脳、脊髄および眼のこの同じ脆弱性を悪用することができる。もう一つの例は、ライム神経胆汁症の原因となるスピロケテット・ボレルリア・ブルグドルフェリである。これは目だけでなく神経系をも攻撃し、パーキンソン病に似た症状、すなわち混乱や認知障害をまねくことがある。さらにもう一つの犯罪者は、ムコ多糖類、カルシウム(Ca2+)細胞外DNAからなるバイオフィルムとして知られる表面に付着する複雑な構造体で、細菌が免疫系から逃れるのを助けると疑われている[12]。そこで、細菌の個体数を特異的に調節し、過剰成長を最小限に抑え、エンドトキシン性や興奮性の細菌株を減少させるか、あるいはプロバイオティクスを保護して増殖させることができるかどうかは、非常に興味深いことである。プロバイオティクスは、神経変性および神経保護に寄与するであろう代謝物合成に寄与するであろうそれらの病原性細菌に対するコロニー化抵抗性を提供する。
細菌成分の転座および我々の免疫障壁の細菌の逆行のために多くの例が存在する。このレビューでは特に取り上げていないが、神経変性疾患患者の脳内に見られる口腔内細菌、Porphyromonas gingivalisは、脳のコンパートメントにアクセスすることができ、直接感染、単球や内皮細胞への感染、血液脳関門(BBB)を損傷した後の感染、または嗅覚神経や三叉神経を介して広がる感染を含むいくつかの経路を介して伝播する [13,14,15]。神経変性の病因にかかわらず、このような例は、神経疾患は多因子性であるが、神経疾患は私たちの微生物叢[14]と腸-血液、BBBおよびおそらく他の免疫特権障壁[13]の完全性との関係を持っているという結論を導く。その点で、最近の証拠は、マイクロバイオータが分子模倣経路を介してアルツハイマー病、PDおよびALSの病因に影響を与えている可能性があることを示唆している。例えば、ペプチドグリカン認識タンパク質遺伝子PGLYRPは、障害または変異した場合、パーキンソン病と関連している。パーキンソン病におけるこの遺伝子は、Prevotellaceaeの低いレベルおよびグラム陰性菌Enterobacterialesの高いレベルと相関しており、これは典型的なEnterococci sp.のレベルを超えた腸内菌共生バランス失調を示している可能性がある[16]。本研究の著者らは、動物プロバイオティクスモデルとして、これらの細菌種を首尾よく使用し、腸の機能不全を再現し、病気の進行を刺激した。例として、いくつかの細胞内原虫寄生虫は、具体的にはBBBを渡り、脳、髄膜と中枢神経系(CNS)[14]の慢性炎症を促進することにより、神経学的機能障害や脳炎を引き起こすトキソプラズマゴンディ、アルツハイマー病に関与している。
神経変性疾患に対するプロバイオティクスの治療応用の有用性に関する正当な主張をするためには、この分野ではまだ多くの情報が不足しているか、または未開発であるため、より大規模なヒト研究が必要である。それにもかかわらず、今日までに、すべてではないにしても、ほとんどの場合、利用可能な治療法や有効な疾患修飾剤はない、神経変性疾患と治療は、主に緩和的または対症療法に焦点を当てている[17]。神経変性の病態についてわかっていることは、アルツハイマー病を含むがこれに限定されない神経変性疾患は、酸化ストレス、神経炎症、アミロイドβ(アミロイドβ)プラークまたは神経原線維の蓄積と特徴を共有し、強く相関しているということである[18]。これらの特徴的な末期病変は神経変性疾患と関連しているが、これらの病変を標的とした治療、すなわちヒトの脳から病変を除去する努力は、治療には至らず、疾患の進行を遅らせることさえできなかった。当時、著者らは、脳の炎症は非常に敏感で脆弱な神経細胞にとって極めて有害であるため、特に脳内の内因性タンパク質に対する抗体を作成する努力に注意を促していた[19]。同時に、アミロイドβを除去するために作られたそれらの創業企業のほとんどが失敗している。アミロイド仮説やタウ仮説に続いて数十億ドルが費やされたことを考えると、病変を標的とした研究であって、前駆的なメカニズムを標的とした研究ではなかったと主張する人もいるかもしれない。科学を非難することはできないが、代替案を見ることができなかったり、自分たちとは異なる仮説を考えることができなかったりする人たちは、本当に科学に従事しているのではなく、大部分がお金を追いかけているだけだと主張することができる。そこで私たちは、新しい発見や他の有望なアプローチに目を向けていた。これらは表面上では遠距離的に関連しているように見えるが、実際には、ミトコンドリア、血管などを含めて、それらの病態に微生物の構成要素を共有している[20,21]。より有望なアプローチの一つは、微生物-腸-脳軸と交差する神経変性疾患とその根底を探ることである。これは、疾患メカニズムの理解を助ける可能性が高く、これらの壊滅的な疾患に対する新たなケアや治療の標準となりうる共生的なコンビナトリアルアプローチを示唆するものである[22,23]。
重要なことに、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症のような最悪の神経変性疾患の多くは、以前に考えられていたよりもGMとの緊密な関連を保持している[22]。私たちは、必要に応じて抗生物質や抑制性化学物質の選択的、適切、管理された責任ある使用を含む栄養や他の介入を介して、私たちのマイクロバイオータとのこれらの関係と健康的な保護同種形態の伝播を探求することが急務となっている。さらに、私たちの免疫組織のバリアは、設計上、脆弱な臓器や組織の適切な恒常性を維持し、異物が全身循環系に侵入するのを防いでいる。これらのバリアは、かつて私たちが理解していたか、あるいは従来のドグマ[13]で信じられていた以上に損なわれている可能性がある。腸管バリアの完全性に対する酪酸レベルの役割を調査している最近のマウスの研究で明らかになったように、腸内マイクロバイオータによって産生される低分子についても考慮すべきである。酪酸の増加は、バリアの恒常性を高め、寿命を延ばすことと関連している。ALS治療薬トリヘプタノインは、ALSのマウスモデルにおいて運動ニューロンを保護し、運動症状の発症を遅らせることが明らかになったが、血漿中のβ-ヒドロキシ酪酸のレベルも1.7倍に増加した[24]。別の例として、酪酸塩の導入は、酪酸塩のような細菌株、例えば、Butyrivibrio、Bacteroides、Odoribacterなどの成長を刺激すると考えられており[25]、693Aマウスを用いた研究では、水中の2%の酪酸塩が寿命を改善することが判明した。微生物発酵の副産物は短鎖脂肪酸(SCFA)特にアセテート、プロピオン酸、酪酸である[26]。共生の一部として、プレバイオティクスは相乗的に作用して大腸・腸内微生物叢を修飾し、人間の健康に利益をもたらす[27]。さらに、本レビューの著者は、Faecalibacterium prausnitziiとジャガイモのデンプンプレバイオティクスからの酪酸のClostridium difficile感染に対する保護的側面とその後のダメージの減衰を発見した[28,29]。
2. ALSと難治性神経疾患
難治性疾患、特に神経変性疾患は特に成功の障害となっており、1990年から 2015年の間に神経疾患全体の死亡率が実際に37%増加しているため、私たちはこれらの疾患にうまく対処できていない[30]。特に難治性の神経疾患の1つは、筋萎縮性側索硬化症である。ALSは、より一般的にはルー・ゲーリック病と呼ばれ、誰がこの病気を患ったのか、なぜアポストロフィー化したのか、という点で、非常に致死的な神経変性疾患であり、細胞死が随意筋や不随意筋の活動の喪失につながる運動ニューロンの病気である。
ALSは急速に進行し、上下の運動ニューロンに影響を与え、神経細胞の損失、変性、損傷をもたらし、脳、脊髄、運動ニューロンの神経細胞の破壊につながる。この進行性障害は、運動ニューロン疾患と呼ばれる神経学的疾患のサブグループに属し、最終的には患者を衰弱または悪化させる。関連する細胞死は、自発的および不随意の筋活動の喪失をもたらす。共通の症状としては、筋力低下、けいれん、協調性の問題、筋肉のこわばり、筋肉の痙攣、筋肉の痙攣などがある。中枢神経系の神経細胞が徐々に劣化することで、筋機能が低下し、随意筋と不随意筋の両方に麻痺が生じる[31]。徐々に、患者は会話、嚥下、最終的には呼吸困難に陥る [32]。ALSは運動ニューロン疾患として知られるより広いグループに属し、著者らが述べているように、脳と脊髄のすべての神経細胞とは対照的に、運動ニューロンのみが徐々に劣化し、変性し、死滅することによって引き起こされる疾患である[31,32]。運動ニューロンは、脳から脊髄へ、そして全身の筋肉へと伸びる神経細胞である。これらの運動ニューロンは、脳と随意筋との間の重要なコミュニケーションリンクを開始し、提供している。
ほとんどの症例は、症状、身体的徴候、進行度、筋電図、および重複する疾患を除外するための検査に基づいて診断される [33]。ALSの顕著な症状は、筋肉のけいれんと脱力感である。現在の医療プロトコルでは、ALSの症状の重症度を明らかにするために、発話、唾液分泌、嚥下、筆記などの12の課題を評価するALS Functional Rating Scale-Revised(ALSFRS-R)を使用している。ALSは40歳から70歳までの人が罹患する傾向があり、最も一般的な散発性ALS(SALS)と遺伝的要素を持つ家族性ALS(FALS)の2つのタイプが知られている。FALSはALS患者の5-10%に過ぎない。生存期間の中央値は約2年から5年であり、ばらつきはあるが、5-10%の患者が10年以上生存している[34,35,36]。ALS患者の約20%は前頭側頭型認知症も発症する。ほとんどの患者は散発型であるため、ALS患者は明確な遺伝的素因を持っておらず、遺伝学が果たす役割は限られていると考えられている。したがって、この疾患の病態を理解するためには、微生物-腸-脳神経内分泌軸の研究が重要である。突然変異や遺伝子変異を持つALS患者は、微妙に異なる臨床的特徴を示すことがある。遺伝性または家族性のALS [37] 、散発性のALS、またはその両方の原因となる遺伝子が、発表時点で25個以上同定されている [38]。
特に、スーパーオキサイドジスムターゼ-1 (SOD-1)、RNA結合蛋白質サルコーマ/トランスロケーション脂肪肉腫またはFUS/TLS、トランスアクティベーション応答(TAR)DNA結合蛋白質、9番染色体オープンリーディングフレーム(C9ORF72)の突然変異や多型が最も多く見られる[39,40]。しかし、これらの知見は、ほとんどの症例の病因が解明されていない散発性ALSのごく一部を対象としているにすぎない。ここでは、FALSとSALSの関連遺伝子の同定に用いられてきた過去と現在の方法をレビューし、それらのリスクベースの分類を提案している[41]。これらの著者は、主要なALS関連遺伝子とALSの遺伝子型-フェノタイプ相関を概説している。筋萎縮性側索硬化症に関連する遺伝的因子を解剖することが重要である。
ALS症例の約10%は遺伝に関連している。ALSとの関連が疑われる最初の遺伝子はSOD-1であると報告され、それ以来、約25の遺伝子がALSの発症に関連して探索されていた。これらの遺伝子は3つのグループに分類される。これらの遺伝子は、(1)プロテオスタシスを変化させる遺伝子、(2)RNAの安定性に影響を与える遺伝子、(3)正常な細胞骨格の機能を阻害する遺伝子の3つのグループに分類されている。プロテオスタシス遺伝子としては、SOD-1,SQSTM1,VAPB、VCP、UNC13A、DAO、OPTN、UBQLN2,CHCHCHD10,MATR3,TBK1,SCFD1,NEK1,C21ORF2などが挙げられる。RNAの性質に影響を与える遺伝子としては、ANG、TARDBP、FUS、ATXN2,C9ORF72,TAF15,HNRNPA1などが挙げられる。最後に、細胞骨格の性質に影響を与える遺伝子としては、DCTN1,PFN1,TUBA4A、MOBPなどが報告されている[28]。これらの中でも、SOD-1とC9ORF72は遺伝性ALS症例に最も一貫して存在することが報告されている。SOD-1変異はALS症例の約22%に認められ、20%は遺伝的に関連している。同様に、C9ORF72は約35%の症例に見られ、25%はイントロニック拡張との遺伝的関連性を示している。ATXN2遺伝子配列中のCAG配列のトリヌクレオチド拡張は、ALSの病因に対する有意な感受性を示している。ATXN2の変異は、初期の運動萎縮を示す傾向がある。TARDBP, FUS, HNRNPA1, SQSTM1, VCP, OPTN, PFN1などの他の遺伝子も注目されているが、ALSとの関連性はそれほど明確には定義されていない。他の遺伝的リンクの大部分は、症例の1%から5%の間で明らかになっている[42]。
3. ALSおよび神経変性のための抗生物質、共生薬および化学療法薬
ALSに処方されている現在の薬には、リルゾールとエダラボンがある[43,44]。ALSと神経変性疾患の治療法はないが、治療法はあるし、多くの研究で微生物叢の異常と神経変性との間に強い関連性があることが示唆されている[45]。私たちが注意を向け、マイクロバイオータに注目し、誇大広告ではなく変革的なものとして、抗生物質やプロバイオティクスが神経変性疾患の治療、特にマイクロバイオータ-腸-脳軸が関与している場合に有効である可能性を推論する能力を持つのは、この結節点である[23]。しかし、新興の抗生物質耐性と、臨床現場や家畜の飼育における抗生物質の過剰使用は、私たちの健康とマイクロバイオータの健康に特別な問題を提起している。抗生物質のスチュワードシップは、抗生物質の誤用を抑制することを目的としているが、知られていないのは、宿主との共代謝や最適な微生物環境、すなわち「ユービオータ」が、抗生物質や食物からの天然化合物によってどのように強化されうるかということである。
抗生物質への頌栄ではないが、近年の神経変性疾患の治療に抗生物質が使われていることに注目している。特に、セフトリアキソン(CFT)などのβ-ラクタム、セファロスポリン系抗生物質は、神経疾患に基づく疾患症状や実験的に誘発された神経疾患であるパーキンソン病、アルツハイマー病、ALS、外傷性脳損傷(外傷性脳損傷)てんかん、脳虚血、神経障害の治療および緩和に有効性を示している[2,46,47]。CFTには神経保護効果や抗炎症効果があることが報告されている。
ALSやその症状や進行の治療に効果を示す薬剤はほとんどない(現在のリストは[42]を参照のこと)。ケモバイオティクス療法、または抗生物質とプロバイオティクスは、科学界でますます関心が高まっている。この関心は、様々な神経変性疾患の症状を緩和し、自然史や経過を修正することを目的とした抗生物質の複数の作用機序によるものである。過去10年間で、神経変性疾患を治療するための抗生物質またはプロバイオティクスおよびシンバイオティクスの使用を支持する証拠は、神経変性疾患および他の関連疾患に対処するためのプロバイオティクスおよび糞便移植材料(FTM)の臨床試験および補完的代替医療における限定的な使用を含むように成長した。
糞便移植は、自然免疫応答、腸免疫の正常化および再調整を含む多くの条件のための腸の完全性の回復を助けることが文書化されている。例えば、Fecal Microbiota Transplantation Effect on Myotrophic Lateral Sclerosis Patients(FETR-ALS)試験プロトコルは、ALSにおける糞便FTMを用いた無作為化臨床試験である[48]。このグループは最近、ALSと免疫系、特にグリア、ミクログリアおよび調節性T(T-reg)リンパ球との関連性を示しており、これらはALSおよび他の神経変性疾患において特に関心の高いものである[11]。ミクログリア-腸は、これらの免疫細胞が関与する細胞数および下流の免疫応答に影響を与えることにより、T-regに直接影響を与える。本研究グループなどによる先行研究では、腸内細菌叢の異常と早期発症前のALSとの間に相関関係があることが示されている。しかし、これらの免疫細胞がALSの進行においてどの程度活性化しているのかは、まだ十分には解明されていない。しかしながら、この相関関係は、腸内細菌叢とALSの発症との間に潜在的な関連性があることを示唆している。本研究は、ALSの治療法として、またALSの腸内細菌叢の回復のための手段として、糞便微生物移植を利用することを提案した最初の研究である。FTMの使用により、T-reg細胞数の増加が観察され、ALS患者の反応が改善される可能性がある。同様に、広範なスペクトルの抗生物質が正常な微生物の恒常性を乱すことで、神経変性疾患の原因となったり、その一因となったりする可能性も示唆されている。
最近の研究では、腸内環境の異常を通じて、抗生物質が多発性硬化症やALSの発症に影響を与えている可能性が示唆されている。これに関連して、抗生物質の使用に関するスウェーデンの研究では、広汎なスペクトルの抗生物質が処方された後のALS発症のリスクを調査した[49]。細菌分析と薬物登録ランキングを、ALSの診断の数年前に投与された抗生物質とその結果としてのALSの状態に適用した。この研究は、マイクロバイオータ異常症と神経変性疾患、およびALSと抗生物質の使用との関連を示唆している。抗生物質は、通常のマイクロバイオータの豊富さの最大30%に影響を与えることが知られている。スウェーデンの症例研究では、ALS患者(n = 2484)を対象に、診断前の数年間の抗生物質の使用と結果としてのALSの状態との相関関係を調査した。スウェーデンの処方薬登録簿と細菌分析を用いて、ケーススタディの各患者に投与された抗生物質が微生物相にどのような影響を与えるかを順位付けすることができた。その結果、ALS患者は対照のスウェーデンの集団と比較して、指標日よりも前に抗生物質を投与される可能性が高いことが示された [49]。ALS診断から 1年以内に処方された抗生物質を除外すると、あらゆる抗生物質の使用はALSのリスクの増加と関連していることが観察された。すべての関連性の中で、β-ラクタマーゼ感受性のあるペニシリンは他の薬剤と比較して非常に有意な関連性を持っていることが指摘された [49]。
4. ALSに対する抗生薬物使用の歴史
そもそも何が抗生物質を使うようになったのかが、将来の治療の鍵を握っているかもしれない。臨床的には、CFT、テトラサイクリン、その他のβ-ラクタム系薬剤がALSの治療に使用されてきた。古い話ではないが、ALSの治療にCFTが初めて使用されたのは1988年で、ALSとライム病との関係を探るための研究が行われた。ライムはボレリア・ブルグドルフェリ感染症としても知られており、ALS患者で抗ボレリア抗体が検出されたときには、ALSとの相関が認められた[49]。そこで、セフトリアキソンがボレリアに対して活性であることが最近明らかになったため、セフトリアキソンの投与が試みられた[50]。その研究では、ALS患者の血清サンプルは、抗ボレリア免疫蛍光抗体価により抗ボレリア抗体陽性であった[50]。Halperinらは、彼らが調査したALS患者に抗ボレリア抗体がまれに見られるわけではないことを確認し、抗ボレリア抗体を有するALSの病状進行の様々な段階にある9人の患者のサブセットをCFTで治療し始めた[50]。彼らは、3人の患者が改善し、3人の患者は病状が進行し、3人の患者は明らかに影響を受けていないことを発見した。この最初の発見は多くの可能性を示唆しており、疾患の時間経過が病因や介入の結果に強く関係していることを示唆するものもある。
CFTは神経保護および抗炎症作用を有することが報告されている。CFTの前処置は、PD[36]神経障害[37]、外傷性脳損傷[38]、および脳虚血[51]の様々な神経学的モデルにおいて、核因子κB、インターフェロン-γ、および/または腫瘍壊死因子-α(TNF-α)およびインターロイキン-1β(IL-1β)などの前炎症性サイトカインを減衰させる。ベータラクタムは古いクラスの抗生物質であり、これは、神経変性疾患のために古い薬剤を再利用することが、医薬品開発のコストを削減するための効率的で有用なアプローチであることを示唆するものではなく、むしろ、基礎科学および基礎的発見への投資を奨励し、それらの努力を今日の現代医学が直面している最も困難な問題に適用する必要があることを示すものである。
梅毒のようなスピロヘータは、その症状が他の病気に擬態することがあるため、「偉大なる僭称」として知られていることに注意することが重要だ。認知障害やライム神経ボレリア症との混同について述べたが、スピロヘータだけがこのタイトルを保持している唯一の微生物ではなく、ライムはバベシア、バルテロネラ、リシェットシア、マイコプラズマ、トレポネーマを含む他の犯罪者で構成されている。レプトスピラ、コクシエラ、Ehrlichia chaffeensis、Francisella tularensis、線虫、寄生虫、および23種類以上の病原体とヒトヘルペスウイルス6などのヒトウイルスの宿主は、いわゆる「ライム病」を構成しうる多くの病原体の一つである[52]。ライム病はヒトの神経組織に影響を及ぼす可能性があり、ライム病で心ブロックを発症した患者の心臓神経ネットワークへの影響がそれを示している[53]。ALSとライム病との関連は確立されていないが、ライム病が原因因子または寄与因子であることを否定することはできない[54,55]。しかしながら、神経変性疾患は典型的にはその病態生物学的に多因子性である。すべての細菌が有害であるか無害であるわけではなく、我々がまだ特定していない嫌気性菌のサブセットが神経疾患に特異的に寄与したり、他の疾患の症状を模倣したりする可能性がある。さらに、ALS患者は、Oscillibacter、Anererostipes、Lachnospiraceae、およびDoreaの過剰増殖のレベルが低下していることを示している。広範囲にわたる生育異常は、アルツハイマー病やパーキンソン病のような他の神経変性疾患の特徴であるが、それにもかかわらず、過剰に生育した個体群は、腸の炎症を引き起こし、腸の伝染性を増加させることで、ALSにおける腸-脳軸全体の病原性に大きく寄与している可能性がある[56,57]。
5. 抗生物質の作用機序
CFTの様々な神経変性疾患に対する神経保護作用のメカニズムは複数存在し、グルタミン酸トランスポーター1(GLT-1)発現のアップレギュレーション、酸化ストレスや神経炎症過程の抑制など、既に解明されている共通の示唆がある。CFTは多様な作用機序を有しており、多くの神経変性疾患の症状や自然経過を改善していた。GLT-1発現のアップレギュレーション、神経炎症や酸化ストレスの減衰だけでなく、様々な神経変性疾患のための神経保護を提供するだけでなく、我々は、アルツハイマー病、PDおよびALSの動物モデルでそれが有用であることがわかる[56,57,58]。β-ラクタムは、シナプスタンパク質を安定化させ、微小管関連タンパク質であるタウをダウンレギュレートし、認知機能の低下を防ぎ、病態を改善し、ALSの様々なモデルや臨床試験で神経保護効果を発揮することが明らかになっている[59]。
このように、β-ラクタム系抗生物質とプロバイオティクスは、抗生物質の効果だけでなく、共生嫌気性菌の有用性をも表している可能性があり、必ずしも相互に排他的なものではない。したがって、特定の微生物の株が神経疾患のメタボローム組成やホメオスタシスにどのように影響を与えているのかを調査し、どの種がALSや神経変性に寄与しているのかを特定することが急務である。その結果、抗生物質の使用が腸内微生物叢に問題を生じさせ、神経疾患との相関関係があると結論づけることができ、腸の完全性の低下または腸のホメオスタシスの低下がALSや他の神経変性疾患に積極的な役割を果たしていることが研究で明らかになっている。
げっ歯類モデルは、CFTがTNF-αとIL-1 βの炎症性産生を有意に減衰させ、これはBcl-2関連Xタンパク質またはBAXとカスパーゼのフォーム、すなわち3と9のレベルの増加を緩和し、一方でBcl2と呼ばれるB細胞白血病/リンパ腫2タンパク質の発現をアポトーシスのレベルで増幅していることを示した。さらに、これらの同じ症状に寄与する可能性があるCFT抗生物質に反応する嫌気性菌のサブセットも存在し得る。一般的に、それは様々な神経疾患の範囲でCFTの作用の共通のメカニズムは、GLT-1発現のアップレギュレーションとプロ炎症性メディエーターと酸化ストレスの減少を介していることが表示される。しかし、これは、各神経疾患に対するCFTの示唆された、そして可能性のある他の新しい神経保護機序を検証するために、さらなる調査が必要である。
6. ALSの発症メカニズム
ALSだけでなく、多くの神経変性疾患にも共通したメカニズムが存在すると考えられている。それぞれの神経変性過程や疾患に特有の脆弱なニューロンが重要な標的となる。ALSでは運動ニューロンが脆弱であるが、アルツハイマー病では海馬の錐体ニューロン、パーキンソン病では黒質のニューロンが標的となる。神経細胞のタイプやサブタイプにかかわらず、脳や神経節の各細胞や領域には、脆弱な神経細胞が存在しており、それがそれぞれの特定の疾患で影響を受ける細胞となっている。それにもかかわらず、いくつかの一般的な攻撃が疾患発症の根底にあると考えられている。特に、酸化ストレス、神経炎症、蛋白質障害、興奮性の過剰刺激、代謝や生体エネルギーの障害、ミトコンドリア機能不全、興奮性または病原体への暴露、および凝集体や包接体は、文献で議論されている最も一般的なメカニズムであり、図1を参照されたい[58,60]。
図1 筋萎縮性側索硬化症と神経変性の発症メカニズムは、遺伝的、ミトコンドリア的、環境的、エピスタティックな腸内細菌叢との相互作用と細菌の直接感染メカニズムを含む主要な細胞、細菌、システムが関与している。
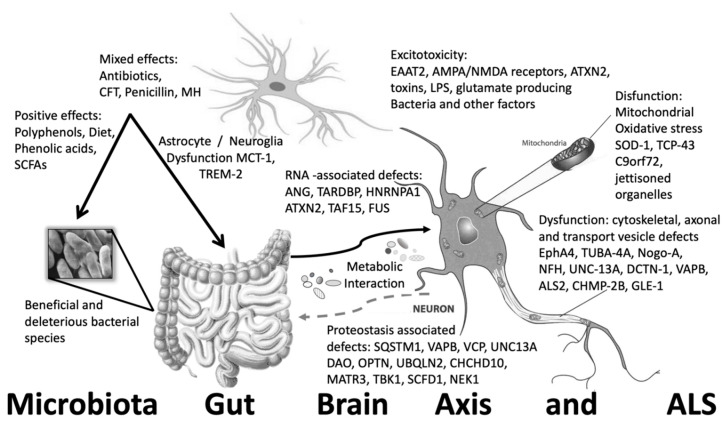
これらのメカニズムは極めて相互に関連しており、影響と伝播の悪循環が複雑に絡み合っており、最終的には細胞の機能不全と死に至る。これらのストレス因子や病気の伝播者を抑制する努力は、これらの病気の症状を緩和するか、あるいは完全に治癒させるための多くの試験やアプローチの対象となっている。残念なことに、時間は患者の側にはないし、病気の時間経過は、あらゆる不可逆的な損傷や病原性因子の程度や防御機構の乏しさが、あらゆる神経変性疾患を議論する際の重要な考慮事項となっている。ALSに焦点を当てることで、関連する脳疾患の共通性も考慮しており、疾患のメカニズムについては多くのことを知ることができるが、有効な治療法の把握や解明には至っていない。しかし、これらの疾患における微生物腸の状態を考えると、これらの破壊的な疾患を予防するための生化学的な保護の層を追加することになる。そのため、いずれは治療法の可能性が見えてくるかもしれない。
7. ALSにおける酸化ストレス、興奮毒性、炎症
すべての神経変性疾患の病因の根底にある古いメカニズムの一つは、酸化ストレスである。酸化ストレスによって誘発される運動ニューロン死は、ALSの発症におけるそのような構成要素である。SOD-1関連の家族性ALSの場合、抗酸化タンパク質代謝はすでに損なわれており、さらなる酸化ストレスは、このメカニズムを介して神経細胞死につながる可能性がある。この点では、内因性の酸化ストレスを促進したり、その十分な鎮静化を妨げたりするのは、突然変異や年齢の上昇、あるいは様々な病状の変化による内因性の酸化還元防御の不足であり、これがこの特定のストレス因子の根底にあると考えられる。これらの攻撃が内因性源または外因性源から生じるかどうかにかかわらず、いくつかの抗酸化物質およびフリーラジカルスカベンジャーがストレスに対処するか、またはストレスを除去するために提案されている。例えば、金属触媒酸化や電離放射線などのストレスを促進するメカニズムは、抗酸化物質やスカベンジャーによるアプローチが病気の予防や治癒につながることを示唆している。家族性ALSにはいくつかの傾向が見られるが、ほとんどのALSの病型では、病因のメカニズムがはっきりしていない。しかし、患者の約20%は内因性の銅/亜鉛SOD-1抗酸化酵素の変異を有しており、FALS患者は中枢神経系の腰部と頸部に焦点を当てた運動ニューロン疾患を発症する傾向がある[39]。そこで、細菌集団を特異的に調節して、成長しすぎた株やエンドトキシン株、エキサイトトキシン株を最小限に抑えることができるようにすること、あるいは、神経変性の原因となるものに対するコロニー化抵抗性を提供する主要な代謝産物を合成して保護し、増殖させることができるようにすることができるようにすることは、非常に興味深いことである。
変異型SOD-1タンパク質は、好気性代謝の副産物として酸素および窒素フリーラジカルを発生させ、ペルオキシダーゼ活性を変化させるなど、他のメカニズムがある [31]。動物モデルにおける酸化ストレスを研究した初期の研究では、SOD-1にトランスジェニックマウスを使用したが、SOD-1を欠損したマウスモデルは有意なALS症状を示したが、細胞死も引き起こした。その後の研究では、動物モデルの中で最も一般的に使用されているALSモデルの一つである変異型G93A-スーパーオキシドジスムターゼ-1のトランスジェニックマウスを使用した研究では、有意に大きな程度でALS症状を示したが、細胞死を引き起こした。我々は、これらのモデルを使用して、潜在的な治療法の有効性を示す。例えば、選択的メタボトロピー性グルタミン酸3(mGlu3)受容体アゴニストLY379268がグリア細胞株由来神経栄養因子(GDNF)を増強し、グルタミン酸トランスポーターGLT-1がG93A SOD-Iトランスジェニックマウス(SOD-1-Tg)の神経障害に有益な効果を示したが、寿命には有意な影響を及ぼさなかった[61]。ペルオキシダーゼ活性を変化させて脂質過酸化を発生させることによる酸素ラジカルの発生は、SOD-1の変異型を用いたトランスジェニックマウスのモデル研究で示された。このグループは、トランスジェニックマウスの脊髄組織のペルオキシダーゼ活性がコントロールと比較してどの程度損傷しているかを調べ、脊髄脂質過酸化が家族性ALSトランスジェニックマウスモデルと相関していることを示した[31,61]。SOD-1関連の家族性ALSの症例では、抗酸化タンパク質代謝はすでに損なわれており、さらなる酸化ストレスは神経細胞死につながる可能性がある。しかし、SOD-1のトランスジェニックマウスを用いた研究や、SOD-1を欠失したマウスモデルを用いた研究では、有意なALS症状を示したが、細胞死を引き起こしたと報告されている[62]。1996年以降、SOD-1ノックアウトマウスは正常に発育し、神経変性の兆候を示すことはほとんどないことが知られている。しかしながら、遺伝子マーカーは、代替モデルを開発するためにSOD-1およびALSと相関する他の遺伝子に注目し、これらのモデル、特に疾患の初期の病因の間に共存する微生物の関与を探求すべきであることを示唆している。
グルタミン酸のレベルが異常に増加すると、神経細胞の損傷および興奮毒性が誘発され、パーキンソン病、ADおよびALSを含むいくつかの神経疾患の病因に寄与することはよく知られている。運動ニューロン疾患の毒性モデルの一部として、グルタミン酸輸送の障害が重要な役割を果たしており、ALSの病態生理にも作用する可能性がある。シナプス前のグルタミン酸トランスポーターであるGLT-1は、大脳皮質と海馬で放出されるグルタミン酸の大部分を除去し[63]、その発現を増強することで神経学的転帰を改善する[64]。さらに、特定のGlu受容体をブロックしたり、グルタミン酸伝達の終止に関与する特定のグルタミン酸トランスポーターを過剰発現させることは、神経疾患の様々な実験モデルを改善することが示されており、抗うつ効果を有する可能性がある。
微生物-腸および抗生物質は、代謝から、または薬物相互作用を介して、抗酸化作用を有することができる。例えば、テトラサイクリン誘導体およびセフトリアキソンは、酸化ストレスおよび電離放射線から神経細胞を保護するか、またはフリーラジカルスカベンジャーとして作用する[65]。β-ラクタム系抗生物質とパーキンソン病の治療に用いられるドーパミンアゴニストであるブロモクリプチンは、酸化ストレスによる細胞死を抑制し、運動ニューロンの機能を維持し、ALS SOD-1-Tgマウスでは発症後もニューロンの生存期間を緩やかに延長させることができる。CFTは、ALS治療のためにブロモクリプチンと併用した場合、作用機序が異なると考えられているが、興味深いことに、両剤は類似の作用機序を持っている。興味深いことに、両薬は類似したラクタム環構造を有しており、これがALS治療の機能的、抑制的、または活性部位として機能する可能性がある[66]。
ALSと環境影響との相関関係から、SOD-1-Tgマウスは、広汎なスペクトルの抗生物質治療を受けた場合、前段階でのビバリウム依存性の代謝異常や異常な代謝パターンを示す傾向があることが示されている[67]。この研究から得られた結果は、抗生物質で処理したSOD-1-Tgマウスと特定の細菌種、特にALS症状を緩和するAkkermansia muciniphila、ALS症状を悪化させるRuminococcus torquesおよびParabacteroides distasonisとマウスの重症度との間に直接的な相関関係があることを示している[67]。Akkermansia muciniphila種を投与したマウスでは、さらに中枢神経系にニコチンアミドの蓄積が認められた。ニコチンアミドは、ALS症状の改善や運動機能の改善との相関性が近年研究されている。本研究では、SOD-1-TgマウスでALSの運動機能が改善されていることが示された。このデータは、これらの実験条件の間に存在する特定のマイクロバイオームと代謝物を特定するために使用され、将来のヒトの研究のための提案を作成するために使用された。
8. 酸化ストレス誘発神経変性におけるミトコンドリアの関与
ミトコンドリアは、アルツハイマー病やALSを含む多くの疾患における酸化ストレスの重要な伝播因子である [20,68,69]。欠損したミトコンドリアは、筋萎縮性側索硬化症[69,70]を含む他の神経変性疾患も同様にマークしている。1967年にLynn Margulisによって初めて提唱されたエンドシンビオン理論[71]を思い出すと、ミトコンドリアは細菌由来であり、そのタンパク質、脂質、および円形DNAは、自然免疫系から細胞内の2つの膜によって保護されている。さらに、損傷を受けると、彼らはこの免疫特権空間から細菌のような高分子を放出して免疫反応性となり、炎症を促進する可能性がある。
ミトコンドリアの断片と損傷したミトコンドリア[70]は、ストレスを受けた細胞やニューロンによって投棄され、炎症を起こしたアストロサイトは、順番に自身のミトコンドリアの断片を排出した[72]。これらの著者らは、このプロセスが劇症的であることを示し、ミトコンドリア分裂を阻害することで、P110処理を加えると、ファイブアルツハイマー病関連変異(5x家族性アルツハイマー病)とアミロイド前駆体タンパク質とプレセニリン-1トランスジェニックマウスモデルにおいて、グリア症が予防され、ニューロンが保護されることを示した。これにより活性酸素が低下し、ミトコンドリアの分裂が減少し、ATP産生が改善された。同時に、P110処理は炎症性サイトカイン産生を半減させた。これには、TNF-αおよびIL-1βの減少が含まれてた。さらに重要なことに、FALS変異を持つスーパーオキシドジスムターゼを発現するミクログリアは、アミロイドのオリゴマーアミロイドβ42形態で処理された細胞と同様に改善された[72]。さらに、げっ歯類細胞からの一次アストロサイト培養培地は、アストロサイトがTNF-αおよびIL-1βを輸出し、グルタミンリピートQ73またはSOD-1変異を有するミクログリアが、培養中の細胞呼吸を抑制し、一次ニューロンの寿命を短縮することを実証した。アストロサイト培養からの条件付き培地を、影響を受けていないミトコンドリアに添加すると、ミトコンドリアは機能不全に陥り、断片化した。この悪化は、P110を添加するか、無傷のミトコンドリアを添加すると逆になったが、これは、ミトコンドリアの分裂がこの劇症的なプロセスに役割を果たしていることを示唆しており、ミトコンドリアの断片化は、ミクログリアやアストロサイトが、サイトカインストレスを介して、他の細胞のミトコンドリアを何らかの形で損傷させる因子を放出することを引き起こしていると考えられる。
いずれにしても、リーキーガットおよびLPSまたは他の細菌成分の転座がこれらの炎症過程に関与していること、および免疫特権障壁の伝染性の増加が脳疾患および神経変性に役割を果たしていることが強く示唆されている[13]。このことは、ALSの突然変異を持つミクログリアのモデルで証明されており、リポ多糖で処理したモデルを使用して、メディアに放出された損傷細胞成分の放出を実証すると、損傷した細胞外成分が毒性の重要な原因であることを示唆している[72]。これは興味深い知見であり、損傷を受けたミトコンドリアの破片、LPSまたは細菌成分が発見された場所から除去されると、他のメカニズムの中で神経炎症を抑制することにより、ALSやアルツハイマー病などの他の神経変性疾患の治療に役立つ可能性があることをさらに示唆している。さらに、ALSの白質病変の死後脳では、セリアック病に起因する可能性が示唆されている[73]。
田中らは、ALSマウスを用いたALS後期において、(WN1316)2-[メシチル(メチル)アミノ]-N-[4-(ピリジン-2-イル)-1H-イミダゾール-2-イル]アセトアミドトリヒドロクロライドが、水溶性と高い血液脳関門伝染性を併せ持つことで、神経細胞の炎症や酸化ストレス誘発細胞死を炎症を介して選択的に抑制することを示した[74]。興味深いことに、WN1316は神経細胞のアポトーシス抑制タンパク質とNF-E2関連因子2を増加させ、グルタチオンに関連する抗酸化経路に影響を与え、酸化ストレス誘発性傷害から運動ニューロンを保護した。このデータは、グルタチオンの静脈内投与がALS患者にも有用であることを示唆しており、ALSレジメンとしてCFTを追加した場合、CFTは炎症を起こしていない髄膜組織を持つ患者の中枢神経系に移行するため、病状や進行度に依存する可能性があることを示唆している[72]。このことは、ALSにおける早期介入がALS患者のサイトカインストレス負荷に依存している可能性を示唆している。
ALSにおける酸化ストレスおよびミトコンドリア保護剤[75,76]についてのより多くの議論は、ミトコンドリアスーパーオキサイドディスムターゼ(mSOD)によって誘発された欠損ミトコンドリアの探索から来ており、これはALSおよび他の神経変性疾患の病因と関連しており、ALS[75,76]および他の神経変性疾患の前兆段階であるミトコンドリアの腫脹、巨大ミトコンドリア、液胞化および断片化によって証明されている[21]。
9. 農薬と毒性のある興奮性および中枢神経系を損傷する化合物
興奮毒素には、グルタミン酸受容体およびα-アミノ-3-ヒドロキシ-5-メチルイソオキサゾール-4-プロピオン酸(AMPA)およびN-メチル-D-アスパラギン酸(NMDA)受容体と同様に、グルタミン酸受容体でのグルタミン酸の作用を模倣するグルタミン酸およびグルタミン酸アナログが含まれる。興奮毒性は、グルタミン酸が代表的な例である内因性の興奮毒素から発生するか、または外因性の神経毒から発生する。脳および中枢神経系における主要な興奮性神経伝達物質として、グルタミン酸濃度はシナプス間隙で1ミリモルに近づくレベルまで急激に上昇し[77,78]、その後急激に低下する。レベルが低下したり、さらに上昇したりすることができない場合、ニューロンはアポトーシスによって死滅する可能性がある[78,79]。これは、脳や脊髄の損傷後にも起こりうる。最終的に、細胞のCa2+流入は酵素、ホスホリパーゼ、エンドヌクレアーゼ、カルパインを活性化し、細胞構造を損傷させる。
例えば、ネオニコチノイドおよびフィプロニルは、世界の3分の1以上で広く使用されている殺虫剤であり、植物に全身的に作用して神経系を有する生物を標的とする。重要なことに、フィプロニルは、この殺虫剤の土壌微生物分解にも悪影響を及ぼす可能性があり、これらの殺虫剤が非標的生物または生態系に及ぼす影響についてはほとんど知られていない[80]。ネオニコチノイドは神経伝達物質の作用を模倣するが、その際、ニューロンを継続的に刺激し、最終的には標的となる無脊椎動物の死に至るが、フィプロニルはニューロン受容体を阻害する [79,81]。ほとんどの殺虫剤は、昆虫や脊椎動物を捕食する生物を含む非標的生物に対して致死的で大きな影響を与える。このことは、人間の健康や神経疾患に対する潜在的なリスクの存在を示唆している。ネオニコチノイドは、持続的な膜脱分極を発生させるアゴニスト活性を示し、神経系の主要な機能不全を引き起こす。ネオニコチノイドはニコチン性アセチルコリン受容体(nAChR)を誘導することが示されており、その結果、シナプスアセチルコリン活性が障害される[79]。チアメトキサムは第二世代ネオニコチノイドであり、イミダクロプリドはアゴニストとしてnAChR活性の低下を示す。アンタゴニスト活性を介してGABA蓄積を引き起こすフィプロニルと比較して、ネオニコチノイドはアゴニスト活性を示す。ネオニコチノイドはまた、脊椎動物の受容体に対する親和性の低下を示し、昆虫とヒトの間でより高い選択性を可能にしている[66]。これらの研究は、典型的なネオニコチノイドであるイミダクロプリドが筋細胞ニューロンアセチルコリン受容体のアンタゴニストであることを強く示唆している [80,82]。
非常に一般的な神経伝達物質であるにもかかわらず、神経伝達物質である GABA がシナプス接合部に過剰に蓄積することで、神経細胞の過興奮が起こる可能性がある。感度と選択性はヒト GABAA 受容体のサブユニット構成に依存し、アセチルコリンとは異なり、アセチルコリンエステラーゼはニコチンやイミダクロプリドには作用せず、おそらく他のネオニコチノイドにも作用しないため、昆虫研究では nAChRs に作用する時間が長くなる [81,83]。GABA 神経伝達物質の産生に関しては、細菌の代謝や選りすぐりの果物、機能性食品、特にアントシアニンに由来することが知られている [83]。これらの著者は、ラクトバチルス・プランタルムまたはアスペルギルス・オリザエで発酵させた黒ニンジンが海馬のインスリンシグナル伝達を改善することで認知機能障害を予防したことを示しており、同様のアプローチがALSにも有用であったことを付け加えることができる[67]。Liらはグルタミン酸ナトリウムをγ-アミノ酪酸に変換することができるLactobacillus brevis [84]の高GABA産生種を同定したが、これはグルタミン酸ナトリウムをγ-アミノ酪酸に変換することができ、腸内の食事源からのグルタミン酸負荷を軽減するのに役立つ。神経細胞の過興奮は、シナプス接合部での神経伝達物質GABAの過剰蓄積から生じる可能性がある[85]。基本的な神経科学の原則と矛盾しているように思われるので、ここではこの肯定を裏付ける参考文献を提供しなければならない。一般に、成熟したGABA作動性シナプスは、シナプス後神経細胞を過分極するように作用するため抑制性であるが、グルタミン酸作動性シナプスは興奮性であり、シナプス後神経細胞では脱分極、すなわち神経の発火であるが、グルタミン酸作動性シナプスは興奮性であり、脱分極する[85]。
シナプス後神経細胞では、グルタミン酸とGABAが哺乳類の脳の主要な神経伝達物質である。抑制性のGABAと興奮性のグルタミン酸は、一緒に脳の興奮の全体的なレベルを含む多くのプロセスを制御する。グルタミン酸は、興奮性または抑制性の神経伝達物質として機能することができる。グルタミン酸は小胞体で合成され、ゴルジ体を経由して輸送され、小胞膜に囲まれたシナプス裂け目に出てく。小胞体膜から解放されたグルタミン酸は、シナプス後のグルタミン酸受容体と相互作用し、反応カスケードを開始する。その後の二次的な作用として、イオントロピック受容体は、これらの受容体とカルシウムイオン濃度との間に固有の関連性があるため、ALSの病因と何らかの関連性があると考えられる。過剰なCa2+は神経細胞死と関連している[85]。
10. 代替薬、化合物および抗生物質がALSを助けるかもしれない
NMDAおよびAMPA受容体およびカイニン酸に作用する興奮毒素、ならびに病理学的に高レベルのグルタミン酸は、高レベルの二価カルシウム陽イオンが細胞内に入ることを許して興奮毒性を引き起こす可能性がある[84,85]。半合成テトラサイクリン誘導体および抗炎症薬であるミノサイクリン塩酸塩(MH)は、強力な神経保護活性を示し、直接的および間接的な阻害作用を含むいくつかの提案されている作用機序により、神経細胞におけるグルタミン酸の興奮毒性を阻害する [74]。ミノサイクリンは複数の二次傷害メカニズムを標的とし、炎症、フリーラジカル、酸化ストレス、グルタミン酸興奮毒性、カルシウム流入、ミトコンドリア機能不全、虚血、出血、浮腫などを潜在的に標的とすることができる[84]。Shultzらは、ホスホイノシチド3-キナーゼシグナル伝達経路、p38マイトジェン活性化プロテインキナーゼの調節、およびマトリックスメタロプロテアーゼの阻害を含む保存されたメカニズムを介して抗炎症性および神経保護性を示すMHの作用を記述した。さらに、MHは、NMDA受容体を介して起こるカルシウム流入を直接阻害し、ミトコンドリアのカルシウム取り込みを阻害し、ポリ(ADP-リボース)ポリメラーゼ-1酵素活性と酸化還元活性鉄による毒性を阻害することができる[74]。また、金属触媒の可能性のあるフリーラジカルを直接スカベンジすることもできる。神経変性メカニズムの間の二次的傷害に影響を与えるMNにはいくつかの前線があるので、MHの治療は炎症以上に特別な可能性を秘めている。
ミノサイクリンやセフトリアキソンのような薬剤が治療効果について試験されてきたが、その結果は、少なくとも試験条件の下では決定的なものではなかった。現在、ALSの治療薬として承認されているのは、リルゾールとイダラボンのみであり、平均寿命を数ヵ月延ばすだけである [43,44,77]。しかし、リルゾール、タランパネル、イダラボンのような薬剤の代替メカニズムは、微生物相の改変に有効である[2]。例えば、リルゾールは、グルタミン酸伝達を阻害し、その濃度を低下させることにより、興奮毒性誘発変性から運動ニューロンを保護し、同時に患者の適度な生存効果を提供している[40]。リルゾールとそのプロドラッグは、生体内でより安定であるように導入されており、その使用と転帰を改善する可能性がある。神経変性疾患におけるグルタミン酸誘発性興奮毒性に対するα-アミノ-3-ヒドロキシ-5-メチルイソオキサゾール-4-プロピオン酸受容体の非競合的アンタゴニストであるタランパネルや、核内因子κB活性阻害剤であるハフェリンAは、疾患の初期段階で投与すると、SOD-1マウスモデルに有益な効果をもたらす可能性がある[43,86,87]。例えば、第2相研究であるALS機能評価スケールでは、Talampanelを投与したALS患者で運動障害が減少しており[87]、ウィットフェリンAを早期に投与することで、ミスフォールド・スーパーオキシドジスムターゼ1のレベルが低下し、ALSのマウスモデルでは寿命が延びている[86]。
細菌由来の分子は、神経変性疾患に対するもう一つの興味深いアプローチである。酸化ストレスや神経炎症が多くの神経疾患の原因となることから、この点では水素分子が注目されている。したがって、抗酸化剤および水素分子(H2)の形態は、脳血管疾患や神経変性疾患を含む神経疾患に使用することができると考えられる[88]。硫化水素(H2S)と水素分子は神経疾患の緩和に役立つ可能性があり、細菌由来の水素が酸化ストレスの治療法として役立つ理由の説明を提供しうる[88]。水素の形態は、いくつかのケースでは細菌の代謝のマーカーでもある。多くの形態の水素は、抗酸化剤と抗炎症剤の両方として機能し[88]、神経疾患での有効性が実証されており、H2 投与の臨床的可能性を示唆している[88]ので、救済または予防を提供する可能性がある。動物モデルやヒト臨床試験では、水素投与の経路として、水に溶かした水素を飲む、通常の生理食塩水に溶かした水素を注射する、または水素ガスを吸入するなどの方法がある。これらの治療法は神経疾患の予防と緩和を提供している[88]。知られていないのは、H2の正確な作用機序であるが、シグナル伝達機序を介して作用している可能性がある。したがって、H2の正確な分子標的およびその正確な作用機序を決定するためには、さらなる研究が必要である。それにもかかわらず、例えば、水素が豊富な生理食塩水は、活性酸素および窒素種(ROS、RNS)の産生、ミクログリアおよびグリアの活性化を有意に抑制し、ミトコンドリアのアポトーシス因子の放出を抑制した[89]。その後、水素は3-ニトロチロシンやカスパーゼ-3の活性化を抑制し、タンパク質のカルボニルレベルを低下させ、ダメージを与えるペルオキシナイトライトやマロンジアルデヒドの生成を抑制することが示された[90]。
最後に、齧歯類の皮質ニューロンにビタミンDを投与すると、グルタミン酸の興奮毒性やカイニン酸から保護され[89,91]、大量投与によりG93Aマウスの運動能力や握力が改善された[89,92]。臨床的には、ビタミンD3はALSFRS-Rスコアの低下を減少させた[92]。高用量ビタミンDを推奨してよいのか?必ずしもそうではないが、北半球の43度線より上の国と南半球の反対側の国のALSの役割と有病率を調べ、日光曝露の有無との関連を調べる必要がある。
11. 抗生物質の興奮剤、タイミングと代替メカニズム
βラクタムの作用機序に代わるものがALSのために存在する。多くの神経病理学的疾患は、興奮毒性につながる代謝経路と密接に関連している。神経および脳細胞への興奮毒性は過剰な刺激によって損なわれるか、または死ぬことができる。興奮毒性は、神経細胞がアスパラギン酸やグルタミン酸などのアミノ酸受容体(神経伝達物質であるアスパラギン酸やグルタミン酸など)の極端な活性化を示す状態と定義することができる。この興奮毒性は、グルタミン酸、アスパラギン酸、および類似物質などの神経伝達物質に由来する可能性がある。細胞外液中のグルタミン酸およびアスパラギン酸の蓄積は虚血性脳イベントの後に起こり、細胞死を引き起こす。選択されたアンタゴニストは、いわゆるグルタミン酸ストームの間に受容体への神経毒性を停止させることができる。
グルタミン酸の興奮毒性は、外傷、発作、神経変性疾患などの様々な障害の一因となっていることが示唆されている。シナプス後のグルタミン酸受容体を調べてみると、その大部分はイオントロピー性受容体とメタボトロピー性受容体で構成されており、Gタンパク質と結合している傾向があることがわかる。AMPAとNMDAの受容体が過剰に活性化されると、神経細胞の損傷は、10マイクロモル(μM)の範囲で報告されている、比較的低レベルのグルタミン酸で起こりうる[29,76,91]。おそらく、これはサブマイクロモルレベルでも起こりうる。一旦活性化されると、これは、膜の脱分極を促進する小胞体のためにカルシウムを放出するために使用される究極のメカニズムにつながる。カルシウムイオンを介した過剰刺激は、関連する神経細胞死を引き起こす可能性がある。健康なニューロンでは、ホメオスタシスカルシウムレベルは非常に低い濃度に保たれている。これまでのメカニズムによる損傷と、グルタミン酸、アスパラギン酸、興奮毒性のある農薬やそれらのアゴニストの過剰導入による損傷を組み合わせると、神経変性の非常に強力なメカニズムが明らかになる。
さらに、この過程を経た興奮毒性は、制御されないCa2+イオンの流入を引き起こし、その病態生理を説明している。カルシウムレベルは、細胞外空間および細胞膜へのカルシウムイオンのアンチポーター輸送によって維持される。しかし、興奮性細胞では、過剰なカルシウム濃度はエンドヌクレアーゼ、プロテアーゼ、キナーゼ、ホスファターゼなど、細胞の恒常性維持における役割が異なる酵素を活性化させる。これらの酵素は、活性化されると、大量の酵素が過剰に活性化されることにより、患部細胞の細胞死やアポトーシスの原因となる。ALSは他の神経変性疾患と同様の特徴を持っており、その発症には細菌が関与している可能性がある。したがって、この神経変性疾患においても、微生物群の役割を排除することはできない。
ALSやその他の神経変性疾患は、腸内の代謝障害やシグナル分子合成障害と同様の方法で、脳やその他の場所でのプロテオスタシスを損なう。体内遺伝子の大部分は腸内細菌ゲノムに含まれているため、プロバイオティクス遺伝子の発現を増強したり、β-メチルアミノ-L-アラニン(BMAA)[82,94]やトリグリセリド代謝やリポ蛋白リパーゼなどのエンドトキシン代謝物を抑制したりすることで、腸内細菌の保護安定性を回復させるために、疾患状態にある腸内細菌の代謝を調節したり、改変したりすることが重要である。アポE4 ホモ接合体バックグラウンドを持つバーベットChlorocebus sabaeusを用いたアルツハイマー動物モデル研究では、β-メチルアミノ-L-アラニンの経口投与後に神経原線維のもつれやアミロイドβプラークの蓄積を含むアルツハイマー病の特徴的な病理学的病理学が開発された[82,95]。さらに、ALSおよびパーキンソン病患者において、β-メチルアミノ-L-アラニンは死後の脳組織で検出されている。
興奮毒性だけでなく、微生物のサブセット、おそらくシアノバクテリアの種[96,97]がALSの発症に影響を与えている可能性が示唆されている。リーシュマニアメジャーは炎症性メディエーターをアップレギュレートするという報告があり、すでにALSに感染しているマクロファージでは、リーシュマニア感染に対する自然免疫がALSに関与していることが示唆されている。その点で、疑わしいアミノ酸誘導体の一つであるBMAAは、最初に複合症候群としてパーキンソニズム認知症および筋萎縮性側索硬化症と関連し、グアムのチャモロ族の人々において神経毒性化合物として同定された[95,97,98,99]。この化合物は細菌由来であることが確認され、窒素種による酸化ストレスに起因すると考えられている[96]。脳血管疾患の研究から、脳微小血管系、脳および脳実質を含む中枢神経系における酸化ストレスが、有害なROSおよびRNSの蓄積につながることがわかっている[99,100]。これらの化合物は白血球や他の免疫細胞の接着を促進し、内皮や他の細胞コンパートメントの伝染性を増加させ、慢性的な傷害刺激と下流のイベントのカスケードをもたらす。特に1つは、酸化ストレスを促進するミトコンドリア損傷である。その他のカスケードには、一酸化窒素合成酵素の異なるアイソフォーム、エンドセリン-1,様々な酸化ストレスマーカー、ミトコンドリアDNA損傷などの血管活性物質の活性の不均衡、血管壁や脳実質細胞におけるミトコンドリア酵素の変化が含まれる[99,100]。
興奮毒性はALSの発症過程の一つとして疑われており、グルタミン酸やアスパラギン酸のような神経伝達物質からの過剰な刺激によって神経細胞が破壊され、毒殺される。グルタミン酸の過剰興奮性および興奮毒性はALSの病態生理に関与している可能性があり、グルタミン酸の興奮毒性による運動ニューロン死がALSの病態に関与していると考えられており、グルタミン酸レベルを低下させることができれば、グルタミン酸レベルを標的とすることがALSの治療アプローチの1つとなる[45]。この考え方を支持するのは、興奮性アミノ酸トランスポーター2(EAAT2)の過剰発現の低下が発症を遅らせ、生存期間を延長すること、およびCFTがげっ歯類の脳内でEAAT2活性を増加させることを示すALS動物モデル研究である。逆に、EAAT2が損なわれると、EAAT2は細胞外空間から遊離したグルタミン酸を取り込まず、シナプス後のニューロンにおけるグルタミン酸受容体の過剰活性化を特徴とする細胞の興奮毒性を誘発する。
Ceftriaxoneは、グルタミン酸トランスポーター遺伝子発現の増加からニューロンを保護し、アポトーシス、グルタミン酸神経毒性を抑制し、生存期間を延長する[95]。ALSを対象としたCFTの第1~3相臨床試験は3段階で実施され、良好な結果が得られたが、有効性は時間に依存することが指摘されている[51]。CeftriaxoneはALSの発症に重要な要素の一つであるグリアに影響を与え、グリア細胞におけるEAAT2タンパク質の発現を増加させる。さらに、EAAT2/GLT-1の過剰発現はALSマウスの発症を遅らせ、生存期間を延長させた。このように、EAAT2をアップレギュレートする標的は、ALSの神経保護に有効である可能性がある。さらに、多発性硬化症のマウスモデルでは、グルタミン酸レベルの急激な上昇に対する免疫細胞応答と相まってEAATの活性が低下すると、中枢神経系の変性と活性化T細胞によってシグナル伝達される運動障害が引き起こされることが示されている。活性化Tリンパ球は脳血管内皮を通過して血液脳関門伝染性を障害し、下流の炎症性細胞の遊走を促進し、脳および脊髄組織に影響を与える[103]。この点に関して、実験的自己免疫性脳脊髄炎の動物モデルでは、EAAT2発現レベルやグルタミン酸取り込みに影響を与えることなく、動物被験者の臨床的な顕著な改善が示されている。この研究は、グルタミン酸トランスポーターが、以前に示唆されていたように、CFTの薬物メカニズムの主な受容体ではなく、免疫細胞の伝染性に重要なミエリン抗原受容体を調節し、膜バリアを越えたT細胞や他の細胞の中枢神経系への移動を遅らせることで、MSの発症に重要な炎症反応に役割を果たしていることを示している。
セフトリアキソンのALSに対する臨床試験では、ALS患者の神経症状を緩和する効果は認められなかった。そのため、CFT投与のタイミングと病期が重要であり、試験が失敗した理由でもある。第1ステージと第2ステージでは、ALS機能評価尺度(ALSFRS-R)の改訂版では、セフトリアキソン4グラムをプラセボと比較して投与した被験者では、ALS患者の神経症状の低下が遅かった。第2ステージの有効性データは有望であったが、第3ステージのCFT試験では、臨床的有効性や第3ステージの生存率は示されなかった。第2相試験では、血漿中および脳脊髄液中のCFTの薬物動態が計画され、ALSを対象とした臨床試験が行われた。セフトリアキソンは、ALS患者を対象とした臨床試験において、生存期間を有意に延長したり、機能低下率を有意に低下させたりすることはなかった。以上のことから、CFTは病気の進行の初期段階でのみ有益である可能性が高いことが示唆されており、私たちの個人的な診療からの逸話的証拠も同様であることを示唆している[61]。試験の結果に落胆するのではなく、さまざまな角度からこの問題にアプローチすべきであり、いくつかは微生物-腸-脳軸や細菌と宿主の共代謝に焦点を当てるべきである。
12. ALSをはじめとする神経変性疾患におけるミクログリアとアストロサイトの活性化
ミクログリア、イン フラマソーム、補体活性化、サイトカイン変化、サイトカインストレスなど、感染に伴う神経炎症には複数の因子が関与している [15,104]。これらのプロセスは、運動ニューロンの退化を進行させ、最終的にはALSにおけるニューロン死に至る。アルツハイマー病も例外ではなく、患者は炎症を呈し、脳内に感染因子が存在し、何らかの形でアルツハイマー病の発症に寄与している。さらに、アミロイドβは抗菌ペプチドとして特徴づけられており、アルツハイマー病や他の神経変性の感染原因の可能性が示唆されている[105,106,107,108]。しかし、因果関係の証拠は明確に確立されていない。脳脊髄液は脳感染症への「窓」と考えられており、臨床アルツハイマー病患者の脳脊髄液は感染因子の神経病因の洞察を提供している[108]。
他の免疫細胞およびグリアベースのメカニズムには、脳卒中、脊髄損傷および他の疾患では通常は神経保護的であるが、PDおよび他の神経変性疾患につながる可能性がある異常なアストロサイト機能が含まれている[10,109]。アストロサイトは、ミクログリアによって産生される特定の炎症性分子の存在下で、変性した異常な免疫細胞になるように見えるが、これは神経毒性反応性アストロサイトと呼ばれる。活性化されたミクログリアは、変化を誘導し、豊富さを増加させる。アルツハイマー病、パーキンソン病、多発性硬化症、ALSなどの脳損傷や主要な神経疾患の患者から採取した組織サンプルには、これらの変化が疑われている。実際、研究者たちは、細菌由来のLPSが正常なアストロサイトを炎症を促進するA1型アストロサイトへと変化させることを発見している。LPSによるミクログリアの活性化があり、これはグリアの炎症性分子を介してA1型アストロサイトへの変換を誘導する可能性がある。げっ歯類の研究では、ミクログリアが産生する分子が同定され、LPS、補体因子C1q、TNF-α、インターロイキン-1α(IL-1α)に曝露するとアストロサイトの機能や挙動が変化することが明らかになった。これらの物質のそれぞれは、A1アストロサイトを部分的に誘導することができたが、それらを組み合わせると、A1アストロサイトの完全な形質転換を促進することがわかった。
アストロサイトは通常、ニューロンを栄養し、保護するが、形成されたA1アストロサイトは実際にニューロンを殺す。パーキンソン病に関与する脆弱なニューロンやドーパミン作動性ニューロンは、A1アストロサイトが大量の有毒サイトカインを産生することで死滅する。正常なアストロサイトの存在下では、網膜細胞は成長し、繁栄する。しかし、培養での生存がアストロサイトとの接触および支持に依存する網膜細胞は、A1アストロサイトの存在下では死滅する。視神経が損傷したマウスでは、A1アストロサイトの増加が認められ、これはTNF-α、IL-1-α、およびC1qに対する抗体を用いて抑制することができた。また、アルツハイマー病、PD、ハンチントン病、ALS、多発性硬化症の患者さんの脳サンプルでも、それぞれの疾患で患部に多くのA1アストロサイトが蓄積していることが確認された。現在、A1アストロサイトからどのような分子が神経細胞に影響を与えるのかを特定し、その特徴を明らかにするための研究が進められている。
ALSと中枢神経系の様々な細胞タイプのプロテインオパチーと43kDaの転写リプレッサーであるDNA結合タンパク質-43(TDP-43)との関連を調べることで、ミクログリアがALSの進行をどのように導くかが明らかになった。本研究では、ヒトTDP-43の神経変性全体を通してのミクログリア活性を調べたところ、特に脊髄を中心とした重度の神経変性に関わらず、ミクログリアは炎症反応に影響を受けず、中枢神経系とALSにおけるミクログリアの神経保護的役割を示唆していることが示された[109]。ミクログリアの活性化において、mRNAの発生に不可欠なTAR-DNA結合タンパク質-43は、神経炎症性メディエーターである一酸化窒素2,TNF-α、およびIL-1βの放出を増加させることが明らかになった。サイトカインや活性酸素と併用すると、TDP-43の上昇はミクログリアの毒性を増加させる[110]。一般的に使用されているパラレルALS疾患モデルに続いて、活性変異体と不活性変異体の両方を持つSOD-1マウスは、進行性の神経変性表現型を示する[110]。具体的には、mSOD-1は変化した三次構造を生成し、その結果生じるミクログリア応答を分化させる[111]。
近年、アルツハイマー病やALSのメカニズムや病態に関して、神経炎症や様々な炎症性マーカーが非常に広く知られるようになってきている。神経炎症は主にミクログリアとアストロサイトの2種類の細胞によって媒介される。中枢神経系の損傷や損傷を取り巻く適切な活性化条件の下では、ミクログリアとアストロサイトの反応が誘発され、結果として、中枢神経系の損傷部位でミクログリアとアストロサイトの両方のレベルが上昇する [112]。活性化されたミクログリアとアストロサイトの同定マーカーとしては、グリア線維性酸性タンパク質(GFAP)とカルシウム結合タンパク質の2つがある [113,114]。Zhangらによると、ミクログリアとアストログリア症の反応は、ミクログリアから放出されたサイトカインなどの産物がアストログリア症の発症を誘導するカスケードパターンに従う可能性が高いという [113]。
ミクログリアとアストロサイトの役割は、ALSの進行中に神経保護と神経毒性という相反する役割を果たすという点でユニークである [110]。ミクログリアの神経保護特性はALSの初期段階で明らかになるが、神経毒作用は中枢神経系の損傷が増大し、ALSが後期に進行するにつれて現れ始める。神経保護の表現型は、追加的なニューロンサポート特性の中でも、組織修復と抗炎症を内包している [32,110]。ALSの末期では、ミクログリアの神経毒性の役割により、重大な炎症、サイトカインストレス、および活性酸素種の産生が引き起こされる [32,110]。前述したように、サイトカインおよびフリーラジカルはmSOD-1と関連していることが証明されている。さらに、mSOD-1 は細胞やニューロンの増殖と成長に不可欠な神経栄養因子の発現に悪影響を及ぼすことが確認されている [111]。神経栄養因子が中枢神経系内で減少すると、サイトカインがより強い炎症反応を引き起こし、運動ニューロンの変性を引き起こす可能性がある [111]。
13. ALSに関与する神経栄養因子およびその他の因子
ALSは多因子性の疾患であり、脳由来神経栄養因子(BDNF)やグリア細胞線由来神経栄養因子などの神経栄養因子による栄養支持を伴う神経細胞の損失は、ALSの病理学的特徴の一つであるため、その説明を行う必要がある。いくつかの神経栄養因子がALS治療の候補薬として示唆されており、ALSのマウスモデルにおいて神経保護および神経再生効果を促進することが実証されている[66]。GDNFの発現は、ALSトランスジェニックマウスにおいて、ニューロンの軸索突起を維持し、動物の寿命を延ばし、運動ニューロンの萎縮を防ぎ、病気の進行を遅らせた [114]。微生物相がどのようにしてこのメカニズムを維持したり、混乱させたりするのかは不明である。
ポリフェノールおよびフラボノイドは、神経疾患の治療に有望であることが示されている。例えば、フラボノイドの7,8-ジヒドロキシフラボンは、選択的で強力な低分子チロシンキナーゼ受容体Bアゴニストであり、BDNFの効果を模倣し、運動障害を有意に改善し、SOD-1(G93A)マウスの脊髄運動ニューロン数および樹状突起棘を保存することが示された[116]。微生物相の役割とポリフェノールの保護性を過大評価することはできず、ALSや神経変性疾患における病原体の役割を抑制するのに役立つ可能性がある。例として、原虫のライシュマニアに対して使用した場合、Clostridium nuciferaからのポリフェノールが豊富な抽出物[117]は、ライシュマニア・アマゾネンシスに対して薬理学的および抗ライシュマニア活性を示し、ポリフェノールが豊富な抽出物は新しい抗ライシュマニア治療法の開発に重要な利点を構成することを示唆している[118]。コーヒーに含まれるクロロゲン酸のようなポリフェノールやフェノール酸の保護活性は、限られた数の研究で実証されており、グルタミン酸の神経毒性から大脳皮質の一次ニューロンを保護し、虚血性脳卒中の傷害の可能性があることが示されている[7,91,115]。
神経変性疾患の理解には、細胞外RNAやDNA/RNA、mRNA、micro RNA、circular RNA、TDP-43などの結合タンパク質を探索することで、SALSや他の神経変性疾患のバイオマーカーとしての役割を果たしていることが明らかになってきている。疾患における細胞外タンパク質およびRNAの探索は、それらが神経変性疾患を取り巻く細胞プロセスで役割を果たしていることを示唆しており、ALSの将来の治療ターゲットを提示する可能性がある[119]。
カフェインのような刺激物であるヌードトロピックは、興奮性の役割を持っているか、あるいは興奮毒性に寄与しているとさえ疑われており、神経病理との関連性を持っている。しかし、ALSやアルツハイマー病については、カフェインの消費などの刺激物がどのように病気の進行に関連し、実際には刺激物であっても保護される可能性がある[120]を説明するための多くのデータがあるようには見えない。さらに、コーヒー紅茶とカフェイン含有製品については、8つの異なる研究、合計351,565人の参加者からの結果をまとめた大規模な研究で調査された。Cox回帰分析と信頼区間を用いて、カフェイン消費とALS死亡率との関係を追跡した。十分な時間が経過した後、結果をまとめて分析したところ、545人の参加者がALSで亡くなっていたことが判明した。この研究の結果から、カフェインとALSの病理学的な関連性には、カフェインが保護または有害となるような有意な関連性があることは示唆されなかった[121]。
14. 神経変性とALSに対抗する工学的アプローチ
クラスター化された規則的に配列された短いパリンドロームリピート(CRISPR)は、マイクロバイオーム、神経免疫系工学、および治療学への応用がある。CRISPR-CASは、遺伝的に恒久的な遺伝的変化におけるその使用のために最も認識されているが、治療用プロバイオティクスの工学は新規であり、微生物操作に対する一過性で遺伝的ではないアプローチとして関心がある。タンパク質発現のより恒久的なアップレギュレーションは、インデューサー、エンハンサー、すなわち、RNAポリメラーゼに対する親和性の増加、またはリプレッサー効果の除去のために作用するようにプロモーター領域をCRISPR改変することによって達成され得る[9]。プロモーター親和性を最適化するためのCRISPRの使用は、配列特異的であり、オフターゲット配列の変化を最小限に抑えながら、関心のある個々の遺伝子を標的とする。
将来のプロバイオティクスは、抗菌ペプチド、治療用シグナル分子の発現、欠陥酵素の修復、細菌性エキソ多糖類のブロック[122]、または現代の食生活から不足している可能性のある他の代謝物や栄養化合物のホストを作り出すために改変される可能性がある[91]。CRISPRは、ウイルスおよびバクテリオファージ感染に対する防御のための細菌免疫システムであり、ファージDNAの配列は感染後にアーカイブされる。これらの配列は、CRISPR関連タンパク質酵素(CAS)[123]を使用して、その後の感染でウイルスDNAを検出し、切断するために使用される。この認識・制限システムは、従来の技術であるジンクフィンガーヌクレアーゼや転写アクチベーター様エフェクターヌクレアーゼよりも容易に標的DNA配列を同定し、切断し、改変する能力を持つ堅牢な遺伝子工学ツールとして適応されている[124]。CASヌクレアーゼ活性の不活性化を介した更なる改変のためのツールとして、いわゆるデッドCAS(dCAS)は、転写活性化因子またはリプレッサーと協働して遺伝子発現をアップまたはダウンレギュレートするために局所的に結合することにより、遺伝子転写に影響を与えるための手段である[17]。デッドCASモチーフは、生物の非遺伝的転写変化に影響を与えるために使用することができる。
神経変性疾患は、伝統的な医薬品や伝統医学では治療が困難であることが示されている。神経変性に起因する困難は、特にALSにおいて、複雑な遺伝的、環境的、エピスタティックおよびエピジェネティックな要因によって特徴づけられ、治療のために個々の危険因子を標的化することを困難にしている。双方向性腸脳軸を標的としたマイクロバイオームの工学的および改変は、神経学的変化に影響を与え、神経変性に伴うマイクロバイオーム異常の腸への影響を改善するための、実行可能でより広範なアプローチである可能性がある[62]。CRISPR工学は、選択的な抗生物質ターゲティング、遺伝子のアップ・ダウンレギュレーション、および新規または有益な遺伝子の挿入を通じた細菌代謝工学を通じた微生物集団の調節に使用することができる。
従来の抗生物質治療は、多くの場合、非特異的であり、いくつかは、潜在的に無差別または傍観者の損傷を引き起こし、潜在的に腸内細菌を広く標的としているが、これは生物学的異常を助長する。これは、好ましい腸内細菌の個体数が減少することで、潜在的に有害な菌株の過剰増殖を可能にし、これを「コロニー化抵抗性の喪失」と呼んでいる。さらに、腸内の多様な細菌の複雑な群集は、同定と定量化に課題を与えている。しかし、16s rRNA領域のハイスループットシークエンシング技術により、大規模な微生物群集を同時にシークエンシングして、その後の同定とカタログ化を行うことが可能になった。16SリボソームRNAマーカーは、細菌を遺伝的にフィンガープリントするための好ましいアプローチである。代わりに、CRISPR-CAS9は、配列特異的なレベルで識別することが示されており、抗生物質耐性を標的とするためにファージを介して送達されている[41,60]。ファージ送達されたCRISPR抗菌薬を用いて、グラム陰性菌の特異的な16s配列を標的とすることができる。さらに、ハイスループットシークエンシングの使用により、個々の患者のマイクロバイオームの解析が可能となり、これらのCRISPR抗菌薬は、患者特有の腸内環境異常の治療に合わせて調整することができるようになる。
疾患のCRISPR技術は、CAS9編集を介して遺伝性の恒久的な変化を作り出すために、またはCRISPR活性化(CRISPRa)または不活性化(CRISPRi)を使用して発現のより一時的な調節を行うために適用することができ、関心のある遺伝子のプロモーター領域の近くに結合するためにdCASを使用する。転写活性化剤と結合したdCASは、p65,HSF1,MyoDなどの転写因子を標的にして発現を増加させるために使用されており、神経免疫系の免疫調節への1つのアプローチとなる可能性がある[60]。CRISPR-Cas9抗菌薬およびCRISPRaモチーフは、例えばインドール-3-プロパノール、短鎖脂肪酸、おそらくGABA [17,91]またはグルタミン酸修飾酵素などの腸内代謝物の過剰発現を介して、障害されたタンパク質および代謝物をコードする微生物遺伝子を標的とし、抗酸化活性を高めるために使用することができる。対照的に、CRISPR干渉は、細菌のエンドトキシンおよび炎症性シグナル分子の発現を非致死的に抑制または沈黙させるために使用することができる。このアプローチは、細菌集団を劇的に変化させず、同時に治療効果を達成する方法で、マイクロバイオーム異常症により慎重にアプローチすることができる。
15. 結論
上述した多くの機構論的研究では、ALS マウスモデルにおいて、疾患の進行と生存を調節する有効な手段が示されている。それらのうちのいくつかは、現在、ALS治療における潜在的な薬剤として考えられている[66]。しかしながら、動物モデルにおける有望な治療法が、特にALS患者において有効な手段に変換されることはめったにない。しかし、これらの治療のタイミングは、疾患の経過中に重要であることがわかっている。さらに、神経変性疾患における微生物-腸-脳軸の役割、選択された抗生物質の過剰使用の制限、古い薬の再利用など、新しい概念を検討すべきである。トランスレーショナルな失敗は、薬剤をBBBを通過させるのが難しいことや、投与タイミング、例えば発症前や早期の投与の方が、少なくとも動物モデルではよりポジティブな結果が得られるように思われることが一因となっているかもしれない。なぜこれがヒトで再現できないのかは、研究と早期診断の問題である。
ALSの進展の障害となっているのは、ALSが稀な病気であることと、その発症と進行についてはほとんど知られていないこと、また、その作用機序がどのようにして起こるのかについては、今日でも不明であったり、十分に解明されていないことである。例えば、(1)治療は神経細胞そのものに直接または部分的に影響を与えるのか、(2)腸内微生物に影響を与えるのか、などの疑問が生じている。(3) 主要な役割を果たす特に病原性の高い生物のサブセットは存在するのか、もし存在するとすれば(4)それらの個体群は一過性のものなのか、(5)それらはまだ分類されたり培養されたりしていないのか、といった疑問が生じる。ALSのような致命的な疾患を対象とした試験で特に難しいのは、層別化とグループ化の問題である。このような試験では、対照群やプラセボ群への割り付けは、プラセボではなく治療を希望する患者にとって受け入れがたいものとなり、この稀な疾患の比較結果を得ることが難しくなる。さらに、研究を利用する場合には、類似の治療基準とアプローチを用いた「頭から頭への比較」として提示するのが最善であろう。重要なことは、メカニズム論的研究は、ヒトのALSの病態生物学の根底にあると示唆されている理論の正確な作用機序を理解することに焦点を当てるべきであるということである。さらに、この疾患の生化学的バイオマーカーを特定し、それを明らかにすることが必要である。
ALSの進行に免疫細胞や中枢神経系の細胞がどの程度関与しているのか、またどの程度活性化しているのかはよくわかっていない。ALSとミクログリアや調節性Tリンパ球などの免疫細胞との関連は特に注目されている。これまでの研究では、腸内環境異常、炎症、および早期発症前のALSとの間に相関関係があるように見えることが示されている。さらに、腸内細菌叢が細胞数や免疫応答に影響を与えることで、T調節性免疫細胞に直接影響を与えることもわかっている。したがって、神経免疫学と炎症経路の解明と改善の分野で基礎科学の資金を増やすことは、患者にとって有益なことであると考えられる。この相関関係は、腸内細菌叢とALSの病因との間の潜在的な関連性を示唆している[48]と、βラクタム系抗生物質が有用であったため、一部の人にだけであれば、効果的な治療法を提供するために、この分野に取り組むことがより重要である。糞便移植を使用することで、T-reg細胞数が増加するだけでなく、早期の症例介入でALSに対する反応が改善されることは、もっともらしいことである[48]。
グルタミン酸の過剰生産が知られている微生物が存在するため、グルタミン酸の興奮毒性がALSの主な原因である場合、ALSを引き起こす細菌の亜種が関与しているという仮説と相互に排他的なものではない。グルタミン酸生産は、Brevibacterium lactofermentumおよびCorynebacterium glutamicumからのグルタミン [125]を含む多くの生物によって起こりうるが、合成に関与する主要な酵素は、主にアンモニウム同化の酵素であり、ニコチンアミド・アデニン・ジヌクレオチド・リン酸グルタミン酸デヒドロゲナーゼ、グルタミン合成酵素、グルタミン酸合成酵素アミノトランスフェラーゼ(GOGAT)およびアラニンデヒドロゲナーゼを含んでいる。腸内細菌の中で、主にアンモニアの取り込みを司る酵素は、グルタミン合成酵素とGOGATである。これらは、グルタミン合成酵素がグルタミン酸とアンモニアをグルタミンに変換し、GOGATがグルタミンとα-ケトグルタル酸を2モルのグルタミン酸に変換するシステムを構成している[7,93]。このように、これらの細菌はグルタミン酸ストームに寄与する可能性があり、グルタミン酸をアセテート、酪酸、二酸化炭素、アンモニアに代謝または発酵させた他の細菌は、グルタミン酸の過剰生産を減少させるのに役立つ可能性がある、すなわち、Clostridium tetanomorphumおよびPeptococcus aerogenesによってそれぞれ使用される酵素経路メチル-アスパラギン酸およびヒドロキシ-グルタル酸を介して[7,25]。さらに、グルタミン酸の利用は、動物の腸内でのクロストリジウム・ディフィシルの定着に重要である[92]。Clostridium sticklandiiによるアミノ酸代謝、特にグルタミン酸の代謝は、以下のような酵素を用いて行うことができる。グルタミン酸脱水素酵素、グルタコン酸CoAトランスフェラーゼ、グルタコニル-CoAデカルボキシラーゼ、短鎖アシル-CoA脱水素酵素、アセテートCoAトランスフェラーゼであり、過剰なグルタミン酸を利用するのに役立つ[91]。
ALSのグルタミン酸興奮毒性説は明確には確立されていないが、微生物が何らかの形でALSや興奮毒性に寄与していることがわかっており、選択された抗生物質は有益な効果を示す一方で、他の抗生物質は有害であると考えられている。例えば、転写や細菌のトポイソメラーゼやDNAジラーゼの阻害剤であるシプロフロキサシンは、グルタミン酸の産生と排泄を伴うClostridium glutamicumの増殖を阻害することが示されている119。酵素アッセイでは、グルタミン酸産生の他の誘引因子が培地に存在しないにもかかわらず、シプロフロキサシンの添加は2-オキソグルタル酸デヒドロゲナーゼ活性を低下させることが示された[7]。以上のことから、微生物がグルタミン酸の毒性に寄与している可能性が高く、抗生物質がALSの発症に役割を果たす可能性があり、同種のプロバイオティクスや選択された抗生物質が病気の初期段階では有益である可能性がある。逆に、グルタミン酸ストームに寄与または原因となる劇症微生物のサブセットが存在する可能性があり、同じサブセットがALSを含む複数の神経疾患における神経変性に関与している可能性がある。微生物-腸-脳軸は病気の治療や予防のために有望ではあるが、神経疾患に関連して、微生物について何が最も重要なのかを明らかにするにはまだ遠い道のりがある。時間は患者の側にはないので、そこに到達するためには、アイデアやレビュー以上のものが必要である。
