Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8234027/
Antioxidants (バーゼル).2021 Jun; 10(6):967.
2021年6月16日オンライン公開 doi:10.3390/antiox10060967
pmcid: pmc8234027
概要
N-アセチルシステイン(NAC)は、パラセタモールの過量摂取の治療や粘液溶解剤として広く使用されている医薬品である。安全性が確立されており、その毒性はまれで、投与経路や高用量に依存する。
その顕著な抗酸化および抗炎症能力は、酸化ストレスおよび炎症に関連するいくつかの疾患の治療に使用される生化学的基礎である。
抗酸化剤としてのNACの主な役割は、細胞の酸化還元バランスを崩す最も重要なビオチオールであるグルタチオン(GSH)の細胞内濃度を高める能力に由来する。
抗炎症物質として、NACは核因子κB(NF-κB)の活性を抑制することにより、腫瘍壊死因子α(TNF-α)およびインターロイキン(IL-6およびIL-1β)のレベルを減少させることができる。
NACは、いくつかの実験的研究において、関連する治療的可能性を持っているにもかかわらず、異なる病態に対処する臨床試験におけるその有効性は、まだ限定的である。したがって、本章の目的は、現在の治療エビデンスに基づき、ヒトの健康に対するNACの薬効と応用の概要を提供することである。
キーワードN-アセチルシステイン、作用機序、抗酸化物質、抗炎症作用
1.はじめに
N-アセチルシステイン(NAC)は、食品医薬品局(FDA)から承認され、世界保健機関(WHO)から必須医薬品として認められ、アセトアミノフェンの過剰摂取(パラセタモール)の治療に広く用いられ、最近では粘膜融解剤として、呼吸器疾患でも使用されている[1]。米国、カナダ、オーストラリアなど一部の国では、NACは市販の栄養補助食品として一般に販売されており、抗酸化作用があり、栄養補助食品として大きな商業的魅力を持っている[2]。
NACの主な役割は、抗酸化作用と抗炎症作用に関連しており、細胞のレドックス不均衡の維持に役立っている。このため、その治療的可能性は、酸化ストレスがその病因および進行に関連する一連の疾患に関するものである[3,4]。しかしながら、異なる生理的条件下でNACが抗酸化および細胞保護能力を発揮するメカニズムは、まだ十分に明らかにされていない[5]。NACの好ましい効果を調査することへの関心の高まりは、強力な細胞生体保護剤としての作用だけでなく、安価であることに関連する安全性、吸収性および生物学的利用能に関する薬物動態学的特性も含んでいる[3,4]。
動物実験では、一過性脳虚血による脳損傷の改善[6]、感染症における疼痛および炎症の管理[7]、炎症細胞の浸潤の減少による甲状腺形態の回復[8]など、NACがさまざまな条件下で酸化ストレスおよび炎症に対して強力な保護効果を発揮することが示されている。いくつかの生体内試験およびex vivoの研究では、NACが潜在的にその推定治療的役割をサポートすることができる重要な生物学的作用を果たしていることが示されているが、異なる病的状態に対処する臨床研究でのその有効性はまだ矛盾した結果を持っている[4,9]。したがって、このレビューの目的は、現在の治療上の証拠に基づいて、人間の健康に対するNACの医療効果およびアプリケーションの概要を提供することである。
2.薬物動態とバイオアベイラビリティ
NACは経口、静脈内、吸入投与が可能で、高用量でも一般的に安全で忍容性が高い[10]。経口投与では、急速な腸管吸収と肝臓での代謝を受け、放出されたシステインの大部分をGSH合成に向かわせる[11]。経口投与後、最大血漿濃度(Cmax)はおよそ1時間から2時間の間に発生する[12]。
遊離型NACの生物学的利用率は非常に低く(10%未満)、無傷の分子が血漿や組織に到達するのはごくわずかである[13,14]。さらに、NACは血漿中にさまざまな形で存在するため(酸化、還元、タンパク質との結合)、その薬物動態(PK)はまだ十分に理解されていない[15,16]。NACは酸化されてジスルフィドであるN,N′-ジアセチルシスチンとなり、さらに他の低分子チオールとの反応によって混合ジスルフィドを生成することができる。完全に代謝された後、システイン、シスチン、無機硫酸、グルタチオンが主要な代謝産物として生成される[14]。
腸および肝の第一通過代謝がないため、静脈内投与は高濃度のNACを迅速に送達することができ、パラセタモールの過量投与の治療に使用されている経路である[16]。NACを150 mg/kgの用量で15分かけて静脈内投与した後、NACのCmaxは平均554 mg/Lであった[17]。全NACの分布容積(Vd)は0.33~0.47L/kgである[13,14]。
Olsson ら (1988)[14]の研究によると、NAC (200 mgを0.9% 食塩水で、1:10に希釈)を静脈内投与した後、60 分後にタンパク質との共有結合が顕著になった。NACの終末半減期は、静脈内投与で5.58時間、400 mg経口投与で6.25時間であった。経口バイオアベイラビリティは、還元型NACで4.0%、総NACで9.1%であった。
重度の肝障害患者では、クリアランスが少ないため、PKが変化するようである。Jonesらによる研究(1997)[15]では、NACのPKが慢性肝疾患患者と対照患者で評価された。600 mgのNACを3 分間かけて静脈内投与した後、血清濃度対時間曲線下の面積は、肝硬変患者では健康な対照群と比較してほぼ 2 倍になった (152.3 対 93.9 mg/L/h)。同様に、末期腎不全(ESRD)および肝機能が正常な患者も、健常者と比較して、NACの総クリアランスが低い[18]。
Nolinら(2010)[18]の研究では、ERSD患者に複数回(12時間ごとにNAC 600 mgおよび1200 mg)経口投与した後、健常対照者(12時間ごとに600 mg)に対して14日間、NACのPKを評価した。ERSD患者において、異なる用量でCmaxおよび血漿中濃度時間曲線値の有意な増加が観察されたが、総クリアランスには変化がなかった。ERSD患者と健常対照者の間では、有意なPK差が認められた。ESRD患者におけるNAC 600 mg経口投与の全クリアランスは、4.9 ± 3.5 L/hであったのに対し、健常者では56.1 ± 12.7 L/hであった。したがって、ERSD患者ではNACの全クリアランスが90%低下し、半減期が13倍(51.3 ± 36.7 h 対対照群 3.7 ± 0.8 h)になり、その結果、これらの患者では全身への曝露がより大きくなった。
NACの経口投与と活性炭の併用は、NACの吸収を阻害することによりバイオアベイラビリティを低下させる可能性がある。しかし、その結果はまだ議論の余地がある[16]。NACの排泄は腎臓系で行われ、その中で約30% (27.0 ± 12.8)が尿中に排泄され[10]、わずか3%が糞便中に排泄される[19]。呼吸器疾患の患者に35S 標識NAC 100 mgを経口投与したところ、24 時間後に放射能の約 22%が尿から排泄された (13-38%の範囲)[20]。より最近の研究では、600 mgのNAC 経口投与後の中国人 (3.66%) および白人 (3.80%)の尿中排泄の範囲が示された。研究参加者はすべて健康であった。著者らによると、この研究で見出された排泄範囲の縮小は、NACが投与後に受ける広範な代謝および変換と一致するものであった[21]。
NACの副作用は軽度から重度まで様々で、使用する製剤や用量によって異なるが、多施設共同医療記録の広範なレビューにより、NACの静脈内および経口投与は副作用が最小限であることが示されている。経口投与では、最も一般的な副作用は吐き気や嘔吐などの消化器症状で、患者の最大23%に発生する[22]。その他の反応としては、かゆみと紅斑がある[11]。NACの腐った卵に似た刺激臭(硫黄による)も、経口投与後の吐き気や嘔吐の発現の一因となっている。NACは、匂いと味を隠して受け入れやすくするために、ノンカフェインのダイエットソーダで希釈されるのが一般的である。NACの新しい製剤として、発泡性風味の錠剤がすでに存在する[23]。静脈内投与も吐き気や嘔吐などの症状を引き起こすことがあり、その頻度は最大で9%である[22]。
製剤を考慮すると、静脈内投与は通常、経口投与と比較して、特にNACの高い血漿濃度を放出する初期負荷の注入後に、より大きな割合の副作用を引き起こす[11]。アナフィラキシー様反応など、より重篤な副作用はまれであり、最大で患者の8.2%でより顕著である。アナフィラキシー様反応は、おそらく非IgE介在性ヒスタミンの放出に関連した非免疫学的由来の反応を伴う。顔面紅潮、かゆみ、血管浮腫などの皮膚症状や、気管支痙攣、血圧低下などの全身症状がある。アナフィラキシー様反応では、通常、皮膚症状の発現が大きく、その頻度は75%である[24]。
NACの吸入型製剤は、呼吸器疾患の治療に最もよく使用されている。一般に、吸入型NACを用いた研究では、他の製剤と同様の安全性プロファイルが示され、この種の製剤に対する良好な耐性が実証されている[25,26,27]。吸入NAC投与後の有害症状には、細菌性肺炎、咳、咽頭痛、薬剤性肺炎があり、中でも咳が最も一般的である[27]。メタ解析を伴う系統的レビューでは、経口NACと比較して吸入NACによる治療では副作用の発生率が有意に高いことが示されたが、NAC治療と対照の治療との間の副作用の発生率の有意差は確認されなかった[28]。
パラセタモールの過量投与患者や健常者がNACを単回または反復投与した場合のNAC過量投与の毒性はまだ定義されていない[29]。グルコース-6-リン酸デヒドロゲナーゼ(G6PD)が正常な患者では、NAC(100g)を短時間で過量投与すると、溶血、血小板減少、急性腎不全、死亡を引き起こすことが報告されている。報告された症例は、パラセタモール過剰摂取の治療のために、10g(10,000mg)とすべきNACの負荷量投与時の誤りから生じたものである[30]。動物におけるNACの毒性データは入手可能である[29]。Box 1は、NACの主な特性の概要を示している。
Box1 化合物N-acetylcysteineの概要
| 化合物「N-アセチルシステイン」の概要 | |||||
| 薬物表示 NACは、主に粘液溶解剤として、またアセトアミノフェン(パラセタモール)の過量摂取の管理に使用される。 |
|||||
化学構造 |
分子式 C5H9NO3S |
同義語 | |||
| ▪N-アセチル-システイン
▪アセチルシステイン ▪N-アセチルシステイン ▪NAC ▪Ac-Cys-OH。 ▪616-91-1. |
|||||
| pKa 3.24: -COOH と9.5: -SH |
|||||
| 分子量 163.2 g/mol |
タンパク質結合率 66-97% (通常アルブミンに結合) |
WHO必須医薬品 毒殺の際に使用される解毒剤など。 |
|||
| 薬物クラス | 治療用途 | 味覚 特徴的な酸味 |
|||
| ▪解毒剤
▪毒性学的な緊急事態 |
▪抗ウイルス剤
▪去痰剤 ▪フリーラジカル捕捉剤 |
||||
| 色・形状 白色結晶性粉末 |
|||||
| におい わずかな酢酸臭 |
|||||
| 医薬品に関する注意事項 | |||||
| ▪発疹、低血圧、喘鳴、呼吸困難などのアナフィラキシー様反応が非経口 NAC 投与後に報告されている。
▪アナフィラキシー様反応は、喘息の患者ではより重症化し、死に至ることもある。 ▪NAC静注後の主な副作用として、発疹、蕁麻疹、そう痒症が報告されている。 ▪急性潮紅と紅斑は、NACの静脈内投与後の重篤な有害反応ではない。 ▪NAC使用後に胸部圧迫感や気管支収縮が報告されている。 ▪NACによって臨床的に気管支痙攣が誘発されることはまれである。 ▪NAC経口吸入後、気道閉塞が増加することがある。 ▪NACの経口投与により、吐き気や嘔吐などの消化器症状がより頻繁に、また発生することがある。 |
|||||
| 吸収量 | |||||
| ▪バイオアベイラビリティは経口投与で6-10%、局所投与で3%未満である。
▪初回ローディング用量150 mg/kgを15分かけて静脈内投与した後の血清中濃度は約500 mg/Lである。 |
|||||
| メタボリズム | |||||
| ▪肝臓でシステインに脱アセチル化され、その後代謝される。
▪経口吸入または気管内注入後、投与された薬物の大部分はスルフヒドリルジスルフィド反応に参加し、残りは肺上皮で吸収され、肝臓で脱アセチル化されてシステインに代謝されると思われる。 |
|||||
| 半減期 | クリアランス | 配信量 | 排泄物 | ||
| ▪大人-5.6時間
▪新生児-11時間 |
0.11 L/h/kg | ション 0.47 L/kg |
▪13-38%(尿)。
▪3%(糞便)。 |
||
| 剤形 | 過量投与 | ||||
| ▪吸入用溶液。
▪静脈内注射。 ▪内用液。 ▪発泡性錠剤。 ▪カプセルである。 ▪タブレット端末 ▪粉体である。 ▪顆粒である。 ▪リキッドである。 ▪点眼液。 |
致死的であったNACの単回静脈内投与量。
▪マウスで1000 mg/kg。 ▪2445 mg/kg(ラット)。 ▪モルモットで1500 mg/kg。 ▪ウサギで1200 mg/kg。 ▪イヌで500 mg/kg。 急性毒性症状は運動失調,活動低下,呼吸困難,チアノーゼ,右折反射消失,痙攣であった。 |
||||
| 薬物間相互作用 | |||||
| ▪NACは様々な薬物(例:プラバスタチン、バルサルタン、エリスロマイシン、トラセミド、ロバスタチン、リオチロニン、ジゴキシン、セリバスタチン、ラロキシフェン、カスフォンギン、エナラプリル、シンバスタチン、ペニシラミン)の排泄を減らすことができる。
▪NACとの併用により、エルキサドリンの血清濃度を上昇させることができる。 ▪NACは、oxytetracycline、trypsin、tetracyclineと併用すると治療効果が低下することがある。 |
|||||
| PubChem (2021)[31] および DrugBank (2021)[32] から引用した。 | |||||
3.分子作用のメカニズム
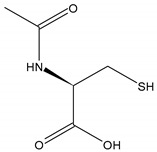
NACは、アミノ酸であるl-システインのアセチル化前駆体として働くチオールであり、1個の電子を供与することで様々なラジカルを還元したり、1個または2個の電子を供与することで求核剤として作用する(図1)[33,34]。スルフヒドリル官能基(-SH)にアセチル基(-COCH3)がアミノ基(NH2)に結合した化学構造を持ち、直接・間接の抗酸化作用や粘液溶解作用に関わる代謝活性を担っている[35]。
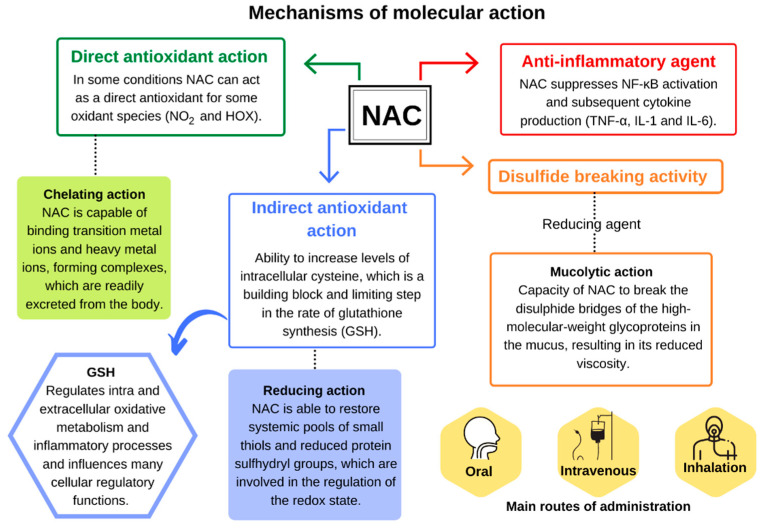
図1 N-アセチルシステインの分子作用機序
Aldiniら(2018)[3]から引用した。
NACの直接的な抗酸化活性は、その遊離チオール基が活性酸素および窒素種(RONS)と反応する能力によるものである[36]。実験条件下では、NACは一酸化窒素(-NO)の還元型およびプロトン化型であるニトロキシル(HNO)に加え、ヒドロキシルラジカル(-OH)、二酸化窒素(-NO2)、三酸化炭素イオン(CO3–)およびチイルラジカル(RS-)と迅速に反応する(表1)。ラジカルアニオンのスーパーオキシド(O2–)、過酸化水素(H2O2)、ペルオキシナイトライト(ONOO-)との反応は表1に示すように比較的緩やかである[34]。
表1 異なる実験条件下でのN-acetylcysteineと各種化合物との反応の速度定数
| 反応物質 | レートコンスタント (M-1-s-1) | 実験条件 | 参考までに。 |
|---|---|---|---|
| -オーオー | 1.36 ×1010 | pH 7, rt | [37] |
| -NO2 | ≈2.4 ×108a ≈1.0 ×107 b |
pH > pKa, rt pH 7.4, rt |
[38] [39] |
| CO3–。 | ≈1.0 ×107 1.8 ×108 |
pH 7, rt pH 12, rt |
[40] |
| HNO | 5× 105 | pH 7.4, 37 °C | [41] |
| O2– | 68 ± 6 ×103 |
pH 7, rt pH 7.4, 25 °C |
[37] [42] |
| 過酸化水素 | 0.16 ± 0.01 0.85 ± 0.09 |
pH 7.4, 37 °C pH 7.4, 25 °C |
[37] [43] |
| オノオ | 415 ± 10 | pH 7.4, 37 °C | [44] |
生理的条件下では、NACの反応速度は他の酵素的および非酵素的抗酸化物質や他の基質と比較して通常低いため、特にその内因性濃度や場所(細胞内または細胞外)などの他の要素を考慮すると、ロンに対するその直接的抗酸化能力の関連性については疑問がある[3,11]。しかし、他のチオールと比較した相対的な濃度によっては、NACが-NO2や次亜ハロゲン酸(HOX)などのいくつかの酸化種に対して何らかの直接的な抗酸化作用を有する可能性がある[3]。
他のチオールと同様に、実験的研究によると、NACはその遊離チオールを介して、遷移金属である銅(Cu2+)や鉄(Fe3+)、重金属であるカドミウム(Cd2+)、水銀(Hg2+)、鉛(Pb2+)などの活性酸化還元金属イオンにも結合して錯体を形成して体から排泄しやすくなる[34]。NACは、毒性がある場合に金属イオンのレベルを下げることができるが[45]、そのキレート特性を評価する臨床研究は限られている。NACが潜在的にキレート剤として作用するのか、あるいは見出された利点が、グルタチオン(GSH)としてよく知られる細胞内のシステイン含有トリペプチド(l-γ-グルタミル-l-システイニル-グリシン)の増加を介した間接的な抗酸化剤としての作用に主に関連しているのかはまだ明らかではない[11]。
GSHは、体内で最も多く存在する非タンパク質のチオールであり、細胞の酸化還元状態の維持を担う主要な抗酸化物質の一つで、活性種と直接反応するほか、様々な抗酸化酵素の補因子または基質として働く[3]。システインの細胞内濃度は低く、したがって、GSHの生合成速度の制限因子として作用する。この特性は、システインと細胞内GSHのプロドラッグとしてのNACの役割を説明するものである[10]。
強力な抗酸化剤としてのNACの重要性は、細胞内のシステインレベルを上昇させ、その後にGSHを増加させる能力に直接関連している(図2)。GSHとシステインの両方を単独で使用しても、細胞内のGSHレベルを上げる効果はないため、NACはパラセタモールなどの異種物質中毒の場合やGSH不足に関連する病態において、異なる組織内のレベルを維持することによって酸化ストレスによるダメージを軽減するための主要戦略の1つとなっている[1,34,46]。
図2 N-アセチルシステインの化学式とグルタチオンへの変換
Rushworth and Megson (2014)[11]より引用した。
さらに、NACはチオールタンパク質(システイニル化した細胞外タンパク質など)を分解し、より抗酸化力の高い遊離チオールを放出し、GSH生合成を促進することができる。NACが発揮する間接的な抗酸化活性に関連するもう1つのメカニズムは、その還元能に関連するものである。NACは、血漿および細胞外液に存在する主要な抗酸化物質であるメルカプトアルブミンと同様に、酸化還元状態の調節に関与する低分子量(LMW)チオールおよび還元タンパク質スルフヒドリル基の全身プールを回復することができる[3].
NACは、その還元能力により、強力な去痰薬としての重要な作用も発揮する。NACは、架橋した粘液タンパク質のジスルフィド結合を還元し、リガンドとの結合を中断して構造を修正し、それによって粘液の粘性と弾性を低下させることができるため、粘液溶解剤として知られている[34]。
実験的研究では、(1)血管平滑筋細胞におけるアンジオテンシンII受容体の結合の減少[47]、(2)サイトカインに対する腫瘍壊死因子(TNF-α)受容体の親和性の変化[48]、(3)トランスフォーミング成長因子β1(TGF-β1)のIII型トランスフォーミング成長因子受容体(TβRIII)ベータグリカンへの結合能の減少[49]など、NACはタンパク質の構造および/または機能を変化させる能力があると説明されている。
最後に、NACはまた、酸化ストレスへの反応に関与する炎症カスケードおよび免疫応答に重要な役割を果たす活性化B細胞の核因子κ-光鎖-エンハンサー(NF-κB)を阻害することによって抗炎症活性を発揮する。NACは、炎症性遺伝子発現の調節に関与する転写因子NF-κBの転位と核活性化をブロックする[9,36]。NACは、リポポリサッカライドで活性化されたマクロファージにおける炎症性サイトカインTNF-α、インターロイキン(IL)-1β、およびIL-6の放出を抑制することが示されている[50]。
4.臨床的効能
図3にNACの治療用途を、表2に実施した臨床試験の一覧(投与量、投与時間、投与経路)を示す。
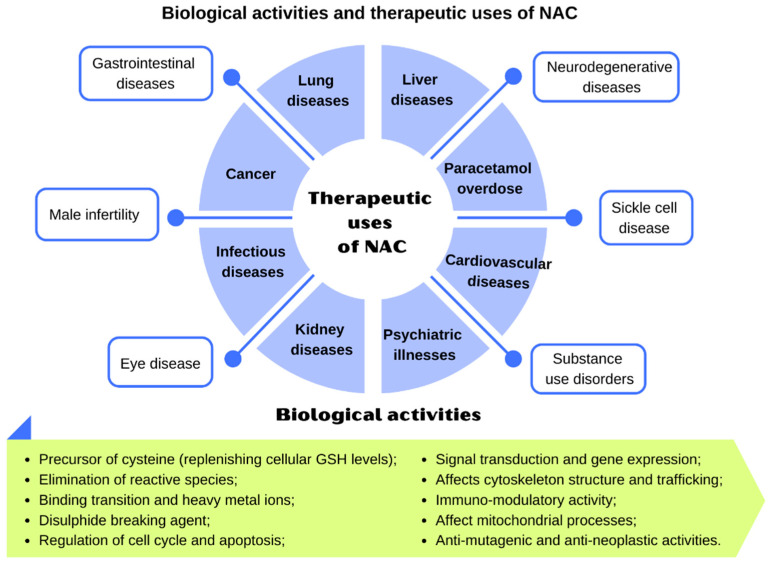
図3 N-アセチルシステインの生物学的活性と治療上の使用。Samuniら(2013)[34]を参考にした。
表2 N-acetylcysteineを用いた様々な臨床条件下での研究
| 病気について | スタディタイプ | 投与量 | トリートメントタイプ | 管理部門 路線 |
参考文献 |
|---|---|---|---|---|---|
| 肺の病気 | |||||
| 慢性閉塞性肺疾患 | 臨床試験 | 600mg/日 | 3年 | 経口 | [51] |
| 臨床試験 | 600mg/日 | 3年 | 経口 | [52] | |
| Clinical trial | 1200mg/日 | 1年 | 経口 | [53] | |
| 臨床試験 ChiCTR-TRC-09000460 | 1200mg/日 | 1年 | 経口 | [54] | |
| Clinical trial | 3600mg/日 | 8週間 | 経口 | [55] | |
| システマティックレビュー メタアナリシスを含むレビュー |
>600mg/日以上 | 長期 | 経口 | [56] | |
| システマティックレビュー メタアナリシスを含むレビュー |
≥1200mg/日以上 | 長期 | 経口 | [57] | |
| システマティックレビュー レビュー |
低用量で ≤600mg/日以下 高用量 >600mg/日以上 |
最低6カ月 | 経口 | [58] | |
| 嚢胞性線維症 | システマティックレビュー メタアナリシスを含むレビュー |
600mg~2800mg/日 | 3.9カ月および12カ月 | 経口または吸入 | [59] |
| 臨床試験 | 1800,2400,3000mg/日 | 4週間 | 経口 | [60] | |
| 臨床試験 2007-001401-15 |
2400mg/日 | 4週間 | 経口 | [61] | |
| 特発性肺線維症 | システマティックレビュー メタアナリシスを含むレビュー |
704.8~1800mg/日 | – | 経口または吸入 | [62] |
| システマティックレビュー メタアナリシスを含むレビュー |
経口投与する。1800mg/日 吸入投与704.8 mg |
3〜15カ月 | 経口または吸入 | [28] | |
| 循環器系疾患 | 臨床試験 | 15,000mg/日 | 24 h | 静脈内 | [63] |
| 臨床試験 | 15,000mg/日 | 24 h | 静脈内 | [64] | |
| 心臓外科 | システマティックレビュー メタアナリシスを含むレビュー |
<100mg/kg/日 から300mg/kg/日以上 |
<24時間未満および48時間以上 | 経口および/または静脈内 | [65] |
| システマティックレビュー メタアナリシスを含むレビュー |
50mg/kg~600mg | 48時間まで | 経口および/または静脈内 | [66] | |
| 臨床試験 | 50-150mg/kg | 術前1時間、術後48時間 | じょうみゃくない | [67] | |
| 精神疾患 | |||||
| 統合失調症 | 多施設共同 臨床試験 |
2000mg/日 | 4週間 | 経口 | [68] |
| 臨床試験 IRCT:2015080223463 | 1200mg/日 | 12週間 | 経口 | [69] | |
| メタアナリシスを含むシステマティックレビュー | 600mg~3600mg/日 | ≥24週以上 | 経口 | [70] | |
| 臨床試験 | 2700mg/日 | 6カ月 | 経口 | [71] | |
| 双極性障害 | 臨床試験 ACTRN12612000830897 | 2000mg/日 | 16週 | 経口 | [72] |
| 臨床試験 12605000362695 | 1000mg/日 | 24週 | 経口 | [73] | |
| うつ病 | 臨床試験 ACTRN12607000134426 |
1000mg/日 | 12週間 | 経口 | [74] |
| システマティックレビュー メタアナリシスを含むレビュー |
1000mg~3000mg/日 | – | 経口 | [75] | |
| 神経変性疾患 | |||||
| パーキンソン病 | 臨床試験 | 150mg/kg | 1 h | 静脈内 | [76] |
| 臨床試験 | 静脈内投与50mg/kg 経口投与1000mg/日 |
3カ月 | 経口および静脈内 | [77] | |
| 臨床試験 | 6000mg/日 | 4週間 | 経口 | [78] | |
| アルツハイマー病 | 臨床試験 | 600mg/日 | 6カ月 | 経口 | [79] |
| 多発性硬化症 | 臨床試験 | 1250mg/日 | 4週間 | 経口 | [80] |
| 臨床試験 | 静脈内投与。50mg/kg(週1回) 経口投与1000mg/日(週6回) |
2カ月 | 経口および静脈注射 | [81] | |
| 肝臓の病気 | |||||
| パラセタモール中毒 | 臨床診療の指針 | 200mg/kg 4時間後、100mg/kg 16時間後 | 20 h | 静脈内 | [82] |
| 急性肝不全 | 無作為化ケースコントロール試験 | 150mg/kgを1時間かけて投与、その後12.5mg/kg/hを4時間、6.25mg/kg/hを残り67時間持続点滴投与 | 72 h | 静脈内 | [83] |
| システマティックレビュー レビュー |
150mg/kgを1時間かけて投与、その後12.5mg/kg/hを4時間、6.25mg/kg/hを残り67時間持続点滴する。 | 72 h | 静脈内 | [84] | |
| 非アルコール性脂肪性肝疾患 | 臨床試験 | 600mg/日 | 3カ月 | 経口 | [85] |
| 急性アルコール性肝炎 | 多施設共同臨床試験 | 1日目:150,50,100 mg/kgをそれぞれ30分、4時間、16時間かけて投与、2~5日目:100 mg/kgを投与。 | 28日 | 静脈内 | [86] |
| 多施設共同臨床試験 | 300mg/kg | 14日 | 静脈内 | [87] | |
| 腎臓の病気 | |||||
| 心臓手術を受ける慢性腎臓病患者 | システマティックレビュー メタアナリシスを含むレビュー |
150mg/kg〜1200mg | 6時間~7日 | 静脈内 | [88] |
| 慢性腎臓病 | 臨床試験 | 5000mg | 血液透析1回分 | 静脈内 | [89] |
| 臨床試験 | 600mg/日 | 1週間の間隔をあけて2回投与 | 経口 | [90] | |
| 消化器系疾患 | |||||
| ヘリコバクター・ピロリ感染症 | 臨床試験 | 600mg/日 | 14日 | 経口 | [91] |
| 臨床試験 | 800mg/日 | 5日 | 経口 | [92] | |
| 大腸炎に伴う大腸がん | システマティックレビュー レビュー |
8000mg~1200mg/日 | 7日~12週間 | 経口 | [93] |
| 消化器がん | 臨床試験 | 1200mg/日 | 手術の2日前から術後5日目まで | 模式的な非経口投与 | [94] |
| 臨床試験 | 800mg/日 | 12週間 | 経口 | [95] | |
| 潰瘍性大腸炎 | 臨床試験 | 800mg/日 | 4週間 | 経口 | [96] |
| 感染症 | |||||
| B型慢性肝炎 | 臨床試験 | 8000mg/日 | 28日 | 静脈内 | [97] |
| 肺結核 | 臨床試験 | 600mg/日 | 2カ月 | 経口 | [98] |
| SARS-CoV-2 | 臨床試験 | 6000mg/日 | 3週間 | 静脈内 | [99] |
| 絨毛膜羊膜炎 | 臨床試験 | 100mg/kg/doseおよび12.5-25mg/kg/doseを乳児に投与した。 | 出産まで診断し、12時間ごとに5回、乳児に投与。 | 静脈内 | [100] |
| 感染症や子宮内炎症 | 臨床試験 | 150mg/kgを1時間で投与し、その後NAC(50mg/kg)を4時間持続注入し、次の16時間または出産までNAC100mg/kgを注入する。 | – | 静脈内 | [101] |
| 急性腎盂腎炎(きゅうせいじんもうえん | 臨床試験 | 体重30kg以上の小児は900mg/日、体重8.5~30kgの小児は600mg/日、体重8.5kg未満の小児は70mg/kg/日 | 5日 | 経口 | [102] |
| がんの予防と治療 | |||||
| 放射線治療、頭頸部がん | 多施設共同前向き対照試験 | 2400mg/日 | 8週間 | 吸入療法 | [103] |
| 臨床試験 | 2500mg/日 | – | リンス | [104] | |
| その他の条件 | |||||
| 禁煙 | 臨床試験 | 1800mg/日 | 12週間 | 経口 | [105] |
| 男性生殖能力 | 臨床試験 IRCT20170830035998N4 |
600mg/日 | 3カ月 | 経口 | [106] |
| 鎌状赤血球症 | 臨床試験 NTR1013 |
1200または2400mg/日 | 6週間 | 経口 | [107] |
| 臨床試験 | 600mg/日、1200mg/日、2400mg/日 | 7カ月 | 経口 | [108] | |
| 子癇前症 | 臨床試験 | 400mg/日 | 6週間 | 経口 | [109] |
| 臨床試験 | 600mg/日 | – | 経口 | [110] | |
| メタボリックシンドローム | パイロット・スタディ | 1200mg/日 | 6週間 | 経口 | [111] |
| 眼の症状 | |||||
| 慢性眼瞼炎 | 臨床試験 | 100mg/日 | 1〜4カ月 | 経口 | [112] |
| マイボーム腺機能不全 | 臨床試験 | 5% | 1カ月 | 目薬 | [113] |
| 臨床試験 | 5% | 1カ月 | 目薬 | [114] | |
4.1.肺の病気
呼吸器疾患の病因と進行は、炎症と酸化ストレスの増加、それに伴うGSHなどの内因性抗酸化物質の減少によって説明することができる[115,116]。NACは、慢性閉塞性肺疾患(COPD)、嚢胞性線維症(CF)、特発性肺線維症(IPF)など、これらの疾患の治療のための有望な治療標的であり、その抗酸化、抗炎症、および粘膜融解特性により、すでに説明したように、GSH細胞内プールを補充する能力と粘液生成および粘性を低下する能力に関連している[55、116](図3)。
通常、NACは600~1200mgの錠剤を1日3回まで経口投与される[11]。COPDのような慢性疾患の治療には、長期間の使用が必要であるため、認可された最大用量は600 mg/日であるが、600 mg/日を超える用量が異なる臨床試験で常に使用されている。NACの安全性プロファイルは、低用量(≤600 mg/日)でも高用量(>600 mg/日)でも通常、類似している。呼吸器疾患における3000mg/日までの投与量の研究では、NACは安全で忍容性が高いことが示されている[27](表2)。
COPD患者に対するNACの臨床効果は、いくつかの臨床試験で証明されているが(表2)、その結果にはまだ賛否両論がある。COPDは、有害物質の吸入による気流障害に関連した慢性的な症状を特徴とし、喫煙者に多くみられる。BRONCUS(Bronchitis randomized on NAC cost-utility study)試験は、第III相の二重盲検無作為プラセボ対照試験で、523人のCOPD患者を3年間追跡調査したものである。患者には、1日あたり600mgの経口NACを投与した場合とプラセボを投与した場合があった。この研究では、低用量のNACによる治療は、強制呼気1秒量(FEV 1)または生命維持能力の低下率に影響を与えず、COPD患者の増悪率または健康状態にも影響を与えないことが実証された[51]。同じ1日600 mgのNAC経口投与による別の臨床試験でも、慢性気管支炎または軽度から中等度のCOPD患者における呼吸器のQOLの進化や増悪の割合に影響を与えなかったことが示された[52]。
これまでの研究結果とは異なり、慢性閉塞性肺疾患の空気の捕捉と気道抵抗に対するN-アセチルシステイン高用量投与の効果については、安定したCOPD患者120名(NAC 600mgを1日2回経口投与した58名、プラセボ投与した62名)を対象に行われた二重盲検無作為プラセボ対照試験(HIACE)により、疾患の増悪の度合いが低下したことに加え、小気道の機能が有意に向上することが示された[53]。同様に、中等症および重症のCOPD患者1006人を対象に開催されたN-acetylcysteine high dose in exacerbations of chronic obstructive pulmonary disease(PANTHEON)の有効性と安全性に関するプラセボ対照試験で、NACを1日1200mg投与した結果、治療群ではプラセボ群に比べCOPD急性増悪が特に中等症患者で著しく減少した[54]。
COPD患者を対象に、高用量NAC(1日2回1800mg、合計3600mg/日)の使用を8週間にわたりプラセボと比較した無作為二重盲検プラセボ対照試験でも、同じ所見は得られなかった。この試験では、高用量を短期間使用した場合の忍容性は良好であることが示されたものの、呼吸器全般の健康状態、肺機能、全身性酸化ストレスおよび炎症の循環的測定値にプラスの効果はもたらされなかった[55]。
Tseら(2013)[53]によると、低用量のNACによる治療と、いくつかの研究でCOPDの評価のためのパラメータとしてFEV 1を使用することは、これらの患者におけるNACの抗酸化および抗炎症治療の効果がないことの原因かもしれない。一般に、高用量はNACのバイオアベイラビリティを高め、その効果を増大させる。したがって、著者らは、低濃度のNAC(600mg/日)では、肺機能、増悪率、または入院再入院のリスクの改善において、有意な抗酸化・抗炎症効果が得られないと示唆した。しかし、より高用量では、COPDにおける酸化ストレスと炎症による影響を軽減し、増悪率に好影響を与えることを示した[117]。
このような観点から、臨床試験の結果をより明確にするために、COPDに対するNACの効果を、総増悪回数、1回以上増悪した患者数、FEV 1の低下率を評価基準として、様々なメタアナリシスが検討されている[56,57]。Shenら(2013)[56]は、高用量のNAC(600mg/日以上)の長期投与は、COPDの増悪を抑制できるが、FEV 1率には影響がないことを示している。また、別のメタアナリシスでは、高用量のNAC(≧1200mg/日)の長期投与はCOPDの増悪を防ぎ、低用量(600mg/日)は、COPDでなく、気道閉塞のない慢性気管支炎の患者にのみ有効である可能性が示された[57]。
より最近の系統的レビュー[58] では、NAC群(n= 1339)と対照群(n= 1352)に無作為に割り付けられた2691人のサンプルが含まれており、低用量NAC(≦600mg/日)または高用量NAC(>600mg/日)を最低6カ月間投与すれば、副作用なく安全にCOPD増悪のリスクを低減できることが示されている。しかし、NAC療法は、増悪率や肺機能のパラメータ(FEV 1)には影響を及ぼさなかった。Cazzolaら(2017)[118]も、COPD患者に補助療法として高用量のNAC(1200mg/日)を使用すると、病気の増悪の可能性を低減できることを実証している。これまでに得られた結果に基づいて、慢性閉塞性肺疾患グローバル・イニシアティブ[119]は、NACなどの粘液溶解薬や抗酸化薬をCOPDの急性増悪のリスクを低減するための補助療法として使用できることを認めているが、強固なランダム化比較臨床試験がないため、限定的にしか認められていない(証拠レベル:B)。
CFの治療に関連して、NACは、ムチン分子の結合を担うジスルフィド結合の加水分解による粘液溶解性の観点から、しばしば使用されている[120]。その結果、1960年代以降、CFと診断された患者の吸入療法として承認されているが、肺機能の改善や肺の増悪を抑える効果は、まだ十分に確立されていない[121,122]。
したがって、CFと診断された患者におけるNACの吸入に関する知見は、特に粘液分泌の除去に有効であることに焦点が当てられている。著者らは、抗酸化物質とCF患者の肺機能との間の既存の知見を総合することを目的としたメタアナリシス付きシステマティックレビューにおいて、NACの経口補充は、肺機能の悪化を防ぐ有益な効果を示すが、有意ではないことが明らかになったため、治療の補助としてNAC(主に吸入による)の投与を推奨している。逆に、吸入で使用した場合、NACは成人の肺機能に対して3カ月後に有意に良好な効果をもたらし、9カ月後と12カ月後も維持された[59]。
CF患者は、気道の感染症や炎症を繰り返すのが特徴であり、これは酸化ストレスの増加と一致する。そこで、18名のCF患者を対象に、高用量のNAC(600,800,1000mg/日)を1日3回、4週間にわたって投与した。その結果、高用量は血中好中球のGSHレベルと気道の好中球数を上昇させ、エラスターゼ活性を有意に低下させることができ、この結果はNF-κB経路を阻害してIL-8の減少を引き起こすというNACの役割によって正当化されると、著者らは結論づけている。使用された用量は、患者の忍容性が高く、軽度の副作用(胸焼け、吐き気、鼓腸)のみが報告された[60]。
その後、NACの使用が報告され、無作為化臨床試験で、CFと慢性肺感染症の成人を対象に、NAC(2400mg/日)の4 週間の経口補給の酸化ストレスマーカーに対する効果が評価され、肺機能の改善が見られたが、脂質過酸化、マロンジアルデヒド(MDA)、8-isoprostane マーカーの減少が見られなかったと結論づけられている。それでも、11人の参加者のうち1人が胃痛のために試験から脱落したものの、この治療法は忍容性が高いと見られている[61]。
NACは、その抗酸化作用と抗炎症作用に基づいて、IPF患者を標準治療と組み合わせて治療するための選択肢として、さまざまな臨床試験で使用されている[28]。IPFは、原因不明の慢性進行性間質性肺疾患であり、高い死亡率を有している[123]。肺の間質および肺胞空間における創傷治癒の異常、筋線維芽細胞の激しい増殖に伴う線維化の結果として、呼吸困難および肺機能の悪化によって特徴づけられる。炎症と酸化ストレスはその病態の一部であり、疾患の進行と関連している[124,125]。
NACは、IPF患者の酸化を抑制し、レドックスバランスを回復させることにより、有効な治療資源となることが推測される[28]。それにもかかわらず、1989年にCantin らによる研究[126] では、IPF 患者は健常者と比較して GSH 濃度が、4 倍低いことが示され、これらの患者のGSH 欠乏が下気道の酸化的-抗酸化的不均衡に寄与し、肺実質の細胞に大きなダメージを与えていることが示唆された。また、IPF患者のGSHレベルを回復させることは、合理的な治療アプローチになりうることが示唆された。
日本人の軽度・中等度IPF患者を対象に、48週間にわたりNAC吸入単独療法の有効性を評価する臨床試験を実施した。患者はNAC投与群(n=51)と対照群(n=49)に無作為に割り付けられた。治療群は1日2回、NAC 352.4mgを生理食塩水で希釈し、マイクロエアーのネブライザーと振動メッシュ技術により総量4mLになるように吸入した。対照群には、研究期間中、治療やプラセボは投与されなかった。100人の参加者のうち、76人が研究を完了した(各グループ38人)。強制換気量(FVC)の変化については、各群間に一般的な有意差は認められなかった。また、下部動脈酸素飽和度の変化、6分間歩行距離試験(6MWD)、肺機能異常値(PFT)など、その他のパラメータの変化についても、NAC群と対照群との間に有意差は認められなかった。吸入NACの安全性については、両群で報告された有害事象の数に有意差はなく、全般的にNACの忍容性は良好であることが示された。細菌性肺炎、咳、喉の痛み、高コレステロール血症が、参加者から報告された最も一般的な有害事象であった[25]。
Roglianiら(2016)[62]は、系統的レビューとメタ解析において、NACに加えてIPFで頻繁に用いられる薬剤、ピルフェニドンとニンテダニブの有効性と安全性を、3847人(治療2254人、プラセボ1593人)の患者を対象に解析した。その結果、NACではなく、pirfenidoneとnintedanibの両剤がIPFの進行抑制に有意に有効であることが示された。また、本試験では、NACの安全性(錠剤で1800mg/日吸入時の濃度は704.8mg/日)についても注目され、有意差はないものの、有害事象のリスクが高いことが示唆されている。
2005年から2016年の間に発表された21の研究を含む別の最近のメタ分析[28]では、IPFにおけるNAC療法の有効性と安全性が評価された。1354人の患者のうち、695人がNAC単独または吸入、あるいは他の薬剤(一般にコルチコステロイドおよびピルフェニドン)との併用を受け、659人が他の療法を受けた。一般的に使用された経口投与量は1日1800mg、吸入投与量は704.8mgであった。データの分析により、NACはIPF患者の肺機能低下を減少させることができ、強制生命維持能力(FVC)の低下と一酸化炭素拡散能(DLCO)の低下に関連し、動脈酸素分圧(PaO2)の安定化により疾患の進行が遅いことが示された。さらに、NACの投与は6分間歩行距離試験の結果も改善し、Sunら(2016)[123]の結果を裏付けた。
4.2.循環器系疾患
他の疾患と同様に、酸化ストレスは心血管疾患(心血管疾患)の発症と進行に関与している。臨床研究および特に実験的研究により、心機能の改善におけるNACの有効性が示されており、糖尿病性心筋症(DCM)、急性心筋梗塞(AMI)、心不全(HF)および冠動脈疾患(CAD)などの状態における心保護的役割が強調されている[127]。
ST上昇型心筋梗塞(STEMI)患者を対象に実施された多施設共同臨床試験NACIAM(N-acetylcysteine in acute myocardial infarction)では、NAC高用量静注(最初の1時間に20mg/分、残り47時間に10mg/分)と低用量のニトログリセリン(2.5 Pg/分、48時間)を併用することで、これらの患者の急性梗塞の大きさを縮小する効果があった。この研究はまた、NACが心筋救助を改善し、これらの患者の胸痛の迅速な解決に作用することを示し、一次経皮冠動脈インターベンションに有益な効果をもたらす可能性のある補助的治療案として提示された[128]。
他の研究でも、この治療上の関連にプラスの効果があることが示されており[63,129]、NACは強力な抗酸化剤として作用することに加えて、ニトログリセリンの効果を増強することが示唆されている。Arstallら(1995)[63]の研究では、ニトログリセリンとストレプトキナーゼにNAC 15,000 mgを24時間かけて静注した併用療法は、AMI患者の酸化ストレスを軽減し、NACで治療した患者の還元型および酸化型グルタチオン(GSH/GSSG)の割合が高く、血漿マロンジアルデヒド(MDA)レベルが低く、左心室機能の保存がより優れていると関連して測定されている。本試験では、臨床試験開始前に全患者にニトログリセリン5μg/minの点滴が行われた。治療群には、NACを最初の1時間に20mg/分、その後23時間に10mg/分、24時間で合計15,000mgを点滴した。NAC点滴開始後、ハイドロコルチゾン100mgを投与し、ストレプトキナーゼ1.5MUを30分かけて静注している。対照群にはNACの点滴は行わなかった。同様に、別の研究では、ニトログリセリンとストレプトキナーゼに加え、NACの静脈内投与(15,000 mg/24時間)を併用すると、AMI患者の血漿MDA値が有意に低下し、左心機能が改善することが示された[64]。
NACの使用は、心臓手術を受けている患者においても検討されている。研究により、NACは、酸化ストレスおよび炎症を減少させることにより、これらの患者の術後合併症を減少させることができることが示唆されている[130,131]。しかし、29の臨床試験と2486人の参加者を対象とした最近の系統的レビューでは、異なる投与経路(静脈内、経口、経口と静脈内)および投与量(100未満、100~300未満、300mg/kg/日以上)で、死亡率、急性腎不全、心不全、入院期間、集中治療室、不整脈、急性心筋梗塞などの心臓手術に伴う主要有害事象を減らす上で著しい効果を示さなかった[65](Nacon et al.
別のメタアナリシス[66] でも、患者578人に対するさまざまな治療レジメン(50mg/kgから600mgの用量まで)のNACの静脈内および/または経口投与が死亡率に影響を及ぼしたという証拠は見つからなかった。しかし、NACによる治療は、心臓手術後によく見られる不整脈であり、患者の入院期間に影響を与える可能性のある術後心房細動を減少させることが示された。Ozaydinら(2008)[67]も、プラセボ群と比較して、50-150mg/kgの用量を術前1時間および術後48時間に静脈内投与したNAC投与群の心房細動発生率が低いことを実証している。心房細動は、GSHの枯渇による酸化ストレスの増加と慢性炎症に関係していると推測される[132]。したがって、現在のデータでは、胸部手術後の患者におけるNACは不整脈の予防に有効であり、術後合併症に関連する他のアウトカムを評価するためにさらなる無作為化臨床試験を必要とすることが明らかになった[133]。
4.3.精神疾患
NACは、強迫性障害、統合失調症、双極性障害(BD)、うつ病などの精神疾患に対する潜在的な治療戦略として認識されている。酸化的プロセスと関連するかどうかにかかわらず、炎症性サイトカインの減少に対するその影響は、NACが精神疾患の症状を調節することができるメカニズムを説明するのに役立つ[134]。現在の証拠に基づくレビュー[135] では、精神疾患の病因と進行には、脳エネルギー代謝の悪化、ミトコンドリア機能、およびレドックス不均衡が関係しており、これらの環境要因および遺伝要因は、疾患の特徴的な症状のみならず、個人の概日リズムおよび代謝リズムの変化においても臨床的役割を果たすと示唆されている。
統合失調症は、妄想や幻覚などの陽性症状と、環境からの離脱、回避、愛情の鈍麻などの陰性症状によって特徴付けられる精神疾患である[135]。統合失調症患者を対象に実施された臨床試験では、NACが慢性統合失調症の臨床転帰を改善する安全かつ効果的な補助療法であることが示されている[68,69,136]。
多施設共同試験[68]では、抗精神病薬による治療に伴う1日2000mgのNACの経口補給の安全性と有効性を評価し、NACによる治療が臨床的全体印象(CGI)スケールおよび陽性・陰性症候群尺度(PANSS)によって測定される臨床的重症度を軽減する、中程度の利益を示すことが示された。さらに、Sepehrmaneshら(2018)[69]は、1200mgのNACの投与が、認知パフォーマンスの改善とともに、PANSSで分析した陽性、陰性、一般、総合の精神病理症状にプラスの影響を与えることを示した。また、メタアナリシスでは、NACを24週間以上投与すると、統合失調症の症状が改善されるとともに、ワーキングメモリの認知領域が改善されることが支持されており、そこでは、1日の投与量の範囲が600mgから3600mgである研究があった[70]。
他の臨床研究では、N-methyl-d-aspartate(NMDA)受容体のグリシン再取り込みを介したグルタミン酸系神経伝達を統合失調症の症状改善の治療標的として、NAC補給の効果を分析している[137,138,139,140]。グルタミン酸は脳内の興奮性神経伝達物質であり、その生理的制御の機能不全が統合失調症などの神経精神疾患の発症に寄与することが知られている。これらの受容体を遮断することで、統合失調症の症状、認知障害、神経生理学的指標を再現できることを示す証拠がある[141]。NMDAは酸化還元反応に敏感な受容体であり、酸化ストレスの増加によって阻害される。したがって、GSHの前駆体としてのNACの役割は、酸化還元系を調節し、NMDA受容体の機能を有利にすることである[142]。
実際、血液、死後サンプルの脳脊髄液における酸化ストレスの増加、グルタチオン系における特定の欠損(調節されていないGSHレドックス、GSHペルオキシダーゼ、GSHレダクターゼ酵素)は、統合失調症の病態生理と密接に関連し、関連することにより、病因病理、さらに症状の悪化から機能的帰結へとつながる[143]。標準治療(抗精神病薬、気分安定薬、および/またはベンゾジアゼピン)を受けている統合失調症患者における2700mg/日のNACの6カ月間の補給の影響を評価することを目的とした無作為化臨床試験では、補給は症状および機能の結果を改善できなかったが、脳内のグルタチオンのレベルおよび神経認知(すなわち処理速度)が増加し、GSH過酸化酵素活性の血中増加もあったことが確認されている[71]。
気分障害の中でも、BDと大うつ病性障害(MDD)は、最もよく見られる疾患である。BDについては、ミトコンドリア機能障害がその病態に関与していることが文献から示唆されている。したがって、ミトコンドリア機能に影響を与える介入は、BDの抑うつ症状の臨床的改善に作用する可能性がある。しかし、181人の参加者を対象に実施された無作為化プラセボ対照臨床試験では、BDと抑うつ症状を持つ患者において、NAC単独または他の抗酸化物質と組み合わせた2000mg/日の補給によるこれらの効果を実証することができなかった[72]。
MDDでは、炎症と酸化のプロセスがうつ病の病態生理の一部であるように思われる。炎症マーカー、炎症性サイトカイン、急性期タンパク質、および接着分子は、通常この障害の患者で上昇し、脳の構造的および機能的異常と低い治療反応に関連すると思われる神経炎症に寄与する[144]。NACはうつ病の補助的治療の有力な候補であるが、通常の治療に伴う1000 mg/日(500 mg×2カプセル、1日2回)の経口補給は、プラセボと比較すると、12週間終了時点でMDD(中等度から重症)の個人の治療にプラスの効果をもたらさなかった。しかし、二次解析により、より重症のうつ病患者において、より有望な効果があることが明らかになった[74]。Magalhãesら(2011)[73]は、BD IIの患者(14人)の小さなサンプルにおいて、1000mg/日の経口投与で、治療群の抑うつ症状と躁症状の完全寛解という興味深い結果を実証することができた。
さらに、岸ら(2020)[75]は、双極性うつ病とMDDの症例において、NACを補助治療として評価した臨床試験、無作為化試験、二重盲検試験のメタアナリシスによる系統的レビューを行った際、NACはグローバル臨床印象度スケールのスコアを下げることができたものの、症状の有意な改善は見られなかったと結論づけた。
最後に、ほとんどの精神疾患における補助的な治療戦略としてのNACの使用に関する推奨事項は、まだ限られていることに留意されたい。炎症および酸化ストレスに対する潜在的な効果に関連するMDD患者におけるNAC補給の臨床効果を調査することを目的とした臨床試験が進行中である(ID ClinicalTrials.gov).
4.4.神経変性疾患
NACは、GSHやl-システインの投与とは異なり、血液脳関門を効果的に通過する能力を持ち、脳内のGSHレベルを上げ、抗炎症作用を示し、グルタミン酸に作用するほか、必須神経伝達系に作用するので、神経原性および神経保護性を有する[145]。この薬物のもう一つの側面は、NMDAの調節であり、これが修飾(機能亢進または機能低下)されると、神経学的および精神医学的変化の原因となる[146]。
パーキンソン病、アルツハイマー病、多発性硬化症における酸化的損傷、グルタチオン枯渇、および/またはNMDA受容体の調節障害を考慮すると、パーキンソン病患者では、カタラーゼ活性の低下とともに、高いレベルのRONSマーカー(脂質過酸化物、MDA、スーパーオキシドディスムターゼ活性-SOD)が見いだされた。さらに、MDAはこの疾患のバイオマーカーとして使用され、SODと脂質ヒドロペルオキシドは疾患の後期特性と関連している可能性が示唆されている[147]。
この意味で、GSHを上昇させ、酸化ストレスに作用する代替療法は、NAC補給のようなこれらの疾患の修飾剤としてしばしばテストされる[148]。したがって、パーキンソン病の被験者にNACを単回静脈内投与(150 mg/kg)した研究では、血中GSH/GSSGおよび脳内GSH比の上昇が見られた[76]。同様に、パーキンソン病患者42名に対して、週1回のNAC静脈内投与(50 mg/kg)およびそれ以上の経口投与(500 mg 1日2回)を3カ月間行い、ドーパミン輸送体との結合を脳画像で測定する実験を実施した。その結果、補給は患者のドーパミン作動性システムにプラスの影響を与え、その結果、臨床効果が改善されることが示唆された[77]。しかし、静脈内投与は長期的に持続可能ではないため、パーキンソン病患者に6000mg/日を経口投与した対照臨床試験では、血中抗酸化能(GSH/GSSGおよびカタラーゼ)の増加が観察されたが、静脈内投与と比較した場合、おそらく低い経口バイオアベイラビリティを反映してGSH脳レベルの増加は観察されなかった[78]。
アルツハイマー病では、いくつかの研究でNACの効果が他の物質と関連して評価されたため、NACの補給は、栄養補助食品製剤に関連する将来の薬のためのもっともらしい代替物として使用されている[149]。プラセボ対照臨床試験において、軽度認知障害者は、毎日600mgのNAC(葉酸、α-トコフェロール、ビタミンB12、S-アデノシルメチオニン、アセチル-L-カルニチンと関連)を6カ月間消費し、認知症の評価尺度の改善と認知機能の維持が得られた[79]。
NACの補給は、白質および灰白質病変を伴い、炎症および酸化的損傷が免疫学的に、特にGSHの脳レベルの減少を介して媒介される神経疾患である多発性硬化症(MS)を患っている人々に利益をもたらす[150,151,152]。この観点から、研究では、抗酸化剤の介入は、この疾患における頻繁な神経変性過程を減衰させることができることが示唆されている[153]。したがって、NACとMS患者との研究では、最大50mg/kg(週1回)の静脈内投与および最大1000mg/日(週6回)の経口投与後に、脳糖代謝、認知、および注意力の改善が確認された[81]。別の研究では、無作為化された患者に1250mgのNACを補給したが、多発性硬化症の個人のGSHレベルの変化と同様に、疲労軽減のアウトカムにおいて有意な結果は認められなかった[80]。
したがって、神経変性疾患におけるNACの効果を、代謝レベル、投与量、投与頻度、投与経路、臨床マーカーの機能として理解するために、さらなる研究が必要である。
4.5.肝疾患
急性および慢性の肝疾患は世界中で非常に多く、罹患率および死亡率の重要な原因となっている[154]。酸化ストレスは、これらの疾患の病因において重要な因子であり、肝臓の線維化反応に関与し、その進行を刺激している[155]。肝疾患における炎症および酸化ストレスの調節におけるNACの有効性は、肝障害の軽減におけるNACの抗酸化および抗炎症の役割を評価した実験および臨床研究の幅広い系統的レビューを通じて、すでに分析されている[9]。
NACはパラセタモール中毒の治療薬として安全かつ有効な薬剤として広く受け入れられている。その病態はすでによく理解されており、肝毒性代謝物であるN-アセチル-p-ベンゾキノンイミン(NAPQI)の過剰産生による肝臓への毒性作用が関与するが、通常の状態では肝GSHによって容易に不活性化される。しかし、中毒の場合、GSHが枯渇し、NAPQIが臓器に蓄積され、細胞傷害や死亡を引き起こす。NACの機能は、GSHのストックを補充し、損傷した肝臓への酸素のより大きな供給に寄与することである[84,156]。
最近、欧米で最も多い重症急性肝障害の原因であるパラセタモール中毒のエピソードに直面して、臨床診療に役立つ最新のエビデンスに基づくガイドが専門家によって作成された(Box 2)。新ガイドラインでは、NACを2袋(200mg/kgを4時間、100mg/kgを16時間)静脈内投与した場合、従来の推奨量(3袋)と同等の効果があり、副作用を大幅に軽減できる利点があるとしている。また、プロトコルでは体重制限を110kgとし、NAC静注の最大投与量を1回目22g、2回目11gに相当する量とした[82]。
Box2
パラセタモール中毒の治療に関する現在の推奨事項
| パラセタモール中毒の管理 |
| アセチルシステイン2袋の標準的なレジメンを新たに推奨ab |
| 初回注入 |
|
| 2回目のNAC注入 |
|
| 継続的なNAC投与が必要な場合は、2回目の点滴の速度(すなわち、100mg/kgを16時間以上)で継続する。パラセタモールを大量に摂取した場合は、より高い点滴速度(すなわち、16時間で200mg/kg)が必要な場合があり、臨床毒性学者に相談する必要があるc。 |
| b成人(14歳以上)には、110kgを上限として、10kg未満を切り上げた実体重を基に投与すること。c急性摂取後の初期パラセタモール濃度がノモグラムラインの2倍以上の場合、アセチルシステインの投与量を200mg/kg(最大22g)に増やし、ブドウ糖5%1000mL(子供、14mL/kgから1000mLまで)または塩化ナトリウム0.9%1000mL(子供、14mL/kgから1000mL)を16時間かけて静注する。Chiewら(2020)[82]から引用した。 |
パラセタモール中毒と同様に、他の薬物や漢方薬、栄養補助食品も急性または慢性の肝障害を引き起こすことがある。パラセタモール以外の薬物によって引き起こされる肝障害には、直接的、免疫介在的、およびミトコンドリア細胞障害も含まれるが、肝毒性の根底にあるメカニズムは、GSH枯渇を伴わず、依然として不明である[83,84]。それでも、NACはこのような状況において、酸素供給を最適化し、全身の血行動態を改善することにより、有益な効果を発揮することが疑われている[83]。
ある前向き研究では、NACの静脈内投与(1時間かけて150mg/kg、その後4時間かけて12.5mg/kg/h、残りの67時間は6.25mg/kg/hの持続点滴)を行った急性肝不全患者の生存率が著しく改善し、死亡率も低く、入院期間も短かった[80]。別の研究では、パラセタモール以外の薬物による肝障害の患者において、NACの72時間静脈内注入の使用に関連する有益な効果を実証できなかった[81]。
パラセタモールに起因しない急性肝不全の患者に、入院直後にNACを静脈内投与すると、脳症、入院、集中治療室への入院、他の臓器の不全が減少するのに加え、死亡率と肝移植の必要性も減少する[157]。これらのデータを裏付けるように、最近のメタアナリシスでも、NACはパラセタモールと無関係の急性肝不全患者の生存率、無移植生存率、移植後生存率、入院期間を改善すると結論づけている[158]。
非アルコール性脂肪性肝疾患(NAFLD)は、遊離脂肪酸の肝流動が増加し、細胞内の抗酸化活性が抑制されると同時に酸化ストレスが増加するため、単純な脂肪症として現れるか慢性肝障害に進行する。実験的研究からの証拠は、NACが肝脂質の蓄積をブロックし、IL-6およびIL-1β、TNF-α、およびNF-κBなどの炎症性マーカーを減少させることを明らかにしている[159]。
NAFLD 患者の肝機能におけるNAC 補給を解析した臨床研究はまだ限られている。Khoshbatenら(2010)[85]は、NAC(600mg、12時間)の3カ月間の経口投与により、NAC投与群ではビタミンC投与群と比較してアラニントランスアミナーゼ値および脾臓サイズが減少したことを示した。この研究は、脂肪浸潤の減少が脾臓の縮小に関連している可能性を示唆しており、これらの人々をより長くフォローすることがより良い結果をもたらすと思われた。
アルコール性肝炎において、プレドニゾロン28日間経口投与とNAC5日間点滴静注(1日目:150,50,100 mg/kgをそれぞれ250,500,1000 mLの5%ブドウ糖溶液で30分,4時間,16時間かけて投与,2~5日目:100 mg/kgを1000 mLの5%ブドウ糖溶液で投与)を組み合わせて行ったところ、6カ月後の患者の生存率は改善しなかったが、重症アルコール性急性肝炎の併用療法では、1カ月後の生存率の改善が認められた。1日あたり100mg/kgを5%ブドウ糖溶液1000mLで投与)では、6カ月後の患者の生存率を改善しなかったが、重症急性アルコール性肝炎の併用療法では、プレドニゾロン単独投与患者と比較して、1カ月後の生存率の改善が証明された[86]。別の研究でも、重症急性アルコール性肝炎の患者において、経腸栄養支持に伴う高用量(500mL/日に調整した5%ブドウ糖で希釈したNAC 300mg/kg)のNAC静脈内投与を用いることの有益性を示すことができなかった[87]。その意味で、NACの肝障害に対する潜在的な効果を明らかにするために、より多くの臨床試験が必要である。
4.6.腎臓の病気
急性腎障害は、心臓手術後の患者に頻繁に現れる症状であり、特に血行動態因子、腎毒性薬剤、および炎症を含む多因子病態を呈している。したがって、NACは、手術に関連する急性腎障害のリスクを低減するための代替周術期治療として使用される[160,161]。メタアナリシスでは、心臓手術を受ける慢性腎臓病患者にNAC(150mg/kg~1200mg)を静脈内投与することで、急性腎障害および心臓の有害事象の発生を有意に低減できることが明らかにされた[88]。しかし、NACの周術期投与が心臓手術に伴う急性腎障害のリスクを低減するかどうかを評価することを目的としたメタ解析を伴う別の系統的レビューでは、心臓手術に伴う急性腎障害のリスクの発生、血清クレアチニンの変化、院内死亡率において、両群で同様の割合が観察された。したがって、著者らは、NACの周術期投与は、心臓手術に伴う急性腎障害のリスク低減のための代替手段としては推奨されないと結論づけた[162]。
一方、ステージ5の慢性腎臓病患者において、血液透析セッション中に、5%グルコースで5000 mgのNACを最終容量50 mLで静脈内投与すると、反応性充血時の血管反応圧を著しく改善するのに十分であった[89]。さらに、ステージ3の慢性腎臓病患者において評価したところ、600mgのNAC経口補給は、血清クレアチニンまたはシスタチンCを変化させることができなかった[90]。
最後に、腎臓病と診断された患者におけるNACの使用の可否については、研究の質、用量の標準化、理想的な投与方法の決定などの理由から、現在のところコンセンサスやガイドラインは確立されていない。消化器疾患。
4.7.消化器系疾患
消化器疾患は頻度が高く、その治療は今日の大きな課題となっている。そのため、NACはストレス、感染、炎症の過程で抗酸化剤として作用することから、ヘリコバクター・ピロリ感染症、大腸がん、炎症性腸疾患(IBD)など、さまざまな消化器系の臨床症状において広く使用されている。
ヘリコバクター・ピロリ感染は、環境、行動、遺伝的要因と密接に関連し、世界中で最も頻度の高い感染症の1つである[163,164]。定着すると、細菌は粘膜バリアを破って胃の上皮に付着し、一酸化窒素および活性酸素種(ROS)を産生することにより、局所的な炎症反応を開始する[165]。炎症が持続すると、慢性胃炎、胃がん、消化性潰瘍などの病態につながる可能性がある[166,167,168]。
NACは、Helicobacter pyloriの毒素によって引き起こされる胃粘膜の酸化ストレスと炎症活性を減少させるだけでなく、細菌が酸性環境での生存と抗生物質の作用からの保護のために形成するバイオフィルムの形成と破壊を防ぐメカニズムを持つことが研究で示され、抗生物質の補助治療の試みで徐々に使用されている[169,170]。
したがって、NACを補充しない治療法と比較して、異なる抗生物質レジメンにNACを追加すると、細菌の根絶率が高まる可能性があることが研究で示唆されている[91,92]。したがって、この仮定を補強するものとして、NACは、ヘリコバクター・ピロリによる初感染または軽度感染を有する個人において、細菌のコロニー形成を減少させ、胃炎を予防する上で有利な効果を有することが観察され、これらの効果は、6週間以内に従来の抗生物質療法に関連してNACの投与後に報告された[171].
しかし、系統的レビューに記載されているように、実施された少数のランダム化臨床試験の結果の基準および詳細が不足しており、ヘリコバクター・ピロリ感染者における抗生物質の使用に関連したNACの適用性の安全性および有効性に関する情報の正確性を阻害している[172]。このメタアナリシスの結果を裏付けるように、第一選択の3剤併用療法に伴うNACの使用を評価することを目的とした後の研究では、2つの治療レジメンに伴う場合、菌の除菌率に対する相加効果は報告されなかった[173]。
大腸がんとの関連では、がん細胞に共通する酸化的損傷に対するNACの保護的役割の可能性が指摘されており、NACによる長期(7日以上)の薬剤管理は、ニトロチロシンおよび8-oxoGによって引き起こされる損傷を減らすことによって、大腸粘膜を保護し、大腸炎に伴う大腸がんの発生を低減することができる[93]。同様に、腹部の大手術を受けた消化器癌患者におけるNAC投与の効果が評価され、それによって、手術の2日前から術後5日まで、1200mg/日のNACを概略非経口栄養法で提供することは、MDAおよび尿中硝酸塩を減少させ、また還元グルタチオンと酸化グルタチオンの比率(GSH/GSSG)を改善できた[94].同様に、無作為化臨床試験において、NAC(800mg/日)の化学予防作用は、大腸上皮の過増殖を抑制することにより、大腸癌における薬剤として確認された[95]。
また、炎症と酸化の状態にあるIBDは、GSHプールの補充とGSH/GSSG比の増加の観点から、NACの投与が有効であると考えられる。したがって、クローン病と診断された患者を対象とした研究において、NACは、GSH/GSSG比を増加させることによって、分泌されたときの活性に直接効果を発揮することに加えて、メタロプロテイナーゼ-2とメタロプロテイナーゼ-3の分泌(これらは上昇すると、疾患の重症度に直接関係し、上皮バリアの変化に寄与することがある)を抑制できることがわかった[174,175]。同様に、潰瘍性大腸炎患者における治療は、臨床パラメータ(便の頻度と硬さ、夜間便、目に見える便中血液、便失禁、腹痛、腹部圧痛、および止瀉薬の必要性、Modified Truelove-Witts Severity Indexによる評価)および血清炎症性サイトカインの減少の著しい改善を示した[96]。
さらに、NACの補給は、正しく行われた場合、特に高齢者において遠位腸閉塞症候群を改善できる可能性を示唆する証拠がある;しかしながら、用量、投与経路および安全性を評価するために、より多くの研究を行う必要がある[176,177]。
腸管バリアが損傷すると、細菌感染症、自己免疫疾患、全身性炎症などの疾患に直接関連する可能性がある。したがって、NACは、炎症状態において、腸管接合部の解離を誘発し、したがって腸管バリアを損なう原因となる、マイトジェンおよび細胞Src(c-Src)により活性化されるタンパク質キナーゼを不活性化することによって、腸管バリアを回復する役割を果たすことができる[178]。
したがって、結果は有望であるものの、NACを使用するのに十分な証拠がないケースもあり、より確実で信頼できる研究が必要であるという論争が残っている。
4.8.感染症
NACは、酸化ストレスや炎症のメディエーターを減少させることで、様々な感染症の治療への応用が確認されている。NACによる改善効果については、Wangら(2008)[97]によるエビデンスでは、重度のB型慢性肝炎と診断された患者において、その補充(8000mg/日)が総ビリルビンおよびアミノトランスフェラーゼを減少させ、プロトロンビン活性を増加させることができた。同様に、急性ウイルス肝炎の患者でその効果を評価すると、移植不要生存期間の改善と死亡率の低下が観察されている[157,179]。
この観点から、NACはその抗酸化活性に加えて、結核菌に感染したヒトマクロファージの抗菌活性を高めることができた[180]。したがって、肺結核と診断された患者にNAC(600 mg/日)を補給すると、痰が有意に減少し、放射線反応、血清グルタチオンペルオキシダーゼレベル、免疫反応も改善した[98]。
SARS-CoV-2に罹患した患者におけるNACの効果を、予防的またはアジュバントとして評価するための新たな研究が行われている。したがって、NACは、アンジオテンシンII変換酵素の増悪した産生をブロックし、ウイルスの細胞への侵入を制限し、さらに酸化ストレスと炎症(特にNF-kBの活性化を抑制)に関与し、これらの患者の肺疾患の重症度をおそらく低減するメカニズムであろうと考えられている[181,182,183]。現在、COVID-19に処方された治療法に関連する6000mg/日のNACを補充した患者を対象とした臨床試験が実施されており、これは、集中治療室(ICU)から正確に抜管および/または移された患者の数および臨床経過により退院した患者の数を定量化することを目的としている(ID[99]。
しかしながら、重症のCOVID-19と診断された患者を対象とした第III相対照無作為化臨床試験では、標準治療と並行してNACの静脈内補充が行われており、著者らは、NACが粘液溶解効果を発揮することに加え、その抗酸化作用によって患者の回復に役立つと考えている(IRCT20200509047364N3、Iranian Registry of clinical trialsにて)[184]。
絨毛膜羊膜炎は、細菌感染による羊膜と絨毛膜の急性炎症を特徴とする妊娠中の合併症の一つである。この疾患の特徴的な条件であるサイトカインストームと酸化ストレスに関連して、新生児の重大な脳損傷、脳室周囲白質軟化症、脳性麻痺を伴う[100,185]。NACの胎児および新生児神経保護としての可能性を考慮し、妊娠中および産後の母子二重盲検試験(母親11名、新生児12名)を実施し、胎盤移行に加えて絨毛膜羊膜炎妊婦とその子供に対するNAC静脈内投与の薬物動態(PK)を評価した。その結果、妊婦では非妊婦に比べ、NACのクリアランスが速いことがわかった。NACの胎盤移行も速く、胎児クリアランスの速度は遅かったことから、NACは脳炎のリスクの高いこれらの新生児に対して出生前治療の可能性を持っていることが示された[100]。
同じ研究グループが、絨毛膜羊膜炎の臨床診断を受けた妊婦22名と新生児24名(双子2組を含む)を対象とした前向き二重盲検試験で、産前産後の母子群におけるNACの安全性を評価しようとしたものである。この研究では、出産前の女性にNAC(100mg/kg/回)または生理食塩水を投与し、出産まで6時間ごとに静脈内投与した。治療群の新生児には、母親の最終投与から6時間後にNAC(早産児:12.5mg/kg/回、成熟児:25mg/kg/回)を投与し、12時間ごとに5回投与した。本試験では、有意な副作用はなく、母子ともに有益な結果を示した。NACを投与された新生児では、主要脳血管間の正常な脳血管結合が回復し、炎症性血管内皮増殖因子(VEGF)が減少し、抗炎症サイトカインIL-1受容体拮抗物質(IL-1Ra)が増加した。治療された女性はまた、炎症における内皮の活性化と白血球の採用に関連するサイトカインの低レベルを示した[185]。
また、早産を含む新生児の有害事象の重要な原因である感染症および/または子宮内炎症(トリプルI)と診断され、早産のリスクを有する妊婦67名を対象にプラセボ対照臨床試験を実施した。妊婦は、NACのローディング用量(150 mg/kg)を1時間で投与した後、NAC(50 mg/kg)を4時間持続注入し、その後16時間または出産までNAC 100 mg/kgを注入するプロトコルと、プラセボ群に水中ブドウ糖(5%)を注入するプロトコルに従った。この研究は、母体内NAC注入が、1分と5分のApgarスコアを改善し、陽圧換気による蘇生の必要性を減らすことに加えて、死亡率と気管支肺異形成などの重度の新生児病変を減らすために実行可能で安全で有効であることを示している[101]。
15歳未満の小児において、通常、尿路感染症の原因菌によって引き起こされる腎臓の感染症である急性腎盂腎炎の治療案として、NACをプラセボ対照臨床試験で使用した。体重30kg以上の小児には900mg/日、体重8.5kg以上30kg未満の小児には600mg/日、体重8.5kg未満の小児には70mg/kg/日という計画で、体重に応じて5日間NACを経口投与した。この研究では、これらの患者におけるNACの使用に関連する利点は示されなかった。著者らは、NACの短期間の投与は、この状態に存在する炎症性バイオマーカーの減少を引き起こすことができないことを示唆した[102]。
4.9.がんの予防と治療
NACは、その重要な薬理学的および生物学的活性により、ある種の癌の予防および治療における薬剤として研究されてきた。したがって、NACは、がん敵対性を低減し、がん細胞のアポトーシスを増加させ、異化、ミトコンドリア機能障害、炎症メディエーター、および酸化ストレスを低減するための抗がん剤として広く研究された[46]。
酸化ストレスは、ストローマ腫瘍細胞において解糖および異化状態を引き起こし、その中で乳酸などの異化物が放出される[186]が、代謝の不均一性によって癌細胞のミトコンドリア代謝を支えることになる。したがって、この不均一性は、がん細胞の増殖を増加させ、アポトーシスを減少させ、転移を伴うより大きな腫瘍を刺激する[187,188]。
Wonら(2020)[103]は、NACによる吸入療法が放射線療法を受ける患者のQOLを改善するかどうかを評価するために、前向き対照多施設研究を開発した。参加者は10施設で確認された頭頸部がん患者で、実験グループは1日2400mgのネブライザーの液体NACを、放射線治療開始から8週間にわたって吸入した。この研究では、薬剤の吸入に伴う副作用は認められず、主な知見は、対照群と比較して実験群では治療後1カ月までの鎮痛剤の使用量が大きく減少し、患者のQOLが改善したことである(p=0.014)。それでも、口腔乾燥などの症状は、実験群で有意に改善された(p= 0.019)[103] ;同様のデータは、放射線治療の前後に2500mg/日のNACによる口腔洗浄を受けた患者に、唾液の肥厚と口腔乾燥の改善を認めた無作為臨床試験でも確認されている[104] ;。
頭頸部がん患者を対象とした無作為化臨床試験において、NACの経鼓膜注射は、曝露前に適用するとシスプラチンによる耳毒性を防ぐことができることが明らかになり、この保護効果はNACがシスプラチンの分子と結合してフリーラジカルを捕獲する反応であると認めた[189]。
酸化ストレスは、乳がんで頻繁に上昇する異化のマーカーである間質モノカルボン酸トランスポーター4(MCT4)の発現を誘導し、がん関連間質異化物が高増殖がん細胞へ輸送されることが示唆される。したがって、NACはグルコースが変化した細胞を好む傾向があることから、MCT4が高濃度に存在する細胞は、本剤の影響を受けやすいと理解される。このように、パイロットスタディでは、NACが乳癌において安全性と生物学的活性を発現し、細胞の増殖とMCT4の発現を減少させることが暴露された[190]。
しかし、胃がんを早期に発見することは、効果的な治療と死亡率の減少のために非常に重要である。NACは、分子間の結合を破壊して粘液の除去を助けることにより直接作用し、この種の検査における障害の1つである粘膜表面上の粘液の高い存在を制限するので、上部消化管内視鏡検査の前投薬として、その有効性と費用対効果が証明されている[191,192]。
要約すると、いくつかの研究によると、NACの補給は、さまざまな種類のがんにおいて、がん細胞の増殖、移動、および浸潤を減少させることができる[193,194]。したがって、NACは、がんの治療および予防における将来の治療法として有望な戦略であり続けている。
4.10.その他の条件
上記の状況に加え、NACは、物質乱用障害、自閉症スペクトラム障害、皮膚疾患(I型ラメラ魚鱗癬、水疱性モルフェア、全身性硬化症、中毒性表皮壊死症、アトピー性皮膚炎、ニキビ)、創傷治癒、インスリン抵抗性、子癇前症、鎌形赤血球貧血などの状況でも使用可能である[195]。
一般に、NACは薬物使用障害の治療に有望な薬剤として作用し、一方、本剤は側坐核からの前頭葉グルタミン酸の伝達を回復させ、再発を抑制する能力を有することが研究により示されている。さらに、禁煙の補助治療におけるNACの有効性を検討した無作為化臨床試験では、第一選択治療に関連するNAC(1800mg)は、呼気一酸化炭素を有意に減少させることができた(p< 0.01);介入群では、離脱症状、うつ、不安は認められず、水溶性腫瘍壊死因子2受容体のレベル(sTNF-R2)が著しく減少したことがわかった[105]。
さらに、グルタミン酸の細胞外調節に関与することから、グルタミン酸作動性障害と酸化ストレスが自閉症スペクトラム障害に関連していると思われることから、NACは自閉症スペクトラム障害の治療においてもっともらしいと思われる。したがって、メタ分析を含む系統的レビューでは、NACの補給によって、自閉症スペクトラム障害の子どもたちの多動性と過敏性が有意に減少し、社会的認知が高まったと評価されている。しかし、著者らは、効果的なNACの推奨を持つために、より多くの研究を実施する必要があることを勧告した[196]。
男性の生殖能力に関して、NACは精子形成と精巣機能に対するポジティブな効果を有しており、これはよく理解されているので、男性の生殖器系における酸化ストレスによって誘発される疾患の治療においてこの薬剤を推奨することができる[197].無精子症の不妊男性50人を対象とした無作為化臨床試験では、NAC 600mg/日を3カ月間経口投与することにより、精子数、運動率、正常な形態が有意に改善されることが示された[106]。
また、鎌状赤血球貧血は、GSHを含む抗酸化系の減少に伴う酸化ストレスの増加と関係があることから、NACは鎌状赤血球患者の治療にも提案されている。あるパイロット研究では、1200mgまたは2400mg/日のNACを6週間経口投与することにより、酸化ストレスのマーカーである赤血球膜のホスファチジルセリンの発現を抑制することができ、NACが鎌状赤血球患者の治療戦略として有益であることが示された[107]。別の第 II 相二重盲検ランダム化臨床試験でも、2400 mg/日までのNAC 経口投与は鎌状赤血球貧血またはサラセミア患者によく耐え、緻密細胞の抑制、GSHのレベルの回復、血管閉塞エピソードの数の減少などの有益な効果をもたらすことが示された[108]。一方、Sinsら(2016)[198]は、プラセボと比較して、鎌状赤血球病患者におけるNAC治療のポジティブな効果を実証することができなかった。しかし、著者らは、参加者のアドヒアランス率が低く、調査結果が損なわれた可能性があると主張している。
子癇前症に関しては、ヒトにおけるNACの補充を評価した文献は2件しかなく、1件は出生時の体重とアプガースコアの増加効果を確認し[109]、他は重症型の早期発症の女性および/またはHELLP症候群(溶血、肝酵素上昇、血小板低下)において疾患の安定化効果を確認[110] している。
妊娠糖尿病については、まだ臨床試験は行われていない。しかし、妊娠糖尿病の雌マウスを用いた実験研究では、妊娠中にNACを投与すると、GSHレベルが上昇し、胎児の心臓のROSレベルが低下し、糖尿病の子孫における先天性心疾患の発生を予防できることが示された。したがって、この研究は、NACの使用が、糖尿病の母親の新生児における先天性心臓障害を予防するための戦略(単独またはインスリンとの併用)となる可能性を示唆した[199]。このような観点から、妊娠糖尿病の女性にNACを経口投与(600mg/1日3回/6週間)した場合の妊娠の結果および代謝プロファイルの解析を目的とした臨床試験がCochrane Central Register of Controlled Trialsに登録されている(ID CN-02170464)。
現在のデータは予備的なものであり、これらの病態におけるNACの関与に関する無作為化臨床試験はほとんどないが、この薬物は治療における有効な選択肢となりうるし、補助的に作用しうる[200]。
メタボリックシンドロームと診断された35名の患者を対象としたパイロット試験において、NACの有効性が評価され、600mg含有錠剤が1日2回、6週間にわたって投与された。その結果、介入群の個体は、恒常性評価モデル(HOMA-IR)によって推定されるインスリン抵抗性パラメータ、高感度C反応性タンパク質(hsCRP)、収縮期血圧、およびトリグリセリドが有意に減少した。したがって、NACは、抗酸化、抗炎症、および血管拡張の経路を通じて、疾患に対していくつかの有益な効果を発揮することができる[111]。
それにもかかわらず、NACは、例えば、眼瞼炎(まぶたのかゆみ、赤み、はれや痂皮を伴う炎症性疾患)の一種であるマイボーム腺の機能障害の場合、眼球の乾燥を生じさせるような、いくつかの眼科疾患において使用されている。そこで、Akyol-Salmanら(2010)[113]は、臨床試験において、この症状を持つ患者における5%NACの目薬の使用を評価し、治療1カ月後、患者はかゆみ、目やに、異物感、目のかすみに著しい改善が見られた。別の臨床試験では、NACの局所使用とステロイド・抗生物質・ベタメタゾン・スルファセタミド・ナトリウムの併用療法を比較し、瞼の衛生と合わせて、NACの投与が、マイボーム腺機能不全の患者においてステロイド・抗生物質の局所併用療法と同等の効果があるようだということが観察されている[114]。さらに、ある無作為化臨床試験では、慢性眼瞼炎患者におけるNACの100mg/日経口投与後に有意な効果が確認され、著者らは、この発見がこの疾患における脂質の過酸化をブロックするNACの効果に起因すると説明している[112]。人工涙液の使用と比較した場合、ドライアイ治療を受けている患者にNACの5%外用製剤を1日4回、2週間投与すると、報告された症状に改善をもたらすことができた[201]。
5.結論
NACは、細胞内のシステインの前駆体として作用し、グルタチオンの枯渇の結果として酸化ストレスに関連するいくつかの疾患において不可欠であるGSHのプールを増加させる。このように、NACは様々な疾患に使用されているが、異なる病態の治療においてNACを効率的かつ幅広く活用することを目指し、適切な投与量および治療プロトコルを明らかにする観点から、さらなる研究が必要である。
資金調達
ブラジルの研究助成機関CNPq(M.C.d.S.T, N.G.G., M.O.F.G. へのフェローシップ), CAPES/RENORBIO/PROAP, INCT-Bioanalítica, FAPEAL/PPSUS, project 60030.0000000192/2021 から資金援助を得たことを感謝いたします。
利益相反
著者は利益相反のないことを宣言している。