Contents
- 概要
- はじめに
- SARS-CoV-2の構造的特徴についての重要な洞察
- SARS-CoV-2によるCOVID-19感染症を軽減するために。現在検討されている戦略
- 主要な治療ターゲット
- SARS-CoV-2による神経学的合併症
- SARS-CoV-2の神経系への侵入経路
- SARS-CoV-2と堅牢なミトコンドリアシステムおよび免疫コンピテンシーはホルミシスに依存する
- SARS-CoV-2による中枢神経系(中枢神経系)と末梢神経系(末梢神経系)への感染のメカニズム
- 間接的侵入
- 直接感染経路
- COVID-19による神経炎症の誘発
- 神経疾患に対するCOVID-19の影響
- SARS-CoV-2に関連した神経系疾患
- SARS-CoV-2と神経細胞障害の動物モデル
- SARS-CoVと中枢神経系研究用モデル
- SARS-CoVと中枢神経系細胞株
- SARS-CoV-2と脳オルガノイドのモデル
- マウスのMHV-CoV感染と神経系の合併症
- COVID-19と神経発達への影響
- 病因に関与するウイルス由来および宿主由来のタンパク質
- ワクチンによるCOVID-19の標的化
- 結論
A Review on SARS-CoV-2-Induced Neuroinflammation, Neurodevelopmental Complications, and Recent Updates on the Vaccine Development
pubmed.ncbi.nlm.nih.gov/34089508/
公開: 2021 年 6 月 5 日
概要
コロナウイルス感染症2019(COVID-19)は、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)を原因とする壊滅的なウイルス感染症である。COVID-19患者の発生率と死亡率は、驚くべき速さで増加している。死亡率は高齢者、特に呼吸困難、心臓異常、腎疾患、糖尿病、高血圧を患っている人で非常に高くなっている。
SARS-CoV-2は、アンジオテンシン変換酵素2(ACE-2)を介してヒトの細胞に侵入し、続いてカテプシンLまたは膜貫通型プロテアーゼセリン2(TMPRSS2)を介してウイルス粒子を取り込むことが既存の証拠で示されている。
SARS-CoV-2が媒介する異常、特に心血管や神経系の異常、凝固系の損傷については、より良い治療法を開発するための広範な研究が必要である。SARS-CoV-2は、そのS-proteinを用いて複数の臓器の宿主細胞に侵入するため、ウイルスのS-proteinはワクチン開発の理想的なターゲットであると考えられている。
この総説では、現在、様々な臨床段階にある様々なワクチンの開発につながる画期的な発見に焦点を当てることを試みた。また、COVID-19の負担を軽減するために試験が行われている様々な薬剤候補についても簡単に説明している。さらに、SARS-CoV-2感染が神経細胞の炎症や神経細胞の障害に与える影響についても、専用のセクションで議論した。
以上、本稿で取り上げた内容が、COVID-19の病態生理やSARS-CoV-2感染による神経細胞の合併症への影響を理解するのに役立つとともに、ワクチン開発の最新情報を提供することが期待される。
はじめに
コロナウイルス(CoV)は、コロナウイルス科、コロナウイルス亜科に属するRNAウイルスである。動物や人間に広く分布し,呼吸器系,腸管系,肝臓系,神経系の疾患を引き起こす[1, 2]。現在、SARS-CoV、SARS-CoV-2,hCoV-229E、OC43,NL63,HKU1がヒトの間でパンデミックしており、軽度で自己限定的な上気道感染症を引き起こしている[3]。重症急性呼吸器症候群コロナウイルス(SARS)-CoVと中東呼吸器症候群コロナウイルス(MERS)-CoVは,過去20年間に2つの高病原性CoVとして出現した[4]。感染力の高いSARS-CoV-2の発生は、現在、世界的にパンデミック感染を引き起こしているコロナウイルスの亜種である。SARS-CoV-2に感染すると,COVID-19と呼ばれる重篤な呼吸器疾患を引き起こし,3~14日の潜伏期間の後,発熱,咳,肺炎,発声障害,時折の下痢などの症状を伴う[5, 6]。2021年4月6日現在、全世界でCOVID-19感染症による1億3,180万人以上の確定症例と280万人以上の死亡が報告されている(https://www.who.int.)。
SARS-CoV-2の構造的特徴についての重要な洞察
SARS-CoV-2は、直径65~125 nmのウイルスで、エンベロープ表面にはクラブ状のスパイクがある。ウイルスにはらせん状のヌクレオカプシドが含まれており,このヌクレオカプシドには27〜32kbpの1本の正鎖RNAが結合している[7, 8]。SARS-CoV-2のゲノムを系統的に調べると,コウモリで報告されている他のβ型コロナウイルスとの相同性が明らかになった。SARS-CoV-2は、SARS-CoVと79%、MERS-CoVと50%の類似性を持っている[9]。SARS-CoV-2のゲノムには,14個のオープンリーディングフレーム(ORF)が含まれている[10]。ORF1a/ORF1abは5′端に位置し,PP1aとPP1abという2つのポリペプチドをコードしている。蛋白質分解によるポリペプチドは,非構造タンパク質(Nsp 1-16)をコードし,ウイルスの複製と転写に必要なレプリカーゼとトランスクリプターゼの複合体を形成する[11, 12]。3′の他の13個のORFは,4つの主要な構造タンパク質と9つの推定上のアクセサリー因子をコードしている。構造タンパク質には,スパイク(S)タンパク質,ヌクレオカプシド(N)タンパク質,膜(M)タンパク質,エンベロープ(E)タンパク質が含まれ,これらはウイルスの組み立てと感染に必須である[13](図1)。”Sタンパク質は、宿主のさまざまな受容体と効率的に相互作用し、宿主細胞表面へのウイルスの付着を促進し、宿主細胞へのウイルスの侵入を仲介する。”M “タンパク質は、ウイルスをそのままの形で維持する[14]。”E “タンパク質は、最小の構造タンパク質で、ウイルスの病原性、ウイルスの組み立て、宿主細胞内でのウイルスの放出に重要な役割を果たしている[15]。”N “タンパク質は、RNA基質、転写調節配列、ゲノムパッキングシグナルと相互作用し、病原性に重要な役割を果たしている[16, 17]。オープンリーディングフレームにコードされている他の必須構造タンパク質およびアクセサリータンパク質は、ヘマグルチニン・エステラーゼ・タンパク質、3a/bタンパク質、4a/bタンパク質である[8]。最近の研究報告によると,SARS-CoV-2のゲノムには多くの変異が確認されており,ウイルスが新しい宿主に適応する能力を獲得していることを示唆している。SARS-CoV-2の感染能力の向上は、NSP2およびNSP3分子の変異によってもたらされたと考えられている[18]。
図1 SARS-CoV, MERS-CoV, SARS-CoV-2の構造とゲノム構成
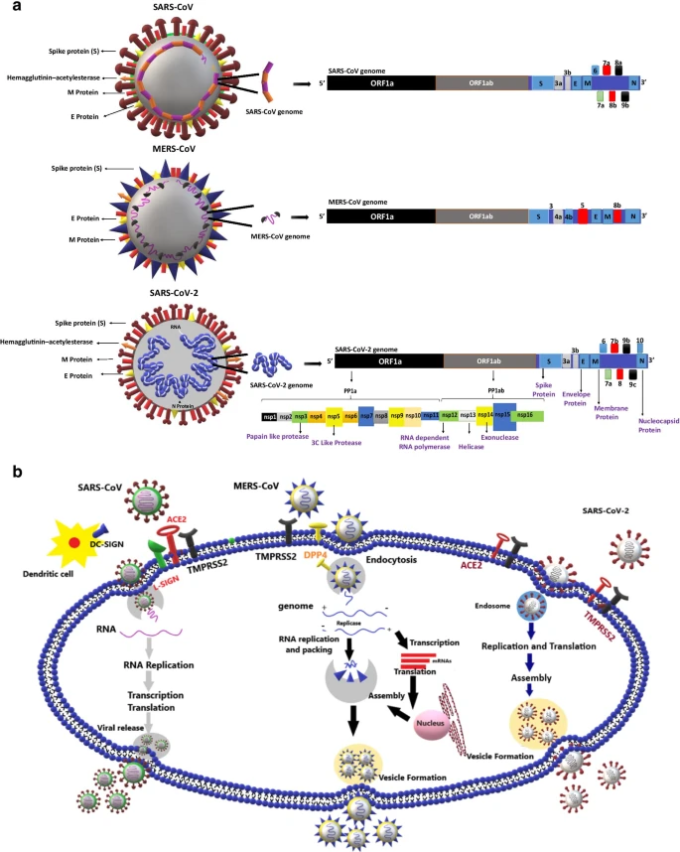
SARS-CoV-2のゲノムには、スパイク(S)タンパク質、ヌクレオカプシド(N)タンパク質、膜(M)タンパク質、エンベロープ(E)タンパク質の4つの主要なタンパク質がコードされている。また,ORF3a,ORF6,ORF7a,ORF7b,ORF8,ORF10の6つのオープンリーディングフレーム(ORF)とポリプロテインORF1abには,ウイルスが宿主細胞に効果的に侵入するために必要ないくつかの酵素タンパク質がコードされている。 b SARS-CoV,MERS-CoV,SARS-COV-2の宿主細胞受容体と複製機構:CoVのスパイクタンパク質は宿主細胞の受容体と相互作用して侵入する。ACE-2は、SARS-CoVとSARS-CoV-2の受容体として機能する。DC-SIGNとL-SIGNは、SARS-CoVの共同受容体として機能する。DPP4はMERS-CoVの受容体として機能する。CoVは宿主の中で増殖し、細胞にダメージを与え、さらなる合併症を引き起こす
SARS-CoV-2によるCOVID-19感染症を軽減するために。現在検討されている戦略
SARS-CoV-2の標的タンパク質に対するいくつかの分子の有効性については、基礎研究、臨床研究、公衆衛生研究で報告されている。また、いくつかの免疫調整剤や薬剤の再利用戦略がSARS-CoV-2に有効であると報告されているが、それらの使用は副作用や全身毒性によって制限されていた。例えば、ACE-2を阻害する抗マラリア薬であるヒドロキシクロロキン( ヒドロキシクロロキン)の投与は、SARS-CoV-2による障害に対して有効であることが証明されている。しかし、 ヒドロキシクロロキンを用いた単剤治療は不成功に終わったことが報告されており、そのため、COVID-19症例を治療するために ヒドロキシクロロキンと他の薬理学的薬剤を組み合わせた戦略が現在検討されている[19]。また、いくつかの新規低分子阻害剤(NSMI)umifenovir、レンデシビル、nitazoxanide、favipiravir、ritonavir、lopinavirなどの抗ウイルス剤、インターフェロン(IFN)抗サイトカイン薬、抗凝固剤、受動的抗体療法が、現在、臨床開発のさまざまな段階で試験されている(表1)[19]。
表1 SARS-CoV-2感染症におけるACE-2受容体とS-protein相互作用を標的とした治療戦略
主要な治療ターゲット
SARS-CoV-2と宿主細胞との相互作用
アンジオテンシン変換酵素2 (ACE-2)
ACE-2は、亜鉛依存性のメタロカルボキシペプチダーゼ外酵素であり、SARS-CoV-2が宿主細胞に侵入する際の重要なメディエーターであることが報告されている[39]。ACE-2は、精巣、心血管上皮、心筋細胞、心筋線維芽細胞、腎臓、肝臓、腸、脳、肺の上皮細胞の極性細胞の頂膜に存在している[39,40,41,42,43]。ACE-2は,ACE(アンジオテンシン変換酵素)と40%の相同性を持つI型の膜タンパク質である。レニン・アンジオテンシン系(RAS)の重要な役割を担っている[44]。ACEは、アンジオテンシンIをアンジオテンシンIIに変換することでRASを活性化する。アンジオテンシンIIの活性化は,Gタンパク質共役型受容体(GPCR)の一種であるアンジオテンシンIIタイプ1受容体(AT1R)およびアンジオテンシンIIタイプ2受容体(AT2R)との選択的な相互作用を介して行われる。しかし,ヒトCoVの侵入におけるACEの役割を明らかにするには,さらなるデータが必要とされている[44]。
ACE-2は、コロナウイルス(NL63およびSARS-CoV)の細胞内受容体として機能し、ウイルスの肺への侵入を促進する[45, 46]。蛍光プローブを用いた研究では、SARS-CoV-2も同じACE-2受容体に作用して宿主細胞に侵入することが確認されている[47, 48]。ACE-2は、N-末端のペプチダーゼドメインとC-末端のコレクトリン様ドメインが結合し、1本の膜貫通ヘリックスと約40アミノ酸残基の細胞内セグメントで構成されている[49, 50]。ACE-2のペプチダーゼドメインは,アンジオテンシンIIをアンジオテンシン(1-7)に切断し,Gタンパク質共役型のMas受容体と結合して機能する。ACE-2-アンジオテンシン-Mas受容体軸は、調節作用を媒介し、ACE-アンジオテンシンII軸の作用に拮抗し、結果的にRAS活性化の有害な影響から肺および心血管系を保護する[51,52,53]。
肺では、ACE-2は肺内皮、I型およびII型肺胞上皮細胞、平滑筋細胞に発現している[41]。いくつかの研究では、ACE-2のダウンレギュレーションが、血管伝染性の変化、浮腫の増加、肺への好中球の蓄積を伴う肺疾患の発症および進行に寄与し、呼吸不全や死に至ることが報告されている[52]。SARS-CoV-2のスパイク(S)タンパク質は,ACE-2と結合し,ディスインテグリンおよびメタロプロテアーゼ-17を活性化することで,ACE-2の脱落を誘発する[54](図2)。S1サブユニットは受容体結合ドメインを持ち,ACE-2に結合すると,ウイルスが宿主に付着しやすくなるような構造変化を起こす[55].Sタンパク質のS1サブユニットは、膜貫通型セリンプロテアーゼ2(TMPRSS2)やpH感受性エンドソームプロテアーゼであるカテプシンBおよびLによって、S1/S2部位およびS2部位でプライミングを受ける。S-proteinプライミングは、SARS-CoV-2の宿主への侵入を媒介し、ウイルスエンベロープと宿主細胞膜の融合によりエンドサイトーシスを誘発する[33, 56, 57, 58]。SARS-CoV-2のACE-2受容体への結合親和性が高まっているのは、SARS-CoV-2のS-proteinをコードする遺伝子にN501Tの突然変異が1つあるためで、この病気が他の臓器に感染する可能性が高くなっている[59]。
図2 肺におけるSARS-CoV-2とACE-2受容体との相互作用
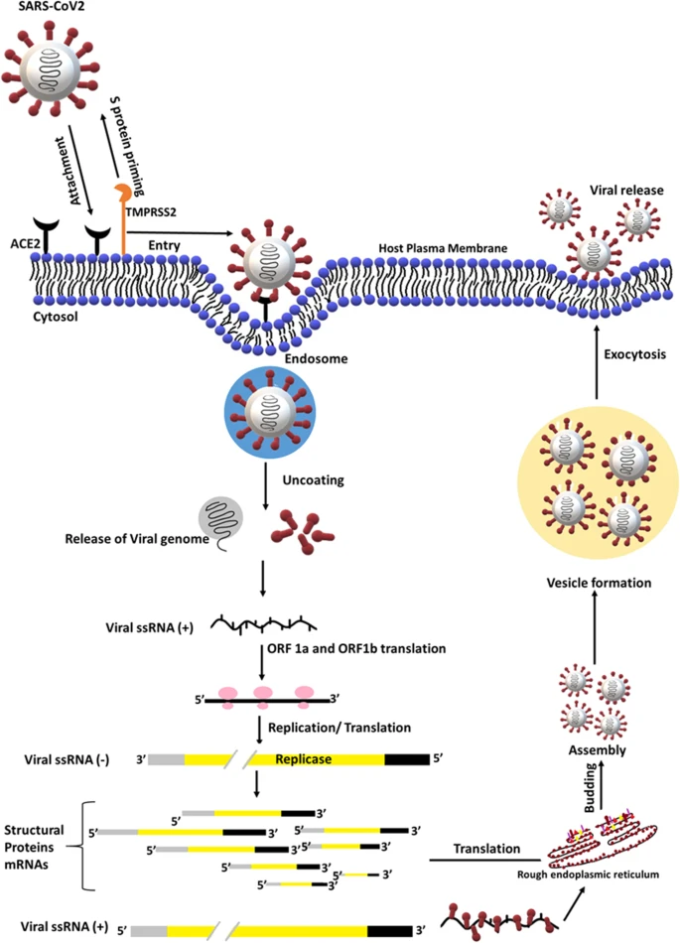
エラスターゼなどのリソソームプロテアーゼや細胞表面プロテアーゼTMPRSS2は、ACE-2受容体を介して膜融合のためにSARS-CoV-2のS-proteinの活性化を誘導する可能性があり、その結果、エンドソーム形成、複数のビリオンの複製、エキソサイトーシスを介して肺へのトロピズムが引き起こされる
エンドソームの酸性環境は,SARS-CoV-2ウイルス膜とエンドソーム膜の融合を促進し,ウイルスゲノムを細胞質に放出することができる[60].放出された正鎖のウイルスRNAは、宿主のリボソーム上でレプリカーゼに翻訳され、タンパク質分解による切断でゲノム複製に必要なタンパク質が生成される。全長アンチセンスの負鎖ウイルスRNAテンプレートは、ウイルスRNA依存性RNAポリメラーゼによって生成され、ウイルスゲノムRNAの正鎖と、より短いサブゲノムの負鎖RNAを複製する[61]。負鎖のウイルスRNAは、小胞体において、ウイルスの構造タンパク質をコードするmRNAの翻訳のテンプレートとして機能する。小胞体では、ウイルスのタンパク質がカプセル化され、膜に出芽る。ウイルスが集合すると、ウイルスは小胞を形成し、エキソサイトーシスによって放出される[61]。
ACE-2遺伝子多型は、一般人口におけるACE発現レベルの違いを説明することから、重度の肺障害の誘発に重要な役割を果たしている[62]。ACE-2多型は、ACE遺伝子のイントロン16にある287bpのAluリピート配列の挿入(I)または欠失(D)によって同定される[63]。ACE-2阻害剤とアンジオテンシンII受容体拮抗剤による治療を用いた現在進行中の臨床試験において、COVID-19患者のACE遺伝子多型を評価するためのさらなる研究が必要である。
ACE-2は他の多くの臓器でも発現しており、したがって、SARS-CoV-2はACE-2との結合を介して組織や臓器に侵入し、腎障害、心障害、肝機能障害、脳障害などの多臓器障害を引き起こす可能性が高い[41, 64, 65, 66](図3)。SARS-CoV-2が脳、肝臓、腎臓、心臓でACE-2と結合することによる発症メカニズムについては、現在のところ十分に理解されていないため、さらなる研究が必要であると考えられる。
図3 SARS-CoV-2が宿主細胞のACE-2受容体と相互作用することで引き起こされる多臓器不全
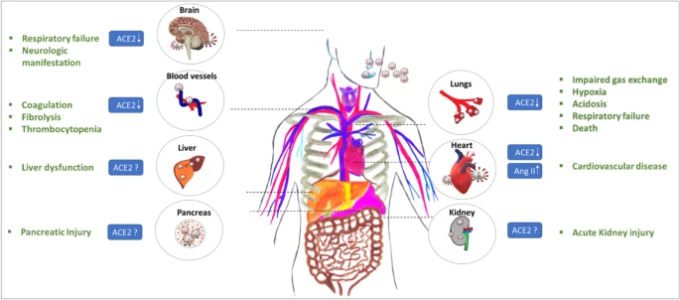
この図は、SARS-CoV-2に感染すると、急性腎不全、呼吸不全、肝不全、神経合併症、心血管疾患を特徴とする多臓器不全が生じることを表している
このギャップに対処するため、最近の研究では、脳においてACE-2がグリア細胞や神経細胞に発現していることが示された。このことは、SARS-CoV-2が循環器系や上鼻腔経気道から侵入して脳障害を引き起こすことで、向神経性学的な可能性があることを示唆している[64]。SARS-CoV-2感染による神経細胞障害の具体的なメカニズムを明らかにするには、さらなる研究が必要である(図3)。
脳に加えて、ACE-2は肝臓の肝細胞にも発現しており、胆管細胞は結果的に肝臓の損傷を誘発する[67]。COVID-19個体の生検では、中程度の微小血管性脂肪症、軽度の小葉性、門脈性の活性が観察された[65]。とはいえ、SARS-CoV-2感染や治療中に使用された抗ウイルス剤が原因となっている可能性もあるため、肝機能障害の根底にあるメカニズムをさらに調査する必要がある[65]。例えば、最近のいくつかの研究では、抗ウイルス剤であるロピナビル/リトナビルが肝臓に損傷を与えることが示されている[68]。この点を解決すれば、SARS-CoV-2による肝障害を軽減するためのより良い戦略を開発することができる(図3)。
腎臓もまた、ACE-2の発現が亢進している臓器である。腎尿細管細胞はACE-2を高発現していることが知られているが[69]、SARS-CoV-2が誘発する腎障害についての研究証拠は報告されていない。COVID-19患者1099人を対象とした統計調査では,0.5%が急性腎障害を報告し、重症率は83.3%であった。COVID-19患者の一部では、尿中にSARS-CoV-2が検出された[69]。SARS-CoV-2感染症が腎臓障害を引き起こすかどうか、引き起こすとしたらそのような細胞障害に関わるメカニズムを検証するための追加研究が直ちに必要である。さらに、COVID-19患者から採取した尿がSARS-CoV-2の検出にも使用できるかどうかは、現在のところ不明である。尿からSARS-CoV-2を検出する方法を確立すれば、鼻や喉からのサンプル採取による苦痛を最小限に抑えることができる(図3)。
心臓の場合、SARS-CoV-2は、SARS-CoVと同様のメカニズムで心血管合併症を引き起こす[70]。心筋細胞に発現しているACE-2は、SARS-CoVと相互作用することができ、Ang-IIのレベルを高め、結果として心血管系の異常を促進する[70]。しかし、SARS-CoV-2が心筋細胞にも直接感染するかどうかは現在のところ不明である。
ACE-2の発現は、膵臓の外分泌腺や膵島でも検出される。膵臓におけるACE-2の発現は肺に比べてわずかに高く、SARS-CoV-2が膵臓のACE-2に結合して重篤な膵臓障害を引き起こす可能性を示している[71]。
研究では、COVID-19患者の凝固と線溶が報告されているが、これは感染時にウイルスの拡散を制限するために宿主の防御機構が活性化されたことによるものである[72]。ウイルス感染の初期段階では、サイトカイン活性の上昇とトロンビンおよびフィブリノーゲンの生成を特徴とする全身性の炎症反応が引き起こされる [72]。この反応により、組織因子の発現が誘導され、凝固が開始される。気管支肺胞洗浄液(BAL)中の凝固因子と線溶因子を測定したところ,トロンビン濃度の上昇と線溶の抑制が認められ,呼吸困難の病態が明らかになった。さらに、SARS-CoV-2感染時の血管内皮障害による大量の内皮細胞アポトーシスがCOVID-19の凝固促進性変化に寄与している[72]。最近の研究では、COVID-19患者の血小板減少が示されているが、SARS-CoV-2の関与のメカニズムはまだ不明である[73](図3)。
サイトカイン・ストーム
病原体関連分子パターン(PAMPs)を認識することによって引き起こされる自然免疫および獲得免疫を介した抗ウイルス反応と,誘導された抗原特異的な適応免疫は,宿主生物を感染症の壊滅的な影響から守る重要な防御システムである[74, 75].ウイルス感染に対する反応は、サイトカイン、ケモカイン、ロイコトリエン、プロテアーゼ、活性酸素種の放出、およびウイルスの除去率に依存する[76]。拮抗するシグナルと細胞反応のバランスは、宿主組織へのダメージを防ぐことで、病原体に対する免疫反応に影響を与える。その結果、活性化された免疫系は休息状態に戻り、継続的に活性化された宿主の免疫反応によって引き起こされるダメージを防ぐことができるのである[76]。ウイルス感染に反応してサイトカインが過剰に合成されると、「サイトカイン・ストーム」と呼ばれる急性かつ重篤な全身性の炎症反応が起こり、多臓器の損傷を引き起こす[76]。IL-6とIL-17は疾患の重症度を予測し、呼吸不全と相関することが研究で示されている[77]。COVID-19に対して、IL-17を単独で、またはIL-6と組み合わせて標的とする治療戦略の可能性が現在検討されている。IL-6を標的とするTocilizumabは、現在、COVID-19患者の治療に米国食品医薬品局(US-FDA)から承認されている[78]。
SARS-CoV-2による神経学的合併症
SARS-CoV-2は、主に肺機能、心機能、腎機能に影響を与える[79]。しかし最近では、SARS-CoV-2が他の器官にも二次的な合併症を引き起こすことが報告されている[79]。神経系の合併症は、新しい治療法を開発する上で、より注意を要する合併症のひとつである。SARS-CoV-2感染症による神経障害は、糖尿病などの既存の代謝異常や他の感染症、あるいは神経系の慢性から急性の炎症性エピソードと組み合わされることが多い[80]。しかし、すべてのCOVID-19患者が神経学的合併症を発症するのか、一部の患者だけが発症しやすいのかは、現在のところ明らかになっていない。したがって、神経系の感染症を発症するリスクのある感受性の高い人の兆候や特徴を知ることが重要だ。
SARS-CoV-2の神経系への侵入経路
血流に侵入したSARS-CoV-2ウイルスは、逆行性軸索輸送を介して、あるいは血液脳関門(BBB)の中心部分である周皮細胞やアストロサイトに感染することで、中枢神経系や末梢神経系(PNS)に広がる[81]。また、SARS-CoV-2の神経侵入は、嗅神経や血管内皮への感染、あるいは感染した白血球がBBBを越えて移動することによっても行われる可能性がある。SARS-CoV-2は、いったんBBBを通過して中枢神経系に侵入すると、セロトニン作動性の背側菜状突起系やヴィルヒョウ・ロービン空間を含む神経伝達経路や血行性経路に沿ってそれぞれ分布することになる。SARS-CoV-2の神経侵襲性は、主に脳幹や呼吸器系と相互作用する延髄構造に依存している。このことは、COVID-19患者に呼吸器系の障害が多発した要因の一つと考えられる[81]。
COVID-19の神経学的影響は、中枢神経系へのウイルスの直接侵入または間接感染のいずれかによるものである[82, 83]。疫学的研究によると、COVID-19患者の初感染と重度感染の間には1週間の潜伏期間があるため、ウイルスが中枢神経系に侵入するのに十分な空間があることが示されている[84]。コロナウイルスでは、神経侵襲性の活性が一般的に検出される。神経侵襲性は、SARS-CoV、MERS-CoV、HCOV-229E、HCOV-OC43でよく知られている[85,86,87]。さらに、SARS-CoV-2のスパイクタンパクは、血液脳関門(BBB)の機能を変化させるため、中枢神経系に侵入する可能性のある新たなメカニズムを提供している[88]。SARS-CoV-2の保存されたウイルス構造とSARS-CoVとの遺伝的類似性は、このウイルスが中枢神経系に侵入できることのさらなる証拠となっている[89, 90]。
Kanbergらは、血清学的バイオマーカーの変動を測定することで、COVID-19患者の中枢神経系損傷を報告している。例えば、アストロサイトとニューロンの損傷のマーカーである血漿グリア線維酸性タンパク質(GFAp)とニューロフィラメント軽鎖(NfL)の上昇が、47人のCOVID-19患者で報告された[91]。この研究の著者らは、重度のCOVID-19患者18名において、GFApとNfLの有意な増加を示したが、GFApレベルは治療経過観察時に減少することが報告された。しかし、NfL値は治療期間中、継続的に上昇したことが報告された。重度の COVID-19 症例と同様に、中等度の COVID-19 症例 9 名においても血漿中の GFAp レベルの上昇が報告された[91]。しかし、この研究では治療経過観察の状況は報告されていない。この現象は、COVID-19感染による中枢神経系でのアストロサイトの早期関与と軸索損傷の遅延に現れている[91]。
Coolenらは、COVID-19患者における中枢神経系の病変の証拠を示している[92]。この研究の著者は、死後24時間以内のCOVID-19患者に磁気共鳴画像(MRI)を実施し、4人に白質変化、後可逆性脳症症候群、出血などの実質的な異常を示した[92]。これは,内皮細胞へのSARS-CoV-2ウイルスの感染とは無関係に,BBBの破壊とCOVID-19に基づく内皮の異常が原因と考えられる.この研究では、他の4人の患者にも嗅球の凹凸や無嗅覚症の兆候が見られた[92]。フランスのストラスブールで行われた研究では,集中治療室(ICU)に入院した急性呼吸窮迫症候群(ARDS)のCOVID-19患者58人の神経機能を評価したところ,ICUへの入院中に8/58人(~14%)の患者に神経学的異常が認められた。しかし、67%(39/58)の患者が深い神経学的徴候を示し、69%(40/58)の患者が鎮静剤や神経筋遮断剤の離脱後に動揺を示した。また、約45%(26/58)の患者が錯乱状態を呈し、67%(39/58)の患者が皮質脊髄路徴候を示したと報告した。偶然にも13名(22.41%)の患者が脳症の特徴を示し、MRIスキャンでは8名(13名)の患者がレプトメンヘラの増強を、11名(13名)の患者が両側の前頭側頭葉の低灌流を示した。45名の患者を対象としたフォローアップ臨床研究では、15名の患者が典型的な場面緘黙症を呈し、その後、不注意、見当識障害、動作や反応の変化が見られた[93]。中国・武漢のCOVID-19患者214人を対象とした研究では、41.1%(88/214人)の患者が重度のSARS-CoV-2感染症に罹患していた。そのうち36.4%(78/214)の患者には、感覚ニューロンの損傷による明確な神経学的徴候が見られ、その結果、嗅覚や味覚の感覚に欠陥が生じ、神経因性疼痛、発作、脳卒中が引き起こされた[83]。さらに、これらの欠陥は、世界中のCOVID-19患者でより顕著に見られた[83]。
症状に基づいて、COVID-19の根底にある神経学的症状は、骨格、筋肉の損傷指数、中枢神経系指数に分別された[94]。これらの神経学的症状のうち、急性脳血管障害、頭痛、めまい、運動失調、意識障害、痙攣などが重要な症状として報告されている。例えば、SARS-CoV-2感染は、神経痛、味覚・嗅覚・視覚障害などの末梢神経系(PNS)の変化を引き起こす[6]。この研究の結果、78/214人の患者に神経学的異常が見られ、中枢神経系の機能障害、骨格筋の損傷、末梢神経系の機能障害に関連する症状が見られた[83]。これらの神経学的症状はすべて、高血圧、糖尿病、慢性悪性腫瘍、脳血管疾患などの併存疾患を持つ高齢の患者(60歳以上)で主に報告された[95,96,97,98]。
ACE-2受容体が、SARS-CoV-2ウイルスの宿主体内への侵入に重要な役割を果たしていることは、最近の多くの研究報告で明らかになっている。このタンパク質は中枢神経系にも広く存在し、主に脳幹、角膜下臓器、室傍核、ソリタリウス管核、吻側延髄領域に存在することが報告されている[99]。脳のこれらの領域は、心血管機能を制御していることが知られている[99]。ACE-2の発現は、神経細胞やアストロサイトでも報告されている[99]。Liらは、COVID-19の感染が腸内細菌組成の変化を引き起こし、腸脳軸を介して精神神経症状を引き起こす神経病理発生を誘発する可能性を解読した[100]。
RT-PCRを用いた初期の研究では、脳におけるACE-2の広範な発現が示されたが[101]、ACE-2の免疫反応は一般的に脳内皮細胞や平滑筋細胞で報告された[102]。グリア細胞におけるACE-2の発現[99, 103]は、脳組織がSARS-CoV-2の潜在的な標的となりうると結論づけている。中枢神経系感染時にSARS-CoV-2のRNAが検出されたことから、SARS-CoV-2による中枢神経系への直接感染の可能性が示唆された。
髄膜炎を発症したCOVID-19患者は、痙攣、海馬の萎縮、汎鼻腔副鼻腔炎を示している[104]。最近の症例研究では,意識の低下を訴えていた56歳の脳炎患者の中枢神経系にSARS-CoV-2ウイルスが存在していた。COVID-19患者におけるこれらの所見は、HCOV-OC43感染患者における過去の報告と一致している[105]。同様に、持続的なてんかんを持つSARS患者の脳脊髄液からSARS-CoVが観察された[106]。COVID-19患者のレトロスペクティブ研究では、急性虚血性脳卒中、脳静脈洞血栓症、脳出血が認められた[83]。したがって、SARS-CoV-2は、気道をバイパスする能力と他の組織に感染を付与する能力を示しており、これがSARS-CoV-2ウイルスの重要な特徴である可能性があると結論づけられた。
SARS-CoV-2と堅牢なミトコンドリアシステムおよび免疫コンピテンシーはホルミシスに依存する
最近の研究では、SARS-CoV-2がオートファジーを損ない、マイトファジーを阻害する能力があることが示されている[107]。この効果は、ミトコンドリア融合が可能で、マイトファジーを障害し、細胞死を誘導するSARS-CoVと同様である[108, 109]。現在、SARS-CoV-2によるミトコンドリアと免疫系の変化の変調を、ウイルスを媒介としたインフラマソームの変調を解明することで研究している。筋肉由来のホルモンであるイリシンは、運動時のミトコンドリアや肺の虚血・再灌流傷害を保護することが報告されている[110]。しかし、SARS-CoV-2で誘発されるミトコンドリア機能不全が、イリシンの調節を介しているかどうかは不明である。さらに、イリシンは、SARS-CoV-2の影響を受ける脂肪細胞の遺伝子の変化を促進し、マクロファージの活性酸素を中和することで、抗酸化作用と抗炎症作用を示すことが示されている[111, 112]。ミトコンドリアは免疫応答に重要な役割を果たしており、いくつかのウイルスはミトコンドリアの機能を調節することができるため、SARS-CoV-2による影響もミトコンドリアの機能の調節障害を介していると推測される[109]。ミトコンドリア機能の変化は、SARS-CoV-2を媒介とする病態生理で起こる異形のプロセスであるかもしれない[113]。いくつかの免疫細胞はミトコンドリアを保有しており、現在では「免疫代謝の概念」に包含されている[114, 115]。しかし、年齢とライフスタイルは、ホルモン様のプレコンディショニングに基づいてウイルスへの感受性を決定する2つの重要な要因である[115]。ウイルスによって誘発された「外因性のホルモン刺激」は、反復的な身体活動によって緩和され、結果的にウイルスが媒介するミトコンドリアストレスを減少させることができる[116,117,118]。身体活動によるホルモン様イリシンを介したプレコンディショニング・シグナルは、重要な酸化還元依存性の抗炎症および抗酸化関連メカニズムであるホルミシスを介した細胞保護につながっている[113]。このように、SARS-CoV-2によるミトコンドリアのハイジャックとホルミシス様のプレコンディショニングは、神経炎症の病態生理の重要な要因と考えられる[113]。
SARS-CoV-2は、複製を促進するために好気的解糖を亢進させる(Warburg shift)ことが報告されているが、これは多くのウイルスが(がん細胞と同様に)代謝のリプログラミングを介して用いる戦略的な戦術である[119]。例えば、メラトニンは、SARS-CoV-2が媒介するこの代謝リプログラミングを阻害することができ、したがって、メラトニンは、ミトコンドリアを保護することができる強力な抗酸化物質と考えることができる[120, 121]。このようなSARS-CoV-2のシグナル伝達の分岐点は、メラトニンによるミトコンドリアの抗酸化システムを研究することによって、神経細胞で解明されるべきである[121]。SARS-CoV-2を含むいくつかのウイルスは、両方の免疫系でミトコンドリアの生体エネルギーと酸化還元機能を変調させ、他の細胞に感染して複製を高める能力を獲得し、その結果、広範な酸化ストレスによるウイルス媒介性の病態生理を助長することができる[121]。新規抗ウイルス分子のホルモンの用量反応は、ウイルス感染に対する神経保護反応の中心的な基盤となる可能性がある。SARS-CoV-2に誘発された神経疾患について、サーチュインやNrf-2関連のシグナルカスケードを含む細胞防御経路を説明するためには、ホルモンの用量反応の研究が重要である[122]。さらに、SARS-CoV-2が神経細胞のミトコンドリアの機能を調節して酸化ストレスを発生させている可能性があるため、ウイルスを介した基礎的な病態生理を解明することが重要である。ミトコンドリアを介した老化は代謝異常と関連しており、SARS-CoV-2による神経病理に対するワクチンを投与する前に、ミトコンドリアの抗酸化物質や抗炎症分子などの新しい治療法が必要である[123]。”ヒドロキシチロソール(HT)を豊富に含むオリーブ果肉水抽出物(HIDROX®)」は、強力な殺ウイルス活性を誘導することで、SARS-CoV-2に誘発される病態生理を緩和することが報告されている[124]。ヒドロキシチロソール(HT)とオレウロペインアグリコン(OLE)は、神経変性の病態生理を緩和するのに有効であると報告されている2つの潜在的な分子である[124]。プロテアソームや第二相解毒酵素の活性を高めるホルミシスと抗酸化作用は、これらの薬理学的分子がSARS-CoV-2に誘発された神経病理生理学に作用する潜在的な作用機序である[125, 126]。上記の治療法に加えて、65歳以上の感染者のSARS-CoV-2に対する免疫老化因子によって加速される合併症を緩和するために、ワクチノミクスのアプローチが有用であるかもしれない[123, 127]。SARS-CoV-2感染症の合併症を軽減するためのワクチノミクスに基づくアプローチの役割を証明するためには、さらなる研究が必要である。
SARS-CoV-2による中枢神経系(中枢神経系)と末梢神経系(末梢神経系)への感染のメカニズム
広範な科学的証拠により、COVID-19が多くの神経系合併症を引き起こすことが証明された[128]。また、COVID-19感染時に国民の健康に与える短期的・長期的な影響を明らかにするため、神経学的合併症は研究者の間で広く注目されている[129]。しかし、COVID-19による神経系の合併症に関わる基本的なメカニズム/経路を確認するには、詳細な研究が必要である。
間接的侵入
SARS-CoV-2は、末梢神経に沿った逆行性・逆行性の輸送によって神経組織に侵入する可能性がある[130]。既存のデータでは,SARS-CoV-2はTMPRSS2およびACE-2受容体を介して嗅球に感染することが示されている[131, 132].一旦感染すると、ウイルスの移動は、ACE-2受容体とは無関係に、嗅覚被覆細胞(OEC)の細胞外小胞(EV)を介して行われる可能性がある。嗅覚神経に加えて、ウイルスは三叉神経や迷走神経を経由して移動することもある[130]。
SARS-CoV-2は、ACE-2またはTMPRSS2受容体を介して神経組織に侵入する可能性がある。ACE-2受容体は脊髄の膜にも発現しているので、ウイルスは末梢神経細胞の表面にあるACE-2受容体に結合して脊髄に侵入する可能性がある。また、ウイルスは、嗅球や嗅上皮に近い篩板を伝染して、間接的に中枢神経系に侵入する。この感染経路を確認するために、無嗅覚症や低嗅覚症がCOVID-19患者の新しい合併症として考えられている[133]。
COVID-19による神経感染は、繊毛状の樹状突起/相馬へのウイルスの取り込みを伴う[134]。このウイルスは、嗅神経に沿った前向軸索機械輸送を介して効果的に侵入することができた[134]。さらに、ウイルスは非神経性の嗅覚上皮細胞に感染して横断し、嗅神経束周辺の脳脊髄液に直接侵入することも可能である[135]。これらの細胞のACE-2およびTMPRSS2受容体は、高齢者に感染を伝播させる可能性があり、OE細胞にSARS-CoV-2が蓄積されるリスクが高いと考えられる[135](図4)。
図4 SARS-CoV-2の神経系への侵入の概要
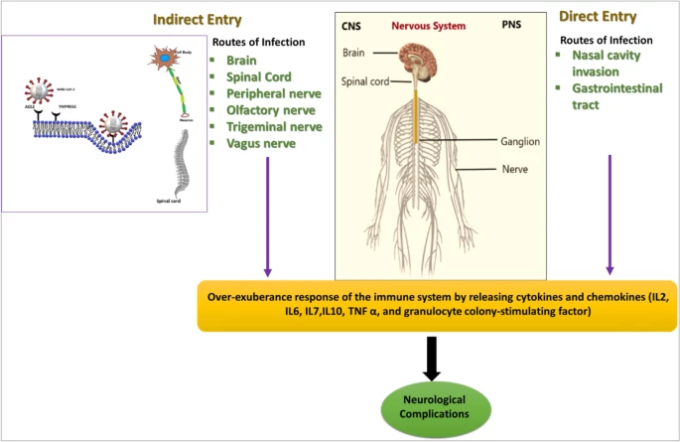
SARS-CoV-2ウイルスは、直接的および間接的な経路で中枢神経系および末梢神経系に感染することが報告されている。その結果、免疫反応の上昇によりサイトカインやケモカインが生成され、重篤な神経合併症を引き起こす
直接感染経路
SARS-CoV-2の感染が神経合併症を引き起こすことが確認されたとはいえ、SARS-CoV-2が神経系に直接侵入し、その正確な微小浸潤がどのようなものかはまだ解明されていない。例えば、髄液と脳組織の両方に核酸物質が存在することで示されるように、ウイルスは脳組織への侵入を直接もたらす可能性がある[130]。このようなウイルス血症は、脳の血液脳関門(BBB)の内皮細胞を介したウイルスのトランスサイトーシスや、脳室の脈絡叢(CP)の血液脳脊髄液関門(血液脳脊髄液関門)の上皮細胞を介したウイルス感染を引き起こす可能性が高い直接的な経路で発生している。そのほか、白血球もBBBを越えてウイルスを輸送するベクターとして機能する可能性がある[136, 137]。Braak仮説では、侵入性の神経ウイルスは、鼻腔や消化管を通って中枢神経系に入る可能性があるとされている[138](図4)。
COVID-19による神経炎症の誘発
SARS-CoV-2感染の重要な神経病理学的メカニズムの一つに、感染者の炎症亢進状態の誘導がある[66]。免疫系の過剰反応により、サイトカインやケモカイン(インターロイキン2,6,7,10,TNF-α、顆粒球コロニー刺激因子(G脳脊髄液)など)の生成が促進される[139]。これらのサイトカインやケモカインは、神経炎症カスケードの広範な活性化を引き起こし、グルタミン酸受容体の活性化を介して神経細胞の興奮性亢進を促し、それに続いて発作が誘発される[140, 141]。SARS-CoV-2感染の炎症説は、重度の脳炎を併発したCOVID-19患者のステロイド反応によっても裏付けられた[142]。
SARS-COV-2感染症における免疫系の過剰な反応は、炎症性の損傷と脳浮腫を引き起こし、その結果、意識障害を誘発する可能性がある[143]。炎症反応と免疫反応は、サイトカインストームをさらに増幅させる[144]。頭蓋内のサイトカインストームは、BBBの破壊と白血球の移動を引き起こす可能性がある。この状態では、ウイルスが直接侵入したり、感染随伴性の脱髄を起こす可能性はない[130]。
COVID-19患者は、鼻腔内の炎症につながる嗅球への直接的な損傷により、味覚と嗅覚の障害を経験することが報告されている。この炎症は、嗅覚受容体への臭気物質の結合を阻害し、それによって嗅覚反応に影響を与える[145]。COVID-19による損傷を受けたニューロンの再生と修復は、嗅球内でより長い時間を要する[145]。同様に、COVID-19は味蕾の機能障害を引き起こし、それによって味覚消失(舌の味覚機能の喪失)を引き起こす[146]。この感染症の急性期には、鼻の炎症や粘膜の浮腫が原因で嗅覚が失われることがある。これらの症状は、ウイルスによって引き起こされる広範囲の嗅覚障害のため、数ヶ月から数年にわたって持続する可能性がある[145]。
神経疾患に対するCOVID-19の影響
COVID-19のパンデミックは、神経疾患や神経変性疾患を持つ多くの高齢者グループに多くの短期的・長期的な悪影響を及ぼした[147]。例えば、パーキンソン病(PD)は壊滅的な神経疾患の1つで、大脳基底核の中脳辺縁系の障害によって発症する[148]。COVID-19に感染したパーキンソン病患者は、振戦、歩行の凍結、あるいはジスキネジアなどの運動症状を含む副作用を示し[149]、ドパミン系薬剤の効果が低下する[150,151,152]。このように、COVID-19の病態生理とドーパミン合成経路の変化が仮説として立てられている。最近の報告では、ドーパミンと合成セロトニンの両方の経路の重要な酵素であるドーパ脱炭酸酵素(DDC)とACE-2受容体の共発現が示されている[153]。SARS-CoV-2がACE-2と結合すると、ACE-2のダウンレギュレーションが引き起こされることが報告されている[154]。ACE-2とDDCの機能的なつながりの可能性は、ドーパミン合成の変化を示しており、これがPD関連の合併症をさらに助長することになる[153]。ドーパミンレベルの不均衡は、PDの重症度を悪化させる。COVID-19がパーキンソン病患者に与える影響に加えて、ウイルスが感染中に散発的なPDを呼び起こす可能性もある。例えば、ACE-2は、ドーパミン合成時のドーパ脱炭酸酵素(DDC)の共同制御に関与していることが報告されている。SARS-CoV-2によってACE-2の発現が低下すると、PDの病態生理に重要な経路であるセロトニン経路とドーパミン経路の両方に変化が生じることになる[53, 153]。したがって、SARS-CoV-2は、ACE-2とDDCの発現が欠損している間に、ドーパミンの変化を効果的に誘発することができるという仮説が立てられている[153]。
多発性硬化症(MS)もまた、SARS-CoV-2感染によって悪化することが報告されている神経学的合併症のひとつである。COVID-19感染のMS患者では、疾患修飾療法(DMT)により、死亡率・罹患率のリスクが比較的低いことが報告されている。さらに、これらの患者における免疫調整薬の摂取は、肺活量の低下を招き、COVID-19関連肺炎のリスクをさらに高める可能性がある[155]。したがって、MSと共存するCOVID-19患者がDMTの摂取を避けるという判断は、免疫調節や疾患の重症度など、いくつかの雑多な要素に依存している。SARS-CoV-2に対する免疫系の過剰反応により、COVID-19感染症の合併症は非常に高くなっている。しかし、合併症を軽減するために標的とすべき分子経路を解読するには、さらなる研究が必要である。さらに、適切な前臨床動物モデルを構築することは、MSを患う人々にCOVID-19が引き起こす合併症に対抗するための、より優れた治療薬の開発に役立つであろう[156,157,158]。
SARS-CoV-2感染はまた、深刻な神経変性プロセスを誘発し、COVID-19によるアルツハイマー病(AD)患者の全生存率を低下させる可能性がある[130]。しかし、現在のところ、COVID-19とAD発症との相関関係を示唆する証拠はない[159]。AD発症の重要な要因の1つは、脳内のアミロイドベータ斑(Aβ斑)の蓄積である[160, 161]。Aβは、アミロイド前駆体タンパク質(APP)が酵素処理されて生成される。ウイルス感染とAβの関係については,複数の研究者によって解明されており,Aβが抗菌ペプチド(AMP)であることを裏付けるデータもある[162]。アルツハイマー病患者から得られた全脳ホモジネートを、年齢をマッチさせた非ADサンプルと比較したところ、AMP作用とAβレベルの間に強い相関があることが示唆された[162]。しかし、AD脳ホモジネートを抗Aβ抗体で処理した免疫枯渇モデルでは、Aβの広範な抗微生物活性が消失した。SARS-CoV-2ウイルスの一過性感染は、脳内のAβ蓄積を開始または加速させ、ADを引き起こす可能性がある[159]。さらに、中枢神経系内の一過性ウイルス感染により正の炎症反応が刺激され、重度の脳内Aβ滞留による自然免疫反応の異常な自己増殖を助長する可能性がある[159]。神経炎症は、ADのもう一つの初期の特徴である。ACE-2を発現している脳組織を介したウイルスの中枢神経系トロピズムは、ACE-2の発現を誘導し、ウイルス侵入のリスクを高め、神経変性を呼び起こす分子プロセスを活性化する可能性がある[159]。しかし、SARS-CoV-2感染におけるこれらの分子メカニズムは、ウイルスによって誘発される神経変性の変化を明確にするためには、まだ解明されていない。
SARS-CoV-2に関連した神経系疾患
ギラン・バレー症候群(GBS)とSARS-CoV-2
ギラン・バレー症候群(GBS)は、炎症性の多発性神経障害で、いくつかのウイルス感染症と関連している[163]。GBSは、SARS-CoV-2感染症で観察される最も悲惨な合併症である呼吸不全を引き起こす可能性があるため、GBSの発生はSARS-CoV-2感染症患者にとって最も重要な点であると考えられている[164]。GBSのその他の合併症は、自己免疫介在性の病態生理による弛緩性麻痺、感覚異常、自律神経機能障害である[165]。
COVID-19患者のGBSは、中国の武漢で初めて報告され、遠位潜時の延長とともに運動神経および感覚神経の脱髄が検出された[166]。これは、ウイルス感染に対して宿主が産生する抗体の交差反応により、末梢神経に結合して神経細胞の機能障害を引き起こすことが原因である[167]。SARS-CoV-2を介したGBS患者の神経細胞の病態生理では、顔面や四肢の麻痺(神経損傷による筋力低下)知覚異常、免疫炎症反応などの症状が見られるとの報告がある[168]。例えば、GBSのミラー・フィッシャー症候群とポリクラニアル神経炎の変種がGutiérrez-Ortizらによって報告されている[169]。ミラー・フィッシャー症候群とポリクラニアル神経炎の患者において、COVID-19感染の数日後に髄液中にアルブミンの細胞学的解離が観察された[169]。いくつかの報告では、複数の末梢神経の脱髄がSARS-CoV-2に関連するもう一つの理由であり、GBS患者の状態を悪化させる可能性を示唆している[170]が、この病態生理を鮮明に解明し、対抗する治療法を開発するためには、広範な研究が必要である[171]。
脳脊髄炎とSARS-CoV-2
急性散在性脳脊髄炎(acute disseminated encephalomyelitis:ADEM)は、SARS-CoV-2の成分が嗅覚神経や三叉神経の末端に中心的に浸潤することで発生すると報告されている疾患の一つである[172]。SARS-CoV-2感染に伴うADEMと診断された患者は、手足の脱力感やしびれ、わずかな排尿障害を訴えるが、現在までにその完全な病態生理は解明されていない。これらの患者の完全な脳脊髄液分析では、高タンパク・高グルコースを伴う黄色グルコース症が報告されている[172]。
筋痛と神経筋接合部の損傷
筋肉痛は、疲労の存在を伴う全身の筋肉痛と呼ばれ、SARS-CoV-2感染者では慢性的な筋肉の損傷により悪化する[173]。筋肉痛の症状は、急性呼吸窮迫症候群(ARDS)を介して引き起こされる呼吸器系の合併症と、筋細胞のACE-2受容体を介してSARS-CoV-2の病態を介して誘発される炎症性サイトカインストームに起因する[173]。もう一つの明らかな慢性的影響は、これらの患者における炎症性サイトカイン反応による免疫介在性の筋損傷である[174, 175](表2)。
表2 SARS-CoV-2感染による神経学的障害のリスト
SARS-CoV-2と神経細胞障害の動物モデル
SARS-CoV-2に関する動物実験は、中枢神経系の病態生理に関する重要な情報を提供することができる[159]。例えば,マウス,ハムスター,フェレット,非ヒト霊長類のモデルは,生体内試験での病原性の影響を調べるためにすでに使用されていた[176].ヒトにおけるSARS-CoV-2の受容体であるヒトACE-2(hACE-2)遺伝子を発現させたトランスジェニックモデルマウスは、神経細胞の損傷に対するウイルス感染の役割を研究するための、そのような動物モデルのひとつである。
可能性のある治療戦略としては、EK1ペプチド(アミノ酸を改変したOC43-HR2P)のような汎コロナウイルス融合阻害剤や、メシル酸カモスタット、メシル酸ナファモスタットのようなTMPRSS2阻害剤の前処理が挙げられるが、さらなる評価を検討する前に、これらの動物モデルでの有効性を検証する必要がある。SARS-CoV-2によって誘発されるACE-2の変調を調べるには、動物モデルの神経組織が有効である[33, 177, 178]。COVID-19感染によるRAS系の調節不全は、小血管の低灌流や動脈のアテローム血栓症を介した虚血性脳損傷に寄与する[179]。これらのプロセスを制御する分子メカニズムは、SARS-CoV-2感染モデルマウスを用いて解読することができる。
SARS-CoVと中枢神経系研究用モデル
MS、PD、アルツハイマー病患者の中枢神経系から分離された剖検標本にコロナウイルスが存在することが、証拠の蓄積によって証明されている。実験的研究では、ヒトCoVは、初代培養の神経細胞、グリア細胞(アストロサイト、ミクログリア)および不死化したヒトミクログリア細胞に容易に感染することが示されている[180]。このことは、SARS-CoV-2が脳をリザーバーとして利用し、神経変性疾患の発症を助長している可能性を示唆している[181]。したがって、SARS-CoV-2感染が中枢神経系に及ぼす影響を分析する必要がある。
SARS-CoVと中枢神経系細胞株
SARS-CoVに関する研究から得られた既存のデータでは、SARS-CoV-2と約78%の塩基配列の相同性を示していた。しかし、SARS-CoV-2のモデルを研究するために開発された特定の神経細胞株は存在しない[182]。現在、神経前駆細胞、ニューロン、ミクログリア細胞(ヒト人工多能性幹細胞(hIPSCs)から得られたもの)が、SARS-CoV-2ウイルス感染の試験管内試験研究や、感染が細胞代謝や細胞生存に関わる様々なシグナルカスケードに与える影響を確かめるために使用されている[182,183,184]。しかし、向神経性学的なヒトコロナウイルスと、ヒト乏突起膠腫細胞株HOGやラットグリア腫瘍細胞株C6などの神経細胞株を用いた研究は他にほとんどない。これらの細胞株はSARS-CoV-2の感染に敏感であり,ウイルスがヒトの中枢神経系を攻撃する基本的な病原性メカニズムを解読するのに役立っている[185,186,187]。いずれの細胞株もSARS-CoVの感染に敏感であると報告されているが、Vero E6やCaco-2などの細胞株ではウイルスの複製が非常に低いことが指摘されている[188]。HCoV-229EとHCOV-OC43の中枢神経系への感染性を調べるために,ヒトH4脳神経膠腫細胞,LA-N-5ヒト神経芽細胞腫細胞,CHME-5ヒト胎児ミクログリア細胞,U-373MGとU-87MGアストロサイト細胞などの様々な神経細胞株が用いられた[189,190,191,192,193].ヒト初代ニューロン,アストロサイト,オリゴデンドロサイト,ミクログリアなどのグリア細胞の培養物も,上記ウイルスの病原性を調べるために使用することができる.これらの神経細胞株が、SARS-CoV-2を用いた実験に適しているかどうかを検証するためには、さらなる研究が必要である。
SARS-CoV-2と脳オルガノイドのモデル
オルガノイドは,試験管内で開発された臓器の小型化,簡略化された3次元バージョンである[194]。オルガノイドは、特定の器官の細胞構造と機能を表している[195, 196]。オルガノイドを使用することで,研究者は,複雑な生理学的・病理学的プロセスを生体内試験システムで開発・確認することができる.SARS-CoV-2の感染,トロピズム,および潜在的な治療法が,肺,肝臓,腸,血管,腎臓のヒトオルガノイドで調べられた[196,197,198]。現在、SARS-CoV-2によって誘発された脳の変化に関連する病態生理学的側面を研究するために、ヒト脳オルガノイドが開発されている[198, 199]。これらのオルガノイドは、COVID-19感染時のニューロン発生の初期段階を研究するのに有用である。
SARS-CoV-2は、脳オルガノイドに存在する成熟した皮質ニューロンに感染する[182]。その上、SARS-CoV-2感染細胞で観察された神経変性作用は、細胞死とリン酸化亢進、それに続くタウタンパク質の誤配置によるものである。これらの変化は、タウオパチーやADでより顕著に見られた[182]。しかし、これらの細胞では感染初期に生産的なウイルス複製が観察されないことから、中枢神経系はウイルスの長期的な貯蔵庫と考えられるという仮説が支持されている[181]。一方、Bullenらは、SARS-CoV-2感染後6時間から72時間の間に、脳オルガノイドモデルの神経細胞全体にウイルス粒子が過剰に蓄積していることを明らかにした[200]。これは、ウイルス感染の初期段階において、活発な複製がより明らかになったことを示している。さらに、ウイルス粒子は、神経細胞の体幹や神経突起の間で顕著に見られた。Mesciら[201]は、脳オルガノイドモデルを用いて、SARS-CoV-2が神経細胞やNPCなどの大脳皮質ニューロンに感染し、興奮性シナプスの破綻を伴う細胞死を引き起こすかどうかを評価することに成功した。また、上記の研究では、SARS-CoV-2感染時の治療法の一部として、(+)ss RNAウイルスに対するFDA承認の脳侵入型抗ウイルス剤であるソホスブビルの有効性を検討した[202]。この研究では,ソフォスブビルが,これらの脳オルガノイドにおいて,ウイルスの蓄積によって引き起こされたシナプス形成の変化を回復させ,神経細胞死を軽減することができると結論づけている.別の研究では、SARS-CoV-2がヒトの脳オルガノイドにおいて神経侵襲性を示すことが報告されており、典型的にはNPCや成熟した皮質ニューロンに見られるとされている[183]。これらの細胞は、ウイルス粒子が小胞体のような構造を越えて蓄積される代謝亢進状態を示していた。これらの証拠から、SARS-CoV-2は神経細胞の仕組みを利用して細胞内で複製する能力を持っていることが確認された。さらに、高密度のSARS-CoV-2に感染した脳組織全体では、低酸素状態、および広範な神経細胞死がより明らかになったことから、SARS-CoV-2がバイスタンダー細胞死を助長する可能性が示唆された[203]。この研究では、COVID-19患者の脳脊髄液で生成されたSARS-CoV-2に対するIgG抗体が、脳オルガノイドにおけるSARS-CoV-2感染の遮断をもたらすことも結論づけている[183]。このように、これらの研究は、SARS-CoV-2が神経細胞に感染し、壊滅的な副作用を伴う神経学的合併症を引き起こす可能性があることを報告している。結論として、これらの研究結果は、中枢神経系におけるSARS-CoV-2の影響を研究するために、ヒト脳オルガノイドを使用することの大きな可能性を示している。
マウスのMHV-CoV感染と神経系の合併症
マウス肝炎ウイルス(MHV)はβCoVの一種であり、ヒトへの感染の危険性はないが、SARS-CoV、MERS-CoV、SARS-CoV-2などの同系統のウイルスと類似している。さらに、このウイルスは中枢神経系を通過して白質病変を引き起こすことができるため、このモデルは脱髄疾患のウイルスモデルとして提案することができる[204, 205]。MHVは白質で複製を起こすことができるため、コロナウイルスによる中枢神経系感染症の研究には有用なモデルとなる。MHV-CoVの向神経性株は、神経炎症を介した急性および慢性の脱髄疾患の原因となることが以前に報告されている[206, 207]。今回、接種経路とMHV-CoV株に基づいて、有意な影響を受けた中枢神経系領域を予測・特定することが可能となった。実験的なMHV-A59向神経性株を接種すると、急性髄膜脳炎を引き起こし、その後、脳と脊髄の両方で亜急性の慢性炎症性脱髄が発生した[208]。脳の最初の接種部位から脊髄へのウイルスの移動は、神経細胞やグリア細胞内でのウイルス粒子の移動と、おそらくウイルスの内在化の段階での脂質膜の融合を伴うメカニズムによって引き起こされる[209]。JHM-CoVを鼻腔内および頭蓋内に接種すると,MHV-A59による症状と同様の症状がBALB/cマウスに生じる.マウスに鼻腔内接種した後、MHV-CoVは嗅神経を介して中枢神経系にアクセスし、嗅覚系から大脳辺縁系の構造や脳幹との結合部に伝播する[210]。
MHV感染による脱髄誘導における免疫系の役割を研究するために,Wangら[211]は,感染した動物をガンマ線で処理して免疫抑制を引き起こし,その後,他の免疫不全動物から細胞を移植して免疫を再構築した。その結果、放射線によって脱髄が阻止され、免疫が回復すると再び脱髄が再開されたことから、免疫が脱髄過程に直接関与していることがわかった。さらに、CD4およびCD8 T細胞が脱髄過程の進展に重要な役割を果たしていることが観察されており、T細胞はこの過程に最も重要である[212, 213]。MHVは、慢性ウイルス感染やウイルス感染の急性期(例えば、SARS-CoV-2)における宿主の防御を介した脱髄を研究するためのユニークなモデルとなる[214]。
COVID-19と神経発達への影響
COVID-19の世界的パンデミックは、SARS-CoV-2感染の結果について妊婦に懸念を抱かせた。このウイルス感染は、胎児の潜在的な欠陥、すなわち長期的な神経発達への影響を引き起こす可能性があるからである[215]。
母親からの病気の垂直感染
母親の全身感染が胎児に及ぼす出生前の影響
胎盤の機能とその結果としての妊娠転帰への影響の可能性 [179]。
胎盤にACE-2受容体が存在することは、SARS-CoV-2感染を受ける潜在的なリスクを示唆している。垂直感染に加えて、母体の感染は胎児の発育中に神経発達上の変化を引き起こす可能性がある。しかし、SARS-CoV-2による神経発達の変化は、妊娠初期の感染による病態生理を理解するために、十分に解明されるべきである[216]。例えば、この感染症は、母体の免疫系の変調を伴うサイトカインストームの発生を助長し、サイトカインやケモカイン(TNF-α、IL-6)などの免疫変化のカスケードを生成し、胎児に伝達される可能性がある。その後、ウイルス感染症の重症妊婦は、胎盤の低酸素症のリスクが高くなり、胎児への酸素供給が損なわれ、その結果、局所的な成長と脳の発達に欠陥が生じる可能性がある[217,218,219]。このように、COVID-19が妊娠に与える影響は、母体と新生児の両方における神経学的合併症の観点から、まだ明らかになっていない。少数の症例で重症化や母体の死亡が示唆されたという報告があるものの、現在までのところ、妊娠がCOVID-19獲得の危険因子の一つであることを示す証拠は報告されていない。
病因に関与するウイルス由来および宿主由来のタンパク質
S-プロテイン
S-proteinは、ウイルスタンパク質の一つで、大きなエクトドメイン、シングルパスの膜貫通アンカー、および短い細胞内尾部から構成されている(図5)[220]。エクトドメインは2つのサブユニット,すなわち,S1(受容体結合サブユニット)とS2(膜融合サブユニット)から構成されており,ヒトの発明の主要なターゲットとなっている。S1とS2のサブユニットは高度に保存されており、コウモリ型SARS-CoVとヒト型SARS-CoVにそれぞれ70%と99%の類似性がある[1, 221]。S1の機能ドメインには,N末端ドメイン(NTD),受容体結合ドメイン(RBD),受容体結合モチーフ(RBM)がある(図5)。S2は,融合ペプチド,ヘプタッドリピート1(HR1),ヘプタッドリピート2(HR2),膜貫通ドメイン(TM),細胞質ドメイン(CP)がある(図5)[2, 59, 220]。電子顕微鏡による研究では,スパイクは,3つのS1ヘッドと3つのS2ストークを持つクローブ型の3量体として現れることが明らかになった[222,223,224,225]。受容体結合サブユニットは,様々な宿主の受容体と効率的に相互作用し,ウイルスの宿主細胞表面への付着を促進する。膜融合サブユニットは、宿主とウイルスの膜を融合させ、ウイルスの宿主細胞への侵入を仲介する[226]。
図5 S-proteinの構造モチーフ
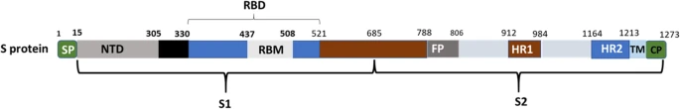
SARS-CoV-2のS-proteinは、S1とS2サブユニットから構成される。S1ドメインがN末端ドメイン(NTD)、受容体結合ドメイン(RBD)、受容体結合モチーフ(RBM)で構成されているのに対し、S2ドメインは融合ペプチド、ヘプタッドリピート1(HR1)、ヘプタッドリピート2(HR2)、膜貫通ドメイン(TM)、細胞質ドメイン(CP)で構成されている。
ACE-2受容体は,SARS-CoV-2のS-タンパク質の結合パートナーである[2, 59]。S1サブユニットのアミノ酸配列を解析した結果,SARS-CoV-2はSARS-CoVと77%の類似性を示した[29, 227, 228]。一方,SARS-CoV-2のS2サブユニットは高度に保存されており,ヒトSARS-CoVと99%の相同性を示した[1]。
SARS-CoVとSARS-CoV-2のRBDの違いは、SARS-CoVに特異的なACE-2結合中和抗体(m96, CR3014)がSARS-CoV-2のSタンパク質と結合できなかったことである[29]。SARS-CoVとSARS-CoV-2のRBDを解析すると、SARS-CoVのRBDにはアルギニン(R426)が存在するのに対し、SARS-CoV-2のRBDにはアスパラギン(N439)が存在し、強い極性相互作用が大きく減少することがわかった[229]。同様に、β6のバリン(SARS-CoVではV404)をリジン(SARS-CoV-2ではK417)に置き換えると、ACE-2のD30と余分な塩橋が形成される[228]。このようなRBMの構造変化は、hACE-2と結合する稜線をよりコンパクトなものに変化させ、N-末端のhACE-2との相互作用を促進し、SARS-CoV-2をより好ましい結合パートナーにしている[230](図5)。
TMPRSS2
TMPRSS2は細胞性のセリンプロテアーゼで、SARS-CoVやMERS-CoVなどのコロナウイルスが宿主細胞に侵入する際に重要な役割を果たしている[57, 231, 232]。いくつかの研究者は、TMPRSS2がSARS-CoV-2の一次標的細胞への侵入のためのS-proteinプライミングを引き起こし、感染した宿主でのウイルスの拡散を可能にすることを確認している[33, 56, 235, 236]。したがって、TMPRSS2は、SARS-CoV-2感染の初期段階をブロックして多臓器不全を回避するための魅力的な創薬標的である。しかし、TMPRSS2とS-proteinの相互作用の複雑な構造は、ウイルス学者がSARS-CoV-2に対する適切な治療法を開発する上で困難な点である。
ワクチンによるCOVID-19の標的化
2021年4月3日現在、83のワクチン候補がヒトで臨床試験中であり、77のワクチン候補が動物で研究中である。そのうち48本が第I相、33本が第II相、23本が第III相の評価を受けている(表3,図6)。いくつかのワクチン候補は現在、第3相臨床試験中であり、臨床データは、FDAの完全な承認を得て、世界中のいくつかの工業生産ユニットで大規模製造することを支持している[237]。
表3 臨床試験中のUS-FDA承認ワクチンのリスト
図6 臨床試験の様々な段階にあるワクチンのリスト

ウイルスの様々な生体分子を標的とした現在のSARS-CoV-2のワクチン候補。ワクチン候補を標的とするウイルスの生体分子には、DNAベースのワクチン、不活化ウイルス、弱毒化生ウイルス、非複製ウイルスベクター、タンパク質サブユニット、複製ウイルスベクター、RNAベース、ウイルス様粒子ベースのワクチンがある
現在のCOVID-19ワクチン候補は、抗体および/またはT細胞免疫応答促進剤である[237]。例えば、タンパク質ベースのワクチンは安全で、ワクチンと一緒に使用されるアジュバントによって免疫応答を誘導する。主に、S1 RBD、RBD-Fc、およびN-末端領域からなるS-タンパク質は、いくつかの生体内試験および非ヒト霊長類モデルにおいて、免疫保護作用を発揮する可能性がある[238,239,240,241,242]。さらに、サブユニットワクチンは、適切なアジュバントの存在下で、1つまたは複数の抗原を介して宿主に免疫応答を引き起こすことができる。しかし、動物モデルにおけるサブユニットワクチンによる免疫は、S1 RBDとIgG1 FCの融合を誘発し、その結果、SARS-CoVの中和を促進する非常に強力な抗体の生成を促すことができる[243, 244]。SARS-CoV-2の臨床モデルでは、動物モデルでの臨床効果の成功例が非常に少ないため、サブユニットワクチンの検討はまだ行われていない。
ワクチンのオゾン化(Ozonation of Vaccine)
全身オゾン療法(OT)は、SARS-CoV-2に有用な潜在的なアプローチとして参照される[245]。OTは、SARS-CoV-2による二次的な合併症の効果的な臨床管理に有益である[245]。OTは酸素化を改善し、肺線維症[246]や腎不全[247]に対する保護作用を発揮する。さらに、この治療法は、肝臓でのタンパク質合成を改善することで、ウイルス感染患者の血漿レベルを安定させることができる[248]。また,心臓 [249, 250],肝臓 [251, 252],腎臓組織 [253]の酸化的損傷を防ぐことで,細胞保護効果を発揮する可能性もある。全身に投与されたOTは,NF-κB/Nrf2経路およびIL-6/IL-1β経路の発現を調節する能力があり,その結果,ウイルスの複製を阻止することで細胞保護を促進する[245].これまでに,OT中の慢性的な酸化ストレスに対するホルモン応答と酸化的プレコンディショニングが実験的に検討されてきた[254]。しかし,オゾンのホルモン反応は明確に示されていた。例えば,高用量のオゾンは,ウイルス感染経路に反応して1型IFNの負の制御を誘導する一方で,炎症性サイトカインおよび炎症性サイトカインの遺伝子転写を調節することができる[255]。OTにはウイルスを死滅させる顕著な効果はないが、酸化ストレスや炎症性サイトカインを調節する能力がある。したがって、OTはCOVID-19患者に提案されている補完的な治療法として考慮することができる。例として、HIVに対する世界的なワクチンの準備には、血漿を「正確な量のオゾン」に長時間、制御して暴露することが含まれている[245]。同様に、治療用のヒトアルブミンとオゾン化したオレイン酸エチルは、ワクチンによる吸収を高め、免疫機能を高めるために主に混合される[248, 256, 257]。COVID-19ワクチンの調製に向けたこのようなワクチンアプローチのオゾン化は、「遊離ウイルス成分の酸化」を促進し、それにより有効性を向上させることができる。
ウイルスベクターベースのワクチン
これらのワクチンは、改変されたウイルスベクターを介してコード化された1つまたは複数の抗原の送達を促進する可能性がある[258]。この技術は、抗原の宿主細胞への導入を促進し、ウイルス病原体に対する体液性および細胞性の免疫反応の生成を促進する[244, 259, 260]。SARS-CoVとSARS-CoV-2に対するウイルスベクターの有効性はまだ検証されていない。以前の報告では、S-proteinをコードする弱毒化ベクターベースの生ワクチンである修正ワクシニア・アンカラ(MVA)ベクターの有効性が明らかにされている[261]。このベクターは、マウス、ウサギ、サルにおいて強力な中和抗体を誘導する[262]。組換えアデノウイルスを用いたモデルマウスへの免疫は、血清および肺のCD8 + T細胞に中和抗体を誘導することが示されている[263,264,265,266]。
DNAワクチンは、免疫原をコード化したプラスミドDNA分子で構成されており、安定性と容易な送達の点でmRNAワクチンよりも効果的であることが証明されている[267]。しかし、その意義は、宿主のゲノムに組み込まれて突然変異を起こすリスクに制約されている[267, 268]。MERS-CoVのSドメインをコードするDNAを免疫したマウスの血清を受動的に投与することで、MERS-CoVに感染したナイーブなマウスを保護することが示されている[269]。別の研究では、S1およびSタンパク質をコードするDNAが、ヒトとラクダに由来する複数のMERS-CoV株に対するクロス中和抗体の生成を誘発することが示されている[270]。さらに、S-proteinをコードするDNAをマウスに免疫すると、CD4 +およびCD8 + T細胞に特異的なペプチドが生成され、その結果、広範なサイトカインの発現が促進された[271]。レンチウイルスベクターをベースにしたシュードタイプのDNAの場合、SARS-CoVのワクチンによる強力な中和抗体は、免疫を受けたボランティアにSタンパク質特異的なCD4 +およびCD8 + T細胞の免疫反応を誘発した[272]。現在行われているDNA/サブユニット/タンパク質ベースのワクチン試験の概要を表2に示する。しかし、SARS-CoV-2におけるこれらのワクチンモデルの意味合いは、抗体依存性増強(ADE)とTh2免疫病理によって制約されている。
フェーズIIに成功したCOVAXIN(Bharat Biotech社)
BBV152(COVAXIN)は、全ウイルス型のβ-プロピオラクトン不活化SARS-CoV-2ワクチンで、筋肉内投与によりTh-1免疫応答を促進するために、toll様受容体7/8アゴニスト(イミダゾキノリン分子)とともに研究・製剤化されたものである[273, 274]。Bharat Biotech社により、インドの11の病院で二重盲検、多施設、無作為化対照の第I相試験が実施された。さらに、この試験では、BBV152の安全性と免疫原性の評価(Clinical Trials.gov NCT04471519)が行われている[275]。しかし、細胞を介した反応を確認するためには、さらなる研究が必要である。
Covishieldは、Serum Institute of India(SII)が英国のOxford-AstraZeneca社、Bharat Biotech社と共同で開発した別のワクチンである。このワクチンは、インドにおけるSARS-CoV-2感染者への筋肉内投与による緊急時の使用が、インド医薬品管理局(DCGI)によって承認された(DCGI、インド)。
ワクチンによる神経系の合併症
現在までに全世界で6億6,500万回分のワクチンが投与されている。いくつかの最近の報告では、COVID-19ワクチン接種による神経系へのリスクはないか最小限であることが示唆されている[171, 276]。しかし,第3相試験中のワクチンの臨床試験では,めまい,頭痛,痛み,筋痙攣,筋肉痛,感覚異常などの軽度の副作用が報告されている[276]。例えば、AZD1222のアデノウイルス・ベクター・ワクチンを第III相試験で投与したところ、2名の患者に神経系の合併症が報告された。詳細な調査の結果、1名の患者はワクチン接種時に診断されていなかった多発性硬化症であったと結論付けられ、その後の報告では、他の要因がこの副作用の原因であると結論付けられている[277,278,279]。その後、これらの報告により、このワクチンには神経系の副作用がないことが明確になり、試験が再開され、インド、アルゼンチン、イギリスで承認された[277]。mRNAワクチンの試験では、37,000人の参加者のうち7人がベル麻痺(顔の筋肉が一時的に弱くなったり、麻痺したりする症状)を発症したが、米国FDAは、この病気の発生率は集団の中で予想されるよりも高くないと結論づけている[280]。ジョンソン・エンド・ジョンソンが開発したワクチン候補は、第3相試験で2名の患者にGBSが報告されている。そのうち、1名はワクチンを接種し、もう1名はプラセボであったことから、GBSとCOVID-19の感染には関連性がないことが示唆されている[281]。Waheedらの事例では、ファイザー社のCOVID-19ワクチン(mRNAワクチン)の初回投与2週間後にGBSが初めて発症したことが報告されている[171]。まれに、震え、複視(1つの物体の2つの像が同時に見えること)耳鳴り(片方または両方の耳で耳鳴りなどの音を感じること)発声障害(声の異常)痙攣、帯状疱疹の再活性化を伴うワクチン投与が報告されている[276]。現在までに、脳卒中17例、GBS32例、ベル麻痺190例、脳脊髄炎6例が “Vaccine Adverse Event Reporting System database “に報告されている[276]。しかし、COVID-19の接種により神経学的合併症の発生率が高いことを示唆する有意な報告はない[276]。
結論
COVID-19パンデミックの原因であるSARS-CoV-2への感染は、神経系に関連した障害や認知に関連した行動の変化など、いくつかの健康合併症を引き起こしている。これらの変化を引き起こす基本的な分子メカニズムは、炎症、細胞死の誘発、細胞間のコミュニケーションの低下などであると報告されている。しかし、(a)SARS-CoV-2は神経細胞に直接侵入できるのか?もしそうなら、どのような経路で侵入するのか?(b) 感染した細胞で引き起こされる病原反応は?(c) なぜ特定のCOVID-19患者だけが神経学的合併症を発症するのか?さらに、(d)COVID-19による神経障害を起こしやすい年齢層との間に関連性はあるのか?さらに、FDAが承認しているワクチンが、SARS-CoV-2の神経細胞への侵入を防ぐ保護機能を拡張できるかどうかも不明である。これらの疑問を解決すれば、より優れた治療薬やSARS-CoV-2感染からの保護戦略を開発するために考慮すべき手がかりやメカニズムが得られる可能性が高い。
