Contents
Inhibiting Epileptiform Activity in Cognitive Disorders: Possibilities for a Novel Therapeutic Approach
www.ncbi.nlm.nih.gov/pmc/articles/PMC7593384/
オンラインでは2020年10月15日に公開
Andras Attila Horvath,1,2,* Emoke Anna Csernus,3 Sara Lality,4 Rafal M. Kaminski,5 and Anita Kamondi2,6
概要
認知機能障害は、自閉症、注意欠陥多動性障害、多発性硬化症、てんかん、アルツハイマー病などの神経変性疾患など、さまざまな精神・神経疾患に共通して見られる症状であり、深刻な衰弱をもたらす。これらの疾患では、てんかん状の活動が高い頻度で見られることが、共通の病態生理的特徴として挙げられる。これらの疾患では、てんかん状の活動が、神経回路のリモデリング、睡眠構造の変化、海馬と皮質の病的な結合、さらには神経細胞の減少などにより、長期的に認知機能に悪影響を及ぼす可能性があることが示唆されている。動物モデルでは、てんかん状の活動が病的なアミロイドやタウタンパク質の形成を促進し、それがネットワークの過興奮を引き起こすことが示されている。てんかん状の放電を抑制することで、認知機能の低下を遅らせることができるかもしれない。これらの知見は、神経変性認知障害に対する抗てんかん薬の治療的使用の基礎となるかもしれない。この総説の目的は,様々な認知障害におけるてんかん様放電の有病率に関するデータを説明し,認知障害に関連するてんかん様放電のメカニズムに関する現在の知識を要約し,認知障害の治療における抗てんかん薬の有用性を探ることである。また,これらの障害におけるてんかん様放電を標的とした薬剤開発や新規治療介入のための将来の方向性を提案する。
キーワード:神経認知障害,てんかん様活動,脳波,認知機能低下,記憶統合,抗てんかん薬
はじめに
認知機能障害は、自閉症スペクトラム障害(ASD)統合失調症、注意欠陥多動性障害(ADHD)多発性硬化症(MS)主要な神経認知機能障害(NCD)など、さまざまな神経・精神疾患に共通する症状である。これらの疾患の累積有病率は、先進国では約50%に達しており、医療・社会的に大きな負担となっている。これらの疾患は、症状や病的背景が大きく異なる一方で、記憶機能の低下が共通の特徴として挙げられる。
てんかんと上記疾患との関連性は、様々な仮説や説明がなされており、医学的にも注目されている。これらの症候群は、てんかん発作のリスクを高めると考えられている。
ASDでは、てんかん発作の発生率が5〜38%と高いことが報告されている(Hara, 2007)。ADHDの症状はてんかん患者に多く見られ、てんかんは不注意型のADHDとの関連性が高いとされている(Plioplys et al 2007)。他の研究では、注意力に問題のある子供は、誘発されない発作の発生が2/3に増加することが提案されている(Austin and Caplan, 2007)。
最近では、てんかんは様々な形態の神経認知機能障害において頻繁に併存することが立証されている(Horváth er al 2016)。家族性ADに関する研究では、発作が患者の約半数に影響を及ぼすことが着実に示されている(Zarea er al 2016)。Beagleらの研究では、びまん性レビー小体型認知症(DLB)の患者による発作発症の累積確率が約15%、前頭側頭型変性症(FTD)の患者による発作発症の累積確率が約3%であることが実証されている(Beagle et al 2017)。さらに、てんかん患者は晩年の神経認知障害の可能性も高い(Subota et al 2017)。
数多くの研究がてんかん発作と認知障害の関連性を調査しているが、発作と発作の間のてんかん状活動[発作間てんかん状活動(IEA)]や、発作活動のないてんかん状活動[潜在的てんかん状活動(SEA)]に関する報告は少ない。古典的なてんかん学では、発作の正確な制御に焦点が当てられていたが、近年、IEAが認知機能に有害な影響を及ぼす可能性を示唆する証拠が増えている(Glennon et al 2016,Hu et al 2016,Meekes and Jennekens-Schinkel 2018)。SEAはIEAと同様の電図的特徴を示し、上述の認知障害はSEAの有病率がすべての状態で上昇するという別の特徴を共有していることから、SEAの潜在的な役割についても分析することは興味深い。
今回のレビューの目的は、様々な認知障害におけるIEAとSEAの有病率に関する研究結果を説明し、てんかん様放電が認知機能に及ぼす影響に関する現在の知識をまとめ、認知機能低下を標的とした治療介入の新しい方向性を提案することである。研究の正確性と新規性を高めるために,2000年以降に発表された研究を分析し,有病率と治療法の項では,ヒトに関する報告のみを掲載した。
認知機能障害におけるSEAおよびIEAの有病率
主な神経認知疾患
神経認知機能障害は、進行性の神経変性プロセスを伴う80~100の様々な疾患を表する。ADは、高齢者の認知機能低下の主な原因であり、世界で3750万人が罹患しており、この数は2050年までに3倍になると予想されている(Abbott, 2011)。ADの最初の症状は、エピソード記憶の障害や空間認識能力の低下などで、通常60~70歳で発症する。6-8年の経過の中で、患者は、方向感覚、コミュニケーション、言語能力を含む他の認知能力を失い、最終的にはセルフケアの能力も失っていく(Cummings and Cole, 2002)。ADの病理学的特徴は、ミスフォールドしたアミロイドタンパクとタウタンパクの蓄積と進行性の広がりである(Ittner and Götz, 2011)。認知機能の低下の進行を大幅に遅らせることはできないため(Cummings and Cole, 2002)特に疾患の初期段階において、ADの修正可能な要因を見つけることが必要であると考えられる。最近、ADの進行に寄与すると考えられているのが、てんかんの活動である。数多くのヒトの研究により、アルツハイマー病患者はてんかん発作を発症する確率が高いことが強調されている(Horváth er al 2016)。IEAは、てんかん発作を呈したアルツハイマー病患者の3分の1において、ルーチンの脳波(EEG)で発作間期のてんかん様活動を確認した3つの研究で分析された(Rao et al 2009,Cretin et al 2016,Sarkis et al 2016)。2つの睡眠脳波研究では、発作の臨床歴がある患者のIEA率は62%(Vossel et al 2013)および80%(Horváth et al 2018b)であった。これらの研究では、IEAは主に前頭側頭領域に現れ、左側が優位であった(Rao et al 2009,Vossel et al 2013,Cretin et al 2016,Sarkis et al 2016,Horváth et al 2018b)。IEAの時間的な発生を分析したのは2つの研究のみで、Vossel et al 2013)の研究では、IEAの10%が覚醒時に検出され、64%がstage2または深い睡眠時にのみ出現したが、我々の以前の報告では、IEAの82%が睡眠に関連し、55%が深い睡眠時に検出された(Horváth et al 2017b)。
ADにおけるSEAの発生を解析した研究はわずかしかない。Liedorpらは、30分間の昼間の脳波を用いて、1,674人のアルツハイマー病患者のわずか3%にてんかん様放電を見出した(Liedorp et al 2010)。Vosselらは、113人のADおよびMCI患者の91%に日中のルーチン脳波を、7%に連続または長期の脳波を評価したところ、6%にSEAを発見した(Vossel et al 2013)。Vossel氏らの別の研究では、脳磁図と睡眠脳波を用いて、これまでにてんかん発作を経験したことのないアルツハイマー病患者の42%にSEAが認められた(Vossel er al 2016)。彼らはSEAの時間的分布も分析し、てんかん活動は睡眠中にほぼ完全に(90%)主に側頭部で起こることを示した。これは、ADのSEAの検出において睡眠時脳波が重要な役割を果たすことを示した我々の以前の報告と一致している(Horváth et al 2017b 2018a)。なお 2016年に行われたVossel氏の研究では、SEAはMini-Mental Score Examinationで判定される認知機能のより早い悪化と関連していた(Vossel er al)。 さらに、研究では、SEAを有するADおよび軽度認知障害(MCI)患者は、認知機能低下の開始が早いことが示唆されており、これは通常、より速い進行を示すより積極的な形態のADと関連している(Vossel et al 2016; Horváth et al 2018b)。表1は、IEAとSEAの有病率に関するAD研究をまとめたものである。
表1 アルツハイマー型認知症におけるてんかん様放電の有病率
| 参考文献 | NS | 研究デザイン | 脳波タイプ | ED(%) |
| Rao et al。、2009 | 39 | 遡及的てんかん性AD患者 | ルーチン(74%)またはEEGなし(26%) | 38%(IEA) |
| クレチンら、2016 | 13 | 遡及的てんかんMCI患者 | ルーティーン | 100%(IEA) |
| Sarkis et al。、2016 | 77 | 遡及的てんかん性AD患者 | ルーティーン | 22%(IEA) |
| Vossel et al。、2013 | 54 | レトロスペクティブ、MCI + AD患者 | ルーチンおよびシリアル | 62%(IEA)、6%(SEA) |
| Horváthetal。、2018b | 42 | 将来性 | 24時間 | 20%(IEA)、28%(SEA) |
| Liedorp et al。、2010 | 1,674 | 回顧展 | – | 3%(SEA) |
| Vossel et al。、2016 | 33 | 将来の非てんかん性AD患者 | 24時間+脳磁図 | 42%(SEA) |
N、患者数、MCI、軽度認知障害、ED、てんかん様放電、IEA、発作間てんかん様活動、SEA、潜在的てんかん様活動
DLBは、行動、認知、動作、睡眠、自律神経機能の変化を伴う、認知症の中で2番目に多いタイプである(Savica er al)。 主な症状は、急速眼球運動睡眠(REM)の睡眠行動障害、記憶喪失、幻覚である(McKeith, 2002)。さらに、注意力や覚醒度の著しい変動、パーキンソニズム(動作の緩慢さ、歩行困難、体の硬直)自律神経系の機能障害(起立性低血圧、便秘)なども見られる(McKeith, 2002)。重要な診断上の特徴は、抗精神病薬に対する過敏性である(McKeith, 2002)。主な病理学的所見は、α-シヌクレインタンパク質の広範な蓄積である(Hishikawa et al 2003)。DLBに関連するてんかんに関する報告はADに比べて少ないが、最近の論文では、DLB患者はアルツハイマー病患者と同様にてんかんにかかりやすいことが描かれている(Beagle et al 2017)。また、死後のアプローチを用いた別の研究では、DLB患者の21.7%に臨床記録のレトロスペクティブな分析によりミオクローヌスが同定され、認知機能低下の早期発症と関連していた(Morris et al 2015)。DLBにおけるIEDやSEAに関する報告はないが、DLB患者がアルツハイマー病患者と同程度の発作の有病率である可能性を考えると、DLBにおけるIED/SEAの解析は今後の重要な方向性である。
FTDは、行動・言語優位の小葉変性症(行動変型、意味変型一次進行性失語症、非流暢変型一次進行性失語症)や、運動優位の障害(皮質基底症候群、進行性核上性麻痺)など、5つのタイプの認知症を包含する異質な疾患である(Bang er al 2015)。初期症状は通常、人生の5~6年目の成人によって現れる(Bang er al)。 組織学的所見は、タウ、tdp-43,およびfusタンパク質の進行性蓄積である(Bang er al)。 FTD患者は、てんかん発作のリスクも高い傾向にあるが(Beagle et al 2017,Arnaldi et al 2020)FTDにおけるてんかん活動の重要性に着目した文献は1例しかない。卵円孔電極の助けを借りて、発作のないFTD患者において、認知行動の日々の変動の原因となりうるSEAが検出された(Horváth et al 2017a)。FTDに関するIEA/SEAの報告例はまだ少ないため,さらなる調査が必要である(Chan er al)。
ハンチントン病は、常染色体優性の神経変性疾患であり、不随意運動、認知機能の低下、人格の変化を特徴とする(Bates er al)。 成人発症の患者に関する報告では、発作の有病率は一般人口と同様であることが示されている(Sipilä er al 2016)。しかし、21歳以下の若年者に現れる希少な若年性タイプ(J-HD)では、30~40%の患者にてんかん発作やてんかん様活動が発生する(Cloud er al 2012)。現在、ハンチントン病におけるSEAまたはIEAを単独で調査した文献はわずかしかない。LandauとCannard(2003)のレビューでは、過去に発表されたJ-HD患者の23例を分析している。てんかん状の異常は17例(74%)に認められた。10例では明らかなてんかん発作を伴っていたので、IEAの有病率は44%であった。7例(30%)ではSEAが検出された。9例ではポリスパイクや波動を伴う全身性の放電が見られ,8例では後部優位の焦点性または多焦点性のてんかん様放電が見られた。この研究の限界は、J-HDの診断が遺伝的に確認されなかったことである。別の研究では、てんかん発作を起こしたJ-HD患者のIEAのパターンを分析し、後頭部の間欠的なリズミカルなデルタ活動がてんかん活動の主な特徴であると述べている(Ullrich er al 2004)。
結論として、様々な形態の神経認知機能障害患者はてんかん発作を起こしやすい傾向にあるが、有病率のデータは高いばらつきを示している。SEAはアルツハイマー病患者の約17%で検出されるが、他の神経認知機能障害についての研究はほとんどない。ADの進行促進におけるSEAの役割については、さらなる調査の必要性が指摘されている。
多発性硬化症
多発性硬化症は、白質だけでなく、皮質や並皮質の炎症過程を伴う中枢神経系の異質な脱髄疾患である。最近の研究では、MSが神経変性疾患としても考慮されるべきであることが強調されている(Ziemann et al 2011)。発作はMSのどの段階でも起こりうることから、主に臨床的な発作に注目が集まっている。SponslerとKendrick-Adeyは、25の科学論文の結果をまとめ、MS患者の発作の有病率を評価する最も広範なレビューを行った(Sponsler and Kendrick-Adey, 2011)。その結果、MS患者の約2%が発作を経験していることがわかった。36人の患者を対象とした研究では、てんかん発作を持つ患者では、てんかんを持たない患者と比較して、早期発症のMS頻度が有意に高いことがわかった(Durmus er al)。 てんかん発作は、病変を取り巻く浮腫、疾患修飾薬によるてんかん閾値の低下、または疾患経過に伴う皮質の厚さの減少の結果である可能性がある(Geurts et al 2005,Cheng et al 2012,Calabrese et al 2017)。Calabrese氏らの研究(2008)では、再発性MS(RRMS)のてんかん患者の90%で皮質内病変が報告されているが、てんかんを伴わないRRMSでは48%にとどまっている。同氏のグループによる別の研究では、RRMSのてんかん患者で最も影響を受けた灰白質病変は、海馬(14.2%)側頭葉(13.5%)帯状体(10.0%)島(8.4%)であった(Calabrese er al 2017)。Lundらは、MSにおけるてんかんは、皮質病変の性質上、症候性局所てんかんに分類されるべきであると示唆している(Koch et al 2008,Lund et al 2014)。
多発性硬化症におけるIEAとSEAの有病率と背景に関する利用可能なデータは限られている。SEAは臨床家を指導する上で大きな参考になる可能性があるが、MS患者のSEAのみに焦点を当てた研究は存在しない。MSで報告されている脳波異常は、拡散した非同期のシータ活動、同期したリズミカルな徐波、局所的な平坦化したEEGパターン(Striano et al 2003年)または頻度は低いが周期的な側方化したてんかん様放電であり、これらはほとんどが疾患の急性増悪で見られる(Lawn et al 2001,Nyquist et al 2001,Gandelman-Marton et al 2003)。表2は、てんかん状と非てんかん状の病的な脳波イベントに基づいて区別して脳波異常を調べたいくつかの研究のリストである。しかし、これらの研究のほとんどは方法論が異なり、IEAを分析した際に、すでに少なくとも1回の発作があることがわかっているMS患者の変化を調べたものである。IEAは患者の3.9~86.9%に認められたが、これは研究方法の大きなばらつきを表している(例えば、脳波の手法や記録時間、レトロスペクティブ研究とケースコントロール研究、サンプルサイズが23人と29,165人の場合など)。SEAを独立して分析した研究は3件のみで、約7~8%の有病率が示唆された。Bustuchina氏は、MSとてんかん活動との間の双方向の関係を仮定し、MSはネットワーク疾患である可能性があるため、最良の治療結果を得るためには両方の実体に重点を置くべきであることを示唆した(Bustuchina Vlaicu 2019)。
表2 多発性硬化症におけるてんかん様放電の有病率
| 参考文献 | NS | 研究デザイン | 脳波タイプ | ED(%) |
| Dagiasi etal。(2018) | 62 | 回顧展 | ルーティーン | 38(IEA) |
| ベンジャミンセン等。(2017) | 431 | 回顧展 | ルーティーン | 3,9(IEA) |
| Calabrese etal。(2017) | 23 | ケースコントロール | ルーティーン | 86,9(IEA) |
| ケリーとロドリゲス(2009) | 168 | レビュー | – | 32,7(IEA) |
| ナイキストら。(2001) | 43 | 回顧展 | スリープアウェイク | 44.2(IEA) |
| Sponsler and Kendrick-Adey(2011) | 29,164 | レビュー | – | 1.95%(SEA) |
| チェンら。(2012) | 93 | 回顧展 | ルーティーン | 8.6%(SEA) |
| ルンドら。(2014) | 364 | 回顧展 | ルーティーン | 7.4%(SEA) |
N、患者数、ED、てんかん様放電、IEA、発作間てんかん様活動、SEA、潜在的てんかん様活動
自閉症スペクトラム(ASD)
自閉症スペクトラムとは、DSM-V(Diagnostic and Statistical Manual of Mental Disorders, fifth edition)で定義された神経発達疾患の総称で、程度の差こそあれ、共通した臨床症状が見られる。そのような症状は、社交性の障害、コミュニケーションの障害、非言語的交流の問題、興味の範囲の制限、反復行動、知的および行動の柔軟性の障害などである(Tuchman and Rapin, 2002; American Psychiatric Association, 2013)。この異質な症候群の病態生理学的背景は、前頭葉の連合野と高次の多峰性側頭葉との間の神経回路の断絶に由来している(Assaf et al 2010; Belger et al 2011)。SEAとIEAは、これらの内在的結合ネットワークの機能不全のバイオマーカーの一つであると考えられる。ASDと診断された患者のてんかん状放電を評価した研究を表3にまとめた。てんかん様活動の有病率は、21~75%と報告されている。また、てんかんはASDと関連しており、その割合は5~39.2%である(Hara, 2007; Ghacibeh and Fields, 2015)。Clarkeらの研究では、てんかん患者の32%がASDの基準を満たしていたが、著者はアンケートのみを使用し、確認のための臨床診断テストは適用されなかった(Clarke et al 2005)。
表3 自閉症スペクトラム障害(ASD)における潜在性てんかん様活動(SEA)の有病率
| 参考文献 | NS | 研究デザイン | 脳波タイプ | ED(%) | ローカリゼーション |
| ヒューズとメリン(2005) | 59 | ケースコントロール | ルーチン+光刺激 | 75 | 一般化された、59%の両側スパイクと54%の徐波複合体 |
| キムら (2006) | 32 | 前向きコホート | ビデオ-EEG | 59 | 焦点/多焦点の鋭い波、一般化された発作性の速い活動 |
| Hrdlicka etal。(2004) | 77 | 前向きコホート | 睡眠ポリグラフ | 38.1 | – |
| Akshoomoff etal。(2007) | 60 | 前向きコホート | ルーティーン | 32 | – |
| 安原(2010) | 1014 | 前向きコホート | 日常的な睡眠ポリグラフ | 85.8 | 正面スパイク65.6%、多焦点スパイク<10% |
| Gennaro Nicotera etal。(2019) | 69 | ルーティーン | ルーティーン | 26.08 | 焦点スパイク、55.55%; 多焦点および拡散スパイク、44.44% |
| マリガンとトラウナー(2014) | 101 | 回顧展 | ルーティーン | 59.4 | – |
| Giannotti etal。(2008) | 104 | 前向きコホート | 日常的な睡眠ポリグラフ検査+光刺激 | 40.55 | – |
| 原(2007) | 130 | 遡及的フォローアップ | ルーティーン | 21 | – |
| Chez etal。(2006) | 889 | 回顧展 | 24時間 | 60.7 | 右側頭葉のスパイク、21.5%; 両側頭葉スパイク、20.2%; 一般化された棘徐波、16.2% |
| Elsayed and Sayyah(2012) | 47 | ケースコントロール | ルーティーン | 51.1 | 限局性前頭葉、後頭葉、側頭葉のスパイク |
| Hartley-McAndrew and Weinstock(2020) | 123 | 回顧展 | ルーティーン | 30 | – |
N, 患者数; ED, てんかん様放電。
いくつかの研究では、自閉症症状の重症度が高くなると、てんかん異常の可能性が高くなることが示唆されている(Elsayed and Sayyah, 2012; Mulligan and Trauner, 2014)。また、脳波異常は、生後1年目の自閉症的退行、低知能、運動、社会的発達の遅れと関連している(Hrdlicka er al)。 この仮説は、Nicoteraらも支持している(Gennaro Nicotera er al 2019)。彼らの研究では、てんかん様放電は、多動性、攻撃的行動、自傷行為、重度の言語障害とも有意に関連していた。Giannotti氏は、ASDの子どもたちの睡眠パターンを具体的に調査し、64.42%の患者が積極的な睡眠問題を抱えていたこと、また、睡眠の乱れはより重篤な疾患経過と関連していることを明らかにした(Giannotti er al)。 本症の予防については、原氏が行った10年間の追跡調査で、非てんかん群の18%が脳波でSEAを示したものの、てんかん群の68%がてんかん発症前にSEA所見を示したことが示された(Hara, 2007)。彼は、日常的な脳波検査によって将来のてんかん発症を予測できることを示唆した。
また、SEAの治療については、ChezらはSEAと診断されたASDの46.6%でバルプロ酸の連隊投与により脳波が正常化したことを明らかにした(Chez et al 2006)。しかし、ASD治療後のASD患者の脳波変化に関する研究は不足しており、行動面に関する研究では、抗けいれん薬の使用がプラセボよりも良い結果をもたらすことを証明できなかった(Hirota er al 2014)。
以上のことから、ASD患者の病態形成に関して、脳波上でSEAが何を意味するのかはまだ確信が持てないが、相関関係や関連性はあると考えられる。現在、ASDでは脳波スクリーニングと予防的な抗けいれん薬治療は推奨されていない(Swatzyna et al 2019)。これは、脳波上で見られるこれらのてんかん様変化の臨床的重要性と、そのような投薬体制によって臨床転帰がどのように影響されるかについて確信が持てないためである。しかし、臨床家は、より長時間の脳波検査を受けることや、一晩の脳波ビデオモニタリングを検討することができる。Chezらは、以前にルーチンの脳波が陰性だった患者では、5%の脳波異常が見逃されていた可能性があることを示しているので、長期の脳波を適用することは確かに重要である。Chez et al 2006)とGennaro Nicotera et al 2019)は、EEG異常が存在する場合、主に睡眠中に検出可能であることを明らかにした。質の高い評価のためには、明確な方法論を持ち、研究集団から得られるデータ量を最大化するような機器の選択を伴う、前向きの無作為化試験が必要である。
ADHD
ADHDは、米国精神医学会のDSM-Vで定義された症候群で、機能や発達を妨げる不注意および/または多動性・衝動性の持続的なパターンである。多動性-衝動性、不注意性、複合性の3つのタイプに分類される。世界的に見ると、この症候群は子どもの約5%、大人の約2.5%が罹患していると言われている(Polanczyk et al 2014)。本症の解剖学的側面に関する脳波や機能画像の研究では、前頭皮質(Parisi et al 2010,Schulz et al 2012,Zaimoglu et al 2015年)特に前帯状皮質背側の関与が示されており、抑制性課題制御時にこの脳領域の機能が低下すること(Bush et al 2005)や、脳波の発作的な異常(Kanemura et al 2013)が明らかになっている。ADHDとてんかんの間には病態生理学的および共存的な重なりがあることを示唆するデータがあり(Dunn and Kronenberger, 2006; Kaufmann et al 2009; Salpekar and Mishra, 2014)てんかんの子ども76人を対象とした研究では、健常対照群の6%に比べて31%がADHDであることがわかった(Hermann er al)。 いくつかの研究では、てんかん児では不注意サブタイプが優勢であるのに対し、非てんかん児では複合タイプが優勢であるとしているが(Dunn and Kronenberger, 2006; Hermann et al 2007; Socanski et al 2010; Kanemura et al 2013)そのような関係を示さなかった研究もある(Lee et al 2016)。ADHDとてんかんの脳波異常を同一患者で区別することは難しいが、このサブグループの小児におけるSEAと一過性の認知障害との関連性を調査することに注目が集まっている(Aldenkamp and Arends, 2004; Schubert, 2005)。
表4は、各研究におけるSEAの有病率をまとめたもので、4.9~53.1%の範囲である。ほとんどの研究はレトロスペクティブで、ルーチンのEEGを使用している。ADHDのてんかん活動は、一般的に、全般的な3Hzのスパイクと波動の放電や、局所的なスパイク(前頭葉、中頭葉、ローランドもしくは頭頂葉、後頭葉)などの発作的な異常として検出される(Holtmann et al 2003,Schubert 2005,Kanemura et al 2013)。Salpekarらによるレビューでは、前頭領域におけるシータ波の増加が、このサブグループの患者における一貫した脳波異常のようであり、アルファ波の非対称性やシータとベータの比率が高いことも報告されていると指摘されている(Salpekar and Mishra, 2014)。SEA患者における抗てんかん薬(AED)の効果は、前頭スパイクを有する小児では行動改善が見られるが、年齢に依存するローランドスパイク異常の場合はあまり見られないようである(Holtmann et al 2003,Schubert 2005,Kanemura et al 2013)。さらに、SEAは347人のADHD児のグループにおいても、発作の発症に対して14%の陽性予測値を示した(Richer et al 2002)。なお、Richer et al 2002)の研究では、SEAは光刺激や過換気の後に一部の患者にのみ見られたという。
表4 注意欠陥多動性障害(ADHD)における潜在性てんかん様活動(SEA)の有病率
| 参考文献 | NS | 研究デザイン | 脳波タイプ | ED(%) | ローカリゼーション |
| 金村ほか (2013) | 46 | 前向きコホート | ルーチン+光刺激20分 | 34.8 | 100%フォーカル |
| Lee etal。(2016) | 180 | 回顧展 | ルーティーン | 16.1 | 8.3%一般7.7%焦点-正面、ローランド |
| ヒューズ等。(2000) | 176 | 将来性 | 刺激を伴うルーチン1時間 | 30 | 24%フォーカル13%バイフロンタル |
| Hemmer etal。(2001) | 234 | 回顧展 | 日常的に目覚めている | 15.4 | 60%フォーカル、(全体で5,6%ローランド) |
| Millichap etal。(2011) | 612 | 回顧展 | ルーティーン | 26.1 | 42.9%フォーカル41.7%一般化 |
| Richer etal。(2002) | 347 | 回顧展 | ルーチン20分+光刺激 | 6.1 | – |
| Zaimoglu etal。(2015) | 148 | 将来性 | 日常的な1時間の目覚め-睡眠 | 26.4 | 前頭、中心側頭 |
| Silvestri etal。(2007) | 42 | 前向きコホート | 睡眠脳波(polysomnograpy) | 53.1 | 28.2%中心側頭、12.5%正面 |
| Matoth etal。(2002) | 126 | 前向きコホート | 刺激のあるルーチン | 5 | – |
| Socanski etal。(2010) | 517 | 後ろ向きコホート | ルーティーン | 7.5 | 一般化53.9%、フォーカル41%、ローランド1.7% |
N, 患者数; ED, てんかん様放電
表4では、てんかん様事象の有病率に関する最新の研究を集めた。Silvestri et al 2007)の研究では、42人の患者の前向きコホートにおいて、SEAの有病率が最も高い(53.1%)ことが報告されている。この研究は、評価に睡眠ポリグラフを用いた唯一の研究であることは注目に値する。SEAは睡眠中に頻発することが知られているが、このような異常を20〜30分程度の日常的な脳波でとらえることは非常に困難である。SEAを持つADHD患者のサブグループが、病気の進行や認知機能の低下を防ぐことでAEDの恩恵を受けるかどうかは未解決の問題である。結論として、いくつかの研究では、脳波は特定の集団において、より粗野な病理を除外するために使用できることが示唆されているが、他の研究ではこの見解を支持していない(Hemmer et al 2001,Matoth et al 2002,Socanski et al 2010,Millichap et al 2011年)。明らかに、ADHDのような中枢神経系(CNS)の病理において、SEAを調べることは重要な役割を果たしている。しかし、コンセンサスが得られるまでは、さらなる研究の余地があると考えられる。
認知機能障害のメカニズム
興奮剤を介した神経変性
神経変性とは、神経細胞の機能や構造が徐々に失われ、神経細胞やグリア細胞が死滅することである(Spillantini and Goedert, 2013)。神経変性疾患における認知機能の低下は、これらの疾患の主要な神経病理学的特徴である、蓄積されたミスフォールドタンパク質の拡散と一致している。有害なタンパク質は、様々な形態の認知症(タウパチー、アミロイドパチー、シヌクレインパチーなど)で異なるが、いずれも細胞膜、ミトコンドリア機能、軸索輸送、シナプス強度、酸化ストレス下での神経の生存に有害な影響を及す(Taylor er al)。 また、誤って折り畳まれたタンパク質は、生理的な神経炎症プロセスを変化させ、炎症誘発物質や神経毒メディエーターを活性化する(Giovannini et al 2002)。引き起こされた変化の要約として、タンパク質のミスフォールドは急速な神経細胞死と関連している。病的なタンパク質の空間的な分布は、神経変性疾患によって異なり、臨床症状も異なる(例えば、ADでは嗅内皮質が最初に変性し、DLBやパーキンソン病では黒質が最初に変性する)。MSでは、神経変性は、ミエリンやオリゴデンドロサイトを標的とする自己免疫性の炎症反応との相互作用でも起こる(Ellwardt and Zipp, 2014)。シナプス形成因子、炎症緩和因子、軸索移動因子の遺伝子変異により、神経の生存率が低下する神経発達因子がASDの発症に重要である(Kalkan er al)。 いくつかの研究では、てんかんでも神経変性が起こることが実証された(Frantseva et al 2000;Rao et al 2006)。側頭葉てんかんの典型的な病理組織学的特徴は、海馬、扁桃体、および内嗅皮質で検出される神経損失およびグリオシスであるが、新規の検査では、ミスフォールドしたタウおよびアミロイドタンパク質の存在も報告されている(Tai er al)。 さらに、神経画像および生理学的データは、てんかんネットワークの構造における進行性の灰白質の萎縮を示している(Bernhardt er al 2010)。
てんかんおよびすべての神経変性疾患に共通する特徴は、皮質の興奮性が増大することである(Di Lazzaro et al 2004,Gilbert et al 2004,Takarae and Sweeney 2017)。様々な疾患において、興奮性の増加が神経変性に先行することを裏付ける証拠が増えている。Vucic and Kiernan(2006)およびVucic et al 2008)は、経頭蓋磁気刺激を用いて、筋萎縮性側索硬化症患者および他の運動ニューロン障害患者において、症状発現前に短間隔の皮質内抑制が低下することを報告した。(Vossel et al 2013)の研究によると、ADの初期症状の数年前から発作の発生が増加しているという。
大脳皮質の興奮性の上昇は、興奮毒性を介して神経変性に寄与する可能性がある(Mehta er al)。 興奮毒性とは、興奮性神経受容体が長時間にわたって活性化された結果、細胞死を引き起こす毒性作用のことである(Bano et al 2005)。正常な状態では、グルタミン酸がシナプス後の受容体(N-methyl-d-aspartate(NMDA)α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid(AMPA))に作用すると、脱分極が起こり、細胞内のカルシウムが増加する。脱分極が長く続いたり、グルタミン酸がシナプス間隙で過剰な濃度になると、神経細胞を殺す毒素となり、細胞内の浸透圧平衡を崩してしまう(Ong er al)。
グルタミン酸の神経伝達システムは、認知症状を伴う多くの疾患で影響を受けている(図1)。筋萎縮性側索硬化症では、高レベルのカルシウム伝染性AMPA受容体が確認された(Leal and Gomes, 2015)。炎症誘発、ミクログリア駆動の興奮毒性は、MSの中心的なイベントである(Gonsette, 2008)。ASDでは、皮質のグルタミン酸濃度の上昇が一般的な所見である(Brown et al 2013)。ADでは、アミロイドがアストロサイトからの過剰なグルタミン酸放出を誘導し(Esposito et al 2013年)再取り込みを担うアストロサイトのグルタミン酸トランスポーターをブロックし(Zott et al 2019年)脱分極の増加に伴ってカルシウム流入を上昇させ(Fu et al 2012年)NMDA受容体を活性化する(Ferreira et al 2010)。さらに、タウはシナプス前のグルタミン酸放出を増強する可能性がある(Decker er al 2016)。正常なapoEの機能は、グルタミン酸効果の減衰に不可欠であるが、その遺伝子変異は、ADの最も知られた危険因子である(Aono er al)。 一方、NMDA受容体の活性化が長く続くと、アミロイドベータの産生・分泌が亢進し(Lesné et al 2005年)タウのリン酸化が亢進する(Liang et al 2009)。側頭葉てんかん患者の手術サンプルにおけるphospho-tauレベルの上昇を説明できるかもしれない(Tai er al)。
図1 認知障害におけるグルタミン酸を介した興奮性亢進とミスフォールドした毒性タンパク質の蓄積の悪循環
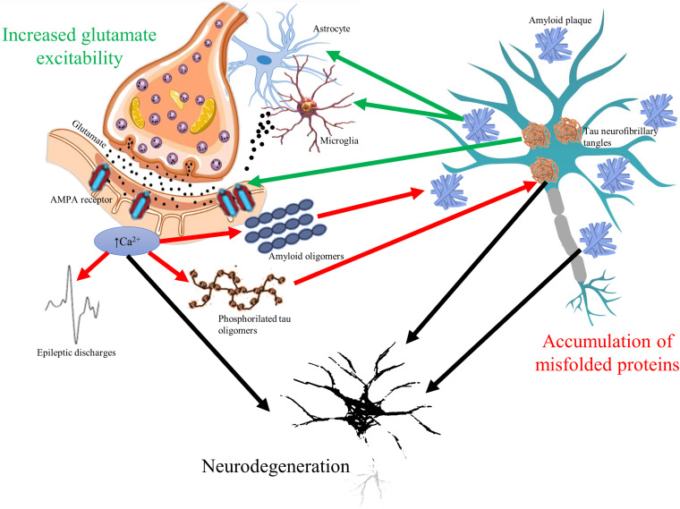
すべての認知障害では、グルタミン酸の神経伝達物質が変化し、α-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸(AMPA)受容体が過剰に発現し、細胞内のカルシウムシグナルが上昇している。カルシウムシグナルの上昇により、アミロイドオリゴマーの細胞外への放出が増加し、タウオリゴマーのリン酸化が増加する(赤矢印)。てんかん発作に代表される神経細胞の発火の増加は、グルタミン酸による興奮性亢進の結果でもある。一方、アミロイド斑やタウ神経原線維の蓄積は、グルタミン酸受容体の発現を変化させ、ミクログリア細胞やアストロサイトからのグルタミン酸の過剰放出を誘発する(緑矢印)。このような双方向の病理学的関係により、認知障害に共通する特徴である進行性の神経変性(黒矢印)が生じる可能性がある。
てんかん活動はNMDA受容体の過剰な刺激と関連しているので、てんかん発作がさまざまな形態の認知障害に見られる神経損失の一因になっているのではないかと推測するのは興味深いことである。実際、てんかん発作の存在は、ADの症状の進行を早めることと関連している(Vossel er al 2013)。しかし、短時間の興奮(IEAおよびSEA)はグルタミン酸放出の増加とも関連しており(Kang et al 2005年)てんかん発作の有害な影響は予測可能である。このことは、Doレベチラセタムらの研究(2013)では、20Hzのバースト活動でもアミロイド負荷が増加することが示され、Beroらの研究(2011)では、神経細胞の過活動がアミロイド負荷の増加と関連することが示され、Vosselらの報告(2016)では、ADの加速的な進行におけるSEAの役割が示されていることからも補強されている。
神経回路のリモデリング
脳の大規模な機能ネットワークにおける興奮性グルタミン酸系活動と抑制性GABA系活動のバランスは、すべての認知機能において重要である(Sengupta er al 2013)。抑制の減少または興奮の増加は、ictogenesisにおいて重要な役割を担っている(Bonansco and Fuenzalida, 2016)。局所的なGABAergic sproutingは、てんかん活動の遠方への拡散を制限し(Sutula, 2002)てんかん発生領域を連結された脳構造から相対的に切り離す。接続性の研究は、中側頭葉てんかん患者において海馬内接続性が増加し、海馬と皮質の接続性が低下しているという病理学的所見を支持するものである(Warren et al 2010,Engel et al 2013)。発作が伝播しててんかんネットワークが拡大すると、海馬-皮質の構造的な連結性が変化し、グローバルネットワークの同期性が低下し、リズミカルな脳活動の組織化が損なわれ、最終的には生理的ネットワークのランダムな組織化につながる可能性がある(Luo er al 2012; 図2)。
図2 てんかん放電の結果としての海馬-皮質回路のリモデリングまたは海馬-皮質回路
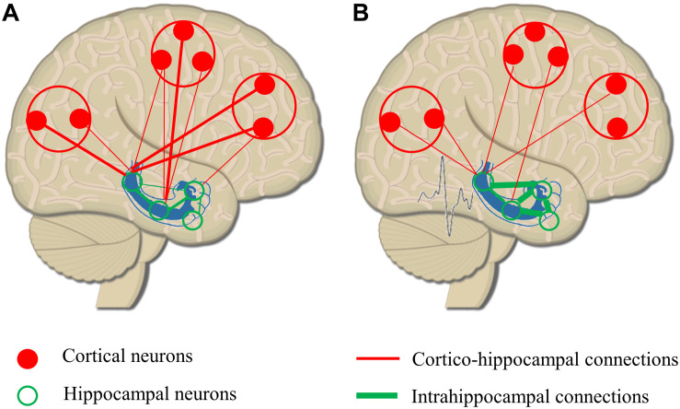
(A)海馬-皮質間の生理的な結合で、局所的な結合が多く強いが、遠方の結合は少なく弱い。(B)てんかん放電の結果、海馬内の結合が増加し、長い距離の結合の強さと数が減少していることがわかる。ネットワーク回路の再構築により、海馬が皮質領域から相対的に孤立し、海馬と皮質の結合の有効性が低下する。
IEAはてんかん発作と同じ病理学的ネットワークの中で広がっているが、根底にある異常な活動は発作の閾値に達していないことを示唆する証拠が増えている(Dzhala and Staley, 2003)。この仮説は、IEA後に観察された一過性認知障害(TCI)の臨床観察からも支持されている。TCIは、記憶のエンコーディング、注意、コミュニケーション、または視空間の能力が一時的に低下することを特徴とする(Holmes and Lenck-Santini, 2006)。IEAが頻繁に起こる場合、てんかん活動は脳機能の長期的かつ遠大な変化を誘発する可能性がある(Caciagli et al 2014)。これは、IEAが皮質のダウンステートを介して紡錘体との結合を示すというGelinas et al 2016)の知見によって支持されている。機能的MRIを用いた研究では、離れた皮質部位でも血中酸素濃度依存イメージング(BOLD)信号にスパイク関連の変化があることが示され、これらの示唆を補強した(Federico er al)。 また、脳波の結合性解析を行ったところ、発作に関連した変化と同様に、IEA時にはてんかんネットワークで機能的結合性が増加し、デフォルトモードネットワーク(DMN)などの機能的ネットワークとてんかんネットワークの間では機能的結合性が低下することを示す同様の知見が得られた(Bettus et al 2008,Fahoum et al 2013)。注目すべきは、これらの変化は長期的な疾患では恒常的なものとなり、進行中のIEAとは無関係であることである(Luo er al)。
すべての病態において、大規模な神経ネットワークの大幅な変化が示されている。海馬内活動の上昇は、ADの前駆段階(認知症の軽度認知障害)で見られ(Bakker et al 2012年)皮質の菲薄化(Putcha et al 2011)や、DMNを含む他の神経ネットワークとの断絶と相関している(Pasquini et al 2015)。DLBやFTDを含む様々な形態の認知症においても、局所的な結合性の増加とグローバルな結合性の減少を示す同様の所見が報告されている(Agosta et al 2013; Dauwan et al 2016)。大規模な脳ネットワーク内の過活動とネットワーク間の連結性の低下は、小児ASDの研究における中心的な所見である(Cerliani et al 2015,Nomi and Uddin 2015)。ADHD患者の前頭葉では、ネットワーク内のハイパーコネクティビティが増加しており(Wang et al 2009)長い距離の接続が失われていることが報告されている。興味深いことに、記憶障害のあるMS患者において、海馬と皮質の結合性におけるADに類似した変化(海馬内結合性の増加とグローバル結合性の減少)が実証されているが、海馬の活性化の減少も並行して確認されている(Hulst er al 2015)。
睡眠に関連する記憶統合プロセスの乱れ
睡眠はすべての脊椎動物に一定の間隔で発生し、恒常的に制御されている。睡眠不足は、ホルモン、恒常性、体温調節の深刻な変化、感染症の発生率の上昇、心血管制御の機能障害など、心身の健康に有害な影響を及ぼすことがよく知られている(Shahar er al 2001)。人間の睡眠は、ノンレム睡眠とレム睡眠に区別される。二重プロセス仮説では、暗黙的な記憶の形成にはレム睡眠が重要であり、エピソード記憶の形成にはノンレム睡眠、特に徐波電気活動を特徴とするエピソード(徐波睡眠、徐波睡眠)が必須であるとしている(Diekelmann and Born, 2010)。広く受け入れられている2段階の記憶モデルでは、脳の構造を、エンコーディング機能を持つ短期記憶容量を持つ領域と、長期記憶の役割を果たす領域に区別している(Walker, 2005)。記憶の統合プロセスでは、オフライン期間(徐波睡眠など)に短期記憶アイテム(新しく発達したシナプス結合)が繰り返し再活性化され、記憶の断片が長期記憶に強化・適応される(Stickgold, 2005)。
この相互作用のための解剖学的構造は、海馬と皮質領域の間のネットワークである。ヒトの徐波睡眠では、脳波は0.5~4Hzのゆっくりとした振動を示し、ニューロン膜の脱分極(upstates)と過分極(downstates)のダイナミックな変化が見られる(Csercsa er al)。 このダイナミックな変化は、強いシナプス結合の強化と並行して、弱いシナプス結合を減らす機会となり、シナプスダウンスケーリングとして知られている(Tononi and Cirelli, 2006)。徐波睡眠中のニューロンは、皮質-皮質、タラモ-皮質、海馬-皮質のネットワークで広範囲に渡って同期している(Dang-Vu et al 2008)。高い同期性は、海馬が生成した鋭い波のリップル、視床の睡眠紡錘、皮質が誘導した徐波のトップダウン制御による位相同期の共起を示す動物およびヒトの神経生理学的研究によって補強されている(Maingret er al)。
てんかんのスパイクは短いが鋭波に似ており、鋭波よりも速い波紋の振動に関連している(Bragin er al)。 多くの研究では、高速の波紋に結びついたてんかん放電が、正常な記憶プロセスを阻害する可能性があると仮定されている(Halász et al 2019,図3)。さらに、それらは、鋭い波動の悪化した記憶統合の機能不全(「ダミー」)亜種としても作用する可能性がある(Gelinas et al 2016)。記憶形成における睡眠関連IEAの重要な役割は、以下の知見によって示唆されている。IEAは徐波睡眠で主に発生し(Bazil, 2000)レム潜時(夜間にレムが最初に発生する時間)の延長、徐波睡眠の持続時間の短縮(Miller et al 2016)生理的波紋の数の減少(Jefferys et al 2012)と関連し、視床紡錘体形成に悪影響を及ぼす(Frauscher et al 2015)。
図3 記憶統合における海馬-視床-皮質の結合
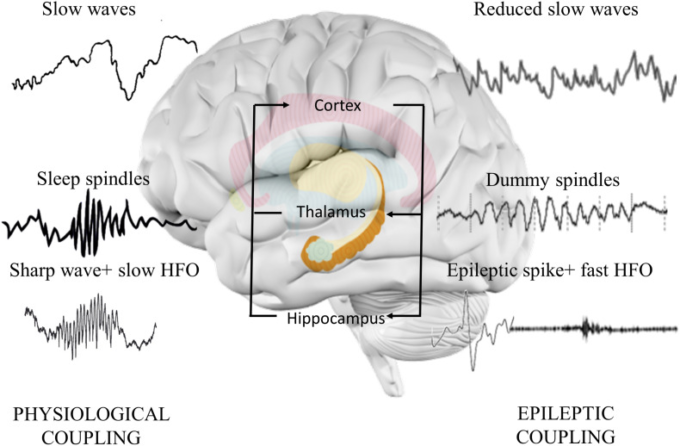
生理学的な記憶統合過程では、海馬、視床、新皮質の同期が不可欠である。海馬の鋭い波紋は、海馬ニューロンのシナプス結合に最近保存された記憶項目が再生されていることに対応する。12-16Hzの周波数を持つ視床の睡眠紡錘体は、海馬の活動と皮質のニューロンを同期させる、記憶形成の必須要素である。大脳皮質の睡眠関連徐波は、海馬の鋭い波の波紋と視床の睡眠紡錘の活性化を促進する最高の同期状態を提供する。てんかんの放電は、より速い高周波振動と結合した鋭い波の病的な変化に対応する。この変化は紡錘体の構造を乱し、正常な紡錘体の活動を低下させ、持続時間が長く、とがった外観を持つダミーの紡錘体の形成を誘発する。大脳皮質の徐波も減少しているが、これはおそらくスパイクによる大脳皮質の過分極(ダウンステート)が原因であると考えられる。このような変化は、記憶統合プロセスの効果を低下させる可能性がある。
てんかん患者の記憶障害には睡眠の変化が重要な役割を果たしているかもしれないが、認知障害でも睡眠障害は非常に多く見られる。アルツハイマー病患者の約40%が睡眠障害を抱えており(Tractenberg et al 2003年)夜間の睡眠障害、日中の眠気の増加、不眠症(Rao et al 2008,Osorio et al 2011年)日暮れ(午後遅くの焦燥感や混乱)(Volicer et al 2001)などが挙げられる。DLB患者の約50〜83%がレム睡眠行動障害を患っている(Ferman et al 2010)。MSでは、閉塞性睡眠時無呼吸症候群(Braley et al 2014年)レストレスレッグ症候群(Manconi et al 2007年)および中等度または重度の不眠症が頻繁に観察される(Brass et al 2014)。不眠症はASDの子どもの44~83%で報告されている(Miano and Ferri, 2010)。ADHD患者を対象とした数多くの研究において、レストレスレッグ症候群、睡眠時周期性四肢運動、睡眠時発症不眠、夜間運動、閉塞性睡眠時無呼吸の発生率の顕著な上昇が強調されている(Konofal et al 2010)。認知障害においても、睡眠の微細構造が大きく損なわれているようである。ASDでは、レム睡眠の減少、睡眠紡錘体の数の減少、徐波睡眠の減少、表層段階の増加が報告されている(Richdale and Schreck, 2009)。徐波睡眠の過度の減少は、睡眠紡錘体とK複合体の減少を伴うADの特徴である(Petit et al 2004)。ADHDの子どもたちは、周期的交替パターンと睡眠紡錘の割合が低いことを示している(Miano et al 2006,KirovとBrand 2014)。このように、認知障害において、睡眠不足の役割は疑問視されていない。
徐波睡眠はすべての認知障害で減少するが、SEAはてんかん患者と同様に深い睡眠に蓄積されているようである。アルツハイマー病患者(Vossel et al 2016)やASD患者(Chez et al 2006)を調べた研究では、約90~100%のてんかん放電が徐波睡眠で検出されている。さらに、夜間脳波でのてんかん様放電の発生は、ADHD患者における注意欠陥の高さや衝動性の高さと正の関係がある(Danhofer et al 2018)。てんかん活動は睡眠構造の組織化を損ない、睡眠関連の記憶定着プロセスを乱すため、SEAが睡眠構造の乱れを加速させ、記憶機能の低下に寄与しているのではないかと述べることは興味深い。
治療的側面
最新の知見と推奨事項
AEDの主な用途は、最適な副作用プロファイルでてんかん発作を効果的に軽減または根絶することである。約30種類のAEDが市販されており、発作の種類、年齢、体調、患者の現在の薬物使用状況に応じて、ファーストライン、セカンドライン、サードラインの適応がある。すべてのAEDのメカニズムを完全に理解しているわけではないが、その有効性は発作数の減少の程度として評価される。てんかん患者の発作をコントロールするために、我々は多大な経験と最近更新されたガイドラインを持っているが、認知障害におけるAEDの選択については比較的限られたデータしかない。ADでは、レベチラセタム(LEV)ラモトリギン(LTG)ガバペンチン、カルバマゼピン、バルプロ酸、フェニトイン、フェノバルビタールに関する研究がある(Horváth et al 2016,Vossel et al 2017)。レベチラセタムとLTGのみが、優れた有効性(1年間の追跡調査で発作数が60~70%減少)と、認知的な副作用のない忍容性に達した(Belcastro et al 2007;CumboとLigori 2010;Lippa et al 2010)。注目すべきは、レベチラセタムによる治療では認知スコア(MMSEおよびADAS-Cog)がわずかに上昇し、LTGの適用では気分が有意に改善したことである(Cumbo and Ligori, 2010)が、この研究はプラセボ対照ではなかった。他の神経認知機能障害における発作制御のためのAED適用に関する研究は存在しない(Horváth er al 2018a)。現行のガイドラインによると、てんかん患者と比較して、他の認知障害では発作の管理に違いはない(Myers and Johnson, 2007; Kelley and Rodriguez, 2009; Felt et al 2014)。
認知機能の低下におけるてんかん放電の中心的役割を支持する証拠が増えている一方で、SEAに影響を与える研究は認知障害では限られている。神経認知機能障害では、レベチラセタムを2週間投与することで、非てんかん性MCI患者のパターン分離のパフォーマンスが有意に改善したが、その他の認知スコアは改善せず、機能的MRIで測定した海馬と内嗅皮の皮質活動の正常化と一致した(Bakker et al 2015)。単回投与のレベチラセタムを用いたMusaeus et al 2017)の研究では、抗てんかん療法がアルツハイマー病患者のβ帯のパワーをわずかに増加させる一方で、ポジティブな認知効果は検出されなかった。残念ながら、他の形態の神経認知機能障害に関する研究は行われていない。さらに、ほとんどのMCIやADの研究は二重盲検観察ではなく、SEAを選択基準や治療効果のマーカーとして使用していない。レベチラセタムに関する現在進行中の臨床試験(例:ILiAd, NCT03489044; LAPSE, NCT04004702; LEV-AD, NCT02002819試験)では、ターゲットグループの特定のためにSEAを評価しているが、結果はまだ発表されていない。てんかん発作を伴わないASD患者においては、AEDの使用に関する7つのプラセボ対照無作為化試験がある。これらの研究では,バルプロ酸,トピラマート,LTG,レベチラセタムの有用性が分析されている。メタアナリシスの結果によると、AEDは行動症状に有意な影響を及ぼさなかったが、研究ではSEA患者のサブグループを区別しておらず、EEGコントロールもされていない(Hirota er al 2014)。ADHDでは、非てんかん患者へのAEDの使用については、独立した単一の報告しかない。バルプロ酸を用いた研究では、ADHD患者の62%で前頭部SEAが減少し、その減少はADHD評価尺度の改善と相関していたことが報告されている(Kanemura er al 2013)。Öncü et al 2014)の研究では、双極性障害またはうつ病を併発したADHD患者の78%においてLTGが気分スコアを改善したが、EEGは適用されなかった。MSでは神経因性疼痛に対してAEDが頻繁に処方されているが、SEAや認知機能への影響に関する研究は行われていない(Solaro er al)。
加齢に伴う薬理作用や薬物動態の変化は、高齢者によるAEDの研究を複雑にしている。AEDの選択にあたっては、安全性の問題や禁忌を慎重に考慮する必要がある。過去の研究では、AEDの使用は、転倒(Seppala et al 2018年)脳卒中(Sarycheva et al 2018年)骨折(Shen et al 2014年)肺炎(Taipale et al 2019年)および有害な薬物間相互作用のリスク上昇と関連している(Anderson 2004)。従来のAED(フェニトイン、バルプロ酸など)の適用は、予定外の入院や運動機能の低下と関連していた(Lin et al 2017)。カルバマゼピンおよびオクスカルバマゼピンの使用は、心臓の有害事象、低ナトリウム血症、および鎮静に付随していた(Spina and Perucca, 2002)。このように、禁忌は個別に検討する必要がある。
認知機能障害の治療におけるAEDの潜在的な役割を理解するためには、様々な認知機能障害を対象とした二重盲検プラセボ対照試験が必要である。脳波によるSEAの検出は、対象となる患者群を正確に特定する上で重要な役割を果たすと考えられ、治療効果を判定する上での基本的な指標となる可能性がある。しかし、AEDは主に発作の制御に用いられる。しかし、AEDは主に発作抑制のために使用されているため、てんかん様放電(IEAやSEAを含む)の抑制効果は限定的であり、未知数である。さらに、認知障害における興奮性亢進を適切に治療するためには、新規の標的の特定と新薬の開発が重要である。
新しい方向性の可能性
これまで述べてきたように、ここ数十年の間に多くのAEDが市場に投入され、さらに多くのAEDが開発されている。基本的に、すべてのAEDは、てんかんの特徴である興奮性と抑制性の神経伝達の異常なバランスを回復するように設計または最適化されている。ほとんどのAED、特に第一世代のAEDは、選択性に乏しく、イオンチャネル、グルタミン酸、GABAA受容体など、神経の興奮性を司る必須のメディエーターに作用する。これらの薬剤は、神経ネットワークに広く作用し、鎮静作用や認知機能障害などの様々な望ましくない副作用を引き起こす(Ortinski and Meador, 2004)。そのため、様々な神経精神疾患に伴うSEAまたはIEAの治療には、個々の神経回路の興奮性を調節する、より選択的なターゲットを持つ新しい抗てんかん薬が適している。
そのような薬剤の一つに、シナプス小胞タンパク2A(SV2A)に結合することで神経細胞の興奮性を調節するというユニークな効果を持つレベチラセタムがある(Löscher er al)。 一般的にシナプス後の受容体やイオンチャネルに作用するより従来のAEDと比較して、レベチラセタムは患者の忍容性が高く、強い鎮静作用を誘発しない傾向がある(Cramer et al 2003,Abou-Khalil 2008)。興味深いことに、レベチラセタムは、その前身であるピラセタムを化学的に改良した後、認知機能向上剤として開発された。低用量のレベチラセタムは、動物モデルと臨床の両方で認知機能を改善することがいくつかの証拠によって示されている。この薬剤のこれらの治療活性は、海馬の過活動を調節することに起因する(Haberman et al 2017)。興味深いことに、レベチラセタムは、成人てんかん患者(Stodieck et al 2001)および小児てんかん患者(Larsson et al 2010)だけでなく、ADHDの小児(Bakke et al 2011)においてもIEAに明確な効果を示し、その結果、臨床症状(例えば、レストレスレッグ)が改善された数少ないAEDの1つである(Gagliano et al 2011)。さらに、前臨床試験では、レベチラセタムがADおよび統合失調症のモデルにおいて認知機能を改善することが示されている(Sanchez et al 2012,Koh et al 2018)。SV2A PETトレーサーを用いたいくつかの研究では、認知障害を伴ういくつかの神経精神疾患および神経変性疾患に関連するSV2A発現の減少が示されていることから、レベチラセタムの作用機序との関連があるかもしれない(Heurling er al 2019)。これは、アルツハイマー病患者において最も明確に示された(Chen et al 2018)。SV2Aは、認知性能に関連するシナプス回路(海馬など)の病理学的変化を反映するシナプス病のマーカーであると考えられている。これらの観察結果から、レベチラセタムが、皮質活動の増加に伴う、あるいはADのSEAに伴う認知障害の治療薬としての可能性を探る臨床試験が数多く行われており(Bakker et al 2015,Vossel et al 2016年)現在進行中の多数の二重盲検試験もまもなく終了する予定である。
GABAA受容体のサブユニット選択的モジュレーターは、SEAやIEAに関連する脳領域に個別に局在するため、有望な治療法となり得る。このような化合物の主な利点は、ベンゾジアゼピン系などの従来の非選択的な薬剤に比べて、安全性と忍容性が向上していることである。このような観点から、α5サブユニットを含むGABAA受容体の選択的なポジティブアロステリックモジュレーターは、てんかん様放電の発生を抑制する可能性があり(Biagini et al 2010年)動物モデルにおける認知能力や記憶能力に有望な効果を示す研究もある(Koh et al 2013)。
グルタミン酸取り込みの異常は、SEAや認知の欠損を伴ういくつかの神経精神疾患に共通するもう一つの重要なメカニズムである(O’Donovan er al 2017)。最近の研究では、アルツハイマー病患者の辺縁領域で観察される神経細胞の興奮性亢進は、グルタミン酸再取り込みの抑制によって開始され、βアミロイドによる神経変性の悪循環を引き起こす可能性があることが示されている(Zott et al 2019)。したがって、興奮性アミノ酸トランスポーター2(EAAT2)の発現または機能を増加させる薬剤によるグルタミン酸の取り込みの回復は、様々な認知障害に伴うSEAまたはIEAの治療に新たな治療的適応を見出すことができると考えられる(Fontana, 2015)。
考察
神経認知機能障害、ASD、ADHD、およびMSを含む認知障害は、人口の約40~50%に影響を与える全体的な有病率が高い。これらの疾患に共通する特徴は、疾患の経過中にてんかん発作の発生率が高いことであり、興奮亢進が認知障害の病態に関与している可能性が示唆されている(Tuchman and Rapin, 2002; Austin and Caplan, 2007; Horváth er al)。 IEAとSEAの有病率と影響は、てんかん発作と比較して、認知障害ではあまり調査されていない。しかし、現代のてんかん学では、孤立していても頻繁に起こるてんかん活動は、てんかん発作よりもてんかん患者の認知機能を損なう可能性があると認識されているため、これらの現象の研究は将来の重要な方向性を示すかもしれない(Berg, 2011)。
また、IEAとSEAの適切な定義や区別がなされていないため、様々な有病率調査の結果を比較することが困難である。interictal用語がictus(発作)の存在を仮定しているのに対し、IEAは明らかな臨床的発作を伴わないてんかん様活動を表現するために頻繁に使用されている。しかし、伝統的なてんかん学では、検出可能な臨床的または電気生理学的発作を伴わないてんかん様放電を良性のEEG変異として認識している(Santoshkumar et al 2009)。てんかん学の観点からは、良性とは、検出された活動が、臨床的に診断されたてんかんやその他の神経学的または精神医学的障害と関連しないことを意味する。しかし、我々の考えでは、発作が起きないことが必ずしも臨床的に良性の行動とは一致しない。可能な説明としては、てんかん様放電とてんかん発作は、皮質の興奮性が高まった結果であり、マーカーであるが、これらはスペクトルの異なる端を表している(Badawy et al 2009a)。ネットワークの興奮性がある閾値を超えると、患者はてんかん発作を起こし、発作間のてんかん放電が頻繁に起こるようになり、てんかんと診断される(Dzhala and Staley, 2003)。閾値に達していない場合、SEAは検出可能であり、一般的なマーカーとしての興奮性の増加を示す(Badawy et al 2009b)。SEAが認知機能の低下と相関することを示唆する神経心理学的・神経画像学的研究が増えていることから(Vossel er al 2016)詳細な神経心理学的調査を伴わないてんかん様脳波グラフォレを「良性」と呼ぶことの再検討を提案する。我々のレビューでは、IEAとSEAという2つの用語を体系的に分離し、てんかん発作が証明されていないてんかん状事象にはSEAを排他的に使用することを提案している。しかし、この区別は重要な結論をもたらした。SEAは、時間的、空間的特性、認知機能への影響に関して、IEAと同様の特性を示す。
IEAとSEAはともに、アルツハイマー病患者(Vossel et al 2016,Horváth et al 2017a)ASD患者(Chez et al 2006年)ADHD(Silvestri et al 2007)の睡眠中に蓄積される。IEAとSEAはともに、AD(Rao et al 2009;Vossel et al 2013,2016;Cretin et al 2016;Sarkis et al 2016;Horváth et al 2018b)ADHD(Lee et al 2016)ASD(Chez et al 2006)では、主に前頭側頭領域上に記録されている。てんかん患者において、発作間放電の頻発は、治療効果の低下、手術後の転帰の悪化、認知機能の低下の増大に関連している(Drane er al 2016)。徐波睡眠におけるIEAの頻度が高いほど、ESESを有するてんかん患者の言語機能に顕著な障害があるとされている(Schertens-de Boer, 2009)。IEAを治療的に減少させることで、焦点性てんかんの子どもの行動問題が改善した(Pressler er al)。 SEAは、ADの2倍速い進行(Vossel et al 2016年)ASDにおける退行の高い有病率(Giannotti et al 2008,Stefanatos 2008年)MSにおける活動性病変数の上昇(Lebrun 2006年)ADHDにおける将来の発作の高い発生率(Lee et al 2016)に付随する。AEDによるSEAの減少は、ADHD患者の行動スコアの60%の改善(Bakke et al 2011年)軽度認知障害患者の認知スコアの改善(Bakker et al 2015年)ASD患者の認知スコアの有意な正の変化(Hollander et al 2001)につながった。
文献の概要に基づいて、SEAが認知に有害な影響を及ぼす方法は様々である。共通しているのは、すべての認知障害で損なわれているグルタミン酸系である(Gonsette, 2008; Esposito et al 2013)。興奮性活動の増加は、様々な認知障害において、様々な神経構造の神経変性につながる関連する興奮毒性をもたらす(Mehta et al 2013)。神経変性プロセスでは、てんかん発作が有害なタンパク質(タウ、アミロイドなど)の蓄積を加速させ、神経損失を促進する(Liang et al 2009,Doレベチラセタム et al 2013)。これらのプロセスは、ミスフォールドしたタンパク質がグルタミン酸の過剰放出を誘発するため、悪循環に陥る(Ittner and Götz, 2011)。このような変化は、局所的な神経ネットワークの過興奮を引き起こし、代償的なリモデリングメカニズムを活性化する(Sutula, 2002)。リモデリングは、影響を受けた構造体を他の機能的ネットワークと切り離すことにつながる(Engel er al 2013)。このことは、認知障害において遠方の接続が失われていることを示す多くの研究によって支持されている(Liu er al 2014)。一般的な興奮性の拡張は、神経認知機能障害患者の機能的な神経ネットワークにおける病的なタンパク質の拡散に重要な役割を果たしている可能性がある(Pievani et al 2011,Hoenig et al 2018)。大規模な機能回路が病的プロセスに関与する場合、その機能は異常を示し、それは睡眠構造の変化によって示される(Palop and Mucke, 2010)。てんかん放電の増加は、徐波睡眠の減少、機能不全のダミー睡眠紡錘体の過剰生産につながり、最終的には記憶の符号化と統合プロセスにおける睡眠機能の喪失につながる(Malow, 2007; Halász er al 2019)。てんかん放電は病理学的プロセスにおいて重要であるため、修正は認知障害における新たな治療の可能性があるかもしれない(Bakker er al)。
SEAまたはIEAを広範な神経精神疾患および認知障害と関連付ける観察およびデータが急速に出現していることから、神経細胞の過剰興奮性を標的とすることに焦点を当てることができる、これまで未開拓だったいくつかの治療の機会が開かれている。このような状況では、このような異常な神経細胞の活動を正常化することができるはずの既存のAEDを使用することが明らかな解決策となる。しかし、一部のAEDでは有望な結果が得られているものの、このクラスの薬剤は一般的に忍容性が低く、治療の幅が狭く、認知能力の低下を伴うことが多い。したがって、SEAまたはIEAが認められた患者を対象に、脳の個別領域における神経細胞の興奮性をより選択的に、おそらくより穏やかに調節することができれば、大きな治療効果が得られる可能性があり、認知障害に対する新しい治療法となるだろう」と述べている。
