Contents
Glycerophospholipid Supplementation as a Potential Intervention for Supporting Cerebral Structure in Older Adults
httホスファチジルセリン://www.ncbi.nlm.nih.gov/pmc/articles/PMC5845902/
オンラインで公開2018年3月7日
要旨
サプリメントによる栄養摂取量の調整は、加齢とともに明らかになる脳の構造的な衰えの軌跡を変化させるのに有効であると考えられる。これまでに、ビタミンB群、オメガ3脂肪酸、またはレスベラトロールを慢性的に補給することで、衰えの速度を遅らせたり、脳組織を修復したりすることが観察されている高齢者を対象とした臨床試験が数多く行われている。また、これらの効果はまだ成人の人間で調査されていないが、グリセロリン脂質(GPL)とのサプリメントは、脳の構造に利益をもたらすかもしれないことを示す動物実験からのいくつかの証拠がある。
研究のこの乏しさにもかかわらず、グリセロリン脂質の補給が有益に変更またはそれに対して保護するように見える高齢者の脳構造の不良な予測因子の数がある。これらは、ホモシステインの濃度の上昇、活性酸素種の不均衡な活動の両方が酸化ストレスのリスクを増加させる、プロ炎症性メッセンジャーの濃度の増加、同様に貧しい心臓と脳血管機能が含まれている。
そのようなものとして、それはグリセロリン脂質の補充は、高齢者の脳構造をサポートすることが仮定されている。これらの脳効果は認知機能に影響を与える可能性がある。
本レビューは、高齢者の脳構造の完全性に対するグリセロリン脂質補給の効果を調査する将来の臨床試験のための理論的基礎を提供することを目的としている。
キーワード:グリセロリン脂質、サプリメント、介入、脳構造、高齢者
序論
脳構造は加齢とともに低下することが観察されている。脳の構造的完全性の加齢に関連した低下は、マクロおよびミクロ構造レベルの両方で明らかであり(例えば、全体および領域の体積の減少、皮質の菲薄化の増加、白質病変の重症度の増加、およびミクロの白質経路の完全性の低下)早ければ若い成人期に始まる可能性がある(Resnick et al 2003; Allen et al 2005; Fotenos et al 2005; Walhovd et al 2005; Bendlin et al 2010; Hendlin et al 2010)。2003; Allen et al 2005; Fotenos et al 2005; Walhovd et al 2005; Bendlin et al 2010; Hsu et al 2010; Westlye et al 2010; Sala et al 2012; Taki et al 2013a)。) また、高齢になると明らかになる認知機能の重要な予測因子として、脳の構造的完全性の低下を指摘する文献も増えている(Davis et al 2009; Bendlin et al 2010; Lockhart et al 2012; Arvanitakis et al 2016)。
すべての成人は、加齢に伴って大脳構造(および認知機能)が少なくともある程度低下しているが、低下の軌跡は一定ではない。成人の中には「正常な加齢」と一致した脳の衰えを示す者もいるが、(機能障害の悪化順に)「加齢性記憶障害」(AAMI)「軽度認知障害」(MCI)アルツハイマー型認知症(AD)などの状態を示す者もおり、これらはいずれも脳構造のより深刻な劣化と認知機能の低下を特徴とする(Anstey and Maller, 2003; Hänggi er al 2011;Smith et al 2011;Bosch et al 2012;Maillard et al 2012;Wang et al 2014;Zheng et al 2014)。) これらの状態は加齢に伴う必然的な特徴ではなく、高齢者の脳構造をサポートすることができる介入を行うことで、集団内での発生率を低下させることができる可能性がある。
加齢に伴う脳構造の完全性に影響を及ぼすと考えられている因子の1つは、栄養摂取である(Scholey, 2018)。 2016;Köbe et al 2016)またはω3多価不飽和脂肪酸(ω3-PUFA;Samieri et al 2012;Tan et al 2012;Titova et al 2013;Pottala et al 2014;Gu et al 2016)は、高齢者におけるより大きな脳のマクロおよびミクロ構造の完全性を予測する。さらに、利用可能な臨床試験からのデータは、これらの栄養素だけでなく、レスベラトロールなどの他の栄養素を慢性的に補給することで、脳の構造的完全性が強化されるか、または時間の経過とともに脳の衰退の軌跡が改善される可能性があることを示している(Smith et al 2010;Douaud et al 2013;Witte et al 2013;Jerneren et al 2015;Köbe et al 2017;Zhang et al 2017)。これらの構造的効果が、少なくとも部分的に、サプリメントに続く高齢者の認知パフォーマンスへの利点を支える可能性がある(Durga et al 2007; Yurko-Mauro et al 2010; de Jager et al 2012; Witte et al 2013)。
リン脂質 (PL) と特にグリセロリン脂質 (グリセロリン脂質) の消費は、また、高齢者の脳構造とその後の認知機能に利益をもたらす可能性がある。グリセロリン脂質の種であるホスファチジルコリン(ホスファチジルコリン)ホスファチジルエタノールアミン(ホスファチジルエタノールアミン)およびホスファチジルセリン(ホスファチジルセリン)は哺乳類の細胞膜に豊富に存在し、これらのグリセロリン脂質(特にホスファチジルコリンおよびホスファチジルセリン)の供給が経口補給によって動物の認知機能を改善することができるという証拠が増えてきている(Zanotti er al 2001;片岡加藤 et al 2005;矢口 et al 2009,2010;李 et al 2010;バベンコおよびセメノバ 2011;永田 et al 2011;朴 et al 2013;張 et al 2015;Qu et al 2016;温ら。2016a,b)または腹腔内/脳内注射(Drago et al 1981; Zanotti et al 1984; Corwin et al 1985; Sakai et al 1996; Blokland et al 1999; Claro et al 1999,2006; Suzuki et al 2000)。同様の結果は、認知機能のレベルが異なる高齢者(すなわち、主観的な記憶不満を伴う正常な認知機能、加齢に伴う「認知機能障害」、AAMI、MCI、または認知症)を対象とした経口補液投与後にも明らかになっている。これらの試験の詳細および所見は、表11-3にまとめられている。
表1 自覚的記憶不定愁訴を有する高齢者におけるグリセロリン脂質補給と認知機能(時系列逆順に記載された試験)と被験者タイプ別
| トライアル | 設計 | 科目 | N | 年齢() | 処理 | 時間 | 結果 |
|---|---|---|---|---|---|---|---|
| More et al。、2014(サブスタディ1) | R、DB、ホスファチジルコリン、PG | SMC | 72 | 60〜80 | SB-ホスファチジルセリン(300 mg / d)+ PA(240 mg / d) | 3ヶ月 | ベースラインの低パフォーマンスを比較した場合、WMSパフォーマンスに対する治療効果はない。ベースラインのより高いパフォーマーでの治療を支持するグループ間のWMSパフォーマンスの有意差 |
| Vakhapova et al。、2014 | OLE | SMC | 122 | 72.4±8.3(ナイーブ); 72.1±7.9(続き) | 100 mg ホスファチジルセリン / d(および26 mg DHA + EPA) | 15ワット | ホスファチジルセリン-DHA未経験の参加者(以前の臨床試験でホスファチジルセリンを受けなかった)の持続的注意と記憶認識のパフォーマンスが大幅に改善された。 |
| リヒター他、2013年 | OL | SMC | 26 | 50〜90(74.6±1.7) | 300 mg / d SB-ホスファチジルセリン | 12ワット | 大幅に改善されたメモリパフォーマンス、実行機能、精神的柔軟性 |
| 加藤片岡ほか、2010年 | R、DB、ホスファチジルコリン、PG | SMC | 73 | T:59.6±1.0(高用量)T:59.1±1.1(低用量)P:59.6±1.1 | 100mg / dSB-ホスファチジルセリンまたは300mg / d SB-ホスファチジルセリン | 6ヶ月 | すべてのグループで、メモリパフォーマンスがベースラインから大幅に向上した。ベースラインとプラセボのパフォーマンスが低い高用量治療参加者のHDS-Rテストのパフォーマンスが向上した。プラセボと比較して、高用量または低用量の治療を受けている参加者の言語記憶想起の遅延の改善 |
| リヒター他、2010年 | OL | SMC | 8 | 69.3±3.2 | 300 mg ホスファチジルセリン / d(および37.5 mg DHA + EPA) | 6ワット | 治療後の遅延言語想起が大幅に改善された |
| Vakhapova et al。、2010 | R、DB、ホスファチジルコリン、PG | SMC | 157 | T:72.9±8.20P:73.01±8.28 | 300 mg / d ホスファチジルセリン(および79 mg DHA + EPA) | 15ワット | 即時の口頭での想起が大幅に改善された。RCFを完了するための時間が短縮される傾向が観察されたが、有意性に達することができなかった(p = 0.079) |
| Jorissen et al。、2001 | R, DB, ホスファチジルコリン, PG | AAMI | 120 | T:65.8±1.1(高用量)T:65.3±0.9(低用量)P:64.6±0.9 | 300 mg / d SB-ホスファチジルセリン; 600 mg / d SB-ホスファチジルセリン | 12 w(+3 wプラセボウォッシュアウト) | 治療またはウォッシュアウト後の認知機能の測定値について、治療効果は観察されなかった。 |
Design-R、無作為化; DB、二重盲検; ホスファチジルコリン、プラセボ対照; PG、並行群; OL、オープンラベル; OLE、オープンラベル拡張; Subjects-SMC、主観的記憶不満者; AAMI、年齢関連記憶障害; Age-T、治療群; P、プラセボ群; Treatment-SB、大豆。PB、植物ベース; BC、ウシ皮質; ホスファチジルセリン、ホスファチジルセリン; PA、ホスファチジン酸; DHA、ドコサヘキサエン酸; EPA、エイコサペンタエン酸; Tim-d、日; w、週; mo、月; Outcomes-WMS、Weschler Memory Scale; HDS-R、長谷川の認知症スケア改訂; RCF、レイコンプレックス図
表3 認知症高齢者におけるグリセロリン脂質補給と認知機能(時系列逆順に記載された試験)と被験者タイプ別
| トライアル | 設計 | 科目 | N | 年齢() | 処理 | 時間 | 結果 |
|---|---|---|---|---|---|---|---|
| Zhang et al。、2015 | R、ホスファチジルコリン、PG | 広告 | 57 | T:74.9±18.2P:75.3±11.8 | 300 mg / d ホスファチジルセリン | 20ワット | 治療後の記憶能力の大幅な改善(語彙と画像のマッチング) |
| More et al。、2014(サブスタディ2) | DB、R、ホスファチジルコリン、PG | 広告 | 96 | 50〜90(75.3) | 300 mg / d SB-ホスファチジルセリン + 240 mg / d PA | 2ヶ月 | プラセボ後に明らかなさらなる悪化が、治療後のADLスコアのさらなる悪化はない。プラセボよりも異常(≤23)から正常スコア範囲(> 23)に進行する治療群の参加者の割合が高かったものの、両方のグループで有意ではないがわずかな改善が見られた。 |
| ハイス他、1994年 | R、OL、PG | 広告 | 70 | 48〜79 | CT + ホスファチジルセリン(400 mg / d); CT + P *(1,200 mg / d); CT; SS | 6ヶ月 | SSまたはCTと比較してCT + ホスファチジルセリングループの8週間および16週間の治療後、(MMSEで)オリエンテーションパフォーマンスが大幅に改善されたが、CT + P *とは比較されなかった。6ヶ月でのMMSEのグループ間の違いはない。グループ内分析は、SSまたはCTの治療効果が明らかではなかったことを示している。CT + P *は、8週間でオリエンテーションスコアの増加を示し、16週間で言語の流暢さを示した。CT + ホスファチジルセリンは、8週間と16週間で有意に高いMMSEを示し、6か月でスコアが高くなる傾向があった。オリエンテーションスコアについても同様の傾向が見られた。CT + ホスファチジルセリン群では視空間性能も改善した。 |
| ハイス他、1993年 | OL、R、PG | 広告 | 80 | 指定されていない | CT + ホスファチジルセリン(400 mg / d); CT + P *(1,200 mg / d); CT; SS | 6ヶ月 | 大幅に改善されたMMSEスコア、およびCP + ホスファチジルセリングループでのみ明らかなブロックスパンテスト(短期記憶パフォーマンス) |
| アマドゥッチ、1988年 | R、DB、ホスファチジルコリン、PG | 広告 | 142 | T:62.0±7.4P:62.2±6.9 | 200 mg / d BC-ホスファチジルセリン | 3ヶ月 | 3ヶ月の治療後、BDRSスコアが大幅に改善された。ベースラインと比較して、有意に改善されたBDRSスコアは、治療後3ヶ月で明らかでした。 |
| 矢口ほか、2009年 | OL、PG | MCI、D | 67 | 59〜93(77.1±0.8) | 300 mg / d POPhtCho | 6ヶ月 | 平均MMSEスコアに対する治療効果。平均MMSEスコアは治療後に増加し、対照被験者では変化は確認されなかった。 |
| グラナタとディミケーレ、1987年 | OL | D | 35 | 61〜80(70.94±5.43) | 300 mg ホスファチジルセリン | 60日 | 口頭および作業記憶のパフォーマンスが大幅に向上 |
| プーカ他、1987年 | OL | D | 27 | 55〜80(65.5±8.6) | 300 mg ホスファチジルセリン | 60日 | 60日後に言語記憶のパフォーマンスが大幅に向上した。記憶能力のいくらかの改善は、30日間の無治療後も維持された。 |
Design-R、無作為化; DB、二重盲検; ホスファチジルコリン、プラセボ対照; PG、並行群; OL、オープンラベル; Subjects-MCI、軽度認知障害; アルツハイマー病、アルツハイマーの認知症; D、認知症; Time-d、日; w、週; mo、月; Age-T、治療群; P、プラセボ群; Treatment-SB、大豆; BC、ウシ皮質; ホスファチジルセリン、ホスファチジルセリン。PA、ホスファチジン酸; DLPhtCho、1,2-ジリノール-sn-グリセロ-3-ホスホコリン; POPhtCho、1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホコリン; CT、認知訓練; SS、社会的支援; P*、ピリチノール; アウトカム-日常生活動作、日常生活動作; MMSE、ミニ精神状態検査; BDRS、祝福された認知症評価スケール
表2 加齢に伴う「認知機能の低下」を有する高齢者におけるグリセロリン脂質補給と認知機能(時系列逆順に記載された試験)
| トライアル | 設計 | 科目 | N | 年齢() | 処理 | 時間 | 結果 |
|---|---|---|---|---|---|---|---|
| 永田ほか、2011年 | OL、PG | CD | 310 | 59〜95(76±1.2) | 100 mg / d DLPhtCho; 90 mg / d POPhtCho; 50 mg / d DLPhtCho + 45 mg / dPOPhtChoの合計 | 5ヶ月 | MMSEスコアは、すべての治療後に著しく増加した。MMSEスコアの増加は、単一のサプリメントと比較して、二重のサプリメントの後に有意に大きかった。 |
| Cenacchi et al。、1993 | R、DB、ホスファチジルコリン、PG | CD | 494 | T:77.8±5.6 P:77.3±6.3 |
300 mg / d BC-ホスファチジルセリン | 6ヶ月 | プラセボと比較して、3ヶ月および6ヶ月の治療後の言語記憶能力が大幅に改善された。 |
| Allegro et al。、1987 | OL | CD | (30) | 72.4±4.8 | 300 mg ホスファチジルセリン | 60日 | 60日間の治療で、言語および作業記憶のパフォーマンスが大幅に向上した。ほとんどのスコアは60日未満の治療スコアに減少したが、治療後30日でベースラインと比較して記憶機能が増加した。 |
| カファラとサンタマリア、1987年 | OL | CD | 30 | 69.2±5.6 | 300 mg ホスファチジルセリン | 60日 | 大幅に改善された言語記憶(習得と想起)即時の意味記憶パフォーマンス、注意/集中。 |
| ヴィラルディータ他、1987年 | R、DB、ホスファチジルコリン、PG | CD | 170 | 55〜80(65.7±7.5) | 300 mg / d BC-ホスファチジルセリン | 90日 | プラセボと比較して、注意/警戒、言語および作業記憶のパフォーマンス、ならびに即時および遅延の意味記憶が大幅に改善された。 |
Design-R, Randomized; DB, Double Blind; ホスファチジルコリン, Placebo Controlled; PG, Parallel Grouホスファチジルセリン; OL, Open Label; Subjects-CD, Cognitive deterioration; Age-T, Treatment Group; P, Placebo Group. 治療-BC、ウシ皮質; DLPhtCho、1,2-ジリノール-2-オレイル-sn-グリセロ-3-ホスホコリン; POPhtCho、1-パルミトイル-2-オレイル-sn-グリセロ-3-ホスホコリン; ホスファチジルセリン、ホスファチジルセリン; Time-d、Days; mo、Month.
認知機能に利益をもたらすグリセロリン脂質のサプリメントの証拠は比較的強固であるが、脳構造への影響を調査している研究は比較的少ない。中年以上のげっ歯類を用いた多くの研究では、グリセロリン脂質の補給は、海馬細胞の形態を改善することが発見された(Nunzi et al 1987; Crespo et al 2004; Qu et al 2016)だけでなく、歯状回内の細胞増殖と生存率を上昇させることがわかった(Maragno et al 2015)。同様に、ホスファチジルエタノールアミン(1,2-ジリノイル-sn-グリセロ-3-ホスホエタノールアミン)の7ヶ月間の経口補充は、老化促進SAMP8げっ歯類における加齢に関連した海馬ニューロン死を減少させることが観察されている(Yaguchi er al)。 しかし、これまでのところ、高齢のヒトを対象としたそのような研究はなかった。
興味深いことに、グリセロリン脂質の補充は、高齢者の脳構造の悪化を予測する多くの因子を潜在的に修正する可能性がある。これらは、上昇したホモシステイン(ホモシステイン)濃度、活性酸素種(ROS)活性の不均衡な活動と増加した酸化ストレス(酸化ストレス)プロ炎症性メッセンジャーの高いレベルだけでなく、貧しい心臓と脳血管機能が含まれている。これらの因子を修飾することによって、グリセロリン脂質のサプリメントは、高齢者の脳の構造的完全性、およびその後の認知機能をサポートする可能性がある。
このレビューでは、グリセロリン脂質への導入 – 彼らの化学構造、どのように彼らは生体内で合成され、どのような食品から、彼らはから利用可能である – が提示される。これに続いて、前述の因子のそれぞれの概要があり、それらがどのように脳構造(例えば、全体および局所の脳容積、皮質の菲薄化、白質病変の重症度、および微視的白質経路の完全性)だけでなく、認知機能に関連しているかが示される。これは、グリセロリン脂質の補充がこれらの危険因子をどの程度修正するか、あるいは保護するかを調査している利用可能な研究の概要で補完される。全体的に、グリセロリン脂質の補給、特にコリンおよび/またはω3-PUFAを含む種は、有益に脳構造の低下を予測する危険因子を修正し、それによって高齢者の脳構造とその後の認知機能をサポートすることが期待されている。
リン脂質
リン脂質とは何か?
用語「リン脂質」(PL)は、リン酸残基を有する任意の脂質(脂肪酸)を記述するために使用することができる(Hanahan, 1997)。PL-GPL(グリセロン脂質)とスフィンゴ脂質の2つの主要なクラスがあり、両方とも脳組織を形成するものを含む細胞膜の必須成分である。このレビューでは、これらが哺乳類の細胞膜内で最も一般的なグリセロリン脂質種であるため(Castro-Gómez et al 2015)グリセロリン脂質、具体的にはホスファチジルコリン、ホスファチジルエタノールアミン、およびホスファチジルセリンに焦点を当てるが、神経認知健康、または高齢者の神経認知健康に関連した危険因子に関連して最も頻繁に検査されているグリセロリン脂質種でもある。
グリセロールは、グリセロリン脂質分子のバックボーンを形成し、それは3つの水酸基(sn-1,sn-2,およびsn-3)を含む。グリセロリン脂質の全体的な種を区別するリン酸基が、sn-3でグリセロールバックボーンに付着している(Ridgway, 2016)。付着したリン酸基は、コリン、エタノールアミン、またはセリンであってもよく、それにより、それぞれホスファチジルコリン、ホスファチジルエタノールアミン、またはホスファチジルセリンを形成する(Ridgway, 2016)。一方、脂肪酸は、sn-1およびsn-2でグリセロールに付着している。かなり多くの場合、sn-1は飽和脂肪酸によって占有され、一方、sn-2は不飽和脂肪酸によって占有され、多価不飽和脂肪酸は、大脳組織膜を構成するグリセロリン脂質において特に顕著である(Castro-Gómez et al 2015)。異なるリン酸基と脂肪酸の組み合わせにより、1,000種以上の異なるグリセロリン脂質亜種が誕生する(Vance, 2008)。哺乳類の細胞膜(ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルセリンだけでなく、ホスファチジルイノシトール)の中で明らかなグリセロリン脂質の種の構造は、図11に示されている。
図1 グリセロリン脂質の一般的な生化学的構造
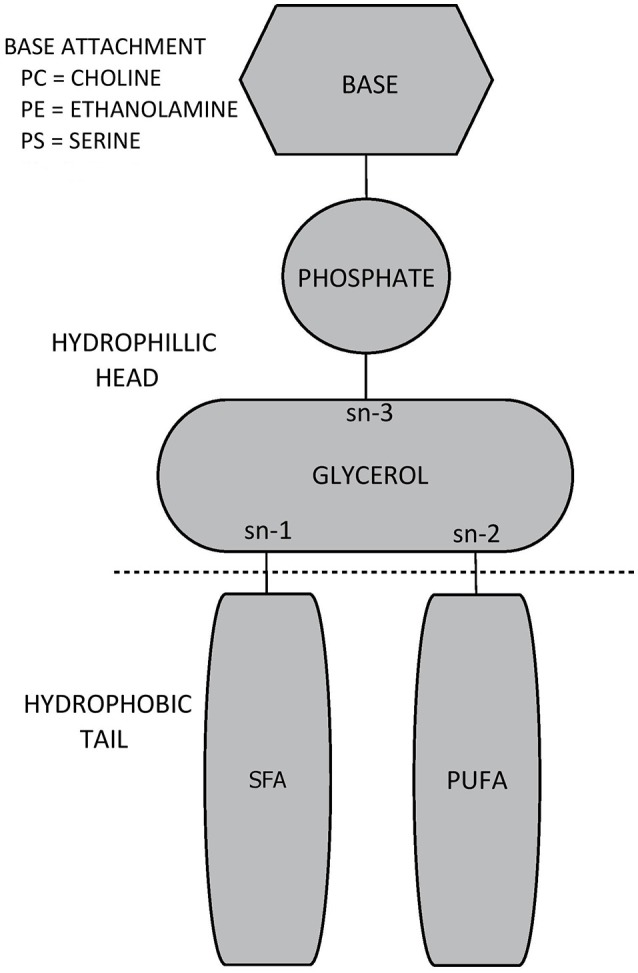
sn-3のリン酸基はグリセロリン脂質分子の親水性頭部を形成し、一方、sn-1およびsn-2に結合した脂肪酸は疎水性尾部を形成する(Castro-Gómez et al 2015)。親水性の頭部と疎水性の尾部の存在は、グリセロリン脂質が水溶液中で一緒に懸濁されたときに二脂質層の形成をもたらす(Cooper and Hausman, 2007)。二脂質層を形成するこの傾向は、グリセロリン脂質が(スフィンゴ脂質およびタンパク質とともに)細胞の二脂質膜を形成することを可能にするが、グリセロリン脂質の異なる種のグリセロリン脂質は膜層の中で異なるように集中しているように見える。ホスファチジルコリンは主にスフィンゴミエリンと一緒に外側の膜層(外側リーフレットと呼ばれることもある)の中に位置している。逆に、ホスファチジルエタノールアミンは、ほとんどの場合、内側の膜層(内側リーフレット)内に集中しており、ホスファチジルセリンは、排他的に内側リーフレット内に位置している(Devaux and Zachowski, 1994; Castro-Gómez et al 2015)。
グリセロリン脂質の生合成
ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルセリンなどのグリセロリン脂質は、いくつかの異なる経路を経て生体内試験で合成される。これらの経路のいくつかは新規合成を含み、他の経路は既存のグリセロリン脂質のリモデリングを含む。
ホスファチジルコリンおよびホスファチジルエタノールアミン(ただし、ホスファチジルイノシトールも)の新規合成に先立つ重要なプロセスは、ホスファチジン酸の最初の形成である(Kent, 1995)。合成されると、ホスファチジン酸は、ホスファチジン酸ホスファターゼおよびCDP-ジアシルグリセロール合成酵素という2つの異なる酵素によって、1,2-ジアシルグリセロールまたはチチジン二リン酸(CDP)ジアシルグリセロールに変換される(Kent, 1995)。1,2-ジアシルグリセロールは、ホスファチジルコリンおよびホスファチジルエタノールアミンの合成に重要であるが、CDP-ジアシルグリセロールは、哺乳類細胞におけるホスファチジルイノシトールの形成に不可欠である(Kent, 1995)。哺乳類細胞では、ホスファチジルセリン合成はホスファチジン酸合成に依存しない。哺乳類細胞におけるグリセロリン脂質生合成に関連する主要なde novoおよびリモデリング経路は、図2に概説されている。
図2 哺乳類細胞におけるホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルセリンの生合成経路
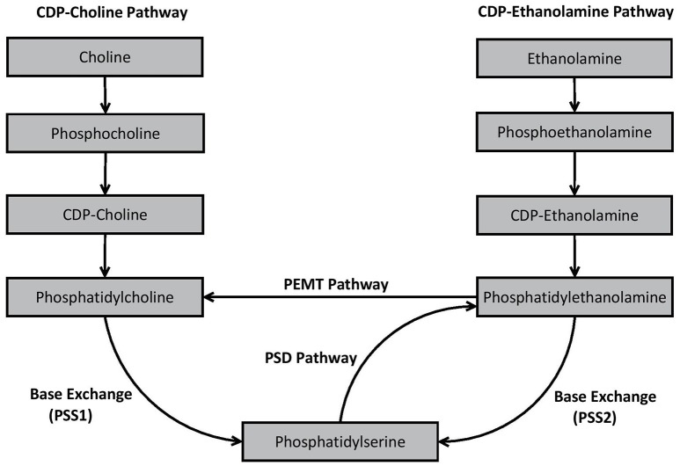
図に示すように、ホスファチジルコリンは2つの主要な経路、シチジンジスホスホコリン(CDP-コリン)経路とホスファチジルエタノールアミンN-メチル転移酵素(ホスファチジルエタノールアミンN-メチルトランスフェラーゼ)経路を介して生体内で産生される。CDP-コリン経路は、ホスファチジルコリンのde novo合成を含む一方、ホスファチジルエタノールアミンN-メチルトランスフェラーゼ経路は、既存のホスファチジルエタノールアミンのリモデリングを含む。ホスファチジルエタノールアミンは、CDP-エタノールアミン経路を介してホスファチジルコリンと類似して合成されるが、ホスファチジルセリン脱炭酸酵素(脳卒中後認知症)経路を介して既存のホスファチジルセリンをリモデリングすることによっても合成される。哺乳類細胞では、ホスファチジルセリンは主に特殊なシンターゼによって媒介される塩基交換反応を介して合成される。ホスファチジルセリン synthase-1 (ホスファチジルセリンシンターゼ-1) は、遊離セリンを ホスファチジルコリン からコリンのために切り替える一方、ホスファチジルセリンシンターゼ-2 は、ホスファチジルエタノールアミン のエタノールアミンを遊離セリンで切り替え、それによって ホスファチジルセリン を形成する。これらの経路のそれぞれに関与する特定の生化学的プロセスの詳細な説明は、他の場所で提供されている(Kent, 1995; Vance, 2008; Vance and Tasseva, 2013)。
異なる経路が同じ一般的なグリセロリン脂質を生成するかもしれないが(例えば、CDP-コリンとホスファチジルエタノールアミンN-メチルトランスフェラーゼは両方ともホスファチジルコリンを生成する)、グリセロリン脂質が合成された経路は、結果として生成されるグリセロリン脂質の脂肪酸組成に影響を与えるようである。例えば、CDP-コリン経路から得られるホスファチジルコリンは、典型的には飽和、一価不飽和または二価不飽和脂肪酸種を含み、一方、ホスファチジルエタノールアミンN-メチルトランスフェラーゼ経路を介して合成されたホスファチジルコリンは、ω3-PUFA種のDHAのような多価不飽和脂肪酸(PUFA)を含むかもしれない(Delong et al 1999; Pynn et al 2011)。これは、ω3-PUFAを含むホスファチジルエタノールアミンに対するホスファチジルエタノールアミンN-メチルトランスフェラーゼ経路の基質選好性に起因するかもしれないが(Delong et al 1999)他の人(例えば、Vance 2014)は、DHA濃縮ホスファチジルコリンが生産される程度は、ホスファチジルエタノールアミンの全体的なリザーバー内のDHAの利用可能性に依存する可能性が高いことを示唆している(RidgwayおよびVance、1988)。
合成経路による脂肪酸組成の違いは、ホスファチジルエタノールアミンについても明らかである。CDP-エタノールアミン経路で製造されたホスファチジルエタノールアミンは、主にモノまたはジ-不飽和脂肪酸種をsn-2で含んでいる。逆に、脳卒中後認知症経路に由来するホスファチジルエタノールアミンは、ω6-PUFAアラキドン酸(ARA)やω3-PUFAのようなDHAやエイコサペンタエン酸(EPA)などのPUFAを含むホスファチジルエタノールアミンを合成することが多い(Bleijerveld et al 2007)。基質特異性は、哺乳類細胞におけるホスファチジルセリン合成の間に明らかである。いくつかの研究からのデータは、他の亜種と比較して、ω3-PUFA、特にDHAを含むホスファチジルコリンまたはホスファチジルエタノールアミンのホスファチジルセリンシンターゼ-1およびホスファチジルセリンシンターゼ-2の選好種が、他の亜種と比較して好ましいことを示している(Kim et al 2004; KimuraおよびKim 2013)。
ω3-PUFAを含むグリセロリン脂質の食事源
生体内合成に加えて、グリセロリン脂質は食事から得られることがある。グリセロリン脂質の推定食事摂取量は1日あたり2~8グラムで、1日の脂肪摂取量の1~10%に相当する(Cohn et al 2010)。グリセロリン脂質は、牛乳、卵、骨格、陸上動物(例えば、牛や豚)からの臓器(例えば、脳)肉、魚(特にオキアミやイカ)などの食品に含まれている。グリセロリン脂質はまた、菜種、ヒマワリの種子および大豆(Weihrauch and Son, 1983)などの特定の種子および豆類を消費することによって得られることがある。
グリセロリン脂質に含まれる脂肪酸の種類は、食品源の間で異なるように見える。海洋魚(例えば、オキアミまたはイカ)哺乳類の脳(例えば、牛または豚)または卵(特に飼料がω3-PUFAで強化されている鶏からのもの)のような食品に由来するグリセロリン脂質は、DHAなどのω3-PUFAを含むように見える(Bourre et al 1993; BourreおよびDumont 2002; Favrelière et al 2003; ChenおよびLi 2008)。大豆では、ω3-PUFAはα-リノレン酸(ALA)の形で存在し(Bourre and Dumont, 2002; Chen and Li, 2008)これは後にEPAおよびDHAのようなより長い鎖のω3-PUFA種に変換される可能性がある(Burdge and Calder, 2005)。大豆だけでなく、魚、哺乳類の脳および卵もまた、ω6-PUFAおよび他の脂肪酸の様々なレベルを提供する(Bourre and Dumont, 2002; Favrelière et al 2003; Chen and Li, 2008)。
ホールフードからはさておき、グリセロリン脂質は市販のサプリメントから得られるかもしれない。重要なことに、これらの補足的なグリセロリン脂質の脂肪酸組成は、グリセロリン脂質が抽出された食品によって異なる。グリセロリン脂質サプリメントは、カプセル(例えば、オキアミ油)として消費されてもよいし、粉末状の化合物として消費されてもよい(Küllenberg et al 2012年にまとめられている)。粉末状のサプリメントは液状化可能であるため、摂取しやすくなっている。これは、嚥下障害(嚥下障害と呼ばれる一般人口によく見られる症状;Aslam and Vaezi, 2013)を経験している高齢者にとって特に重要であると考えられる。これらの成人は、栄養不足または欠乏症を発症するリスクが高くなる可能性がある(Sura et al 2012)。
これまでの研究では、ω3-PUFAのバイオアベイラビリティが、脂肪酸のこの種を含む全食品またはサプリメントの摂取後に増加する可能性があることが示されている(Popp-Snijders et al 1986;Bourre et al 1993;Yaqoob et al 2000;BourreおよびDumont 2002;Kew et al 2004;Ulven et al 2011;Browning et al 2012)。他の研究は、PUFAがトリグリセリドではなくグリセロリン脂質として消費された場合、PUFAのバイオアベイラビリティが強化される可能性があることを実証している(Wijendran et al 2002; Ramprasath et al 2013)。このように、グリセロリン脂質の補給は、ω3-PUFAのような栄養素のバイオアベイラビリティを増加させる効果的な方法である可能性がある。コリンのような他の栄養素もグリセロリン脂質に付着している可能性があることを考えると、グリセロリン脂質の補給はこれらの栄養素のバイオアベイラビリティーも高める可能性がある。
高齢者の脳構造をサポートする手段としてのグリセロリン脂質サプリメント
グリセロリン脂質の補給と脳の構造的完全性を予測する因子
脳組織内のリン脂質の濃度は、年齢の増加とともに低下するように見える(Soderberg et al 1990,1991; Svennerholm et al 1994,1997)。このように、リン脂質の食事摂取量を増加させる、特にグリセロリン脂質は、ニューロン膜への組み込みに起因する脳構造の完全性に利益をもたらすかもしれない。しかしながら、グリセロリン脂質の補給はまた、高齢者のより悪い脳構造を予測するように見えるいくつかの因子を修正することによって、間接的に脳構造をサポートすることができる。
このレビューの焦点はこれらの潜在的な間接的な効果である。具体的には、このレビューでは、生化学的(ホモシステイン、ROS活性と酸化ストレス、炎症)と生物物理学的(心臓と脳血管機能)の危険因子が、より悪い脳構造の完全性だけでなく、認知機能の低下に関連していること、そしてグリセロリン脂質の補給がこれらの因子を修正する、またはこれらの因子から保護することが観察されている程度について議論する。また、グリセロリン脂質の補給がこれらの効果を促進する可能性のある潜在的な経路についても議論される。全体的に、それは予想される、グリセロリン脂質の補充は、変更、または前述の要因に対する保護を介して、高齢者の脳構造の整合性とその後の認知機能に利益をもたらすであろう。
ホモシステイン
高齢者のホモシステインと脳構造
ホモシステインは、s-アデノシルホモシステインに由来する硫黄含有アミノ酸であり、s-アデノシルメチオニンが関与するメチル反応の副産物である(Selhub et al 2000 2013;Madsen et al 2015)白質病変または無症候性脳梗塞の頻度および体積の増加(Vermeer et al 2002;Wright et al 2005;Seshadri et al 2008;Raz et al 2012)ならびに脳微細構造の完全性の低下(Bettcher et al 2014;Hsu et al 2015)。脳のマクロおよびミクロ構造の完全性と認知機能との関連性を考えると、ホモシステインも認知機能の重要な予測因子である可能性がある。実際、複数の研究で、ホモシステインが上昇した成人ではMCIや認知症を発症するリスクが増加することが観察されている(Launtenschlager et al 2005;Kim et al 2007;Whalley et al 2014)だけでなく、多くの認知領域でパフォーマンスが低下することも観察されている(Narayan et al 2011b;Allam et al 2013;Jochemsen et al 2013;Parizkova et al 2017)。
ホモシステイン濃度は、遺伝学および年齢などの非修飾可能な因子によって影響を受ける可能性があるが、ホモシステイン濃度に影響を与えると考えられている多くの修飾可能な因子も存在する。最も重要な修飾因子の一つは、栄養摂取、特にビタミンB群の摂取/吸収である(Joosten et al 1996;Jacques et al 2001;Refsum et al 2006)。ビタミンB6,B12および葉酸はホモシステイン代謝に不可欠であり、これらのビタミンの摂取量またはバイオアベイラビリティが低いとホモシステイン濃度の上昇が予測される(Jacques et al 2001; Refsum et al 2006)。これらのビタミンB群のサプリメントは、ホモシステイン濃度を低下させることが示されている(Eussen et al 2006;McMahon et al 2006;Smith et al 2010;Clarke et al 2014;FordおよびAlmeida 2014)。さらに、VITACOG研究からのデータは、ビタミンB6,B12および葉酸の慢性的な補充が、ホモシステイン濃度の有意な減少に起因する総および局所的な脳萎縮の減少率で、脳構造に有益であることを示している(Smith et al 2010; Douaud et al 2013; Jerneren et al 2015)。補充によるホモシステインの低下はまた、高齢者を対象としたいくつかの研究では、ビタミンB群補給後のホモシステインに続く記憶力と処理速度の改善が観察されており、認知能力を向上させる可能性がある(Durga et al 2007; de Jager et al 2012)。しかし、いくつかのシステマティックレビューやメタアナリシスでは、ビタミンB群補給によるホモシステインの低下は高齢者の認知機能を改善しないことが示されている(Clarke et al 2014; Ford and Almeida, 2014)が、これらのレビューでは方法論的な弱点があるため、最近の研究ではその結果が批判されている(Smith and Refsum, 2016)。
全体的に見ると、栄養補給によるホモシステインの低下は、高齢者の脳構造の完全性に恩恵をもたらす可能性があるように思われる。また、認知機能にも有益であるかもしれないが、これらの後者の効果については文献の中で議論の余地がある。
グリセロリン脂質の補充とホモシステイン濃度
コリンはビタミンB群と似ており、食事からの摂取量が成人のホモシステイン濃度を予測するようである。赤肉、鶏肉、魚、卵、牛乳などの多くの動物性および植物性食品、さらにブロッコリー、ジャガイモ、インゲン豆、豆類、ナッツ類にはコリンが含まれている(Cho et al 2006; Detopoulou et al 2008)。摂取および吸収後、コリンはベタイン-ホモシステインメチル転移酵素経路でメチル供与体として機能するベタインに酸化され、これにより、ホモシステインはベタイン-ホモシステインメチル転移酵素によって触媒される反応でメチオニンに変換される(Olthof et al 2005)。重要なことに、コリン(またはその代謝物ベタイン)の摂取またはバイオアベイラビリティの増加は、成人におけるホモシステイン濃度を否定的に予測することが観察されている(Schwab et al 2002;Steenge et al 2003;Cho et al 2006;Chiuve et al 2007;Atkinson et al 2008;Detopoulou et al 2008)。
コリンは、ホスファチジルコリン(だけでなく、スフィンゴミエリンとして知られるスフィンゴ脂質も)を区別する基底付着物を形成するので、ここでは強調されている。実際、コリンはホスファチジルコリンの分子量の15%を占めている(Cheatham et al 2012)それにより、ホスファチジルコリンは食事から供給される可能性のあるコリンの重要なキャリアとなっている。このように、ホスファチジルコリンの摂取量が多いとホモシステイン濃度を否定的に予測すると予想される。Framingham Heart Study(Cho er al 2006)およびNurses Health Studies(Chiuve er al 2007)のFFQデータを利用したいくつかの横断的研究では、コリンを含む多くの食事性化合物がホモシステインとの関連で検討された。Cho et al 2006)は、推定ホスファチジルコリンの摂取はホモシステイン濃度と逆相関があり、同様の相関はスフィンゴミエリン、ホスホコリン、グリセロホスホコリンを含む他のコリン含有化合物についても確認されていることを決定した。しかし、ホモシステイン濃度に関連する追加因子(例えば、ビタミンB群摂取量、カフェイン、アルコール摂取量)をコントロールした後、ホスファチジルコリンはもはやホモシステイン濃度とは関連していなかったが、他のコリン含有化合物は有意な予測因子として残っていた。興味深いことに、Chiuve et al 2007)は、ホスホコリンおよびグリセロホスホコリンからのコリンとホモシステインとの間の負の関連を観察したが、ホスファチジルコリンの摂取量との間には有意ではない正の関連があるようであった。
ホモシステイン濃度に対するホスファチジルコリン補給の直接的な効果を検討した唯一の研究であるが、Olthof et al 2005)は、2.6gのコリンを含む34gの大豆レシチン(ホスファチジルコリンで構成)を50-71歳の成人男性に2週間かけて1日経口投与した。Olthof et al 2005)は、治療後のホモシステイン濃度がプラセボに比べて18%低下したことを観察した。しかし、この研究で摂取されたコリンのレベルは、Cho et al 2006)およびChiuve et al 2007)が報告した1日あたりの推定平均摂取量(それぞれ313±61および323mg/d)をはるかに超えていることに注意することが重要である。このように、ホスファチジルコリンはコリンの供給により、通常の食事とサプリメントの組み合わせでは、食事だけで摂取するよりもホモシステインを低下させる可能性がある。
ホモシステイン を下げることは、慢性的なビタミン B の補充を含む臨床試験の数で脳の構造的完全性に利益をもたらすことが観察されている。このように、コリンの供給のためにホスファチジルコリンを慢性的に補充すると、同様の効果が明らかになる可能性がある。しかし、現在までのところ、ホモシステインを低下させる手段としてのホスファチジルコリンの使用についての調査はほとんど行われていない。コリンは、選択ビタミンB群と同様に、ホモシステインのメチル化のための必須栄養素であるため、これは興味をそそられる。ホスファチジルコリンの摂取量とホモシステイン濃度との関係を決定するデータの相対的な不足は、追加のよく設計されたRCTのによって是正されるべきである。今後の研究では、高度なイメージング方法の追加利用は、ホスファチジルコリンの摂取量とその後のホモシステインのレベルが脳の構造的完全性にどのように関係するかを決定するのに役立つ。
ホモシステインと脳構造への潜在的な利益を下げる
ホスファチジルコリンのサプリメントは、人間の老化で脳構造に利益をもたらすかを決定する作業の乏しさがあるにもかかわらず、それはホスファチジルコリンのサプリメントは、ホモシステインを下げて、ホモシステインの上昇濃度に関連付けられていると理論化された有害な効果を軽減することによって、脳構造に利益をもたらす可能性があることはもっともらしい。ホモシステインの上昇の一つの効果は、高リン酸化タウの蓄積のリスクの増加だけでなく、脳組織内の神経原線維のもつれ(NFT)の存在の増加である(Luo et al 2007; Zhang et al 2008; Popp et al 2009; Wei et al 2011; Hooshmand et al 2013; Li et al 2014)。これらの因子の両方が、認知機能のスペクトルにわたって成人の脳のマクロおよびミクロ構造の完全性の低下と関連している(Whitwell et al 2008;Polvikoski et al 2010;Tosun et al 2010;Glodzik et al 2011,2012;Marnane et al 2016;de Souza et al 2017;Hoy et al 2017;Kantarci et al 2017)。
ホモシステイン濃度の増加は、タウの脱リン酸化に関与するプロテインホスファターゼ2A(PP2A)などのキナーゼの阻害を通じて、高リン酸化タウの産生を悪化させるようである(Luo et al 2007;Zhang et al 2008;Wei et al 2011)。しかし、ホモシステイン濃度を下げると(ビタミンB群の補給により)PP2Aの不活性化が緩和され、それによりタウの高リン酸化が低下することが観察されている(Zhang er al)。 さらに、ホモシステインの低下とNFT負荷への変化を検討した試験はないが、NFTは大部分が高リン酸化タウタンパク質で構成されていることを考えると、理論的にはホモシステインの低下は、NFTが形成され、したがって、脳組織内で明らかになる程度に影響を与えるはずである。データは限られているが、コリンの供給に起因するホスファチジルコリンの補充は、、ホモシステイン濃度を下げるために観察されている。このように、それはホモシステインを低下させることによって、ホスファチジルコリンサプリメント(中等度から高用量で投与)は、それによって高リン酸化タウおよびその後のNFTの濃度の低下を促進し、それによって長期的に脳の構造的完全性をサポートすることができる可能性がある。これらの効果は、高齢者で調査する必要がある。
高リン酸化タウとNFT負荷の増加に加えて、ホモシステインの上昇は、脳の構造的完全性の低下につながる可能性のある、より微妙な効果を促進する可能性がある。ホモシステイン濃度の上昇は、ω3-PUFAを含むホスファチジルコリンの産生低下につながる細胞ホスファチジルエタノールアミンN-メチルトランスフェラーゼ活性を阻害し、それによって細胞膜内のホスファチジルコリンおよびその前駆体ホスファチジルエタノールアミンの歪んだ濃度比を促進する(Innis et al 2003; Miller et al 2003; Devlin et al 2007; Selley, 2007)。
ホスファチジルエタノールアミンN-メチルトランスフェラーゼ阻害によるDHAを含むホスファチジルコリンの産生の低下はまた、ホモシステインレベルが上昇したときに生物学的組織内で観察されるDHA濃度の低下を部分的に説明し得る(Innis et al 2003; Miller et al 2003; Li et al 2006; Devlin et al 2007; Selley et al 2007; Rasmussen et al 2010; Huang et al 2013; Kume et al 2013; Iglesia et al 2017)。ホスファチジルエタノールアミンN-メチルトランスフェラーゼ経路によるDHAなどのω3-PUFAを含むホスファチジルコリンの産生は、肝臓から血漿中へ、そしてそれ以降の脳組織へDHAを輸送するための重要なプロセスである(Smith and Refsum, 2016)。最終的には、膜(脳組織内のものを含む)内のDHAなどのω3-PUFAの低濃度は、その後、酸化ストレスのリスクの増加と炎症の上昇を促進し、その後、より悪い心・脳血管機能(血圧の上昇、動脈硬化、血液脳関門の伝染性)につながる可能性がある。これらの要因については、このレビューの後のセクションで議論される。
ホスファチジルコリンはコリンの主要な食事源である。そのため、サプリメントを介したホスファチジルコリンの摂取量の増加は、コリンのバイオアベイラビリティーの増加を促進し、それによってホモシステイン濃度を低下させ、その後、ホスファチジルエタノールアミンN-メチルトランスフェラーゼ活性に対するホモシステインの抑制効果を緩和する可能性が高い。これは、DHAなどのω3-PUFAからなるホスファチジルコリンの生体内試験合成が回復したことにより、ω3-PUFAが細胞膜(脳組織内のものを含む)に存在する程度に影響を与えるであろう。しかし、その由来によっては、投与されたホスファチジルコリンにもω3-PUFAが含まれている場合がある。DHAのようなω3-PUFAを含むホスファチジルコリンを補充することは、おそらく細胞膜内のこれらのPUFAの濃度の増加を促進するであろう。これは、そのような上昇した酸化ストレスと炎症などの要因が明らかである程度に影響を与えるだろう、それによって妨害された心臓と脳血管機能の可能性を減少させ、その後、脳構造が時間をかけて悪化する程度。
ホスファチジルコリンの摂取がホモシステイン濃度にどのように関係するかを調べるには、より多くの作業が必要であるが、利用可能な限られたデータは、十分な量のホスファチジルコリンサプリメントは、ホモシステイン濃度を低下させる可能性があることを示している。ホモシステインを低下させることにより、ホスファチジルコリンサプリメントは、ビタミンB群と同様の方法で、脳の構造的完全性と潜在的に認知機能に利益をもたらす可能性がある。コリンを含むグリセロリン脂質(すなわち、ホスファチジルコリン)の慢性的な補充が高齢者のホモシステイン濃度を有意に低下させるという仮説が立てられている。栄養補給によるホモシステインの低下が脳の構造的完全性に恩恵を与えた以前の研究に基づいて、ホスファチジルコリン補給によるホモシステインの低下も同様に高齢者の脳の構造的完全性とその後の認知機能をサポートすることが期待されている。
酸化ストレス
高齢者の酸化ストレスと脳構造のリスク
酸素の即時供給は、適切な細胞機能のために不可欠であるが、酸素代謝の結果として活性酸素の形成がある(Chiurchiù et al 2016)。活性酸素は、炎症性免疫応答中の病原体の破壊および平滑筋緊張の調節を含む多くの重要な生理機能に不可欠である(Popa-Wagner et al 2013)。正常な条件下では、活性酸素活性は、スーパーオキシドディスムターゼ(SOD)グルタチオンペルオキシダーゼ(GPx)グルタチオン(GSH)などの内因性抗酸化物質だけでなく、食事性抗酸化物質とバランスがとれている(Chiurchiù et al 2016)。しかし、活性酸素のバランスが崩れると、細胞膜を構成する脂質やタンパク質に酸化的なダメージを与え、それによって細胞膜の構造や機能に影響を与える可能性がある(Popa-Wagner et al 2013; Von Bernhardi et al 2015)。
不均衡な活性酸素活動による生体組織の損傷は、酸化ストレス(酸化ストレス)と呼ばれている。脳組織は、不釣り合いな代謝活動を維持するために相当量の酸素を必要とするため、特に酸化ストレス(酸化ストレス)の影響を受けやすい。脳組織内での酸化ストレスのリスク増加を促進する他の因子には、神経化学反応による著しい活性酸素の産生と、酸化を促進する可能性のある鉄の沈着が含まれる(Popa-Wagner et al 2013)。
脳組織の酸化ストレス感受性に寄与する追加の要因は、細胞膜内のPUFAが活性酸素による酸化的損傷に対して非常に感受性が高いことである(Chan et al 1982; BrettおよびRumsby、1994; Bongarzone et al 1995)。1995年)ミエリン脂質およびタンパク質の破壊を促進することが観察されている(Chia et al 1983a,b; KonatおよびWiggins、1985; Bongarzone et al 1995年)増加したROS活性(対応する抗酸化活性の増加なし)である。しかしながら、高齢のヒトでは、磁気共鳴画像法(MRI)を用いて決定されるように、活性酸素活性または酸化ストレスを反映する指標と脳の構造的完全性を関連付けるデータは存在しないようである。脳組織膜内の脂質およびタンパク質の酸化は、少なくとも部分的には、認知的に正常な(Davis et al 2009;Burzynska et al 2010;Westlye et al 2010)だけでなく、認知障害のある高齢者(すなわち、MCIまたはアルツハイマー病)で同定された脳微細構造の完全性のそれらの減少に寄与している可能性が高い(Bosch et al 2012;Wang et al 2012;Zhang et al 2013)。これらは完全な指標ではないが、拡散テンソルイメージング(DTI)指標である「放射状拡散率」と「軸索拡散率」は、それぞれ脳白質内のミエリンと軸索の完全性を反映することが示唆されている(Song et al 2002,2003;Sun et al 2006)。これらの測定法を利用した今後の研究により、ROS活性、ひいては酸化ストレスが加齢に伴う脳の構造的完全性の低下にどのように寄与しているかについて、さらなる洞察が得られる可能性がある。
脳組織の酸化ストレスに対する感受性が高まっていることから、酸化ストレスを示す指標、または不均衡な活性酸素活動(例えば、内因性抗酸化物質または食事性抗酸化物質の濃度低下)による酸化ストレスに対する感受性の上昇は、認知機能の低下を予測する可能性がある。実際には、健康な成人と比較して、MCIまたはアルツハイマー病を持つ人々は、内因性および食事由来の抗酸化物質の減少した濃度を示すように見える(Rinaldi et al 2003; Padurariu et al 2010; Mandal et al 2015)。さらに、MCIまたはアルツハイマー病を有する成人はまた、マロンジアルデヒド(MDA)F2およびF4イソプロスタンス(それぞれω6およびω3-PUFA酸化の測定値)およびタンパク質カルボニル(Mangialasche et al 2009; Padurariu et al 2010; Torres et al 2011)の増加した濃度によって証明される、認知的に正常な成人よりも上昇した酸化ストレスを示す。
逆に、相反するデータが利用可能であるが、食事性抗酸化物質(例えば、カロテノイド)のより多くの摂取は、高齢者におけるより高い認知パフォーマンスと関連している(Jama et al 1996; Berr et al 1998; Akbaraly et al 2007; Wengreen et al 2007)。さらに、GPxやGSHなどの内因性抗酸化物質の高濃度は、臨床的な認知症評価尺度だけでなく、ミニ精神状態検査でのパフォーマンスの向上を予測するように見えるが、MCI、アルツハイマー病、または「認知機能障害」を有する高齢者における実行機能の改善も予測する(Umur et al 2011;Mandal et al 2015;Revel et al 2015)。
グリセロリン脂質の補給と酸化ストレス
前臨床データは、ホスファチジルセリンのようなグリセロリン脂質での前処理が、上昇したROSの劇症的な影響から細胞を保護し、それによって酸化ストレスのリスクを減少させる可能性があることを実証しているようである。ある初期の研究では、Latorracaら(1993)は、培養ヒト線維芽細胞をアセトアルデヒド(37.5mM)と50mUのキサンチンオキシダーゼを含む溶液に懸濁させ、これが高活性酸素産生をもたらす反応を誘発した。活性酸素の増加によって促進された細胞損傷は、乳酸脱水素酵素を測定することによって定量化され、アセトアルデヒドとキサンチンオキシダーゼの両方にさらされた細胞は、コントロール(ビヒクル溶液+アセトアルデヒド、キサンチンオキシダーゼを含まない)と比較して、レベルが40%増加していた。しかし、実験溶液に懸濁する前に4日間、13μMのホスファチジルセリンで前培養した細胞では、乳酸脱水素酵素の有意な増加はなかった、ホスファチジルセリンへの曝露は、他の方法では、活性酸素産生の増加に続いて期待される組織の酸化的損傷を防止したことを示唆している。
グリセロリン脂質を用いた細胞の前培養は、活性酸素の産生の減少を促進し、それによって酸化ストレスの発生リスクを低下させる可能性がある。Hashioka et al 2007a)は、400 ng/mlのリポ多糖類(LPS)と400 ng/mlのフォボル12-ミリスチン酸12-酢酸塩を組み合わせて、げっ歯類から採取したミクログリア細胞に投与した。この組み合わせにより、活性酸素と反応性窒素種であるスーパーオキシドと一酸化窒素がそれぞれ産生され、これらが一緒になってペルオキシナイトライトと呼ばれる強力な酸化剤を形成している可能性がある。しかし、ホスファチジルセリンとホスファチジルコリン、またはホスファチジルコリン単独で構成されるリポソームを用いてミクログリア細胞を1時間前培養したところ、スーパーオキサイドと一酸化窒素の産生が著しく減少した。このことは、スーパーオキサイドと一酸化窒素の産生を低下させることで、ホスファチジルコリンとホスファチジルセリンからなるリポソームで処理することで、ペルオキシナイトライトの産生が低下し、酸化ストレスの発生が抑制される可能性があることを示唆していると考えられる。同様に、Chaung et al 2013)は、活性酸素産生を刺激するために、これらの細胞が電気刺激を受ける前に24時間、25μMのDHAまたは25μMのホスファチジルセリンを単独または組み合わせて、C6細胞(神経膠腫をモデル化したげっ歯類グリア細胞)を前培養した。DHAまたはホスファチジルセリンのいずれかで前培養した細胞のために、活性酸素産生は有意に低かったが、治療法をまたいで、これらのグリア細胞の電気刺激は、正常に活性酸素産生を上昇させた。さらに、DHAとホスファチジルセリンの組み合わせは、分離してどちらかの治療時よりもさらに低い活性酸素産生を促進するように見えた。
動物を用いた先行研究では、ω3-PUFAを含むグリセロリン脂質を補給することで、酸化ストレスを防止できる可能性があることが示されている。(Hiratsuka et al 2008)は、異なる脂質種で強化された3つの実験飼料のうちの1つをネズミに与えた。対照食では、脂質は紅花油(対照)実験食ではカツオの卵巣から得られるω3-PUFA DHAをトリグリセリドまたはグリセロリン脂質(ホスファチジルコリン, ホスファチジルエタノールアミン, SM)のいずれかで補給した。げっ歯類は、最初の2週間’げっ歯類は、その後、脳組織内の脂質過酸化の上昇を引き起こした糖尿病をモデルにするように、ストレポゾトシン(40 mg / kg)の5つの毎日の注射を受けたが、5週間の期間のためにそれぞれの食事を与えた。食事介入の完了時に、脳脂質酸化の有意差は、コントロールグループ内の齧歯類またはトリグリセリドとしてDHAを受けているものの間で識別されなかった。しかし、脳脂質酸化は、グリセロリン脂質として配信されたDHAを食べさせたげっ歯類で有意に低かった、DHAを含むグリセロリン脂質との補充は、脳組織内の酸化ストレスのリスクを低下させる可能性があることを示唆している。
上記の研究に加えて、他の研究では、グリセロリン脂質の補給が内因性抗酸化物質の濃度を高める可能性があると判断されている。劉 et al 2012)は、繰り返しネズミのてんかん様発作を誘発するためにペンチレネテトラゾールを投与した。この投与により、一酸化窒素などの反応性窒素種の濃度が有意に上昇し、脳組織や肝臓組織内のSODなどの内因性抗酸化物質の濃度も低下した。発作誘発後、Liu et al 2012)は、2.5mg/kgのDHAおよび/または300mg/kgのホスファチジルセリンで強化された飼料を36日間にわたって実験的にネズミに与えた。DHAまたはホスファチジルセリンのいずれかを飼料に添加した場合、大脳組織内のSOD濃度が上昇し、これらの栄養素を併用した場合には肝臓内のSOD濃度が上昇することが観察された。一酸化窒素は、DHAまたはホスファチジルセリンで強化された食事を摂取すると大脳組織で減少したが、肝臓の濃度は別々の治療法または組み合わせた治療法では減少した。同様に、(Zhang et al 2015)は、アミロイド-β1-42の5.0μLの頭蓋内注射がSOD濃度の有意な低下を促進することを観察したが、ウシ皮質から供給されたホスファチジルセリン(それによって他の脂肪酸の間でDHAを含む)で濃縮された食事の消費は、用量依存的な方法で脳のSOD発現を増加させた。さらに最近では、Qu et al 2016)は、アミロイド-β25-35の脳内注射を介してげっ歯類のアルツハイマー病をモデル化し、その後、大脳皮質および海馬内でSODおよびGPxなどの内因性抗酸化物質の濃度を低下させた。アルツハイマー病コントロールモデルと比較して、30日間、海洋由来ホスファチジルコリン(DHAとEPAの高レベルを含む)の中用量(0.1 g/kg/d)または高用量(0.2 g/kg/d)を受けたアルツハイマー病をモデル化したげっ歯類は、皮質組織内のGPxが増加したことを示した。低用量(0.05 g/kg/d)中用量または高用量のホスファチジルコリンを投与したげっ歯類では、皮質組織内のSOD活性の上昇が認められたが、海馬内のSOD活性の上昇は、最高用量のホスファチジルコリンを投与した後にのみ明らかになった。GPxでは海馬内での治療効果は観察されなかった。
グリセロリン脂質の補充と酸化ストレスの潜在的な効果の経路
グリセロリン脂質の補充は、脳組織を含む生物学的組織内の酸化ストレスのリスクを低減する可能性があることを示す前臨床試験および臨床試験の範囲からのデータがある。海洋源(例えば、オキアミやイカ)哺乳類(例えば、牛や豚)の脳だけでなく、大豆からのグリセロリン脂質は、脂肪酸、特にDHAやEPAなどのω3-PUFAの提供を介して酸化ストレスのリスクを減らすことができる。酸化還元バランスを維持することは複雑で、広範囲の生物学的プロセスを介して促進されるが、このレビューでの議論は、ω3-PUFAの提供に起因するグリセロリン脂質の補給は、活性酸素と内因性抗酸化物質の活性または濃度を調節することによって、それによって酸化ストレスのリスクを低下させる可能性がある2つの潜在的な経路に限定される。
ω3-PUFAを含むグリセロリン脂質が酸化ストレスのリスクを減少させる最初の経路は、内因性抗酸化物質の合成に関連する転写因子のアップレギュレーションを含む。先行研究は、細胞をω3-PUFA(DHA、EPA、またはALA)とインキュベートすると、SOD、GSH、およびGPxなどの内因性抗酸化物質の濃度が増加するように見えることを示している(Di Nunzio et al 2011,2016;Saw et al 2013)。これらの内因性抗酸化物質の濃度の増加は、これらの抗酸化物質をコードする遺伝子の転写に関与する因子であるNF-E2関連因子2(NrF2)の活性の上昇と関連している(Di Nunzio et al 2011,2016;Saw et al 2013)。これらの効果は、DHAおよびEPAなどのω3-PUFAの酸化に応答して起こる可能性があり、これらの脂質(例えば、4-ヒドロキシ-2E-ヘキセナール)の酸化に起因する副産物は、その後、Keap1などのNrF2核内転座を減少させることが知られている因子を阻害する(Gao et al 2007)。これらの仮定された効果は、最近、魚油の投与(齧歯類モデル)またはω3-PUFAのDHAおよびEPAの前処理(齧歯類胚性神経細胞試験管内試験)が、酸素-グルコース欠乏に続く神経細胞の破壊を有意に減少させることを同定した(Zhang et al 2014)によって検討された。Zhang et al 2014)はまた、DHAで前処理した細胞は、酸素グルコース遮断後にNrF2のより大きな核転座を示したことを観察した。さらに、彼らは、ω3-PUFA酸化の最終生成物である4-ヒドロキシ-2E-ヘキセナールが、ω6-PUFA酸化の最終生成物である4-ヒドロキシ-2E-ノネナールよりもはるかに強力なNrF2活性のインデューサーであることを観察した。
先に示されたように、ω3-PUFAの補充は、生物学的組織内でのこれらのPUFAのバイオアベイラビリティを上昇させるために有効である(Popp-Snijders et al 1986; Bourre et al 1993; Yaqoob et al 2000; BourreおよびDumont 2002; Favrelière et al 2003; Kew et al 2003,2004; Browning et al 2012)。しかしながら、ω3-PUFAをリン脂質として送達することは、トリグリセリドよりもこれらの脂質の組織濃度を上昇させるのに有効であるかもしれない(Ramprasath et al 2013)。典型的には、膜内のω3-PUFAの濃度上昇は、ARAなどのω6-PUFAを犠牲にして起こる(Calder, 2015)。このように、生物学的組織内のω3-PUFAのバイオアベイラビリティを増加させることは、それによって酸化されるPUFAのこれらの種の可能性を増加させ、それによって4-ヒドロキシ-2E-ヘキセナールの生産を増加させるのではなく、4-ヒドロキシ-2E-ノネナール(ω6-PUFAから)の生産を増加させ、増加したNrF2活性および内因性抗酸化物質の生産につながる可能性がある。このプロセスは、内因性抗酸化物質の濃度の増加、およびそれゆえに以前の研究でのグリセロリン脂質投与後の酸化ストレスのリスクの減少を説明するものであるかもしれない。
ω3-PUFAを含むグリセロリン脂質が酸化ストレスのリスクを減少させる第二の経路は、活性酸素を産生する選択された酵素の活性をダウンレギュレートすることである。活性酸素生産に関連する酵素の一つの特定のクラスは、ニコチンアミド・アデニン・ジヌクレオチド・ホスフェート(NADPH)オキシダーゼで、Noxと略される(Lambeth, 2004; Bedard and Krause, 2007)。Noxは、NADPHから分子状酸素への電子移動を促進し、それによって活性酸素、特にスーパーオキサイドを発生させる膜結合型タンパク質である。障害されたNox活性は、内皮機能障害、歪んだ平滑筋の成長だけでなく、炎症(GiordanoとVisioli 2014)に寄与する可能性があり、また、Braakステージを予測しながら、MCIとアルツハイマー病のリスクの増加にリンクされているアルツハイマー病の病理学(ブルース-ケラー et al 2010;アンサリとScheff 2011)。多くの異なるNox酵素(例えば、Nox1,Nox2,Nox3,Nox4,Nox5)があり、これらは様々な生物学的組織内で低濃度から高濃度で発現する可能性がある(Lambeth, 2004; Bedard and Krause, 2007)。重要なことに、Noxタンパク質の活性は、p22phox、p47phox、p67phox、p40phox、およびGTPase Racを含む多くの異なるタンパク質によって調節される(Bedard and Krause, 2007)。
グリセロリン脂質のサプリメントは、グリセロリン脂質がω3-PUFAを含むと仮定して、Nox活性をダウンレギュレートし、その後、酸化ストレスのリスクを低下させるかもしれない。(リチャード et al 2009)は、48時間DHAでヒト大動脈内皮細胞を前培養し、DHAの治療は、Nox4発現の減少を促進し、その後、アンジオテンシンIIとIL-1βへの曝露のためにそれ以外の場合はアップレギュレートされた活性酸素の産生を観察した。さらに、毛のないマウスの皮膚へのDHAの局所適用は、コントロールと比較して、用量依存的な方法で紫外線照射後のNox4の発現を有意に減衰させた(Rahman et al 2011)。Depner et al 2013)によるより最近の研究では、ネズミには、人間が定期的に消費する西洋の食事に似た栄養組成の飼料を与えた。げっ歯類の一部はまた、対照群ではオリーブオイルのみを与えられたのに対し、EPAおよび/またはDHAなどのω3-PUFAの補給を受けた。Depner et al 2013)は、ω3-PUFAを追加した食事を摂取した後のNrF2発現の増加を観察しなかったが、彼らは、p22phox、p40phox、p47phox、p67phox、およびGTPaseのRACサブグループのメンバーであるRAC1を含むNox調節タンパク質の顕著な減少を観察した。これらの以前の研究の知見に基づいて、グリセロリン脂質(ω3-PUFAを含む)の補充は、活性酸素を産生することが知られている酵素の活性をダウンレギュレートすることによって、またそれらの酵素の活性を刺激する因子と同様に、酸化ストレスのリスクを減少させる可能性がある。
全体的に、グリセロリン脂質のサプリメント、特にω3-PUFAを含むものは、活性酸素の産生の減少につながるいくつかの異なるタンパク質メッセンジャーの活性を変更する可能性があるが、内因性抗酸化物質の合成を増加させ、それによって酸化ストレスのリスクを低下させるように思われる。このように、グリセロリン脂質(ω3-PUFAを含む)を慢性的に補給することは、高齢者の活性酸素と内因性抗酸化物質の濃度の間のより大きなバランスを促進することが期待されている。これはおそらく、酸化ストレスを示すマーカーの低濃度として顕在化するであろう。老化したサンプルでは、酸化ストレス関連マーカーの低発現または抗酸化物質(内因性および食事性)の発現の上昇が、より大きな脳構造の完全性に関連していることが予想され、順番に、より大きな認知機能の予測になるだろう。
炎症
高齢者の炎症と脳構造
炎症は、身体組織の損傷や感染症に続く免疫応答の不可欠な要素である。炎症反応を調節する重要な影響は、炎症の促進または緩和に特化した細胞性メッセンジャーの産生および放出である。一般的な炎症促進性メッセンジャーには、インターロイキン(IL)-1β、IL-6,IL-8,IL-12,腫瘍壊死因子α(TNF-α)、およびC反応性タンパク質(CRP)が含まれ、抗炎症性メッセンジャーの例には、IL-4およびIL-10が含まれる(Baune et al 2008; Marioni et al 2010)。
加齢とともに、免疫学的にプライミングされた状態へとシフトしているようである。これは海馬などの大脳組織で確認されており、炎症性反応は典型的に高齢者ではより大きな大きさと持続時間である(レビューはBarrientos et al 2015を参照のこと)。複数の研究から得られたデータによると、先に挙げたようなプロ炎症性メッセンジャーの濃度の上昇は、より悪い脳構造の完全性を予測することが示されているので、これは神経認知健康の文脈で重要な観察である。これらの有害な影響は、より低い地域の脳組織体積、白質病変の体積の増加だけでなく、より悪い脳の微細構造として明らかである(Baune et al 2009; Werschingら。2010;永井 et al 2011;Bettcher et al 2012,2014,2015;Miralbell et al 2012;Satizabal et al 2012;Arfanakis et al 2013;Taki et al 2013b;Sudheimer et al 2014;Jiang et al 2015)。)
同様に、プロ炎症性メッセンジャーの高濃度と、認知パフォーマンスの低下または加齢に伴う認知機能低下の割合の増加との間には、関連があるようである(Yaffe et al 2003;Dimopoulos et al 2006;Wright et al 2006;Marioni et al 2010;Economos et al 2013;Mooijaart et al 2013;Adriaensen et al 2014;Tegeler et al 2016)。MCIや認知症と診断された成人では、認知機能が正常な成人に比べて炎症性メッセンジャーの濃度が高いことが明らかになっている(Dimopoulos et al 2006; Magaki et al 2007; Bermejo et al 2008; Troller et al 2010)が、炎症の亢進に伴う認知症リスクの増加が確認されている(Schmidt et al 2002; Engelhart et al 2004)。
興味深いことに、いくつかの研究では、大脳の構造的完全性をコントロールした後、炎症と認知の関係の強さが有意に減少したことを示しているようである(Arfanakis et al 2013;Marsland et al 2015)。これらの結果は、炎症が脳組織の劣化を促進することによって、一部では認知機能に悪影響を及ぼす可能性があることを示唆している。このように、炎症性メッセンジャーを調節するために有効な介入を同定することは、高齢者の脳構造、ひいては認知機能をサポートするために最も重要であるかもしれない。
グリセロリン脂質サプリメントと炎症
以前の前臨床研究からのデータは、グリセロリン脂質の補充がプロ炎症性メッセンジャーの濃度を変化させる可能性があることを実証している。いくつかの研究において、Treede et al 2007, 2009)は、caco-2細胞(ヒト腸管上皮細胞)にTNF-αを投与すると、核内因子κ-B(NF-KB)の活性化が誘発されることを観察した。しかしながら、ホスファチジルコリンとの同時処理は、NF-KBの活性化およびその後のプロ炎症性メッセンジャー(追加のTNF-αなど)の濃度をコントロール培養物と比較して低下させることを防止した。同様に、アミロイド-βおよびインターフェロン-γを投与する前に、ホスファチジルセリンおよびホスファチジルコリンからなるリポソーム(それぞれ豚の脳または卵黄から得たもの)に曝露したヒトミクログリア細胞の培養物は、TNF-αの濃度が低いことが示された(Hashioka er al)。
前臨床の文献に基づいて、Hartmann et al 2009)は、関節炎の齧歯類モデル(カラギーナンとカオリンを含む溶液を膝関節に注射することを含む)を使用している。この溶液の注入は、関節炎と一致する炎症反応を誘発した-具体的には、注入を受けた関節内だけではあるが、熱、腫れ、圧力感受性の増加。重要なことに、これらの効果は、非ステロイド性抗炎症薬またはホスファチジルコリン(150mg/Kgの用量)を経口投与することによって軽減されたが、後者のみが患部関節内の付着白血球の数を減少させた。別の研究では、LPSを注射したげっ歯類でTNF-αとIL-6の濃度が上昇した。しかし、ホスファチジルコリン(1%)で強化された実験的な食事を与えられたげっ歯類は、対照のげっ歯類と比較して、LPS注射後のTNF-α濃度が有意に低いことが示された(Tokes et al 2011)。同様に、大豆由来のホスファチジルコリン(1%)で強化された飼料を摂取すると、小腸虚血後のイヌの消化管における抗炎症効果が促進された(Ghyczy et al 2008)。他の研究では、トリニトロベンゼンスルホン酸浣腸の3日前と5日後にホスファチジルコリンの補充を受けたげっ歯類において、TNF-αとIL-6の両方の濃度が減少した(Kovacs et al 2012)。さらに、Jung et al 2013)は、そうでなければ健康なげっ歯類において、LPS注射による多臓器傷害をモデル化した。LPS注射は、TNF-αやIL-6などのプロ炎症性メッセンジャーや抗炎症性メッセンジャーIL-10の増加を誘発した。しかし、ホスファチジルコリンを投与したネズミでは、TNF-α、IL-6ともに有意な減少が認められたが、IL-10の濃度には影響はなかった。
グリセロリン脂質に反応する炎症性メッセンジャーの濃度を調べる研究の重みはホスファチジルコリンに焦点を当てているが、より少ない範囲でホスファチジルセリンに焦点を当てているが、いくつかの研究はホスファチジルエタノールアミンについても調査している。ホスファチジルコリンの補充に反応して抗炎症効果を観察したにもかかわらず、Treede et al 2007, 2009)はホスファチジルエタノールアミンを補充したときにこれらの効果を再現することができなかった。後の研究では、Eros et al 2009)は、2%カラギーナンを含む100μLの生理食塩水を第6肋間腔で胸腔に注入することを介してげっ歯類の胸膜炎(肺組織と胸腔を覆う組織の炎症)をモデル化した。カラギーナンの注入は、総白血球数の増加と同様に、肺組織内の白血球蓄積量の上昇を誘発した。重要なことは、ホスファチジルコリン、ホスファチジルエタノールアミン、N-アシルホスファチジルエタノールアミンまたはNAPE(飼料組成:ホスファチジルコリン1%、ホスファチジルエタノールアミン0.4%、NAPE0.1%)を含む特殊飼料を投与したげっ歯類において、カラギナン投与前7日間および投与後48時間の間に炎症が減少したことである。しかし、カラギーナンとホスファチジルエタノールアミンまたはNAPEを併用した場合の抗炎症効果は、ホスファチジルコリンとホスファチジルエタノールアミンまたはNAPEのいずれかに起因する可能性があると考えられ、分離することは困難である。
グリセロリン脂質サプリメントと炎症-潜在的な効果の経路
利用可能な文献によれば、ホスファチジルコリンの補給は炎症を有益に修飾することができる可能性があることが示唆されている。これらの効果は、ホスファチジルコリンがコリンの重要な供給源であり(Cho et al 2006;Chiuve et al 2007)したがってコリン作動性抗炎症経路を刺激することに起因する可能性がある。この経路では、迷走神経の求心性線維は、アセチルコリン受容体、特にマクロファージおよび他の非神経性サイトカイン産生細胞上のα7ニコチン性アセチルコリン(α7nACh)受容体と相互作用する。迷走神経からのアセチルコリンの放出は、これらの受容体を活性化し、その結果、NF-KBに対する抑制効果を促進し、その結果、プロ炎症性メッセンジャーに関連する遺伝子の転写を抑制することになる(Gallowitsch-Puerta and Pavlov, 2007)。
いくつかの研究において、コリンはα7nACh受容体アゴニストとして機能することが観察されている。Parrish et al 2008)は、TNF-α濃度を測定する前に、ネズミのマクロファージ細胞をコリンの存在下または非存在下で4時間LPSで培養した。コリン処理は、用量依存的にLPSの提示後のTNF-α濃度を低下させるようであった。TNF-αのこの低下は、NF-KB活性の低下により生じたことが判明した。Parrishらは次に、エンドトキシン(6mg/kg)の注射の前の2つの時点(6時間および30分)でコリン(5または50mg/kg)または生理食塩水を腹腔内注射することにより、これらの効果をげっ歯類で実証した。より高いコリン用量は、α7nACh受容体の活性化に続くNF-KB活性の低下に起因して、エンドトキシンを注射した前のげっ歯類におけるTNF-α濃度を低下させた。重要なことに、これらの結果はその後、ヒトの全血および培養マクロファージで再現された。同様の観察は、CDP-コリン(ホスファチジルコリンの前駆体であるが、コリンも含む)をげっ歯類に皮内注射で投与した後、Gurun et al 2009)によっても行われた。また、コリンの抗炎症作用は、コリンがα7nACh受容体を刺激し、その後、NF-KB活性を抑制し、したがって、プロ炎症性メッセンジャーの産生を抑制することに応答して起こることが観察された。この可能性のあるメカニズムを理解するためにはさらなる研究が必要であるが、コリンの重要な供給源であるホスファチジルコリンがコリン性抗炎症経路を介してプロ炎症性メッセンジャーの濃度に影響を与えている可能性がある。これは、ホスファチジルコリンの投与がTNF-αのようなプロ炎症性メッセンジャーの濃度低下と関連していたという、以前に議論された経験的観察を説明している可能性が高い(Treede et al 2007, 2009)。
グリセロリン脂質の補充が炎症に影響を与える追加の経路は、炎症性細胞を含む細胞膜の脂肪酸組成の変更を通してである。以前の研究では、主にリン脂質内のω3-PUFAの補給は、血清および膜結合したリン脂質内のω3-PUFAのバイオアベイラビリティの増加を促進することが示されている(Ramprasath et al 2013年)。膜グリセロリン脂質内でのω3-PUFAの増加は、典型的には、ARAなどのω6-PUFAを犠牲にして起こる(Calder, 2015)。このように、炎症反応の間、ホスホリパーゼA2の作用を介して、ω6-PUFA ARAではなく、EPAまたはDHAのようなω3-PUFAの放出に向けた傾向があるかもしれない。一旦放出されると、これらの脂肪酸は、エイコサノイドの産生をもたらすシクロオキシゲナーゼ(COX)および/またはリポキシゲナーゼ(LOX)酵素によって代謝され得る。ARA代謝に起因するエイコサノイドは、TNF-α、IL-6,IL-8,およびIL-1βなどの炎症誘発性メッセンジャーの産生を刺激するため、親炎症性である(Wall et al 2010; Serhan and Petasis, 2011)。しかしながら、ω3-PUFAの代謝によって産生されるエイコサノイド、特にEPAは、ARAに関連するものよりもはるかに少ない強力なプロ炎症性効果を発揮する(Wall et al 2010; Calder 2015)。さらに、COXおよびLOX酵素によるEPAまたはDHAの代謝は、レゾルビン、マレシンおよびプロテインなどの強力な抗炎症性および炎症解決剤の合成を促進する(BannenbergおよびSerhan 2010;SerhanおよびPetasis 2011;Calder 2015)。さらに、ω3-PUFAのバイオアベイラビリティの増加は、NF-KBの核内転座の減少、したがってプロ炎症性メッセンジャーに関連する遺伝子の転写を促進するのに役立つかもしれない(Wall et al 2010; Calder 2015)。
全体的に、それは、グリセロリン脂質、特にDHAなどのコリンおよび/またはω3-PUFAを提供するものを補充すると、有益に炎症性メッセンジャーの濃度を変更することが予想される。プロ炎症性メッセンジャーの高濃度への慢性的な暴露は、高齢者の貧しい脳の構造的完全性を予測するように見えるように、それはプロ炎症性メッセンジャーへの暴露を低下させることが脳の構造に利益をもたらすことが予測される。その後、これらの効果が高齢者の認知機能をさらに向上させることが期待される。
循環器・脳血管機能
高齢者の心・脳血管機能と脳構造
心血管機能および脳血管機能もまた、高齢者の脳構造を予測する適切な因子である。心血管機能の一般的な測定値の1つは血圧(BP)であり、具体的には収縮期血圧(SBP)と拡張期血圧(DBP)である。中高年および高齢者では、血圧(収縮期および/または拡張期)または高血圧(臨床的に診断された高SBPおよびDBP)の上昇は、総脳体積および領域脳体積の減少として反映され、より悪い脳マクロ構造の完全性を予測することが観察されている(Den Heijer et al 2003a, 2005; Raz et al 2003a, 2005; Den Heijer er al 2003a, 2005; Raz et al 2003; Beauchet et al 2013)皮質の菲薄化(Leritz et al 2011; Alosco et al 2014; Gonzalez et al 2015)だけでなく、脳白質病変または高次脳機能障害の重症度の増加(Goldstein et al 1998; Guo et al 2009; Allan et al 2015)も予測されている。血圧の上昇はまた、より低い脳微細構造の完全性を予測するようである(Kennedy and Raz, 2009; Leritz et al 2010; Salat et al 2012)。心血管機能のもう一つの指標は動脈硬化(AS)である。動脈硬化の増加は、脳白質病変または脳白質亢進の重症度の増加と同様に、脳容積の低下を予測することが観察されている(Tsao et al 2013;Lilamand et al 2016)。BPとASの両方の上昇は、慢性的に上昇した脈動圧が脳微小血管系にダメージを与えるため、一部では、より悪い脳構造の完全性に寄与している可能性がある。これは、順番に虚血とその後の脳組織の崩壊(Gonzalez et al 2015; van Sloten et al 2015; Lilamand et al 2016)につながる減少した脳灌流を促進する可能性がある。
心血管機能の低下と脳の構造的完全性との間に明らかな関連があることから、心血管機能の低下が認知機能の低下を予測することは次のとおりである。血圧の上昇は、MCIや認知症を発症するリスクの増加と同様に、認知機能の低下を予測することが観察されている(Launer et al 2000;Whitmer et al 2005;Köhler et al 2014;Chen et al 2015;Alipourら、Goldust。2015; Alipour and Goldust, 2016)で、同様の効果が動脈硬化上昇した成人で観察されている(Singer et al 2014; Hajjar et al 2016; Lim et al 2016; Pase et al 2016; Meyer et al 2017)。年齢とともに増加した血圧(NeatonおよびWentworth、1992;Lloyd-Jones et al 2005)およびAS(Benetos et al 2002;Mitchell et al 2004)のための優勢があることを考えると、栄養介入でこれらのアウトカムをターゲットにすることは、高齢者の脳の構造的完全性、したがって認知機能に利益をもたらすかもしれない。
同様に、「血液脳関門」(BBB)の完全性/伝染性(脳血管機能の重要な指標)も、高齢者の脳構造の完全性に影響を与える可能性がある。BBBは、脳組織を灌流する毛細血管の内皮細胞が緊密に圧縮されて構成されている。O2やCO2などのガスは、その濃度勾配に沿ってこれらの毛細血管内皮細胞間を自由に拡散することができる。しかし、オクルーディングやクラウディンなどの膜貫通タンパク質や接合部接着分子などで構成される「タイトジャンクション」の存在は、水、イオン、その他の大きな分子の毛細血管内の流れを制限している。より大きな分子はBBBを横切ることがあるが(脳組織に入るか出るかのいずれか)そのような分子の移動は通常、複雑な受容体およびトランスポーターシステムに依存している(Popescu et al 2009; Zeevi et al 2010)。
BBBの完全性の維持、したがって選択的な伝染性は、脳組織の最適な健康を確保するために不可欠である。しかし、加齢とともにBBBの完全性は低下し、伝染性は増加する傾向があるようである。Pelegri et al 2007)とDel Valle et al 2009)は、げっ歯類の老化促進モデル(SAMP8)において、加齢に伴うBBB伝染性の増加を観察している。同様に、同時期に発表されたシステマティックレビューおよびメタアナリシスでは、若年者に比べて高齢者ではBBB伝染性の低下が確認されている(Farrall and Wardlaw, 2009)。
加齢に伴うBBB伝染性の変化は、高齢者の脳組織の完全性だけでなく、認知機能の変化を予測するようである。システマティックレビューでは、Farrall and Wardlaw(2009)は、BBB伝染性の上昇が脳白質病変の重症度の増加と相関していることを示す多くの研究を同定した。同様に、BBB伝染性の上昇は、記憶力の低下(Wang et al 2006)およびミニメンタル状態検査のパフォーマンス(van de Haar et al 2016)の予測因子である。また、認知症(アルツハイマー病および血管性亜型)またはMCIのいずれかの成人では、認知的に正常な成人と比較して、BBB伝染性が上昇している傾向があるようである(Farrall and Wardlaw, 2009)特に海馬だけでなく、大脳皮質および深部灰白質においても(Wang er al)。 BBB伝染性の増加は、大脳構造への悪影響を通じて認知機能に悪影響を及ぼす可能性がある。高度な構造神経画像法、微妙な認知変化に敏感なコンピュータタスク、そして重要なことに、より大きな(認知的に多様な)参加者サンプルを利用したさらなる研究は、BBB伝染性への変化が加齢に伴う脳構造の完全性と認知機能にどのように影響を与えるかについての更なる洞察を提供するであろう。
グリセロリン脂質サプリメントと心臓/脳血管機能
先に示されたように、海洋由来の供給源(例えば、オキアミ)に由来するグリセロリン脂質だけでなく、哺乳類の脳や大豆もω3-PUFAの供給源として機能する可能性がある。ω3-PUFAの摂取量の増加またはバイオアベイラビリティーがBPに有益であることを示唆する証拠がある(Mori et al 1999;Paschos et al 2007;Takeuchi et al 2007;Theobald et al 2007;Witte et al 2013)が、そのような効果は、未治療(または治療不良)の高血圧症を有する成人に限定されるかもしれないが(Campbell et al 2012;Miller et al 2014;Minihane et al 2016)。動脈硬化に対しても同様の有益性が観察される可能性がある。システマティックレビューおよびメタアナリシスにおいて、Pase et al 2011)は、ω3-PUFAの補給が脈波伝播速度および動脈コンプライアンスの改善に有効であることを明らかにし、ASの減少を示した。その後の試験では、Pase et al 2015)は、6gの魚油(480mgのDHA+480mgのEPA)を16週間毎日補給すると、大動脈拡張圧で測定される中心性動脈硬化が有意に低下することを観察した。ω3-PUFAの摂取量/バイオアベイラビリティーと動脈硬化のレベルとの間の関連性のための追加の支持は、ω3-PUFAの組織濃度が高いとASの低下を予測する中高年および高齢者を対象としたいくつかの研究によって提供されている(Anderson et al 2009; Sekikawa et al 2013; Reinders et al 2015; Lee et al 2016)。先行研究では、グリセロリン脂質の補給が生物学的組織内のω3-PUFAの濃度を効果的に上昇させる可能性があることが示されていることを考えると(Ramprasath et al 2013)、ω3-PUFAを含むグリセロリン脂質の補給は、血圧や動脈硬化などの心血管機能の測定にも利益をもたらすことが予想される。
これまでのところ、グリセロリン脂質のサプリメントが高齢者の心血管機能に影響を与えるかどうかを調査した研究は非常に少ない。ある研究では、Vakhapova et al 2011)は、157人の高齢成人(平均年齢は〜72歳)に1日1回ホスファチジルセリン(300mgのホスファチジルセリンと79mgのDHAとEPA、3:1の比率)を15週間毎日投与した。最初の15週間の二重盲検治療段階では、SBPとDBPのいずれについても治療群と対照群の間に差は認められなかった。しかし、この試験は、ホスファチジルセリン(ホスファチジルセリン 100mg、DHAおよびEPA 26mg)の投与量を減らしたオープンラベルの延長試験として、さらに15週間継続された。延長試験には、当初の試験段階から 121名の成人が参加し、2つのグループに分けられた。以前にホスファチジルセリンサプリメントを投与されていた成人は「continuers」と呼ばれ、元々プラセボを投与されていた成人は「ナイーブ」と呼ばれた。Vakhapova et al 2011)は、15週間の追加介入後、「continuers」に指定された成人ではベースラインからDBPが有意に低下したが、「ナイーブ」群では変化が認められなかったことを明らかにした。しかし、同時投与が唯一の実験的治療法であったため、これらの効果がホスファチジルセリンに起因するものなのか、それとも追加のω3-PUFA(またはその両方)に起因するものなのかを判断することはできない。別のオープンラベル試験では、Richter et al 2013)は、50歳から90歳の成人30人に、大豆由来のホスファチジルセリン(それによってDHAなどの長鎖ω3-PUFAに変換される可能性のあるALAを含む)を1日300mg、12週間投与した。治療後、Richter et al 2013)は、SBPとDBPの両方に有意な減少を確認した。
心血管機能への有益な効果は、グリセロリン脂質のサプリメントに続いて観察されているが、反対のデータが利用可能である。Jorissen et al 2002)は、AAMIの高齢者に300または600mgを12週間投与した場合の大豆由来ホスファチジルセリンの安全性に関するデータを報告している。著者らの報告によると、補給期間終了時には、いずれのBP指標においても有意な群間差は認められなかった。しかし、有益な効果が認められなかったのは、重要な方法論的要因によるものかもしれない。同じ研究からのデータを用いた以前の発表では、Jorissen et al 2001)は、グリセロリン脂質の補充に続く認知的利益の欠如は、生産後15ヵ月までにホスファチジルセリンが50%低下したことに起因する可能性があると示唆している。Jorissen et al 2001)は、治療法が製造された後〜11ヵ月後にホスファチジルセリンの投与が終了したと報告しているが、心血管への影響の可能性を最小化するのに十分に分解が進んでいたかもしれない。Jorissen et al 2002)と同様に、Richter et al 2013)は、ゼラチンカプセルの形でホスファチジルセリンを投与したが、Richter et al 2013)は、カプセルがグリセロリン脂質の安定性のために特別に設計されたと報告している。これらの研究の間のもうひとつの適切な違いは、並行して治療群を使用していることである。Jorissen et al 2001, 2002)は二重盲検、並行群のデザインを利用した。Vakhapova et al 2011)は、「continuers」または「ナイーブ」と指定された成人が心血管系の利益を経験したかどうかを決定するために、グループ内での比較のみを行っているようで、グループ間の潜在的な効果を特定するための追加の分析は行われていない。同様に、Richter et al 2013)はプラセボ群を含まないオープンラベル試験を実施したため、心血管機能の変化は群内分析のみで決定された。最後に、これらの研究ではサンプルサイズにマーカーの違いがあった。(Jorissen et al 2002)と(Vakhapova et al 2011)では、それぞれ約130人の参加者がいたのに対し、Richter et al 2013)では30人(試験終了時には26人)しかいなかった。これらの試験デザインや規模の違いが、これらの研究間の結果の違いを説明し始めるかもしれない。このように、グリセロリン脂質の補給は心血管機能に有益であるかもしれないが、高齢者におけるこれらの効果を確認するためには、さらによく設計された臨床試験が必要である。
グリセロリン脂質の補給に続く心血管系の利益のいくつかの調査があるが、グリセロリン脂質の補給がどのように脳血管機能、特にBBB伝染性に影響を与えるかを検証する臨床試験は今日まで行われていないようである。これにもかかわらず、コリンおよび/またはω3-FAを含むグリセロリン脂質を慢性的に摂取すると、高齢者のBBB伝染性への利益が明らかになることはもっともである。グリセロリン脂質の補給がBBB伝染性に利益をもたらす可能性のあるメカニズムはで強調されている。
グリセロリン脂質の補充と心臓/脳血管機能-効果の潜在的な経路
心臓および脳血管機能の低下には複数の因子が関与している可能性が高いが、酸化ストレスと炎症の両方が特に重要であることが示唆されている。活性酸素の増加は、酸化ストレスと同様に、高血圧の病因における重要な因子であることが示唆されている(Vaziri and Rodríguez-Iturbe, 2006; Briones and Touyz, 2010; Wu and Harrison, 2014)。さらに、炎症の上昇は、酸化ストレスおよび内皮機能障害の両方との相互関係を介してそうするかもしれないが、血圧の上昇または高血圧の存在を予測することが示唆されている(Vaziri and Rodríguez-Iturbe, 2006; Dinh et al 2014)。さらに、酸化ストレスは、血管壁のリモデリングを介して潜在的に動脈硬化の上昇と正の関係がある(Patel et al 2011; Kawamoto et al 2016) (Fleenor, 2013)。同様に、慢性的に上昇した炎症は、動脈壁の構造的構成に有害な変化を引き起こし、最終的に動脈硬化上昇の一因となる可能性がある(Jain et al 2014)。
同様に、酸化ストレスにつながる不均衡なROS活性だけでなく、特定のプロ炎症性メッセンジャーの濃度の上昇は、BBB伝染性の上昇を促進することが示唆されている(レビューはPun et al 2009;OakleyおよびTharakan 2014;RochfortおよびCummins 2015を参照のこと)。他のメカニズムの中でも、タイトジャンクションタンパク質に対する有害な変化は、酸化ストレスに続くBBB伝染性の増加またはTNF-αまたはIL-6などのプロ炎症性メッセンジャーの濃度上昇の原因としてしばしば強調される(Pun et al 2009;CoisneおよびEngelhardt 2011;Elahy et al 2015;VaratharajおよびGalea 2017年を参照のこと)。ホモシステインの上昇はまた、げっ歯類におけるBBB伝染性の上昇を予測する(Kamath et al 2006;Lominadze et al 2006;Beard et al 2011;Rhodehouse et al 2013)。BBB伝染性の低下は、MCIを有する成人においてホモシステインの上昇とともに観察されている(Lehmann et al 2003)。これらのリスクメカニズムのそれぞれは、コリンおよび/またはω3-PUFAを含むグリセロリン脂質の補給によって修正可能であることが示されている(前のセクションを参照)。その後、グリセロリン脂質の補充は、高齢者のBBB伝染性にさらに利益をもたらすと予想される。これは、十分に設計された臨床試験で調査する必要がある。
より多くの研究が必要とされているが、グリセロリン脂質の補給が高齢者の心臓および脳血管機能に関連した測定に利益をもたらす可能性があることを示唆する直接的および間接的な証拠がある。このように、コリンおよび/またはω3-PUFAを含むグリセロリン脂質の慢性的な補給は、高齢者の心機能および脳血管機能の前述の指標を改善し、それによって高齢者の脳構造の完全性および認知機能を支持するという仮説が立てられている。
概要
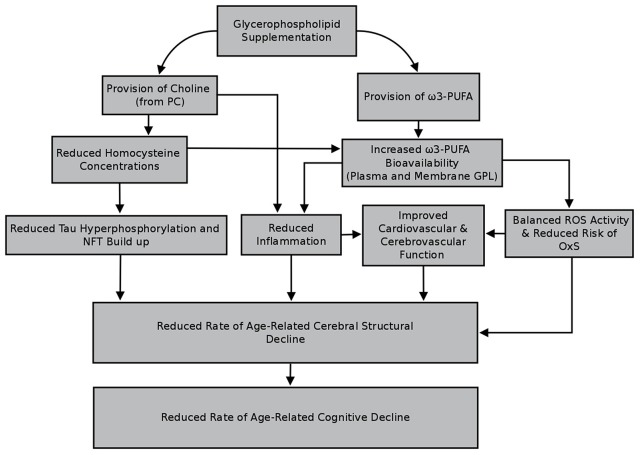
グリセロリン脂質の慢性的な補充は、動物や高齢者の認知機能に利益をもたらすことが観察されている(表11-3と同様に、導入を参照してほしい)。また、グリセロリン脂質の補充が脳構造に有益であるという考えを支持するデータもあるが、これまでにこれらの効果はげっ歯類でのみ検討されている。高齢のヒトでの研究が少ないにもかかわらず、脳構造への有益な効果が達成可能であることはもっともらしく、特に投与されたグリセロリン脂質がコリンおよび/またはω3-PUFA(DHA、EPA、またはALA)を含んでいる場合である。前述の栄養素を含むグリセロリン脂質の長期的な補充は、これらの栄養素のバイオアベイラビリティを上昇させ、それによって脳組織の破壊に関連するいくつかの因子の修正、またはそれに対する保護をもたらすことが期待される(ホモシステイン、酸化ストレス、炎症、および心血管系および脳血管系の機能のセクションを参照してほしい)。このレビューで概説されている因子を最小化または改善することで、グリセロリン脂質の補充は時間の経過とともに脳の構造的低下の割合を低下させる可能性がある。また、グリセロリン脂質が細胞膜の主要な構成要素であることを考えると、補充は、脳組織への少なくとも軽度の修復を促進する可能性がある。それは衰退、修復、またはその両方の組み合わせの減少率によってであるかどうか、それは脳構造をサポートすることによって、グリセロリン脂質の補給はまた、年齢の増加に伴う認知機能の低下の軌跡に影響を与える可能性があることが予想される。図33は、グリセロリン脂質の補充が高齢者の脳構造、そしてその後の認知機能に利益をもたらす可能性がある選択された経路を概説している。これらの効果は、高度な構造神経画像法の使用を組み込んだ将来のよく設計された臨床試験で検討されるべきである。
図3 グリセロリン脂質補給が高齢者の脳構造と認知機能に恩恵をもたらす可能性のある経路を選択してほしい
結論
マクロレベルとミクロレベルの両方で、脳の構造的完全性が加齢とともに低下することを示す実質的な研究がある。栄養摂取量を変更することは、ビタミンB群、ω3-PUFA、またはレスベラトロールとの慢性的な補充は、おそらく修復を促進し、時間の経過とともに減少した脳の劣化を媒介することを示す多くの試験で、加齢に伴う脳構造をサポートするための手段として急速に認識されつつある。このレビューでは、脳構造への利益がグリセロリン脂質の補充に応答して起こる可能性があり、それによって将来の人間の臨床試験のための理論的な基礎を提供することを介して、いくつかの異なる経路を論じている。
脳のマクロおよびミクロ構造の完全性が高齢者の認知機能の適切な予測因子であることを考えると、それは脳構造をサポートすることによって、認知機能の低下の減少率が明らかになるかもしれないことはもっともらしい。栄養補給のような容易に利用できる介入を通じて、加齢に伴う脳の衰え、したがって認知機能の低下の軌跡を改善することは、AAMIやMCIなどの加齢に関連する疾患のリスクを低下させ、発症を遅らせるのに役立つかもしれない。さらに、認知症などの病的状態の発症を遅らせることができ、認知症の発症率の低下に貢献する可能性がある(Brookmeyer et al 2007)。栄養の変更が容易で、有害な副作用が相対的にないことを考えると、栄養補給、特にグリセロリン脂質を用いた栄養補給は、加齢に伴う神経認知の健康をサポートするための有用な介入である可能性がある。
利害関係の相反についての記述
JMRはオーストラリア政府の大学院研究奨学金を受けている。DJWは、アボットニュートリション社、バイエルヘルスケア社、ニューロブランド社から研究費およびコンサルタント料を受領している。HMはSwisse-Wellnessから研究資金を受けている。ASは、アボットニュートリション、オーストラリアワイン研究所、バリラ、バイエルヘルスケア、ブラックモア、コグニス、サイベックス、Dairy Health Innovation Consortium、ダノン、ジンサナ、グラクソ・スミスクラインヘルスケア、マスターフーズ、マルテック、ナチュレックス、ネスレ、ノバルティス、レッドブル、サノフィ、ユニリーバ、バーデューレサイエンス、リグレーから研究費とコンサルタント料を受領している。APは、Biostime、Blackmores、DSM、LifeVantage、Novasel Australia、Enzo Nutraceuticals、Swisse Wellnessから研究助成金とコンサルタント料を受けている。APは以前、Swisse Wellnessの科学諮問委員会のメンバーでした。DJWとASはともに、高齢者の神経認知機能の健康に対するリン脂質サプリメントの効果を調査する臨床試験を実施するために、ARLA Foodsから助成金を受けている。ASは、食品業界から研究資金、コンサルタント、名誉賞を受けている。
