コンテンツ
pubmed.ncbi.nlm.nih.gov/36788995
A Potential Role of the Spike Protein in Neurodegenerative Diseases: A Narrative Review
オンライン公開 2023 Feb 11.
pmcid: pmc9922164
モニタリング・エディター アレクサンダー・ムアセビッチ、ジョン・R・アドラー
ステファニー・セネフ1 Anthony M Kyriakopoulos, 2Greg Nigh, 3and Peter AMcCullough4
概要
ヒトプリオンタンパク質およびプリオン様タンパク質のミスフォールディングは、多くの神経変性疾患の原因として広く認識されている。SARS-CoV-2のスパイクプロテインがプリオン様タンパク質に特徴的なアミノ酸配列を有しているという説得力のある証拠から、プリオンおよびプリオン様疾患に関する試験管内試験および生体内試験の実験的証拠に基づき、神経変性疾患を引き起こす可能性を推測している。
私たちは、ワクチンによって誘導されたスパイクプロテインの合成が、神経細胞における有毒なプリオン様線維の蓄積を促進していることを提案している。また、これらのタンパク質が全身に分布することが予想される様々な経路を概説する。
mRNAワクチン接種を受けた人に頻発する可能性のある細胞病理と疾病発現の両方を検討した。具体的には、スパイクプロテインがプリオン様特性を介して、神経炎症および神経変性疾患、血管系における凝固障害、広く普及しているインスリン抵抗性の文脈でプリオンタンパク質の制御が抑制されることによるさらなる疾患リスク、およびその他の健康合併症に寄与することを説明する。
これらのプリオン様特性が、SARS-CoV-2の自然感染よりも、ワクチン関連のmRNA誘導型スパイクプロテインに関連性がある理由を説明する。私たちは、現在のオミクロンの変異株において、プリオン様特性が明らかに失われていることを楽観的に受け止めている。
私たちは、この論文で述べた一連の病理学的事象は仮説に過ぎず、まだ検証されていないことを認識している。また、私たちが紹介する証拠は、研究文献に基づくものではあるが、現在のところ、直接的なものではなく、状況証拠に基づくものが多いことも認識している。
最後に、私たちの発見が一般大衆に与える影響について述べ、私たちが緊急に考慮する必要があると考える公衆衛生上の勧告について簡単に述べる。
–
本論文の以前のバージョンは、2022年8月16日にAuthorea preprint serverに投稿されたものである。-
キーワード 神経変性、アミロイドーシス、g四重鎖、糖尿病、cd16+単球、エクソソーム、mrnaワクチン、プリオン病、スパイクプロテイン、sars-cov-2
導入と背景
プリオン病は、伝達性海綿状脳症(TSE)とも呼ばれ、動物やヒトがかかるまれで一貫して致命的な脳疾患の一群である。プリオン病は「タンパク質性感染性粒子」によって引き起こされ、生物による古典的な感染がなくても、病気の拡大を促進することができる。
狂牛病(牛海綿状脳症)、羊のスクレイピー、鹿の慢性消耗病(CWD)などがある。ヒトのプリオン病は、クロイツフェルト・ヤコブ病(CJD)と呼ばれ、常に致死的である。致死性家族性不眠症(FFI)は、プリオンタンパク質の特定の変異によって引き起こされるまれな致死性遺伝病である。
一般的な命名法では、プリオンタンパク質の自然に折り畳まれた形をPrPCと呼び、間違って折り畳まれた形をPrPSC(「スクレイピー」の意味)と呼ぶ。プリオン蛋白質は、神経細胞に発現している同じ蛋白質のミスフォールディングを促進するために、外部のミスフォールディングしたプリオン蛋白質(PrPSC)が感染源となり、自己触媒的に病気が伝播していく仕組みになっている。
現在では、プリオンタンパク質の可溶性中間体であるオリゴマーが毒性物質であることが一般に認識されている。一方、不溶性プラークは、可溶性オリゴマーの除去をもたらすという意味で、保護的であるとさえ考えられる[1]。
プリオン病の一般化は、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)などの神経変性疾患も含み、これらの疾患にはプラークやレビー小体に蓄積された誤ったタンパク質の存在があることが次第に明らかとなってきている。
アミロイド原性タンパク質と呼ばれるこれらのタンパク質は、「プリオン様」とも呼ばれ、その広がりは、古典的により厳格な定義のプリオンタンパク質(PrP)と重なる性質も持っている可能性がある[2,3]。タウとα-シヌクレインは共にアミロイド形成性であると特徴づけられている[4-6]。
さらに、ALSに関連してミスフォールドするタンパク質である43kDaのTAR-DNA結合タンパク質(TDP-43)は、プリオン様様式で細胞間を伝播する凝集体を形成することが研究者によって発見されつつある[7]。
タンパク質の凝集体は、ナノチューブのトンネル化、裸の凝集体としての分泌、エクソソームなどの細胞外小胞へのパッケージングという少なくとも3つの異なるメカニズムによって、ある細胞から別の細胞に伝搬することができる[8]。
–
ある注目すべき研究では、細菌のプラスミド開始タンパク質であるRepAの変異株が、細胞内にアミロイドオリゴマーを構築し、神経変性におけるヒト細胞のミトコンドリア障害と同様に、細菌の致死的カスケードを誘発するというものである[9]。
本研究では、野生型RepAを発現するように操作したヒト神経芽腫細胞株を用いて研究を行った。A31V変異を持つRepAの変異株は、アミロイド線維を形成しやすいことが示された。遺伝子改変されたヒト神経芽腫細胞は、変異型RepA凝集体を放出するマウス細胞と共培養された。
マウス細胞から放出されたアミロイド線維は、ヒトのレシピエント細胞のサイトゾルに存在し、細胞毒性を示すことが示された。このように、アミロイドーシスはマウス細胞からヒト細胞へと伝播したのである。この結果に基づいて、著者らは「プリオン生物学の根底にある中心的な原則」を述べている。
「あるプリオン様タンパク質がどのような生物学的起源を持つものであっても、系統的に無関係な受信者細胞に伝達することができる。ただし、受信者細胞が可溶性タンパク質を発現し、その上に入力タンパク質が容易にアミロイド構造を形成できることが条件である」[9]。
すなわち、変異型プリオン様細菌タンパク質に類似したmRNAワクチンをトランスフェクトしたヒト細胞が過剰に産生するスパイクプロテインがアミロイド線維として放出され、様々なアミロイド形成タンパク質、特にプリオンタンパク質を発現する神経細胞に取り込まれ、種として作用する可能性があるというものである。
この結果、細胞毒性および神経変性が生じ、mRNAワクチンの副反応として観察される多くの神経症状を説明できる可能性がある。この論文の残りの部分では、研究文献からの広範な証拠に基づいて、この仮説をさらに発展させる。
スパイクプロテインがプリオン様機能を通じて神経毒性を持つかもしれないという考えは、新しいものではない。2020年、Tavassoly Oらは、スパイクプロテインに由来するペプチドが、既存のアミロイド原性ヒトタンパク質と交配し、線維形成を促進し、神経変性を引き起こすかもしれないと提唱した[10]。
スパイクプロテインのプリオン様の可能性を示す強力な証拠は、スパイクプロテインのS1セグメントの受容体結合ドメイン(RBD)が、ヘパリンおよびアミロイドβ、α-シヌクレイン、タウ、プリオンタンパク質、TAR DNA結合タンパク質43(TDP-43)など複数の異なるアミロイド形成性のヘパリン結合タンパク質に結合するという計算モデルによる証明で2021年に発表されたペーパーにある[11]。
彼らは、これがスパイクプロテインがミトコンドリアの酸化ストレス、アポトーシス、神経変性を引き起こすメカニズムである可能性を提唱した。ヘパリン結合は、脳内のアミロイド蛋白の凝集を加速させる[12]。
COVID-19感染に伴う脳内皮細胞によるスパイクプロテインのエンドサイトーシスにより、アルツハイマー病における中枢神経系の障害が増幅されるという事例が報告されている。他の研究と一致して、これらの著者らは、スパイクによる内皮炎が血液脳関門を乱し、スパイクプロテインとアミロイドβまたは過リン酸化タウとの相互作用を介してアルツハイマー病を悪化させることを提案した[13]。
レビュー
スパイクプロテインはプリオン様ドメインを持つ
COVID-19 mRNAワクチンは、SARS-CoV-2スパイクプロテインをコードするmRNAを含む脂質ナノ粒子をベースにしている。このワクチンは、mRNAの内容物を分解から保護し、それをトランスフェクトした細胞が長期間にわたって高い生産速度で大量のスパイクプロテインを生産することを保証するために、いくつかの方法で設計されている[14-18]。
バイオインフォマティクスを用いた包括的な研究により、多様な種から、遺伝子配列にプリオン様シグネチャーを持つ多数のウイルスタンパク質が同定された。特に、受容体との結合や宿主細胞との融合に関与するウイルス表面タンパク質にプリオン様ドメインを同定した[19]。
これらの同じ著者らは、後にスパイクプロテインのプリオン様可能性を分析した論文を発表した。彼らは、SARS-COV-2スパイクプロテインのRBDに、オリジナルのSARS-CoVウイルスにはなかったプリオン様ドメインを見いだした。
アスパラギン(N)とグルタミン(Q)に富む領域は、多くのプリオンタンパク質の特徴である。SARS-CoV-2変異株では、SARS-CoVと比較して5つのアミノ酸が置換されており、疎水性のQ/Nリッチ領域が形成されているため、プリオン形成が可能であることがわかった。
彼らはまた、SARS-CoV-2変種のいくつかを分析し、デルタ変種はオリジナルのWuhan株よりもプリオン形成のスコアが高く、一方、オミクロンは大幅に低いスコアであることを決定した[20]。
グルタミン酸アスパラギンに富んだ領域(QNR)は、制御分子やRNA結合タンパク質で頻繁に見つかっている。隠れマルコフモデリング(HMM)は、調査対象のクラスを表す訓練データのセットが与えられたときに、特定の観測シーケンスの尤度を計算するために使用される統計ツールである。
HMMは、タンパク質やプリオン配列の組成的な類似性を評価するために使用される。オンラインアプリケーションであるprion-like amino-acid composition (PLAAC) analysis(plaac.wi.mit.edu/) は、ウイルス、原核生物、真核生物のタンパク質中のプリオン候補ドメインを特定するためにHMM技術を採用している[22,23]。
PLAAC解析の結果得られる対数尤度比(LLR)は、調査したタンパク質がプリオン原性である可能性を推定するものである。PLAACアルゴリズムは、すでに研究されている酵母プリオンの少なくとも1つのドメインと組成的に一致する与えられたタンパク質のプリオン原性ドメイン(PrD)を分析する[24]。
表1は、PLAACによって推定され、それらの平均LLRスコアによってミラーリングされた最も多くのPrDドメインを含む主要な真核生物(ヒト)ウイルスの目および種を含む[19,20,25〜28]。さらに、主なSARSコロナウイルスとその変異株のLLRスコアも表表Table 1に含まれている。
表1 真核生物DNA、様々なヒト病原性RNAウイルス、およびヒト病原性RNAコロナウイルスのいくつかの変種におけるプリオジェニック・ドメイン(PrD)の比較
LLR:ウイルスタンパク質におけるプリオン原性ドメイン(PrD)の濃縮を予測する対数尤度比。-
* :ソース[14]; ** :ソース[20]; *** :ソース[15]。4* :ソース[21]; ソース[22]; 5* :出典[23]。
| 真核生物ヒトDNA・RNAウイルス*。 | 病原性SARSコロナウイルスとその変異株***。 | ||||
| タンパク質にプリオン原性ドメインが最も多く含まれる主なウイルスの目と種を提示 | Herpevirales(α、β、γヘルペスウイルスを含む)。平均LLR:6.75;メガウイルス**: 平均LLR:10.35;ポジティブストランドRNAウイルス、含む。
Picornavirales (Enterovirus B, cardiovirus B) および Flaviviridae (Zika virus, Hepatitis C virus):平均LLR:6.47;バキュロウイルス科(コロナウイルスを含む)。平均LLR:ヘルペスウイルスと同程度。 |
SARS-CoV:LLR:4.426。 | SARS-CoV-2: LLR: 4.856 | デルタB.1.617.1変異株。
LLR: 6.025 |
オミクロンB.1.1529の変種。
LLR: 3.080 |
| タンパク質のドメイン | DNAウイルスの場合。ウイルス膜とエンベロープは、糖タンパク質と膜タンパク質に関与している。
RNAウイルスの場合ウイルス前駆体タンパク質、細胞侵入用タンパク質 |
スパイクプロテインヘプタッドリピート1 (HR-1) | スパイクプロテイン受容体結合ドメイン(RBD) | スパイクプロテインレセプター結合ドメイン | スパイクプロテインレセプター結合ドメイン |
| タンパク質の機能 | 転写、翻訳、タンパク質合成ウイルスの吸着と侵入 | 細胞接着、融合、細胞侵入とSARS CoV感染症の病態4*。 | COVID-195*のACE2受容体への結合、接着、細胞侵入および病態の解明 | ||
スパイクプロテインのアミロイド形成能を評価する研究では、理論と実験の両方の方法を用いて、SARS-CoV-2スパイクプロテインがタンパク質分解を受けた後にアミロイド様フィブリルを出現させることを確認した。理論的な予測により、スパイクプロテインの中にアミロイドを形成する可能性のある7つの配列が同定された。
このタンパク質をプロテアーゼである好中球エラスターゼとインキュベートした実験では、24時間の同時インキュベーションでアミロイド様線維が出現した。特定のセグメント、スパイク194-213(FKNIDGYFKI)は6時間後に非常に多く、それは理論的に同定された最もアミロイド化しやすい配列とほぼ完全に重なっていた。免疫活性化に反応する好中球は、好中球エラスターゼを培地に放出し、そこでスパイクプロテインにアクセスし、アミロイド形成性セグメントに分解することができるだろう[29]。
SARS-CoV-2のスパイクプロテインは、S1およびS2セグメントの接合部にRRARという独特の多塩基酸4アミノ酸の挿入物があるが、SARS-CoVではこの挿入物は存在しない。この配列は、好中球エラスターゼのようなプロテアーゼに感受性があるいくつかの切断部位を持つ[30]。
SARS-CoV-2スパイクプロテインによる炎症部位に引き寄せられた好中球が分泌する好中球エラスターゼは、おそらく遭遇したスパイクプロテインを切断してS1セグメントを循環中に放出し、アミロゲン反応を増強させることができると思われる。
好中球エラスターゼ由来のアミロイドは、長い間、アミロイド形成に関係しているとされてきた。アミロイド線維は、好中球からエラスターゼを含む好中球細胞外トラップ(NET)の放出を誘発し、アミロイドを毒性のあるオリゴマーに断片化することができる[31]。
α-シヌクレインはパーキンソン病(PD)の原因因子として確立している。レビー小体型認知症(LBD)は、脳内のα-シヌクレイン沈着を伴う比較的一般的な疾患で、多くの場合PDと類似性を示す[32]。
バイオインフォマティクス研究から生まれた実験的関係は、SARS-CoV-2スパイクプロテインがアミロイド生成タンパク質、特にα-シヌクレインと相互作用し、細胞株でレビー小体型病変を誘導することを示している[33]。また、α-シヌクレインの発現を上昇させることも確認された。著者らは、スパイクプロテインのこれらの特性が、他の研究でも見出されているCOVID-19とPDの関連を説明する基本的なメカニズムである可能性を示唆した[34]。
α-シヌクレインの過剰発現は、有害なアミロイド線維へのミスフォールディングのリスクを増加させる[35]。6番目の年齢の男性のケーススタディでは、SARS-CoV-2感染と同時にCJD症状が発現したことが報告されている。神経症状の急速な進行により、2カ月後に死亡した[36]。著者らは、SARS-CoV-2に対する激しい炎症反応は、神経変性疾患を促進または悪化させるという仮説を立てた。
ある総説では、この症例と、COVID-19に関連する神経疾患または症候群に関する発表された研究文献からいくつかの症例が報告されている[37]。彼らの表 1には、Long-COVIDに関連したアルツハイマー病、てんかん、多発性硬化症、プリオン病、視覚障害などの25例が挙げられている。
–
Luc Montagnier教授は、HIVの研究で最近亡くなったノーベル賞受賞者である。最近発表されたモンタニエの共著論文には、COVID-19ワクチンを接種した直後にCJDの症状が自然に出て重症化した26例が記載されている。26例のうち23例は、mRNAワクチンの2回目の注射から15日以内に症状を呈した。
他の3例はアストラゼネカのDNAベクターワクチンに関連したもので、症状は最初の1カ月以内に出現した。26人のうち、論文執筆時点で20人が死亡し、残りの6人は危篤状態であった。死亡までの平均時間は、注射後5カ月未満であった[38]。
CJDは極めて稀な病気で、通常、生涯で100万人に1人しか発症しない。また、通常、最初の症状が現れてから死亡するまで数年かかる。したがって、これは明らかに極めて珍しいタイプのCJDであり、これらのワクチンの安全性について懸念を抱かせるものである。
まだヒトの臨床研究によって証明されていない仮説ではあるが、この急速に進行するタイプのCJDは、スパイクプロテインとプリオンタンパク質との分子模倣による可能性もある。プリオン様ドメインを含むタンパク質は、プリオン様疾患発症だけでなく、癌やウイルス感染の原因物質として、近年、計算機による解析で盛んに研究されている[39]。
スパイクプロテインにはYQAGSという5残基の配列があり、これはプリオンタンパク質のC末端ドメインにある配列(YQRGS)と1残基だけ異なっている。スパイクプロテインのこの配列は、RBD内のB細胞エピトープの末端に位置している。
この配列に対する抗体は、分子模倣によりプリオンタンパク質のC-末端に結合する可能性がある。球状C末端ドメインの自己抗体がプリオンタンパク質の小胞体への輸送を阻害することにより、攻撃型のCJDを引き起こすことが研究で示されている[40]。
AI Chatbot:
分子模倣(ぶんしもう、molecular mimicry)は、免疫学や生化学において、異なる分子が類似の構造を持つため、一方の分子を認識する抗体や細胞が他方の分子も認識してしまい、異物を攻撃してしまう現象を指す。通常、この現象は自己免疫疾患の発症に関与しているとされている。例えば、リウマチ性関節炎では、自己抗体が自分自身の結合組織を攻撃することで発症する。また、ウイルス感染などで生じた抗体が、人体内に存在する正常なタンパク質を攻撃することもあるとされている。
mRNAワクチンの生体内分布
1979年の時点で、スクレイピープリオンをマウスに投与すると、腹腔内投与、静脈内投与、多回皮下投与にかかわらず、常に同じパターンの感染拡大が見られることが認識されていた。脾臓での伝播は、脊髄への顕著な広がりのかなり前に一貫して現れ、脳での感染性は最も長い潜伏期を必要とした。結論として、免疫細胞が感染性タンパク質を脾臓に運び、さらに感染性が血管系やリンパ系を介さず、主に神経に沿って伝播することが判明した[41]。
–
神経系で高発現し、他の多くの組織では発現レベルが低いPrPとは異なり、アミロイド前駆体タンパク質(APP)は神経系以外の筋肉、肝臓、免疫系(胸腺、脾臓)、その他多くの臓器で高発現する[42,43]。
–
注射後のワクチンからのmRNAの生体内分布を調べる研究は、わずか数件しか行われていない。2017年に発表された研究では、マウスの筋肉に注射した後のインフルエンザヘマグルチニンタンパク質をコードするmRNAの分布を追跡している。彼らは、さまざまな臓器で見つかったmRNAの最大レベルを定量化し、これらのデータを使用してmRNAの移動経路を推測した。
予想通り、圧倒的に高い濃度は筋肉にとどまっていた(5,680 ng/mL)。しかし、近位リンパ節ではかなりの量(2,120ng/mL)が検出され、遠位リンパ節ではかなり少量(177.0ng/mL)であった。臓器の中では、脾臓と肝臓の濃度が圧倒的に高かった(脾臓で86.9 ng/mL、肝臓で47.2 ng/mL)。血漿 (5.47 ng/mL), 骨髄 (3.35 ng/mL), 回腸 (3.54 ng/mL), 精巣 2.37 ng/mLと少量で、脳 (0.429 ng/mL)を含む他の多くの臓器で微量だった[44]。
–
別の研究では、ラットに筋肉内投与された狂犬病mRNAワクチンの生体内分布経路を追跡した。彼らは、mRNAが1日以内に排出リンパ節に現れ、血液、肺、脾臓、肝臓にも存在することを発見した[45]。T細胞の活性化とB細胞による抗体産生は、主にリンパ節と脾臓の胚中心で起こるため、この技術の開発者は、mRNAがリンパ系と脾臓に現れることを喜んでいる[46]。
–
私たちは、これらが動物ベースの生体内分布試験であることを認識し、認識している。そのため、ヒトへの関連性は推測に過ぎない。しかし、これらの研究は、ヒトでの生物学的分布に何らかの関連性があることを期待して実施されている。このテーマを明確にするヒトでの研究がない場合、ヒトでの生体内分布に類似している可能性のある利用可能な最良の証拠として、生体内試験研究を含めることにする。
エクソソームとマイクロRNA
エクソソームは、30-150nmの大きさの膜状の分泌ナノ小胞で、すべての細胞によって生成・放出され、しばしばストレス条件下でも生成される。この細胞外小胞は、エンドソーム膜の内方への出芽により後期エンドソームで生成される。核酸、タンパク質、脂質、代謝物など多様な物質を内包している。核酸、タンパク質、脂質、代謝物など多様で、シグナル分子、栄養物、毒素などを内容物として、近接・遠距離の細胞間情報伝達を担っている。特に、脂質膜は、内在化したRNA分子を細胞外のリボヌクレアーゼによる分解から保護することができる。
2021年にWei Hらによって発表された論文は、タンパク質、RNA、およびその他の分子をエクソソームに分類し、他の細胞に輸送することを制御する複雑なメカニズムに関する優れたレビューを提供している[47]。
mRNAワクチンでナノ粒子からmRNAを取り込んだ細胞が、mRNAの一部を、イオン化できる陽イオン性脂質とともに小さな脂質粒子に包み、エクソソームとして外部の媒体に放出することが実験によって示された。実際、著者らは、放出されたエクソソームにおいて、カチオン性脂質分子とヌクレオチドの比率が1対1であることを見いだした[48]。
彼らはまた、エクソソームを取り込んだ細胞が、エクソソームに含まれるmRNAからタンパク質を合成できることを実証した。この実験は、ヒトエリスロポエチンをコードするmRNAを対象としていたが、COVID-19ワクチンのスパイクをコードするmRNAについても、同様の結果が期待できる。
理論的には、脾臓の免疫細胞がスパイクプロテインをコードする無傷のmRNAを迷走神経に沿って脳まで運び、脳のニューロンやミクログリア細胞がそのmRNAを取り込んでスパイクプロテインの合成を始めることができるということである。
さらに、腸内でミスフォールドしたαシヌクレインが迷走神経を介して脳に届けられ、PDを引き起こすことが、2019年に発表されたマウス研究で劇的に示された。迷走神経切断は、腸から脳への伝達からマウスを完全に保護した[49]。
米国ワクチン有害事象報告システム(VAERS)は、米国政府によって維持されている全国ワクチン安全性監視プログラムで、医療従事者や患者は同様に、自分が受けたあらゆるワクチンに関連すると考えられる副作用の事例を提出することができる[50]。
VAERSのデータ分析では、迷走神経および/またはそれが接続する頭部の主要な神経の炎症に関連する可能性のある症状を記載した様々な有害事象の2021年における件数を集計している。これらの症状には、無嗅覚症(嗅覚障害)、耳鳴り、難聴、顔面神経麻痺、めまい、片頭痛、発声障害、嚥下障害、吐き気、嘔吐、呼吸困難、失神、徐脈が含まれていた。2021年にCOVID-19ワクチンに関連したこれらの症状を持つ症例が20万件以上あり、その年にこれらの症状に関連したあらゆるワクチンの症例の97.2%に相当する[17]。
VAERSからの証拠は、これらの症状に関連して迷走神経に炎症があることを証明するものではないが、そのような炎症は、観察された症状の説得力のあるもっともらしい説明である。エクソソームが脳内のアミロイド生成タンパク質の伝播に重要な役割を果たすという証拠もある。
ヒトのプリオンタンパク質であるPrPは、正常型(PrPC)とミスフォールド型(PrPSC)の両方でエクソソームと結合していることが確認されている。さらに、PrPSCを含むエクソソームには感染性がある[51]。
エクソソームは、アルツハイマー病に関連する2つのタンパク質であるアミロイドβとリン酸化タウの両方を輸送することができる。アルツハイマー病に関連するAβプラークは、エクソソームタンパク質に富んでおり、エクソソームが元凶であることが示唆されている[52]。
タウオパチーのマウスモデルにおいて、エクソソーム合成を阻害する技術は、タウの伝播を停止させることが判明している[53]。タウタンパク質は、AD患者の脳内のプラークにおいてミスフォールドしたAβと共凝集しており、このことは、エクソソームのエンドサイトーシスを介して誘導される毒性の一般原理が存在する可能性を示唆している[54]。
最後に、タウ凝集を起こした細胞から特異的に得られたエクソソームは、レシピエント細胞において可溶性タウを播種し腐敗させることができる[55]。
エクソソームにしばしば含まれる分子の一種にマイクロRNA(miRNA)がある。miRNAは約22塩基の小さな一本鎖の非コードRNA分子で、動物、植物、ウイルスなどの複数の系統にわたって見出されている。通常、タンパク質をコードするmRNA分子の3’および5’(5’キャップ付近)非翻訳領域(3’、5’UTR)に結合することにより、特定のタンパク質に対する遺伝子の発現を抑制する能力を通じて、重要な制御的役割を果たす[56,57]。
抗原提示樹状細胞(DC)とT細胞のいずれも、エクソソームmiRNAを分泌し取り込むことが可能だ。そのため、エクソソームを、これらの必須制御RNAを他のカーゴと関連させて異なる細胞種間で移送する細胞間コミュニケーション機構として捉えることが適切である[58]。
ここでの議論に重要なのは、miR-155とmiR-146aという2つのmiRNAである。どちらもエンドトキシンに曝された免疫細胞から放出されるエクソソームに存在することが分かっている[58]。両者はまた、COVID-19との関連で発現レベルが変化するmiRNAの短いリストに挙げられている[59]。
–
胚中心での抗原提示後の抗体産生過程において、エクソソームがT細胞とB細胞の細胞間コミュニケーションに必須の役割を果たすことが実験的に明らかにされている。このエクソソームには3種類の特異的なmiRNA(そのうちの1つはmiR-155)が存在し、適切なB細胞応答を引き出すのに必須であることが同定された。miRNAは、抗体産生プロセスに不可欠なB細胞の生存、増殖、抗体クラススイッチングを促進した[60]。
私たちは以前、特にmiR-155がmRNAワクチンに関連する心筋炎にどのように関与している可能性が高いかを示した[17]。
ここでは、神経変性疾患の誘発におけるmiR-146aの役割について論じることにする。脾臓の免疫細胞から放出されたエクソソームは、迷走神経を伝って脳幹核に到達すると仮定する。エキソソームは、スパイクプロテインだけでなく、タンパク質をコードする無傷のmRNA分子も含む毒性物質を、脳の受容体細胞に送り込む。
miR-146aは、一般的に発現しているmiRNAであり、多くの疾患に関与している。miR-146aは、アルツハイマー病に関連してタウの高リン酸化をもたらすrho-associated, coiled-coil-containing protein kinase 1(ROCK1)を抑制することが示されている[63]。
miR-146aは、ROCK1 mRNAとその3′ UTRに結合してタンパク質への翻訳を抑制している。キナーゼを抑制することがタウのリン酸化を増加させるというのは紛らわしいかもしれないが、ROCK1はタウに直接作用するわけではない。
ROCK1がタンパク質ホスファターゼ・テンシンホモログ(PTEN)をリン酸化すると、PTENが活性化され、タウの脱リン酸化が促進される。つまり、miR-146aによるROCK1の抑制は、PTENの不活性化をもたらし、タウに付着したリン酸塩の蓄積をもたらす。
ROCK1のもう一つの役割は、急性炎症時のマクロファージや好中球の過剰な動員を抑制することであり、miR-146aによるその抑制は、マクロファージや好中球の組織への過剰な浸潤をもたらし、炎症を増大させる[64]。
–
Pogue AIとLukiw WJによる総説では、miRNAは脳に豊富に存在し、多くの加齢性神経疾患の進行に関与していることが示されている。miR-146aは、アルツハイマー病、筋萎縮性側索硬化症(ALS)、黄斑変性症、多発性硬化症、側頭葉てんかん、CJDなどのいくつかの神経変性疾患における炎症性寄与因子として特別視された[61]。
上述のように、miR-146aはエンドトキシンに反応してアップレギュレートされる。スパイクプロテインは、そのfurin切断部位のすぐ上に、黄色ブドウ球菌が産生するエンテロトキシンB(SEB)のセグメントと連続的かつ構造的に類似するスーパー抗原様モチーフである配列を含んでいる[65]。さらに、次のセクションで見るように、エキソソームを受け取ったミクログリアにおいて、スパイクプロテインがmiR-146aをアップレギュレートすることが期待できる直接的なシグナル伝達経路が存在する。
–
以前のレビュー論文で、私たちは、mRNAワクチンの主な効果は、I型インターフェロン(IFN)シグナル伝達を阻害し、潜伏ウイルスや癌の活性化に対する感受性を高めることであると提案した[17]。
この仮説は、スパイクプロテインがインターフェロン制御因子3(IRF3)と相互作用し、IFN-Iの活性化を終了させることを示す試験管内試験臨床分析によって支持されている[66]。気管支肺胞洗浄で得られたマカク肺細胞に関するさらなる試験管内試験の調査は、スパイクがI型インターフェロンの発現を阻害するという仮説の妥当性を補強するものである[67]。
この試験管内試験の証拠に基づいて、私たちは、miR-146aの過剰発現がこのダウンレギュレーションの重要な寄与因子である可能性があることを示唆する。miR-146aは、IRF5、Signal Transducer and Activator of Transcription 1 (STAT1) Interleukin-1 Receptor-Associated Kinase 1 (IRAK-1), and tumor necrosis factor (TNF) receptor-associated factor 6 (TRAF6),などIFNシグナルの必須メディエーターの合成を抑制することによりIFNシグナルを抑制することが示されている[68]。
CD16+単球とtoll-like receptor 4の関係
SARS-CoV-2に感染した患者の30%は、ウイルスが消失した後も衰弱した症状を経験し続ける。この症状は俗に「Long-COVID」と呼ばれ、正式には「Post-acute sequelae of COVID(PASC)」とも呼ばれる。
一般的な症状としては、息切れ、疲労、ブレインフォグ、炎症、凝固異常などがある。PASCに罹患した46人の患者を対象とした研究では、急性感染から15カ月後までのPASC患者において、2つの特定の非典型的単球型、(CD14Lo、CD16+)と(CD14+、CD16+)が著しく増加していることが明らかになった。これらの非典型的単球の統計的に有意な数は、感染後15カ月までSARS-CoV-2 S1タンパク質を含んでいることが判明した[16]。
–
フォローアップのプレプリントヒト研究は、COVID-19のワクチン接種後にPASC様症状を経験した個人を対象としていた。これらの患者のうち6人からCD16+単球が分離され、それらもまたS1とS2の両方の配列と、いくつかの変異型S1ペプチドを含んでいることが確認された[69]。
これらの単球からスパイクプロテインの断片が継続的に放出されることによって、PASCの症状が維持されることが提案された。これらの単球がmRNAをDNAに逆転写し、プラスミドに保存している可能性がある[70]。
レトロトランスポゾンであるlong interspersed nuclear element-1(LINE-1)を発現するヒト細胞は、トランスフェクションによって曝露後6時間以内にスパイクプロテインのmRNAをDNAに逆転写できることが実験的に示されている[71]。
–
すべてのレトロウイルスに存在するGagポリタンパク質は、必須核酸結合タンパク質であり、逆転写と宿主DNAへの統合に向けた重要なステップとして、ビリオンの組み立ての多くの側面を調整する[72]。
2020年に発表された、挑発的なタイトルの論文。”Prion protein PrP nucleic acid binding and mobilization implicates retroelements as the replicative component of transmissible spongiform encephalopathy” は、PrPが核酸結合性抗菌タンパク質で、レトロウイルスGagタンパク質と同様に、LINE-1レトロエレメント由来RNAに結合して逆転写を誘発できると提唱した。さらに、彼らはPrPSCの細胞毒性はLINE-1レトロトランスポジション活性を促進する能力に依存していると主張している[73]。
これはDNAの二本鎖切断と細胞損傷をもたらすが、同様に、PrPSC,そして類似のRNA結合タンパク質であるスパイクプロテイン自体も、LINE-1を介したスパイクプロテインmRNAのDNAへのレトロトランスポジションを促進すると推察される。LINE-1はほとんどの細胞で不活性だが、神経細胞は癌細胞や免疫細胞のようにLINE-1を活発に発現し、特に神経変性疾患と関連している[74,75]。これらのことが持つ潜在的な意味は、深刻である。
–
血液中のフィブリノーゲンは、他のβリッチアミロイドやプリオンと同様に、タンパク質分解(フィブリノリシス)に対して比較的抵抗性のある異常なアミロイド状のフィブリンに凝固することがある。健康なボランティアとCOVID-19患者から血液と血小板の少ない血漿サンプル(PPP)を採取したヒトの研究では、SARS-CoV-2スパイクプロテインは、細胞に取り込まれない場合でも、直接的な方法で血液凝固過多とフィブリノーゲン変化を生じると結論付けられた[76]。
Kell DBらによる論文は、SARS-CoV-2スパイクプロテインがフィブリンと相互作用して、フィブリノイドと呼ばれる異常なアミロイドフィブリン微小塊を形成することができるという証拠を提示した。これらの微小塊は、赤血球の毛細血管への輸送を阻害し、感染した組織への酸素の供給を阻害することができる。彼らは、スパイクプロテインのこの特徴が、PASCの主要な根本的病因である可能性を論じた[77]。
実際、血小板は血液中のプリオンタンパク質の最大の貯蔵庫である。血小板の活性化は、血小板がプリオンタンパク質を放出し、エクソソームの表面にそれを表示するように誘導することが示されている[78]。この病態は、神経変性疾患を引き起こす脳内のタンパク質のミスフォールディングを引き起こすプリオン様タンパク質の能力を著しく彷彿とさせ、その根底にある生物物理学的側面が類似している可能性がある。
アミロイドβに関連した血栓は、異常な構造を持ち、タンパク質分解による分解を受けにくくなっている。アミロイドβはフィブリノゲンと相互作用し、フィブリノゲンと結合することでオリゴマー化が促進される[79]。この論文の著者らは、アミロイドβのこうした性質が、アルツハイマー病に伴う血管異常の重要な一因となる可能性を論じている。
–
血液単球は、toll-like receptor 4 (TLR4) 経路を通じて、グラム陰性菌が産生するエンドトキシンを認識する[80]。TLR4経路は、骨髄分化因子88(MyD88)を介して、TNF-αとインターロイキン-1β(Il-1β)のmRNAとタンパク質レベルの両方をアップレギュレートすることによって、炎症反応を誘導する[81]。
ブドウ球菌の超抗原であるエンテロトキシンB(SEB)は、TNF-αの強力な誘導物質であり、(CD14Lo、CD16+)単球の大膨張を刺激する。全血培養にリコンビナントTNF-αを添加すると、(CD14Lo, CD16+)単球集団が全単球プールの35%まで拡大した[82]。注目すべきは、SARS-CoV-2のスパイクプロテインには、フーリン切断部位のすぐ上にSEBに酷似した配列があることである。この配列は、オリジナルのSARS-CoVには存在しない[65]。
–
SARS-CoV-2のスパイクプロテインがTLR4に結合し、活性化することが、慎重に行われた実験により確信を持って証明された。スパイク3量体はTLR4受容体に約300nMの親和性で直接結合し、これは多くのウイルスと受容体の相互作用の結合強度に匹敵するものである。
さらに、スパイクプロテインは炎症物質であるIl-1βを強力に誘導し、この誘導はTLR4阻害剤を加えると失われる[83]。SEBに類似したセグメントがTLR4の活性化に関与していることが考えられる。
–
米国カリフォルニア州ボルダーの研究チームは、スパイクプロテインのS1サブユニットに着目し、S1セグメントを成体オスSprague-Dawleyラットのcisterna magnaに注入すると、行動障害、ミクログリア活性化、神経炎症反応が起こることを明らかにした。
彼らは、S1が病原体関連分子パターン(PAMP)を介してシグナルを発することを突き止め、トランスジェニックTLR4ヒト胚性腎臓(HEK)-293細胞を用いた試験管内試験実験により、S1がTLR4受容体に結合してTNF-αや他の炎症性サイトカインのアップレギュレーションを誘導することを示した[84](PAMP:pathogen-associated molecular pattern)。
–
PDにおけるTLR4の役割を支持する証拠が増えてきている[85]。TLR4の発現は、炎症性サイトカインIL-1βのアップレギュレーションとともに、PDに関連して黒質で高値を示す[86]。また、パーキンソン病患者では、循環単球やB細胞におけるTLR4の発現が亢進している[87]。
–
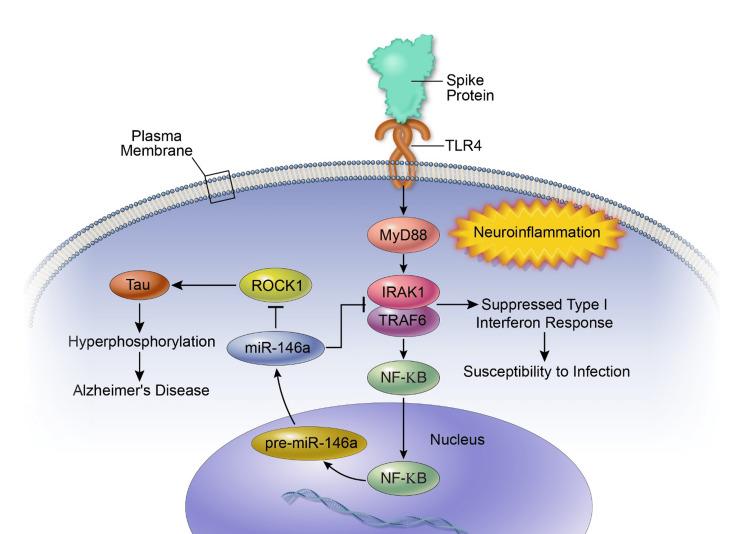
図1は、スパイクプロテインによるTLR4シグナル応答の活性化と神経細胞におけるmiR-146aのアップレギュレーションに関与する経路の案を模式的に示したものである。
図1
スパイクプロテインが神経細胞のTLR4受容体に結合し、NF-kBシグナル応答を刺激して、miR-146aのアップレギュレーションとその後の後遺症を引き起こす経路と結果の模式図。出典[55,56,58,70,72,73]。
重度のCOVIDの症状は、敗血症と多くの特徴を共有している[88]。CD16+単球サブセットは、敗血症患者で拡大し、CD16+単球の炎症反応の調節異常は、敗血症に関連している[80]。敗血症患者は、血中のCD16+単球のレベルが上昇しており、これは炎症性ケモカインIl-6の上昇と関連している[89]。
–
(CD14+, CD16+)単球は、他の単球に比べて炎症性サイトカインの発現量が多く、抗原提示能が高いことが認識されている。そのため、感染症や炎症において重要な役割を担っている[90]。
AIDS認知症患者を対象とした研究では、(CD14+, CD16+)細胞が血液中の単球の非常に高い割合(平均37%)を占めていることが明らかになった。これらの細胞は、「脳に入り込み、神経細胞を毒性因子にさらすかもしれない」と指摘している。[91]。Prabhu VMらによる関連する調査研究(2019)は、単球サブタイプレベル(すなわち、単球の調節異常)が長期非進行者(LTNP)HIV活性化で観察されるものと一致することを示す、確固たる説得力のある結果を提供している[92]。
これらの患者のCD4数は正常範囲内だが、全身性炎症が長引き、非T細胞相関性のウイルス血症のリスクが高い傾向がある。より正確には、本研究における単球の非クラシックなCD14+, CD16+の拡大は、LTNP HIV陽性患者で観察されるものと緊密に相関していた。
これらの患者では、単球上のM2表現型に特徴的なマンノース受容体CD206の非常に高い発現と、T細胞の活性化の増加が、ウイルス量の増加に対応していることがわかった。このように、LTNP HIV患者における非典型的な単球のサブタイプは、慢性的なT細胞炎症反応によって特徴づけられる。
–
さらに、異常に高いレベルの(CD14+、CD16+)単球は、サルコイドーシスや神経原性炎症と関連する複雑局所疼痛症候群とも関連している[93,94]。
サルコイドーシスは、肉芽腫の形成を特徴とする慢性炎症の疾患である。サルコイドーシスでは、単球および単球由来の細胞が健常対照者と比較して増加する。さらに、サルコイドーシス患者におけるTNF発現の増加は、複数の患者の多数の気管支肺胞洗浄(BAL)サンプルに単球が多く含まれていることから、存在する単球に起因していると考えられる。したがって、サルコイドーシス患者の臨床的重症度は、存在する単球の数と密接に関連している[95]。
しかしながら、2020年のFraser SDらによる別の研究調査では、サルコイドーシスにおける非古典的な単球のタイプが拡大し、それらは調節受容体の非常に低い発現によって特徴付けられると結論づけている[96]。
–
私たちは、これらの細胞事象と炎症や特定の病態の臨床症状との間の関連は、試験管内試験や生体内試験のデータをヒト被験者の組織学的所見に結びつける推論の連鎖に依存していると認識している。しかしながら、これらの潜在的な関連性を検討することは重要であり、より厳密な調査が必要であると考えている。
スパイクプロテインとPrPの相互作用の可能性
エイズウイルスであるHIVは中枢神経系に侵入し、認知障害につながる神経炎症を引き起こす。2017年に発表された研究では、HIVによって誘導されたTNF-αの発現が、脳のアストロサイトからPrPを脱落させることが実証された。認知機能に問題のあるAIDS患者の脳脊髄液中のPrPのレベルは、認知機能に問題のないAIDS患者のレベルと比較して上昇していた[97]。
–
スパイクプロテインのS2セグメントは、ウイルス膜と細胞膜の膜融合を担っている。S2タンパク質とHIV-1のgp41タンパク質の立体構造を調べたところ、この2つのタンパク質は同じ2つのαヘリックスを持ち、類似の膜融合メカニズムをとる可能性があることが明らかになった[98]。
–
スパイクプロテインが急激なTNF-αの発現上昇を誘導し、認知障害を引き起こすということは、HIVと同様に脳内のPrP発現も上昇させる可能性を示唆している。最近、私たちのチームは、ネズミのミクログリアやヒトの単球やマクロファージにおいて、スパイクプロテインの相互作用によりPrPCの発現が誘導されることを明らかにした[38]。
本研究では、スパイクプロテインによるtoll-like receptorの活性化に従って、βアミロイド代謝を介したp53の発現促進を介して、プリオンタンパク質の正常アイソフォームとβアミロイドの発現が共にアップレギュレートされると予測される。PrPC数の増加は、プリオンのコンフォメーションミスフォールディングを引き起こし、プリオンとプリオン関連疾患を発生させる[99,100]。
–
プリオンタンパク質の主な機能は不明だが、神経細胞のストレス条件下では保護的であることが示されている。脳卒中患者の血漿中ではPrPの発現が増加しており、神経細胞をアポトーシスから保護する[101]。また、PrPは酸化ストレス条件下で細胞を老化から保護するという証拠もある。硫酸銅とのインキュベーションにより培養した線維芽細胞の老化を誘導すると、PrP mRNAレベルの増加、PrPタンパク質量の増加、PrPの核局在化が見られた。
PrPの発現をsmall interfering RNAでノックダウンすると、老化のマーカーが増加した。これらの知見から、PrPは酸化ストレス条件下で発現が上昇し、老化の変質を遅らせる抗酸化剤として役立つという結論に至った[102]。
–
スパイクプロテインは、トランスフェクトされた細胞において、老化を誘導することが実験的に示されている[103]。さらに、mRNAワクチンは、主にその脂質含有量に起因して、曝露された免疫細胞のシンシチアを形成することにより、早期の老化を誘導することが提案されている[104]。
ワクチンには、イオン化可能な脂質、コレステロール、リン脂質である1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC)が含まれており、これらは全てシンシチア形成に寄与する可能性があるのである。DSPCはホスファチジルセリン(PS)の模倣物質であり、外部化したPSがシンシチアの形成を促進することがよく知られている[105]。
マウスモデルでは、老化した免疫細胞がマウスの全身的な老化を促進することが証明されており、おそらくヒトでもそうであろう[106]。
–
In vitroの分子生物学的研究により、高分子の混雑がネイティブPrPの神経毒性可溶性βオリゴマー構成への変換を促進することが示されている[107]。トランスフェクションした免疫細胞においてmRNAからスパイクプロテインが急速に生成されると、ストレス条件によりPrP合成がアップレギュレートすると同時に、混雑環境が引き起こされると考えることができる。これはPrPSC分子の形成に理想的な環境であり、脾臓などのトランスフェクトされた免疫細胞からエクソソーム内に放出されるのだろう。
PrPCから感染性PrPSC分子への変換は、PrPSCが存在しない場合には極めて遅いプロセスである。しかし、中間体PrPの影響下では、PrPSCは鋳型援助モデルによって強固で不可逆的なアミロイド生成を誘導することができる。
また、PrPSCが存在し、PrPCと相互作用する別のモデルでは、アミロイド生成への進行は速く、可逆的であり(核重合モデル)、神経毒性を確立することができる[99,100]。
–
図22は、三角筋への注射から始まる、神経変性に至る可能性の高い一連の流れを模式的に示したものである。
図2
三角筋にmRNAを注入し、最終的に脳の神経変性に至る後遺症の模式図。
–
APCs。抗原提示細胞;LNPs:脂質ナノ粒子、CJD: クロイツフェルト・ヤコブ病、ALS:筋萎縮性側索硬化症、AD:アルツハイマー病;PD:パーキンソン病。
Hsp70の役割と糖尿病
ヒトにおける複数の研究から、糖尿病および/または肥満を患っている人は、COVID-19による重篤な転帰のリスクが高いことが示されている[108,109]。
この観察に対する一つの可能な説明は、これらの条件が、通常炎症反応の解消につながる発熱に対する自然な反応である熱ショック反応(HSR)を乱すということである[110–112]。実際、高リスクのCOVID-19患者では、抗炎症性HSRが抑制されている[113]。
熱ショック伝達因子1(HSF1)は、熱ショックタンパク質の発現を制御する主要な転写因子である。Il-6とIl-1βの活性を抑制し、炎症反応をおさえる[114]。組織損傷や生命を脅かす多臓器不全を引き起こすのは、しばしば過剰な免疫系による過剰なサイトカイン産生である[115]。

–
通常、HSRは、Hsp72およびHspa1aとしても知られる誘導性熱ショックタンパク質70(Hsp70)、代謝および制御プロセスにおける多くの複雑な役割を持つ分子シャペロンの発現を誘導する。熱ショックタンパク質は、HSRによる活性化後の細胞において、全タンパク質量の最大2%を占めることがある[116]。
Hsp70/72は、タンパク質のフォールディングプロセスにおいて他の多くのタンパク質と相互作用してフォールディングを促進し、タンパク質凝集体の形成からの保護を助け、損傷を受けたタンパク質の分解を促進する[117]。
–
ストレス性の刺激は、細胞内熱ショックタンパク質の細胞外環境と循環への放出を誘発することができる。細胞外のHsp70/72は、抗原に対する適応免疫反応を促進する役割を担っている[118]。
また、細胞外のHsp70/72は抗原と結合することができ、その複合体はスカベンジャー受容体を介して抗原提示細胞(APC)に認識される。APCは複合体を取り込み、結合したHsp70/72がプロテアソームに到達するまで抗原を封じ込める。
処理後、抗原はMHCクラスI分子に輸送され、細胞傷害性CD8+T細胞の活性化を引き起こす。Hsp70/72-抗原複合体は、リソソームで処理され、MHCクラスII分子上の抗原由来ペプチドの提示につながり、CD4+ T細胞を活性化することもできる[119,120]。

–
インスリンシグナルの障害は、HSRの誘導能の低下とそれに続く炎症の収束につながる。グリコーゲン合成酵素キナーゼ3(GSK-3)はセリン・スレオニンキナーゼであり、多くの疾患の分子病態生理において重要な役割を担っている。その過剰発現はインスリン抵抗性に関連している[121]。GSK-3はHSF1のDNA結合活性と転写活性の両方を負に制御している[122]。
TNF-α遺伝子のプロモーター領域にはHSF1の結合部位があり、TNF-αの転写を抑制している。したがって、インスリン抵抗性を有する者は、HSF1の発現を誘導する能力が低下しているため、エンドトキシン曝露に対する感受性が上昇する[123]。
–
Hsp70の最も重要な機能の1つは、神経変性疾患から保護することである。研究文献の多くの論文は、Hsp70が適切なフォールディングを促進し、フィブリル形成を遅らせる能力を通じて、様々なタンパク質ミスフォールディング神経疾患からの保護に関連している[124–126]。
試験管内試験の研究からの証拠も非常に明確である。プリオンに慢性的に感染した細胞でHsp70を薬理学的に誘導すると、PrPSCの蓄積が有意に減少した。さらに、Hsp70の遺伝子を欠損したマウスは、野生型マウスと比較してプリオン病の進行が加速された[126]。
–
COVID-19で死亡した患者のヒト死後調査は、SARS-CoV-2スパイクプロテインの主要な標的が脾臓の免疫細胞、特にマクロファージであり、多くの感染細胞がアポトーシスを起こしたことを示した[127]。
アポトーシスした細胞は、健康な細胞よりも多くのエクソソームを放出する[128]。これを確認するためには、試験管内試験および生体内試験での徹底的な調査が必要だが、mRNAワクチン中のmRNAの指示によりスパイクプロテインを絶えず合成している脾臓の胚中心部の免疫細胞は、過剰なタンパク質負荷によりかなりのストレスを受け、スパイクプロテイン断片がアミロイド生成型にミスフォールドする可能性があると予想される。
発熱は、ワクチンに対する非常に一般的な副反応で、HSRの活性化を示している。脾臓の免疫細胞は、HSF1の影響を受けてHsp70をアップレギュレートすると予想される。そして、スパイクに対する適切な抗体反応を引き起こすために必要なスパイクプロテインやmiR-155、miR-146aなどのmiRNAとともに、エクソソームとして放出するのであろう。
–
エクソソームは、プリオンの伝達のための新規かつ効率的な方法である。エクソソーム放出を刺激するとプリオンタンパク質の細胞間移行が増加し、逆にエクソソーム放出を薬理学的に阻害するとプリオン移行効率が低下する[129]。
ワクチン接種を受けた肥満や糖尿病の人は、HSRのインスタンス化能力が低下し、スパイクプロテインを含むエクソソームを取り込んだ細胞はスパイクプロテインのミスフォールディングから守られず、したがってアポトーシスに対してより脆弱になり、悪循環を引き起こすと考えられている。
G4重鎖の潜在的な役割
ワクチンのスパイクプロテインとウイルスによって合成されたタンパク質を比較する際に考慮すべき点は、ワクチン用のmRNAを指定する際の「コドン最適化」ステップに関連している。これは、ほとんどのアミノ酸のヌクレオチドコードが冗長であることを利用したもので、ウイルスが使用するコドンを、タンパク質の組み立てに効率的なものに置き換える作業である。
その結果、最も効率の良いコドンは、平均して他のコドンよりも多くのグアニンを含んでいることがわかった。グアニンヌクレオチドは、ヌクレオチド配列中に豊富に存在すると、「G四重鎖」(G4)という特殊な構造を構成することができる[17](G4)。G4は、あまり理解されていない方法で翻訳を制御する可能性があるため、最近話題になっている[130]。
さらに、ヒトプリオンタンパク質のmRNAには、複数のG4形成モチーフが存在することが明らかになった。G4は、プリオンタンパク質がミスフォールドした状態になるために重要な役割を担っているという仮説が立てられている[131]。
ウイルス版のスパイクプロテインmRNAの元の塩基配列は、4つのG4モチーフを形成する可能性を持っているだけである。一方、ファイザー版は9個、モデルナ版は19個形成する可能性がある[132]。
2014年に発表された論文の著者は、「プリオン蛋白質中のG-四重鎖:プリオン病におけるミッシングリンク?」という適切なタイトルの結論で次のように書いている」PrP mRNAにおけるG4形成モチーフの存在は、PrPCからPrPSCへの初期変換におけるミッシングリンクとなる可能性がある。
PrPCおよびおそらくプリオン様特性を有する他の多くのRNA結合タンパク質の(誤った)折り畳みにmRNA構造がどのように関与しているかを理解することは、CJDおよび関連疾患のより良い治療法の開発にとって最も重要である」[131]。
COVID-19ワクチン接種のリスク/ベネフィット比の再評価
Lancet誌に掲載された研究では、COVID-19ワクチンの有効性を経時的に追跡調査している。その結果、2回接種シリーズの2回目の接種から8カ月が経過すると、免疫機能はワクチン未接種の人のそれよりも低くなることが示された[133]。
ブースターは一時的に高い抗体レベルを回復させることができるが、頻繁なブースターは、無期限に自然免疫機能をさらに低下させ、様々な感染症やがんのリスク上昇につながる可能性がある。さらに、ウイルスの急速な進化により、現在優勢な株のスパイクプロテインに対する抗体の結合力がますます弱くなっている。幸いなことに、現在のオミクロン株は、オリジナルの株よりも毒性が低いようだ。これは、プリオン様ミスフォールディングの可能性が減少した結果かもしれない。
–
私たちは、試験管内試験と生体内試験の研究に大きく依存していることを認識している。しかし、私たちは、これらの研究を、文書化されたヒトの組織学的、病理学的な相関関係や細胞経路、事象とできる限り密接に結びつけている。これらのことを考慮すると、mRNAワクチンのリスク/ベネフィット比は再評価される必要がある。ワクチンを接種するたびに、スパイクプロテインが大量に血中に放出され、アミロイド誘発作用の可能性をさらに進め、将来の神経変性疾患のリスクを増加させる。
BMC誌に掲載された 山本賢二氏のコメントは、医療界に対し、顕在化した疾患や症状に対してワクチンがどのような役割を果たしたかをより適切に評価するために、病院患者に対する最新のワクチン接種日を記録しておくよう促している。
彼はまた、COVID-19による死亡のリスクが最も高い患者以外への継続的なブーストを促進する政策を強く非難している[134]。政府は、ワクチンブースターを繰り返すことがCOVID-19に対処する有効なアプローチであるとする盲目的な政策を再考することが急務である。
結論
私たちは、SARS-CoV-2スパイクプロテインのプリオン様特性に関する広範な文献を検討した。さらに、mRNAワクチンがスパイクプロテインを脳に運ぶことができる経路を特定した。これは、脾臓の胚中心から放出されたエクソソームが迷走神経を経由して起こり、神経変性疾患のリスクを増加させることを示唆するものである。そうなれば、COVID-19ワクチンによって、感受性の高い人の神経変性疾患が発現するまでの期間が短縮されることが予測される。今後、ワクチンの普及が進んでいる国では、人口レベルでの神経変性疾患の発症年齢が低下していくと推測される。
–
特に重要なのは、CD16+単球がワクチン接種後数ヶ月にわたってスパイクプロテインを産生し続けるという証拠で、おそらくmRNAの細胞質での長期間の存在やmRNAのDNAへの逆転写によって産生されるのであろう。ワクチン接種によって誘導された抗体は時間とともに弱まり、COVID-19から十分に保護するためには、抗体レベルを上げるために頻繁なブースターを必要とすることが明らかになっている。
ブースター接種のたびに、将来の神経変性疾患のリスクが高まる。幸い、オミクロン変種感染ではプリオン様能力が大幅に低下しているため、大量接種を中止すれば、今後予想されるプリオン様疾患の増加は安定的に推移する可能性がある。
備考
Cureusに掲載されているコンテンツは、独立した個人または組織による臨床経験および/または研究の結果である。キュアスは、ここに掲載されたデータまたは結論の科学的正確性または信頼性について責任を負うものではない。Cureusに掲載されたすべてのコンテンツは、教育、研究および参考の目的でのみ使用されるものである。
また、Cureusに掲載された記事は、資格を有する医療専門家のアドバイスに代わる適切なものとみなされるべきではない。Cureusに掲載されているコンテンツにより、専門家の医療アドバイスを無視したり、避けたりしないでほしい。
脚注
著者らは、競合する利害関係が存在しないことを宣言している。-