コンテンツ
FLCCCホームページ
https://covid19criticalcare.com/
オリジナル
2022年5月24日
情報開示
この文書は、主に医療従事者がワクチン傷害を受けた患者に対して適切な医療を提供することを支援することを目的としている。患者は、新しい治療を始める前に、常に医療従事者に相談する必要がある。
協力者
このプロトコルは、12名の世界的に著名な医師の専門知識を活用した共同作業によって作成された。Dr. Pierre KoryとDr. Paul Marikは、以下の方々の貢献に感謝している。Keith Berkowitz博士、Flavio Cadegiani博士、Suzanne Gazda博士、Meryl Nass博士、Tina Peers博士、Robin Rose博士、Yusuf (JP) Saleeby博士、Eugene Shippen博士、Mobeen Syed博士、Fred Wagshul博士の貢献に感謝する。
また、私たちの経験を共有してくださった多くのワクチン感染者の方々のフィードバックにも大変感謝している。

定義
コビッドポストワクチン症候群の正式な定義はないが、COVID-19ワクチンの接種と臨床症状の開始または悪化の時間的相関があれば、他の同時原因では説明できない場合、COVID-19ワクチンによる傷害と診断するのに十分である。
第3相および第4相臨床試験が進行中であるため、COVID-19ワクチンの安全性および毒性プロファイルを完全に決定することはできない。生命倫理の観点から、COVID-19ワクチン接種後に新たに発症した、あるいは悪化した徴候、症状、異常の症例は、他に証明されない限り、ワクチンによる損傷と見なされなければならない。
なお、Long-COVID/長期不調組症候群とポストワクチン症候群の症状や特徴には大きな重複がある。しかし、多くの臨床的特徴はポストワクチン症候群に特徴的であるように思われる。最も顕著なのは、ワクチン接種後では重度の神経症状がより一般的になることだ。さらに問題を複雑にするのは、Long-COVIDの患者さんはワクチン接種も受けていることが多く、定義の問題をより難しくしていること
疫学
米国疾病管理センター(CDC)米国国立衛生研究所(NIH)米国食品医薬品局(FDA)世界保健機関(WHO)はワクチン後遺症を認めておらず、この疾患に対する特定のICD分類コードも存在しない。従って、ポストワクチン症候群の正確な有病率は不明である。[1]
しかし 2022年5月16日現在、米国だけでCOVID-19ワクチン接種後の有害事象が815,385件報告されている。また、米国のワクチン有害事象報告システム(VAERS)には、COVID-19接種後に5,309例以上の心筋炎、151,796件の重篤な有害事象、14,613名の死亡が記録されている。なお、VAERSのデータベースは、少なくとも30倍の過少報告によって制限されている[2]。
さらに、公表されている臨床試験データは、ワクチン接種を受けた患者の少なくとも1~1.5%がワクチン接種後に重篤な有害事象を発症することを示唆している。[2,3] COVID-19ワクチンは米国で5億7200万回、世界で110億回接種されているので、世界中で数百万人のワクチン傷害患者がいると考えられ、米国では少なくとも200万人の患者がいると考えられる。
医療界がこの深刻な人道的災害を認識していないため、これらの患者は残念ながら敬遠され、必要かつ当然受けるべき医療を受けられないでいる。さらに、これらの患者さんに関する臨床的、分子的、病理学的データは限られており、この疾患を治療するための情報を得ることはできない。したがって、私たちは、ワクチン傷害患者の管理について、推定される発症メカニズム、および医師と患者自身の臨床観察に基づいてアプローチしている。
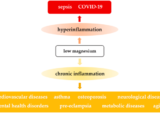
発症メカニズム
スパイク蛋白、特にS1セグメントは、ポストワクチン症候群を引き起こす主要な病因であると思われる。[4,5] S1タンパク質は非常に強い毒性を持っている。複数の病態生理学的プロセスが交差し、重なり合って、ワクチン傷害の広大なスペクトルに寄与していると思われる。[1,6]
- 急性の即時反応(数分から数時間以内)は、急性のIgEを介した過敏性反応の結果であると思われる。I型反応は、mRNA、ポリエチレングリコール [7] またはナノ脂質粒子の他の成分に対してあらかじめ形成された抗体によるものかもしれない
- ワクチン接種後(数時間から48時間以内)に発症する急性心筋炎/心臓突然死症候群は、特に若いスポーツ選手に見られるが、スパイク蛋白による代謝異常に反応して副腎髄質から過剰なカテコールアミンが産生されることによる「ストレス心筋症」によるものと考えられる[8]。[8]
- 亜急性および慢性の心筋炎は、周皮細胞およびマクロファージを介したスパイク蛋白誘発性の炎症反応の結果であると思われる。[9,10]
- 亜急性(数日)および慢性(数週間から数)のワクチン関連傷害は、おそらくS1誘発性炎症反応、自己抗体の産生、凝固カスケードの活性化、および二次的ウイルス再活性化の重複効果から生じている
- 炎症反応は、スパイク蛋白によって誘導される単核細胞の活性化によって、体内のほとんどすべての臓器で起こるが、特に脳、心臓、内分泌器官が関与していると言われている
スパイク蛋白の分子模倣により、多様な自己抗体が産生される。[これらの自己抗体は、ギラン・バレー症候群(GBS)横紋筋炎、免疫性血小板減少症、小繊維神経障害(SFN)/自律神経障害の原因と考えられている。[21-28]
これらの抗体の多くは、Gタンパク質共役型細胞膜受容体に対して指向性を持つ。[抗神経細胞抗体は、無数の神経学的所見に寄与していると考えられる[17,19]。SFN/自律神経障害は、ワクチン接種後の特徴的な障害であり、膨大な数の自己抗体と強く関連しているようである。さらに、自己抗体は、抗リン脂質症候群、全身性エリテマトーデス(SLE)関節リウマチなど、多くの特異的な症候群を引き起こす可能性がある。
スパイク蛋白は高い血栓形成能を持ち、凝固カスケードを直接活性化する。さらに、凝固経路は単核細胞や血小板が産生する炎症性メディエータを介して開始される。[5] 凝固カスケードの活性化は、大きな凝血塊(脳卒中や肺塞栓の原因)と微小凝血塊(多くの臓器、特に脳で微小梗塞の原因)の両方を引き起こす。
新しいデータは、ワクチンがアレルギー性疾患(湿疹、皮膚発疹、喘息、皮膚や目のかゆみ、食物アレルギーなど)を誘発することを示唆している。これは、(B細胞による)抗体クラスの切り替えとIgE抗体の生産を伴う独特の免疫調節障害によるものと思われるマスト細胞活性化症候群(MCAS)と重なる部分があり、両疾患の区別は明確ではない。[29,30] しかしながら、MCASの定義では、同定可能な原因がなく、アレルゲン特異的IgEによるものではなく、マスト細胞の検出可能なクローン性増殖もない。[29]
参考記事


そして最後に、免疫機能の変化により、休眠中のウイルスや細菌性病原体の活性化が起こり、単純ヘルペス、帯状疱疹、エプスタインバーウイルス(EBV)サイトメガロウイルス(CMV)感染の再活性化、ライム病やマイコプラズマの再活性化をもたらすことがある。[31-33]
ワクチン傷害を受けた患者の発症メカニズムの根底にある共通の要因は、「免疫機能不全」である。免疫機能不全の発生と機能不全の重症化は、おそらく以下のような多くの交錯した要因から生じる。
- 遺伝 遺伝学:ワクチン傷害を受けた患者の一親等は、ワクチン傷害のリスクが非常に高いと思われる
- mRNAの負荷と産生されるスパイク蛋白の量 これは、より高濃度のmRNAを含む特定のワクチンロットに関連している可能性がある。[1]
- 性別 ワクチン傷害を受けた患者の約80%が女性であるようだ。さらに、エストロゲンによる治療は、イベント/再発を悪化させたり、促進させたりすることが報告されている。女性は、自己免疫疾患(特にSLE)のリスクが非常に高いことが知られており、このことはこの所見を説明するものと思われる。エストロゲンは、グルココルチコイド受容体のシグナル伝達を妨害する。[34] さらに、エストロゲンは、B細胞およびT細胞の機能を調節する
- 基礎となる栄養状態および併存疾患 ある種の既往症が、ワクチン接種後に免疫系をより反応しやすくしている可能性がある。これには、自己免疫疾患やライム病などの慢性炎症性疾患の既往がある人が含まれる。メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子変異やエーラスダンロス型症候群のある方は、ビタミンB12,ビタミンD、マグネシウムなどの栄養素が不足している場合と同様に、リスクが高くなる可能性がある
治療方法
ポストワクチン症候群の最適な管理には、多くの原則が不可欠だ。
- 重要なことは、ワクチン傷害を受けた患者の管理について詳述した公表された報告がないことだ。したがって、我々の治療法は、想定される病因論、臨床観察、および患者の逸話に基づいている
- ポストワクチン症候群の核となる問題は、慢性的な 「免疫調節障害」である。第一の治療目標は、免疫系を回復させ正常化させること、言い換えれば、体の自然治癒力を高めることだ。私たちは、症状を悪化させる可能性のある免疫抑制剤の使用よりも、免疫系を弱め、正常化するための免疫調整剤の使用や介入を推奨している。しかし、特定の自己免疫疾患を持つ患者さんでは、免疫抑制剤をコントロールしながら使用することが適切な場合がある
- 治療は、各患者の呈する症状や疾患症候群に応じて個別に行う必要がある。すべての患者が同じ治療法に同じように反応するわけではないことから、治療は各患者の特異的反応に応じて個別に行われなければならない。ある特定の介入(例えば、高気圧酸素療法)が、ある患者にとっては救命となり、別の患者にとっては全く効果がないという特異な所見もある
- 患者は自分自身のコントロールとなり、治療に対する反応によって治療計画を修正する必要がある
- 早期治療が重要であり、治療が遅れると、治療効果が減弱する可能性が高い
- 患者は一次治療のプロトコルで開始されるべきであるが、これは患者の特定の臨床的特徴に従って個別化されるべきである。一次治療プロトコルに対する反応から、追加の治療介入の追加または削減を決定する必要がある。二次治療は、主治医の治療に対する反応が不十分な患者、および重度の無力化した患者において開始されるべきである
- ポストワクチン症候群の患者は、いかなる種類のCOVID-19ワクチンもさらに受けてはならない。同様に、Long-COVIDを持つ患者は、すべてのコビッドワクチン接種を避けるべきである
- ポストワクチン症候群の患者は、COVID-19に感染しないようあらゆる努力をすべきである。これには、予防プロトコル(FLCCCプロトコルを参照)が含まれる場合がある。万が一、ウイルスに感染した場合、あるいは感染が疑われる場合には、早期の治療が不可欠である(FLCCCプロトコルを参照)。COVID-19はワクチン傷害の症状を悪化させる可能性がある
- ワクチン傷害を負った患者は、しばしば、自分を助けるかもしれないと信じるあらゆる薬物や介入を試そうと必死になる。残念ながら、無節操な業者がこうした非常に弱い立場にある患者を利用し、高価で証明されていない治療薬を売りつけることがある
- 同様に、患者はしばしば広範な診断テストを受けることになる。これらの検査はほとんど役に立たず、通常は状況を混乱させ、不適切な治療介入につながる。「実験的」「検証されていない」「臨床的に意味のない」診断テストを受けることも多いので、患者はそのようなテストを受けることは避けるべきである。私たちは、いくつかの簡単で基本的なスクリーニング検査を推奨しており、臨床的適応があれば4〜6ヶ月ごとに繰り返し行うべきである。検査は、その結果によって治療方針が変更される場合にのみ行うという原則を忘れないようにしよう
- 高気圧酸素療法(HBOT)は、重度の神経学的損傷の場合、および急速な下降線を示す患者において検討されるべきである(下記参照)
- 非科学的で検証の不十分な「スパイクプロテインデトックス」プログラムは避けるべきである。
ベースライン検査
- CBCとその鑑別、血小板数
- 標準的な血液生化学検査(肝機能検査を含む)
- Dダイマー(凝固活性化のマーカーとして)
- CRP-進行中の炎症のマーカーとして(包括的な広範囲のサイトカイン/ケモカインパネルは不要で、非常に高価であり、その結果が治療法を変えることはない)
- 早朝コルチゾール-一部の患者は自己免疫性副腎不全を発症する)
- TSH-甲状腺疾患の除外
- HbA1C-ワクチンによる傷害を受けた患者は、糖尿病発症のリスクが高い
- トロポニン、プロBNP、ガレクチン-3,ST2-心疾患を除外する
- CMV、EBV、単純ヘルペス、HHV6,マイコプラズマの血清検査/PCR-ウイルス/細菌の再活性化の除外(治療への反応が悪い患者では、ライム(Bb)バルトネラ、バベシアなどのダニ媒介性疾患の検査が有効な場合がある-たとえばhttps://igenetwitter.com/ および https://www.mdlab.com/)
- ビタミンD値(25OHビタミンD)
- アレルギー体質の患者やワクチンに対する急性反応を経験した患者では、以下の検査が有用:好酸球数、IgE値、RAST検査および/または皮膚テスト。
MCASでは、血清トリプターゼ、血清ヒスタミン、24時間尿中N-メチルヒスタミンを考慮する必要がある。[29] - 自己抗体の限定的なスクリーニング 全身性エリテマトーデスアンチコアグラント(B2ミクログロブリンなどが陽性の場合)およびANA。ワクチン傷害患者、特に自律神経機能障害/SFNの患者は、G蛋白結合細胞表面受容体、 [17,19] ACE-2, [35] 神経細胞、ミエリン、および他の自己エピトープに向けられた自己抗体の広範囲な配列を有することが多い。これらの抗体の有無は、これらの患者の管理にはほとんど影響を与えない

1stライン治療法(症状別ではなく、重要性の高い順に記載)
- 毎日の間欠的断食または毎日の定期的断食 断食は、オートファジーを刺激してミスフォールドしたタンパク質や異物タンパク質を除去し、マイトファジーを促進してミトコンドリアの健康を改善し、さらに幹細胞の生産を増加させることによっても、免疫系の恒常性を促進するのに大きな効果がある。[36-42] 断食は、スパイクタンパク質の分解と除去を促進する上で重要な役割を担っている可能性が高い
- イベルメクチン 0.2-0.3mg/kg 毎日、最大4-6週間 イベルメクチンは、強力な抗炎症作用を有する。[43-45]また、スパイク蛋白に結合し、宿主による排除を助ける。[46-48]イベルメクチンと間欠的断食が相乗的に作用して、スパイクタンパク質を体外に排出する可能性が高い。イベルメクチンの試用は、第一選択療法として考慮されるべきである。患者は、i) イベルメクチン反応者と ii) イベルメクチン非反応者の2つのカテゴリーに分類されるようだ。後者は治療が難しく、より積極的な治療が必要であるため、この区別は重要である
- 低用量ナルトレキソン(LDN) LDNは、抗炎症性、鎮痛性、および神経調節性を有することが実証されている。[49,50] 1mg/日から開始し、必要に応じて4.5mg/日まで増量する。完全な効果を得るには、2~3ヵ月かかることがある
- メラトニン:就寝前に2~6mgのスローリリース/エクステンデッドリリース メラトニンは、抗炎症作用および抗酸化作用を有し、ミトコンドリア機能の強力な調節因子である。[51-55] 投与量は、夜間に750mcg(μg)~1mgで開始し、忍容性に従って増量する。代謝の遅い患者は、より高用量で非常に不快で鮮明な夢を見ることがある
- アスピリン(Aspirin)81mg/日
- ビタミンC 1000mgを1日3~4回経口投与 ビタミンCは、I型インターフェロンの合成を増加させるなど、重要な抗炎症、抗酸化、および免疫強化の特性を有する。[56-60] 腎臓結石の既往歴のある患者には避ける。ビタミンCの経口摂取は、マイクロバイオームにおける保護的な細菌集団の増殖を促進するのに役立つ
- ビタミンDとビタミンK2 ビタミンDの投与量は、ベースラインのビタミンDレベルに応じて調整する必要がある。しかし、ビタミンDを4000-5000ユニット/日、ビタミンK2を100mcg/日から開始するのが妥当な量である
- ケルセチン 250-500mg/日(または混合フラボノイド)。フラボノイドは、幅広い抗炎症特性を持ち、マスト細胞を抑制し [61-65] 、神経炎症を軽減することが実証されている。[66] ケルセチンとイベルメクチンとの間の薬物相互作用の可能性(下記参照)により、これらの薬物は同時に服用してはならない(すなわち、朝と夜で時間をずらす必要がある)。ケルセチンの使用は、まれに甲状腺機能低下症に関連している。[67] この関連の臨床的影響は、甲状腺疾患の既往のある個人または不顕性甲状腺症のある個人に限られるかもしれない。ケルセチンは、甲状腺機能低下症の患者では注意して使用されるべきであり、TSHレベルはモニタリングされるべきである
- Nigella Sativa 200-500mgを1日2回 [68-71] チモキノン(Nigella Sativaの有効成分)は、シクロスポリンおよびフェニトインの吸収を低下させることに留意すべきである。したがって、これらの薬剤を服用している患者は、ニゲラサティバの摂取を避けるべきである。[72] さらに、全身麻酔を受けたニゲラサティバ服用患者において、セロトニン症候群が2例報告されている(アヘン剤との相互作用の可能性が高い)。[73]
- プロバイオティクス/プレバイオティクス ポストワクチン症候群の患者は、古典的にビフィズス菌の喪失を伴う重度のディスバイオシスを有する。[ケフィアは、プロバイオティクスを多く含む栄養補助食品として高く推奨されている。[77] 推奨されるプロバイオティクスは、Megasporebiotic(Microbiome labs)およびTrueBifidoPro(US Enzymes)である
- マグネシウム 500mg/日
- オメガ-3脂肪酸 Vascepa、LovazaまたはDHA/EPA 4g/日 オメガ-3脂肪酸は、レゾルビン産生を誘導することにより、炎症の解消に重要な役割を果たす。[78,79]
参考記事

2ndライン治療/補助
重要性の高い順に記載
- ヒドロキシクロロキン(HCQ) 200mgを1日2回、1~2週間投与し、その後、耐容性に応じて200mg/日まで減量する。 ヒドロキシクロロキンは二次治療薬として望ましい。 ヒドロキシクロロキンは強力な免疫調整剤であり、全身性エリテマトーデス(SLE)に対する選択薬と考えられており、この疾患による死亡率を減少させることが実証されている。したがって、自己抗体が陽性である患者や、自己免疫が顕著な基礎的メカニズムであると疑われる患者では、 ヒドロキシクロロキンを早期に検討する必要がある。さらに、SLEとポストワクチン症候群には多くの共通点があることに注意する必要がある。 ヒドロキシクロロキンは妊娠中でも安全である;実際、この薬物は子癇前症の治療に使用されている。[80-84] 長期間の使用では、体重61kg(135ポンド)未満の患者には、投与量を減らすべきである(100または150mg/日)
- ビタミンCの静脈内投与 25gを毎週、ビタミンC 1000mg(1g)を1日2-3回経口投与と併用する。高用量ビタミンCの静脈内投与は 「苛性」であり、2-4時間かけてゆっくりと投与する必要がある。さらに、患者の忍容性を評価するために、初期投与量は7.5~15gとする。1日総投与量8~12gは忍容性が高いが、慢性高用量は腎結石の発生と関連しているので、治療期間を制限する必要がある。[85-90]ビタミンCの静脈内投与は、忍容性に応じて離脱する
- フルボキサミン 12.5mg/日の低用量から開始し、忍容性をみながら徐々に増量する
- ピロロキノリンキノンを用いた「ミトコンドリアエネルギー最適化剤」(例、Life Extension Energy OptimizerまたはATP 360®)。[91-93]
- N-アセチルシステイン(NAC)600~1500mg/日。[94-96]
- スルフォラファン(ブロッコリー抽出物);400 mcg/日。[97-99]
- 低用量コルチコステロイド 10-15mg/日のプレドニゾンを3週間投与。10mg/日、その後、5mg/日に漸減し、忍容性を確認する
- 行動修正、マインドフルネス療法 [100] および心理的支援は、患者の全体的な幸福および精神的健康の改善に役立つ。[101] 自殺は、ワクチン傷害を負った患者における現実の問題である。支援グループと精神保健の専門家との相談が重要である
- 太極拳 太極拳は、中国の伝統的な武術の健康増進のためのものであり、Long-COVIDを含む疾患の予防と治療に有益であることが示されている。[102,103] Long-COVIDは、労作後の激しい疲労および/または症状の悪化を特徴とするため、患者には、労作を控えめにし、耐えられる範囲でゆっくりと増やすよう助言する必要があることに注意すべきである。[104]

参考記事
3rdライン治療
- 高気圧酸素療法(HBOT) [105-113]; HBOTは、強力な抗炎症特性を有し、炎症性サイトカインを減少させ、IL-10を増加させる。さらに、HBOTは、マクロファージをM2表現型に偏光させ、ミトコンドリア機能を改善させる。驚くべきことに、これらの効果を媒介するのは、溶存酸素濃度の上昇よりもむしろ圧力の上昇であるようだ。最適な投与量と投与スケジュールは不明であるが、抗炎症作用を媒介するには1.5から2.0ATMの圧力が必要であると思われる。1.3 ATMを超える圧力は、ハードシェルチャンバーを使用しなければ達成できない。長引くCOVIDとポストワクチン症候群の治療に関する公表データは非常に限られているが、驚くべき救命効果が逸話として報告されている。この治療法は、物流上の問題とコストによって制限されている
参考記事

その他の可能性のある治療法(さらなる評価を要する)
- プラズマフェレーシス プラズマフェレーシスは、重症COVID患者の全身サイトカインレベル、凝固障害、および免疫反応性を改善し、死亡率に効果がある可能性がある。[115-122】Kiprovらは、Long-COVID患者における劇的な臨床的改善の症例報告を発表している。[123] この報告では、患者の炎症性マクロファージのマーカーが減少し、ナチュラルキラー細胞や細胞障害性CD8 T細胞などのリンパ球のマーカーが増加した;さらに、循環炎症性タンパク質が減少した。さらに、プラズマフェレーシスにより自己抗体が除去され、これらの患者さんの凝固障害が改善されたものと思われる。我々は、この治療法で治療されたワクチン傷害患者の神経症状、特にSFNとブレインフォグが著しく改善したという逸話的な報告を知っている。しかし、これは限られた高価な資源であり、それ自体、合併症がないわけではない。さらに、臨床的反応の耐久性を決定する必要がある。血漿交換はワクチン接種後の重篤な神経障害患者に対する治療法の選択肢の一つであるが、この治療法を広く推奨する前にさらなるデータが必要だ
- ペントキシフィリン(PTX) PTX ER、400mgを1日3回、重度の微小循環障害を有する患者に検討する必要がある。PTXは、非選択的ホスホジエステラーゼ薬であり、抗炎症作用と抗酸化作用を有する。[さらに、PTXは、赤血球の変形能を改善し、血液粘度を低下させるため、ワクチン傷害者の凝固障害の発症に関連する高粘度および赤血球の過凝集を緩和することが可能である[124]
- マラビロク 300mgを1日2回経口投与する。6〜8週間経過し、上記の治療にもかかわらず重大な症状が続く場合、この薬剤を検討することができる。注 マラビロクは高価であり、重大な副作用や薬物相互作用の危険性がある。マラビロクは、C-Cケモカイン受容体5型(CCR5)拮抗薬だ。多くのLong-COVID患者およびワクチン接種後の患者がマラビロクで治療されているが、この薬剤の役割はさらに評価される必要がある。[114]
- バルプロ酸 [125,126]; デパコート、250mgを1日2~3回。バルプロ酸は、抗炎症作用を有し、マクロファージをM2表現型に偏光させる。[127] HDAC阻害剤は、神経再生のために研究されている。さらに、バルプロ酸は重要な抗凝固作用および抗血小板作用を有する。[128] バルプロ酸は、神経症状に有用である可能性がある
- シルデナフィルとL-アルギニン L-シトルリンの併用または併用なし [129-134]; シルデナフィルの用量を25から100 mgまで漸増し、1日2-3回、L-アルギニン/L-シトルリン5000 mg粉末を1日2回使用。血栓や灌流不良を伴う微小血管疾患だけでなく、ブレインフォグにも有用である可能性がある。クルクミン、レスベラトロール、EGGG、バルプロ酸はすべて、ホスホジエステラーゼ5(PDE5)阻害剤を増強することが注目されている
- Vedicinals-9® 抗ウイルス、抗炎症、免疫調節、抗熱、鎮痛作用を持つ9つの生物活性化合物からなる、ユニークな植物性医薬品ベースの治療用懸濁液だ。この化合物には、バイカリン、ケルセチン、ルテオリン、ルチン、ヘスペリジン、クルクミン、エピガロカテキンガレート、ピペリン、グリチルリチンが含まれている。(https://www.vedicinals.com/vedicinals-9/)。これらの化合物の多くは、我々のプロトコルに含まれており、この9つの植物医薬品の組み合わせが、より広く利用可能なフラボノイドの組み合わせと比較して、さらなる利益をもたらすかどうかは不明である。[135]
- C60またはC60フラーレン [136,137]; C60は、Carbon 60の略で、60個の炭素原子からなり、中空のサッカーボールのようなものを形成し、「フリーラジカルスポンジ」として考えられている。C60は、これまでに発見された中で最も強力な抗酸化物質と考えられている。この発見により、ロバート・カール、ハロルド・クロート、リチャード・スマレーの3人が1996年にノーベル化学賞を受賞した
- 冷水療法(例:冷水シャワー) [138,139]; 温水/熱水の浴槽は避ける
参考記事

疾患特異的な治療補助剤
小繊維ニューロパチー(SFN)/自律神経ニューロパチー
- 三環系抗うつ薬(低用量から開始し、忍容性に応じて増量する)
- ガバペンチン 300 mg 1日2回、忍容性により増量
- αリポ酸 600mg/日
- 体位性頻脈症候群 – 十分な水分補給を確保し、圧迫ストッキングまたは腹部バインダーの使用を検討する
- 体位性頻脈症候群-クロニジン 0.1mgを1日2回、忍容性に応じて増量する
- 体位性頻脈症候群-フルドロコルチゾン 0.1~0.2mg/日または甘草根(アルドステロン様化合物であるグリチルリチン酸を含有する)
- 体位性頻脈症候群-ミドドリン;5~10mg 1日3回
- 高気圧酸素療法(HBOT)の試行
- 小繊維ニューロパチー/自律神経ニューロパチーの診断は、臨床診断であることに留意する必要がある。[21-28] この診断を下すために、複雑で高価な検査は必要ない。SFNは、複数の自己抗体と密接に関連していることに留意すべきである。これらの自己抗体の検査は、臨床的には何の役にも立たない
全般的な神経症状/傷害/ブレインフォグ/疲労
- LDNは、多くの神経症状の治療に極めて重要な役割を果たすと考えられる
- フルボキサミン 12.5mg/日の低用量から開始し、忍容性をみながら徐々に増量する。フルボキサミンで著明な改善を示す患者もいれば、この薬物に対する忍容性が低い患者もいるようである。フルオキセチン20mg/dayも三環系抗うつ薬と同様に代替薬である
- Nigella Sativa 200-500mgを1日2回
- バルプロ酸およびペントキシフィリンは、これらの患者において価値があるかもしれない
- これらの症状は、マスト細胞活性化症候群(MCAS)が介在している可能性がある;下記の具体的な治療法を参照
参考記事
DICが高値の患者および血栓症の証拠を有する患者
- これらの患者は、NOACまたはクマジンで少なくとも3ヶ月間治療し、その後、抗凝固療法を継続するかどうかを再評価する必要がある
- 出血の危険性が高い場合を除き、ASA 81mg/日を継続すること
- ルンブロキナーゼはプラスミンを活性化し、フィブリンを分解する。例えば、ルンブロキシム(US Enzymes)。[140] ルンブロキナーゼは、消化管からの吸収が良好なようである。[141]
- ターメリック(クルクミン)500mg×2回投与 クルクミンは、抗凝固、抗血小板および線維素溶解の特性を有する。[142]
- 選択された患者では、3重の抗凝固療法を考慮すべきである。[143]1ヵ月を超えない範囲で治療する。三重抗凝固療法は重篤な出血のリスクを増加させる;この合併症に関して患者にカウンセリングを行う必要がある
- 顕著な微小血管疾患/血栓症を有する患者では、ペントキシフィリンとシルデナフィルの併用療法を試行する必要がある。[124,144]

参考記事

ワクチンによる心筋炎/心膜炎
- 心機能の進行性低下を予防/制限するために、ACE阻害剤/ARBと、忍容性に応じてカルベジロールを併用する
- 心膜炎患者におけるコルヒチン-0.6mg/日の経口投与、必要なら0.6mg/日2回に増量。患者が下痢を起こした場合は減量する。白血球数をモニターする。腎機能障害がある場合は、投与量を減らす
- 持続的な胸痛や心イベントの他の徴候や症状が観察された場合は、心臓専門医またはERに紹介する
ヘルペスウイルス再活性化症候群
- L-リジン;1000mgを1日2回投与 [145,146]
- バルトレックス;500~1000mgを1日2回、7~10日間服用する

参考記事
耳鳴り
- ポストワクチン症候群で報告される頻度の高い、身体障害を伴う合併症である。
- 耳鳴りは、対応する外部音響刺激がない場合の音の感覚を指し、したがって、幻聴現象に分類されることがある。耳鳴りの感覚は通常、ブーン、ヒス、またはリングのような未形成の音響的性質である。耳鳴りは、片側または両側に局在することがあるが、頭の中に現れると表現することもできる。[147]
- 理想的には、患者は耳鼻咽喉科専門医または聴覚専門医によって評価され、基礎疾患を除外する必要がある
- この身体障害疾患を管理するために、以下のような多くの治療アプローチが存在する。[147-149]
- 認知行動療法 [150] 。
- 耳鳴り再訓練療法、補聴器、音響療法、聴覚知覚トレーニング、反復経頭蓋磁気刺激などの専門的療法。[147]
- 多くの薬理学的薬剤が、耳鳴りの治療に使用されている。カルバマゼピンを含む抗痙攣薬は、一般に期待はずれである。以下の薬剤は、ある程度の臨床的有用性を示している。
- 三環系抗うつ薬、特にノルトリプチリンとアミトリプチリン。[151,152] さらに、SSRIであるsertralineは、ある程度の効果を示している。[153]
- クロナゼパムおよびその他のベンゾジアゼピン系薬剤。これらの薬物は一時的な緩和をもたらすかもしれないが、依存性の問題のため、長期的な使用は推奨されない。[154]
- メラトニン・スローリリース2~6mg、就寝時。[155]
ベル麻痺/顔面知覚異常、視覚の問題
- 低用量ナルトレキソン 1mg/日から開始し、必要に応じて4.5mg/日まで増量する。完全な効果を得るには2-3ヶ月かかることがある
- 低用量コルチコステロイド 10-15mg/日のプレドニゾンを3週間投与。忍容性に応じて10mg/日、その後5mg/日に漸減する
- 2~3ヶ月間、仕事量、ストレス、軽い運動を減らす
新規発症のアレルギー性疾患患者およびマスト細胞活性化症候群(MCAS)の特徴を有する患者
- 新規フラボノイドであるルテオリンは、強力なマスト細胞阻害剤であることが報告されている。[61,62,64,65] ルテオリン20~100 mg/日の摂取が推奨されている
- ターメリック(クルクミン) 500mg/日。クルクミンは、H1およびH2受容体を遮断し、マスト細胞の脱顆粒を制限することが報告されている。[156,157]
- H1受容体遮断薬 ロラタジン10mg/日、セチリジン5~10mg/日、フェキソフェナジン180mg/日
- H2受容体拮抗薬 ファモチジン20mgを1日2回、忍容性を確認しながら使用する。[158]
- モンテルカスト10mg/日 患者によってはうつ病を引き起こす可能性があるため、注意する。モンテルカストの「マスト細胞安定化剤」としての有効性には疑問が呈されている。[29]
- ビタミンC 1000mgを1日2回。ビタミンCは、アレルギー性疾患およびMCASに強く推奨される。ビタミンCは、免疫細胞の機能を調節し、強力なヒスタミン阻害剤である
- 低ヒスタミン食

参考記事

IVIG治療(免疫グロブリン静注療法)
- 一般に、IVIGによる治療は推奨されない
- 一般的なワクチン傷害患者におけるIVIGへの反応はまちまちで、長期的な改善を示す患者はごくわずかである。最初の改善がみられた患者の多くは、2~3週間後に再発する。また、効果がないと報告する患者もいれば、悪化したように見える患者もいる。非中和抗SARS-CoV-2抗体の存在により、IVIGが抗体依存性免疫増強(ADE)を引き起こし、症状を重篤化させる可能性は否定できない
- しかしながら、IVIGはギラン・バレー症候群、横紋筋炎、免疫性血小板減少症を含む特定の自己免疫症候群において推奨されている。これらの患者さんには、主要な免疫調節療法を併用する必要がある
- 小繊維神経障害の患者を登録したRCTでは、IVIGは有効でないことが証明された。[159]
- 多くの患者がIVIGに初期反応を示すという事実は、この疾患の多くの側面が自己抗体によるものであるという考え方を裏付けるものである。IVIGは、形成された抗体を除去するが、B細胞による継続的な抗体産生を阻止しない;したがって、反応は短期間である可能性が高く、したがって自己抗体の産生を制限する介入(中核免疫調節療法)が必要である
免疫抑制療法
- 原則として、免疫抑制療法は避けるべきである。これらの薬剤はワクチン傷害を受けた患者の免疫機能障害を悪化させ、免疫恒常性の回復を阻害する可能性があるからである
- 免疫抑制療法は、自己免疫症候群が確立し、他の治療法が奏効しなかった患者において適応となることがある
参考文献
- Blaylock RL. COVID Update: What is the truth? Surgical Neurology International 2022; 13.
- Rose J. A report on the U.S. Vaccine Adverse Events Reporting System (VAERS) of the COVID-19 messenger ribonucleic acid 9mRNA) biologicals. Science, Public Health Policy, and Law 2021; 2:59-80.
- Neil M, Fenton N, Smalley J et al. Latest statistics on England mortality data suggest systematic mis-categorisation of vaccine status and uncertain effectiveness of Covid-19 vaccination. Research Gate 2021.
- Colunga Biancatelli RM, Solopov P, Sharlow E et al. The SARS-CoV-2 spike protein subunit 1 induces COVID-19 like acute lung injury in K18-hACE2 transgenic mice and barrier dysfunction in human endothelial cells. Am J Physiol Lung Cell Mol Physiol 2021; 321:L477-L484.
- Marik P, Iglesias J, Varon J et al. A Scoping Review of the pathophysiology of COVID-19. International Journal of Immunopathology and Pharmacology 2021.
- Seneff S, Nigh G, Kyriakopoulos AM et al. Innate immune suppression by SARS-C-V-2 mRNA vaccinations: The role of G-quadruplexes, exosomes and microRNAs. Food & Chemical Toxicology 2022; 164:113008.
- Chen BM, Cheng TL, Roffler SR. Polyethylene glycol immunogenicity: Theorectical, clinical and practical aspects of anti-polyethylene glycol antibodies. ASC Nano 2021; 15:14022-48.
- Cadegiani FA. Catecholamines are the key trigger of mRNA SARS-CoV-2 and mRNA COVID-19 vaccine-induced myocarditis and sudden deahts: a compelling hypothesis supprted by epidemiological, anatomopathological, molecular and physiological findings. medRxiv 2022.
- Schauer J, Buddhe S, Gulhane A et al. Persistent cardiac MRI findings in a cohort of adolescents with post COVID-19 mRNA vaccine myopericarditis. J Pediatr 2022.
- Verma AK, Lavine KJ, Lin CY. Myocarditis after COVID-19 mRNA vaccination. N Engl J Med 2022; 385:1332-34.
- Schiaffino MT, Di Natale M, Garcia-Martinez E et al. Immunoserologic detection and diagnostic relevance of cross-reactive autoantibodies in Coronavirus disease 2019 patients. J Infect Dis 2020; 222:1439-43.
- Trahtemberg U, Fritzler MJ. COVID-19-associated autoimmunity as a feature of acute respiratory failure. Intensive Care Med 2021.
- Woodruff MC, Ramoneli RP, Lee FE et al. Broadly-targeted autoreactivity is common in severe SARS-CoV-2 infection. medRxiv 2020.
- Zuo Y, Estes SK, Ali RA et al. Prothrombotic autoantibodies in the serum from patients hospitalized with COVID-19. Sci Translation Med 2020.
- Pascolini S, Vannini A, Deleonardi G et al. COVID-19 and immunological dysregulation: can autoantibodies be useful? Clin Trans Sci 2021; 14:502-8.
- Wang EY, Mao T, Klein J et al. Diverse functional autoantibodies in patients with COVID-19. Nature 2021; 595:283-88.
- Cabral-Marques O, Halpert G, Schimke LF et al. Autoantibodies targeting GPCRs and RAS-related molecules associated with COVID-19 severity. Nature Communications 2022; 13:1220.
- Arthur JM, Forrest JC, Boehme KW et al. Development of ACE2 autoantibodies after SARS-CoV-2 infection. PloS ONE 2021; 16:e0257016.
- Wallukat G, Hohberger B, Wenzel K et al. Functional autoantibodies against G-protein coupled receptors in patients with persistent Long-Covid-19 symptoms. Journal of Translational Autoimmunity 2021; 4:100100.
- Levine TD, Kafaie J, Zeidman LA et al. Cryptogenic small-fiber neuropathies: Serum autoantibody binding to trisulfated heparin disaccharide and fibroblast growth factor receptor-3. Muscle & Nerve 2020; 61:512-15.
- Oaklander AL, Mills AJ, Kelley M et al. Peripheral neuropathy evaluations of patients with prolonged long COVID. Neurol Neuroimmunol Neuroinflamm 2022; 9:e1146.
- Burakgazi AZ. Small-fiber neuropathy possibly associated with COVID-19. Case Rep Neurol 2022; 14:208-12.
- Shouman K, Vanichkachorn G, Chesire WP et al. Autonomic dysfunction following COVID-19 infection: an early experience. Clinical Autonomic Research 2021; 31:385-94.
- Hinduja A, Moutairou A, Calvet JH. Sudomotor dysfunction in patients recovered from COVID-19. Clinical Neurophysiology 2021; 51:193-96.
- Abdelnour L, Abdalla ME, Babiker S. COVID 19 infection presenting as motor peripheral neuropathy. Journal of the Formosan Medical Association 2020; 119:1119-20.
- Abrams RM, Simpson DM, Navis A et al. Small fiber neuropathy associated with SARS-CoV-2 infection. Muscle & Nerve 2021.
- Zhou L, Shin S. Small fiber neuropathy. Practical Neurology 2021;36.
- Bednarik J, Bursova S, Dusek L et al. Etiology of small-fiber neuropathy. Journal of the Peripheral Nervous System 2009; 14:177-83.
- Theoharides TC, Tsilioni I, Ren H. Recent advances in our understanding of mast cell activation-or should it be mast cell mediator disorders? Expert Rev Clin Immunol 2019; 15:639-56.
- Weinstock LB, Brook JB, Walters AS et al. Mast cell activation symptoms are prevalent in Long-COVID. International Journal of Infectious Diseases 2021; 112:217-26.
- Gold JE, Okyay R, Licht WE et al. Investigation of Long COVID prevalence and its relationship to Epstein-Barr Virus reactivation. Pathogens 2021; 10:763.
- Chen T, Song J, Liu H et al. Positive Epstein-Barr virus detection in coronavirus disease 2019 (COVID-19) patients. Scientific Reports 2021; 11:10902.
- Le Balc’h P, Pinceaux K, Pronier C et al. Herpes simplex virus and cytomegalovirus reactivations among severe COVID-19 patients. Crit Care 2020; 24:530.
- Duma D, Collins JB, Chou JW et al. Sexually dimorphic actions of glucocorticoids provide a link to inflammatory diseases with gender differences in prevalence. Science Signaling 2010; 3:ra74.
- Tomassetti F, Nuccetelli M, Sarubbi S et al. Evaluation of S-RBD and high specificity ACE-2 binding antibodies on SARS-CoV-2 patients after six months from infection. International Immunopharmacology 2021; 99:108013.
- Fung J, Moore J. The complete guide to fasting. Victory Belt Publishing; 2016.
- deCabo R, Mattson MP. Effects of intermittent fasting on health, aging, and disease. N Engl J Med 2019; 381:2541-51.
- Hannan A, Rahman A, Rahman S et al. Intermittent fasting, a possible priming tool for host defense against SARS-CoV-2 infection: Crosstalk among calorie restriction, autophagy and immune response. Immunology Letters 2020; 226:38-45.
- Zhao Y, Jia M, Chen W et al. The neuroprotective effects of intermittent fasting on brain aging and neurodegenerative diseases via regulating mitochondrial function. Free Radical Biology & Medicine 2022; 182:206-18.
- Beckman JA. Thrombolytic therapy for pulmonary embolism. JAMA 2014; 311:2385-86.
- Cheng CW, Adams GB, Perin L et al. Prolonged fasting reduces IGF-1/PKA to promote hematopoietic-stem-cell-based regeneration and reverse immunosppression. Cell Stem Cell 2014; 14:810-823.
- Hine C, Mitchell JR. Saying No to drugs: Fasting protects hematopoietic stem cells from chemotherapy and aging. Cell Stem Cell 2014; 14:704.
- Ci X, Li H, Yu Q et al. Avermectin exerts anti-inflammatory effect by downregulating the nuclear transcription factor kappa-B and mitogen activated protein kinase pathway. Fundamental & Clinical Pharmacology 2009; 23:449-55.
- DiNicolantonio JJ, Barroso-Arranda J, McCarty M. Ivermectin may be a clinically useful anti-inflammatory agent for late-stage COVID-19. Open Heart 2020; 7:e001350.
- Yan S, Ci X, Chen N et al. Anti-inflammatory effects of ivermectin in mouse model of allergic asthma. Inflamm Res 2011; 60:589-96.
- Saha JK, Raihan J. The binding mechanism of ivermectin and levosalbutamol with spike protein of SARS-CoV-2. Research Square 2021.
- Bello M. Elucidation of the inhibitory activity of ivermectin with host nuclear importin alpha and several SARS-CoV-2 targets. Journal of Biomolecular Structure and Dynamics 2021.
- Lehrer S, Rheinstein PH. Ivermectin docks to the SARS-CoV-2 spike receptor-binding domain attached to ACE2. In Vivo 2020; 34:3023-26.
- Younger J, Parkitny L, McLain D. The use of low-dose naltrexone (LDN) as a novel anti-inflammatory treatment for chronic pain. Clin Rheumatol 2014; 33:451-59.
- Toljan K, Vrooman B. Low-dose naltrexone (LDN) – Review of therapeutic utilization. Med Sci 2018; 6:82.
- Molina-Carballo A, Palacios-Lopez R, Jerez-Calero A et al. Protective effect of melatonin administration against SARS-CoV-2 infection: A systematic review. Current Issues in Molecular Biology 2022; 44:31-45.
- Hasan ZT, AlAtrakji MQ, Mehuaiden AK. The effect of melatonin on thrombosis, sepsis and mortality rate in COVID-19 patients. International Journal of Infectious Diseases 2022; 114:79-84.
- Reiter RJ, Sharma R, Ma Q et al. Plasticity of glucose metabolism in activated immune cells: advantages for melatonin inhibition of COVID-19 disease. Melatonin Res 2020; 3:362-79.
- Reiter RR, Sharma R, Castillo R et al. Coronavirus-19,Monocyte/Macrophage glycolysis and inhibition by melatonin. J SARS-CoV2 COVID 2021; 2:29-31.
- Colunga Biancatelli RM, Berrill M, Mohammed YH et al. Melatonin for the treatment of sepsis: the scientific rationale. J Thorac Dis 2020; 12 (Suppl 1):S54-S65.
- Marik PE. Hydrocortisone, Ascorbic Acid and Thiamine (HAT therapy) for the treatment of sepsis. Focus on ascorbic acid. Nutrients 2018; 10:1762.
- Marik PE. Vitamin C for the treatment of sepsis: The scientific rationale. Pharmacol Therapeut 2018; 189:63-70.
- Colunga Biancatelli RM, Berrill M, Marik PE. The antiviral properties of vitamin C. Expert Rev Anti Infect Ther 2020; 18:99-101.
- Miranda-Massari JR, Toro AP, Loh D et al. The effects of vitamin C on the multiple pathological stages of COVID-19. Life 2021; 11:1341.
- Holford P, Carr AC, Zawari M et al. Vitamin C intervention for Critical COVID-19: A pragmatic review of the current level of evidence. Life 2021; 11:1166.
- Theoharides TT, Cholevas C, Polyzoidis K et al. Long-COVID syndrome-associated brain fog and chemofog: Luteolin to the rescue. Biofactors 2021; 47:232-41.
- Theoharides TC. COVID-19, pulmonary mast cells, cytokine storms, and beneficial actions of luteolin. Biofactors 2020; 46:306-8.
- Bawazeer MA, Theoharides TC. IL-33 stimulates human mast cell release of CCL5 and CCL2 via MAPK and NF-kB, inhibited by methoxyluteolin. Eur J Pharmacol 2019; 865:172760.
- Weng Z, Patel AB, Panagiotidou S et al. The novel flavone tetramethoxyluteolin is a potent inhibitor of human mast cells. J Allergy Clin Immunol 2015; 135:1044-52.
- Patel AB, Theoharides TC. Methoxyluteolin inhibits neuropeptide-stimulated proinflammatory mediator release via mTOR activation from human mast cells. J Pharmacol Exp Ther 2017; 361:462-71.
- Calis Z, Mogulkoc R, Baltaci AK. The roles of flavonols/flavonoids in neurodegeneration and neuroinflammation. Mini Rev Med Chem 2020; 20:1475-88.
- Sathyapalan T, Manuchehri AM, Thatcher NJ et al. The effect of soy phytoestrogen supplementation on thyroid status and cardiovascular risk markers in patients with subclinical hypothyroidism: A randomized, double-blind, crossover study. J Clin Endocrinol Metab 2020; 96:1422-49.
- Islam MT, Guha B, Hosen S et al. Nigellalogy: A review on Nigella Sativa. MOJ Bioequiv Availab 2017; 3:00056.
- Barbash IJ, Davis BS, Yabes JG et al. Treatment patterns and clinical outcomes after the introduction of the Medicare Sepsis Performance Measure (SEP-1). Ann Intern Med 2021.
- Ashraf S, Ashraf S, Ashraf M et al. Honey and Nigella sativa against COVID-19 in Pakistan (HNS-COVID-PK): A multi-center placebo-controlled randomized clinical trial. medRxiv 2021.
- Fakhar-e-Alam Kulyar M, Li R, Mehmood K et al. Potential influence of Nagella sativa (Black cumin) in reinforcing immune system: A hope to decelerate the COVID-19 pandemic. Phytomedicine 2021; 85:153277.
- Hannan MA. Black Cumin (Nigella sativa L.): A Comprehensive Review on Phytochemistry, Health Benefits, Molecular Pharmacology, and Safety. Nutrients 2021; 13.
- Warner ME, Naranjo J, Pollard EM et al. Serotonergic medications, herbal supplements, and perioperative serotonin syndrome. Can J Anaesth 2017; 64:940-946.
- Gutierrez-Castrellon P, Gandara-Marti T, Abreu AT et al. Probiotic improves symptomatic and viral clearance in Covid-19 outpatients: a randomized, quadruple-blinded, placebo-conttrolled trial. GUT Microbes 2022; 14:e2018899.
- Zuo T, Wu X, Wen W et al. Gut microbiome alterations in COVID-19. Genomics, Proteomics & Bioinformatics 2021.
- Chen Y, Gu S, Chen Y et al. Six-month follow-up of gut microbiota richness in patients with COVID-19. Gut 2021.
- Rosa DD, Dias MM, Grzeskowiak LM et al. Milk kefir: nutritional, micobiological and health benefits. Nutrition Research Reviews 2017; 30:82-96.
- Lee CR, Zeldin DC. Resolvin infectious inflammation by targeting the host response. N Engl J Med 2015; 373:2183-85.
- Serhan CN. Novel pro-resolving lipid mediators in inflammation are leads for resolution physiology. Nature 2014; 510:92-101.
- Shukla AM, Shukla AW. Expanding horizons for clinical applications of chloroquine, hydroxychloroquine and related structural analogues. Drugs in Context 2019; 8:2019-9-1.
- Plantone D, Koudriavtseva T. Current and future use of chloroquine and hydroxychloroquine in infectious, immune, neoplastic and neurological diseases: A mini review. Clin Drug Invest 2018; 38:653-71.
- Ruiz-Irastorza G, Khamashta MA. Hydroxychloroquine: the cornerstone of lupus therapy. Lupus 2008; 17:271-73.
- de Moreuil C, Alavi Z, Pasquier E. Hydroxychloroquine may be beneficial in preeclampsia and recurrent miscarriage. Br J Clin Pharmac 2020; 86:39-49.
- Siso A, Ramos-Casals M, Bove A et al. Previous antimalarial therapy in patients diagnosed with lupus nephritis: Influence on outcomes and survival. Lupus 2008; 17:281-88.
- Fontana F, Cazzato S, Giovanella S et al. Oxalate nephropathy caused by excessive vitamin C administration in 2 patients with COVID-19. Kidney Int Rep 2020; 5:1815-22.
- Auer BL. Relative hyperoxaluria, crystalluria and haematuria after megadose ingestion of vitamin C. Eur J Clin Invest 1998; 28:695-700.
- Mashour S, Turner JF, Merrell R. Acute renal failure, oxalosis, and vitamin C supplementation: a case report and review of the literature. Chest 2000; 118:561-63.
- McHugh GJ, Graber ML, Freebairn RC. Fatal vitamin C-associated acute renal failure. Anaesth Intensive Care 2008; 36:585-88.
- Lawton JM, Conway LT, Crosson JT et al. Acute oxalate nephropathy after massive ascorbic acid administration. Arch Intern Med 1985; 145:950-951.
- Fletcher RH. The risk of taking ascorbic acid. JAMA Intern Med 2013; 173:388-89.
- Misra HS, rajpurohit YS, Khairnar NP. Pyrroloquinoline-quinone and its versatile roles in biological processes. J Biosci 2012; 37:312-25.
- Akagawa M, Nakano M, Ikemoto K. Recent progress in studies on the health benefits of pyrroloquinoline quinone. Bioscience, Biotenchnology, and Biochemistry 2016; 80:13-22.
- Hamilton D, Jensen GS. Nutraceutical support of mitochoncrial function associated with reduction of long-term fatigue and inflammation. Alternative Therapies in Health & Medicine 2021; 27:8-18.
- Izquierdo JL, Soriano JB, Gonzalez Y et al. Use of N-Acetylcysteine at high doses as an oral treatment for patients with COVID-19. Science Progress 2022; 105.
- Shi Z, Puyo CA. N-Acetylcysteine to combat COVID-19: an evidence review. Therapeutics and Clinical Risk Management 2020; 16:1047-55.
- De Flora S, Balansky R, La Maestra S. Rationale for the use of N-acetylcysteine in both prevention and adjuvant therapy of COVID-19. FASEB J 2020.
- Houghton CA, Fassett RG, Coombes JS. Sulforane: translational research from laboratory bench to clinic. Nutr Rev 2013; 71:709-26.
- Kim JK, Park SU. Current potential health benefits of sulforaphane. EXCLI Journal 2016; 15:571-77.
- Mokhtari RB, Baluch N, Homayouni TS et al. The role of sulforaphane in cancer chemoprevention and health benefits: a mini-review. J Cell Commun Signal 2018; 12:91-101.
- Sanabria-Mazo JP, Montero-Marin J, Feliu-Soler A et al. Mindfulness-based program plus amygdala and inusla retraining (MAIR) for the treatment of women with fibromyalgia: A pilot ramdomized controlled trial. J Clin Med 2020; 9:3246.
- Yong SJ. Long-haul COVID-19: Putative pathophysiology, risk factors, and treatments. medRxiv 2020.
- Shu C, Feng S, Cui Q et al. Impact of Tai Chi on CRP, TNF-alpha and IL-6 in inflammation: a systematic review and meta-analysis. Ann Palliat Med 2021; 10:7468-6478.
- Zhang Z, Ren JG, Guo JL et al. Effects of Tai Chi and Qigong on rehabilitation after COVID-19: a protocl for systematic review and meta-analysis. BMJ Open 2022; 12:e059067.
- Brown JT, Saigal A, Karia N et al. Ongoing exercise intolerance following COVID-19: A magnetic resonance-Augmented Cardiopulmonary excercise Test Study. J Am Heart Assoc 2022; 11:e024207.
- Robbins T, Gonevski M, Clark C et al. Hyperbaric oxygen therapy for the treatment of long COVID: early evaluation of a highly promising intervention. Clinical Medicine 2021; 21:e629-e632.
- Oliaei S, Mehrtak M, Karimi A et al. The effects of hyperbaric oxygen therapy (HBOT) on coronavirus disease-2019 (COVID-19): a systematic review. Eur J Med Res 2021; 26:96.
- Senniappan K, Jeyabalan S, Rangappa P et al. Hyperbaric oxygen therapy: Can it be a novel supportive therap in COVID-19? Indian Journal of Anaesthesia 2020; 64:835-41.
- Kjellberg A, De Maio A, Lindholm P. Can hyperbaric oxygen safely serve as an inti-inflammatory treatment for COVID-19? Medical Hypotheses 2020; 144:110224.
- Hadanny A, Abbott S, Suzin G et al. Effect of hyperbaric oxygen therapy on chronic neurocognitive deficits of post-traumatic brain injury patients: retrospective analysis. BMJ Open 2018; 8:e023387.
- Han CH, Zhang PX, Xu WG et al. Polarization of macrophages in the blood after decompression in mice. 7 2017;240.
- De Maio A, Hightower LE. COVID-19, acute respiratory distress syndrome (ARDS), and hyperbaric oxygen therapy (HBOT): what is the link? Cell Stress & Chaperones 2020; 25:717-20.
- Buras JA, Holt D, Orlow D et al. Hyperbaric oxygen protects from sepsis mortality via an interleukin-10-dependent mechanism. Crit Care Med 2006; 34:2624-29.
- Tezgin D, Giardina C, Perdrizet GA et al. The effect of hyperbaric oxygen on mitochondrial and glycolytic energy metabolism: the caloristasis concept. Cell Stress and Chaperones 2020; 25:667-77.
- Patterson B, Yogendra R, Guevara-Coto J et al. Targeting the monocytic-endothelial-platelet axis with maraviroc and pravastatin as a therapeutic option to treat long COVID/Post-acute sequelae of COVID (PASC). Research Square 2022.
- Jamme M, Mazeraud A. Plasmapheresis efficiency in Coronavirus disease 2019: More related to what you add and not what you take away? Crit Care Med 2021.
- Patidar GK, Land KJ, Vrielink H et al. Understanding the role of therapeutic plasma exchange in COVID-19: preliminary guidance and practices. Vox Sanguinis 2021.
- Hashemian SM, Shafigh N, Afzal G et al. Plasmapheresis reduces cytokine and immune cell levels in COVID-19 patients with acute respiratory distress syndrome (ARDS). Pulmonary 2021; 27:486-92.
- Balagholi S, Dabbaghi R, Eshghi P et al. Potential of therapeutic plasmapharesis in treatment of COVID-19 patients: immunopathogenesis and coagulopathy. Transfusion and Apheresis Science 2020; 59:102993.
- Keith P, Day M, Perkins L et al. A novel treatment approach to the novel coronavirus: an argument for the use of therapeutic plasma exchange for fulminant COVID-19. Crit Care 2020; 24:128.
- Morath C, Weigand MA, Zeier M et al. Plasma exchange in critically ill COVID-19 patients. Crit Care 2020; 24:481.
- Fernandez J, Gratacos-Gines J, Olivas P et al. Plasma exchange: An effective rescue therapy in critically ill patients with Coronavirus Disease 2019 infection. Crit Care Med 2020.
- Gucyetmez B, Atalan HK, Sertdemir I et al. Therapeutic plasma exchange in patients with COVID-19 pneumonia in intensive care unit: a retrospective study. Crit Care 2020; 24:492.
- Kiprov DD, Herskowitz A, Kim D et al. Case report. Therapeutic and immunomodulatory effects of plasmapheresis in long-haul COVID. F1000Research 2022; 10:1189.
- Mostafa-Hedeab G, Al-kuraishy HM, Al-Gareeb AA et al. A raising dawn of pentoxifylline in the management of inflammatory disorders in Covid-19. Inflammopharmacology 2022.
- Pitt B, Sutton NR, Wang Z et al. Potential repurposing of the HDAC inhibitor valproic acid for patients with COVID-19. Eur J Pharmacol 2021; 898:173988.
- Unal G, Turan B, Balcioglu YH. Immunopharmacological management of COVID-19: Potential therapeutic role of valproic acid. Medical Hypotheses 2020; 14:109891.
- Wu C, Li A, Leng Y et al. Histone deacetylase inhibition by sodium valproate regulates polarization of macrophage subsets. DNA and Cell Biology 2012; 31:592-99.
- Larsson P, Alwis I, Niego B et al. Valproic acid selectively increases vascular endothelial tissue – type plasminogen activator production and reduces thrombus formation in the mouse. J Thromb Haemost 2016; 14:2496-508.
- Santamarina MG, Boisier D, Contreras R et al. COVID-19: a hypothesis regarding the ventilation-perfusion mismatch. Crit Care 2020; 24:395.
- Mario L, Roberto M, Marta L et al. Hypothesis of COVID-19 therapy with sildenafil. International Journal of Preventive Medicine 2020; 11:76.
- Santamarina MG, Beddings I, Martinez Lomakin F et al. Sildenafil for treating patients with COVID-19 and perfusion mismatch: a pilot randomized trial. Crit Care 2022; 26:1.
- Kniotek M, Boguska A. Sildenafil can affect innate and adaptive immune system in both experimental animals and patients. Journal of Immunology Research 2017; 2017:4541958.
- Isidori AM, Giannetta E, Pofi R et al. Targeting the NO-cGMP-PDE5 pathoway in COVID-19 infection. The DEDALO project. Andrology 2021; 9:33-38.
- Al-kuraishy HM, Ali-Gareeb AI, Al-Niemi MS et al. COVID-19 and phosphodiesterase enzyme type 5 inhibitors. J Microsc Ultrastruct 2022; 8:141-45.
- Harasstaini OA, Moin S, Tham CL et al. Flavonoid combinations cause synergistic inhibition of proinflammatory mediator secretion form lipopolysaccharide-induced RAW 264.7 cells. Inflammation Research 2010; 59:711-21.
- Marforio TD, Mattioli EJ, Zerbetto F et al. Fullerenes against COVID-19: Repurposing C50 and C70 to clog the active site of SARS-CoV-2 protease. Molecules 2022; 27:1916.
- Hurmach Vv, Platonov MO, Prylutska SV et al. C60 fullerene against SARS-CoV-2 coronavirus: an in silico insight. Scientific Reports 2021; 11:17748.
- Shevchuk N. Adapted cold shower as a potential treatment for depression. Medical Hypotheses 2008; 70:995-1001.
- Mooventhan A, Nivethitha L. Scientific evidence-based effects of hydrotherapy on various systems of the body. North American Journal of Medical Sciences 2014; 6:199-209.
- Wang YH, Li SA, Huang CH et al. Sirt1 activation by post-ischemic treatment with lumbrokinase protects against myocardial ischemia-reperfusion injury. Fronteirs in Pharmacology 2018; 9:636.
- Yan XM, Kim CH, Lee CK et al. Intestinal absorption of fibrinolytic and proteolytic lumbrokinase extracted from earthworm, Eisenia andrei. Korean J Physiol Pharmacol 2010; 14:71-75.
- Keihanian F, Saeidinia A, Bagheri RK et al. Curcumin, hemostasis, thrombosis, and coagulation. J Cell Physiol 2018; 233:4497-511.
- Pretorius E, Venter C, Laubshder G et al. Combined triple treatment of fibrin amyloid microclots and platelet pathology in individuals with long COVID/Post -acute sequelae of COVID-19 (PASC) can resolve their persistent symptoms. Research Square 2021.
- Ng WK, Rosenblatt Y, Brock GB et al. Phosphodiesterase inhibitors in vascular ischemia: A case report and review of their use in ischemic conditions. Can J Plast Surg 2010; 18:e5-e9.
- Griffith RS, Wlash DE, Myrmel KH et al. Sucess of L-Lysine therapy in frequently recurrent Herpes simplex infection. Treatment and prophylaxis. Dermatologica 1987; 175:183-90.
- Griffith RS, Norins AL, Kagan C. A multicentered study of Lysine therapy in Herpes simplex infection. Dermatologica 1978; 156:257-67.
- Langguth B. Treatment of tinnitus. Curr Opin Otolaryngol Head Neck Surg 2015; 23:361-68.
- Langguth B. Pharmacological approaches to the treatment of tinnitus. Drug Discovery Today 2010; 15:300-305.
- Langguth B, Elgoyhen AB, Cederroth CR. Therapeutic approaches to the treatment of tinnitus. Ann Rev Pharmacol Toxicol 2019; 59:291-313.
- MartinezDevesda P, Waddell A, Perera R et al. Cognitive behavioral therapy for tinnitus (Review). Cochrane Database of Syst Rev 2007.
- Sullivan M, Katon W, Russo J et al. A randomized trial of nortriptyline for severe chronic tinnitus effects on depression, disability, and tinnitus symptoms. Arch Intern Med 1993; 153:2251-59.
- Bayar N, Boke B, Turan E et al. Efficacy of amitriptyline in the treatment of subjective tinnitus. Journal of Otolaryngology 2001; 30:300-303.
- Zoger S, Svedlund J, Holgers KM. The effects of sertraline on severe tinnitus suffering – A randomized, double-blind, placebo-controlled study. J Clin Psychopharmacology 2006; 26:32-39.
- Bahmad FM, Venosa AR, Oliveira CA. Benzodiazepines and GABAergics in treating severe disabling tinnitus of predominantly cochlear origin. 12 2006;144.
- Hosseinzadeh A, Kamrava SK, Moore BC et al. Molecular aspects of melatonin treatment in tinnitus: A review. Current Drug Targets 2019; 20:1112-28.
- Jacob A, Wu R, Zhou M et al. Mechanism of the anti-inflammatory effect of Curcumin: PPAR-gamma activation. PPAR Research 2007; 2007:89369.
- Kakavas S, Karayiannis D, Mastora Z. The complex interplay between immunonutrition, mast cells, and histamine signaling in COVID-19. Nutrients 2021; 13:3458.
- Afrin LB, Weinstock LB, Molderings GJ. COVID-19 hyperinflammation and post-Covid-19 illness may be rooted in mast cell activation syndrome. Int J Infect DIs 2020.
- Geerts M, de Greef BT, Sopacua M et al. Intravenous immunoglobulin therapy in patients with painful idiopathic small fiber neuropathy. Neurology 2022; 96:e2534-e2545.

