Contents
Molecular and Therapeutic Aspects of Hyperbaric Oxygen Therapy in Neurological Conditions
オンラインで公開 2020年8月27日
www.verywellhealth.com/hyperbaric-chamber-treatment-4582432
概要
高気圧酸素療法(HBOT)とは、100%の酸素ガスを絶対圧力1気圧以上で封入したチャンバー内に被験者を収容し、その中で治療を行うものである。この治療法は、損傷した組織への酸素の供給を増やすことで、組織の回復を早め、その生理的側面を改善するために用いられる。この総説では、低酸素症の影響と、HBOTにさらされた被験者に起こる分子的・生理的プロセスについて述べる。また、ヒトおよび動物モデルの神経学的疾患および神経発達障害の治療におけるHBOTの有効性についても述べる。最後に、この分野の課題を論じ、科学界がHBOTの分子的側面と多種多様な神経疾患への応用をよりよく理解できるようにするための将来の方向性を探る。
キーワード
高気圧酸素療法、低酸素、神経疾患、神経発達障害、自閉症スペクトラム障害、脳性麻痺、外傷性脳損傷、ミトコンドリア、白質、活性酸素ストレス、血管新生
1. はじめに
1.1. 神経症状における低酸素症
神経細胞やグリア細胞による細胞エネルギーの産生と、脳の代謝の恒常的な維持は、酸素の大量消費に依存している[1]。低酸素とは、ある部位に酸素が十分に供給されない状態であり、脳組織などの特定の組織で発生する場合は局所的低酸素、全身を指す場合は全身的低酸素と呼ばれる[2]。細胞死[3],炎症過程の誘発[4],ミトコンドリア機能の低下[5]など,組織にさまざまな障害を引き起こすことが知られている。
神経細胞の低酸素症は,不可逆的な損傷を引き起こし,電気的なコミュニケーションに支障をきたし[6],グリア細胞,特にオリゴデンドロサイト(オリゴデンドロサイト)に大きな損傷を与える可能性がある[1,7]。発育段階での低酸素状態は、脳の発達に影響を与え、結果として神経発達障害(神経変性疾患)を引き起こす可能性がある[8,9]。発達後も、脳は体全体の酸素消費量の約20%を消費しており、通常の機能を果たすには十分な量でしかない。つまり、脳は受け取ったエネルギーのほぼすべてを消費しているのです[10]。したがって、脳に何らかの損傷や異常が生じた場合、通常の酸素供給が不足する可能性があり、脳損傷の回復には、グルコースレベルなどの他の必須要素に加えて、酸素が制限要因となり、いずれも神経病理学的に重要な要因となる。
低酸素は、外傷性脳損傷(外傷性脳損傷)[11,12]、アルツハイマー病[13]、脳卒中[14,15]、脳性麻痺(脳性麻痺)[16]、多発性硬化症[17]、自閉症スペクトラム障害(自閉症スペクトラム障害)[6]など、さまざまな神経症状で発生し、その症状の一部に関与することが知られている。アルツハイマー病のマウスモデルでは,低酸素が記憶喪失に寄与することが示されており[18],脳卒中などの低酸素事象を経験したヒト被験者は,後年になってアルツハイマー病になりやすいことがわかっている[18]。自閉症スペクトラム障害被験者では、脳血流(脳血流)の減少とともに、低酸素症の証拠が見つかっている[6,19,20]。自閉症スペクトラム障害における低酸素の役割はまだ解明されていないが、van Tilborgら[7]は、出生後の低酸素および胎児期の炎症により、ラットが自閉症スペクトラム障害の典型的な症状である社会的抑制、反復行動および不安様行動の増加、髄鞘障害を示すことを示した[21]。
低酸素症を治療するための選択肢は限られている。ある研究では,低酸素症に罹患したラットの治療にリチウムを長期的に補給することを検討し,治療後にいくつかの脳領域で脳内グルコース代謝率の改善が観察された[22].また,別の研究では,低酸素虚血脳障害モデルマウスにおいて,補体系の一部であるタンパク質C3aの経鼻投与により,認知機能障害が軽減された[23]。しかし,ほとんどすべての既知の治療法にはある程度の侵襲性があり,ヒトではまだ十分に解明されていないものもある。高気圧酸素療法(HBOT)は、非侵襲的な治療法であり、ヒトにおいて様々な症状に広く用いられているが、低酸素関連の症状において治療的および分子的側面を改善することがわかっている[24]。
1.2. HBOT
HBOTでは、被験者は100%の酸素ガスが入ったチャンバーに1気圧以上の圧力で入れられ、主に低酸素症関連の症状に対する治療法として用いられている[24]。治療プロトコルはいくつかあり,病態に応じて異なる。例えば、糖尿病の創傷に対する治療は、通常、2.0〜2.4ATAの圧力で30〜40日間続く[25]。一方、脳卒中の場合、いくつかの研究では、使用された治療は2ヶ月間続き、被験者は2ATAの圧力で週に5日治療を受けた[26,27]。高圧の酸素が豊富な環境を提供することで、HBOTは血漿中の溶存酸素濃度と動脈酸素圧を上昇させ、その結果、低酸素組織への酸素供給を助ける可能性がある[28,29]。
最初の高圧チャンバーは、1662年に英国の医師ナサニエル・ヘンショーによって建設された。現在の高圧チャンバーとは異なり、最初のチャンバーは純酸素ではなく圧縮空気を使用していた [29]。なぜなら、酸素の毒性に関する懸念があったからであるが、後にその懸念は払拭された。伝統的にHBOTは、創傷[30]や感染症の組織回復の促進、心臓外科などの手術の補助[31]、一酸化炭素中毒の緩和[32]、その他の症状の治療に使用されていた。低酸素がいくつかの神経症状における重要な問題として確立されたため、その後、HBOTは神経生物学的特性の文脈で研究され、この総説でさらに議論されるように、生物学的および行動学的な障害を改善することが示された。例えば、外傷性脳損傷では、HBOTは脳血流を改善し[33]、外傷性脳損傷ラットモデルにおける脳内アデノシン三リン酸(ATP)発現量の増加に示されるように、損なわれた脳代謝を回復させ[34]、外傷性脳損傷ラットモデルにおける二次的な細胞死および神経炎症を減少させ[35]、神経可塑性を改善することが明らかになった[36]。さらに、慢性的な認知障害を患う治療を受けた被験者では、記憶および認知機能の改善が認められた[37]し、治療を受けたADマウスモデルでも改善が認められた[28]。最近では、自閉症などのいくつかの神経変性疾患に対してもHBOTが評価されている[6]。これらの疾患における低酸素の役割は十分に理解されていないが、HBOTはこれらの疾患の病理学的側面のいくつかを改善することがわかった。
ここでは、主に3つの神経疾患に焦点を当てて、さまざまな神経疾患に対するHBOTの分子的効果と、その治療的意義について議論する。ここでは、主に自閉症スペクトラム障害、脳性麻痺、外傷性脳損傷の3つの神経疾患に焦点を当て、様々な神経疾患に対するHBOTの分子効果とその治療的意義について議論する。
2. 神経生物学的な観点から見たHBOT
HBOTは、神経疾患に罹患した被験者の中枢神経系(CNS)において、ミトコンドリア機能、白質、神経炎症、酸化ストレス、脳血流の変化など、分子レベルの変化を引き起こすことが観察されている。このセクションでは、神経生物学的な観点からHBOTのメカニズムを議論し、この分野におけるいくつかの最新の研究を紹介する(図1)。
図1 高気圧酸素療法(HBOT)後の脳内の主要な分子変化
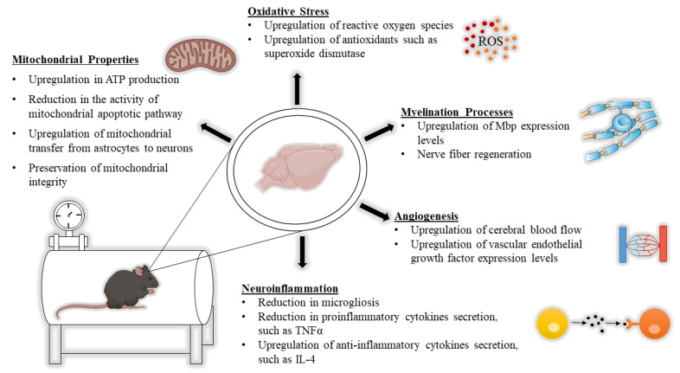
ミトコンドリアの特性、酸化ストレス、髄鞘形成過程、血管新生、神経炎症のすべてがHBOT後に変化する
2.1. HBOTのミトコンドリア特性への影響
ミトコンドリアは重要な細胞小器官であり、ATPを生成して細胞にエネルギーを供給する役割を担っている[38]。また、アポトーシス[39]や増殖[40]などの細胞プロセスを仲介し、シナプス可塑性[41]などの神経細胞の機能にも関与している。
ミトコンドリアは電子伝達系を介してATPを産生するが,その際,酸素は最後の電子受容体として重要な役割を果たす。この過程では、プロトンがミトコンドリアマトリックスから膜間部に送り込まれるため、プロトン勾配が生じる。膜間部のプロトン濃度が高くなると、膜内に電位とプロトンの化学的勾配が生じ、膜電位の維持とATP生産プロセスに不可欠なものとなる。膜の完全性(構造や機能)が損なわれると、細胞内でアポトーシスの経路が開始されることになる。
神経細胞の活動は大量のエネルギーを消費し、神経細胞にはわずかなエネルギーしか蓄えられていないため、神経細胞では、十分に機能しているミトコンドリアが非常に必要とされている[42,43]。加齢とともに増幅するミトコンドリアDNAの変異など、ミトコンドリアの機能障害を引き起こす可能性のある疾患はいくつかあるが[44]、このオルガネラの機能は、酸素消費に大きく依存している。低酸素状態のような酸素レベルの低下は,エネルギー産生にダメージを与え[45],組織内の乳酸の凝集やその他の代謝変化を引き起こす[8]。そのため、ミトコンドリアに到達する酸素量を増加させることで、ミトコンドリア機能障害に関連する神経症状を治療するためにHBOTを使用することを検討した研究がいくつかある。
HBOTは、ミトコンドリア代謝などのミトコンドリア異常の是正を促進し[46]、損なわれたミトコンドリア膜の完全性を改善し[47]、アストロサイトから神経細胞へのミトコンドリアの移動を引き起こすことで二次的な細胞死を抑制することが分かった[48]。治療後のATPレベルの変化に応じてHBOTの影響を測定した研究もある[34,46,49]。例えば、Huら[46]は、中大脳動脈閉塞と高血糖を組み合わせて虚血と出血性変化を誘発した脳卒中モデルのラットを研究した。HBOT後、ATP発現量を酵素結合免疫吸着法(ELISA)で測定した結果、エネルギー代謝の重要なマーカーであるNAD+発現量の増加とともに、ATP発現量が有意に上昇していた。さらに、NAD+の産生制限タンパク質であるニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)活性の上昇や、細胞のアポトーシスに関係するp53や炎症に関係するNF-κBの上流タンパク質であるSirt1の発現量の上昇が確認された(図2)。
図2 ミトコンドリアの特性に対するHBOTの有益な影響
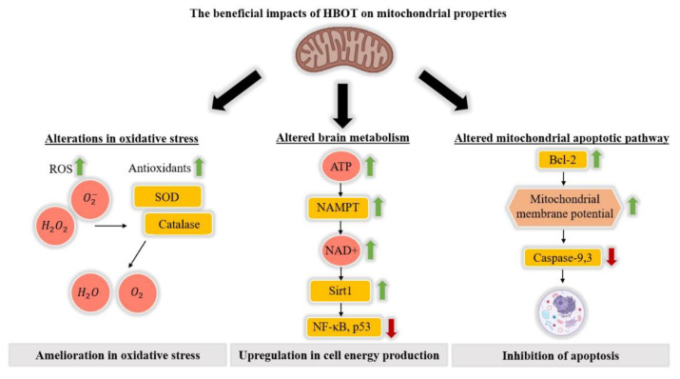
HBOTの影響を受けるミトコンドリアに関連する3つの重要なプロセス-酸化ストレス、細胞エネルギー生産、アポトーシス。
p53とNF-κBの発現が同時に低下したことから、HBOTによってATP/NAD+/Sirt1経路が活性化されたことが明らかになった。さらに、NAD+を投与すると、HBOTと同様の効果が得られ、ATP合成酵素阻害剤、NAMPT阻害剤、Sirt1小干渉RNA(siRNA)を投与すると、HBOTのポジティブな効果が阻害された。HBOTによるこの特異的経路の活性化により、細胞の壊死が減少し、神経機能が改善された[46]。
その他の研究では、ミトコンドリアに対するHBOTの効果の他の側面が検討された。Palzurら [47]は、外傷性脳損傷のラットモデルにおいて、ミトコンドリアの完全性およびミトコンドリアのアポトーシス経路の活性に対するHBOTの効果を調べた。彼らは、片方の半球に病変を形成し、比較のために傷のない半球を用いた。3つの異なるグループを比較して統計分析を行った。HBOT治療を行わず、片方の半球に皮質の動的変形を行った対照群、HBOT治療を行い、1つ目の群と同様の処置を行った群、皮質の動的変形を行わずに手術を行ったシャム群の3つのグループを比較し、統計解析を行った。その結果、ミトコンドリアの膜貫通電位で測定されるミトコンドリアの完全性は、未治療の対照群と比較して治療群では両半球間の膜貫通電位の差が低いことに見られるように、HBOT後に有意に回復した。さらに、ミトコンドリアのアポトーシス経路を介してアポトーシスを仲介することが知られているカスパーゼ-3とカスパーゼ-9の活性は、無処置対照群では有意に低下していたのに対し、処置群では上昇していた。しかし、アポトーシスを開始することが知られているタンパク質であるカスパーゼ-8は、処理群と未処理群の間で活性に大きな差は見られなかった。これらの結果は、アポトーシスを抑制するタンパク質であるBcl-2およびBcl-xLの発現量の増加が外傷性脳損傷ラットモデルのペナンブラでHBOT後に測定されたという先行研究と一致した[50]。さらに、アポトーシス促進タンパク質であるBaxの量には、有意な変化は測定されなかった[50]。これらの研究を総合すると、Bcl-2,カスパーゼ-3,およびカスパーゼ-9がこの特定の経路に関与しているのに対し、カスパーゼ-8はほとんどが外因性アポトーシス経路に関与していることから、HBOTがミトコンドリアの内因性アポトーシス経路に特異的に影響を与えることが強く示されている[51,52] (図2)。
最後に、アストロサイトからニューロンへのミトコンドリア移行に対するHBOTの効果を調べるため、試験管内試験研究が行われた [48]。研究者らは、アストロサイトと共培養したラットの初代ニューロン細胞をHBOTチャンバーに入れた後、腫瘍壊死因子α(TNF-α)またはリポポリサッカライドのいずれかに細胞を曝露して、二次的な細胞死の段階で脳損傷または脳卒中に似た環境を作り出した。彼らは、HBOTを事前に使用することで細胞の生存率が高まり、アストロサイトから神経細胞への高いミトコンドリア移行が誘導されることを観察し、HBOTによって活性化されたミトコンドリア移行が、二次的な細胞死から神経細胞を保護することを示唆した[48]。
今日では、外傷性脳損傷および脳卒中に関連して、ミトコンドリア特性に対するHBOTの効果に焦点を当てた研究が数多く行われている。ミトコンドリア障害は自閉症スペクトラム障害などの神経変性疾患にも共通する現象であるため [53,54]、今後の研究の方向性としては、これらの障害に対するHBOTの有効性も検討することが自然であろう。
2.2. 白質の変化に対するHBOTの影響
ミエリンは、神経細胞を包む外側の層である [55]。ミエリンは主に脂質で構成されており、中枢神経系のオリゴデンドロサイトによって生成される [56]。ミエリンは、軸索を通過する電気情報を分離するという重要な役割を果たしており、これはニューロンの接続に不可欠である[55,57]。この分離層は、神経細胞間の情報伝達を適切に行う上で重要であり、ミエリン化の欠損を伴う神経疾患がその証左である[58,59,60,61,62,63]。
多くの研究から、低酸素症と髄鞘形成不全の関連性が示唆されている[7,64,65]。Backらは、後期オリゴデンドロサイト前駆体が酸素不足に特に敏感であることを発見し、そのことが高い細胞死に反映されている[65]。したがって、低酸素状態では、成熟した髄鞘形成オリゴデンドロサイトに分化する細胞の数が減少する可能性がある。Creeら[60]は、低酸素症の損傷マウスにクレマスチンという薬物を投与すると、髄鞘形成オリゴデンドロサイトの数が増加し、ミエリンの超微細構造が改善されたと述べている。これらの知見を総合すると、HBOTは低酸素症による白質の損傷を改善することができ、白質の欠損および低酸素症に関連する神経疾患の症状の一部を緩和できる可能性が示唆される。
ある研究では、外傷性脳損傷後によく見られる一連の症状である打撲後症候群を有するヒト外傷性脳損傷被験者の神経線維再生に対するHBOTの効果が調査された[66]。この効果は、生きている人間の被験者の白質の変化を評価できる磁気共鳴画像(MRI)技術である拡散テンソル画像(DTI) [67] を用いて観察された。その結果,臨床症状の大幅な改善とともに,脳梁,内包,中脳などの多様な脳領域において,ボクセルの拡散の異方性の度合いを表す値である分画異方性の増加が観察された。また,前頭葉の白質を中心に,ボクセル内の全拡散を示す平均拡散率の低下も観察された[66]。これは,いずれも神経線維が回復したことを示している。
動物モデルにおいて、ミエリン塩基性タンパク質(Mbp)および再ミエリン化に対するHBOTの影響を調査した研究がいくつかある。Baratz-Goldsteinら[68]は、軽度外傷性脳損傷のマウスモデルにおいて、HBOTの即時処理または遅延処理のいずれかを適用して、これらの効果を調べた。彼らは、どちらの治療も未治療の対照群に比べてMbpの発現低下と脱髄を改善し、治療群と偽薬群のMbp発現量の測定値が同じであることを発見した[68]。治療群と対照群との間の差は、治療開始から 10日後にはすでに観察されており、治療期間を4日間に限定した場合でも、HBOTはかなり早い回復をもたらしたことになる。Kraitsyらの研究 [69]では、HBOTにより、ミエリン構造に重要なMbpの2つの特定のアイソフォームの発現レベルのアップレギュレーション、プロテオリピッドタンパク質(Plp)のアップレギュレーション、および再ミエリン化プロセスの増加が認められた。
これらの研究やその他の研究は、神経系の白質に対するHBOTの重要な効果を示しているが、オリゴデンドロサイトに対して直接行われたメカニズム研究は不足しており、HBOTとミエリン化プロセスに作用するメカニズムを理解する上で鍵となる可能性がある。
2.3. 神経炎症に対するHBOTの影響
脳内の神経炎症は、脳が外傷や損傷、その他の病的状態に陥った際に、中枢神経系の免疫細胞と末梢の免疫系が反応することである。主に、ミクログリアやアストロサイト[70,71]、あるいは血液脳関門が損なわれたときに浸潤してくる末梢免疫系細胞[72]によって生じ、それらの細胞はさまざまな炎症性サイトカインを分泌する[71,73]。神経炎症は組織修復に必要なプロセスであるが、通常、慢性炎症と呼ばれる免疫系の過活動状態が長期化すると、アルツハイマー病 [74]、自閉症 [75,76,77]、脳性麻痺 [78,79]、外傷性脳損傷 [80]で起こりうるように、広範囲の組織損傷を引き起こす可能性がある。
低酸素は、自然免疫系の細胞の活性化を媒介して、炎症性サイトカインの分泌を増加させ、免疫細胞の凝集を増加させることにより、神経炎症を誘発する主要な要因となる[4,81,82]。一方、慢性的な神経炎症は、低酸素誘導因子1α(Hif1-α)の発現増加に見られるように、低酸素状態を引き起こしたり、増加させたりすることもあり、この2つの状態の間に正のフィードバックサイクルが生じている[83,84]。
神経炎症との関連性が高い神経変性疾患の一つにアルツハイマー病がある。アルツハイマー病では、脳内に大量のアミロイド斑が蓄積する。これらのプラークは、活性化したミクログリアがプラークを取り囲み、炎症性サイトカインを分泌するミクログリア症を引き起こす可能性がある[85,86,87]。Shapiraら[28]は、ADモデルマウスに対するHBOTの影響を研究し、治療後にアミロイドプラークの周囲のミクログリアが減少し、海馬の免疫蛍光染色で示されるTNF-αなどの炎症性サイトカインも減少したことを発見した。これらの研究者は、サイトカインの量が減少したのは、ミクログリアの量が減少したためではないかと考えた。さらに、形態学的検査では、HBOTがミクログリアの突起の伸長を促進し、プラークの周囲に出芽たミクログリアの数を増加させることが示され、これはミクログリアの活性化状態と機能の変化を示していると考えられた。これらの知見は、低酸素レベルおよびアミロイドプラークの量の減少、ならびに認知および不安に似た行動の改善と並行して現れた[28]。
いくつかの研究では、炎症性サイトカインの分泌量の減少以外に、HBOTが免疫細胞の抗炎症性サイトカインの分泌を促進することによって神経炎症を抑制することが分かっている [28,88,89]。動物モデルでは、HBOTによって、リアルタイム定量PCR法で測定した抗炎症性サイトカインであるインターロイキン(IL-4)をコードするmRNAの発現レベルが上昇し[28]、ELISA法で測定した大脳皮質における抗炎症性サイトカインであるIL-10の濃度が上昇した[88]。抗炎症性サイトカインの変化は,さまざまな神経症状をもつヒトの患者でも同様に見られた[89].
HBOTの抗炎症作用は、組織の修復を促進し、アポトーシス経路を阻害することで二次的な細胞死を防ぐことができる。このことは外傷性脳損傷マウスモデルで示されており、HBOT後に抗炎症性サイトカインIL-10の発現が増加すると、カスパーゼ-3活性が低下し、Bax発現レベルも低下した[88]。これらの知見を合わせると、HBOTには将来の損傷を食い止めるだけでなく、組織の治癒プロセスを開始する能力があることが示唆される。
2.4. 酸化ストレスに対するHBOTの影響
酸化ストレスは、細胞内の活性酸素種(ROS)のバランスが崩れた結果である。酸化ストレスにはいくつかの原因があるが、その第一の原因は、高酸素状態のミトコンドリアからの活性酸素の放出である [90,91]。活性酸素は、正常な状態では、シナプス可塑性の調節[92]や分子シグナリング[93]など、いくつかの細胞プロセスに有益であるが、活性酸素レベルが異常になると、DNAの断片化やタンパク質の架橋を引き起こし、細胞のアポトーシスにつながる可能性がある[93,94]。HBOTを使用する際に最も懸念されるのは、酸素を大量に投与して高酸素状態になる可能性があるため、酸化ストレスが増加することである。
HBOTの酸化ストレスへの影響については、相反する結果がある。HBOT後に、活性酸素濃度のバランスをとるのに非常に重要な抗酸化物質が増加することを示した研究もあれば [95,96]、高い酸素供給量に応じて活性酸素が増加し、酸化ストレスが誘発されることを示した研究もある [97,98,99]。しかし,後者の研究のいくつかは,標準的なプロトコルを逸脱した連続した曝露を繰り返して行ったもの[99]や,臨床的に承認された圧力レベルよりも高い4気圧という比較的高い気圧を用いて動物を用いて行ったもの[97]である。さらに,治療終了から 24時間後には,上昇した活性酸素はベースラインに戻り[100,101],活性酸素の上昇によって生じたDNA損傷は可逆的であることが示された[102]。
活性酸素の上昇にもかかわらず、脳虚血などに関するいくつかの研究では、HBOT後にはさまざまな抗酸化物質が増加することが示されている[95,96]。Wadaら[96]およびNieら[103]は、それぞれ脳虚血および脊髄虚血のげっ歯類モデルにおいて、スーパーオキシドディスムターゼ(SOD)およびカタラーゼといった重要な抗酸化酵素が、HBOTプレコンディショニングを介して増加することを示した。
すでに述べたように、活性酸素の増加は、細胞毒性だけでなく、良い結果をもたらすことがある。活性酸素は、Hif1-αの安定化を介して血管新生に関わる細胞経路のシグナル伝達を開始するのを助ける可能性があり、その結果、血管内皮増殖因子(VEGF)の産生が増加する[104,105,106]。このことは、セクション2.5で詳述されているHBOTと血管新生の関係をさらに強固なものにしている。
HBOTは活性酸素濃度を上昇させる可能性があるが、適切なプロトコルでの使用は安全であることが確立されている [101,107]。さらに、前述の抗酸化物質の増加がこの活性酸素の増加を打ち消し、酸化ストレス状態が治療前と同じレベルにとどまるようなバランスを生み出す可能性がある。Wadaら[96]は、ROSの上昇がSODなどの抗酸化物質の発現を高め、さらには虚血耐性を作り出す可能性を示唆している(図2)。
2.5. 血管新生の誘導と脳血流の変化に対するHBOTの影響
脳のある部位への血液供給が減少すると、その部位の高い酸素需要を満たせず、低酸素状態になる可能性がある。例えば、自閉症では、側頭葉などの言語に関連する特定の脳領域で脳血流の減少が認められ[6]、また、顔の表情を観察するなどの特定の活動時にも脳血流の減少が認められる[108]。
創傷における脳血流および血管新生(新しい血管が作られるプロセス)の増加におけるHBOTの治療的価値は、しっかりと確立されている[105]。神経学的状態におけるこれらの側面に対するHBOTの効果は、主に陽電子放出断層撮影法(PET) [109]、単一光子放出コンピュータ断層撮影法(SPECT)および機能的MRI [110]など、様々な画像技術を用いて研究されている。ヒトを対象とした研究のほとんどがSPECT画像を用いており,さまざまな神経症状において,症状の改善とともに血流の増加が認められている[27,33,36].
Talら[66]は、ヒトの外傷性脳損傷被験者において、HBOT後に脳血流と脳血液量が増加したことを、動的帯磁率コントラスト増強MRI画像で測定して観察しており、これは血管新生を示す可能性がある。他の研究では、分子マーカーの調査により、HBOTによる血管新生の誘導の証拠が発見された。中枢神経系でそのようなマーカーを測定した2つの研究 [111,112]では、特に血管新生に関与するVEGF mRNAのアップレギュレーションが示された。血管新生は、血管の修復と同様に、HBOTが脳血流を増加させる中心的なメカニズムである可能性がある。
以上の研究から、HBOTが血管の修復を助けることが明らかになった。酸素の直接的な供給を達成することに加えて、HBOTが中枢神経系における血管新生を促進することにより、組織に到達する酸素量を間接的に増加させることができることを強く示唆している。
3. 治療的観点からのHBOT
第2節で述べたように、HBOTは神経疾患において広範な有益な分子効果を示し、この治療法のエキサイティングな治療の可能性を強調している。以下では、神経症状に焦点を当てたヒト臨床研究における治療的観点からHBOTをレビューする。
3.1. 自閉症スペクトラム障害
自閉症スペクトラム障害は、社会的行動の抑制や不安などの症状を特徴とする発達障害の一群である[21]。米国疾病対策予防センターによると,54人に1人の子どもが自閉症スペクトラム障害と診断されており[113],最も一般的な神経変性疾患の1つとなっている。効率的な治療法は見つかっておらず,この障害の病因のほとんどは不明である。興味深いことに、ミトコンドリア機能障害[53,54]、白質の変化[114,115]、および低灌流[116]など、自閉症スペクトラム障害が示す分子異常のいくつかは、HBOTによって治療可能な可能性のある機能障害と関連している。したがって、HBOTによって自閉症スペクトラム障害のいくつかの症状が改善される可能性があるという期待がある[84,117]。
長年にわたり、自閉症スペクトラム障害の症状に対するHBOTの効果を調査した研究では、矛盾した結果が得られている[118,119,120,121,122,123]。1つの研究[118]では、62人の自閉症スペクトラム障害の子供たちがHBOT(酸素濃度24%、圧力レベル1.5ATA)で治療を受けたか、または無治療の対照シャム群に割り当てられた。治療群では、医師が実施したClinical Global Impression評価で測定された言語能力と社会的相互作用に大きな改善が見られ、その他の改善も見られた。
Rossignolらによる別の研究では、2種類のHBOTプロトコルの有効性が検討された。100%酸素の1.5ATAと24%酸素の1.3ATAである[123]。行動の改善は、有効なアンケート(ABC-C、SRS、ATEC)に従って被験者の両親によって評価された。両群とも、治療前と比較して、C-reactive protein発現量の減少によって測定された炎症の減少と、発話や認知意識などの臨床面での改善が見られた。なお、この研究は、被験者が無作為にグループ分けされていない非盲検試験であることに留意してほしい。さらに3件の研究では、社会的および認知的な改善を含む、HBOT後の臨床的および行動的な改善が認められた [124,125,126]。残念ながら、これらの研究には対照群がなく、結果の解釈が複雑になっている。
さらに、自閉症スペクトラム障害の文脈でHBOTを調査したいくつかの研究では、上述の側面で大きな改善は認められなかった[119,120,127]。Granpeeshehらが行った研究では、人間の自閉症スペクトラム障害被験者が2つのグループに分けられた。1つは24%の酸素を1.3ATAで照射し、もう1つは偽装群として、1ATAの室内空気(21%の酸素)を照射した[119]。検証された心理テスト(ABC、アルツハイマー病OS、SRSなど)によると、行動面での有意差は認められなかった。Sampanthavivatらによる対照研究では、治療群(1.5ATA、100%酸素)と、室内空気中の圧力をわずかに高めた1.15ATAの偽装群の両方で、自閉症スペクトラム障害の子供たちの行動に有意な改善が見られた[127]。いくつかの行動テストでは、臨床医と親の評価が一致しなかったが、ほとんどの面で両群間に有意な差は認められなかった。HBOTのいくつかの研究では、わずかに上昇した圧力の使用が何らかの治療を構成していることが観察されていることに留意されたい[128]。したがって、対照群の治療にこの圧力を使用することは問題となりうる。この問題については、セクション3.2およびセクション4でさらに議論する。
Luoらによる研究では、自閉症スペクトラム障害に強く関連する障害であるFragile X症候群のマウスモデルに対するHBOTの効果が研究され、社会性および不安様行動の改善が認められた[122]。
自閉症スペクトラム障害は非常に大きなスペクトルであるため、この分野では、病因が類似している可能性のあるスペクトル上の特定のグループに焦点を当てた、よりきめ細かな研究が必要であると考えられる。特に、ミトコンドリア機能障害を有することが知られている自閉症スペクトラム障害亜集団は、自閉症スペクトラム障害全体の5%を占めており、臨床的および分子的な特徴を共有している[53,129]。これは、セクション2.1で議論したように、HBOTがミトコンドリア活性にプラスの影響を与えることが示されていることが少なからず影響しているためであり、このような研究の有力な候補となっている。
3.2. 脳性麻痺(CP)
脳性麻痺は、主に大脳の発達段階での脳の損傷により発症する神経変性疾患である。振戦や筋力低下などの運動機能障害を特徴とする非進行性の運動障害とされている。脳性麻痺の症例のほとんどは、出生前の段階で発生するが、脳が完全に発達する前であればいつでも発生する可能性がある[16]。
脳性麻痺の主な原因が脳血流の減少であるという事実[130,131]は、低酸素との強い関連性を示しており[16]、したがって、HBOTの治療の可能性を示している。実際、脳性麻痺の被験者に対する非侵襲的治療法としてHBOTが試験されている。残念ながら、この分野で行われた研究の大部分は、脳性麻痺に対するHBOTの治療効果を支持しないデータを示している[132]。Colletらの研究 [133] では、脳性麻痺の子ども111人が研究に参加し、治療群は1.75ATAの圧力と100%の酸素がある環境に置かれ、対照群は1.3ATAの圧力と室内空気にさらされた。対照群と治療群の間には、運動特性や認知特性に関して有意な差は見られなかったが、両群とも、高圧にさらされる前の状況と比較して、時間の経過とともにそれらの特性が改善されていた。したがって、対照群が改善したのは、わずかに上昇した圧力の効果によるものであり、HBOTが脳性麻痺に対してプラスの治療効果をもたらす可能性があることを意味していると言えるだろう。実際、Boussi-Grossら[36]は、ヒト被験者を1.3 ATAと室内空気中に置くことの効果と、組織の酸素濃度が50%上昇するなどの観察可能な生理学的変化が生じることから、これらの条件を対照群に適用する際に生じる問題について議論している。彼らは、「偶発的な」治療を避けつつ、プラセボ効果を発揮する対照群プロトコルを設計する代替方法を提案した。
より最近の研究では、HBOTと理学療法や言語療法などを含む集中的なリハビリテーションの組み合わせを、集中的なリハビリテーションのみで治療した対照群と比較して調査している[128]。この研究では、圧力と酸素濃度が異なる3つの高気圧治療が行われた。3つの治療法すべてにおいて、対照群と比較して運動機能が有意に改善したことから、高気圧治療が脳性麻痺に有効である可能性が示された。改善されたグループの1つが1.3ATAと室内空気で治療されたことに注目し、これはColletら[133]のコントロールグループで観察された改善と一致している。
このセクションの最後に、さらなる調査が必要と思われる2つの見解を述べる。まず、ほとんどの研究が比較的幅広い年齢層を対象に行われたことに注目する。脳性麻痺は非進行性の疾患であると考えられているため、自閉症スペクトラム障害と同様に、治療に適した年齢があるのかもしれない。第二に、Mukherjeeの研究に倣い、HBOTの100%酸素レベルの有益な効果と、圧力レベルの上昇と室内空気のみの治療との比較をさらに研究すべきである。Mukherjeeの研究では、圧力上昇のみの治療を受けたグループが、高圧と100%酸素の両方を受けた他の2つのグループと同等の改善を示した[128]。
3.3. 外傷性脳損傷
外傷性脳損傷は、若年層の死亡および障害の主要原因の1つである[11]。外傷性脳損傷による合併症は、激しい頭痛などの症状が現れる打撲後症候群など、受傷後数年経ってからも発生する可能性がある[11]。脳血管が損傷すると低酸素と外傷性脳損傷が強く結びつくため、HBOTは外傷性脳損傷の潜在的な治療法として広く研究されている[134,135,136]。
HBOTは、いくつかの前臨床研究[68,137]および臨床研究[36,66,138,139,140,141,142]において、外傷性脳損傷に対する大きな治療効果があることが示された。Boussi-Grossら[36]は、56人の外傷性脳損傷被験者を対象とした無作為化比較試験において、HBOTがヒトの外傷性脳損傷被験者の認知機能と生活の質を改善したとしている。この研究では、クロスオーバー方式の対照群を利用し、その中に2つの実験群があった。この研究では、クロスオーバー方式の対照群と、2つの実験群が用いられた。各グループは、治療前と治療後に自分自身と比較し、最初のグループが治療を終えた後、後者のグループの治療が始まる前にグループを比較した。治療前と治療後に3つの異なるパラメータが測定された。認知機能(4つの異なる認知機能指標で測定)QOLイト(生活の質)(アンケートで測定)脳活動(SPECTで測定)である。すべての測定で、記憶力、注意力、脳血流に有意な改善が見られた。これらの改善は、HBOT後の治療群とクロスオーバー群でのみ認められ、対照の未治療期間では認められなかった。被験者は受傷後何年も経ってからHBOTを受けたことから、外傷性脳損傷の場合、治療に臨界期はないことが示唆された。
Rockswoldら[142]では、外傷性脳損傷を受けた42人の被験者を無作為に2つのグループに分けた。HBOTと正常気圧酸素療法(NBOT)を組み合わせた治療を3日間連続して行う群と、無治療の対照群である。乳酸/ピルビン酸比、頭蓋内圧などの生理的側面の有意な低下とともに、HBOT/NBOT群では死亡率の低下が認められ、6ヶ月後の追跡調査ではグラスゴーアウトカムスケールの有意な改善も見られた。これらの結果は、168人の外傷性脳損傷患者を2週間のHBOT群と無治療の対照群に無作為に分けたRockswoldらの知見と一致しており、治療群では死亡率の有意な低下が観察された[139]。さらに、Talら[66]とTalら[140]では、ヒトの外傷性脳損傷被験者に対するHBOTのレトロスペクティブ分析により、運動技能や処理速度などの認知機能の改善とともに、脳血流の増強が認められている[66,140]。
外傷性脳損傷に対するHBOTの効果について、分子的側面と治療的側面の両方に焦点を当てた40年間の広範な研究において、多くの研究が外傷性脳損傷に対するHBOTの使用を支持しているようである [135,136]。しかし、HBOTで治療したヒト外傷性脳損傷被験者の臨床研究のほとんどは、適切な偽装群を持っていなかったため、ヒト被験者に対する治療効果についてはさらに調査する必要がある[141]。外傷性脳損傷研究において適切な偽装群を構築するという問題は、多くの場合、即時の治療が必要であるという事実と、外傷性脳損傷症例に固有の不均一性のために、困難なものとなりうる。脳性麻痺は通常、発達段階における脳の損傷によって引き起こされるが、外傷性脳損傷とは異なり、HBOTの治療効果に関してはより多くの矛盾した結果が見つかっていることは興味深い。このことから 2つの病態の治療法の間のプロトコルの違いを検討し、2つの病態の間に多くの違いがあるにもかかわらず、外傷性脳損傷に対するHBOTの成功から何か知見が得られるかどうかを検討する必要がある。
4. 考察と今後の研究
結論として、HBOTによる神経学的症状の改善については、分子的側面と治療的側面の両方で豊富な証拠がある。観察されている主な分子的変化は、髄鞘形成過程とミトコンドリア活性の改善、血管新生の促進、神経炎症の減少である。治療面では、記憶力、認知機能、運動機能、生活の質の向上などが挙げられる。
一方で、さらなる調査が必要な問題も残っている。刺激的な科学的疑問の一つは、HBOTによって独立して影響を受けることが知られている髄鞘形成プロセスとミトコンドリア活性がどのように関連しているかということである。オリゴデンドロサイトとミトコンドリア活性の関係が調べられており、ミトコンドリアの異常がオリゴデンドロサイトの分化、成熟、および活力に影響を及ぼすことが示されている[143,144]。したがって、今後の研究では、HBOTの文脈におけるこれらの分子変化の相互作用を支配するより深いメカニズム、特にミトコンドリア活性の改善によって白質の完全性の向上が起こるかどうかを探ることができる。さらに、分子メカニズムと治療的側面との関連性を、例えば、分子変化が生じた脳領域と被験者の臨床効果との間に関連性があるかどうかを調べる必要がある。
HBOTが発作[107]やその他の副作用[145]を引き起こしたいくつかの研究を除けば、HBOTは神経学的疾患に使用しても安全であることがわかっている。特定のプロトコル、特に非常に高い圧力(3 ATA以上)を用いたプロトコルでは、HBOTは酸化ストレスを有害なレベルまで増大させる可能性があることに注意することが重要である。したがって、神経学的症状には特定のHBOTプロトコルのみを使用し、各症状や病態に応じて最も効果的かつ安全な選択を検討する必要がある。
HBOTプロトコルおよび対照群のデザインにはかなりのバリエーションがあるため、この分野における相反する結果を比較することは困難である。さらに、これらの研究の多くは、被験者の年齢にも大きな違いがある。神経変性疾患は発達の重要な段階にある患者に影響を与えるため、今後の研究では治療の重要な時期を検討する必要がある。
HBOT研究における重要な問題は、「プラセボ効果」は得られるが、実際の治療や実際の生理学的変化は得られない、適切な対照群をいかにして設計するかということである。この問題を解決するために、いくつかのタイプの偽群が検討されてきた。いくつかの研究では、偽群に1.3 ATAのHBOTチャンバーと室内空気を用いている。すでに述べたように、このわずかな圧力上昇は生理学的変化をもたらさないように思えるかもしれないが、組織内の酸素が50%増加するため、何らかの効果的な治療を構成することになる。他にも、高圧と低圧を頻繁に繰り返すことで高圧感を再現したり、低濃度の酸素を圧縮空気で補ったりする方法が考えられている。しかし、これらの方法は技術的にも倫理的にも問題がある。セクション3.2で取り上げたMukherjeeの研究では、これらの困難を回避する方法が提案されている[128]。この研究では、対照群はリハビリテーション治療を受け、実験群はHBOTとリハビリテーションの両方を受けた。このようにして、治療の有効性に対するHBOTの影響を分離したのである。さまざまなタイプの対照群を検討し、その中から 1つを選んで「従来型」の対照群とすることで、HBOTの機能を理解する能力が大幅に向上すると考えている。