Contents
Magnesium and inflammation: Advances and perspectives
pubmed.ncbi.nlm.nih.gov/33221129/
2020年11月18日
a ミラノ大学、生物医学・臨床科学科 L. Sacco, Via GB Grassi 74, I20157 Milano, Italy
b クレルモンオーヴェルニュ大学、INRAE、UNH、クレルモンフェラン、フランス

ハイライト
- マグネシウムは免疫反応の調節に貢献する。
- 低マグネシウムは様々な課題に対する非特異的な免疫応答を増強する。
- 低マグネシウムは低悪性度の慢性炎症と関連する。
- 関係する主なメカニズムとしては、カルシウムの調節緩和とレドックスの不均衡が挙げられる。
- 調節不能なマグネシウム輸送体は炎症に寄与している。
概要
マグネシウムは、すべての組織の代謝と恒常性の調節に関与し、生命に不可欠な要素である。また、免疫機能を調節し、自然免疫系や適応免疫系の細胞に作用する。マグネシウム欠乏症は、食細胞を初期化し、顆粒球の酸化バーストを促進し、内皮細胞を活性化し、サイトカインのレベルを上昇させ、炎症を促進する。その結果、しばしば診断されないことが多い低マグネシウム状態は、様々な免疫課題に対する反応性を強め、多くの一般的な慢性疾患の病態生理に関与している。
ここでは、マグネシウム欠乏症、炎症反応と疾患の間のリンクをサポートする最近の進歩を要約し、基礎となるメカニズムのより良い理解に向けて新たなヒントを提供する。
1. 序論
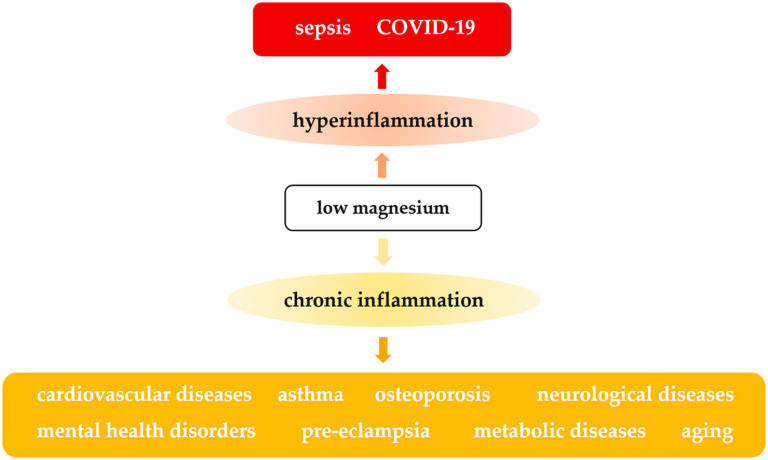
炎症を制御するためにマグネシウム(Mg)を使用したことを記述した最初の報告は、100 年前にさかのぼる。それは、試験管内試験および生体内試験での実験的研究だけでなく、疫学調査では、低Mg状態と炎症との間の接続を確立し、関与する細胞およびmo-lecularメカニズムを明らかにし始めることが唯一の80年代である。ヒトの体内で 4 番目に多く存在する陽イオンである Mg は、細胞の増殖とアポトーシスをモデル化し、新陳代謝を形成するために不可欠であることを考えれば、この関連性は驚くべきことではない(図 1)。また、Mgは免疫システムを形成するためにも必要である。興味深いことに、Mg欠乏は適応免疫細胞の応答を損なう一方で、自然免疫系を活性化し、炎症を促進する[2]。
Mgの議論の余地なく重要な機能にもかかわらず、不顕性のMg 欠乏症は、不足したMgの摂取量、薬、慢性疾患のためにむしろ一般的であり、成人のための可能な公衆衛生上の懸念として番号付けされている[3]。
このレビューでは、まず、Mg 欠乏が急性炎症のいくつかの典型的な徴候を促進し、炎症反応を亢進させていることをまとめた。このことを踏まえて、我々はCOVID-19のいくつかの病原性の側面への低Mg状態の潜在的な寄与について推測する。その後、我々は、罹患率、障害、死亡率の主要な原因である多くの非伝染性疾患の共通のスレッドであるMg欠乏症と慢性炎症との関連について議論する。Mg トランスポーターの発見により、Mg の研究が活発になってきていることから、炎症における Mg トランスポーターの役割について、現在の知見を簡潔に概観する。
2. COVID-19に着目したMg欠乏症、急性炎症と炎症反応の亢進
Mg欠乏症と炎症との関連を支持する上での主要な進歩は、生体内試験および試験管内試験での実験研究に由来している。げっ歯類では、マグネシウム血症の低下は急性炎症反応の典型的な徴候、すなわち充血、 浮腫、急性期タンパク質の上昇、インターロイキン(IL)1,IL-6,腫瘍壊死因子 (TNF)αなどの循環性炎症性プロサイトカインにつながる[4]。さらに、中枢神経系や末梢神経系に存在し、免疫細胞でも産生されるタチキニンの一種であるサブスタンス P は、Mg 欠乏ラットでは上昇しており、炎症の持続に寄与している[5]。
注目すべきことに、実験的な Mg 欠乏は、様々な免疫負荷に対する自然免疫応答を高める。その結果、Mg 欠乏動物から分離されたマクロファージや好中球は、様々な刺激に対して過敏に反応するようになった[6]。この過剰反応性は、急性炎症組織内の局所的な Mg 濃度の低下によって促進されている可能性があり、これは IL33/ST2 シグナルを介して引き起こされるイベントであり、様々な臓器の炎症反応に寄与している[7]。
最近では、Mg はダメージ関連分子パターン(DAMP)の原型である高移動度グループボックス 1(HMGB1)の分泌を阻害し、ラットの敗血症発症の原因となる Toll-like receptor 4(TLR4)/nuclear factor-kappa B(NF-κB)軸を阻害することから、敗血症に起因する横隔膜機能障害からラットを保護することが示されている[8]。
試験管内試験実験では、Mg 欠乏が急性炎症の主役である白血球と微小血管内皮細胞の 挙動に直接影響を与えることが示されている。微小血管内皮細胞は、急性炎症の血管イベントの編成に極めて重要である。培地中の Mg 濃度が低いと、これらの細胞では NF-κB が活性化され[9] 、一酸化窒素やプロスタサイクリンといった血管 活性分子などの炎症性メディエーターが大量に合成され、これらの分子は血管拡張や過 透析を引き起こし、その結果、急性炎症の 2 つの基本的な徴候である充血や浮腫を引き起こすことになる。さらに、低 Mg による NF-κB の活性化は、内皮表面を白血球との接着性を高め る接着分子を増加させ、大量のサイトカインやケモカインの放出を刺激して好中球を 活性化させ、これらのサイトカインやケモカインは内皮接着分子と速やかに結合し、傷つい た組織に移動する [9,10] 。さらに、Mgは、プリンリン作動性受容体P2X7をダウンレギュレートすることにより、細胞外ATPの炎症促進効果に対して培養内皮細胞を防御する[104]。実際、ATPは、負傷した細胞によって受動的に放出されたり、好中球によって積極的に分泌され、P2X7受容体に結合し、プロ炎症性サイトカインIL-1ositsLu_1E9EとIL-18 [105]の成熟とリリースを誘導するインラマソームを活性化する。
低Mg状態とヒトにおける急性炎症との関連についての知識は非常に限られている。注意すべきは、低マグネシウム血症は、敗血症を伴う集中治療室の患者で頻繁に 同定されており、全身性炎症反応症候群と多臓器不全[11]の開発に関連付けられている。しかし、病原体の存在下で個人の反応性が亢進するのは Mg 欠乏症なのか、それとも敗血症の結果としての Mg 低下なのか、どちらが先なのかは明らかではない。この不可解な疑問に答えるために、現時点ではデータはない。
このことをすべて念頭に置いた上で、SARS-CoV-2 が健康、経済、社会的、文化的権利に大きな打撃を与え、世界中に広まり始めたとき、私たちは、無症状で、ルーチンの臨床検査では検出しにくい潜在的な Mg 欠乏症が、COVID-19 [12] の重篤な臨床症状を引き起こす可能性があると予想した。重要なことに、湖北省武漢市で行われた最近のレトロスペクティブな研究では、重症の COVID-19 患者の血中 Mg 濃度が非重症の COVID-19 患者よりも有意に低いことが報告されており [13]、Mg 欠乏症が軽症から重症への進行を助長する可能性があることが示唆されている。我々は、Mg 欠乏症がウイルスを刺激する炎症反応を誇張することで、急性呼吸窮迫症候群、内皮機能障害、 凝固障害、多臓器不全につながるサイトカインストームの発症を促進しているのではないかと推察している。発作性炎症と並行して、CD8 +およびCD4 + Tリンパ球は、以下のように障害される。
COVID-19 [14]のように、Mg欠乏はこれらの細胞の増殖と活性化の両方を減少させるので、このような指標は、再び低Mg状態に起因する可能性がある[2]。この目的のために、インフルエンザ A ウイルスに感染した Mg 欠乏マウスの肺では、CD4 + および CD8 + T 細胞が著しく減少していることは注目に値する[15]。COVID-19 患者の呼吸困難の原因と関連している可能性があるもう一つの興味深い問題は、敗血症の実験モデルにおいて、低 Mg が横隔膜機能を低下させるという証拠から来ている[8]。明らかに、横隔膜の収縮が低下すると呼吸が著しく障害され、人工呼吸が必要になる可能性がある。結論として、Mgのホメオスタシスを補正して維持することでサイトカインストームを和らげ、その結果、COVID-19の軽症から重症への移行を防ぐことが可能であることを提案することが可能である。
3. Mg欠乏症と慢性炎症:非伝染性疾患における役割
いくつかの研究では、中等度または不顕性のMg 欠乏症は、低グレード、虚弱と心血管疾患、糖尿病、喘息、子癇前症、骨粗鬆症、炎症性腸疾患、精神疾患や神経変性疾患[2]の間で多くの一般的な病理学的条件の共通分母のための強力な危険因子である慢性くすぶり炎症を誘導することを示している。慢性炎症のバイオマーカーは、炎症性メディエーター、特に C 反応性蛋白質(CRP)の 2~4 倍の増加である。したがって、低Mg状態はCRPの上昇を伴い、Mg補給はCRPレベルを低下させる[16-18]。
メタアナリシスや無作為化比較試験では、Mgの摂取量と冠動脈性心疾患、脳卒中、心臓病死亡率などの心血管系イベントのリスクとの間に逆相関があることが示されている[19]。Mg欠乏はNF-κBの活性化を介して内皮機能障害を引き起こし、内皮機能障害はアテローム性病変の開始と進行に寄与するため、血清中濃度の低下をもたらす低Mg摂取量はアテローム性動脈硬化症の危険因子である[20]。また、Mg欠乏は血小板凝集を増加させる[25]が、これはアテローム形成や血栓症に関与する事象である。
心臓発作の後、CRPは虚血性心筋細胞の補体を活性化し、虚血性心筋細胞の溶解につながる。したがって、CRP は心疾患の誘発、発症、増悪に関与している。このような患者では、Mg は抗酸化作用を発揮して内皮を保護し、心筋細胞の損傷の原因となる CRP を減少させるため、Mg の補給が有効であると考えられる。
Mg の血清レベルと喘息の重症度との間には逆相関関係が存在しており、これは気道を蝕む慢性炎症性疾患であり、マスト細胞、Th2 細胞、好酸球、好中球などの炎症性細胞を特徴とする。Mg は気管支平滑筋細胞の弛緩に関与していることが知られて いるが、喘息の炎症性の側面に対する Mg の影響についての研究はほとんど行われていない。Mgは、喘息患者の好中球呼吸バーストを減少させる環状アデノシン一リン酸のレベルを増加させることに関与している[28]。Mgは顆粒球による酸素フリーラジカルの産生を阻害し、これが上皮細胞の損傷の原因となる。また、Mgはマスト細胞の脱顆粒を阻害し[29]、炎症性メディエーターの放出を防ぐ。また、Mg の血清レベルが低いと、喘息の気道病理の多くの側面に関与している 炎症促進性サイトカインである TNF-α の増加と関連していることも実証されている[30]。したがって、成人と小児を対象とした臨床試験では議論の余地のある結果 が報告されているが、β-アゴニストと併用した場合には、喘息発作の治療に Mg の補給が有効であることを支持する根拠がある[31,32]。
Mg欠乏症はまた、妊娠第20週目以降に発生し、蛋白尿と高血圧によ って引き起こされる障害である子癇前症[33]の発症にも関与している。子癇前症は、さまざまな免疫細胞の活性化と関連しており、その中にはマクロファージ、好中球、Th1細胞が含まれており、これらの細胞が腎臓や胎盤に侵入し、炎症性カスケードを活性化させている。子癇前症の女性では、IL-6,TNF-α、IL8などのいくつかの炎症性サイトカインの増加により、内皮機能障害が発生し、血圧が上昇する。Mg は血管拡張剤であるため、全身の血圧を低下させ、さらに炎症性サイトカインのレベルを低下させるため、子癇前症の治療に有効である可能性がある。さらに、Amash らは、Mg の投与により子癇前胎盤の循環中の IL-6 の分泌が減少することを実証している[106]。
炎症と骨減少症との間には相関関係があることが示されている[34]。いくつかの研究では、Mgの摂取量が少ないと骨密度が低下し、骨折のリスクが高まることが示されている[35-37]。
Mg欠乏による骨への影響は、異なるメカニズムによって説明できる。全Mgの約60%が骨に貯蔵されていることを考えると、低Mgがアパタイト結晶の構造を変化させることで骨に直接影響を与えることは驚くべきことではない。また、Mg 欠乏はカルシウムの恒常性調節因子である副甲状腺ホルモン(PTH)とビタミン D の恒常性にも影響を与え、低カルシウム血症を引き起こす。さらに、低Mg誘発性の炎症性サイトカイン、特にTNF-αとIL1は、破骨細胞機能を亢進させ、ひいては骨量減少を促進する役割を持っている[38]。特に、TNF-αは破骨細胞の分化と活性化を促進し、破骨細胞に対して抗アポトーシス作用を示し、破骨細胞の寿命を延ばす。IL1はマクロファージコロニー刺激因子(M-脳脊髄液)の産生を増加させることで破骨細胞の活性を刺激し、破骨細胞のアポトーシスを抑制する[39]。Mg欠乏に伴う慢性炎症は、動物モデルにおいて病気の行動と関連している[2]。
ヒトでは、マグネシウム欠乏は、線維筋痛症における抑うつ症状[40]や神経障害性疼痛に関連した記憶機能の低下と関連している[41]。これは、血液脳関門(BBB)の透過性を高めるだけでなく、サイトカインやその他の炎症性メディエーターが求心性神経を介して中枢神経系(CNS)に到達し、脳の常駐細胞を活性化するという事実に起因していると考えられる[42]。これにより、中枢神経系では、白血球の浸潤、グリア細胞の活性化、炎症性メディエーターの放出によって特徴づけられる神経炎症と呼ばれる広範囲の免疫反応が発生する[43,44]。神経炎症は、神経変性、発作、片頭痛の慢性化、外傷性脳損傷、虚血性脳卒中などに関連する病原性の役割を持っている[43,44]。片頭痛、てんかん、パーキンソン病、アルツハイマー病(AD)などの患者の脳内に低量の Mg が検出されたことは興味深いことであるが、そのメカニズムは不明のままである。ADに焦点を当てると、細胞外アミロイドβタンパク質(Aβ)の凝集、タウリン酸化、TNF-αおよびIL1βの一貫した増加を伴う神経炎症がこの疾患の典型的な特徴である[46-48]。TNF-αは神経細胞でプレセニリンエンハンサー2(PEN2)とニコスタリン(NCT)をアップレギュレートし、アミロイド前駆体タンパク質(APP)の処理とAβの沈着を増加させるため、これらは厳密に相互に関連している。したがって、TNF-αを標的とすることで、APP/プレセニリン1トランスジェニックマウスにおけるAβの産生とタウのリン酸化が抑制され、認知機能が改善されることになる[47]。試験管内試験では、Mgはグリア細胞におけるTNF-αのレベルを低下させ、ニューロンにおけるPEN2とNCTをダウンレギュレートする[49]。ADのマウスモデルでは、MgはIL1βをダウンレギュレーションするため、グリア細胞の活性化を防ぎ、ニューロンにおけるAPPの発現を減少させる[48]。ADの動物モデルでは、Mgは、シナプスの損失を抑制し、NMDA受容体のシグナリングを回復し、記憶を改善し、認知障害を逆転させる[50,51]。高Mgはまた、BBB透過性を減少させ、脳[52,53]からAβのBBBクリアランスを促進する。65 歳以上のヒトでは、Ca:Mg 比の低減を目的とした個別化された Mg の補給により、認知機能が有意に向上している[54]。現在、治療ガイドラインで推奨されている薬剤はいずれも AD には有効ではなさそうであるため、臨床現場では Mg を用いた様々な治療レジメンを統合することが興味深いかもしれない[55]。
i)ほとんどの前述の障害は、典型的には老化の間に発生し、ii)自然免疫とレドックスアンバランスの異常が老化といくつかの加齢に関連する疾患の駆動要因であるので、それはMgは、そのMgの摂取量が一般的に低い高齢者の骨の健康、心臓血管機能と代謝補償を維持する上で決定的な役割を持っていることに注目すべきである[56]。最近では、食事による Mg の補給は、ハッチンソン・ギルフォード・プロジェリア症候群、早期老化によって特徴付けられる稀な遺伝性疾患[57]のマウスモデルにおいて、長寿を改善し、心血管系の健康を改善することが示されている。試験管内試験では、低Mgは老化の特徴である老化表現型の獲得を促進する[58]。このように、Mg の恒常性を維持することは、健康的な老化のために重要であることは、いくつかの証拠が裏付けている。
4. 低 Mg 誘発性炎症のメカニズムの概要
いくつかのメカニズムは、低Mgによる炎症の促進をどのように説明するために想定することができる。Mgは、すべての代謝経路の規制と酸化還元バランスに関与しているので、その欠乏は、代謝とエネルギッシュなストレスを生成し、フリーラジカルの蓄積に関連付けられている。これらのすべてのイベントは、結果として変化した機能と、適応応答を活性化するために細胞を強制する。これは試験管内試験では内皮細胞で起こり、低 Mg で培養すると大量の活性酸素種を産生し、ストレスタンパク質と NF-κB パスウェイをアップレギュレートして、活性化されたプロ炎症性の表現型を獲得する [21]。また、好中球やマクロファージは、低 Mg に維持された場合、生理的条件下よりも多量のフリーラジカル を産生するようになる[6]。したがって、ラットの Mg 欠乏食は炎症に関連した酸化ストレスを誘発する[59]。
考慮すべきもう一つの重要な側面は、Mg と Ca との間の拮抗関係である[60]。Caは、細胞機能の大規模な配列を支配する基本的なシグナ ル伝達分子である[61]。Mg は、Ca 結合タンパク質(カルモデュリンやトロポニン C など)への Ca の取り込みを阻害し [62]、ミトコンドリアのユニポーターによる Ca の取り込みを制限し [63]、イノシトール 1,4,5-三リン酸やリャノジン受容体による Ca の放出を阻害するため、Ca の細胞内アンタゴニストと考えられている [64]。一方、細胞外の Mg は、Ca 電圧依存性のチャネルを制御する [60,65]。その結果、Mg欠乏は細胞機能に関連した影響を持つCaの細胞内レベルを増加させる。炎症部位では、細胞内 Ca の増加は、血管反応性に重要な急性炎症の初期段階である肥満細胞の脱顆粒を促進する。さらに、高Caはインテグリンの局所クラスターを活性化し、白血球の内皮への接着と内皮接合部を介した白血球の移動を媒介する[66](図2)。
低Mgによる活性酸素の増加とCa動態の変化は、ミトコンドリア機能の変調を示唆している。ミトコンドリアは、細胞の大黒柱としての役割だけでなく、Caの恒常性を調節し、Mgを貯蔵し、活性酸素の主な供給源となっている[67]。Mgはミトコンドリアの機能を保護しているようであり[60,68]、ミトコンドリアのMgトランスポーターmrs2のノックダウンはオルガネラの形態に影響を与え、ストレスに対する細胞の感受性を高める[69]。ミトコンドリアは炎症の制御においても中心的なハブとなっているため[70]、炎症に関与する細胞タイプにおいて、Mg欠乏状態下でのミトコンドリアの動態と機能を研究することは興味深いことであろう。
脳では、Mg欠乏によりNMDA受容体が活性化され、グルタミン作動性興奮性シグナ ルが解放され、それによって興奮毒性とそれに続くニューロンの傷害が引き起こされる。実際、制御されていないグルタミン作動性神経伝達は、精神疾患や神経障害に関与している。また、NMDA 受容体の活性化はサブスタンス P の放出を引き起こし、神経内分泌系の変化を誘発し [71] 、それに伴ってアセチルコリンやカテコールアミンなどの神経伝達物質が分泌され、これらはすべて酸化ストレスや炎症に関与している(図 3)。
近年、Mg 欠乏症は腸内細菌叢の変化と関連していることが知られており、腸内細菌叢は 生涯にわたって相互に有益な関係を築き、人間の健康に貢献している複雑な生態系である。腸内細菌叢は、炎症反応をモデル化する役割を持っていることが知られている[72]。実際、腸内細菌叢と宿主との間のデリケートな平衡の崩壊は、腸管バリアの透過性の変化を誘導し[73]、リポ多糖類やペプチドグリカンなどの微生物産物の血液循環への移動を引き起こし、炎症性サイトカインの産生を誘発する[72]。このシナリオでは、腸内細菌叢とミネラルメタボリズムとの間に興味深い相互作用 があることが実証されており[74]、Mg に関するいくつかのエビデンスが得られている。マウスでは、短期間の Mg 欠乏は腸内粘膜と局所免疫応答に影響を与え [75]、4 日間の低 Mg 食で腸内の細菌量が減少し、回腸バリアの機能が損なわれ、 肝臓と腸内の炎症性サイトカイン TNF-αと IL-6 の発現が増加するのに十分であった [76]。
さらに、微生物叢の乱れは、腸内炎症の原因となる細菌発酵の産物であるギ酸塩の蓄積につながり[77]、これが腸内細菌叢の乱れと相まってMg吸収を阻害し、全身的な低Mg状態を助長し、低Mg/炎症サイクルを発生させることになる。
さらに、マイクロバイオータは神経炎症の重要なレギュレーターとして浮上してきた。特に、迷走神経の活性化、サイトカインの産生、神経ペプチドや神経伝達物質の放出を通じ て、末梢および中枢のイベントを微生物叢が調整している[78,79]。いくつかの証拠は、Mg欠乏を行動の変化と腸内細菌叢の変化の両方と結びつけている。6 週間の Mg 欠乏状態での食事は抑うつ的な行動や不安に似た行動につながり、これは腸内細菌叢の変化と海馬の神経炎症を伴っており、IL-6 の量子化によってモニターされていた。これらのデータは、低Mg食は、うつ病の発症に寄与するマイクロバイオータ-腸-脳軸の不均衡を誘発する可能性があるという仮説を支持している[80,81](図3)。
5. Mgトランスポーターと炎症
Mg は第二のメッセンジャーとして機能するため[82]、Mg の過渡現象を促進す るいくつかのチャネルやトランスポーター、さらには Mg を細胞外に押し出したり、小器官に 送り込んで貯蔵したりするトランスポーターが特徴づけられていることは注目に 値する。
ユビキタスに発現しているイオンチャネル一過性受容体メラスタチン(TRPM)7 は、主に Ca や Mg 陽イオンに透過性のあるイオンチャネルとキナーゼという機能的な二面性を有している[83]。TRPM7の炎症への関与は、腎臓細胞で実証された。TRPM7キナーゼドメインを欠失した細胞は、アルドステロンで処理すると、神経細胞/内皮の接着を促進する接着分子ICAM-1の発現が増加し、シクロオキシゲナーゼ-2とプラスミノーゲンアクチベーターインヒビター-1の合成を伴う炎症促進性の表現型を示する[84,85]。
最近の研究では、マウスモデルにおいてTRPM7の抗炎症的役割が示されている。特に、TRPM7-キナーゼドメインの欠失ヘテロ接合マウスでは、心血管系の炎症およびイボシス、多量の炎症性サイトカイン、マクロファージの異常な活性化、好中球/内皮の付着および白血球の移行の増加が示された。著者らは、TRPM7 欠失によって誘導される炎症性および抗炎症性の効果は、Mg の補給が TRPM7 欠失マウスの状態を改善することから、Mg 依存的なメカニズムと関連していることを示している[86]。
いくつかの研究では、免疫機能の調節におけるTRPM7の重要な役割が示されている[87]。TRPM7は肥満細胞の生存に不可欠であり、そのキナーゼドメインは、細胞内Caおよび細胞外Mg濃度に対する感受性を変化させることで、脱顆粒プロセスを制御している。TRPM7の発現は、喘息ラット骨髄由来の肥満細胞において有意に高く、その阻害はヒスタミンや炎症性サイトカインIL-6,IL13,TNF-αの分泌を減少させる[88]。
TRPM7はまた、単球およびマクロファージの活性化および増殖に関連していることが示された。TRPM7チャネル活性は、マクロファージのM2抗炎症サブタイプへの分極に不可欠である。したがって、M2サブタイプへの分極に関与するIL4はTRPM7活性を増加させ、一方、TRPM7阻害はLPS誘導性TNF-αの発現に対するIL4の阻害効果を減少させ、プロ炎症性M1タイプの分極の獲得につながる[89-91]。適応免疫系の細胞に関連して、TRPM7は機能的なBおよびTリンパ球の発達に役割を持っている。TRPM7 は細胞外 Mg 濃度の変化によって調節され、B 細胞および T 細胞受容体の下流でホスホリパーゼ活性を刺激する。マウスモデルでは、TRPM7 は抗原の取り込み、T 細胞への提示、胸腺の発達、胸腺造血を制御している[92]。
TRPM7が中枢神経系で発現しており、TRPM7の機能と発現の変化が様々な神経変性疾患に寄与していることは興味深いことである。
TRPM6チャネルは、TRPM7とともに、その吸収を調節することで、全身のマグネシウムの恒常性を調節している[2]。TRPM6 欠損マウスは、多くのリンパ系臓器の変性を伴う低マグネシウム血症を示し、マグネシウム、内分泌シグナル、免疫細胞が相互に関連していることを証明している[93]。
マグネシウム輸送体の他のファミリーも炎症の制御に関与している。溶質輸送体ファミリー(SLC)41A1と41A2は2つの重要なMg輸送体であり、前者はほとんどの組織やリンパ系細胞株でユビキタスに発現しており、後者は様々な免疫細胞で発現している。TRPM7のために削除されたリンパ球におけるこれら2つのトランスポーターの過剰発現は、ニワトリのリンパ芽細胞における細胞増殖の低下を部分的に救済する[94]。
MagT1は、Mgに対する高度に特異的なトランスポーターとして記述されており[95]、最近では免疫応答に関与するタンパク質のMg依存性グリコシル化に直接関与するオリゴ糖転移酵素(OST)複合体(96)のサブユニットとして出現した[97]。したがって、MagT1遺伝子の機能喪失はXMEN(X-linked immunodeiciency with magnesium defect, EBV infection, and neoplasia)と呼ばれる免疫不全症候群を引き起こし、CD4+リンパ減少、T細胞活性化障害、ナチュラルキラー(NK)細胞やCD8+T細胞の細胞溶解機能の低下を特徴としている[95,98]。XMEN患者の細胞の培養液中に硫酸マグネシウムを添加すると、NKおよびCD8 +細胞の表面上の活性化受容体NKG2D発現の部分的な回復を誘導し、それらの細胞毒性機能を改善するが[99]、Mg補給はXMEN患者では成功していないことが証明されている[97]。MagT1がその輸送体のグリコシル化を介してMgの恒常性に寄与している可能性がある。
6. 結論と展望
炎症は、組織損傷に対する保護反応と考えられており、迅速な開始とタイムリーな解決を伴って調整されている[100]。炎症が制御されていない場合や解消されていない場合、炎症は有害であり、病気の原因となる。過去 20 年の間に、Mg 欠乏が急性炎症過程での高炎症と慢性疾患での低悪性度炎症の両方に寄与している ことが、多くのデータによって確認されてきた。細胞や分子のメカニズムは一部解明されてきたものの、未だに調査すべき不可解な課題がある。以下にそのいくつかを列挙する。
第一に、有機物と無機物の両方の異なる Mg 塩が、様々な研究で利用されてきた。これらの塩の抗炎症効果を比較することは重要であり、バイオアベイラビリティーや組織特異的活性が異なる可能性があるためである。
第二に、ミトコンドリアは自然免疫応答の重要な制御因子であるため、炎症に関与する細胞では、細胞外での Mg の様々な利用可能性の下で、これらの小器官の機能とダイナミクスを研究する必要がある。
第三に、急速に増加している Mg チャネルやトランスポーターと炎症を結びつける現在の知見を統合するためには、より多くの研究が必要である。解明すべき興味深い問題は、細胞の挙動を駆動する上で、細胞内 Mg と細胞外 Mg のどちらがより重要なのかということである。また、炎症性の課題の下での細胞質と小器官の間の Mg の一過性の動きを追跡することも興味をそそられる。
第四に、栄養因子は、胚の生活の中でエピゲノム生成のバランスをとり、生活を通してそれを編集することが知られている場合でも、エピゲノム上のMgの影響に関するデータはまだ不足している。妊娠中のラットのMg欠乏は、シトシングアニン(CpG)ジヌクレオチド[101]のメチル化を変化させ、成人ラットではDNAのメチル化を増加させ、ヒストンを変更し、いくつかのマイクロRNA [102]をアップレギュレートする。これらの結果から、炎症におけるエピジェネティックな関与の可能性が示唆されているが、このトピックについては、より多くの研究が必要であることは明らかである。
最後に、炎症過程の解決における Mg の役割を理解するための研究を促進すべきである。現在では、活発で高度に専門化された経路が炎症の解決に関与していることが 明らかになってきている[103]。課題は、Mg が炎症を抑制するだけでなく、それに加えて、内因性のプロ分解経路を活性化したり、促進したりする可能性があるかどうかを理解することであ り、それによって、時間的にも空間的にも炎症を封じ込めるための新たな戦略への道を開くことである。