コンテンツ
COVID-19: Famotidine, Histamine, Mast Cells, and Mechanisms
www.ncbi.nlm.nih.gov/pmc/articles/PMC8021898/
オンラインで公開2021年3月23日
概要
COVID-19の発症にはSARS-CoV-2の感染が必要であるが,COVID-19の徴候や症状の多くは一般的な急性ウイルス疾患とは異なる.SARS-CoV-2の感染は、臨床的なCOVID-19疾患の発症に必要であるが、十分ではない。現在、COVID-19の曝露前または曝露後の予防的医療対策として承認されたものはない。臨床データでは、ファモチジンがCOVID-19感染症を軽減することが示唆されているが、作用機序や投与量選択の根拠は不明である。我々は、ファモチジンの作用について、抗ウイルス作用や宿主を介した作用など、いくつかの妥当な仮説を検討した。その結果、COVID-19の症状を緩和するファモチジンの主要な作用機序は、オンターゲットのヒスタミン受容体H2活性であり、臨床的なCOVID-19の発症には、マスト細胞の機能不全による活性化とヒスタミンの放出が関与していると考えられた。これらの知見および関連する仮説に基づいて,特性の優れた薬剤の再利用に基づくCOVID-19多剤併用療法の新しい戦略が開発され,臨床試験が行われている。これらの薬剤の多くは,COVID-19疾患の外来および入院治療のいずれにも適した安価なジェネリック経口剤として世界中で入手できる。
キーワード:ファモチジン(PubChem CID: 3325)肥満細胞活性化疾患、COVID-19,炎症亢進状態、GPCR(G Protein Coupled Receptors)ヒスタミン(H2)受容体
はじめに
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は 2019年12月中にヒトの感染症で初めて検出された感染力の高い病原性ベータコロナウイルスである(Wu D. et al 2020; Wu and McGoogan, 2020; Zhu er al)。 コロナウイルス感染症-2019(COVID-19)は、SARS-CoV-2による感染と因果関係のある疾患スペクトラムであるとされている。確定的なCOVID-19の診断には、ウイルスの存在が必要であり、ウイルスは単離、増殖、またはその他の方法で固有のSARS-CoV-2ウイルス核酸配列として検出することができる。SARS-CoV-2ウイルスの排出や核酸が陽性であっても、臨床的なCOVID-19を発現しない患者がいます(Danis et al 2020,Furukawa et al 2020,Ki and Task Force for -nCo 2020,Lai et al 2020,Pan et al 2020,Zou et al 2020)。症状のある患者の13~20%が酸素吸入を必要とする重度の呼吸器障害を発症し、X線所見ではground glass opacitiesとconsolidationが認められる(Huang er al 2020,Shi er al 2020,Wang er al 2020)。SARS-CoV-2感染者の最大80%は無症候性であり、COVID-19には進行しないようである(Tian et al 2020a;BMJ 2020;Day 2020;He et al 2020;Hu et al 2020;Mizumoto et al 2020;WHO 2020)。したがって、SARS-CoV-2の感染は、臨床的なCOVID-19疾患の発症に必要ではあるが、十分ではない。
COVID-19の患者は、SARS-CoV-2に感染してから 2~14日後に、軽度から重度の非特異的な臨床症状を呈する。これらの症状には、咳や息切れのほか、発熱、悪寒、反復性硬直、筋肉痛、頭痛、口腔咽頭炎、異臭、無月経などのうち少なくとも2つが含まれる(Giacomelli et al 2020,Lechien et al 2020)。入院が必要なより重篤な症状としては、呼吸困難、持続的な胸の痛みや圧迫感、錯乱や覚醒困難、中枢性チアノーゼなどが挙げられる。入院患者のうち、20~42%が急性呼吸器症候群(ARDS)を発症し、病院の集中治療室(ICU)に入院する最も一般的な原因となっている。ICUに入院した患者の39~72%が死亡する(CDC 2020)。
様々な情報源から得られた臨床データは、ファモチジン治療がCOVID-19に関連する罹患率および死亡率を低下させる可能性を示しているが、他の研究では、ファモチジン治療による臨床上のメリットはないことが示唆されている。入院中のCOVID-19患者1,620人を対象とした初期のレトロスペクティブコホート研究によると、入院中にファモチジン(経口または静脈内投与、1日20mgまたは40mg)を投与された84人の傾向スコアマッチした患者では、死亡または挿管のリスクが統計的に有意に減少し(調整ハザード比(aHR)0.42,95%CI 0.21-0.85)さらに死亡のみのリスクも減少した(aHR 0.30,95%CI 0.11-0.80)(Freedberg et al 2020)。ファモチジンとCOVID-19に関するより最近のレトロスペクティブ研究は、効果なし(Cheung et al 2020,Shoaibi et al 2020,Yeramaneni et al 2020)から、当初報告されたものと同様の効果(オッズ比-OR-死亡0.37,OR-死亡または挿管0.47)まで、より多様で、一般的にはあまり悲観的ではない(Mather et al 2020)。効果なしと報告した最新の2つの研究(Shoaibi et al 2020; Yeramaneni et al 2020)とHartford病院の研究(Mather et al 2020)との間の測定結果の違いは、ファモチジンの投与量を含めた複数の説明があるかもしれない。初期の限定的なケースシリーズでは、COVID-19の症状を緩和するためには、標準的な市販薬よりも高い用量のファモチジンを投与する必要があることが示唆されている(エルゴ、高用量[HD]ファモチジン治療)(Janowitz et al 2020)。これらのデータを合わせると、当初報告された生存パターンの増加(Freedberg et al 2020)は、シメチジンと共有されていないファモチジンのオフターゲット、非ヒスタミン受容体を介した特性によるものであると解釈されている(Borrell 2020,Freedberg et al 2020,Janowitz et al 2020)。HDファモチジンは当初、米国(US)でCOVID-19の治療を目的としたIND(Investigational New Drug)の免除を受けて試験が行われていた。この初期の二重盲検無作為化臨床試験では、ファモチジンの高用量静注とヒドロキシクロロキンまたはレムデシビルのいずれかとの併用が行われたが(ClinicalTrials.gov Identifier: NCT04370262)この試験は延期され、まだ登録が完了しておらず、結果も報告されていない。また、COVID-19治療のためのHDファモチジンは、現在、バングラデシュ(ClinicalTrials.gov Identifier: NCT04504240)およびイラン(Samimagham er al 2020)で臨床試験が行われている。最近の心強い臨床報告としては、標準的なOTC用量のファモチジンとセチリジンの同時投与(Hogan et al 2020)や、HDファモチジンとセレコキシブの併用(Tomera and Kittah, 2020a; Tomera and Kittah, 2020b)などが挙げられる。
ここでは、ファモチジンがどのように作用して初期段階のCOVID-19の臨床症状を緩和するのかを調べることを目的としている。最も可能性の高い作用機序としては、抗ウイルス活性を介したもの、新規ヒト標的を介したもの、あるいは現在のFDA市販承認に記載されているオンターゲット機序を介したもの(ファモチジンはヒスタミン受容体H2アンタゴニスト(およびインバースアゴニスト))が挙げられる。
方法
ファモチジンの作用機序の実験的解析
ファモチジンは、SARS-CoV-2のパパイン様プロテアーゼ(PLpro)との分子ドッキングデータに基づき、COVID-19の再利用薬候補として著者らが当初選択した。この分析結果に基づき、米国食品医薬品局(FDA)は、現在進行中の二重盲検無作為化臨床試験(ClinicalTrials.gov Identifier: NCT04370262)に対するIND免除を許可した。PLproの触媒部位に結合する活性を持つと予測されるライセンス化合物のランキングリストを計算機で作成し、上位の各化合物のPLpro触媒部位への結合ポーズを製薬化学者のチームで検討し、ランク付けを行った。次に、高い計算機結合スコアを生成し、検査に合格したライセンス化合物の添付文書または製品モノグラフを検討し、有害事象、FDA警告、薬物相互作用オンターゲットメカニズム、薬物動態および吸収・代謝・排泄・毒性(ADMET)タンパク質結合、利用可能な治療期間の考慮に基づいて化合物をランク付けした。ファモチジン(PEPCID®)は、ヒスタミンH2アンタゴニスト(インバースアゴニスト)で、市販の錠剤および静脈注射用の溶液として広く利用されているが、試験した化合物の中で最も有望な化合物として繰り返し計算上ランク付けされ、最も良好な薬物動態および安全性プロファイルと関連していた。
計算機上でのドッキング予測の成功率は通常20%程度であることを踏まえ、COVID-19の治療薬としてのファモチジンの作用機序を評価するために、複数の作業仮説(Multiple Working Hypothes:1890)という手法を適用した。検証した関連仮説は以下の通りである。
- – SARS-CoV-2 PLproの阻害剤としての直接結合と作用。
- – SARS-CoV-2の感染または複製の直接作用する阻害剤としての作用。
- – シグマ受容体または非ヒスタミンH2 G-coupled protein受容体のいずれかにオフターゲットで結合し、阻害する。
- – ヒスタミンH2受容体を阻害する。
中華人民共和国(PRC)からの検証されていない伝聞に基づく一般紙の初期報道(Borrell, 2020)では、COVID-19の治療にファモチジンが臨床的に有用であり、他のH2受容体拮抗薬(シメチジン)はそうではないことが示唆されていた。このことから、ファモチジンは既知の作用機序であるH2受容体阻害剤として作用していないと推察された。そこで、ファモチジンとシメチジンの様々な投与量における全身の循環レベルをモデル化し、薬物動態解析を行った。
ファモチジンがCOVID-19の臨床症状を緩和し、既知のH2受容体の阻害作用および逆作動作用を介して作用するのであれば、末梢の肺を含む損傷組織にヒスタミン放出の組織病理学的な原因があるはずである。ヒスタミンの最も一般的な放出源は肥満細胞であるため、SARS-CoV-2を用いてアフリカミドリザル(AGM)を実験的に感染させた。剖検の際には、罹患した肺と対照の肺の切片を採取し、マスト細胞の存在と密度を染色した。
ファモチジンはSARS-CoV-2 PLproに直接結合し,阻害剤として作用するか?
組換えSARS-CoV-2 Plproの製造
(His)6-TEVsite-SARS-CoV-2 PLpro(Wuhan-Hu-1分離株のnsp3,ポリプロテイン1ab 1564-1878)の配列を含む発現プラスミドをATUM社から商業的に入手した。このプラスミドを大腸菌BL21(DE3)pLysSに形質転換した。発現および精製プロトコルは、先行研究(Lindner et al 2005)から採用した。
組換え型ISG15の生産
proISG15(2-165)の発現プラスミドは、David Komander(Addgene plasmid #110762; n2t.net/addgene:110762 ; RRID:Addgene_110762)からの贈り物であった(Swatek et al 2018)。発現および精製プロトコルは、(Swatek et al 2018)から適応した。Superdex 75カラム(GE Healthcare)でのサイズ排除クロマトグラフィーステップを最終ステップとして追加した。
PLpro活性アッセイ
SARS-CoV-2 PLproによるISG15の切断は、4nMのPLproを50mM Tris-HCl(pH7.3)150mM NaCl、2mM DTT,0.1mg ml-1 BSAで、10μMのISG15と最終容量20μLで室温で1時間インキュベートすることで試験した。コントロールは酵素なしでインキュベートした。サンプルはSDS-PAGEにかけた。
ファモチジンはVero細胞におけるSARS-CoV-2の感染および複製を直接阻害するか?
阻害剤存在下でのウイルスの増殖および細胞毒性アッセイ
96ウェルプレートに2,000個のVero E6細胞をダルベッコ変法イーグルス培地(DMEM、10%FBS)に播種し、37℃、5%CO2で24時間培養した。感染の2時間前に、培地を、DMSOコントロールを含む、表示された濃度より50%高い濃度で目的の化合物を含む100°ulのDMEM(2%FBS)に交換した。その後、プレートをバイオセーフティーレベル3(BSL3)の施設に移し、100 PFU(MOI 0.025)を50°ulのDMEM(2% FBS)に添加し、最終化合物濃度を表示した。その後、プレートを37℃で48時間インキュベートした。感染後、上清を除去し、細胞を4%ホルムアルデヒドで24時間固定した後、BSL3施設から取り出した。その後、細胞をDAPIカウンターステインでウイルスNPタンパク質を免疫染色した。感染細胞(488nM)および全細胞(DAPI)は、Celigo(Nexcelcom)イメージングサイトメーターを用いて定量した。感染率は((感染細胞/全細胞) – 背景)*100として定量化し、次にDMSOコントロールを100%感染とし、解析を行った。各実験のIC50およびIC90は、Prism(GraphPad Software)ソフトウェアを用いて決定した。選択した阻害剤については、感染した上清をTCID50法を用いて感染性ウイルスの力価を測定した。また、製造者の指示に従い、MTTアッセイ(Roche社)を用いて細胞毒性を測定した。細胞毒性は、感染していないVero E6細胞で、同じ化合物の希釈液を用いて、ウイルス複製アッセイと同時に行った。
TCID50アッセイ
感染上清は、感染後48時間目に回収し、後で使用するまで-80℃で凍結した。感染力は、Vero E6細胞での限界希釈滴定により定量化した。簡単に言うと、Vero E6細胞を96ウェルプレートに20,000細胞/ウェルで播種した。翌日,SARS-CoV2を含む上清を10-1から 10-6の範囲で10倍に希釈して塗布し,5日後にクリスタルバイオレットで細胞の単層を染色してウイルスCPEを検出した。組織培養感染量(TCID50)/mlの中央値は,Reed and Muenchの方法で算出した。
ファモチジンはSigma 1または2受容体と結合し,相互作用するか?
Sigma-1およびSigma-2競合結合アッセイ
Sigma-1受容体の[3H](+)-ペンタゾシンの競合曲線は、ヒトSigma-1受容体を過剰発現させたExpi293細胞(Thermo Fisher社)を用いて、Famotidine、CimetidineおよびPB-28(ポジティブコントロールとして)の結合をテストした。膜は、50mM Tris(pH8.0)で緩衝した100μLの反応液に、10nMの[3H](+)-ペンタゾシン,0.1%BSA、および7濃度(10μMから0.1nMの範囲)の競合する寒冷リガンドを入れてインキュベートした。反応は37℃で2時間インキュベートした後、ブランデル社のセルハーベスターを用いてガラス繊維フィルターでろ過して終了した。ガラス繊維フィルターは,0.3%ポリエチレニミンに室温で30分以上浸してから収穫した。すべての反応は、96ウェルブロックを用いて3重に行った。膜をフィルターに移して洗浄した後、フィルターを5 ml Cytoscintシンチレーション液に一晩浸し、ベックマン・コールターLS 6500シンチレーションカウンターを用いて放射能を測定した。データはGraphPad Prismソフトウェアを用いて解析した。Ki値は、GraphPad Prismソフトウェアを用いて、データを直接フィットさせ、実験的に決定されたプローブのKdを用いて算出した。このプロセスでは、Cheng-Prusoff補正を暗黙的に使用しているため、二次補正は行わなかった。
Sigma-2競合曲線は,ヒトsigma-2(TMEM97)を過剰発現させたExpi293細胞を用い,放射性プローブとして[3H] DTGを用いて同様に行った。
ファモチジンは,ヒスタミンH2 GPCR以外のG-Coupled Protein Receptor(GPCR)を介したオフターゲット活性を介して作用するのか?
ヒトG-coupled Protein Receptor genome(GPCRome)スクリーニングは、公表されている手順(Kroeze er al 2015)に若干の修正を加えて実施した。簡単に説明すると、HTLA細胞をポリ-L-リジンコートされたクリアボトム384ウェル白板に6,000細胞/ウェルの密度で、1%透析FBSを補充したDMEM40ul中で一晩サブカルチャーし、20ng/ウェルのTangoコンストラクトで24時間トランスフェクションし、さらに24時間薬物刺激(最終的に10uM)を受け、培地と薬物溶液を除去し、発光計数のためにBright-Glo Reagents(Promega)を添加した。濃度応答アッセイでは、HTLA細胞をTangoコンストラクトで24時間トランスフェクトし、ポリ-L-リジンコートしたクリアボトム384ウェル白板に、1%透析FBSを添加したDMEM40ul中に10,000細胞/ウェルの密度でプレーティングし、一晩刺激のために薬剤を受け取る前に6時間培養した。その後、プレートを上記のようにカウントした。
ファモチジンはヒスタミンH2受容体をブロックすることで作用するのか?
ファモチジンの既知のオンターゲット活性から、既知の主な作用機序はヒスタミンH2受容体のアンタゴニストであると考えられている。この仮説は、当初、中国(武漢)の臨床研究者が、ヒスタミンH2受容体拮抗薬であるシメチジンではなく、ファモチジンの使用がCOVID-19の死亡率の抑制に関連していることを確認したという未検証の報告により否定された。この2つの異なるH2受容体拮抗薬の臨床効果の違いは、ファモチジンとシメチジンの吸収、薬物動態、薬物分布の違いを反映しているのではないかと考えられた。標準的な経口投与と、COVID-19の治療のために適応外で外来臨床使用として処方されているファモチジンの高用量投与、あるいは進行中の入院臨床試験(NCT04370262)で使用されているファモチジンの高用量投与における両薬剤の定常状態濃度を算出し、それぞれの薬剤について公表されているH2受容体IC50と比較した。
GloSensor cAMPアッセイ
cAMP産生は、マイナーな変更を加えて、一過性にトランスフェクトされたHEK293T細胞(Stauch et al 2019)で測定した。簡単に言うと、HEK293 T細胞をH2とGloSensor cAMPレポーターDNA(Promega)で一晩共トランスフェクトし、ポリ-L-リジンコーティングされたクリアボトム384ウェル白板に、1%透析FBSを補充したDMEM40ul中で15,000細胞/ウェルの密度で6時間プレーティングし、培地を除去し、細胞を薬剤緩衝液(20ul/well、1x HBSS、20mM HEPES、pH7.40)中の3mMルシフェリンで30分間負荷した。試験化合物は、1mg/ml BSAを添加した同じ薬剤緩衝液で調製し、細胞に添加した(20 ul/well at 2x)。20分後に発光をカウントし、結果をPrism 8.4で解析した。
ヒトヒスタミン受容体を用いたラジオリガンド結合アッセイ ヒトH1,H2,H3,H4受容体との放射性リガンド結合アッセイは,NIMH PDSP assay protocol(https://pdsp.unc.edu/pdspweb/?site=assays)および公表されている手順(Besnard er al 2012)に従って実施した。
ファモチジンおよびシメチジンの薬物動態解析
様々な用量のファモチジンおよびシメチジンの定常状態の値は、標準的な薬物動態計算を用いて以下のように算出した。バイオアベイラビリティーおよびクリアランスの値は、ファモチジンおよびシメチジンの錠剤およびカプセル剤のLin(1991)の報告に基づき、ファモチジン60mg×2回投与の場合は、Yehら(1987)の報告に基づく動態データを用いた。ファモチジンの静脈内投与(120mg q8時間)については、ファモチジンの新薬承認申請(NDA 19-510/S-029, 20-249/S-012)から動力学的データを得た。
算出した。AUC(Area under the curve)の算出は以下のように行った。AUC (mg h/L) = (F x Dose)/Cl; ここで、F = バイオアベイラビリティ、Cl = クリアランス。定常状態(Css)の値は以下のように計算した。Css(μg/L)=AUC/T;ここで、Tは投与間隔(h)である。Css値は、ファモチジンの分子量(337.45)とシメチジンの分子量(252.34)を用いてμMに換算した。
SARS-CoV-2に感染したAGMの肺実質にはマスト細胞が増加している?
アフリカミドリザルにSARS-CoV-2をエアゾールで感染させ、臨床症状が進行した後、または試験期間終了後(感染後4週間)に安楽死させた(Blair er al)。 肺の切片をトルイジンブルーで染色し、Zeiss Axio Scan.Z1スライドスキャナー(Carl Zeiss Microscopy, White Plains, NY)でデジタルスキャンした。スライド全体の画像は、デジタル画像解析ソフトウェア「HALO Multiplex IHC v2.1.1」(Indica Labs, Albuquerque, NM)を用いて解析した。肥満細胞は、細胞質内のメタクロマシーの検出により定量化した。メタクロマシー検出の陽性閾値は、陽性対照として肥満細胞腫のスライドを用いて獣医病理学者が設定した。肺切片全体に注釈領域を描き、注釈領域で分析を行った。検出された細胞の総数に対するマスト細胞の割合を報告した。
結果
ファモチジンの作用機序の解析
ファモチジンはSARS-CoV-2プロテアーゼに結合しない
COVID-19の医療対策としてのファモチジンの初期試験は、SARS-CoV-2のパパイン様プロテアーゼ(PLpro)の阻害剤を特定することを目的とした計算分子ドッキングの取り組みから生まれた(Baez-Santos et al 2015,Daczkowski et al 2017)。コロナウイルス由来のパパイン様プロテアーゼ(PLpro)は、ウイルスポリプロテインの処理に加えて、コンセンサス配列LXGGのC末端を切断することで、宿主細胞のタンパク質から細胞内基質であるユビキチンとインターフェロン刺激遺伝子15(ISG15)を除去することが知られており、このプロセスはdeISGylationと呼ばれている(Han et al 2005;Mielech et al 2014)。ここでは、SARS-CoV-2のPLproのISG15に対する酵素反応を用いて、ファモチジンによるPLproの阻害の可能性を評価した。PLproによるISG15のC末端8アミノ酸の切断は、SDS-PAGEで明確に検出された(図1,レーン2および3)。しかし、1-100μMのファモチジンを反応に加えても、アッセイ中に切断されるISG15の量は大きく減少しない(図1,レーン4-6)ことから、ファモチジンはSARS-CoV-2のPLproを阻害しないと考えられる。以前の仮想スクリーニングの報告(Wu C. et al 2020)では、ファモチジンは、主プロテアーゼ(Mpro)としてより一般的に呼ばれる3キモトリプシン様プロテアーゼ(3CLpro)に結合する可能性が示唆されたが、このメカニズムは最近否定された(Anson er al)。
図1 大腸菌から精製したSARS-CoV-2 PLproによるISG15 C-terminal 8アミノ酸の開裂。ISG15をSARS-CoV-2 PLproとインキュベートした(レーン3-6)
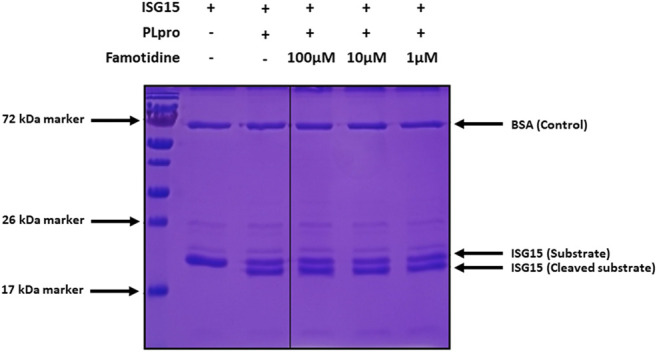
SARS-CoV-2 PLproは4nMで、ISG15は10μMで存在した。レーン4〜6では、ファモチジンをそれぞれ100μM、10μM、1μMとした。コントロールは酵素なし(レーン2)。タンパク質は15% SDS-PAGEで分解し,クーマシーブルーで染色した。マーカータンパク質の分子量はゲルの左側に示した。
ファモチジンはSARS-CoV-2の感染を直接阻害しない
ファモチジンが他の経路でSARS-CoV-2の感染を阻害する可能性を評価するため、Vero E6細胞を用いたアッセイを行い、ファモチジン、レムデシビル、ヒドロキシクロロキンの組織培養感染量(TCID50/mL)の中央値を比較した(図2)。その結果、レムデシビルとヒドロキシクロロキンはいずれも抗ウイルス活性を示したが、ファモチジンではSARS-CoV-2の感染を抑制する効果は認められなかった。
図2 ファモチジンはSARS-CoV-2感染を直接阻害しない
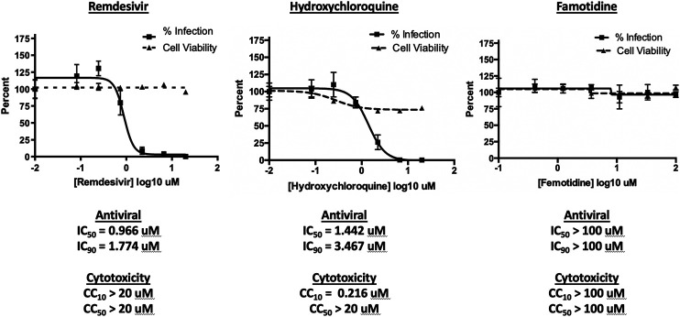
ファモチジンが他の経路でSARS-CoV-2の感染を阻害する可能性を評価するために、Vero E6細胞を用いたアッセイを行い、ファモチジン、レムデシビル、ヒドロキシクロロキンの組織培養感染量(TCID50/mL)の中央値を比較した。方法に記載されているようにVero E6細胞を培養、感染させ、細胞に結合したSARS-CoV-2 NPタンパク質の免疫組織化学的染色を代用して、感染の有無をイメージングサイトメーターでスコアリングした。非特異的細胞毒性(生存率の逆数)は、MTTアッセイを用いて評価した。必要に応じて、感染した上清をTCID50法を用いて感染性ウイルス量を測定した。結果は、テストした医薬品の関数としてのVero E6細胞へのウイルス感染の阻害率、感染した細胞の生存率、50%または90%の複製阻害を達成するために必要な医薬品濃度(それぞれIC50,IC90)および細胞の生存率を10%または50%減少させるために必要な医薬品濃度(CC10,CC50)で表示した。
ヒトの受容体
FamotidineはSigma-1または2受容体結合を介して作用しない
最近、広範囲にわたる研究により、ウイルスと宿主タンパク質の間の相互作用のマップが発表された(Gordon et al 2020)。その中で、シグマ-1およびシグマ-2受容体の調節が抗ウイルス作用を持つことが示された。シグマ受容体とヒスタミン受容体は、抗精神病薬のハロペリドール、抗ヒスタミン薬のアステミゾールやクレマスチン、抗うつ薬のクロミプラミンなど、いくつかのリガンドが共通している。そこで,ファモチジンとシグマ1またはシグマ2受容体との相互作用の可能性を検証した(図3)。クローン化したシグマ受容体を用いて,確立された手順に従って放射性リガンドの競合結合実験を行った(Schmidtら,2016;Alonら,2017)。これらのアッセイにおいて、ファモチジンは、10μMまでのファモチジン濃度で、シグマ-1およびシグマ-2受容体のいずれかに対する放射性リガンドプローブの検出可能な変位を示さなかった。したがって、ファモチジンのシグマ-1およびシグマ-2受容体への結合は、生理学的に適切な濃度では無視できると考えられる。
図3 ファモチジン(青丸)シメチジン(赤四角)およびポジティブコントロールとして強力なシグマ受容体リガンドであるPB-28(緑三角)の競合結合曲線
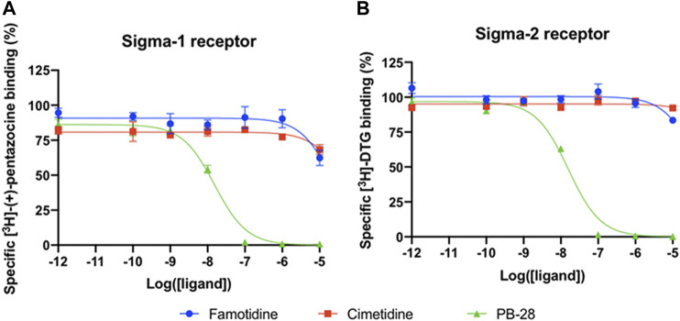
A)シグマ-1を発現させたExpi293膜における[3H](+)-ペンタゾシンの競合曲線。(B) シグマ2(TMEM97)を発現するExpi293膜における[3H]DTGの競合曲線。
ファモチジンは受容体H2に選択的に作用する
よく知られているように(Bertaccini et al 1986年)ファモチジンはヒスタミンH2受容体の選択的遮断剤であり、測定された親和性は約14nMであり、ヒスタミンH2受容体に対するシメチジンの親和性(590nM)よりも実質的に活性である(図4A)。以下に示すように、ファモチジンは33nMの力価を持ち、非常に効果的なインバースアゴニスト活性(基礎活性を75%低下させる)を持つことがデータから明らかになった(図4C)。興味深いことに、シメチジンとは異なり、ファモチジンはGsタンパク質シグナルを遮断するように作用する一方で、実際にはアレスチンのリクルートの部分的なアゴニストとして作用し、効力はヒスタミンの約15%、EC50は105nMであった(図4D)。このことは、この分子がアレスチンのスカフォールドされたシグナル伝達を促進していることを示唆している–例えば、ERK経路を介して(Alonso et al, 2015)アレスチンに偏ったメカニズムにより、受容体の内在化と内在化後のさらなる非正規のシグナル伝達を促進する(Irannejad and von Zastrow, 2014; Jean-Charles er al)。 これらの特徴は、ファモチジンをシメチジンから確実に区別し、他のH2ブロッカーからも潜在的に区別している。GPCRアンタゴニストに対するアレスチンのリクルートをこのように偏って活性化することは、前例がないわけではないが、一般的ではないからである。
図4 ヒスタミン受容体に対するファモチジンとシメチジンの活性

実験は二重に行った。(A) ファモチジンとシメチジンの4つのヒスタミン受容体に対する競合結合の用量反応曲線と参照化合物。B)部分的アゴニストであるファモチジンは、強力な内因性アゴニストであるヒスタミンの存在下で、H2のアンタゴニスト活性を示す。C)ファモチジンとシメチジンのH2に対する逆アゴニスト作用、一方、ヒスタミンはcAMP産生を基底の20倍刺激した(N = 2)。D)ヒスタミン受容体との相互作用によるファモチジン(左)とシメチジン(右)のアレスチンのリクルート。
ファモチジンは他のGPCRを活性化する可能性がある
GPCR-omeの318の受容体に対するファモチジンの活性化をスクリーニングしたところ、基礎上昇の平均倍数が3.0を超えた受容体は、H2を含めて7つだけであった(図5)。いずれの場合も、4重の複製が一致しなかった。H2を除くと、いずれの活性化も追跡調査では再現できなかった。
図5 GPCR-omeの318の受容体を活性化するスクリーン

ファモチジンがヒスタミンH2受容体のインバースアゴニストとしての活性に加えて、他のG-coupled protein受容体(GPCR)を介して作用するかどうかを検証するために、既知のヒトGPCR 318種のそれぞれと相互作用したときのファモチジンの潜在的なアゴニスト活性(最終的に10μM)を検出するスクリーニングアッセイ法を適用した。他の医薬品を用いた先行調査では、このアッセイにおける非特異的シグナルのベースラインを、対応するベースラインの3倍と定義している。ベースラインの3倍以上というスクリーニング基準を満たすGPCRをリストアップした。これらのスクリーニングシグナルはいずれもフォローアップ試験で検証されず、Famotidineは他のヒトGPCRに対してアゴニスト活性を持たないという結論に達した。
ファモチジンは機能的に重要な全身濃度に達するが、シメチジンはそうではない
公表されている薬物動態および生体内分布データ(Lin et al 1987;Yeh et al 1987;Lin、1991)に基づいて、ファモチジンとシメチジンの異なる用量での予測定常濃度を算出した。このモデル化により、COVID-19の患者がファモチジンとシメチジンのどちらを服用したかで臨床結果が異なることは、この2つの薬剤の薬物動態および薬物分布特性の違いによって容易に説明できることが示された。
薬理学的拮抗薬の治療効果を得るためには、その標的の半最大抑制濃度(IC50)を大幅に上回る定常濃度を得ることが必要である。そこで、ファモチジンとシメチジンの相対的な全身作用を評価するために、H2受容体に対する各薬剤のIC50値を、標準的な臨床用量で予測される定常血漿濃度(Css)と比較した。その結果、ファモチジンがH2に結合する際の阻害剤の濃度は、(基質が飽和状態の場合)反応速度が最大反応速度Vmaxの半分となる14nM(Ki)であるのに対し、シメチジンは586nMのKiでH2に結合することがわかった。これまでの報告では、機能的なIC50は約3倍高いとされており、今回の解析にはこれらのデータを用いた(Lin et al 1987;Lin、1991)。これらの報告では、H2受容体を50%阻害するのに必要な阻害剤の総濃度(IC50)は、ファモチジンが13μg/L(0.039μM)シメチジンが400〜780μg/L(1.59〜3.09μM)と報告されている。定常濃度(Css)は、投与量、クリアランス、バイオアベイラビリティ、分布容積などの薬物動態データを用いて算出した(Lin, 1991)。表1にファモチジンとシメチジンのCss値を示す。
表1 ヒスタミンH2受容体拮抗作用におけるファモチジンおよびシメチジンの半最大抑制濃度(IC50)値と比較した、標準的な投与量におけるファモチジンおよびシメチジンの定常状態の濃度(Css)
| IC50またはCss | 濃度(質量/体積) | 濃度(モル濃度) | ||
|---|---|---|---|---|
| ファモチジン | ||||
| IC50ヒスタミンH 2 | 13μg/ l | 0.039μM | ||
| IC50好中球H 2 O 2 -アッセイ | 67μg/ l | 0.201μM | ||
| IC50好中球H 2 cAMPアッセイ | 8μg/ l | 0.024μM | ||
| IC50好酸球H 2 cAMPアッセイ | 53.6μg/ l | 0.158μM | ||
| IC50マスト細胞H 2のcAMP増加 | 決まっていません | |||
| 総濃度(質量/体積) | 総濃度(質量/体積) | 遊離薬物濃度 c (質量/体積) | 遊離薬物濃度 c (モル濃度) | |
| Css(20 mg錠poqd) | 17.7μg/ | 0.053μM | 14.2μg/ l | 0.042μM |
| Css(20 mgカプセルpoqd) | 18.4μg/ l | 0.055μM | 14.7μg/ l | 0.044μM |
| Css(20 mg錠pobid) | 35.4μg/ l | 0.105μM | 28.3μg/ l | 0.084μM |
| Css(20 mgカプセルpobid) | 36.8μg/ l | 0.109μM | 29.4μg/ l | 0.087μM |
| Css(20 mg錠鍋) | 53.1μg/ l | 0.157μM | 42.5μg/ l | 0.126μM |
| Css(20 mgカプセル鍋) | 55.3μg/ l | 0.164μM | 44.2μg/ l | 0.131μM |
| Css(40 mg錠鍋) a | 55.4μg/ l | 0.164μM | 44.3μg/ l | 0.131μM |
| Css(40 mg錠鍋) b | 80.8μg/ l | 0.239μM | 64.6μg/ l | 0.192μM |
| Css(60 mg錠鍋) | 144.3μg/ l | 0.425μM | 115.4μg/ l | 0.340μM |
| Css(8時間ごとに120 mg IV) | 1,290μg/ l | 1.092μM | 1,032μg/ l | 0.874μM |
| シメチジン | ||||
| IC50ヒスタミンH2 | 400〜780μg / l | 1.59〜3.09μM | ||
| Css(200 mg錠poqd) | 175μg/ l | 0.69μM | 140μg/ l | 0.055μM |
| Css(300 mg錠poqd) | 226μg/ l | 0.90μM | 180.1μg/ l | 0.720μM |
a Linら(1987)のpKデータを用いて算出した。
bYehら(1987)のpKデータを用いて計算した。
cファモチジンとシメチジンは、全身循環において約20%のタンパク質と結合する(Somogyi and Gugler, 1983; Echizen and Ishizaki, 1991)。
ヒト初代好中球および好酸球において、ヒスタミンによるH2の活性化は、O2-放出(Gespach and Abita, 1982; Burde et al 1989)血小板活性化因子による走化性(Rabier et al 1989)ロイコトリエン生合成などの好中球エフェクター機能を阻害する(Flamand er al)。 好酸球の機能もH2の活性化によって阻害される。ヒスタミンの結合は好酸球ペルオキシダーゼの放出を減少させ(Ezeamuzie and Philips, 2000)、高濃度では好酸球の走化性を阻害する(Clark et al 1975; Wadee et al 1980)。ファモチジンは、好中球および好酸球に対するこれらのH2を介したヒスタミン作用の最も効果的なアンタゴニストの一つである(Reher er al)。 また、これらの表現型に関連する2つの指標のIC50を表1に示する。マスト細胞はヒスタミンH2およびH4受容体を発現しており、ヒスタミンによるマスト細胞のcAMPの増加はファモチジンによって阻害される(Lippert er al 2004)。10μMのファモチジンをプレインキュベートすると、ヒト皮膚マスト細胞におけるヒスタミン誘発cAMP上昇が阻害されるが、この効果のIC50は決定されていない(Lippert er al)。
すべての投与法において、ファモチジンのCssはH2受容体の一般的なIC50値を超え、20mgおよび40mgの1日2回投与(b.i.d.)および1日3回投与(t.i.d.)では、未結合のファモチジンのCssはH2 IC50の2~5倍となった。また、臨床試験NCT04370262で現在投与されている静脈内投与量のCssを計算してまとめたところ、その投与量はファモチジンのIC50を20倍以上上回った。一方、シメチジンの標準的な投与量である1日200または300mg(q.d.)では、Cssは報告されているIC50の範囲である400〜780μg/lの数分の1にとどまる。
SARS-CoV-2感染アフリカン・グリーン・マカクの肺実質におけるマスト細胞密度の比較分析
SARS-CoV-2感染アフリカミドリザル(AGM)の肺実質へのマスト細胞の浸潤に関する研究をまとめた画像とデータを図6に示した。パネルA(倍率20倍)に示すように、ナイーブなAGMの肺実質では、マスト細胞(矢印)は肺胞間質内にほとんど観察されない。パネルBおよびC(20倍)では、軽度(B)および重度(C)の肺炎を発症したSARS-CoV-2感染AGMの間質内にマスト細胞(矢印)の増加が見られる。パネルDは、SARS-CoV-2に感染したAGMの全葉において、マスト細胞が全細胞に占める割合が、ナイーブな対照組織と比較して上昇していることを示している。
図6 SARS-CoV-2に感染したアフリカミドリザル(AGM)の肺実質へのマスト細胞の浸潤

20倍に拡大。トルイジンブルー染色。RA:右前、RM:右中、RI:右中、RL:右下、LL:左下。
症例報告、重度のCOVID-19 ファモチジンによる外来治療
患者JMは47歳の男性で、8日後に下痢、腹部の痙攣、噯気、元気のなさ、乾いた咳、関節痛、筋肉痛、異臭、加齢臭を訴え、COVID-19のPCR診断を受けた。高血圧症(10年)II型糖尿病(4年)高コレステロール血症(3年)痛風(10)の既往歴がある。現在の投薬はメトホルミン、アロプリノール、リシノプリル、アトルバスタチンなど。本人は来院した病院で病院のメンテナンスを担当している。
同一世帯の息子が12日前にCOVID-19症状を発症していたことが判明した。8日目に外来患者の鼻腔内ぬぐい液からPCR法による陽性診断を受けたところ、発熱(102度)寝汗、息切れ、胸部圧迫感が出現した。ファモチジン(「PEPCID AC ®」60 mg p.o. t.i.d. = 2.24 mg/ft2 t.i.d.)は、症状が重度のCOVID-19のFDA基準に合致し、リスクの高い既往症を併発していたため、PCR診断を受けた時点で投与を開始した。ファモチジンの投与は30日間継続された。夜間にファモチジンを投与したところ、患者は一晩中眠ることができ、胸部圧迫感の完全な緩和、咳の減少を報告したが、発熱(101.6°F)が続いた。
10日目、患者は、下痢、腹部の痙攣、吐き気、元気のなさ、乾いた咳、関節痛、筋肉痛、異臭と年齢差、労作時の息切れを引き続き訴え、救急外来を受診した。10日目の身体検査では、胸部を含めて異常はなく、バイタルサインも正常であった。患者の体格指数(BMI)は36(デュボワBSA 26.78 ft2)であった。SpO2は93%で、その後30分かけて鼻腔カニューレによる3L/minで97%と99%に上昇した。SARS-CoV-2 の rtPCR 診断分析のために鼻腔内サンプルを採取した。包括的な代謝パネルでは、血清ナトリウムと塩化物の軽度の減少と高血糖(260 mg/dl)が認められた。全血球数(CBC)は正常で、特にリンパ球数は正常であった。尿検査では、比重が1.025であったが、その他は正常であった。ポータブル胸部X線検査では、吸気性が悪かったが、COVID-19に一致する「胸部空洞疾患」が認められたと解釈された(図7,胸部X線検査[CXR]10日目)。患者は脱水症状と診断され、オンダンセトロンの静脈内投与、正常食塩水1Lの静脈内投与が行われ、病院のパルスオキシメーターを装着して自宅に退院した。退院時のSpO2は室内空気で94%であり、歩行しても低下しなかった。
図7 ase Study JM: CXR and Timeline.

症状開始から8日目にファモチジン(60mg PO tid)を開始した。30日間継続された。50日目の時点でもアノスミア(嗅覚脱失)とエイジスミアが残っている。
この患者は、15日目にシャワーを浴びているときに近距離失神を起こし、再び救急外来を受診した。身体検査に異常はなかった。バイタルサインは正常であった。SpO2は2時間の間に室内空気で98,93,97%を示した。基礎代謝パネルでは、高血糖(266mg/dl)のみが認められた。CBCは、軽度のリンパ球減少(0.96,基準範囲1.00~3.00×103/μL)と軽度の単球増加(0.87,0.20~0.80×103/μL)を除いて正常であった。胸部X線検査では、「両側の肺底部にかすかな斑状の圧密が見られ、左下の肺底部は以前に比べて最小限に改善していると思われる」と解釈された(図6 CXR 15日目)。この患者にはアジスロマイシンが投与され、自宅に退院した。
初発から 27日目と28日目に鼻腔内スワブを用いたPCR検査でSARS-CoV-2核酸が陰性となり(2回連続)初発から31日目に地元病院での仕事に復帰した。COVID-19症状を初めて発症してから47日後、彼は引き続き味覚や嗅覚の欠如を指摘しているが、それ以外はCOVID-19からほぼ回復していると考えている(図7のタイムライン)。
この患者は、FDAの重症COVID-19の基準を満たしており、COVID-19の危険因子である男性、47歳、高血圧、肥満(Divoux et al 2012年)2型糖尿病があるため、ファモチジンの使用が推奨された。これは逸話的な例であるが、この患者はファモチジンの使用を開始すると一晩で症状が緩和された。因果関係を証明するのに十分ではないが、この症例はCOVID-19の典型的な症状の背景を示しており、また、外来患者を対象としたファモチジン治療の臨床試験を十分にコントロールする必要性を示唆している。
考察
ファモチジンは特許切れの医薬品であり、先発医薬品(PEPCID®)およびジェネリック医薬品として、錠剤、カプセル剤、点滴静注剤がある。ファモチジンの一般的な薬理作用はよく知られており、優れた吸収、分布、代謝、排泄、毒性プロファイルを持っている(FDA, 1986)。ファモチジンは、H2受容体拮抗薬(およびインバースアゴニスト)であるという点で、現在COVID-19の治療薬として試験されている薬剤の中でもユニークである。現在、ファモチジンは、COVID-19の治療薬として、ヒドロキシクロロキンまたはレムデシビルのいずれかと併用して高用量の静脈内投与を行う二重盲検無作為化臨床試験が行われている(ClinicalTrials.gov Identifier: NCT04370262)。入院中のCOVID-19患者1,620名を対象としたレトロスペクティブコホート研究によると、入院中にファモチジン(経口または静脈内投与、1日20mgまたは40mg)を投与された84名の傾向スコアマッチ患者は、死亡または挿管のリスクが統計学的に有意に減少し(調整ハザード比(aHR)0.42,95%CI 0.21-0.85)さらに死亡のみのリスクも減少した(aHR 0.30,95%CI 0.11-0.80)(Freedberg et al 2020)。その後のファモチジン/COVID-19のレトロスペクティブデータ解析報告は、効果なしと報告したもの(Cheung et al 2020,Shoaibi et al 2020,Yeramaneni et al 2020)から、様々なレベルの保護効果を報告したもの(Mather et al 2020)まで、はっきりしていない。これらのレトロスペクティブ研究では、ファモチジンの投与量が報告されているが、すべてのケースで、その投与量は報告されていないか(Cheung er al 2020)胃食道逆流症(GERD)の緩和のための標準的な投与量が主となっている。高用量のファモチジン(60-80mgを1日3-4回経口投与)を対象としたレトロスペクティブな研究はこれまでに報告されていない。シメチジンやプロトンポンプ阻害剤では同様の効果が得られないのに、ファモチジンではCOVID-19による死亡率が抑えられたという逸話的な報告や非公開データから、ファモチジンの有益な効果は、既知のオンターゲット活性とは関係ないのではないかと最初に推測された(Borrell, 2020)。しかし、本報告書などに詳細に記載されている研究によると、ファモチジンは、主要なSARS-CoV-2プロテアーゼ(PLproまたはMpro)のいずれかを直接阻害して作用するものではないことが示されている(Anson et al 2020)。Vero E6ベースの細胞アッセイでも、H2を発現する細胞での抗ウイルス活性は検証されていないが、この細胞株ではファモチジンは直接抗ウイルス活性を持たないことが示されている。また、ファモチジンがシグマ-1または-2受容体に結合して作用するという仮説は、ここにまとめた研究では支持されなかった。
COVID-19治療薬としてのファモチジンの明らかな活性を説明する最も簡単な方法は、ファモチジンがヒスタミン受容体H2に結合することにより、ヒスタミンシグナル伝達の拮抗または逆拮抗、およびアレスチンの偏った活性化を介して作用するというものである。もしそうであれば、COVID-19を発症するSARS-CoV-2感染は、少なくとも部分的には病的なヒスタミン放出を介していると推察するのが妥当であろう。H2アンタゴニストであるシメチジンを経口投与しても予防効果が得られないという逸話は、経口投与後の全身の薬物濃度が不十分であることで説明でき、ファモチジンのH2結合による潜在的な効果を否定するものではない。十分な量のシメチジンを静脈内投与すれば、臨床的に有効なレベルに達する可能性があり、この仮説はさらに支持されるだろう。シメチジンでCOVID-19の臨床効果が得られなかったことは、ファモチジンのインバースアゴニズムまたは他のGPCRを介した効果が、(予備的に)観察された臨床効果に重要な役割を果たしていることを示しているのかもしれない。ヒスタミン受容体競合試験におけるファモチジンの活性を分析した結果、試験対象となる臨床的定常状態のファモチジンの薬物レベルの範囲では、ファモチジンはH2に特異的であることが示された。したがって、ヒスタミンH1受容体、H3受容体、H4受容体のオフターゲットアンタゴニズムがファモチジンを介した効果に寄与する可能性は低いと考えられる。
H2拮抗(および逆作動)を引き起こすのに十分な定常状態のファモチジン濃度は、安価な経口錠剤と安全な投与量で容易に達成できる。上述のように、COVID-19の結果に対するファモチジンの効果を検討した現在入手可能なレトロスペクティブな病院研究で採用されているファモチジンの投与量は、H2受容体でヒスタミンが介在する全身作用を完全に阻害する可能性が低いレベル(1日20-40mg)であると考えられる(Freedberg et al 2020)。一方、NCT04370262試験では、H2の拮抗作用のIC50よりも20倍以上多い量のファモチジンを血管内投与している。COVID-19の治療のために高用量のファモチジンを含む他の前向き無作為化臨床試験が進行中である[Samimagham et al 2020)NCT NCT04504240]。今回発表されたデータは、ファモチジンの用量選択の根拠となるものであり、全身のH2拮抗作用のIC50の合理的な倍数で定常状態の濃度を維持し、最大のH2標的効果を確保するには、8時間ごとに40mg~8時間ごとに80mgの錠剤を経口投与することで十分であることを示している。ファモチジンは主に腎臓で排泄されるため、高用量の投与には十分な腎機能が必要である(FDA, 1986)。
ファモチジンは、H2拮抗作用に加えて、インバースアゴニストとして作用し、サイクリックアデノシン一リン酸(c-AMP)の濃度を低下させる可能性がある(Alonso er al)。 内皮細胞の伝染性は、ヒスタミンH2の活性化に起因しており、ファモチジンの前処理によって鈍化する(Luo er al)。 ヒスタミン、ブラジキニンおよびデスアルグ・ブラジキニン受容体の係合は、AKT-1の活性化をもたらす共通の経路を介して内皮伝染性の増加をもたらすことができる(Di Lorenzo et al 2009)。また、H2受容体は、Gq/11タンパク質を介してシグナルを発し、その結果、イノシトールリン酸が形成され、細胞質のCa2+濃度が上昇して、内皮細胞液伝染性の増加を説明することができる(Panula er al)。
1つの代替仮説として、ファモチジンはH2受容体を介したシグナル伝達を阻害するだけでなく、DABKおよびDAKDリガンドに対する内皮細胞の反応を緩和するキニンB1受容体とのクロストークにも関与しているのではないかと考えられる。しかし、今回のデータはこの仮説と一致していない。4回繰り返したTANGOアッセイでは、ブラジキニン受容体B1およびB2の活性化は観察されなかった。
もう一つの仮説は、ファモチジンが好中球の活性化に対する感受性を緩和し、細胞外トラップを生成するというものである(Radermecker et al 2020)。剖検では、COVID-19の微小血管血栓は多数の好中球を示しており、現在ではオーバーシュート、グローバルな好中球の活性化が重症・重篤に存在することが示されている。
COVID-19(Nicolai et al 2020,Radermecker et al 2020)。過剰に活性化された好中球と強化された好中球細胞外トラップ(NETS)は、その後、肺、腎臓、心臓の検体で確認されたNET様構造で機能している。活性酸素種はNETosisに重要であり、これらの効果はファモチジンやシメチジンを含むヒスタミンH2ブロッカーによって少なくとも部分的に緩和される(Mikawa er al)1999)。これまでのファモチジンの薬理学的研究では、好中球の細胞内カルシウム濃度が用量依存的に減衰し、高用量では活性酸素種が減衰することが示されている[詳細はTomera and Kittah (2020b)を参照]。これは、HDファモチジンを投与すると、Dダイマーの上昇や肺塞栓症が標準的な抗凝固療法に反応するようになるという臨床観察結果を説明するものである(Tomera and Kittah, 2020a; Radermecker er al)。
COVID-19の症状は多臓器に影響を及ぼすが、急性呼吸窮迫症候群(ARDS)による呼吸不全が最も一般的な死因である。肺の構造と機能に寄与する細胞のRNA発現プロファイルを調べると、肺にはSARS-CoV-2の感染に感受性のある複数のACE2/TMPRSS2陽性細胞タイプが存在することが明らかになった。さらに、ヒスタミン受容体H1およびH2が陽性であるこれらの肺細胞やその他の関連細胞は、マスト細胞の脱顆粒後の局所的なヒスタミン放出に反応する可能性があり(Krystel-Whittemore er al 2015)したがって、H2陽性の細胞はファモチジンの効果に反応する可能性がある。
ファモチジンがどのように肺の症状を軽減するかを理解するには、COVID-19の肺の病態生理を理解する必要があるが、COVID-19には2つの主要な病相があると考えられている。そのためには、肺の組織や細胞の種類を理解する必要がある。肺水腫は、図8に示したように、肺胞内のいくつかのレベルで起こる流体移動の調節機能が失われることによって生じる。毛細血管の壁には、グリコカリックス、タイトジャンクションを持つ内皮細胞、そして基底膜がある。上皮には、II型肺細胞が製造・分泌する肺胞内腔液上の界面活性剤層があり、I型肺細胞自身は、タイトジャンクションとアルブミンを制限する負電荷を帯びた基底膜を持つ。末端導管気道領域に存在する肺周皮細胞は、内皮基底膜を合成し、前毛細動脈、毛細血管、後毛細静脈の血流を調節する重要な役割を果たしている。これらの細胞や層のいずれかが破壊されると、浮腫が生じる。この浮腫液は、軽度の機能障害では経血であり、炎症や壊死が起こると滲出液となる。肺胞壁や肺胞腔の浮腫を引き起こす可能性のある病態としては、SARS-CoV-2による細胞の感染や、細胞や基底膜の機能、糖衣やタイトジャンクションの完全性に影響を与える何百もの化合物を放出するマストセルの脱顆粒などがある。これらの化合物には、ヒスタミン、ブラジキニン、ヘパリン、トリプターゼ、サイトカインなどがある。
図8 細胞の相互作用とガス交換

肺胞の関連する細胞および組織のミクロ解剖を示す模式図。肺水腫は、毛細血管壁成分、サーファクタント、I型およびII型肺細胞、および内皮基底膜を合成し、ヒスタミンや他のシグナル分子に対する収縮・弛緩反応を介して前毛細動脈、毛細血管、後毛細静脈の血流を制御するヒスタミン応答性収縮細胞である肺周皮細胞など、肺胞内のいくつかのレベルで起こる体液移動の調節機能の喪失に起因する。
これらの肺細胞の遺伝子発現パターンから、どの細胞が感染する可能性が高いか、また、ファモチジンの投与やその結果生じるH2拮抗作用または逆作動作用によって直接影響を受ける可能性のあるH2受容体を発現しているかがわかる(図9)。これらのパターンは、上皮細胞および内皮細胞におけるACE2およびTMPRSS2の発現パターンに基づいて、これらの細胞タイプが感染する可能性が高いことを示唆している。ファモチジン効果を発揮しやすい細胞としては、2型肺細胞、平滑筋細胞、周皮細胞、ミエロイド顆粒球(マスト細胞、好中球、好酸球を含む)などが挙げられる。
図9 LunGENSウェブポータル(Du et al 2015)から 100万分の1転写産物(TPM)に正規化したヒト単細胞肺遺伝子発現

アンジオテンシン変換酵素2(ACE2:黒)膜貫通型プロテアーゼ、セリン2(TMPRSS2:オレンジ)ヒスタミン受容体H1(青)H2(緑)H4(黄)のDropseq PND1実験によるシングルセル肺遺伝子発現パターン。
初期のCOVID-19症例から得られた限られた組織病理は、ウイルス感染と肺でのヒスタミン作用の両方を支持しているように思われる。Sufang Tian et al 2020b)は、初期のCOVID-19に関する特異な研究として、癌のために切除された組織における初期のCOVID-19のウイルス性肺病理について述べている。彼らの写真顕微鏡写真は、2つの異なる病状パターンを示している。図9パネルBに示すように、この肺組織のいくつかのサンプルは、ウイルス感染に関連する間質性肺炎とフィブリン性滲出液の通常の単核性炎症パターンを示している。この炎症性浸潤に好中球や好酸球が見られないのは注目に値する。好中球のH2活性化は、O2放出(Gespach and Abita, 1982; Burde et al 1989)血小板活性化因子による走化性(Rabier et al 1989)ロイコトリエン生合成(Flamand et al 2004)などの好中球エフェクター機能を阻害するという説明がある。好酸球の機能もH2の活性化によって阻害される。ヒスタミンの結合は好酸球ペルオキシダーゼの放出を減少させ(Ezeamuzie and Philips, 2000)、高濃度では好酸球の走化性を阻害する(Clark et al 1975; Wadee et al 1980)。
(Tian et al 2020b)および(Zeng et al 2020)の報告には、間質および肺胞の浮腫がある一方で、肺胞隔壁が正常な構造を維持している画像も含まれている(図10パネルA)。これは、炎症がなく、液体が滲出液のように見えるため、ウイルス感染で典型的に観察されるパターンではない。これは、ヒスタミンや他のマスト細胞産物が内皮細胞、周皮細胞、II型肺細胞に作用することによる体液バリアーの調節障害と一致する。ヒスタミンによる内皮の伝染性の増加は、H1受容体の活性化によって引き起こされるため、これらの細胞に対するファモチジンの治療効果の可能性があるとすれば、それはマスト細胞の脱顆粒の阻害による間接的なものである可能性が高い。フォルスコリンは、アデニルシクラーゼという酵素を活性化し、細胞内のcAMPレベルを上昇させ、ヒト好塩基球およびマスト細胞からのヒスタミン放出を抑制することができる(Marone et al 1986)。ヒスタミンは、マスト細胞のサイトカインやTNF-aの放出をPGE2依存的に制御するオートクラインレギュレータとして作用する可能性がある。試験管内試験の研究によると、このオートクラインフィードバックはH2とH3によって媒介されているようだ。また、内皮細胞はSARS-CoV-2の感染を受けやすい。肥満細胞の脱顆粒による肺水腫は、初期の無症候性低酸素状態や、息切れを伴う高コンプライアンスの非ARDS換気パターンと相関している可能性がある(Couzin-Frankel, 2020)。図10パネルBの画像では、微小血管血栓の評価ができない。
図10 初期COVID-19の肺病理

COVID-19初期の肺の病理組織で、正常な構造を維持している肺胞隔壁とともに、間質および肺胞の浮腫の非典型的なウイルス病理パターンを示している。ウイルス性肺炎にしては珍しく、COVID-19疾患の初期に切除されたこの症例では、炎症が見られず、溜まった液体は滲出液のように見える。
腺癌のために右中葉(RML)を切除した84歳の女性。入院6日目のCTスキャンでは、腫瘍塊に加えて、RMLにGGO(ground glass opacity)が認められた。12日目に肺葉切除を実施。13日目(術後1日目)のCTスキャンでは、両側の胸部にGGOが認められた。16日目に、咳、呼吸困難、胸部圧迫感を伴う典型的なCOVID-19症状を発症した。毛細血管の酸素飽和度は77-88%であった。29日目に死亡した。鼻腔ぬぐい液によりSARS-CoV-2が確認された(Tian er al 2020b)。
パネルA(RML)。滲出液に一致する広範な肺水腫がある(開いた黒星)。肺胞隔壁は正常に見え、炎症は見られない(青の開矢印)。感染症を示唆する特徴はない。
パネルB(RML)。肺胞腔内に線維性の滲出液が見られる(赤の開星)。肺胞隔壁には浮腫と単核球の浸潤が見られる(黒実線の矢印)。好中球は認められない。ARDSの顕著なびまん性肺胞障害は見られない。間質性ウイルス性肺炎の典型的な特徴である。
これらの所見は、COVID-19の症状が現れてから5日後に死亡した患者の別の剖検症例報告でも支持されている。この症例でも、顕微鏡写真には非炎症性の経水性タイプの浮腫が見られた(Schweitzer et al 2020)。これらの研究の両方において、初期段階のCOVID-19肺疾患において観察された非炎症性浮腫は、マスト細胞によるヒスタミン放出と一致する。
肥満細胞の脱顆粒は、機能的にも臨床的にも異なる初期と後期の段階を経て進行するCOVID-19の自然史と相関している。SARS-CoV-2感染症の多くは、下気道ウイルスの典型的な初期段階のパターンに従っており、大多数の患者は無症候性または軽症であるが、少数の患者は後期段階の急性呼吸窮迫症候群(ARDS)に移行する。COVID-19は、重症のウイルス疾患に典型的なこのスペクトルの中で、いくつかの特徴を持っている。外来では、初期のCOVID-19は通常、他の「インフルエンザ様疾患」と区別がつかず、喉の痛み、頭痛、下痢から発熱、咳、筋肉痛まで様々な非特異的症状を呈する。しかし、この最初の数日間は、COVID-2特有の特徴である無嗅覚症を伴うこともある(Eliezer et al 2020)。COVID-19の患者が息切れ(SOB)を起こすのは、症状が出始めた最初の1週間の終わり頃である。これは、他のウイルスには見られない特徴である(Cohen er al 2020)。SOBを発症したCOVID-19患者の身体検査では、労作時に酸素飽和度が劇的に低下する。CTスキャンでは、通常、肺水腫に一致する両側の胸骨部 ground glass opacificationが見られる。鼻咽頭ぬぐい液は SARS-CoV-19 に陽性である。このSOBは、正常に近いコンプライアンス(すなわち、50 mLcmH2O以上)を伴う低酸素症の独特の臨床表現型と相関している。この原因の一つとして、周皮細胞や血管平滑筋のH2受容体に対するヒスタミンの作用が考えられている。また、H1関連の浮腫や肺血管の微小血栓症も原因となりうる。このような患者はPEEP換気を行っても、肺胞の確保ができないため、助けにならない患者である。このような患者には、うつ伏せになることが有効である(Gattinoni et al 2020)。この段階では、その後の重篤な合併症、特に人工呼吸が必要となった場合に60~80%の死亡率となるARDSに進行するリスクが最も高くなる。また、虚血性脳卒中などの神経症状や合併症が加わることもある(Filatov et al 2020,Mao et al 2020,Qureshi et al 2020)。後のCOVID-19の心臓合併症には、心筋炎、急性心筋梗塞、心不全、不整脈、および静脈血栓塞栓イベントが含まれる(Long et al 2020;Mahmud et al 2020)。
複数の研究により、入院を必要とするCOVID-19患者では凝固性亢進状態にあることが示されている。最近の大規模な剖検研究の結果によると、小血管微小血栓症として現れる新規の肺中心の凝固障害も存在することが示唆されている。この研究に基づくと、COVID-19で死亡した患者の50%以上に肺微小血栓症があることが示唆されている(Carsana er al 2020)。この血栓症は動脈血管だけでなく、図11に見られるように、炎症やARDSがない場合には肺胞毛細血管にも見られる(Magro er al 2020)。
図11 剖検時のCOVID-19の肺微小血管における微小血栓症(Magro er al 2020)

毛細血管の広範なフィブリン性閉塞による肺胞隔壁の拡大がある(開いた黒矢印)。赤血球の浸出を伴う肺胞腔の浮腫が見られる。隔壁には軽度の単核球浸潤が見られる。肺胞浮腫には血液と同程度の好中球が認められる。
フィブリンの沈着と赤血球の浸出を伴う毛細血管壁の破壊、隔壁と肺胞腔内に好中球を認める(ヘマトキシリン・エオジン、1000×)。COVID-19に伴う微小血管凝固については、(Magro er al 2020)を参照のこと。
小さな微小血栓は、ヨード化された造影剤を用いてもCTスキャンで識別することが難しいため(Oudkerk er al 2020)死前の診断は困難である。実験室での凝固検査では、通常、プロトロンビン時間(PT)および活性化部分トロンボプラスチン時間(aPTT)が正常または軽度に延長し、血小板数が正常から増加またはわずかに減少し、フィブリノーゲンレベルが上昇し、D-ダイマーが非常に上昇する(Panigada et al 2020)。一部の著者はDIC様の状態と称しているが、この肺微小血栓症は、顕在化したDICに典型的な凝固因子消費性出血状態としては現れず、むしろ凝固性亢進血栓症に近い状態である。COVID-19では、D-ダイマーの上昇が予後不良と相関し、IL-6やCRPの上昇も見られることから、この凝固性血栓症がCOVID-19の中核的な病態であると考えられる。ある研究では、IL-6レベルがフィブリノゲンレベルと相関しており、おそらく急性期反応を介していると考えられている(Ranucci er al 2020)。COVID-19における肺の微小血栓症の病因は不明である。この所見に関する複数の作業仮説が現在評価されている(Ackermann er al 2020)。血管内皮グリコカリックスの損傷は、TNF-α、虚血、細菌のリポポリサッカライドによって引き起こされる可能性がある。同様に、活性化したマスト細胞はサイトカイン、プロテアーゼ、ヒスタミン、ヘパリナーゼを放出し、グリコカリックスを劣化させ(Alphonsus and Rodseth, 2014)それによって微小血栓症の原因となる可能性がある。グリコカリックスが破壊されると、内皮細胞の接着分子が露出し、さらなる炎症、白血球や血小板のローリングや接着を誘発する(Becker er al 2010)。血清中で測定された糖衣成分は、敗血症患者の死亡率上昇と正の相関がある(Nelson er al)。 凝固性亢進の他の原因としては、ウイルスの侵入によるACE2陽性内皮細胞への直接的なダメージや、感染症に対する炎症反応による二次的なダメージが挙げられる。マスト細胞はヘパリンを放出して接触系を活性化し、プラスミンとブラジキニンを産生する。プラスミンの活性化は、D-ダイマーレベルの特異的な上昇を説明することができる。血小板の活性化も、血栓炎症反応の一部として考えられるが、血栓形成における正確な役割はまだ解明されていない(Jackson et al 2019)。より完全な理解には、さらなる研究が待たれる。
初期のCOVID-19は、ウイルス感染症の通常の特徴に加えて、無嗅覚症、加齢臭、痒みや蕁麻疹を含む皮膚の発疹、神経精神症状(夢の状態の変化を含む)無症候性低酸素症を呈することが多い。これらの症状はすべてヒスタミンシグナルと一致している。アノスミア(嗅覚脱失)、エイジスミア、および悪液質に関連する他の症状は、COVID-19およびマスト細胞脱顆粒症候群の両方でしばしば報告されており、悪液質の病態生理を推進する上でのヒスタミンシグナル伝達の潜在的な役割がレビューされている(Becker et al 2012,Zwickl et al 2019)。図12にまとめたように、血液凝固異常、他の臓器系への関与、ARDSという特徴的な後期所見は、症状出現後2週目に発生する。これは、SARS-CoV-2抗原に対する免疫グロブリン反応の上昇と一致している。一部の患者では、7~10日目に病状が突然悪化することがあり、これはSARS-CoV-2スパイクタンパクの中和抗体価の上昇と相関している(Suthar er al)。 この研究では、IgGが症状発生後4日以内に上昇し始めることが示されており、最初の抗原曝露とは矛盾している(Suthar er al)。 SARS-CoV-2への曝露後7日以内に始まる特異的中和抗体反応の急速な開始は、一次B細胞反応ではなくリコールを示唆しており、したがって、反応は既存の記憶細胞集団によって駆動されている。SARS-CoV-2に反応するCD4+T細胞は、非曝露者の約40-60%から検出されており、循環している「普通の風邪」コロナウイルスとSARS-CoV-2の間の交差反応性T細胞の認識を示唆している(Grifoni er al)。 これらの記憶細胞は、以前に別のコロナウイルス(例えば、循環している英数字のコロナウイルス)にさらされたことで教育された可能性があり、COVID-19の病気の進行の第二段階がデング出血熱と免疫学的基盤を共有しているのではないかという懸念が生じている(Mongkolsapaya et al 2003)。もし、既存の交差反応性IgE「感冒」抗体および/または関連するメモリーB細胞集団が存在するならば、マスト細胞の脱顆粒の機能不全を説明するのに役立つかもしれないし、そうでなければ、悪化させるかもしれない。この初期の急速な体液性反応から産生された抗体は、さらに肥満細胞の脱顆粒を促進する可能性がある。この段階では、D-ダイマーの上昇は、CRPやIL-6の測定値と同様に、予後の悪さと相関している。
図12 COVID-19の自然史
(Oudkerk et al 2020)より改変
現在のレビューでは、COVID-19の臨床および病理学的所見を、マスト細胞の活性化と脱顆粒の潜在的な役割を考慮していない、抗ウイルス自然免疫反応と適応免疫反応の標準モデルに基づいて説明しようとしている。レビューでは、単球、マクロファージ(Merad and Martin, 2020)適応T細胞およびB細胞のヘルパーおよびエフェクター反応に関連する炎症細胞反応カスケードが強調されている(Vabret er al)。 これらのタイプの免疫反応は、COVID-19に関連する新しい微小血管性肺血管内凝固症候群を説明するためにも呼び出される(McGonagle et al 2020)。
我々は別のパラダイムを提案する。SARS-CoV-2感染によるマスト細胞の活性化は、COVID-19に関連する中核的な病理カスケードの一部と異常な症状の多くを説明できるだろう(Kritas er al)。 COVID-19の初期段階で観察された特異な臨床症状の多くは、ヒスタミン放出の既知の効果と一致している(Conti er al 2020)。ヒスタミンは、PGE2依存的にマスト細胞サイトカインおよびTNF-a放出のオートクライン調節因子として作用する可能性があり、試験管内試験の研究に基づくと、オートクラインフィードバックはH2およびH3によって媒介されるようである(Bissonnette、1996)。このモデルは、手術や剖検で見られる病理組織学的所見と一致しており、ファモチジンを用いたヒスタミンH2受容体遮断の潜在的な効果を示唆する臨床薬理学的所見によっても支持されている。また、このモデルは、COVID-19感染症の初期段階の臨床症状と肥満細胞活性化症候群(MCAS)の臨床症状が大きく重なること(Afrin et al 2020,Butterfield 2020,Weiler 2020,Weinstockら。2020)さらにCOVID-19の後期段階におけるデング出血熱やショック症候群(T細胞枯渇を含む)との類似性も指摘されている(Mongkolsapaya et al 2003;Guzman and Harris 2015;Redoni et al 2020)。COVID-19に関連する心臓イベント、脳卒中、および関連する転帰は、Kounis症候群とも一致するようである(Gonzalez-de-Olano et al 2011,Kounis 2016,Kounis et al 2020)。この仮説は、SARS-CoV-2感染AGMの肺胞隔壁および肺実質、ならびにCOVID-19患者の肺胞隔壁においてマスト細胞の数が増加しているという本明細書の所見によって支持される(Motta Junior er al 2020)。
COVID-19がマスト細胞の脱顆粒の機能不全によって部分的に駆動されるのであれば、マスト細胞関連の障害を治療するのに有用な市販薬を採用した様々な医療介入が、SARS-CoV-2感染に関連する死亡や疾患の軽減に役立つ可能性がある。例としては、β2アドレナリン受容体拮抗薬(Scola et al 2004)やクロモリンナトリウム(Zhang et al 2016;Han et al 2016)などのマスト細胞安定化活性を有する薬剤、他のヒスタミン拮抗薬(例えば、H1型およびH4型)(Okayama et al 1994;Maroneら、。2003; Hogan et al 2020)ロイコトリエン拮抗薬およびロイコトリエン受容体拮抗薬(Fidan and Aydogdu, 2020)炎症性腸疾患のために開発されたような抗炎症剤、およびマスト細胞活性化阻害剤(Castells and Butterfield, 2019; Theoharides er al)。 このような再利用医薬品を、SARS-CoV-2の感染や複製を直接阻害する医薬品と組み合わせて使用すれば、安全で効果的なSARS-CoV-2ワクチンが利用可能になるまでの間、COVID-19を予防または治療するための強力で安全かつ効果的な外来治療薬を迅速に開発することができるかもしれない。
表2 検証した複数の作業仮説の概要
| 仮説 | テストアプローチ | 結果 |
|---|---|---|
| ファモチジンはSARS-CoV-2Pl-Proに結合するか、さもなければ阻害することによって作用しますか? | 直接PL-pro結合アッセイ | 仮説を拒否する |
| ファモチジンはSARS-CoV-2M-Proに結合するか、さもなければ阻害することによって作用しますか? | 文献レビュー、先行研究 | 仮説を拒否する |
| ファモチジンはベロ細胞におけるSARS-CoV-2感染または複製を直接阻害しますか? | TCID-50ウイルス阻害アッセイ | 仮説を拒否する |
| ファモチジンはシグマ1または2受容体への結合を介して作用しますか | シグマ-1およびシグマ-2競合結合アッセイ | 仮説を拒否する |
| ファモチジンはヒスタミンH2GPCRに選択的ですか?ファモチジンは、ヒスタミンH2 GPCR以外のG共役型タンパク質受容体(GPCR)が関与するオフターゲット活性を介して作用しますか? | GPCRomeスクリーニング | 仮説を拒否する |
| ファモチジンはヒスタミンH2GPCRに選択的ですか?ファモチジンは、ヒスタミンH1、H2、H3、またはH4 GPCR受容体を遮断することによって作用しますか(拮抗薬または逆作動薬)? | GloSensorcAMPアッセイ | ヒスタミンH1GPCRの仮説を拒否する |
| ヒスタミンH2GPCRの仮説を受け入れる | ||
| ヒスタミンH3GPCRの仮説を拒否する | ||
| ヒスタミンH4GPCRの仮説を拒否する | ||
| 標準的なGERD用量でのヒスタミンH2遮断薬シメチジンの有益な臨床COVID-19活性の報告された欠如は、ファモチジンのヒスタミンH2受容体MOAに反論しますか? | 比較薬物動態分析 | 仮説を拒否します。シメチジンのGERD用量は、既知の組織H2受容体標的を遮断するのに十分な全身血中および組織レベルを提供しません |
| 標準的なGERD用量のファモチジンは、有益な臨床COVID-19活性に十分な全身薬レベルを達成していますか? | 薬物動態分析と文献レビュー | 仮説を拒否します。白血球標的への影響を軽減するために必要な濃度は、推奨されるGERD経口投与によって達成される全身組織レベルを超えています |
| 高用量のファモチジン投与はCOVID-19病の臨床経過に影響を及ぼしますか? | ケーススタディ | 仮説のサポートが制限されており、さらにテストが必要です |
