Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8146296/
Immunopharmacol Immunotoxicol. 2021 : 1-12.
2021年5月21日オンライン公開
要旨
SARS-CoV-2は、炎症性疾患である急性肺炎を発症するβ-CoVの一種である。サイトカインストームは、COVID-19患者の主要な死因の1つとして認識されている。また、急性炎症とサイトカインストームの結果として、多臓器不全とともにALIとARDSが発表されている。
SARS-CoVは、β-CoVファミリーの一員として、NLRP3インフラマソームを活性化し、構造タンパク質や非構造タンパク質を用いて宿主免疫系と複雑に相互作用しながら、様々な形で急性炎症を起こすことが既に確認されている。
トラニラストに関する多くの研究により、本薬剤は炎症を抑制する効果的な抗血液凝集因子として作用し、NF-κBなどの炎症に関連するいくつかの重要な転写因子を阻害し、NLRP3インフラマソームを阻害することにより、急性型COVID-19の改善に役立つ可能性があることがさらに証明されている。
また、いくつかの研究により、不適切な組織のリモデリングの防止、好中球、IL-5、好酸球の抑制、炎症部位への炎症細胞の浸潤の抑制、IL-33などの急性気道炎症に関わる因子の制限、粘膜分泌を増加させるサイトカインIL-13の抑制に対する本剤の直接的効果が明らかにされている。
したがって,トラニラストは,他の薬剤とともに,急性型COVID-19の治療薬として期待できる。
キーワードコロナウイルス, COVID-19, トラニラスト, NLRP3 インフラマソーム, 炎症, SARS-CoV-2
はじめに
コロナウイルス(CoV)は,ヒトや脊椎動物にとって潜在的な病原体として知られており,ヒト,家畜,鳥,コウモリ,マウス,その他多くの野生動物の呼吸器系,消化器系,肝臓,中枢神経系を侵す[1]。アルファおよびベータCoVは通常哺乳類に感染し、ガンマおよびデルタCoVは主に鳥類や魚類に感染し、まれに哺乳類に感染する[2]。
2019年以前は、ヒトに感染し呼吸器疾患を発症するものとして紹介されたCoVは6種類のみであった。この点、ヒトのCoV 229E(HCoV-229E)、HCoV-NL63、HCoV-HKU1、HCoV-OC43(HCoV-OC43は上気道感染(URTI)のみを発症)は、乳児、子ども、成人に重度の感染症を引き起こすが稀なケースである。
また、重症急性呼吸器症候群CoV(SARS-CoV)および中東呼吸器症候群(MERS)は下気道を冒すことがあり、それぞれ過去に中国(2002年)および中東(2012年)でヒトSARSを引き起こした[3,4]。2019年12月、中国湖北省武漢市において急性呼吸器感染症の患者が報告された。
多くの患者は、武漢市を拠点とし、新型CoV(SARS-CoV-2)の発生のホットスポットとされる華南海産物卸売市場と直接的または間接的なつながりがあった[5]。この分野で行われた研究により、SARS-CoV-2はSARS-CoVと多くの遺伝的類似性を持っていることがさらに明らかになっている。
SARS-CoV-2の遺伝子配列の解析や、ウイルス表面のスパイク(S)タンパク質の類似性から、SARS-CoV-2はSARS-CoVと同様に、アンジオテンシン変換酵素2(ACE2)受容体を用いて細胞内に侵入する可能性が高いと予想された。
ある研究では、5人の患者のシークエンスから、SARS-CoV-2のゲノム配列がコウモリのCoVと96%同一であることが判明している[5,6]。CoVは、約30kbの長さのポジティブセンス一本鎖RNA(+ssRNA)、5′キャップ構造、ポリ(A)テールを持つ最大のリボ核酸(RNA)ウイルスでもある。
β型CoVに属するSARS-CoV-2も同様に下気道を侵し、重篤な呼吸器症候群を引き起こすことが明らかにされている。トラニラスト(INN、商品名リザベン)は抗アレルギー薬として知られているが、表1に示すように、他の疾患に対する有効性がさまざまな臨床試験で検討されている。
痛風、高尿酸血症、活動性関節リウマチ、サルコイドーシスなどの疾患では、免疫反応と炎症の両方が破壊的な役割を担っている[10]。さらに、痛風や高尿酸血症などの一部の疾患では、免疫病態におけるNLRP3インフラマソームの破壊的な役割が確立されている。
COVID-19では破壊的な炎症、サイトカインストーム、NLRP3インフラマソームの亢進が認められることから、本疾患に対するトラニラストの有効性と安全性を検証する臨床試験の実施が必要である。本総説では、COVID-19におけるトラニラストの抗炎症および免疫調節の役割について述べるとともに、その作用機序を明らかにする。
表1 COVID-19患者におけるトラニラストの役割を示す研究
| 目標 | メカニズム | 本研究の主な結論 | レフ |
|---|---|---|---|
| NLRP3インフラマソーム | トラニラストは、NLRP3インフラマソームを阻害する。 | 免疫力が低下した患者さんに対する重症コビド19の治療では、NLRP3インフラマソームとその下流経路が主要な治療標的の一つとなっています。 | [7] |
| NLRP3インフラマソーム | トラニラストは、NLRP3インフラマソームを阻害する。 | SARS-CoV-2による炎症性サイトカインシグナルは、NLRP3インフラマソームを標的とするトラニラストなどの治療薬投与により緩和され、患者の予後を速やかに改善させることができます。 | [8] |
| NLRP3インフラマソーム | トラニラストはNLRP3またはNLRP3-ASC相互作用をターゲットとし、NLRP3インフラマソームの形成を阻害します。 | SARS-CoV-2感染に対する感受性が高いことを示す代謝異常の肥満者の免疫システムには、メタ炎症の発生、すなわち全身の代謝性炎症の増加に起因する初期欠陥がある可能性がある。 | [9] |
一連の文献
COVID-19の免疫原性
免疫系とウイルスの相互作用と同様に、免疫病態についてより深く理解することは、間違いなく非常に有用である。重症のCOVID-19患者における免疫反応を明らかにすることは、効果的な治療法の開発において重要な進歩をもたらすかもしれない[11]。
SARS-CoV2は、様々なメカニズムを通じて、適応免疫反応と自然免疫反応の調節不全を引き起こす。一方では、ウイルスは有効な抗ウイルス免疫反応を損ない、他方では、重症で重篤なCOVID-19の患者において重度の炎症反応を呼び起こすのである。
COVID-19リンパ球減少症の病態に関連する様々な研究は、Tリンパ球およびNK細胞の過活動と消耗、炎症性好中球およびマクロファージの破壊的役割、T細胞ヘルパーサブセットの異常分化、Th17細胞頻度の上昇を報告している。
好中球の炎症の悪化、重症炎症の重要なマーカーとしての好中球-リンパ球比(NLR)の増加、IgGおよび全免疫グロブリンの過剰産生を伴う抗体産生傾向の変化、ケモカイン、接着分子および炎症性サイトカインの過剰発現[12-18]などである。
注目すべきは、COVID-19患者の主要な死因の1つがサイトカインストームであるということだ。この病気の患者の多くは、病気の軽い症状しか示さないが、一部の患者は、この条件下で非常に重い症状を示す。一般に、基礎疾患を患っている65歳以上の患者は、死亡のリスクが非常に高くなる。
その上、急性肺損傷(ALI)および急性呼吸窮迫症候群(ARDS)[2]は、急性肺機能不全、呼吸不全の急性発症、および動脈酸素濃度の低下を特徴とする2つの状態であり、COVID-19患者におけるサイトカインストームの主要な病的合併症である[11,19-21]。
したがって、SARS-CoV-2は感染率が高いので、ACE2の発現とは無関係に、より広い範囲の細胞に影響を与えることさえあり、これは肝不全、CNS病変、GI障害を報告したこれらの研究の強い証拠である[22-25]。
COVID-19におけるサイトカインストームと炎症の源としてのNLRP3インフラマソーム
NLRP3 インフラマソームは、インターロイキン1β(IL-1β)、IL-18、およびガスダミンD(GSDMD)の産生を増加させることによって炎症を著しく増強する自然免疫系の最も重要な構成要素の一つである。また、破壊的な炎症を伴う多くの疾患の病態形成に重要な役割を担っている。
ウイルス感染症に関する多くの研究により、NLRP3インフラマソームの過剰活性化が確認され、その結果、患者に破壊的な全身性の炎症が起こることが分かっている。SARS-CoV-2の増殖は、他のCoVによるNLRP3インフラムマソームの直接的および間接的な活性化の多数の観察とともに、広範囲の細胞で比較検討することができる。
このインフラムマソームは、ARDSや多臓器不全(MOF)に続いて発症する急性サイトカインストームによって誘発され、最終的に患者の死に至ると考えられる[8]。COVID-19患者における急性炎症の制御に関する多くの臨床試験が実施されているが、これらの治療のほとんどは、単に関連する枝に焦点を当て、炎症の根源およびモータートリガーを無視している。
ALIとARDSは、しばしば、炎症性サイトカイン、ケモカイン、プロテアーゼ、およびオキシダントの産生の増加と同様に、肺における好中球の蓄積によって特徴づけられる[26]。研究により、COVID-19患者の肺には多数の感染性および非感染性マクロファージが存在することがさらに示され、このウイルス性疾患の免疫病態におけるマクロファージの重要な役割を示している。
さらに、IL-2、IL-7、顆粒球コロニー刺激因子(G-CSF)、インターフェロンガンマ誘導蛋白10(IP-10)、単球化学誘引蛋白1(MCP-1)、マクロファージ炎症蛋白1a(MIP-1a)、腫瘍壊死因子α(TNF-α)などの炎症前および抑制性サイトカインが急性例で高レベルで報告されている[27]。
最近の研究では,連鎖球菌毒素ショック症候群(TSS)モデルにおいて,NLRP3インフラマソームの活性化がサイトカインストームとMOFの誘導および進行の中心的メカニズムであることが示唆されている.この点で、NLRP3インフラマソームは、ALIおよびADRSの誘導において重要な役割を果たす[28-30]。これに対応して、他の研究では、NLRP3 インフラマソームの活性に起因する強力な前炎症性サイトカインとしてのIL-1βが、ARDSの病態に関与していることが明らかにされている(図1)[31]。
図1 トラニラストの免疫反応調節における想定される役割とSARS-CoV-2による免疫病理の可能なメカニズム
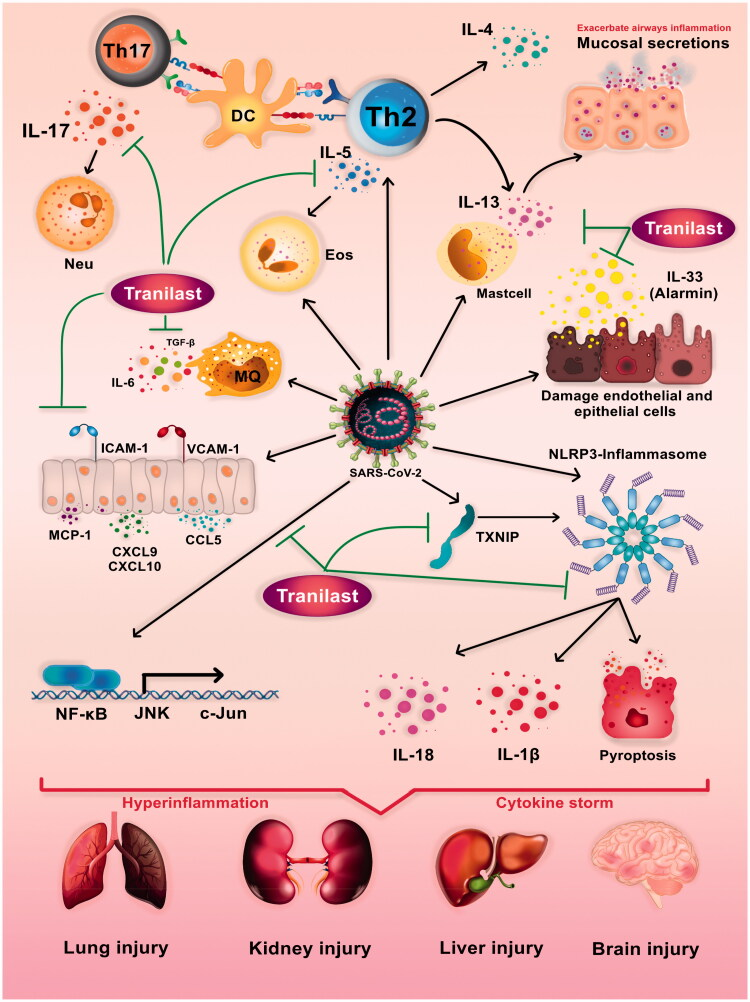
SARS-CoV2は、適応免疫反応および自然免疫反応の調節障害を引き起こし、重度の炎症、サイトカインストーム、多臓器不全症候群を引き起こす。インフラマソームおよび依存性経路の過剰活性、ケモカインおよび接着分子の過剰発現、炎症性サイトカインの過剰産生、CD4+ T-リンパ球の異常分化、Th17およびTh2の破壊的役割はすべてCOVID-19免疫病発生の主要因である。
トラニラストは、NLRP3 インフラマソーム(NLRP3, Caspase1, TXNIP)、シグナル伝達経路 (NF-κB)、サイトカイン(IL-33, IL-5, IL-17, IL-13, TGF-β)、ケモカイン(CCL5, CXCL9, CXCL9)と細胞接着分子 (ICAM1)などの異なる経路に影響を与えることによってCOVID-19の増悪を防ぐ可能性を持っている
β-CoVは異なる方法でNLRP3インフラマソームを活性化する
SARS-CoV-2と80%以上の構造的・系統的類似性を持つSARS-CoVは、異なる方法でNLRP3インフラマソームを活性化させる。また、宿主細胞の細胞恒常性を維持するためには、適切なイオン濃度が非常に重要である。したがって、NLRP3インフラマソームは、ホメオスタシスが破壊されるとアラーミンを認識し、その後活性化される可能性がある。
また、カリウムイオンの流れもNLRP3インフラマソームを活性化させる[32,33]。さらに、ビロポリンは小さく疎水性の高いウイルスタンパク質であり、様々な種類のウイルスにおいて、細胞内のイオン濃度の恒常性を乱し、結果としてNLRP3インフラムソームを活性化する[34-37]。
SARS-CoV viroporin 3aは、このように細胞膜イオンチャネルを形成してカリウムイオンとナトリウムイオンを放出し、カルシウムを置換して、より多くのNLRP3インフラマソームを活性化することができる[38]。さらに、SARS-CoV ビロポリンEは、ゴルジ装置および他の細胞小器官の膜に侵入し、それによってNLRP3 インフラマソームを活性化する。
さらに、SARS-CoVプロテインNは、細胞内のカルシウム貯蔵量を細胞質内に移動させることで、NLRP3インフラマソームを活性化させる。SARS-CoV ORF8bタンパク質も77残基のバリンによって細胞内蓄積を引き起こすことは注目に値する[39]。
Contact-guided Iterative Threading ASSEmbly Refinement (C-I-TASSER)によって作成されたSARS-CoV-2の成熟ペプチドの最新の構造モデルは、COVID-19の原因であるSARS-CoV-2はORF3aとE viroporinの両方をコードできることを明示している。
したがって、SARS-CoV-2は、第一段階を強化するだけでなく、NLRP3インフラマソームを活性化することができる。この点に関して、様々な研究により、サイトカインストームの破壊的な影響を防ぐためにNLRP3インフラマソームが積極的に抑制的な役割を果たすことがさらに明らかにされている[40]。さらに、NLRP3 インフラマソームを直接的および間接的に阻害し、それによって炎症を抑制することができるさまざまな天然、化学、ホルモン化合物も同定されている[41]。
炎症性疾患の治療におけるNLRP3 インフラマソーム阻害の重要性
NLRP3 インフラマソームは、免疫学において最も重要な分野の一つである。そのため、今後の医学研究では、NLRP3 インフラマソーム活性化の分子メカニズムを調べ、NLRP3 インフラマソームまたはその阻害経路の有効な阻害剤を特定することで、炎症性疾患の治療に焦点を当てる必要がある。
相当数のNLRP3 インフラマソーム阻害剤が現在までに報告されており、その中にはNLRP3を直接阻害するもの、あるいは間接的にインフラマソームの構成要素や関連するシグナル伝達経路を阻害するものがある[42]。IL-1β阻害もまた、NLRP3インフラマソーム関連炎症性疾患の治療のために行われた成功した実験の1つである。
カナキヌマブ(IL-1β中和抗体として)、アナキンラ(IL-1βとIL-1αの結合を阻止する組み換えヒトIL-1受容体拮抗薬として)、およびリロナセプト(IL-1βとIL-1αに結合するIL-1デコイ受容体として)は、種々の炎症疾患の治療において食品医薬品局(FDA)によって承認されている薬品である[43]。
IL-18阻害剤(すなわちGSK1070806)およびIL-1α中和抗体(すなわちMABp1)と名付けられた2つの同様の生物学的薬剤は、その開発の初期段階にある[44]。IL-1β阻害またはIL-1受容体1型(IL-1R1)の欠損は、カルサイフォシン(CAPS)モデルマウスにおける死亡率の停止につながらないことに注目することは重要であり、NLRP3インフラマソームの活性化過程で放出される他の炎症性メディエーターが疾患の進行に不可欠であるかもしれないと示唆している[45]。
したがって,小分子を用いてNLRP3 インフラマソームを直接標的とすることは,侵襲性がはるかに低く,費用対効果が高く,サイトカインをより特異的にブロックする方法である.この点で、ジアリールスルホニルウレア含有化合物(MCC950)は、当初CP-456773ナトリウム塩(CRID3)/CP-456773として報告され、最強かつ最も特異的なNLRP3インフラマソーム阻害剤として知られている[46]。
CAPSを含む免疫病理の様々な前臨床モデルに対するMCC950の治療効果は、in vitroの実験的自己免疫脳脊髄炎(EAE)[47]、アルツハイマー病(AD)[48]。脳損傷 [49]、動脈硬化 [50]、心不整脈 [51]、心筋梗塞 [52]、糖尿病 [53]、肝炎、ステアトルレア[54]、大腸炎など、免疫病理のモデルとして確認されている[55]。
MCC950の関節リウマチ(RA)治療のための第II相臨床試験は、肝毒性のために中断されているが、これらの実施された研究は、炎症性疾患の治療におけるNLRP3インフラマソームを標的とする説得力のある理由と考えることができる[56]。
間違いなく,ヒトに使用される薬剤が直接的,間接的にNLRP3インフラマソームを阻害することができれば,それらは炎症性疾患の究極の治療候補と見なされるだろう.したがって,トラニラストはその一つであり,1982年に韓国と日本で抗アレルギー剤およびトリプトファン代謝物アナログとして,アレルギー,喘息,肥厚性瘢痕の治療薬として承認された(約40年前)[10]。
近年、この薬剤を用いて、NLRP3の直接阻害に関与するメカニズムが明らかにされた。いくつかの研究はさらに、トラニラストがNACHTドメインに結合し、そのATPase活性に影響を与えることなく、NLRP3-NLRP3間の相互作用とその後のオリゴマー化を停止させることを明らかにした[57]。
トラニラストはまた,NLRC2やAIM2といった他の既知のインフラマソームの活性化を阻害することなく,NLRP3インフラマソームを特異的に阻害するように作用します.この薬剤は、NLRP3インフラマソームを直接的に阻害するだけでなく、他の炎症反応も様々な形で効果的に抑制する。
実際、トラニラストは複数のメカニズムで効果的に炎症を抑制し、副作用である不適切な組織リモデリングも防止する。したがって、重症のCOVID-19患者における免疫反応を理解することは、効果的な治療法の開発において大きな前進につながる可能性がある[11]。
この点で、多くの臨床試験が、これらの患者の急性炎症を管理することを試みている。パンデミックCOVID-19の発生当初、他の病原性β-コロナウイルスを調査する多くの研究が、NLRP3インフラマソームの活性上昇と調整障害がCOVID-19患者のサイトカインストームの発生に重要な役割を果たすという考えを強調した[7,58]。
例えば,ある研究では,COVID-19患者のリンパ球減少性肝臓におけるパイロプトーシスとインフラマソームの活性化の役割を調べ,パイロプトーシスとNLRP3インフラマソームの阻害は,その後,肝臓障害を引き起こし,COVID-19患者の治療ターゲットになる可能性も確認されている[59]。
SARS-CoV-2によるパイロプトーシスと薬剤トラニラストによる抗炎症反応の単細胞数理モデルにより,トラニラストがNLRP3インフラマソームの形成を遅延させ,パイロプトーシスを抑制する可能性があることが示された[60]。これらの研究結果は、トラニラストのようなNLRP3インフラマソーム阻害剤の有効性が示唆された総説の形で紹介されている(表1)。
トラニラストのサイトカインおよびケモカインに対する作用
免疫系の反応の制御、その適切な機能、および免疫細胞と非免疫細胞の理想的な相互作用は、さまざまな細胞によるさまざまなサイトカインおよびケモカインの発現に起因し、生体の生理状態およびがん、自己免疫、アレルギー、炎症性疾患などの多くの疾患の免疫病態に重要な役割を担っている[61,62]。サイトカインやケモカインもウイルスや宿主免疫系の関与に寄与していることが示されており、潜在的な治療標的として考慮することが可能である[63]。
同様に、トラニラストはサイトカインおよびケモカインの発現パターンに影響を与えることができる(図1およびand2).2)。その結果、サイトカインIL-1ファミリーに属するIL-33がアラミンとして分泌され、特に損傷した内皮細胞や上皮細胞からケモカインの発現を増加させることがわかった。
遺伝的に、このサイトカインは喘息の増悪と最も強く関連しており、肺の炎症の発生と悪化に顕著な役割を果たす[64,65]。また、NLRP3インフラマソームの活性化因子の1つとして、活性酸素種(ROS)を増加させる。最近のいくつかの研究では、肺組織および肺胞マクロファージにおけるケモカインの高い発現が、COVID-19において破壊的な役割を果たすことが報告されている[66]。
プロテインキナーゼB(AKt)シグナル伝達経路は、NF-κBの発現を増加させ、その一方で、2型炎症を強化することが報告されている。トラニラストは、リポ多糖刺激マクロファージからのIL-33の分泌を抑制することができると報告されている。
従って、急性炎症の発生から患者を保護することができる[64]。この点に関して、ある研究では、トラニラストは、IL-33および2,4-dinitrophenyl group (DNP) / bovine serum albumin (BSA) 刺激剤で刺激した骨髄由来のマスト細胞の脱顆粒とIL-13 産出を抑制することが実証されていた。
ARDS患者では、IL-13は粘膜分泌物をエスカレートさせることにより、状態をさらに悪化させることができ、トラニラストが気道炎症の抑制に有効であることが示されている[65]。さらに、IL-6は、COVID-19の患者における急性炎症を引き起こす炎症性サイトカインの一つである。
線維芽細胞からのIL-6分泌は、同様に手根管症候群の間の炎症を悪化させる破壊的な役割を担っている。ある研究では、トラニラストが効果的かつ用量依存的に線維芽細胞の増殖とIL-6の分泌を抑制することを見出した[67]。別の研究では、急性気道炎症を有する喘息モデルマウスにおいて、ベクロメタゾンと共にトラニラストの治療効果を評価した。
その結果、トラニラストは、成長因子であるトランスフォーミング増殖因子β(TGF-β)を減少させることにより、粘膜下組織の肥厚およびリモデリングを防止することができることが示された[68]。この点に関して、トラニラストがToxocara canis(Tc)感染マウスにおけるIL-5分泌を抑制することができることを見出した研究がある。
さらに、この薬剤は、抗原で刺激して培養したTc感染マウスの肺および脾臓の細胞におけるIL-5の産生を用量依存的に減少させることができた。トラニラスト(100 mg/kg)を1週間連日投与したところ、肺におけるIL-5のメッセンジャーリボ核酸(mRNA)発現を有意に抑制した。
さらに、この治療法は、IL-5血清レベルを減少させた[69]。喘息患者の気道炎症の悪化における好酸球の破壊的役割と、これらの細胞の産生および動員に対するIL-5の有効性を考慮し[70]、COVID-19患者の治療に対する抗IL-5モノクローナル抗体(Mepolizumab)の効果を検討した1つの臨床試験が、世界保健機関(WHO)の国際臨床試験登録プラットフォーム(ICTRP)(NCT04275245)[71]で登録されている。
したがって、ベクロメタゾンの定期的な投与は、鼻炎およびアレルゲンに対する鼻粘膜反応を軽減することができる。COVID-19患者の剖検を行ったある研究では、気道の過剰な壁の厚さが、特にALIとARDSにおける増悪因子の1つであることが判明している[72]。
角膜のウイルス感染も、炎症や潰瘍を引き起こし、最終的には失明を引き起こす。この点に関して、ある研究では、ヒト角膜線維芽細胞における多くの炎症性分子の発現に対するトラニラストの効果が評価された[73]。その結果,本薬剤は,ポリ(I:C)刺激角膜線維芽細胞において,IL-6,IL-8,MCP-1,細胞間接着分子1(ICAM-1),血管細胞接着分子1(VCAM-1),MMP-1およびMMP-3の発現を時間依存的に低下させた[73]。
炎症性サイトカインやケモカイン、上皮細胞や内皮細胞の接着分子、肺胞マクロファージなどの肺組織常在の免疫細胞の増加は、破壊的な炎症と肺機能不全の主な悪化原因として知られているので、本研究の結果は、COVID-19患者の治療におけるトラニラストの有効性に期待できる可能性がある。
肝性脳症は、急性肝障害、肝不全、または肝門脈シャントの後に発生する中枢神経系障害の広い範囲に影響を与えることも示された。この障害は、肝臓がアンモニアから尿素を生成および排泄できない状態になり、中枢神経系に衰弱効果を与える[74]。
この疾患の間、炎症は破壊的な役割を果たす。その後、チオアセトアミド注入は、IL-6とIL-13の血清レベルを著しく増加させ、酸化的/抗酸化的バランスを負に変え、肝機能、合成、代謝、および肝排泄を損なう可能性がある。別の研究では、トラニラストを15日間投与したところ、酸化・抗酸化バランスが正常に戻り、IL-6とIL-13の血清レベルが低下し、肝機能が有意に改善された。
したがって、トラニラストの抗炎症作用、抗酸化作用、および免疫調節作用は、神経肝損傷に対する保護作用を正当化しうるものであった[76]。これらの知見は、COVID-19 患者におけるSARS-CoV-2の神経肝臓損傷の報告によれば、COVID-19 患者の治療におけるトラニラストの投与に期待を持たせることができる。
さらに、いくつかの研究は、トラニラストがケモカイン(C-X-Cモチーフ)リガンド9(CXCL9)及びCXCL10の発現を減少させることを示し、それらはトラニラストの標的として作用するように思われた[77]。この点に関して,ある研究では,トラニラストは,角膜線維芽細胞表面のTNF誘導によって発現するT cell receptor alpha constant(TRAC),eotaxin-1ケモカイン,およびVCAM-1の発現を減少させることが見いだされている.これに対応して,これらの効果は,現在 COVID-19の治療効果を臨床試験で検討しているdexamethasoneの効果と同様であった[78]。
COVID-19の重症例では、TGF-βは、気道壁の肥厚に影響を与えることによって、IL-6や他の炎症性サイトカインとともにT-helper cell 17(Th17)系統の分化を増加させ、疾患のさらなる悪化につながるように思われた[79]。
トラニラストはまた,炎症性サイトカインの作用を中和し,ケモカインと細胞浸潤の抑制を通じてCOVID-19による急性炎症の増悪を防ぐことさえ可能である.角膜線維芽細胞によるケモカインや接着分子の合成は、重度の光線過敏症における角膜病変の発生をもたらす。
インスリン抵抗性の病態には、酸化ストレス、サイトカイン、MCP-1、TGF-β、IL-2などのケモカインが重要な役割を担っていることが比較的に知られている。興味深いことに、本剤は、抗酸化作用とMCP-1、TGF-β、IL-2の発現を低下させることにより、インスリン抵抗性を改善することが明らかにされている。
したがって、トラニラストは、インスリン抵抗性を低減するのに有効であると考えられる[80]。さらに、ある研究グループは、メサンギウム細胞のMCP-1産生に対するトラニラストの効果を検討し、その結果、この薬剤がIL-1刺激によるMCP-1産生を抑制する可能性が示唆された。
なお、COVID-19の患者では、MCP-1の発現が有意に高いことが分かっている。したがって、トラニラストの抗ケモカインの役割は、この疾患の急性期におけるMCP-1のようなケモカインの発現の増加の重要な役割に関して、このような条件下での患者の治療において他の有望な結果を助けることができる[81]。
さらに、ある研究では、酢酸デオキシコルチコステロン(DOCA)-食塩高血圧のモデルを用いて、高血圧条件下での心筋線維化および心臓への単球とマクロファージの浸潤の抑制に対するトラニラストの治療効果を調査していた。DOCA-salt投与からわずか2週間で、TGF-β1、plasminogen activator inhibitor-1(PAI-1)、MCP-1、IL-6などのサイトカインや因子の発現レベルが有意に上昇した。
その後、トラニラストの投与により、これらの因子が減少し、高血圧による心筋の線維化およびコラーゲンの蓄積を抑制することができた[82]。この研究結果は、トラニラストが炎症を抑え、組織の障害を抑制しながら、炎症や異常なリモデリングプロセスによって引き起こされる病態に有効であることを示している。
最近の研究では、COVID-19の異なる形態において、いくつかのタイプの炎症性サイトカイン(TNF-α、IL-1α、1βなど)、TH2復帰サイトカイン(IL-4、5、13など)、およびCXCL1/GRO-α、CCL11/Eotaxin、CXCL9/MIG、CXCL10/IP-10、CCL2、CXCL1、CXCL5、CCL27/CTACKなどの炎症性ケモカインにおける増殖レベル間の関連がさらに確認されている。
また、IL-2、6、9、18、IFN-γなどのサイトカインやケモカイン(CCL2/MCP-1、CCL3/MIP-1α、CCL7/MCP-3、CXCL8/IL-8、CCL5/RANTES、CCL4/MIP-1βおよびCXCL12/SDF-1α )が増加するとCOVID-19の死亡率に関連すると言われている[66,83-85]。
したがって、COVID-19の治療において、様々なサイトカインおよびケモカイン、ならびにそれらの下流および上流のシグナル伝達経路を潜在的な治療標的として認識することは不可能ではない。前述のように、トラニラストは回復しつつある患者を助けることができるので、NLRP3インフラマソーム、様々なサイトカインおよびケモカイン(図2)、他の薬剤や治療法などの主要な転写因子およびシグナル伝達複合体の発現に効果を発揮することにより、結果としてサイトカインストームを防ぐことができるのである。
図2 トラニラストの炎症抑制効果、COVID-19の管理に
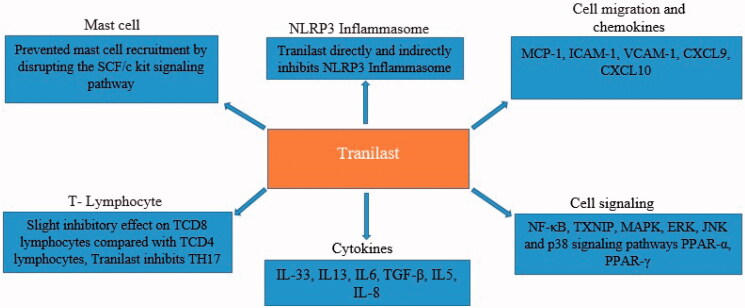
SARS-CoV-2は炎症を上昇させ、NLRP3インフラマソームを活性化し、その後サイトカインストームと破壊的な炎症を引き起こし、COVID-19患者のALI/ARDSを引き起こすことが研究により示されている。
トラニラストは、免疫系、NLRP3インフラマソームおよび炎症の制御に有効な役割を果たし、重症および中等症のCOVID-19患者をサポートすることが期待される
シグナル伝達経路に対するトラニラストの効果
近年、免疫系反応に関与するシグナル伝達経路の解明が試みられ、多くの未解決の疑問に答えることが可能となった。したがって,シグナル伝達経路の正確な知識は,疾患病原体に対する認識を高め,様々な新薬の開発に役立っている[86]。トラニラストは、炎症と線維化のプロセスに関与するシグナル伝達経路に大きな影響を与えることができる(図1)。
この点で、ある研究では、移植片対宿主病(GvHD)に対するトラニラストの治療効果が評価された。また、腫瘍抑制、酸化ストレス、炎症反応、炎症抑制、線維化形成に関与する多機能タンパク質であるNF-κBとチオレドキシン相互作用タンパク質(TXNIP)を抑制することにより、この疾患の治療に役立っていた[87]。
研究により、TXNIPが活性酸素とNLRP3インフラマソーム活性化の橋渡し役であることが確認されている。TXNIP遺伝子に変異を有するマウスは、IL-1β産生のみならず、NLRP3インフラマソームの活性化にも著しい障害を示していた[88]。
ラットの炎症による急性腎障害(AKI)の場合、NLRP3インフラマソームの活性化はTXNIPシグナル伝達経路を介したものであった[89]。様々な研究で確認されているように、TXNIPは様々な方法でNF-κBの作用を増強する[90]。
したがって、NF-κBおよびTXNIPを低減することは、特にNLRP3を阻害することによって、COVID-19における急性炎症の緩和に有効であり得る。また、シクロスポリンによる腎毒性モデルラットで行われた別の研究では、トラニラストがTGF/Smadシグナル経路の調節を通じて、この疾患を改善し、その進行を防ぐことができることがさらに見出されている[91]。
虚血再灌流障害(IRI)は、中止後に血液が組織に戻るときにも発生し、生命を脅かす炎症反応を伴う。脳梗塞ラットを用いた試験で,トラニラストの治療効果が検討された.その結果,神経細胞のアポトーシスを効果的に抑制することが確認された[92]。
さらに,炎症性サイトカインの分泌や,炎症性転写因子の一つであるNF-κBの発現を抑制した[92]。興味深いことに、自然免疫反応を低下させたが、2つの核内転写調節因子であるペルオキシソーム増殖剤活性化受容体α(PPAR-α)およびPPAR-γの発現を増加させた。
この核内受容体は、個体の健康状態を安定化させるために様々な作用を生み出すため、様々な組織で発現している。PPAR-αの活性化は、アルツハイマー病、パーキンソン病、多発性硬化症(MS)などの神経変性疾患における神経保護を引き起こすことも報告されている[93,94]。
別の研究では,トラニラストは,炎症反応の主要な経路であるマイトジェン活性化プロテインキナーゼ(MAPK)やNF-κBなどのいくつかのシグナル伝達経路を阻害することにより,ヒト角膜線維芽細胞においてIL-1で誘導されるMMP-1,2,3の生成を抑制していた[95]。
この薬剤は、NF-κBおよびc-Jun N-terminal kinase(JNK)シグナル伝達経路を障害することにより、MCP-1産生を抑制するように見えた[81]。注目すべきは、インターフェロンγ(IFN-γ)のような刺激に応答して、ミクログリア細胞は、誘導性一酸化窒素合成酵素(iNOS)の発現レベルを増加させ、その結果、より高いレベルのNOを生成することである[96]。
ある研究では、マウスN9ミクログリア細胞株を用いて、上記の経路に対するトラニラストの効果をさらに検討し、無毒性量のトラニラストに細胞を曝露することで、細胞によるNO生成レベルの低下と並行して、IFNγ誘導性iNOSの発現レベルを効果的に低下させることができることが示唆された。
これらの効果に加えて、トラニラストは、その抑制性キナーゼ(IkB)を活性化することによって、NF-κBを阻害した[97]。通常、NF-κBは常にIkB阻害因子の制御下にある。パターン認識受容体(PRR)アラリンの発達とシグナル伝達とともに、IkBはついにNF-κBの制御をあきらめたのである。
トラニラストはその発生も阻止し、IkBの捕縛からNF-κBを解放させない。ある研究では、トラニラストは、血管内皮細胞におけるNF-κB依存性の接着分子の発現を抑制していた。一方、興味深いことに、主要組織適合性複合体(MHC)I分子の発現には、この抑制効果は観察されなかった[98]。
ヒトの研究での観察と同様に、SARS-CoV-2感染サルの最近の研究では、肺毛細血管における激しい細胞浸潤とリンパ球の集積が示された[4]。したがって、白血球の浸潤に必要な接着分子の発現を抑制することは、COVID-19 患者の重篤で破壊的な炎症に有用である。
しかし、MHC-Iに対する阻害作用がないことは、肯定的な点として考慮することができる。MHC-Iはまた、ウイルス感染や、腫瘍における抗原提示において重要な役割を担っている[99]。その上,ウイルスは,免疫反応から逃れる方法として,MHC-Iの発現低下を利用している.したがって、この研究の結果は、トラニラストの抗炎症効果を示すとともに、ウイルスの抗原提示に影響を与えないことを示したものであった。
また、トラニラストは、extracellular signal-regulated kinase (ERK), JNK, p38シグナル伝達経路を阻害することが明らかにされた[78]。さらに、この薬剤は、リン酸化の抑制を通じてJNK-activator protein-1(AP-1)シグナル伝達を弱めることにより、炎症を抑制することができる[73]。
免疫系細胞の機能に対するトラニラストの効果
炎症は、主役が異なる免疫系細胞であるプロセスである。したがって、これらの細胞の機能を調節または変更するために、多くの薬剤が設計され、製造されている[100]。炎症に関与する細胞の機能に対するトラニラストの効果を検討した研究がいくつかある[101]。
マスト細胞は、粘膜表面に配置されているために炎症を開始する自然免疫上の重要な有効細胞でもあり、炎症性サイトカインを産生する細胞としても知られている[102]。さらに研究により、TNFは主要な炎症性サイトカインの1つとしてマスト細胞の分泌顆粒に貯蔵されていることが示されている。
TNF受容体1型のライゲーションは、TRADD遺伝子と呼ばれるアダプタータンパク質のリクルートをもたらし、その結果、TNF受容体関連因子(TRAF)分子(E3ユビキチンリガーゼ)および受容体相互作用セリン/スレオニンプロテインキナーゼ1(RIPK1)活性化が可能となる。
さらに、下流の結果としては、NF-κBおよびJNK MAPK経路の活性化、アポトーシス死の誘導が挙げられる。トラニラストは、さらに有効な抗血液凝集因子として作用し、また、NF-κBなどの主要な炎症関連転写因子を阻害することにより、炎症の制御に役立ち、したがって、COVID-19の急性型を改善する可能性がある。
この薬剤は、ERK、JNK、およびp38 シグナル伝達経路を阻害することもできる[78]。ラットの腎臓間質性線維症の改善におけるトラニラストの役割を調査した研究では、この薬剤は、幹細胞因子(SCF)/c-kitシグナル伝達経路を破壊することによって、肥満細胞の動員を防いでった[103]。
肥満細胞は、ウイルス病原体関連分子パターン(PAMPs)を検出するために様々なPRRを備えており、β-CoVに起因する気道炎症においても重要な役割を担っていることは注目されるべきである[104]。大腸炎などの炎症性腸疾患(IBD)は、免疫反応や急性炎症によって引き起こされる破壊的な損傷の一種と考えることができる。
この点で、ある研究は、ラットの大腸炎を治療するためにトラニラストを使用していた。その後、トラニラストの経口投与により、組織病変部における細胞浸潤率は92%まで減少し、その結果、粘膜下層の厚さが減少した[105]。COVID-19患者におけるALIおよびARDSに関する過去の研究において、重度の細胞浸潤と気道の病的肥厚が報告されていることから、この研究の結果はより重要なものとなっている。
トラニラストが重症のCOVID-19の治療にどの程度役立つかは想像がつくる。この薬剤は、自己免疫疾患であるMSやRAの動物モデルで有効性が確認されている。また、CD8+T細胞(TCD8)リンパ球に対して、TCD4リンパ球と比較してわずかな抑制効果を有することが実証されている[77]。
好中球の数の増加および肺組織におけるその存在は、したがって、より深刻な肺の損傷につながる可能性がある。そこで、ある研究では、刺激された好中球の活性化プロセスに対するトラニラストの効果が検討された。その結果、さらに、MMP-7、MMP-8、MMP-9、および組織のリモデリングに必要なTIMP因子などのマトリックスメタロプロテアーゼの発現および産生のレベルが低下していることが示された[106]。
COVID-19の顕著な特徴は、TCD8およびTCD4リンパ球の数の減少であることは注目に値する[107]。COVID-19のような多くの炎症性疾患では、好中球もまた、疾患の免疫病態において破壊的な役割を担っている。さらに、COVID-19患者の肺には、高密度の好中球が見つかっている[108]。
これに対応するIL-17およびTH17の産生は、好中球の機能を高める上で重要な役割を担っている。いくつかの研究は、さらにCOVID-19におけるTH17リンパ球の異常な分化を示している。このため、IL-17はCOVID-19の治療における潜在的な標的として導入されている[109]。
この点、重症のCOVID-19患者では、IL-4、5、13などのTH2サイトカインの産生も倍増し、病状を悪化させている[66]。その結果、トラニラストは、TCD4リンパ球の分化に対する効果だけでなく、炎症性好中球とマクロファージの機能の強さを緩和するCXCL8などのケモカインの減少によって媒介されることがある。あるいは、IL-4、5、13などのサイトカインの発現や産生を緩和することで、病気のプロセスを後押しするのに役立つ(図1)。
肺疾患におけるトラニラストの効果
肺の損傷によって生じる間質性肺線維症は、リモデリングの制御不能によって生じる致死的な現象である。肺胞マクロファージは、肺線維化の発症に重要な役割を果たす。また、リモデリングの制御不能は、COVID-19の重大な合併症であり、特に肺の病変や損傷を伴う重症例では、その可能性が高いとされている。
トラニラストは、ラットの肺胞マクロファージを抑制することにより、肺線維化を効果的に制御できることが示された[76]。TGFβ2刺激A549細胞およびマウス肺線維症モデルに対するトラニラストの効果を検討し、最終的にトラニラストがTGF-βシグナル伝達経路を阻害することによって肺線維症を制御することを報告した。
COVID-19の患者ではTGF-βレベルの上昇が報告されており、TGF-β阻害はこの疾患の治療法としての可能性も示唆されている[110]。トラニラストの吸入は、ラットの急性肺炎を効果的に抑制することができる。この吸入剤は溶解性が高く、薬物濃度を低くする必要があるため、COVID-19患者の肺の炎症を抑制する候補として考えることができる[111,112]。
オレイン酸(OA)をブタに注射すると、血管透過性の上昇と低酸素症とともに、ARDS/ALIと同様の肺障害が発生した。トラニラストの経口投与は、オレイン酸注入による急性肺障害の重症度を軽減させることができた。したがって,トラニラストは,SARS-CoV-2の致命的な合併症であるARDS/ARIの治療のための有効な候補であることが証明されるかもしれない[113]。
併用療法はCOVID-19のサイトカインストームを抑制する
COVID-19の免疫病態には、異なるシグナル伝達経路、サイトカインやケモカインの種類、転写因子の種類が関与している。そのため、本疾患には併用療法が適していると提案されている。また、登録されている臨床試験の多くは、様々な薬剤からなる薬物療法が検討されている。
現在、サイトカインストームを制御するために、副腎皮質ステロイドおよびその他の免疫抑制剤が使用されており、それぞれがサイトカインストームの原因物質の一部と相殺している[114]。副腎皮質ステロイドは、炎症性サイトカインの放出と動脈からの炎症性白血球の流出を抑制することで効果的に作用する[115]。
一方、トラニラストは副腎皮質ステロイドと一緒に処方することができる。トラニラストは、サイトカインストームの形成の主な原因の1つであるNLRP3-インフラムマソームの活性化を抑制する。したがって、トラニラストと副腎皮質ステロイドおよびその他の免疫抑制剤を併用することで、サイトカインストームを抑制することができる。
副腎皮質ホルモン、トラニラスト、および他の類似の薬剤は、モノクローナル抗体、研究中の組み換え薬、および細胞療法よりも費用対効果が高く、最終的には、低所得国や後進国を含むすべての国に広範に利用できるため、重要な知見となっている。
他の臨床試験におけるトラニラストの安全性と副作用
TRPV2阻害剤であるトラニラスト(300mg/日)を筋ジストロフィーおよび心筋症の患者2名に3ヶ月間投与したところ、心不全患者においてトラニラストがTRPV2を効果的に阻害することが確認された。また、腎不全の悪化、心拍数の増加、心室早期収縮などの副作用も観察された[116]。
別の研究では、2型糖尿病患者2名にトラニラスト(300 mg/日)が投与された。これらの患者では、治療前の皮膚サンプルは、網状真皮の拡張と厚いコラーゲンを含む老廃物を示していた。治療期間終了後、皮膚の質は改善し始め、超音波画像診断により皮膚の厚さが減少していることが確認された。
これらの患者におけるトラニラストのポジティブな効果は、この薬剤がコラーゲン合成を調節する役割に起因していると考えられる。しかしながら、これらの患者の各々に重篤な副作用は観察されなかった[117]。それに対して、いくつかの研究では、高用量での本剤による肝毒性および腎不全の増悪が報告されていた。
しかし,本研究で引用した臨床試験では,患者は本剤の300〜600 mgを数カ月あるいは1年間投与された(表2)。とはいえ、トラニラストの使用によるCOVID-19患者の治療の目的は、他の抗炎症薬や免疫抑制薬と同様に、サイトカインストームや致死的な全身性炎症を防ぐための短期治療である。
したがって、これらの患者における治療期間は、上記の研究よりもはるかに短くなっている。実際、トラニラストによる治療の主な目的は、NLRP3インフラマソームによるサイトカインストームと炎症の増悪を防ぐことだ。なお、入院患者は様々な薬剤で治療を受けているため、腎機能や肝機能の評価が日常的に行われている。
COVID-19の免疫病態や入院初日における激しいサイトカインストームの発生を考慮し、患者には数日間だけトラニラストを投与し、インフラマソーム活性を抑制している。なお,イラン(IRCT20200419047128N1)および中国(ChiCTR2000030002)において,トラニラストによるCOVID-19患者の治療の有効性および安全性を評価する臨床試験が行われており,その結果はこの問題の理解に役立つ可能性がある。
表2 Clinical Trials.govに登録された、様々な疾患に対するトラニラストの有効性と安全性を評価した臨床試験
結論
トラニラストに関連する多くの知見によると、長年処方されているこの薬剤は、NF-κBのような主要な炎症性転写因子を阻止し、NLRP-3インフラマソームを阻害することにより、有効な抗血液凝固因子として作用し、結果として重症COVID-19を改善することが可能である。
さらに、本疾患の病態の一つである不適切な組織リモデリングの防止に本剤が直接作用することを示した研究もある。好中球、IL-5、そして好酸球を抑制することにより、トラニラストは重症患者のレジメンとして有効な薬剤となり得る。多くの研究が、炎症部位への炎症性細胞の浸潤を抑制するトラニラストの効果的な役割を立証している。
一方、IL-33などの急性気道炎症に関与する因子やIL-13などの粘膜分泌物を大きく増加させるサイトカインを抑制することから、他の薬剤とともに重症のCOVID-19患者に対する治療薬として期待できる。