Contents
COVID-19 and lipids. The role of lipid disorders and statin use in the prognosis of patients with SARS-CoV-2 infection
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC8542506/
オンラインで2021年10月25日公開
Stanisław Surma,1,2 Maciej Banach,corresponding author3,4,5 and Joanna Lewek3,5
概要
2020年3月、SARS-CoV-2コロナウイルスによるコロナウイルス感染症2019(COVID-19)の世界的パンデミックが始まった。数多くの研究から得られた結論は、動脈性高血圧、糖尿病、肥満、心血管疾患の基礎疾患などの併存疾患を持つ人々は、COVID-19の重篤な経過に対して特に脆弱であることを示している。また、心血管疾患の最も一般的な危険因子である脂質異常症の患者も、COVID-19の重篤な経過をたどる危険性が高いことが、入手可能なデータから示唆されている。一方、COVID-19の感染は、脂質プロファイルに影響を与え、脂質異常症を引き起こすことが明らかになっており、適切な治療が必要である。スタチンは、抗ウイルス作用、抗炎症作用、免疫調節作用、心臓保護作用を有することから、COVID-19の予後を改善するための有効な手段と考えられている。多くの観察研究により、脂質低下治療がCOVID-19の経過に有益な効果をもたらす可能性が示されており、予後の改善や死亡率の低下が顕著である。
キーワード スタチン, 脂質異常症, SARS-CoV-2, COVID-19
はじめに
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は 2019年12月に中国・武漢で初めて確認された。人獣共通感染症ウイルス科に属するコロナウイルスとして、その遺伝物質は一本鎖のリボ核酸である。SARS-Cov-2は 2020年3月11日に世界保健機関が世界的なパンデミックと宣言した呼吸器系の急性感染症である「コロナウイルス感染症2019(COVID-19)」を引き起こす。COVID-19の特徴は、死亡率が約2,3%、感染率が約2.5~3.0(既感染者1人あたりの新規感染者数)であることである[1]。これまでに全世界で440万人以上がCOVID-19により死亡している(2021年9月)。
COVID-19の経過では、重症度が異なる3つのフェーズがあり、感染初期から回復、死亡までをカバーしている[2]。臨床的には、COVID-19に感染した後に発生する症状が重要だ。Lopez-Leonらによる15件の研究のメタ分析では、COVID-19の長期的影響の発生率が評価されており、その内訳は、疲労(58%)頭痛(44%)注意障害(27%)脱毛(25%)呼吸困難(24%)であった[3]。Iqbalらが行った38件の研究のメタ分析によると、急性期のCOVID-19後症候群では疲労と呼吸困難が、慢性期のCOVID-19後症候群では疲労と睡眠障害が最も多く見られる症状であることがわかった[4]。
最近発表されたShiらによる27件の研究のメタアナリシスでは、COVID-19による死亡を予測する要因についての理解がまとめられている。COVID-19の経過における最も重要な死亡予測因子は、腎代替療法(相対リスク:RR = 53.5; 95%CI: 22.4-127.3; p < 0.001)侵襲的機械換気(RR = 29.3; 95%CI: 21.5-39. 9; p < 0.001)プロカルシトニン高値(RR = 19.9; 95% CI: 7.31-53.9; p < 0.001)慢性腎臓病(RR = 8.37; 95% CI: 3.94-17.8; p < 0.001)および脳血管疾患(RR = 7.66; 95% CI: 3.87-15.2; p < 0.001) [5]である。COVID-19患者の予後に対する心血管疾患(心血管疾患)の影響については、Baeらによる51件の研究のメタ分析で評価された。その結果、COVID-19の予後(重篤な経過または死亡)を悪化させる要因として、動脈性高血圧(オッズ比:OR=2.50,95%CI:2.15-2.90)糖尿病(OR=2.25,95%CI:1.89-2.69)その他の心血管疾患(OR=3.11,95%CI:2.55-3.79)が含まれることが示された[6]。上記の研究結果は、心血管疾患がCOVID-19患者の予後を著しく悪化させることを示している[7]。
脂質異常症の高い有病率と、心血管リスクの形成における重要な役割を考慮して[8]、脂質異常症とCOVID-19に関する文献調査を行った。最新文献のレビューに基づき、本論文では、脂質異常の発生率とCOVID-19患者の予後との間の潜在的な関係、SARS-CoV-2感染が脂質代謝に及ぼす影響、COVID-19患者の治療におけるスタチンの役割について説明している。入手可能な文献データを批判的に検討し、COVID-19パンデミック時のスタチン使用に関する臨床上の推奨事項を提示している。本論文は、脂質学とCOVID-19に関する最新の知見を簡潔かつ包括的に示している。さらに、COVID-19におけるスタチンの使用に関する最新のガイドラインについてもまとめている。
COVID-19患者の経過と予後に及ぼす脂質異常症の影響
コレステロールは、SARS-CoV-2の宿主細胞への侵入に重要な役割を果たしている[9]。試験管内試験の研究では、ACE2(アンジオテンシン変換酵素2)を発現させた細胞で膜結合型のコレステロールを枯渇させると、スパイクタンパクの結合が50%減少したため、SARS-CoVの感染力が低下した[10]。脂質異常症の患者では、全身のコレステロール含量が増加しているため、細胞の脂質ラフト中のACE2受容体の数が増加し、SARS-CoV-2の細胞への侵入が容易になると考えられる。SARS-CoV-2の細胞内への侵入におけるリポタンパク質とその受容体の役割については、さらなる生化学的研究が必要である[9]。脂肪酸を含む脂質がSARS-CoV-2と相互作用することが示唆されており、COVID-19に対する介入戦略の可能性がある[11]。さらに、コレステロールがSARS-CoV-2のS字型スパイクの形状に影響を与えることで、ACE2との親和性が高まり、このコロナウイルスの感染力が高まる可能性が指摘されている[12]。SARS-CoV-2の宿主細胞への侵入には、スカベンジャー受容体クラスBタイプ1(SR-B1)の重要な役割も示唆されている。実験的研究では、SR-B1アンタゴニストを使用すると、SARS-CoV-2の感染力が低下することが判明している[13]。
最近発表されたいくつかの観察研究では、脂質異常症、その治療とCOVID-19の重症度との関係が注目されており、脂質異常症がCOVID-19患者の予後悪化と関連していることが示されている。Atmosudigdoらが行ったCOVID-19患者3663人を対象とした9つの観察研究のメタ解析では、脂質異常症は18%の患者に認められた。その結果、脂質異常症は、COVID-19患者の死亡リスクを39%増加させることが示された(RR = 1.39; 95% CI: 1.02-1.88; p = 0.010)。さらに、脂質異常症もCOVID-19の重篤な経過のリスクを39%増加させた(RR = 1.39; 95% CI: 1.03-1.87; p = 0.008)。メタ回帰分析では、COVID-19の経過および予後に対する脂質異常症のこのような悪影響は、動脈性高血圧を併発している高齢男性でより顕著であることが明らかになった。脂質異常症は、COVID-19の経過および予後を悪化させる要因となる可能性があることが示された。しかし、併存疾患や患者が服用している薬に関するデータは不足していた[14]。HariyantoとKurniawanによるCOVID-19患者6922人を含む7つの研究の別のメタ分析では、脂質異常症とCOVID-19の経過との間に同様の関連性が示された。著者らは、脂質異常症が重症化するCOVID-19のリスクを39%増加させる可能性があることを証明した(RR = 1.39; 95% CI: 1.03-1.87; p = 0.03)[15]。同様に、SantosらはCOVID-19患者3711人を対象とした研究で、脂質異常症がCOVID-19の重症コースのリスク増加と関連することを示した(OR = 12; 95% CI: 1.33-108; p = 0.03)[16]。このことは、Choiらのメタアナリシスでも支持されており、COVID-19と脂質異常症を有する患者は、正常な脂質プロファイルを有する患者に比べて、重度のCOVID-19のリスクが49%(RR = 1.49; 95% CI: 1.11-2.01; p = 0.01)高いという特徴があった。一方、血清中の総コレステロール、低比重リポタンパク質(LDL)高比重リポタンパク質(HDL)トリグリセリドの濃度の増加は、COVID-19の重症度と逆相関することが示されている[17]。最近発表されたLiuらによる28件の研究のメタアナリシスでは、COVID-19患者の予後に対する脂質異常症の影響に関する既存のデータがまとめられている。この研究では、COVID-19患者12,995人が対象となった。脂質異常症は、COVID-19の重篤な経過のリスク(OR=1.27,95%CI:1.11~1.44,p=0.038)およびCOVID-19による死亡のリスク(OR=2.13,95%CI:1.84~2.47,p=0.001)を高めることが示された。研究者らは、COVID-19患者における脂質異常症の発生は、予後を悪化させる可能性があると結論づけている[18]。
COVID-19患者1411人を対象としたMasanaらの研究では、血清の総コレステロール、LDL、non-HDL、HDLコレステロール、トリグリセリドがCOVID-19の予後(重症か軽症か)を予測するのに有用であることが評価されている。入院前または入院中に測定された低HDL値と高トリグリセリド値は、COVID-19の重症化の強い予測因子であることが示されている。研究者らは、脂質プロファイルは炎症の高感度マーカーと考えるべきであり、COVID-19患者では測定すべきであると指摘している[19]。YıldırımとKayaによる興味深い研究では、血漿中のアテローム性指数(AIP)が0.6285以上であることが、COVID-19患者の院内死亡率の予測因子であり、重症の初期バイオマーカーであることがわかった[20]。
Petrilliらは、5279人の患者を対象に、COVID-19の入院リスクおよび重症化経過に対する脂質異常症の影響を評価したが、逆の結果が得られた。脂質異常症の発生は、COVID-19における入院リスクの増加(OR = 0.93; 95% CI: 0.75-1.2; p = 0.51)または死亡リスクの増加(OR = 0.98; 95% CI: 0.82-1.17; p = 0.79)とは関連しないことが示されている[21]。その後、Changらは、軽度のCOVID-19症状を持つ211人の患者を対象としたレトロスペクティブ研究で確認した。彼らは、脂質異常症は重度のCOVID-19への進行リスクの増加とは関連しないことを発見した(OR = 1.203; 95% CI: 0.010-148.987; p = 0.940)[22]。同様に、Simonnetらは、脂質異常症とCOVID-19の経過との間には関係がないとしている(OR = 0.68; 95% CI: 0.24-1.97; p = 0.48)[23]。124人の患者を対象に、脂質異常症だけでなく、体重過多・肥満が人工呼吸開始のリスクに与える影響を評価した。体重増加(体格指数;BMIを用いて評価)とCOVID-19の経過を悪化させるリスクとの間には有意な関係が認められたが、脂質異常症についてはそのような関係は認められなかった(OR=0.68,95%CI:0.24-1.97,p=0.48)[23]。上記の研究結果の不一致にはいくつかの理由が考えられる。まず,脂質異常症の診断基準が研究によって異なっていたこと(米国と中国で行われた研究では,脂質異常症の発症率に大きな差が認められた) [17]. 第二に、SARS-CoV-2感染の過程では、脂質代謝の急激な変化が見られることが判明し、脂質異常症がCOVID-19の前に発生したのか、あるいはCOVID-19の間に発生したのかを解釈することが困難であった[17, 24]。第三に、上記の研究結果から、おそらく脂質異常症はそれ自体ではCOVID-19の重篤な経過のリスクを高めることはなく、肥満や2型糖尿病などのリスクを高める疾患の構成要素として機能し、全体の予後に影響を及ぼす可能性があると考えられる。特に、糖尿病はCOVID-19の重症化や死亡のリスクを有意に高める。しかし、Choiらのシステマティックレビューでは、COVID-19の予後を悪化させるのは、脂質異常症そのものではなく、脂質異常症に起因する心血管疾患である可能性が示されている[17]。結論として、脂質異常症の有病率とCOVID-19との関係については、さらなる研究が必要である。
Moazzamiらによる13件の研究のメタアナリシスでは、重度のCOVID-19の代謝危険因子が評価されている。COVID-19の患者における肥満と糖尿病の発生率は、それぞれ29%(95%CI:14~47%)と22%(95%CI:12~33%)であることが示されている[25]。Caussyらの研究では、肥満の発生率はCOVID-19の経過によって異なることが示された。標準化された有病率指数を用いて、著者らは、重症・重篤なCOVID-19患者では、一般集団と比較して、肥満(BMI≧30kg / m2)が多く見られることを明らかにした(標準化された有病率比。PR = 1.35; 95% CI: 1.08-1.66 and PR = 1.89; 95% CI: 1.33-2.53) [26]. COVID-19の患者5515人を対象としたFaghir-Gangiらによる20件の研究のメタアナリシスでは、2型糖尿病が14%(95%CI:11-17%)に存在することが示された[27]。肥満と2型糖尿病の両方が存在すると、COVID-19患者の予後が悪化した。Popkinらによる75件の研究のメタアナリシスでは、COVID-19患者の予後に対する肥満の影響が評価された。肥満は、COVID-19による入院のリスクを113%(OR = 2.13; 95% CI: 1.74-2.60; p < 0.0001)集中治療室への入院のリスクを74%(OR = 1.74; 95% CI: 1. 46-2.08;p<0.0001)人工呼吸が必要となるリスクが66%(OR=1.66;95%CI:1.38-1.99;p<0.0001)COVID-19による死亡リスクが48%(OR=1.48;95%CI:1.22-1.80;p<0.001)となった[28]。糖尿病とCOVID-19の重症度および死亡率との関係は、Kumarらによる33件の研究のメタ分析で評価され、糖尿病はCOVID-19の重症度のリスクを有意に増加させ(OR = 2.75; 95% CI: 2.09-3.62; p < 0.01)COVID-19による死亡のリスクを増加させることが示された(OR = 1.90; 95% CI: 1.37-2.64; p < 0.01)[29]。脂質異常症は、肥満患者や糖尿病患者によく見られる。KaurとAeriが150人の肥満患者を対象に行った研究では、78%の患者に脂質異常症が見られた[30]。一方、2型糖尿病患者9285人を対象としたLiらの研究では、59.3%の患者に脂質異常症が認められた[31]。
一般に、現時点では脂質異常症がCOVID-19による重篤な経過や死亡のリスクを高めるかどうかはわかっていない。しかし、脂質異常症は、肥満や2型糖尿病患者に多く見られ、最適な治療が必要である。一方、COVID-19患者では、肥満と2型糖尿病の両方が一般的であり、予後を著しく悪化させる。そのため、脂質異常症の発生率とCOVID-19患者の予後との正確な関係については、さらなる研究が必要である。
COVID-19の経過に対する脂質異常症の影響に関する観察研究の上記の矛盾した結果にかかわらず、本疾患の経過において脂質代謝が障害されることが示されている[24]。さらに、スタチン系薬剤の使用がCOVID-19患者の予後を改善することが明らかになった[32]。
脂質代謝に対するCOVID-19の影響
COVID-19の経過では、主にHDL機能の低下に起因する脂質代謝の一時的な障害が観察された(図1)[33]。SARS-CoV-2コロナウイルスはスパイクタンパク(S)を介してACE2と結合し、細胞内への侵入を可能にする。SARS-CoV-2が肺組織に侵入すると、肺胞マクロファージが活性化され、インターロイキン6(IL-6)単球化学吸引蛋白質-1(MCP1)マクロファージ炎症蛋白質(MIP)などの炎症メディエーターが放出されるようになる。これらのタンパク質は、さらにマクロファージ、好中球、Tリンパ球を引き寄せる。免疫系細胞の活性化は、制御不能な炎症の発生、いわゆるサイトカインストームや免疫系の調節不全、さらにはプロスタグランジンE2(PGE2)トロンボキサンB2(TXB2)ロイコトリエンB4(LTB4)リポキシンA4(LXA4)などのエイコサノイドの蓄積を引き起こす。炎症がコントロールされないと、アポリポタンパク質AI(ApoA-I)アポリポタンパク質E(ApoE)の濃度が低下し、血清アミロイドA(SAA)の濃度が上昇することで、HDLリポタンパク質の機能が低下する。これらの変化は、HDLリポタンパク質の抗炎症作用、抗酸化作用、免疫調節作用を低下させる。酸化したHDLおよびLDLリポタンパク質(oxLDLおよびoxHDL)は、酸化LDLスカベンジ受容体(LOX-1)の強力な活性化因子であり、さらなる炎症と組織障害を引き起こす。血清可溶性LOX-1(sLOX-1)の細胞外部分は、酸化した脂質と循環しているマクロファージとの相互作用をさらに刺激し、IL-6,インターロイキン10(IL-10)腫瘍壊死因子α(TNF-α)などの炎症性サイトカインを放出する。HDLリポタンパク質の表面に存在するパラオキソナーゼ1(PON1)という酵素の機能低下と過剰な炎症反応により、脂質の酸化がさら酸化したoxLDLおよびoxHDLリポタンパク質の割合が増加すると、ApoA-Iとマクロファージ上のATP結合カセットトランスポーター(ABCA1)との相互作用が不十分になり、レシチンコレステロールアシルトランスフェラーゼ(LCAT)によるコレステロールのエステル化が低下するなど、コレステロールの再輸送に障害が生じる。これにより、コレステロールエステルが、肝SR-B1との相互作用の直後に、あるいはコレステロールエステル転送蛋白質(CETP)によるLDLへの転送と肝LDL受容体(LDL-R)による取り込みの後に、間接的に肝臓に戻されることが減少するという病態生理学的な効果が得られる。HDL上のApoEとアポリポタンパク質C-III(ApoC-III)の濃度が低いと、リポタンパク質リパーゼ(LPL)の活性が低下し、超低密度リポタンパク質(VLDL)とトリグリセリドの蓄積につながる。また、LDLリポタンパク質に含まれる酸化リン脂質は、危険関連分子パターン(DAMPs)として認識され、これにより、インフレモソームが刺激され、血管内皮細胞の機能が損なわれ、動脈硬化が進行することも特筆すべき点である。また、oxLDLとLOX-1の相互作用の影響(細胞内へのoxLDLの蓄積)も、動脈硬化の進行を加速させる要因となっている[33]。
図1 SARS-CoV-2感染によって引き起こされる脂質障害[33]
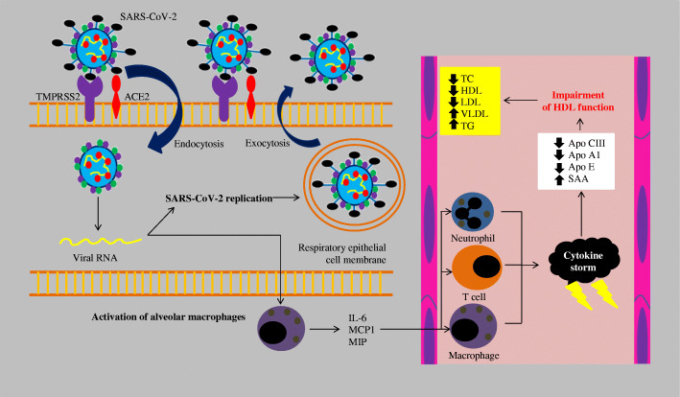
SARS-CoV-2 – 重症急性呼吸器症候群新型コロナウイルス,TMPRSS2 – 膜貫通型セリンプロテアーゼ2,ACE2 – アンジオテンシン変換酵素2,RNA – リボ核酸、IL-6 – インターロイキン6,MCP1 – 単球化学誘引蛋白質-1,MIP – マクロファージ炎症蛋白質。Apo CIII(アポリポタンパク質C-III)Apo A1(アポリポタンパク質A1)Apo E(アポリポタンパク質E)SAA(血清アミロイドA)TC(総コレステロール)HDL(高密度リポタンパク質)LDL(低密度リポタンパク質)VLDL(超低密度リポタンパク質)TG(トリグリセリド)。
COVID-19の患者における脂質代謝異常の特徴は、観察研究で一部確認されている(Tab. (Tab.1).1)。しかし、COVID-19患者における低脂血症の開始を示す観察結果や、この疾患の予後への影響については注意が必要である。Weiらの研究の解説[35]では、この種の観察結果の限界がいくつか指摘されている。脂質プロファイルの単一の評価(入院時)では、脂質濃度の変動がCOVID-19の経過に与える影響を予測できないことがわかった。また、コメントの著者は、採用した低脂血症という基準は正しくないとしている。さらに、この研究では、脂質低下療法の結果への影響は含まれなかった。このように、コメントの著者は、低LDLコレステロールとCOVID-19の経過との関係を確立するためには、より多くの分析、研究が必要であると結論づけている[39]。
表1 SARS-CoV-2感染の血清脂質濃度への影響
| 著者/年 | 被験者数 | 総コレステロール[mg / dl] | LDL [mg / dl] | HDL [mg / dl] | TG [mg / dl] | 結論 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| COVID-19(+) | COVID-19(−) | COVID-19(+) | COVID-19(−) | COVID-19(+) | COVID-19(−) | COVID-19(+) | COVID-19(−) | |||
| Hu et al。、[ 34 ]; 2020 | 114-COVID-19(+)80 – COVID-19(-) | 152 * | 188 | 85.4 * | 119 | 42.1 * | 49.5 | 102 | 187 | HDLは、中等度のグループと比較して、重症のグループで有意に低かった。総コレステロール、LDL、TGに違いはなかった |
| Wei et al。、[ 35 ]; 2020 | 597-COVID-19(+)40-COVID-19(-) | 169 * | 184 | 88 * | 110 | 49 ** | 52 | データなし | データなし | HDLは重症患者では有意に減少したが、重症患者では減少しなかった。LDLは、重症患者と重症患者の両方で有意に減少した |
| Wang et al。、[ 36 ]; 2020 | 229-COVID-19(+)1140-COVID-19(-) | 147 ** | 181 | 103 * | 110 | 30.4 ** | 53.4 | 95 * | 106 | HDLは重症患者で低かった。総コレステロール、LDL、およびトリグリセリドは、重症患者で有意差はなかった |
| Wang et al。、[ 37 ]; 2020 | 143-COVID-19(+) | データなし | データなし | 101 | データなし | 35.1 | データなし | データなし | データなし | HDLは重症患者で低かった。LDLは重症患者で有意差はなかった |
| Zhang et al。、[ 38 ]; 2020 | 74-COVID-19(+)*** | 164 | データなし | 101 | データなし | 40.2 | データなし | 111 | データなし | HDLとLDLは重症患者で減少した |
* p < 0.001; * p < 0.05; *** 2型糖尿病患者
さらに、COVID-19患者の臨床例を記述したSorokinらの研究では、疾患期間に応じて個々の血清脂質の濃度が一時的に変化することが示された(図2)[33]。COVID-19の患者17人を対象とした研究では、LDLのレベルに関して同様の結果がFanらによって得られている[40]。Li らの研究では、血清脂質レベルの変化と COVID-19 患者の予後との関係が評価された。この研究では、COVID-19 の重症コースの患者 424 名(生存者 34 名、非生存者 390 名)を対象とした。入院中、LDL、総コレステロール、HDL、ApoA1は生存者では増加傾向を示したが、非生存者では減少傾向を示したことが示された。さらに、HDLおよびApoA1の血清濃度は、C反応性タンパク質(CRP)生存者の入院期間、および疾患の重症度スコアと逆相関していた。CRP/HDL(> 77.39)またはCRP/ApoA1(> 72.37)の比率が高い患者は、入院中の死亡率が統計的に有意に高かった。研究者らは、COVID-19が重症化すると、非生存者ではHDLとApoA1の濃度が劇的に低下すると結論づけている。さらに、CRP/HDL比が高いことは、死亡率の上昇や予後の悪さと有意に関連している[24]。Caterinoらの研究では、COVID-19患者のリピドミクスプロファイルと炎症性サイトカインおよびアラーミンのプロファイルが分析された。COVID-19患者に見られる脂質異常の病因には、脂肪組織が重要な役割を果たしていることが示されている[41]。糖尿病の病因におけるCOVID-19の潜在的な役割を取り上げている考えがあることは言及する価値がある。SARS-CoV-2による膵臓β細胞の恒久的な損傷のリスクが示唆されている。しかし、この概念にはさらなる研究が必要である[42]。
図2 COVID-19中の脂質プロファイル
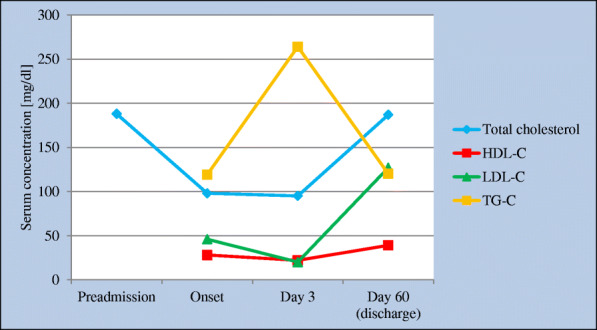
-Sorokinらの論文[33]より引用
このように、COVID-19では、脂質プロファイルに多くの変化が見られ、この疾患の重症度と相関している。強調しておきたいのは、COVID-19の重症度と脂質レベルの低下との間に観察された関係は、予後不良の原因ではなく、急性炎症性疾患の結果である可能性があるということである。COVID-19患者の脂質代謝障害の病態は、これまで十分に解明されていない。サイトカインストームの影響による血清SAA濃度の上昇が、HDLの機能を阻害する重要な要因であると考えられる。炎症が肝のアポリポタンパク質遺伝子の発現を変化させ、炎症誘発性のSAAの結合を促進し、その結果、HDL中のApoA1濃度が置換され減少することが報告されている[43]。さらに、血清中のSAA濃度は、COVID-19の重症度と正の相関関係があることが示されている(p<0.01)[44]。
COVID-19の患者に見られる脂質異常は、他の感染症や炎症性疾患の経過中に見られる脂質異常と類似していることは特筆すべきことである[45]。要約すると、COVID-19の経過において、炎症による脂質障害(非常に多くの場合、総コレステロール、HDLおよびLDLの減少、およびトリグリセリドの増加)が起こる可能性がある。
スタチンとCOVID-19:臨床試験の結果
COVID-19の重症度および予後に対するスタチンの使用の影響については、いくつかのメタアナリシスが行われている(Tab. (Tab.2.).2.)。COVID-19患者10,448人を対象としたLeeらの研究では、COVID-19の死亡率に対するスタチン投与の効果が調査された。さらに、死亡リスクに対するスタチンの効果を、肺炎患者のレトロスペクティブコホートと比較した。研究者らは、スタチンの使用に伴うハザード比(HR)の有意な低下を示した(HR = 0.637,95%CI:0.425-0.953,p = 0.0283)。さらに、COVID-19の患者と入院中の肺炎患者のレトロスペクティブコホートとの間でHRを比較したところ、スタチンの使用は同様の効果を示した。このように、スタチンの使用はCOVID-19患者の死亡率低下と有意に相関し、肺炎患者での知見と一致した[59]。
表2 COVID-19 の経過と予後に対するスタチンの効果を評価した研究のメタアナリシスの結果のまとめ ICU – 集中治療室
| 著者/年 | 分析期間 | 含まれる研究の数 | サンプルサイズ | 結果 | 結論 |
|---|---|---|---|---|---|
| コウとハサン[ 46 ] | 2020年7月27日まで | 4 | 8990 | 重症度と死亡率:リスク↓30%(HR = 0.70; 95%CI:0.53–0.94) | スタチンの使用は、COVID-19患者の予後を改善します |
| シェーン[ 47 ] | 2019年12月から2020年12月 | 13 | 42,722 | 死亡率:統計的リスク低減なし(OR = 0.97; 95%CI:0.92–1.03)重症度:統計的リスク低減なし(OR = 1.09; 95%CI:0.99–1.22)交絡因子に合わせて調整、重症リスクの27%低減COVID-19の疾患と死亡率が実証された(調整済みOR = 0.73±0.31対未調整OR = 1.44±0.84; p = 0.0028)。 | COVID-19患者のスタチン療法は予後を改善する可能性がある |
| オノラトら。[ 48 ] | 2019年から2020年9月28日 | 7 | 2398 | 重症度と死亡率:リスク↓41(OR = 0.59; 95%CI:0.35–0.99)。入院前にスタチンを使用した研究結果の分析は、スタチンを使用することのさらに大きな利点を示した(OR = 0.51; 95%CI:0.41–0.64)。 | スタチンの使用は、COVID-19患者の予後を改善します |
| パルら。[ 49 ] | 2020年12月18日まで | 14 | 19,988 | 重症度と死亡率:統計的にリスクの低下はない(OR = 1.02; 95%CI:0.69–1.50)。調整後、有害な結果のリスクを49%削減します(OR = 0.51; 95%CI:0.41–0.63)。 | COVID-19患者のスタチン療法は予後を改善する可能性がある |
| チョウら。[ 50 ] | 2019年1月から2020年12月 | 13 | 110,078 | 入院前のスタチンの使用:死亡リスクに有意な影響はない(OR = 0.62; 95%CI:0.38–1.03)。COVID-19の診断以降のスタチンの使用:死亡のリスクを低減した(OR = 0.57; 95%CI:0.43–0.75)。スタチンの使用は、ICUに入院したCOVID-19患者の死亡率を低下させませんであった(OR = 0.65; 95%CI:0.26–1.64)。非ICUの患者では、スタチン使用者の死亡リスクは低かった(OR = 0.64; 95%CI:0.46–0.88)。スタチンの使用はICUへの入院のリスクを減少させませんであった | COVID-19診断後にスタチンを投与された患者またはICUに入院していない患者は死亡リスクが低かった |
| Vahedian-Azimi etal。[ 32 ] | 2020年11月2日まで | 24 | 32,715 | ICU入室のリスクが大幅に減少します(OR = 0.78; 95%CI:0.58–1.06)。気管挿管のリスクに有意な影響はない(OR = 0.79; 95%CI:0.57–1.11)。死亡の有意な減少(OR = 0.70; 95%CI:0.55–0.88)。病院前での使用(OR = 0.77; 95%CI:0.60–0.98)と比較して、スタチンの院内投与による死亡率の低下(OR = 0.40; 95%CI:0.22–0.73)が実証された。 | スタチンは、COVID-19患者のICU入室の潜在的な減少と総死亡率の減少 |
| Wu et al [ 51 ]。 | 2020年11月10日まで | 28 | 63,537 | スタチンの使用は、死亡リスクの低下(OR = 0.71、95%CI:0.55–0.92)および人工呼吸の必要性(OR = 0.81、95%CI:0.69–0.95)と関連していた。スタチンの使用は、ICUでの治療のリスクを軽減することがわからなかった(OR = 0.91; 95%CI:0.55–1.51)。 | スタチンはCOVID-19患者の予後を改善する可能性があるため、患者が入院したときにスタチンの服用を中止する必要はないようである。 |
| Permana et al [ 52 ]。 | 2019年12月1日から2020年11月11日 | 13 | 52,122 | スタチンの院内使用は、死亡リスクの56%の減少と関連していた(RR = 0.54; 95%CI:0.50–0.58)。スタチンの入院前の使用は、死亡リスクと関連していなかった(RR = 1.18; 95 %CI:0.79–1.77)。 | スタチンの院内使用は、COVID-19患者の死亡リスクの低下と関連していた |
| イエトマーら。[ 53 ] | 2020年12月まで | 16 | 395,513 | COVID-19に感染する前にスタチンを使用すると、死亡のリスク(調整後のRR = 0.65; 95%CI:0.56–0.77)と重篤な疾患のリスク(aRR = 0.73; 95%CI:0.57–0.94)が減少した。 | スタチンの使用は、COVID-19患者の死亡または重篤な病気のリスクの低下と関連している。COVID-19パンデミック中に脂質低下療法の適応が示された患者におけるスタチンの継続使用の重要な役割が示されている。 |
| ハリヤントとクルニアワン[ 54 ] | 2020年11月25日まで | 35 | 11,930,583 | スタチンの使用は、COVID-19のリスクを減らすことに有意な影響を及ぼしない(OR = 1.09; 95%CI:0.58–2.03)。スタチンの使用は、COVID-19のリスク重症度コースの軽減に有意な影響を及ぼしない(OR = 1.07; 95%CI:0.86–1.33)。 | スタチンの使用は、COVID-19患者の転帰を改善しなかった。 |
| Zein etal。[ 55 ] | 2021年3月1日まで | 8 | 14,446 | スタチンの使用により、死亡のリスクが減少した(RR = 0.72; 95%CI:0.55–0.95)。入院中にスタチンを使用した患者のサブグループでは、死亡のリスクがさらに低いことが観察された(RR = 0.71; 95%CI:0.54–0.94)。観察された効果は、年齢、男性の性別、糖尿病、動脈性高血圧などの要因の影響を受けないであった。 | スタチンは、COVID-19患者の死亡リスクを軽減する。 |
| Diaz-Arocutipa etal。[ 56 ] | 2021年3月3日まで | 25 | 147,824 | 病院内でのスタチンの使用は、死亡のリスクに影響を与えなかった(調整済みHR = 0.74; 95%CI:0.49–1.10)。スタチンを慢性的に使用すると、死亡のリスクが大幅に減少した(aHR = 0.71; 95%CI:0.56–0.91)。 | スタチンは、特に慢性的に使用される場合、COVID-19患者の死亡リスクを軽減します |
| Kollias etal。[ 57 ] | 2021年3月5日まで | 22 | 114,688 | スタチンを使用する場合と使用しない場合では、死亡のリスクが減少した(HR = 0.65; 95%CI:0.53–0.81およびOR = 0.65; 95%CI:0.55–0.78)。 | スタチン治療は、入院中のCOVID-19患者の調整された死亡リスクの約35%の減少と関連していた。 |
| コウとハサン[ 58 ] | 2021年6月3日まで | 35 | 138,402 | スタチンの使用により、あらゆる原因による死亡のリスク(OR = 0.63、95%CI:0.51–0.79)、および重度のCOVID-19のリスク(OR = 0.80、95%CI:0.73–0.88)が減少した。 | スタチンの使用は、COVID-19患者のより良い予後と関連している。 |
全体として、COVID-19患者の予後改善に対するスタチンの効果を評価した場合、メタアナリシスの結果は依然として矛盾している。おそらく、この矛盾した結果は、年齢、性別、併存疾患、多剤併用、遺伝的素因、環境因子、ライフスタイルなどの交絡因子の影響であろう。メタアナリシスの結果が異なることを説明する重要な要因として、使用するスタチンの種類の違いが考えられる。この可能性はRossiらの研究で強調されており、COVID-19患者においてシンバスタチンとアトルバスタチンの投与が死亡率を低下させたのに対し、プラバスタチンとロスバスタチンの投与ではそのような差が見られなかった[60]。Cariouらの研究では、スタチンの効果はCOVID-19患者の心血管負荷(病期、基礎疾患の重症度、併存疾患)に依存する可能性が示されている[61]。この種の研究には誤差がつきものなので、発表されたメタアナリシスの結果の解釈には注意が必要である[62]。さらに,いくつかのメタアナリシスで使用されている方法論についても議論されている[63, 64]。今後の研究では、COVID-19患者におけるスタチン治療の利点の可能性について、より多くの情報を提供する必要がある。しかし、COVID-19患者ではスタチン治療を中止すべきではないことが知られている[65]。
スタチンの使用とCOVID-19患者の予後との因果関係は、無作為化対照臨床試験(RCT)の結果によってのみ確認することができる。Talasaz氏らによる包括的な文献レビューでは、COVID-19の治療におけるスタチンの使用(特にアトルバスタチンとロスバスタチン)に関する進行中のRCTがまとめられている。さらに著者らは、COVID-19の治療におけるオメガ-3脂肪酸、フィブラート、ナイアシンの役割についても研究中であることを示している[66]。強調しておきたいのは、スタチンはCOVID-19患者の治療に用いられる他の薬剤に取って代わるものではないということである。スタチンは、一部の患者において治療を補完することができる。
COVID-19患者にスタチンを使用することは、他のSARSコロナウイルスに感染した患者の長期追跡調査で観察された脂質障害のリスクの低減にも寄与すると思われる[67]。
スタチンとCOVID-19:メカニズム
COVID-19患者におけるスタチン投与の有益な効果は、その多面的な作用機序によりいくつかの研究で観察されている。スタチンがCOVID-19患者の予後に好影響を与えるいくつかのメカニズムが記述されている[68]。SARS-CoV-2感染に関連するスタチンの作用には、直接的および間接的なメカニズムがある[69]。
スタチンの直接作用
SARS-CoV-2の細胞内への侵入には、細胞膜コレステロールが関与している。図1,1に示すように 図1,1に示すように、SARS-CoV-2が宿主細胞に侵入する過程では、ACE2タンパク質の存在が必要である。細胞膜のサブドメインであり、大量のコレステロールを含む脂質ラフトの存在が、ウイルス感染の促進に重要な役割を果たしていることが示されている[7]。脂質ラフトは、SARS-CoV-2のスパイクタンパク質(S)とACE2との相互作用や、ウイルスの細胞内へのエンドサイトーシスに重要な役割を果たしている[7]。コロナウイルス感染症におけるACE2の重要な役割は、すでにSARS-CoV-1の場合に証明されている。SARS-CoV-1に感染したACE2ノックアウトマウスは、ACE2が正常に発現している野生型マウスと比較して、ウイルスの複製、Sタンパク質のRNAレベル、肺の損傷が有意に低かったことが示されている[70]。SARS-CoV-2感染において脂質ラフトが重要な役割を果たしていることは、Luらの研究でも確認されている。著者らは、ACE2が脂質ラフトのバイオマーカーであるカベオリン-1やモノシアロテトラヘキソシルガングリオシド(GM1)と共局在していることを示した。さらに,脂質ラフトのコレステロール含量を低下させたところ,ACE2がラフト以外の環境に移動したことが判明した[71].興味深いことに,SARS-CoV-2の細胞内への侵入は,脂質ラフトに存在するカベオリン,クラスリン,ダイナミンなどのタンパク質によって媒介されている可能性がある[72].コロナウイルス感染におけるコレステロールの重要な役割は、さらに、SARS-CoV感染におけるコレステロール枯渇の効果を調べたところ、細胞内のウイルスmRNAが大幅に減少したことからも裏付けられた[71]。内因性のコレステロール合成を減少させることで、スタチンは脂質ラフト中のコレステロール量を減少させ、SARS-CoV-2の宿主細胞への侵入を制限すると考えられる[7]。スタチンのもう一つの直接重要な作用機序は、SARS-CoV-2の複製を直接阻害することである。in silico研究では、ピタバスタチン、ロスバスタチン、ロバスタチン、フルバスタチンが、このウイルスの複製と転写の制御に関与する主要プロテアーゼSARS-CoV-2(Mpro)に高い親和性を示すことが示された[73]。SARS-CoV-2コロナウイルスのRNA複製を担う最も重要なポリメラーゼは,RNA依存性RNAポリメラーゼ(RdRp)である。Babyらの研究では,ピタバスタチンがこの酵素の活性部位に強く結合することが,分子動力学のシミュレーションによって示されている。著者らは,この実証されたメカニズムをSARS-CoV-2感染症の治療に利用できる可能性を示している[74]。
このように、スタチンは、SARS-CoV-2の細胞内への侵入とその増殖を直接阻害する効果を発揮する可能性がある。これらのメカニズムは、試験管内試験での確認が必要である。
スタチンの間接効果
スタチンは、炎症性サイトカインの過剰発現を抑制する(COVID-19に伴うサイトカインストームの重症度を軽減する可能性がある)。COVID-19のサイトカイン・ストームに関与する最も重要なサイトカインはIL-6である。IL-6のレベルは、COVID-19の重症度と正の相関関係があることが示されている[75]。血清中のIL-6濃度が高いと、サイトカインストームに加えて、発熱、高フェリチン血症、低フィブリノゲン血症、凝固障害、細胞減少などの症状が現れる、活性化したマクロファージによる重篤な炎症であるマクロファージ活性化症候群(MAS)の発症に寄与する可能性がある[76]。これまでの研究では、スタチンがIL-6レベルを低下させることが示されている。Bonsuらによる心不全患者6214人を対象とした19の無作為化臨床試験のメタアナリシスでは、スタチンはIL-6とCRPの両方の血清レベルを低下させることができ、アトルバスタチン、シンバスタチン、ピタバスタチンなどの親油性スタチンが明らかに優位であることが示された[77]。IL-6レベルを低下させるスタチンの作用機序は複雑で、toll-like receptor 4 (TLR-4)を阻害し、その結果、nuclear factor kappa B (NFκB)の炎症促進作用を抑制することからなります[69]。マウスの細胞では、アトルバスタチンがTLR-4の遺伝子発現を低下させることが示された[78]。MASのリスクを減少させるスタチンの効果は、今のところあまり理解されておらず、さらなる研究が必要である[69]。
COVID-19では血管内皮が損傷を受けることが知られており、したがって、スタチンの興味深い効果は血管内皮への影響である。スタチンはフリーラジカルから血管内皮を保護し[69]、NOD-like receptor family, pyrin domain containing 3 inflammosome (NLRP3)の炎症促進活性を低下させ[79]、ヒト内皮前駆細胞(EPC)のレベルを高めることで血管内皮の再生能力を最大限に高めることが示されている[80]。
もう一つ特筆すべきことは、スタチンの抗凝固作用である。COVID-19患者では血栓塞栓症の合併症が比較的多く見られる。ある多施設共同レトロスペクティブ研究では、COVID-19に関連する全体の血栓性合併症率は9.5%(95%CI:6.8-12.8)であることがわかった[81]。これまでの研究では、スタチン系薬剤(特にアトルバスタチンとロスバスタチン)の使用により、最も深刻な血栓塞栓症のひとつである肺塞栓症の再発リスクが低下することが示されている[82]。スタチンの上記の有益な効果の説明は、プラスミノーゲンアクチベーターインヒビター-1(PAI-1)のレベルに対する影響である。Sahebkarらが行った16件の無作為化比較試験のメタ分析によると、スタチン(特にアトルバスタチン)は血清中のプラスミノーゲンアクチベーターインヒビター-1(PAI-1)のレベルを有意に低下させ、その結果、プラスミンという酵素によるフィブリン血栓の分解を促進することが示された[83]。また、スタチンはvon Willebrand因子抗原の血漿レベルを低下させることにより、抗凝固作用を有することが示されている[84]。
スタチンの抗線維化作用は、SARS-CoV-2感染症の合併症(特にlong-COVID-19症候群)の観点から非常に興味深いと思われる。COVID-19患者107名を対象としたLiらの研究では、回復後3〜6ヶ月後に、一部の患者が肺線維症を発症する可能性があることが示されている[85]。マウスとヒト肺線維芽細胞/筋線維芽細胞を用いた実験的研究では、線維化のプロセスに対するアトルバスタチンの効果が評価された。マウスでは、アトルバスタチンの投与により、間質組織の線維化とコラーゲン蓄積の数が減少し、α-平滑筋アクチン(α-SMA)リシルオキシダーゼ様タンパク質2(LOXL2)およびp-Srcのレベルが低下したことが示された。In vitroの研究では、トランスフォーミング成長因子β(TGF-β)の作用を制限することで、α-SMAとフィブロネクチンのレベルが低下することが示されている[86]。また、スタチンは、感染後の肺線維症に関連することが知られているTGF-βシグナルを減衰させることにより、上皮間葉転換(EMT)を阻害し、線維芽細胞と上皮細胞の間で結合組織のリモデリングと沈着を引き起こすことが示唆されている[87, 88]。スタチンはまた、線維芽細胞のアポトーシスを増加させる[89]。
また、スタチンは、HDLリポタンパク質のレベルを上げることによって、平均してこのように抗ウイルス効果を発揮することができるということも言及しておきたいと思う。HDLリポタンパク質は、リポタイコ酸だけでなく、リポ多糖も結合できることが示されている[90, 91]。さらに、HDLがリポポリサッカライドと結合することで、このエンドトキシンの毒性から動物を守ることができる[92]。さらに、HDLはいくつかのウイルスの細胞への侵入を阻止し、様々な組織での感染と増殖を抑えることができる[93]。さらに,HDLリポタンパク質は,抗酸化作用,抗凝固作用,免疫調整作用,抗炎症作用を特徴とし,血管内皮の再生にも関与している[94]。COVID-19を含む炎症性疾患では、HDLリポタンパク質レベルが40〜70%減少することが観察されており、疾患の経過をさらに悪化させる可能性がある[94]。
スタチン作用の非常に興味深い間接的な抗ウイルスメカニズムは、アラキドン酸レベルに対するこれらの薬剤の効果である。Hoxhaによる文献のレビューでは、アラキドン酸の欠乏がCOVID-19の発症リスクを高める可能性があると結論づけられている[95]。Dasによる文献レビューでは、COVID-19の予防と治療にアラキドン酸が果たす役割の可能性まで指摘されている[96]。Riséらの研究では、スタチンが高コレステロール血症患者の血漿中のアラキドン酸濃度を有意に増加させることが示された[97]。Gocらの試験管内試験研究では、SARS-CoV-2の細胞内部への侵入に対する多価不飽和ω-3脂肪酸(アラキドン酸を含む)の効果が評価された。これらの酸は、SARS-CoV-2が細胞表面のACE2と結合するのを妨害することが示されている[98]。したがって、スタチンはアラキドン酸の合成を増加させることにより、SARS-CoV-2が細胞に感染しにくくする可能性がある。
このように、スタチンにはCOVID-19患者の予後を改善する直接的、間接的な多くの効果があると考えられる。COVID-19患者におけるスタチン投与の有益な効果のメカニズムを図3に示す。
図3 COVID-19の文脈におけるスタチン系薬剤の直接的および間接的な作用機序の概要
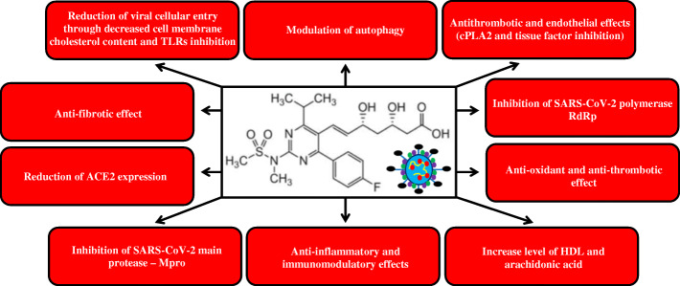
TLRs-トールライクレセプター、ACE2-アンジオテンシン変換酵素2,cPLA2-ホスホリパーゼA2,TLR-トールライクレセプター、HDL-高密度リポ蛋白質
家族性高コレステロール血症の患者に対する臨床上の推奨事項
家族性高コレステロール血症(ヘテロ接合およびホモ接合)の患者は、COVID-19の重篤な経過をたどるリスクが高い可能性があることを考慮して、BanachらはCOVID-19パンデミック時のこのグループの患者の治療に関する簡単な推奨事項を作成した。勧告の著者は、COVID-19の重症度を軽減する上でスタチンが有益な効果を発揮する可能性を示す多くの科学的証拠があることを示している。家族性高コレステロール血症の患者は、心血管リスクが一般人よりもはるかに高いため、特に治療原則と社会的距離を尊重すべきである。治療管理は遠隔医療サービスを利用して行い、薬はより長い期間処方されるべきである。家族性高コレステロール血症と新たに診断された場合には、直ちに専門センターに紹介し、電話によるアドバイスと治療を行うべきである。COVID-19患者へのスタチン系薬剤の使用は一般的に安全である。定期的な脂質アフェレーシスを必要とするすべての患者は、この処置を受けられるようにすべきである[99]。このような特定の患者グループでは、集中的な脂質低下療法の必要性が強調されている。欧州心臓病学会(ESC)のガイドラインに示されているように、COVID-19の経過中にスタチンを使用することは、大多数の患者において安全であり、患者の予後を改善する可能性がある。したがって、スタチン治療を中止することは推奨されない[100]。ここで強調しておきたいのは、発表されたばかりのポーランドの脂質異常症の診断と治療に関するガイドラインにおいて、COVID-19患者におけるスタチン治療の役割に関する複数のデータに基づいて、世界で初めて専門家がCOVID-19患者におけるスタチンの使用に関する推奨を試みたことである(表(Tab33.)
表3 COVID-19 患者における脂質異常症の治療に関するポーランドの推奨事項 [101]
| 推奨事項 | クラス | レベル |
|---|---|---|
| COVID-19の患者では、特に心血管リスクが高いまたは非常に高い人々で、推奨される最高用量のスタチンを使用する必要がある場合、LDLコレステロール値の上昇の治療をできるだけ早く最適化する必要がある。 | IIa | NS |
| 脂質低下療法の開始または強化とそのモニタリングは、e-visit / e-advice中にも可能である。 | 私 | NS |
| パンデミック時のCVDリスク因子の最適制御は、特にLDL-Cの治療目標の達成を含め、利用可能性が限られている状況でCOVID-19患者の心血管イベントと死亡のリスクを低減する必要があるため、特に重要だ。健康資源の。 | 私 | NS |
| COVID-19の患者では、予後の改善につながる可能性があるため、入院中も最適なスタチン治療を継続する必要がある。 | IIa | NS |
考察
この論文で示されたCOVID-19における脂質異常の予後への影響、脂質代謝へのCOVID-19の影響、COVID-19患者の予後を改善するためのスタチンの役割などの問題は、著者らの見解やこれらの問題を記述した他の論文と一致している[102, 103]。スタチンだけでなく、他の薬剤を用いた効果的な脂質低下治療が、COVID-19患者の予後を改善すると思われる。Israel らの研究では、COVID-19 患者が服用している様々な薬剤が疾患の経過に及ぼす影響を評価した。その結果、ロスバスタチンとエゼチミブの使用は、COVID-19による入院のリスクを有意に減少させることが示された(それぞれ、OR = 0.673,95% CI: 0.596-0.758,p < 0.001およびOR = 0.488,95% CI: 0.377-0.622)p < 0.001)[104]。Barkasらは、proprotein convertase subtilisin/kexin type 9(PCSK9)阻害剤が、その免疫調節作用によって、急性呼吸窮迫症候群やサイトカイン放出症候群などのCOVID-19の重篤な合併症のリスクを低減する可能性を示唆している[105]。PCSK9は、インターフェロンβ(INF-β)の発現を減少させることが示されている[106]。したがって、特に高コレステロール血症の患者にPCSK9阻害剤を使用することで、この副作用を軽減し、INF-βに関連する生物の抗ウイルス効率を向上させることができるはずである[107]。全体的に、スタチン治療以外の脂質低下治療もCOVID-19の重症度を低下させる可能性が示唆されているが、この問題はさらなる研究が必要である。
我々は、最適な脂質低下療法がCOVID-19患者の予後を改善すると強く信じている。そのため、他の推奨事項に従い、特にCOVID-19がパンデミックしている間は、血中の脂質パラメータを厳密に管理することが極めて重要であることに同意する。
これまでの論文と比較して、本論文は脂質異常とCOVID-19の双方向の関係を包括的に示している。また、引用された研究結果を批判的に論じ、その解釈には注意が必要であることを示した。最新のメタアナリシスとCOVID-19パンデミック時のスタチン使用に関する臨床上の推奨事項を提示した。
結論
脂質異常はCOVID-19の重症化リスクを高める可能性があるが、一方でSARS-CoV-2感染自体が一部の患者に脂質異常を引き起こす可能性があり、主にHDLリポ蛋白の機能を低下させる(臨床的な観点からは明らかに重要性は低い)。スタチンの使用は、これらの患者のCOVID-19の重症化のリスクを低減し、死亡のリスクを低減する可能性がある[108]。スタチンは、その多面的な作用機序により、SARS-CoV-2の宿主細胞への侵入を抑え、サイトカインストームによる合併症のリスクを低減させることができます[109]。家族性高コレステロール血症の患者や、心血管疾患リスクが高い、あるいは非常に高い患者は、COVID-19の重篤な経過をたどる危険性がある。したがって、このグループの患者では、脂質低下治療を特に注意する必要がある。
現在、スタチンの使用がCOVID-19スコアに及ぼす影響を調査するため、多くのRCTが行われている。脂質の問題とCOVID-19を結びつける病態生理学的なメカニズムはますます多く研究されており、そのメカニズムと結果に関する既存の疑問に最終的に答えることになるだろう。
