Contents
pubmed.ncbi.nlm.nih.gov/30050429/
Front Aging Neurosci. 2018; 10: 205.
オンライン公開 2018 Jul 12.
クレメント・L・トレンペ1、トーマス・J・ルイス2,※1
要旨
散発性アルツハイマー病は、出生前に始まり、社会的に最も恐ろしい病気として終息する悲劇的な旅路である。その多くは、慢性偏頭痛、気分障害、眼疾患、代謝症候群、歯周病、ホルモン、自己免疫疾患など、一見無関係と思われる疾患の訴えである。これらの疾患を管理するだけでなく、認知症になる前に適切に治療することで、認知症の発症を大幅に減らすことができるかもしれない。現在、健康への不満が多いのは、全般的に健康状態が悪く、免疫力が低下していることを反映している。ビクトリア時代中期には、人々は長寿でありながら健康で、慢性疾患に罹患する割合は現代人の10分の1であった。慢性疾患やアルツハイマー病にかかりやすくなるのは、年齢に関係なく、我々の健康状態が悪いからなのである。感染症は、アルツハイマー病やその他の神経変性疾患の多くの症例に関与しているが、多くの慢性疾患にも関与している。アルツハイマー病は多因子性で全身性であり、「脳だけ」ではないことを、因果関係を探る科学者たちは認識している。アルツハイマー病の流行を遅らせ、止め、逆転させるためには、原因因子の特定と逆転を、人間の生活全般にわたって行わなければならない。このアプローチでは、年齢を問わず、身体と脳の免疫力を高め、炎症と感染をコントロールすることを考慮する必要がある。感染症も原因の一つだが、根本的な原因は多因子にわたるもので、免疫の健康状態も関係している。パスツールは、19世紀のフランスにおけるベルナールの功績を認め、「種は無であるが、土は全てである 」(The seed is nothing, the soil is everything.)と最高の言葉を残している。
キーワード アルツハイマー病、感染症、全身性、糖尿病、先天性、免疫、予防、炎症

はじめに 免疫と感染症
歴史的には、感染症は罹患率と死亡率の原因であった。感染症は、間違いなく、今もなお、罹患率と死亡率の主要な原因であるが、多くの原因物質が潜行性であり、生物と疾患の因果関係が不明確であるため、この関係はほとんど無視されている(Cochranら、2000)。Paul Ewald博士は、進化的適性の概念が、現代社会における疾病の主要な原因が感染症であることを如実に示していると説明している(Cochran et al., 2000)。進化的適性とは、ある生物が競合する生物と比較して、進化的に成功することを意味する。生物の生存や繁殖に不利な遺伝形質は、遺伝子プールにあまり長くは残らない。自然淘汰され、体力に重大な影響を与える遺伝性疾患や形質は、時間の経過とともに衰退していくしかないのである。したがって、健康に深刻な影響を及ぼす一般的な慢性疾患を考える場合、非遺伝的な原因を推定することができる。Ewald (2002)によれば、”疾病が何世代にもわたって人間集団に存在し、なおかつ人々の体力にかなりの悪影響を与える場合、その疾病は感染性の原因である可能性が高い “という。
免疫系の活力は、アルツハイマー病を含むあらゆる慢性疾患における最も重要な危険因子であると考えられる。世界保健機関は、”Risk Factors of Communicable Diseases” (World Health Organization, 2011) の中で、「人間と微生物の共生とは別に、病気を引き起こす生物は空気や水、土などの人工的な不衛生な環境下で繁殖する」と述べている。免疫力の低い人、体力のない人、不衛生な環境で生活している人は、周囲から感染するリスクが高い」と述べている。この疾患モデルは、アルツハイマー病や他の慢性疾患にも同様に当てはまるが、感染源はあまり明らかではなく、診断が十分になされたり、考慮されたりすることが少ないため、限界がある。
慢性炎症は、アルツハイマー病を含む慢性疾患の原因と考えられている(Rogers, 1995; Holmes et al., 2009; Kawai et al., 2018)。Opie(1929)の定義によると、”炎症は、細胞や血清が傷害物質について蓄積し、それを除去または破壊する傾向があるプロセスとして定義することができる。” 慢性炎症は、組織損傷の原因とされ続けているが、この複雑なカスケードは、内外のメディエーターによって刺激され、抗原に対する免疫反応を促進する危険信号の放出につながる(Rock and Kono, 2008)。慢性的な潜伏感染症は、慢性炎症の重要な刺激因子である(Beatty et al.、1994)。宿主-病原体相互作用は、微生物の病原性に対する宿主の感受性の重要性として定義されるが、この相互関係は一筋縄ではいかないものである。CasadevallとPirofski(1999)は、宿主-病原体相互作用の6つの異なるクラスを提案し、感染、炎症、免疫健康、病気の関係が、明白ではあるが、必ずしも統計的な確実性をもたらさないかもしれないことを説明する一助となっている。
Rivasら(2017)は、現在の研究パラダイムは還元主義であるにもかかわらず、生物系はその限られた要素を組み合わせ、感染症に関わる複雑な構造と解決策を生み出していると説明している。老化のネットワーク理論、特に炎症老化は、「様々なストレス要因に対処する能力のグローバルな低下と、それに伴う炎症性状態の漸増」と定義され、1つまたはいくつかではなく、「多数」を測定することによって、より非還元主義の個別健康評価に貢献する(Franceschiら、2000年)。炎症性老化という概念は、慢性的な侮辱に対する免疫系の活性を測定するものである。したがって、あらゆる慢性疾患は、生体システムに対するストレスとその対処能力、あるいは対処能力の欠如を示す指標となる可能性がある。
アルツハイマー病を含む慢性疾患の発症は、高齢になるほど増加し、免疫老化と関連している(Solana et al., 2012)。アルツハイマー病の病態は、認知症と臨床診断される数十年前から存在していることが、多くの研究で示されている(Mortimer et al.、2005年)。したがって、アルツハイマー病の素因は、65歳前後から始まる免疫老化の加速に先立って確立されている(図(Figure1).1)。この曲線はまた、0-5歳の間の未熟な免疫系による疾患への脆弱性を表している。この時期に、アルツハイマー病やその他の慢性疾患の前兆、特に潜伏感染症が、脆弱な宿主に日和見的に侵入し、時間の経過とともに疾患として発現し、アルツハイマー病の著しい増加につながる可能性がある。また、健康な人と不健康な人の比較や、健康に悪影響を及ぼす急性の健康状態や突然の人生の転機を含む一過性の感受性も表現されている。
図1 年齢スペクトルにわたる慢性疾患とアルツハイマーの感受性の表現(House,2018)
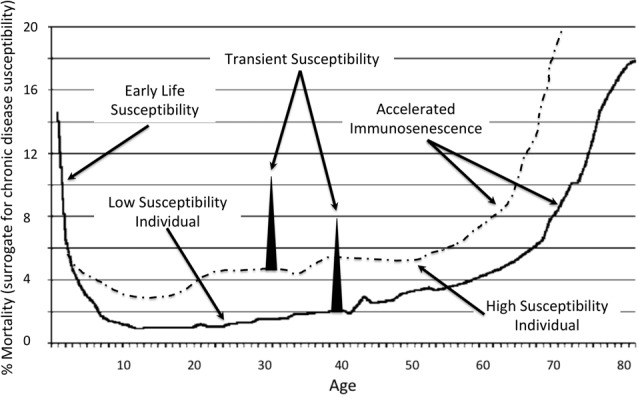
アルツハイマー病に関連するオカルト・エクトピック義務性細胞内病原体は数多くあり、クラミドフィラ・ニューモニエ(CP; Balin et al, 1998)、Borrelia burgdorferi(BB; Marquand and Muller, 1997)、口腔のグラム陰性嫌気性細菌(Riviere et al. 多くの感染種は、ヒトと動物の両方の集団内に遍在している。CPは、米国の成人の間で50%を超える血清有病率を示している(Blasi et al.) 脆弱な個体では、CPは脳に移行し、神経変性に寄与する(Gérard et al.、2006)。
免疫系の健康と感染症との関係は、ベルナールとパスツールの研究にまでさかのぼる(Garko, 2012)。MITの現代の研究では、免疫と将来のアルツハイマー病の間に強い相関関係があることが実証されている(Dougherty, 2015)。CDCは、顧みられない寄生虫感染症に関する記事の中で、トキソプラズマ寄生体に感染した6000万人のアメリカ人のうち、重度の健康被害を経験するのは感受性のある人のごく一部だと説明している(Wong and Remington, 1994; Chaudhry et al, 2014; Jones et al, 2014)。AD患者におけるT. gondiiの有病率が対照群と比較して高いことは、生物と疾患との関連を示している(Schulzら、2007;Rashnoら、2016、2017)。米国では推定18%が血清陽性であり、世界では推定1/3が感染していると言われている(Dalimi and Abdoli, 2012)。慢性的な感染により、トキソプラズマ症が再活性化することが報告されている(Montoya and Liesenfeld, 2004)。感染者にとっては、図11に示されたあらゆる感受性因子がトキソプラズマ症の増殖とアルツハイマー病の悪化の可能性に寄与している可能性がある。
CDCは、トキソプラズマ症に感染してもほとんど症状が出ないことを指摘している。しかし、Kaiser Family Foundationによると、医療費のうち最も高い割合で、定義されていない状態に対して発生している(Peterson-Kaiser Health System Tracker, 2018)。トキソプラズマ症やその他の潜伏生物は、これらの状態や関連する高い医療費に寄与している可能性が高い。Stratton and Wheldon(2006)は、多発性硬化症や心臓病と関連して発見された場合のCPのライフサイクルとその治療について説明している。Wheldon博士は、20年以上にわたる臨床診療の中で、CPと関連する疾患として、心臓伝導障害、タンポナーデを伴う噴出性心膜炎、慢性閉塞性気道疾患、多発性硬化症、アルツハイマー病、慢性疲労症候群、脳炎、網膜血管炎、黄斑変性、老眼、クローン病、新発生の成人ぜんそく、統合失調症(ヘーベプレニア)などのリストを寄稿している。トキソプラズマ症に関連する同様のリストは、今後研究が進めば確立されるかもしれない。
ライム病は、スピロヘータを媒介とする感染症で、BBと同時感染することにより発症する慢性疾患としてよく知られている。Miklossyは、1994年にBBとアルツハイマー病の関連について仮説を立て、因果関係を証明した(Miklossy, 1994, 2011)。CDCは最近、米国における2014年の年間新規患者数3万人を2017年には30万人以上とする推計を修正した クリス・クリストファーソンはADと診断されたのに、ライム病の発見後、「クリストファーソンは近年記憶障害に苦しみ、アルツハイマー病と言われたが、誤診されずっと実はダニ媒介性の病気ライム病に苦しんでいたらしい」(マーカス、2016)という世評が流された。感染症とアルツハイマーの関連性と因果関係は、ほとんど無視され続けている。
「ライム病の概要」では A Critique of an Ignored Pandemic」において、Ken Stoller博士は、人間集団の20%が感染しており、原因不明の疾患を説明する可能性が十分にあることを示唆している(Stoller, 2015)。最近完了した、インディアナ州中央部の機能しているが不健康な製造会社労働者70人のコホートの調査では、報告されたライフスタイル、症状、幅広い炎症バイオマーカー、血清検査に基づいて、ライム病を含むステルス感染について41人を評価した。41人のうち、40人は少なくとも1つの潜伏性生物に陽性で、ほとんどが2つ以上持っていた。28人はCPのIGG力価が陽性で、12人はToxoplasma Gondiiに陽性、18人はライムのIGGバンドに少なくとも1つ陽性、1人はQ熱に陽性、1人はRickettsia Typhiiに陽性だった(Lewisら、投稿)。未検査の30人がライム陰性であったと仮定すると、これらのデータはStollerが提案した集団感染負荷の推定値を支持するものである。
出生前のAD感受性
先天性感染症は、胎児や新生児に影響を与える。従来、これらの感染症はウイルスによって引き起こされると考えられており、妊娠中のいつでも赤ちゃんが感染する可能性がある。妊娠中に母体がウイルス性疾患に罹患していることが分かっていても、母体の免疫システムによって胎児や新生児へのウイルス感染が防がれることがある。しかし、母乳を与えない母親や母乳をやめた直後は、新生児の免疫系の機能は急激に低下し、その後0〜5歳にかけて徐々に強化される(図Figure 11)。
歯周病菌は先天性感染症の大きな要因である。母親の歯周病と早産児の出産との関係を最初に報告したのはOffenbacherら(1996)である。早産児の世界的な発生率は約9.6%で、米国では12~13%、欧州では5~9%、アフリカでは18%と地域格差がある。Born Too Soon」によると、米国の早産は184カ国中131位である(Blencowe et al.、2013)。また、満期死産はFusobacterium nucleatumを含む細菌によって引き起こされる(Han et al.、2010)。胎盤は、肝臓や脾臓などの他の臓器に比べて免疫力が低下しているため、細菌が定着しやすい臓器である。子宮内感染は早期早産の主要な原因と考えられており、臨床的および実験的研究のデータは、これらの高リスク早産の40%以上を感染が占めることを示唆している(Kravetz and Federman, 2005; Kemp et al, 2017)。
歯周病感染による早産と認知症の統計的関連性を判断することは、出生と疾病の間に70年以上の開きがあるため、困難である。乳幼児死亡率の高い州での出産」において Race and Risk of Dementia」では、人種別コホートにおいて、後年認知症になる割合が高いことは、乳児死亡率の高さと統計的に関係があった(Gilsanz et al.) 高齢者のコホートでは、人種別の乳幼児死亡率が最も高い州で生まれた黒人は、全国平均と比較して認知症のリスクが40%増加した。著者らによれば、早期生活条件が認知症発症の人種間不平等に寄与している可能性がある。早産は感染症が圧倒的に多いことから、認知症の過剰は、出生時の発育不全(免疫状態の低下)、妊娠中の慢性感染症、あるいはこれらの悪条件の組み合わせのいずれかと関連していると推測され、これらはすべて免疫老化に伴って将来のアルツハイマー病のリスクを高める(Jeffcoatら、2002)、Figure 11。
非歯周病菌感染症は、妊娠の有害事象と認知症の両方に関連している。妊娠中のサイトメガロウイルス(CMV)感染は臨床的に有害な結果をもたらし、子宮内感染率はおよそ33%と報告されている(Stagno et al.、1987)。CMVは血管性痴呆患者の脳に非常に高い割合で存在する(Linら、2002年)。また、アルツハイマーの危険因子としても関与している(Barnesら、2014)。CMVは、感染によって誘発される炎症反応の他に、免疫老化を促進する可能性があり、その結果、寿命のどの時期においても、感染または共感染の結果、アルツハイマー病にかかりやすくなる可能性がある(図1.1)。Dowによれば、「免疫能のある人では、CMVへの感染は通常、新生児でも無症状だが、いったん定着すると、完全に排除できない免疫系にとってその封じ込めが優先される(Dow、2015)」。しかし、健康な免疫能のある人でも、これまで考えられていたよりも頻繁にCMV感染の症状を示すことがあり、時には深刻な結果を招くこともあり、年齢が危険因子として関与していることも指摘されている。このように常にCMVの警戒を維持するために、免疫系にもたらされる結果は深刻である可能性がある。CMV感染により、CD8+T細胞サブセットの表面表現型に類似の変化が生じることが、若年者と高齢者の報告で示されている。このことから、明らかに加齢に伴う変化は、むしろ加齢に伴うCMV感染の有病率の上昇によるものであるという考え方が生まれた。この現象は、他の病原体によっても引き起こされる可能性があり、感受性と疾病発生は、提案されている宿主-病原体相互作用の異なるクラスによって説明される(Casadevall and Pirofski, 1999)。
早期の生命徴候と将来のADへの感受性
米国では、1型糖尿病(T1D)の診断時年齢のピークは10-14歳である(Maahs et al.、2010)。遺伝も関係しているかもしれないが、感染症が強く関係している。T1Dは、おたふくかぜ、風疹、CMV、はしか、インフルエンザ、脳炎、ポリオ、エプスタイン・バー・ウイルスなどのウイルス感染症に続いて発症する。ウイルスは、β細胞の破壊プロセスを誘発または促進することにより、T1Dの発症に重要な役割を果たす(Christen et al.) また、細菌もT1D関連物質である。CPは、非糖尿病対照者の10.5%に対し、若年T1D患者の46.5%に認められた(Rizzo et al.、2012)。さらに、CP抗体陽性は、代謝コントロール不良(HbA1c>9%)の患者と代謝コントロール良好(HbA1c<7%)の患者および膵臓β細胞の機能不全の患者で有意に多かった(Rodriguezら、2015年)。高齢のT1D患者は、糖尿病でない患者と比較して認知症のリスクが80%以上増加し、T2D被験者を除外するとリスクはさらに高くなる(Whitmerら、2015年)。このようにT1D、そしてより重要なのは、この病気に関連する潜在的な免疫機能障害と感染症は、将来のADの指標となるのである。
若いライフサインと将来のADへの感受性
プライマリーケアのオフィス訪問のうち、10%以上がうつ病または気分関連である(Staffordら、2000;Olfsonら、2014)。研究コミュニティは、うつ病とアルツハイマー病が関連していることを知っており、うつ病は単なる症状ではなく、ADの危険因子であることが明らかになっている(Dantzerら、2008;Wilsonら、2010)。フラミンガムコホートの17年間の前向き研究では、うつ症状を持つ高齢者はアルツハイマー病の発症リスクが50%増加することが示されている(Saczynskiら、2010)。また、別の研究では、AD発症群は非発症群と比較して、診断前の6-7年の観察期間中に抑うつ症状のほとんど認められない増加を示し、診断後の2-3年の観察期間中には変化がないことを報告している(Wilson et al.、2010)。Caraciら(2010)によると、慢性炎症、視床下部-下垂体-副腎(HPA)軸の過活性化など、大うつ病の病態を支える分子メカニズムやカスケードが、ADの病態にも関与している(Caraciら, 2010)。Johnsonら(2015)は、認知症の症状が現れ始めるかなり前から、うつ病の徴候が始まることを発見している。彼らは、集団で容易に測定可能な気分・うつ症状の中核グループが存在し、医療従事者が認知症発症リスクのある人と正常に老化した人を区別できるようになる可能性があると考えている。
潜伏性トキソプラズマ症とヒト」では、統合失調症やうつ病性障害、強迫性障害、アルツハイマー病やパーキンソン病、てんかん、頭痛や片頭痛、精神遅滞、自殺傾向、知能などさまざまな精神疾患の病因におけるトキソプラズマ症の影響について検討している(Dalimi and Abdoli, 2012)。トキソプラズマ・ゴンジーは、神経変性疾患と診断されていない感染高齢者の記憶力を低下させる。実行機能と記憶に関する研究では、トキソ陽性の被験者は、トキソ陰性群と比較して約35%の記憶パフォーマンスの低下を示し、このグループはまた、非感染者と比較してQOLの低下を報告した(Gajewski et al.、2014年)。我々自身の70人の研究コホートでは、40人がトキソプラズマ症のIgG抗体を検査し、12人が陽性であった(Lewisら、提出)。
ライムの原因菌は、若年・中年者の気分障害で報告されている(Fallonら, 1993; Derschら, 2015)。気分障害や自殺傾向における感染からの因果関係の判断は、屁理屈に悩まされる。Garakani and Mitton(2015)は、「この患者のパニック発作は、退院後、数ヶ月後に、ライム力価が陰性であるにもかかわらず、「慢性ライム病」の疑いで長期の抗生物質治療を受けた後に消失した」(Garakani and Mitton, 2015)と述べている。治療後のライム病症候群の大きな特徴は、うつ病である(Rebman et al.、2017)。Miklossyは、BBとアルツハイマーの関係について、最も頑固な反対者を納得させるに十分な分析を提供している(Miklossy, 1994, 2011; Miklossy et al, 2004)。うつ病は、同じ感染過程の手がかりになるかもしれないし、一般にうつ病はアルツハイマー病に先行するので、治療がより効果的になるかもしれない。
若年から中年期の徴候と将来のADへの感受性
Rotterdamの研究では、2型糖尿病(T2D; Ott et al.、1999)の患者では認知症とADのリスクが高いことが明らかになった。T2Dを持つ人は、健康な同世代の人と比べて、神経変性疾患を発症するリスクが50%高くなる(Mayeda et al.、2015)。人生の早い段階でのインスリン抵抗性は、神経変性の発症リスクを高める可能性がある(Luciano et al.、2015年)。インスリン抵抗性は、1943年に初めて記述されたように、感染症が原因の一つである(Greene and Keohen, 1943)。JAMAに掲載された「Insulin resistance due to infection in diabetes mellitus in man」と題された論文は、あまり引用されていない。現代版では、病原体の負荷は、考慮されたすべての危険因子の中でインスリン抵抗性と最も強い関連を持つと結論づけている(Fernández-Realら、2006年)。例えば、HSV-2価は、炎症を考慮した後でも、インスリン感受性と負の相関があった。この関係は、CPとエンテロウイルスに血清陽性の被験者ではさらに強化された。T2Dの人は、図11の「高感受性者」曲線になりやすい。
中年の兆候と将来のADへの感受性
眼は脳のカナリアである。なぜなら、網膜は脳の胎生期の露頭だからである(Dowling, 1987)。網膜は網膜神経節細胞からなり、その軸索は視神経を形成し、その繊維は実質的にCNSの軸索である。眼球はユニークな物理的構造を持ち、表面分子やサイトカインが局所的に配列しており、脳や脊髄と同様の特殊な免疫反応の宿主である。脳を侵すいくつかの明確な神経変性疾患は眼に症状が現れ、眼の症状はCNSの診断に20年も先行することが多い(London et al.、2013)。様々な眼に特異的な病態は、アルツハイマー病や緑内障など、他のCNS病態と特徴を共有している(McKinnon, 2003)。
CPの免疫グロブリンの血清検査は、緑内障の患者では対照群と比較して有意に高い(Yuki et al.、2010)。緑内障との関連で指摘されている他の感染症は以下の通り。Helicobacter pylori (Galloway et al., 2003), Bartonella henselae (Gray et al., 2004), HIV (Nash and Lindquist, 1992), CMV (Sekhsaria et al., 1992), Toxoplasmosis (Sheets et al., 2009), Tuberculosis (Egbagbe and Omoti, 2008) and Lyme disease (Zaidman, 1997)などがある。眼は、”眼球免疫特権 “と呼ばれる生存との微妙なバランスによって、炎症性疾患の影響を受けやすい。Streileinによると、「驚くことではないが、炎症が眼球内で発生した場合、視力に対する重大な脅威となる」(Hazlett and Stein-Streilein, 2012)とのことだ。免疫特権と容易なアクセスは、神経変性が多くの場合、脳よりずっと前に眼に現れる理由を説明し、低コストで早期または病前のスクリーニング手段と将来のADへの治療可能な関連性を提供するものである。
黄斑変性症は、血管障害と神経変性疾患の両方であり、シンプルでエレガントな検眼器具で簡単に観察することができる。加齢黄斑変性症(AMD)」と題された研究。目の中のアルツハイマー病?” と題する研究 (Kaarniranta et al., 2011)、”Parallel findings in age-related macular degeneration and Alzheimer’s disease,” (Ohno-Matsui, 2011)などの研究は、神経変性疾患の早期診断がどのようなものかを示す例である。黄斑疾患と神経変性疾患の共通項として、あまり研究されていないのが感染症である。CPは加齢黄斑変性症に関与していることが証明されている(Haas et al.、2009)。我々自身の臨床評価では、AMDの臨床例のかなりの割合で、血清陽性のCPやその他の潜伏感染症が見つかっている。
感染、炎症、アルツハイマーの特徴
Balinら(1998)は、CPとアルツハイマー病を結びつけている。その後彼らは、「遅発性アルツハイマー病のトリガーとしてのクラミジア肺炎感染の概念実証研究」(Balin, 2017)など、このテーマに関する数十の論文を発表している。ハーバード大学主導のチームは、ADの特徴であるベータアミロイドが実は抗菌性を持っていることを初めて確実に示した(Soscia et al.、2010)。RavnskovとMcCullyは、微小血管の低酸素症は、LDL粒子による感染性残渣の隔離によって始まり、このプロセスはアルツハイマー病でも認められると説明している(Baileyら、2004;RavnskovとMcCully、2009年)。タウの過リン酸化は、微小血管疾患関連神経変性疾患でも指摘されている(Castillo-Carranza et al, 2017)。冬眠する動物もタウを高リン酸化しており、アルツハイマー病と冬眠の共通点は低酸素であり、βアミロイドと同様に修飾されたタウが脳を保護する役割を担っている可能性がある(Su et al.) Corriveauら(2016)は、認知障害や認知症に対する血管の寄与の重要性を説明している。Miklossyら(2006)は、スピロヘータやリポポリサッカライドによって誘発される炎症、βアミロイド前駆体タンパク質、高リン酸化タウの産生の増加を指摘した。Balin(2017)は、病原体、炎症、Abeta 1-42産生、遺伝子転写物の制御、タンパク質発現の間の関連性を掘り下げた。遺伝子転写物およびタンパク質発現に関する結論は、インフェクトゲノミクスの研究によって支持されている(Kellam and Weiss, 2006; Nibali et al.) 感染以外の単一の説明では、アルツハイマー病で観察されるすべての病態を支持することはできない。
結論
最適でない健康と慢性炎症は日和見感染の素因となり、人生の連続性を通して無数の疾患が将来のアルツハイマー病のリスクと感受性に関する情報を提供する。健康状態の悪化、歯周病、先天性感染症、うつ病、糖尿病、眼疾患などは、神経変性疾患への進行のロードマップを提供している。これらの疾患の発症・進展には、免疫系の未熟さ、機能不全、老化が基本にあり、日和見感染症の増殖を促進する。臨床的には、医学は病気の症状を管理するというパラダイムを変え、将来のアルツハイマー病やその他の慢性疾患のリスクを特定するために、炎症のバイオマーカーによって免疫の健康状態を検査するという予防的アプローチを採用しなければならない。次に、リスクのある被験者には、健康状態を改善するためのガイダンスを提供する必要がある。また、免疫力が低下している人は、感染症の検査を行い、発見された場合は、負担が軽減されるか、根絶されるまで治療する必要がある。このプログラムは、アルツハイマー病に関連する疾患の兆候や症状が見られる人に対し、年齢層を超えて実施されなければならない。この方法によって、アルツハイマー病の発症を5年遅らせることができ、発症数を半減させることができると考えられている。臨床医が初期の慢性疾患とアルツハイマー病の関連と因果関係を認識し、管理よりも緩和に重点を置くことで、50%以上の発症抑制が現実的となる。
