Contents
pubmed.ncbi.nlm.nih.gov/37704050/
ハイライト
散発性ADのウイルス感染仮説を支持する研究は増え続けている。
限定的ではあるが、ADの発症と増悪における役割を支持する有力な証拠がある。
ADの病態におけるウイルスの寄与を明らかにするためには、さらなる研究が必要である。
要旨
アルツハイマー病(AD)は、高齢者の認知症の中で最も頻度の高い疾患である。この病気には、散発性(原因がまだ完全には解明されていない)と家族性(代々家族の中で遺伝する)の2つの主な病型があり、プレセニリン1(PSEN1)、2(PSEN2)またはアミロイド前駆体タンパク質(APP)遺伝子の変異が明らかな常染色体優性遺伝をする。ADの主な特徴は、アミロイドβ(Aβ)ペプチドの細胞外沈着とタウ蛋白のリン酸化亢進型の細胞内沈着である。
AD散発型のウイルス感染仮説を支持する研究は増え続けている。特に、いくつかのヘルペスウイルス(すなわち、HHV-1、HHV-2、HHV-3または水痘帯状疱疹ウイルス、HHV-4またはエプスタインバーウイルス、HHV-5またはサイトメガロウイルス、HHV-6AおよびB、HHV-7)、フラビウイルス(すなわち、ジカウイルス、デング熱ウイルス、日本脳炎ウイルス)、ヒト免疫不全ウイルス(HIV)、肝炎ウイルス(HAV、HBV、HCV、HDV、HEV)、SARS-CoV2、リジュンガンウイルス(LV)、インフルエンザAウイルス、ボルナ病ウイルスなどがADのリスクを高める可能性がある。ここでは、これらの結果をまとめ、考察した。これらの知見に基づき、今後の研究の重要な課題も提示した。
キーワード
アルツハイマー病、ウイルス、感染仮説、神経変性、ベータアミロイド、タウタンパク質
1.はじめに
アルツハイマー病(AD)は、高齢者に最も多くみられる認知症である(Breijyeh and Karaman, 2020)。主な臨床症状には、認知機能の低下と、精神神経症状または認知症の行動・心理症状(BPSD)として知られる知覚、気分、性格、基本的機能に関わる他のいくつかの症状がある(Altomari et al.、2022、Laganà et al.、2022)。発症年齢に基づいて、ADは散発性AD(sAD)-その原因はいくつかの仮説に関連する可能性がある(Brunoら、2022)-と家族性AD(fAD)- プレセニリン1(PSEN1)、プレセニリン2(PSEN2) またはアミロイド前駆体タンパク質(APP)遺伝 子の変異の明らかな常染色体優性遺伝であっても、代々家族内で遺伝する-に分類することができる(Abondioら、2021)。
この疾患の主な神経病理学的特徴は、 アミロイドβ(Aβ)ペプチドの細胞外沈着(アミロイド斑)と、リン酸化が進みミスフォールディングしたタウの神経細胞内凝集体(神経原線維のもつれまたは神経原線維凝集体)である(Serrano-Pozoら、2011、Skaper. 2012)。Aβペプチドはアミロイド前駆体タンパク質(APP)に由来する。APPは膜糖タンパク質であり、細胞外にある大きなN末端グリコシル化ドメインと、細胞内にある小さなC末端ドメインが特徴である(Müller et al.)生理的条件下では、APPは非アミロイド生成経路(α-セクレターゼ経路)とアミロイド生成経路(β-セクレターゼ経路)の2つのプロセシング経路を受け、後者がAβペプチドの産生を促進する(Kojro and Fahrenholz, 2005)。より具体的には、βサイトアミロイド前駆体タンパク質切断酵素1(BACE1)は、APPの膜貫通部分を切断するβセクレターゼ酵素であり、γセクレターゼとともに、ADにおいてますます大きく、構造的に複雑な、可溶性の、局所に沈着した脳凝集体を形成するAβ種を生成する(Hampel et al.)AD患者では、アミロイド斑と神経原線維変化がびまん性大脳萎縮を伴い、特に大脳辺縁構造、前頭葉、側頭葉、頭頂葉で顕著である(Perl, 2010,Thompson and Vinters, 2012)、アストログリオーシス(Jain et al. 2015)、ミクログリオーシス(Hansenら、2018)、ニューロンおよびシナプスの損失(DeTureとDickson. 2019)、神経炎症(Henekaら、2015)。
アミロイドカスケード仮説(Hardy and Higgins, 1992)、コリン作動性仮説(Terry and Buccafusco, 2003など)、炎症仮説、感染性仮説(Komaroff, 2020,Bruno et al, 2022)などである。このうち、感染仮説(Naughtonら、2020)は、病原体とAβペプチドの産生および凝集との関連を支持する証拠が増えてきたこと(Brunoら、2022、Ezzatら、2019、Robinson and Bishop. 2002)、感染症に罹患した後にADを発症するリスクが増加することが報告されていること(Itzhakiら、2020)、AD患者の脳内にウイルスが存在することが報告されていることから、最近大きな注目を集めている。
ウイルスは、生体細胞内でのみ生存・繁殖可能な偏性細胞内寄生生物である。ウイルスは、引き起こす病気や攻撃する臓器が多様である傾向があるが、すべてのウイルスは構造が統一されており、タンパク質と核酸から構成されている(Taylor, 2014)。核酸を外部環境から保護するために、ウイルスは核酸をカプシドと呼ばれるタンパク質の殻で包んでいる。核酸とカプシドは一緒になって、ビリオンのヌクレオカプシドを形成する(Louten, 2016)。ウイルスはまた、遺伝物質としてRNA またはDNAを 含むという点でもユニークである。とはいえ、ウイルスにはリボソームやミトコンドリアなどの細胞様小器官は存在しない。宿主細胞の代謝過程なしには複製できないため、ウイルスは遺伝的寄生生物である(Taylor, 2014)。ウイルスの分類は単純ではなく、2800種以上のウイルスが存在し、その性質も大きく異なっている。主な分類は、ビリオンの大きさ、カプシドの構造、核酸の種類、物理的性質、宿主種、または原因となる疾患に基づいている(Taylor, 2014)。
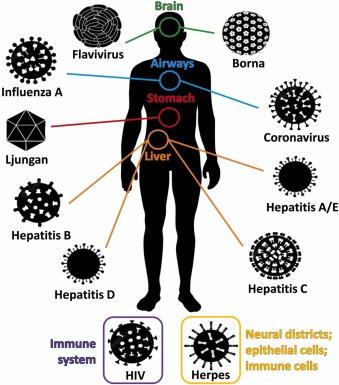
ADの背景に感染症があるという考えは、1907年にアロイス・アルツハイマーの「ライバル」であったオスカー・フィッシャー( OskarFischer)によって初めて提唱された(Allnutt and Jacobson, 2020)。この仮説は、 1991年にJamiesonら(Jamieson et al.過去30年の間に、ADのリスク上昇に関連するウイルスの数が増加している:他の ヘルペスウイルス、フラビウイルス、ヒト免疫不全ウイルス(HIV)、 肝炎ウイルス、リュンガンウイルス、 ボルナウイルス、 A型インフルエンザウイルスなど(図1、 表1)(Chan and Valcour, 2022,Chemparthy et al. 2021、Chuら、2021、Filgueiraら、2021、Jhaら、2020、Lingelら、2020、Magakiら、2022、Murphyら、2021、Nirら、2021、Ojeda-Juárez and Kaul. 2021、Yinら、2022)。われわれの知る限り、ADの病因におけるこれらのウイルスの潜在的な役割については、ほとんど検討されていない。ここでは、このテーマに関する現在の実験的証拠を包括的にまとめ、レビューする。その結果に基づいて、今後の研究の重要な課題を提示する。

図1.特定のウイルス/ファミリーのウイルス感染に主に関与する部位
表1.ADリスクの上昇に関連するウイルスの一般的特徴。
| 家族 | 属 | 種 | 名称 | ゲノムの種類 |
|---|---|---|---|---|
| ヘパースウイルス科 | シンプレクスウイルス | ヘルペスα-エルペウイルス1 | ヒトヘルペスウイルス1 (HHV-1) | 二本鎖DNA |
| ヘルペスα-エルペウイルス2 | ヒトヘルペスウイルス2 (HHV-2) | |||
| バリセロウイルス | ヘルペスα-エルペウイルス3 | ヒトヘルペスウイルス3(HHV-3)または水痘帯状疱疹ウイルス(VZV) | ||
| リンパクレイプトウイルス | ヘルペスガンマエルペウイルス4 | ヒトヘルペスウイルス4(HHV-4)またはエプスタイン・バーウイルス(EBV) | ||
| サイトメガロウイルス | ヘルペスβヘルペウイルス5 | ヒトヘルペスウイルス5(HHV-5)またはサイトメガロウイルス(CMV) | ||
| ロゼオロウイルス | ヘルペスβヘルペスウイルス6 | ヒトヘルペスウイルス6 AおよびB(HHV-6AおよびHHV-6B) | ||
| ヘルペスβヘルペスウイルス7 | ヒトヘルペスウイルス7 (HHV-7) | |||
| フラビウイルス科 | フラビウイルス | ジカウイルス | ジカウイルス(ZIKV) | 一本鎖RNA |
| デングウイルス | デングウイルス(DENV) | |||
| 日本脳炎ウイルス | 日本脳炎ウイルス(JEV) | |||
| レトロウイルス科 | レンチウイルス | ヒト免疫不全ウイルス1と2 | ヒト免疫不全ウイルス(HIV-1およびHIV-2) | 一本鎖RNA |
| ピコルナウイルス科 | ヘパトウィルス | ヘパトウィルスA | A型肝炎ウイルス | 一本鎖RNA |
| ヘパトウイルスB | B型肝炎ウイルス | 二本鎖DNA | ||
| ヘパトウィルスC | C型肝炎ウイルス | 一本鎖RNA | ||
| ヘパトウィルスD | D型肝炎ウイルス | 一本鎖RNA | ||
| ヘパトウィルスE | E型肝炎ウイルス | 一本鎖RNA | ||
| コロナウイルス科 | ベータコロナウイルス | 重症急性呼吸器症候群関連 コロナウイルス |
重症急性呼吸器症候群 C オロナウイルス2 (SARS-CoV-2) |
一本鎖RNA |
| ピコルナウイルス科 | パレコウイルス | パレコウイルスB | リュンガン・ウイルス(LV) | 一本鎖RNA |
| ボルナウイルス科 | オルソボルナウイルス | 哺乳類1型オルソボルナウイルス | ボルナ病ウイルス(BDV) | 一本鎖RNA |
| オルトミクソウイルス科 | アルファインフルエンザウイルス | インフルエンザAウイルス | インフルエンザAウイルス(IAV) | 一本鎖RNA |
2.ヘルペスウイルスとAD
ヘルペスウイルスは 、ヘルペスウイルス 科に属する正20面体対称の2本鎖 DNAウイルスで ある(Roizmannら、1992)。すべてのヘルペスウイルスは生産性感染と溶解性感染を起こし、感染者の反応性に応じて多かれ少なかれ長い華やかな時期を経て潜伏感染となる。潜伏部位はヘルペスウイルス亜科ごとに異なるが、これらの部位は常に免疫系による絶え間ない攻撃から保護されており、感染者からこれらのウイルスを根絶することは事実上不可能である。現在、水痘帯状疱疹ウイルス(VZV)としても知られるHHV-3、エプスタイン・バーウイルス(EBV)としても知られるHHV-4、 サイトメガロウイルス(CMV)としても知られるHHV-5を含む8種類のヒトヘルペスウイルス(HHV)が知られている(Carneiro et al.)HHV-8を除くこれらのウイルスはすべて、ADと関連している(Ashrafら、2019、Barnesら、2015、Bernsteinら、2020、Jeong and Liu. 2019、Polkら、2002)。このテーマに関して近年行われた主な研究を以下の小項目で述べる。
2.1.HHV-1とHHV-2
HHV-1およびHHV-2は、Simplexvirus属およびHerpesviridae科の2つの近縁種のウイルスである(Carneiro et al .) シンプレクスウイルス属のウイルスはエンベロープ状のカプシドを有し、形や形状は様々で、直径は150〜200nmである;ゲノムは線状で、長さは約152キロベース(kb)であり、多くの場合、代替スプライシングによって転写される重複遺伝子を有する(Carneiroら、2022、Duarteら、2019) 。宿主細胞への侵入は、ウイルス表面タンパク質が エンドサイトーシスを仲介 する宿主細胞レセプターに付着することで達成さ れる。複製は細胞核内で起こるが、翻訳はリーキースキャンニング(すなわち 、タンパク質合成の実際の開始位置が 迂回され、翻訳が配列に沿ってさらに下流で起こる可能性がある)によって行わ れる(Carneiro et al.)ウイルスは主に溶原性であり、核脱出(すなわち、核孔の代わりに核膜を通過する)、出芽、微小管輸送によって宿主細胞から排出される(Carneiro et al, 2022,Zhu and Viejo-Borbolla, 2021)。
HHV-1は三叉神経節に存在する傾向があり、多くの場合、口の周りや唇にできる冷え症の形で現れ、数日から数週間で自然に治癒する(Cohen, 2020,Duarte et al.)50歳未満の世界人口の約67%がHHV-1に感染している(Jamesら、2020)。感染力も強く、HHV-1は小児期に経口感染することが多い(Jamesら、2020年)。キスや口と性器の接触など、感染した唾液が関与する場合には性行為感染することもある(Jamesら、2020年)。この種は特に神経系にダメージを与えるようで、特にAPOEε4キャリアの場合、HHV-1感染がAD発症リスクの上昇につながるという研究もある(Wuら、2020、Zhangら、2020)。さらに、AD脳のアミロイド斑(アミロイド斑の90%がウイルスDNA全体の72%を含む)では、加齢した正常脳(アミロイド斑ではウイルスDNAの24%しか検出されなかった;p値<0.001)に対して、ウイルスDNAが非常に高い頻度で局在していることが観察された(Wozniakら、2009)。しかしながら、最近の研究では、HHV-1が異常なAβおよびリン酸化過剰タウタンパク質の発現に影響を与える可能性は否定された。なぜなら、感染した三叉神経節およびAD患者や対照者の脳では、どちらもウイルスDNAと優先的に共局在しないからである(Tran et al.)また、 H4-Nヒト脳細胞株を用いた in vitro実験では、 HHV-1がAPPのエンドサイトーシス、切断、Aβ産生を開始し、細胞外からのAβ沈着によってAD発症を刺激するというメカニズム的関与が示唆された(Ge and Yuan, 2022)。さらに、HIVに感染しているが神経症状はない患者(n=128、平均年齢48歳、範囲43-54歳、女性28%)の脳脊髄液を分析したところ、慢性HHV-1重複感染と血液脳関門(BBB)透過性およびAβ濃度との間に逆相関があることが示され、被験者が少なくとも1回HHV-1の症候性再活性化を起こしていれば、より有意な相関が認められた(Trunfioら、2023)。このことは、HHV-1感染が直接的な原因ではなく、ADや認知症の症状を調整する危険因子としての役割を担っていること、また感染の神経学的転帰を決定する上で環境因子や宿主因子が関与していることを示唆している。実際、慢性ウイルス感染症は、必ずしも認知症にエスカレートするわけではない一般的な認知障害において、より顕著な役割を担っていることが示唆されている(Murphyら、2021)。さらに、マウスの海馬ニューロンおよび膠芽腫細胞を用いた実験的研究により、脳内のタンパク質の蓄積は、ウイルス感染/再活性化に対する即時的(神経原線維凝集体による)または長期的(Aβ蓄積による)反応であり、ウイルスの存在とそれに伴う抗ウイルス免疫反応の両方によって引き起こされるという仮説が紹介されている(Vojtechovaら、2022)。興味深いことに、抗ウイルス薬の使用によって脳内のアミロイド斑や神経原線維凝集体の蓄積が抑制され、HHV-1が関与するAD関連の認知障害や認知症に対する創薬や薬理学的治療への道が開かれる可能性があることも、いくつかの研究で報告されている(Arruéら、2022、Lehrer and Rheinstein. 2022、Prottoら、2022、Vojtechovaら、2022)。実際、HHV-1とADの明確な関連を示す証拠はまちまちであり、この関係の課題と治療機会についてより多くの光を当てるために、いくつかの調査項目が追求されている。
密接に関連するHHV-2は、性器ヘルペスの形で現れることが多く、主に性感染症である(Cohen, 2020)。このウイルスは仙骨神経節に存在する傾向があり、そこから定期的にヒトの性器管に排出されるが、ほとんどの場合無症状であるため、気づかれずに性感染する可能性が高くなる(Schiffer et al.)無症候性再活性化は、感染の兆候として目に見えにくい症状によって特徴づけられるため、患部に水疱がなくてもウイルスを獲得する可能性がある(Johnstonら、2011年)。過去40年の間に、いくつかの抗ヘルペス薬が製造、試験され、商業化に成功している(Krishnan and Stuart, 2021,Majewska and Mlynarczyk-Bonikowska, 2022)。例えば、HHV-2陽性で無症状の人を対象とした無作為化試験で、1日1gのバラシクロビルの有効性が60日間試験された。一部の被験者には抗ヘルペス薬が投与され(n=36、平均年齢39±13歳、女性24%)、他の被験者にはプラセボが投与された(n=37、平均年齢36±11.5歳、女性29%)。毎日綿棒を採取し、PCR法でHHV-2の検査を行った。この研究では、バラシクロビルを投与された患者では、プラセボと比較して無症候性のウイルス排出が71%減少したことが強調された(p値<0.001)(Sperlingら、2008)。興味深いことに、不一致のパートナー(一方は感染、一方は非感染)を持つ911組のカップルを対象とした別の研究では、感染率は性的接触10000回につき約5回であり、無防備な性行為ではHHV感受性女性に顕著な影響があり、保護された性行為では性に偏った感染(すなわち、感染女性はコンドームを使用していても非感染の性的パートナーにウイルスを感染させる可能性が高い)が認められた(Magaret et al.)中枢神経系(CNS)では、HHV-2は髄膜炎や髄膜脳炎に関連することが最も多く、特に新生児に深刻な結果をもたらしている(Berkhoutら、2022、Jakobsenら、2022;Liら、2022b)が、in vitroおよびin vivoの両方で認知症様症状やADへの関与に関する証拠は限られている(Bergströmら、2021、Kristenら、2015年)。
2.2.HHV-3 (VZV)
HHV-3またはVZVは ヘルペスウイルス科に属するDNAウイルス である(Arvin, 1996)。VZVは潜伏していることがあり、衰弱したり免疫力が低下したりすると再び出現する。つまり、一次感染である水痘と、一次感染から何年も経ってから発症する二次感染である帯状疱疹(HZ)であり、一般に「帯状疱疹」と呼ばれている(Arvin, 1996,Gershon et al.)
水痘は非常に感染力の強い疾患で、典型的な小児疾患ではないが、全身に小水疱が散在する皮疹が出現する(Dunkleら、1991) 。第一段階では、ウイルスは空気感染(くしゃみ、キス、咳など)と小水疱への直接接触の両方で感染する。この感染様式はウイルスのライフサイクルによるものである。 鼻 粘膜や局所のリンパ節の T 細胞に感染した後 、増殖し、そこから血液を介して肝臓、脾臓、その他のリンパ節に至る。 これらの臓器でウイルスは再び増殖し、その後皮膚や粘膜に到達する。この時点で、皮膚に移行したウイルスは斑状丘疹状病変を生じ、それが血清を含む小水疱となる。この血清は、最初は透明であるが、小水疱が終末期である膿疱に入ると混濁し、やがて痂皮に変化する。小児では、水痘の合併症として、出血性症状、脳炎、および血液、骨、肺、皮膚を含む細菌感染症が起こりうる(Gershonら、2015)。
前述のように、VZVは脳神経節、後根神経節、腸神経節、自律神経節の神経細胞に潜伏していることがあり、再活性化するとHZを引き起こす。帯状疱疹の最も高い発生率は、50歳以上または免疫不全患者、特にHIV/AIDS患者である(Yawn et al., 2007)。HZは小水疱性発疹を特徴とし、多くの場合、激しい疼痛を伴う。T3からL3までの皮膚節が侵されることが多い。三叉神経の眼枝が侵された場合、眼性帯状疱疹(HZO)は紅斑の出現とともに現れ、”クラスター “状に集まった水疱を伴う。この発疹は、ウイルスが神経に潜伏していたまぶたの限られた範囲に生じます。特徴的なのは痛みで、最初はピリピリした痛みから始まり、やがて灼熱感や耐え難い痛みに変わっていきます。その後、感染は結膜や角膜に広がることもある(Sampathkumar et al., 2009)。
HZの最も頻度の高い合併症は、帯状疱疹後神経痛(PHN)であり、小水疱性皮疹の出現を特徴とするウイルス性疾患で、HZの治癒後も激しく持続する焼けるような痛みを伴う(Kost and Straus, 1996,Sampathkumar et al., 2009)。例えば、衣服に触れたり、夜間動いたり、あるいは急激な温度変化、大きな音、精神的ストレスなどが引き金となり、耐え難い激痛が生じ、生活の質を著しく損なうことがある。しかし、痛みの強さはまだ主観的なものと考えられている(Baron et al., 2009)。最も重要な危険因子は、この場合も成人期である。一般的に、若い人よりも50歳以上の人の方がこの病気にかかりやすいと言われている(Yawn et al., 2007)。
これまでの研究で、ADではかなりの脳血管病変が存在することが示されている(Chenら、2009、O’Brienら、2003)。実際、脳低灌流と虚血現象は非常に頻度が高く、その結果として血管新生が起こり、これがAβと相乗してADを発症させる。特に高齢で免疫不全の患者では、VZVは脳動脈で複製して血管障害を引き起こし、その後に脳細胞を損傷する唯一のヒトウイルスである(Gilden et al.)したがって、認知症リスクの上昇とVZVによる血管障害との関連は検証可能な仮説である。
Tsai氏ら(2017)は、HZOと感染後の認知症リスクとの関係を検証しようとした。彼らは、HZOと診断された患者群(n=846、平均年齢62.2±12.5歳、女性50.3%)と対照群(n=2538、平均年齢61.4±13.3歳、女性49.1%)を特定し、合計3384人の研究参加者を得た。第1群ではHZOの初診日から、対照群では同時期に医療サービスを初めて利用した日から、認知症と診断される個人を特定するために、参加者を5年間個別に追跡調査した(Tsai et al.)その結果、追跡調査期間中に認知症と診断されたのは、HZO患者では4.61%であったのに対し、HZO患者では1.65%であった。さらに、この研究では、HZOがその後の認知症リスクを有意に増加させることが示された(ハザード比[HR]=2.83、95%信頼区間[CI]=1.83-4.37、p値<0.001);このリスクは、女性よりも男性の方が1.4倍高いことが判明した(HR=3.35、95%CI=1.79-6.28、p値<0.001vsHR=2.40、95%CI=1.31-4.41、p値<0.01)(Tsai et al. 2017).
ヘルペスウイルス(HZを含む)の診断を受けた後のADリスクは、65歳以上で約30%有意に増加すると推定したUkraintsevaらによって、VZVとADの直接的な関連が確かに見出された。しかし、同じ研究において、これらのウイルスに対するワクチン接種は、このサンプルにおいてADリスクの有意な減少をもたらさないことが判明した(Ukraintsevaら、2017)。しかし、HZ患者39205人を含む78410人を対象としたChenらの研究によれば、抗ウイルス治療は認知症の予防に有効である可能性がある(HR=0.55、95%CI=0.40-0.77、p値<0.05)。平均追跡期間6.22年の間に、4204人の被験者が認知症と診断され、認知症の発症にHZが関与している可能性が示唆された(HR = 1.11; 95%CI=1.04-1.17、p-value<0.05)(Chen et al.)
Baeらによるより最近の知見も、2018年にChenらによって報告されたものと一致している(Bae et al.、2021)。彼らの研究では、195089人の健常者(平均年齢61.7±9.4歳、女性54.7%)と34505人のHz患者(平均年齢60.3±8.1歳、女性61.3%)が対象となり、そのうち28873人(平均年齢66.9±8.1歳、女性61.3%)が抗ウイルス治療を受けた。HZ患者のADリスクはHRで1.11(95%CI =1.04-1.19、p値=0.003)であった。また、未治療群と治療群におけるHZ後の認知症発症率は、それぞれ1000人年あたり12.26(95%CI =10.87-13.65、p値=0.003)であった。87-13.65、p-value<0.001)、1000人年当たり9.36人(95%CI=8.20-10.52、p-value<0.001)であり、治療群の認知症リスクのHRは0.76(95%CI=0.65-0.90、p-value<0.001)であった(Bae et al. 2021).逆に、Choiらは、HZは年齢や性別を問わず認知症リスクを増加させないことを強調している(Choiら、2021a)。最近、Cairns、ItzhakiとKaplanは、ADの病態にHZが関与していることを見いだせず、HSV-1の再活性化を促進するVZVの間接的な影響を仮定した(Cairns et al., 2022)。同じ年の別の研究では、HZが認知症の発症に関与している可能性は否定されており、ワクチン接種が認知症の予防に有効であるとは考えられていない(Schmidt et al.)しかし、VZVとADの直接的な関連については、まだ相反する結果が出ており、これらの点を明らかにするためには新たな研究が必要であろう。
2.3.HVV-4 (EBV)
エプスタイン・バー・ウイルス(EBV)としても知られるヒトヘルペスウイルス4は、リンパクリプトウイルス属に属するガンマヘルペウイルスであり、長さ約172kbpの二本鎖DNAを持ち、85以上の遺伝子をコードしている。DNAはタンパク質のカプシドに包まれており、これらのタンパク質とウイルス膜の間にはウイルスマトリックスが介在している(Odumade et al.)成熟したビリオンの直径は通常120~180ナノメートル(nm)で、その外表面には糖タンパク質が存在し、これらは宿主細胞に侵入し感染するために最も重要である(Hoover and Higginbotham, 2023)。
EBVは1964年、Epstein、Barr、Achongによってバーキットリンパ腫組織から初めて単離された(Epstein et al.)これは腫瘍関連ウイルスとして初めて報告された症例であり、その発見により、ある種のがんはウイルス起源であるという仮説が導入された(Esau, 2017)。
EBVは主に、 ウイルスタンパク質gp350と宿主細胞のCD21タンパク質との接触を通じて、上皮細胞や免疫B細胞に感染する(Speck et al., 2000)。別のメカニズムとしては、ウイルスタンパク質gp42とHLAクラスII分子が関与する(Odumade et al.)感染したB細胞の数は症状が現れた後に減少するが、生物から完全に排除することは不可能のようである(Hadinotoら、2008)。上皮細胞を攻撃する際、BMRF-2ウイルスタンパク質はインテグリンavb1と相互作用し(Tugizovら、2003)、ウイルス膜タンパク質gH/glはインテグリンavb6/8と相互作用して上皮細胞に合流する(Chesnokovaら、2009)。EBVには、核抗原(EBNA2およびEBNA3A-B-C)によって区別できる2つのサブタイプがある(Sample et al.、1990)。最初の亜型はアジア、ヨーロッパ、北米で優勢であるが、アフリカでは両方の亜型が共存している(Fields et al., 2007)。亜型はまた、細胞溶解を刺激し、細胞死を誘導する自発的な能力においても異なっている(Buck et al., 1999)。
しかしEBVは、ウイルス活性が検出されない持続的な細胞感染状態(潜伏期)を誘導することもできる(Odumade et al.)この状態でどの遺伝子が発現するかによって、このウイルスには3種類の潜伏期が存在し、それぞれ免疫B細胞の挙動に異なる影響を与えるという特徴がある(Cohen, 2020,Murata, 2014)。例えば、バーキットリンパ腫では、免疫B細胞におけるEBNA1、EBERS、BART遺伝子の発現を特徴とするタイプ1の潜伏感染が検出される(Roweら、1987)。2型潜伏は上咽頭がんで認められる(Raab-Traub, 2002)。3型潜伏は様々な病態に特徴的である(Young et al., 1989)。最後に、 メモリーB細胞にウイルス遺伝子が発現しない0型潜伏が存在する(Babcockら、2000年)。
EBV発現には、若年、社会経済的地位の低下、衛生状態の低下など、いくつかの危険因子が存在する(Bakkalciら、2020、Higginsら、2007)。EBVは主に唾液を介して経口感染し、若年成人が罹患する症例の少なくとも50%で単核球症と関連している(Dunmire et al.)乳幼児は、口移しする前に親が固形食品を咀嚼して乳幼児のために分解する「予措法」によってウイルスに感染する可能性がある(Bakkalci et al .)臨床的には、EBVは単核球症感染の主な原因である。EBVに感染した対象者は、発熱、疲労、咽頭痛などの症状を発症する確率が高いが、リンパ節腫脹、脾腫、肝腫大も診断されている(Dunmire et al, 2018,Son and Shin, 2011)。
EBVはすでにいくつかの神経病理と関連している(Zhangら、2022)。実際、いくつかの研究から、EBVはCNSで複製され、BBBの完全性を損なうことが明らかになっている。BBBが関与する病変は、神経認知機能の低下、神経損傷、神経炎症と関連している(Liu and Cohen, 2016,Meyding-Lamadé and Strank, 2012,Van Gent et al.)EBV感染に関連する主な神経病理は、パーキンソン病(PD)、多発性硬化症(MS)、急性小脳失調症、髄膜炎、急性びまん性脳脊髄炎である(Zhangら、2022)。
ADはEBV感染とも関連しているようだ。2014年の研究(Carbone et al., 2014)では、ADと診断された被験者(n=93、平均年齢83.89±6.89、女性75.25%)を対照群(n=164、平均年齢77.44±5.26、女性46%)と比較し、EBVやその他のヘルペスウイルスの存在を検出しようとした。末梢血白血球を分析したところ、AD患者の45%、対照群の31%がEBVに感染していた(奇数比[OR]=1.843、95%CI=0.976-3.480)。さらに、APOE遺伝子のε4アイソフォームによって対象者を層別化することで、ε4対立遺伝子がEBV陽性と関連するのは対照群のみであり、追跡調査中にADを発症した対象者ではEBV抗原に対するIgGレベルが上昇していることが示された(Carbone et al. 2014).したがって、本研究は、EBV感染がAD発症の危険因子としてどのように作用するかを浮き彫りにした。
Shimらによる縦断的研究では、ベースライン時には認知機能障害を示さなかったが、2年以内に無記名MCIを発症した韓国人コホート(n=36、平均年齢66.6±3.9歳、60%女性)の血漿中の抗EBV igGsレベルを分析した(Shimら、2016)。これらの被験者は、同じようにマッチさせた健常対照群と比較され、韓国版ミニメンタルステート検査(MMSE)、アルツハイマー病神経心理学的バッテリー(CERAD)および臨床認知症評価(CDR)スケールで検査され、抗EBV IgGs抗体は市販の酵素結合免疫吸着測定(ELISA)キットで分析された(Shim et al.)研究の結果、MCIを発症しやすい被験者ほど抗EBV IgG値が高く、これらの値はCDR(β=0.244、p値=0.049)とCERAD-K(β=-0.177、p値=0.036)の両スコアと相関していた。IgGレベルとK-MMSEスコアとの間には有意な相関は確認されなかった(Shim et al.)この研究はさらに、EBV感染が、限定的なものであっても認知機能低下の発症の危険因子である可能性を示唆している。
さらに最近の研究では、Huang氏らがメンデルランダム化研究デザインにより、(EBV感染による)単核球症とADリスクとの間に有意な関連を発見した(OR=1.634、95%CI=1.092-2.446、p値=0.017、偽発見率[FDR]調整、p値=0.034)。017、偽発見率[FDR]調整、p値=0.034)、少なくとも97%のヨーロッパ人祖先を持つ個人の大規模コホートにおいて、同じ病気がADの家族歴と関連していることを強調している(OR=1.392、95%CI=1.061-1.826、p値=0.017)(Huang et al. 2021).
しかし、Tornianien-Holm氏らによる先行研究では、健常成人においても高齢者集団においても、EBV感染と認知機能低下との間に関係は認められなかった(Torniainen-Holm et al.)特に、フィンランドのコホート(n=6554、平均年齢53.0±0.4歳、女性52.5%)を対象とした彼らの縦断研究では、いくつかの神経心理学的検査を通じて認知能力を測定したところ、CMVおよびEBVに対するIgG値(固相免疫測定法により検出)は認知パフォーマンスと関連せず、したがって認知機能の低下とも関連しないことが示された(Torniainen-Holm et al.)
EBV感染とAD発症の関連を支える分子メカニズムは、まだほとんど解明されていない。何人かの著者は、EBVが潜伏性であることから、初感染後も免疫系は常に活性化されており、慢性的な炎症状態が加齢とともにAD様の表現型を誘導することが検証されているという仮説を立てた(Carboneら、2014、Krsticら、2012、Leonardo and Fregni. 2023)。さらに、サイトカインレベルの急上昇や、α1-アンチキモトリプシンなどの他の炎症初期マーカーは、すでにADや加齢による認知機能低下と関連している(Carboneら、2014)。
ADとEBVとの間に明確な関連性が存在するかどうかをよりよく理解するためには、さらなる解析が必要である。これが実証されれば、EBVがADおよびその神経生物学的表現型の直接的な原因であるかどうかを決定することが最も重要であろう。
2.4.HHV-5 (CMV)
HHV-5またはCMVは、世界人口の60%から90%に感染している広範なウイルスであり、発展途上国や社会経済的条件の悪い地域で血清有病率が高い(Fowlerら、2022、Zuhairら、2019)。CMVはエンベロープを持つ二本鎖DNAウイルスで、ほぼ球形をしており、直径は約150〜200nmである。エンベロープの下には、対称性が正20面体である古典的なウイルスカプシドが存在する。CMVビリオンは約30-40のタンパク質を含むと推定されている(Varnum et al.)感染段階において、CMVはエンドサイトーシス機構を介し、特徴的な糖タンパク質を利用して細胞内に侵入する。一旦攻撃された細胞内に入ると、後者の核内に局在し、ここで宿主の核内酵素を利用して複製を開始する(Crough and Khanna, 2009)。CMVの新たな宿主への伝播は、様々な方法で起こりうる。明らかに感染者のものであるか、感染が進行している口腔咽頭、膣、精嚢分泌液との直接接触、妊娠後の授乳期における母乳を介して、妊娠中の経胎盤感染、感染した血液や血液製剤の輸血、骨髄移植や臓器移植の後などである(Sia and Patel, 2000)。健康な人の場合、CMVはせいぜい症状の軽い感染を引き起こす程度である。CMVが実質的で明らかな症状を引き起こすまれなケースでは、進行中の感染の症状は、一般的なインフルエンザの症状を彷彿とさせる。実際、それらは一般的に38℃以上の発熱、悪寒、全身倦怠感、咽頭痛、疲労感、筋肉痛、リンパ節腫脹、関節痛、食欲不振からなる(Crough and Khanna, 2009,Gandhi and Khanna, 2004)。時に、CMV感染による症状が単核球症の典型的な症状と混同されることがある。
先天性CMV感染は、早産、低体重児出産、黄疸、肝臓の肥大と機能低下、全身の紫斑を特徴とする皮疹、小頭症、脾臓の肥大、肺炎、てんかんなど、さまざまな結果をもたらす可能性がある(Adlerら、2007、Crough and Khanna. 2009)。免疫系の機能が低下している人(HIV/AIDS患者など)では、CMV感染が眼、肺、肝臓、食道、胃、腸、脳など様々な臓器の機能に影響を及ぼし、網膜の炎症に伴う視力低下、消化器障害、脳炎、肺炎などの症状が現れることがある(Rubin, 2007)。免疫系はCMV感染の拡大に効率的に対抗できるが、ウイルスを永久に根絶できないことが多い。このことは、一時的な免疫系の全般的弱体化(例えばストレスなど)がCMVを再活性化し、二次感染を引き起こすまで、感染者の骨髄細胞にCMVが臨床的に潜伏していることを意味する(Forte et al.)健康な人では、再活性化現象は問題にならない。逆に、免疫抑制者では、CMVの再活性化は、免疫不全者の一次感染で報告されているような深刻な結果を引き起こす可能性が高い。要するに、健常者ではCMV二次感染は臨床的には無関係であるが、免疫抑制者にとっては特に恐れられている危険な事象である(Luscalovら、2016、Ongら、2022、Pröschら、2000)。
CMV感染、CMVに対する免疫反応とADの関係を分析した研究は数多くある(Honjo et al.)Barnes氏らは、CMV血清陽性の罹患率における民族差を検証し、アフリカ系アメリカ人(AA)とヨーロッパ系アメリカ人(EA)の高齢者を対象に、CMV血清ステータスとAD発症および認知機能低下との関連を、毎年平均5年間調べた(Barnes et al.)彼らはまた、民族/祖先がこの関連を修飾するかどうかも評価した。この研究の参加者(n=849、平均年齢78.6±7.2歳、黒人25%、女性76%)のうち、73.4%(n=623)がCMV感染陽性と判定され、CMV抗体レベルはEAよりもAAで有意に高かった(89.0%対68.2%、p値<0.001)(Barnesら、2015)。また、平均5年間の観察後、n=93人がADを発症し、CMV血清陽性は、AD発症の相対リスク(RR)の2倍上昇(RR=2.15、95%CI=1.42-3.27、p値<0.001)と、被験者の民族/祖先の背景とは無関係な認知機能低下の速さと関連していた(Barnesら、2015)。
Lurain博士らは、CMVの再活性化により、血清陽性者ではCD28-/CD57+の表現型を持つCD8+T細胞(細胞傷害性効果でウイルスを破壊することが知られている)の割合が高くなり、細胞の老化やADの病理学的診断に関連することを示した。同様に、同じ表現型を持つCD4+T細胞(抗体の産生を助ける)の増加は、感染者におけるAβの蓄積と相関することが指摘された。さらに、この研究では、CMV特異的血清IgG抗体レベルと神経原線維凝集素との間、および脳脊髄液IFN-γとCMV血清ステータスと神経原線維凝集素との間に有意な関連があることがわかった(Lurain et al.)
炎症反応、特にIFN-γレベルの上昇は、Westmanらによる研究でも、ADのCMV血清陽性患者とADのCMV血清陰性患者(n=26vs4、平均年齢78.3±6.54歳、女性43%)を比較して認められた(Westmanら、2014)。したがって、ADの免疫学において、IFN-γは炎症促進因子としてかなりの役割を担っているという仮説が成り立つ。
さらに、Buら(2015)は、健常対照者(n=102、平均年齢69±9歳、女性63%)とAD患者(n=114、平均年齢70±10歳、女性69%)を比較したところ、 CMVの感染負担とAD発症との間に有意な関連があることを示唆した(OR=2.33、95%CI=1.140-4.766、p値=0.020)のに対し、健常対照者(n=102、平均年齢69±9歳、女性63%)とAD患者(n=114、平均年齢70±10歳、女性69%)を比較したところ、Lövheimらは、CMVとAD発症との直接的な関連は認めなかったが、ヘルペスに関連するCMVがADの発症を促進する可能性を示唆した(Lövheim et al. 2018).
この段落で示された結果が矛盾していることを考えると、CMV血清陽性が単独で、あるいは他の感染症とともに、ADの発症を促進するかどうかを証明するためには、他の研究が必要である。
2.5.HHV-6
HHV-6は、ヒトβヘルペスウイルス6A(HHV-6A)とヒトβヘルペスウイルス6B(HHV-6B)という非常によく似た2つの種を表す総称である。HHV-6AとHHV-6Bは、βヘルペスウイルス亜科に属するロゼオロウイルス属の二本鎖DNAウイルスである(Carneiro et al.、2022)。HHV-6AとHHV-6Bは、検査されたほぼすべてのヒト集団に感染する。HHV-6Bの一次感染は、一般的な小児疾患である亜胞状発疹性発疹(乳児ロゼオラまたは第6病としても知られる)の原因である(Carneiro et al.)HHV-6Aは主に子どもから子どもへと感染するため、大人がこの病気にかかることはまれである。HHV-6Aはより神経毒性が強く、てんかんやMSのような神経炎症性疾患の患者に多く見られるとされている(Bahramianら、2022年、Dunnら、2020、Santpereら、2020)。脳内のHHV-6濃度はAD患者でも上昇している可能性があるが、感染と疾患との明確な関係はまだ確立されていない。実際、この話題に関しては、限られた矛盾した証拠が見つかっており、いくつかの研究ではこの有害な関連を否定している(Agostini et al 、2017)、一方、免疫系の感受性と感染に対する反応を支持する証拠を見つける者もいる(Carboneら、2014、Licastroら、2015、Linら、2002、Readheadら、2018、Rizzoら、2019、Wozniakら、2005)。これらの結果を一般化することはできないが、それでも地域社会に関するいくつかの研究では、HHV-6転写産物の存在と神経認知障害との関係が強調されている。例えば、HHV-6感染者(n=290、平均年齢67.1±5.3歳、女性52.4%女性)を対象とした中国の研究では、性・年齢をマッチさせた健常対照者コホートと比較した場合、HHV-6コピー数と方向、注意-計算、言語のタスクとの間に有意な逆直線相関があり(すべてp値<0.05)、同じタスクについては非線形な用量反応相関があることが明らかになった(C. Huang et al. 2022).しかし、国際的な公衆衛生活動と学際的なアプローチに支えられた広範な実験的研究が、HHV-6と脳の関係についてより完全な枠組みを提供するために必要である。
2.6.HHV-7
ヒトヘルペスウイルス7(HHV-7)はβヘルペスウイルス亜科のロゼオロウイルスである(Ablashi et al., 1995,Staheli et al.)HHV-7はFrenkelらによってヒト宿主から分離され、特に健康なドナーのT細胞から分離された(Frenkelら、1990)。その後、Bernemanらは慢性疲労患者の 末梢血単核球(PBMC)からHHV-7を分離したことを報告している(Bernemanら、1992)。HHV-7はヒト集団に最も広く存在するウイルスの1つであり、最初の接触は乳幼児期に起こる可能性が高いと思われるが、感染は生涯続き、免疫不全者はウイルス再活性化時に重篤な臨床症状を発症するリスクが高い(Wang et al., 2007,Wyatt et al., 1991)。
HHV-7のビリオンの大きさは約200 nmであり、最も外側の部分は膜糖タンパク質の複合体であり、高密度のマトリックスとヌクレオカプシドが ウイルスの遺伝物質を保護している(Ablashi et al., 1995)。70以上のタンパク質をコードするHHV-7のゲノムは、長さ10kbの反復DNA配列によって両端が区切られた145kbの単一領域からなる(Kosuge, 2000,Staheli et al.)HHV-7に初感染すると、唾液腺がウイルスの貯蔵庫となる。唾液腺はウイルスが最も多く存在する解剖学的部位だからである(Yadavら、1997)。そこでHHV-7はCD4 + Tリンパ球と上皮細胞に浸潤する(Payne, 2017)。
臨床的には、HHV-7は第6の疾患である乳児バラ疹と関連している(田中ら、1994)。肝炎、呼吸器感染症、急性小児片麻痺(体の片側に起こる脱力や麻痺の繰り返しを特徴とするまれな神経発達障害)もHHV-7感染と関連しているという報告がある(Kosuge, 2000)。
HHV-7は成人および小児の神経障害を誘発することもある。Schwartzらの研究では、ポリメラーゼ連鎖反応を用いて、思春期の被験者(n=2972、平均年齢2.3歳、範囲0~17.99、女性45%)の脳脊髄液からHHV-7のDNA断片を検出した(Schwartzら、2014)。実際、57人(1.9%)からウイルスDNAが検出された。このうち3例では、一次HHV-7感染が神経疾患の実際の原因であった:2例はウイルス性脳炎、残りの1例はギラン・バレー症候群(GBS)であった。他の18人の青年はヘルペスウイルス感染に関連すると思われる神経疾患(脳炎、髄膜炎、脱髄)を示した。同様の神経疾患が、HHV-7に感染した成人被験者コホート(n=251、平均年齢55歳、範囲15~89歳、48.21%女性)でも認められている(Corral et al.)HHV-7が免疫不全の小児で急性脳症を誘発することも確認されている。Foiadelliたちは最近、急性脳症と活動性HHV-7感染を有する患者群(n=12、平均年齢9.5歳±4.5歳、女性50%)について報告した:ウイルスDNAはリアルタイムPCRによって髄液中に検出され、髄液1mLあたり20~3500DNAコピーが検出された。7人の患者に髄膜脳炎の症状がみられ、残りの5人には急性精神神経症状がみられた(Foiadelliら、2022)。
Readheadらによる最近の研究で、AD患者の脳組織では対照群と比較してHHV-6とHHV-7が有意に増加していることが明らかになった(Readhead et al.)この調査は、AD患者と健常対照者を含む4つの独立したマルチオミックデータセットを用いて行われた。さらに、ヘルペスウイルスの存在量とAPP 遺伝子変異との関連も同定した。具体的には、ADの有無にかかわらず脳におけるビリオンの存在を評価するため、彼らはマウントサイナイ脳バンクの2つのコホート(すなわち、AD患者と健常対照群)についてRNA配列解析を行った。 そして、4つの大脳領域(上側頭回、n=137、前頭前皮質、n=213、下前頭回、n=186、海馬傍回、n=107)のトランスクリプトーム解析を行った 。その結果、HHV-6とHHV-7の両方がAD患者の最初の2つの大脳領域でより多く検出された。さらに著者らは、AD患者と進行性核上性麻痺の被験者を比較することで、HHV-7とHHV-6Aのレベルは神経変性疾患間で等しく分布しているのではなく、考慮される疾患によって影響を受けることを明らかにした(Readhead et al.)しかし、Jeong氏らによる同じデータの詳細な再解析では、検証された仮説を除外することなく、元の研究ではADとウイルス量との間に実際の関連がなかったことを指摘している(Jeong and Liu, 2019)。さらに、2022年の研究(Bigleyら、2022)では、ネズミのロゼオロウイルス (ヒトのものと相関がある )に感染した5XFADマウスモデルを用いて、ロゼオロウイルス属のメンバーがAβ蓄積に及ぼす影響を評価している。 ウイルス負荷、神経病態、ウイルスとAβの相互作用を電子顕微鏡で分析した結果、マウスの神経炎症の原因はウイルスの直接感染であったが、Aβ沈着はウイルスによっても炎症エピソードによっても引き起こされなかったことが示された。同様に、AD患者(n=350)と対照群(n=31)(Charles F. and Joanne Knight Alzheimer’s Disease Research Center (Knight-ADRC)から採取したサンプルのサブセット)の中枢神経系におけるウイルスRNAの存在を分析した ところ、ロゼオロウイルス感染とADとの 直接的な関連は 認められなかった(Bigleyら、2022)。
これらの観察から、HHV-7と神経生物行動表現型を結びつけるいくつかの機序はADに典型的であることが示唆されるが、Aβ沈着や炎症との関係は明らかではない(図2)。したがって、HHV-7とADの関係を明らかにするためには、広範な機能的研究が必要であろう。

図2.神経系における向神経性および非向脳性ウイルス感染の主な症状。
3.フラビウイルス
フラビウイルスは、フラビウイルス科に属する一本鎖RNAウイルス属である(Westaway et al., 1985)。この属は86種のウイルスからなり、そのうち73種は53種に分類されている(King et al.)少なくとも40種のフラビウイルスがヒトや脊椎動物に病原性を示し、肝炎、血管ショック症候群、脳炎、急性弛緩性麻痺、先天異常、胎児死亡などさまざまな病気を引き起こすことが知られている(King et al.)これらのウイルスの中には、 ジカウイルス、デングウイルス、 日本脳炎ウイルスなどがあり、ADとの関連が指摘されている(Chuら、2021、Lingelら、2020、Yinら、2022)。このテーマに関して近年行われた主な研究を以下の小項目で紹介する。
3.1.ジカウイルス
ジカウイルス(ZIKV)は、フラビウイルス 科 フラビウイルス属の節足動物媒介性ウイルス(アルボウイルス)である(Musso and Gubler, 2016)。ZIKVは直径40nmを超えない球形をしており、フラビウイルス科に属する他のウイルスと同様に、 正20面体のカプシドに包まれた一本鎖RNAゲノムを持ち、カプシド(C)、前膜/膜(prM/M)、エンベロープ(E)の 3つの構造タンパク質をコードする正極性で約11,000塩基の長さを持つ。ゲノムは5′-UTRと3′-UTRの2つの非翻訳領域に挟まれている。非構造タンパク質は、主にウイルス複製を促進する機能を持ち、NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5があり、後者はRNA依存性RNAポリメラーゼタンパク質である(Kuno and Chang, 2007)。 系統解析の結果、ジカウイルスはアフリカ系とアジア系の別個の系統に分類できることが示された(Plourde and Bloch, 2016,Sirohi and Kuhn, 2017)。ZIKVは1947年、ジカの森(ウガンダ)で発熱したアカゲザル(Macaca mulatta)から初めて分離され、その後同じ森のイエネコから同定された(Dickら、1952)。ヒトへの感染は1954年にナイジェリア(アフリカ)で初めて報告された(MacNamara, 1954)。長年にわたり、ZIKV感染は世界中で報告されている。2007年、ミクロネシア連邦でジカ熱が初めて大流行し(Duffy et al.、2009)、その後2013年と2014年にフランス領ポリネシアで発生した(Cao-Lormeau et al.、2014)。さらに2015年には、ブラジル(Campos et al., 2015)で別のアウトブレイクが検出され、その後アメリカ大陸の他の国々(Hennessey et al.ZIKVは感染した蚊に刺されることで感染し(Musso and Gubler, 2016)、また頻度は低いが、性行為、入院、輸血や臓器移植、母子感染など、ベクター以外の経路でも感染する(Musso and Gubler, 2016)。臨床的には、ZIKVに感染した人の18%が発熱、関節痛、斑状丘疹状発疹、結膜炎、そして頻度は低いが頭痛、めまい、筋肉痛、嘔吐、下痢などの様々な症状を発症する(Agumadu and Ramphul, 2018,Fernanda Estofolete et al.)さらに、ZIKVはGBS(Sejvarら、2011)や小頭症(Liら、2016)といった神経学的合併症を引き起こす可能性がある。2020年、ブラジルでZIKVに誘発された急速進行性認知症の症例が報告され、Osvaldo Nascimentoらによって2020年の米国神経学会で報告された。ZIKV感染後6ヵ月以上経過した27歳の女性は、目立った病歴はなく、観念運動失行、計算障害、重度の短期記憶喪失を特徴とする臨床像を呈した。深部腱反射は四肢を通じて対称的に亢進し、左手のジストニック収縮のエピソードも観察された(Nascimento et al.)いくつかの報告によると、ADの病態はZIKV感染と関連している可能性がある。2020年の論文によると、ZIKVはAPP切断のためのBACE1結合部位をブロックすることによって細胞内でAPPと相互作用し、その結果APPの発現を増加させる可能性がある。その結果、APPはヒトの神経前駆細胞/幹細胞とマウスの新生児脳細胞の両方において、ZIKVの複製に対する負の制御因子となり、ZIKVが介在する脳損傷において保護的な役割を果たすと考えられる(Lingel et al.)一方、ZIKV感染は、BACE1量の増加、活性化された小胞体ストレスによるPERKの過剰活性化、およびヒトオルガノイドモデルにおけるPERK-eIF2α経路の影響を受けたGSK3α/βを介したタウのリン酸化の上昇を通じて、Aβ蓄積を誘導する可能性がある(Lee et al.)さらに、ZIKVがヒト間葉系幹細胞において、同じくADに関連するタンパク質であるCASP3の差次的発現を促進することが示されている(Beys-da-Silvaら、2019)。したがって、APPはZIKV感染によるダメージを防御するように見えるが、対照的に、ZIKVはADの発症に関与するタンパク質(Aβと過リン酸化タウ)の蓄積を増加させるように見える。ZIKVとADの関係はCostaによっても実証され、ADの症状治療薬としてFDAに承認されているメマンチンによるN-メチル-d-アスパラギン酸受容体の遮断が、ZIKVによる神経細胞損傷を緩和しうることが報告された(Costa et al.)ADの根底にあるZIKVの分子メカニズムをより明確にし、そのウイルスに感染したことがAD発症の危険因子となるかどうかを理解するためには、他の研究が必要である。
3.2.デング熱
デング熱は、節足動物が媒介する最も重要なウイルス性疾患で、1943年に日本で初めて分離され、東南アジア、西太平洋地域、ラテンアメリカ、アフリカ、東地中海地域で頻繁に発生している (Chang et al .)成熟したデングウイルス(DENV)は直径約50 nmの球形ビリオンで、3つの構造タンパク質(C、prM/m、E)、脂質エンベロープ、10.7 kbの正極性一本鎖RNA(ssRNA)から構成される。このキャップされたRNAは 、2つの非翻訳領域(5′-UTRと3′-UTR)に挟まれた長い オープンリーディングフレーム(ORF)によって構成されて いる(Perera and Kuhn, 2008) 。3′-UTRはDENVの複製に重要であり、 哺乳類細胞における ウイルスの増殖と RNA合成を調節する (Tajima et al., 2007)。ウイルスの構造タンパク質と非構造タンパク質の違いに基づいて、抗原的に異なる4つの血清型に区別することができる:DENV-1、DENV-2、DENV-3、DENV-4である(Murugesan and Manoharan, 2020)。DENVは主にヒトスジシマカとイエネコによってヒトに伝播される(Harapan et al.、2020)が、輸血、骨髄移植、分娩内伝播、周産期伝播など、ベクター以外の伝播様式があるため、DENVの根絶は困難である(Chen and Wilson. 2016)。DENVの重症度に関連する最も重要な因子は、女性の性別(Huyら、2013)とヨーロッパ系(Figueiredoら、2010)または中国系の祖先(Pangら、2012年)である。世界人口における症候性DENVの症例数は、毎年少なくとも1億人と推定されている(Bhatt et al.)これらの症例は、重症度の低い軽度のデング熱から始まり、致死的となる可能性のあるデング出血熱やデングショック症候群まで、幅広い臨床症状を特徴とする(Cui et al.)神経学的には、DENV感染はデング脳症(Hendarto and Hadinegoro、1992)、脳炎(Solomon et al.、2000)、神経眼障害(Somkijrungroj and Kongwattananon. 2019、Xie Cen et al. 2023)、急性横紋筋炎、急性散在性脳脊髄炎、GBS(Carod-Artalら、2013)、デング筋機能障害(Gulatiら、2020)などの免疫介在性症候群がある。興味深いことに、2020年にMohammedらは、DENV感染後に痙攣と進行性認知症を発症した64歳の高血圧女性の症例を報告している(Mohammedら、2020)。同じように、Mathewたちは、32歳の男性が重症のDENV感染後、脳梁の可逆的な脾臓病変に伴う多領域の認知障害と言語失行を特徴とする急速発症性痴呆を発症した症例を報告した(Mathewら、2021年)。最近、Chang氏らは、デング熱の診断を受けた認知症の既往歴のない台湾の成人(n=398、平均年齢56.0±10.7、女性55.5%)を同定し、認知症発症リスクを対照の非DENV群(n=1592、平均年齢55.7±11.1、女性55.4%)と比較した(Chang et al.)著者らは、デング熱を発症した人は、デング熱を発症していない人に比べ、認知症発症リスクが71%増加することを明らかにした(HR= 1.71; 95% CI= 1.03-2.83, p-value <0.05)。認知症の発症率は、男性(1000人年当たり4.28人)よりも女性(1000人年当たり4.91人)の方が高かった。認知症のリスクは高齢者集団でより高いことが観察された:60〜69歳の参加者のHRは3.80(95%CI=2.08〜6.93、p値<0.001)、70歳以上の参加者のHRは12.8(95%CI=6.66〜24.7、p値<0.001)であった。脳血管障害(HR=2.83、95%CI=1.66-4.83、p値<0.001)、うつ病(HR=3.77、95%CI=2.08-6.84、p値<0.001)などの合併症を有する参加者でも同様の結果が得られた。さらに著者らは、異なる追跡期間(1~3年、4~6年、6年以上)において、デング熱と認知症との関連を検討した。6年以上追跡調査されたデング熱患者群では、認知症発症リスクが有意に上昇した(HR= 3.11, 95% CI= 1.59-6.08, p-value <0.001)が、短期間(1~3年)および中間期間(4~6年)追跡調査された患者では、認知症リスクは上昇しなかった(それぞれ、HR= 1.11, 95% CI= 0.30-4.13; HR= 1.79, 95% CI= 0.62-5.15)(Chang et al. 2021).さらに、Chu氏らは、1997年から2012年にかけて台湾で募集されたDENV患者(n=816、平均年齢59.66±9.64歳、女性52.1%)と対照者(n=8160、平均年齢59.63±9.65歳、女性52.1%)を2013年末まで追跡調査し、DENV感染後の患者は認知症発症リスクが高いことを縦断的に特徴付けた(HR= 2.23、95%CI=1.51-3.28、p値<0.001)、特にAD(HR=3.03、95%CI=1.08-8.45、p値<0.001)、および特定不能の認知症(他のタイプの認知症、特に脳血管病変の何らかの証拠を伴うADの診断)が、対照群と比較して高かった(HR=2.25、95%CI=1.43-3.53、p値<0.001)(Chu et al. 2021).この関連は、人口統計学的変数と併存疾患を調整した後も統計学的に有意であった。
DENVとADの関連性の根底にある病態生理については、予備的データから神経炎症が主役である可能性が示された。実際、DENVは血漿漏出、BBB損傷、感染した単球やマクロファージの浸潤(Guzman and Harris, 2015)を介して血行性ルートから中枢神経系に侵入し、神経炎症を誘発する。実際、重症のDENV患者では、インターロイキン-6、インターロイキン-10、腫瘍壊死因子αなどの炎症性サイトカインのレベルが上昇していることが報告されている(Guzman andHarris, 2015)。さらに、炎症性サイトカインはミクログリアとアストロサイトを活性化し(Liddelowら、2017)、ミクログリアと炎症性サイトカインとの間の悪循環の発生は、ADの重要な病理学的要素を表している(Wangら、2015)。さらに、炎症後、インドールアミンジオキシゲナーゼという酵素が活性化され、トリプトファンを セロトニンではなくキヌレニンに代謝し (Roman and Irwin, 2020)、セロトニンの喪失が記憶力の低下に関与し、ADの進行を促進する可能性があり(Smith et al.さらに、DENVはin vitroでリポタンパク質受容体関連タンパク質1(LRP-1)の発現を低下させる(Treeら、2019)。LRP-1は脳血管平滑筋細胞におけるAβクリアランス受容体として同定されており、この経路の変化は慢性炎症、Aβ蓄積、脳アミロイド血管症(CAA)に寄与することから、ADとCAAの両方の病態に関与していると考えられる(Kanekiyo et al.)興味深いことに、DENVはヒトの微小血管内皮細胞に直接感染し、アポトーシスを誘導することができる(Vásquez Ochoa et al.)現在までのところ、ADとDENVの関連を解析した研究は台湾で行われたもののみである。さらに、ヒトにおけるこの関連を説明しうる分子メカニズムをより明確にするために、さらなる研究が必要である。
3.3.日本脳炎ウイルス
日本脳炎ウイルス(JEV)は一本鎖RNAゲノムを持ち、3つの構造タンパク質(すなわちC、prM/M、E)と7つの非構造タンパク質(NS1、NS2A、NS2B、NS3、NS4、NS4B、NS5)をコードする(Poonsiri et al.JEVは特に南アジアと東南アジアに広く分布し、毎年約69,000人が感染している(Turtle and Solomon, 2018)。臨床的には、JEV感染は発熱、コリーザ、下痢または硬直を呈し、脳炎や肺水腫、肝腫大、脾腫、 血小板減少などの他の症状を伴うことがある(Kumar et al.)JEV感染は認知障害(Campbellら、2011、Heffelfingerら、2017)や認知症の症例(Ayukawaら、2004、Nakashimaら、1999、Shojiら、1994、Shojiら、1990)にも関連している。さらに、Yinら(2022 )は最近、JEV1およびJEV2患者(JEV1、n=14、平均年齢44.1±19.1、女性14%;JEV2、n=12、平均年齢54.1±14.7、女性50%)および対照被験者(n=33、平均年齢37.6±15.1、女性34%)のCSFプロテオミクスプロファイリングを解析し、いくつかのADタンパク質のレベルが有意に上昇していることを見出した(すなわち 、 APOE、SPARCL1、 フィブリノーゲンα鎖前駆体、血清アミロイドA-1蛋白;SAA1)、あるいは減少(APPとアミロイド様蛋白1;APLP1)していた(Yinら、2022)。最後に、Germanら(2006)は、JEVに感染したマウスの炎症部位の損傷した軸索にβ-APPが蓄積していることを報告しており(German et al.
4.ADに関連するその他のウイルス
ヘルペスウイルスやフラビウイルスだけでなく、他の科に属するウイルスもADと関連している。科学的証拠については、以下の小項目で述べる。
4.1.ヒト免疫不全ウイルス
ヒト免疫不全ウイルス(HIV )は、レンチウイルス科に属するレトロウイルスの2つの株(HIV-1とHIV-2)の総称 であり、ヒトに特異的に感染し、後天性ヒト免疫不全症候群(AIDS)の発症の原因となっている(Weiss, 1993) 。このウイルスは、タンパク質のカプシドに包まれた一本鎖の陽性末端RNAセグメントとして感染し、このカプシドは、生殖の際に宿主細胞から取り出された液体マトリックスと脂質膜に囲まれている。具体的には、HIVビリオンは2本のRNA鎖を持ち、そこから9個(10個の場合もある)のウイルス遺伝子が 、高度に制御されたRNAスプライシングとポリタンパク質プロセッシングのシステムを通じて、12個の 構造タンパク質、2個の必須制御要素、および4個のアクセサリー要素を産生する (Engelman and Cherepanov, 2012,Gelderblom et al., 1989,ドイツ諮問委員会血液(Arbeitskreis Blut)、サブグループ「血液によって伝達される病原体の評価、2016)。
HIVは、宿主免疫系の重要な細胞、特にCD4+ T細胞、マクロファージ、樹状細胞を標的として増殖し 、いくつかの直接的および誘導的アポトーシス機構を通じて、感染細胞(および非感染バイスタンダー細胞)の不活性化または破壊を引き起こす(Powell et al.)また、HIVは、古典的な無細胞経路(ビリオンが細胞を出て細胞外液中を移動し、別の細胞に到達する経路)と、最近認識されるようになった細胞間拡散(特にリンパ系臓器では、ウイルスシナプスまたは表面抗原としてのウイルス機構がHIVのより効率的な拡散を促進する)の両方を通じて、新しい細胞に拡散することが知られている(Bai et al.いずれにせよ、未治療の感染症の結果は、数週間から数年の可変期間にわたるリンパ球の枯渇であり、免疫系の障害は増大し、その結果、主に日和見病原体によって引き起こされる早死にが生じる(Powellら、2016)。しかし近年、効率的な抗レトロウイルス治療法の開発により、HIVの感染率は低下し、ウイルスが検出されない状態(罹患者のウイルス量が50コピー/mL未満である状態)はウイルスの伝播が不可能であることに相当するまでになった(Eisingerら、2019、Rodgerら、2019)。このことは、感染した免疫細胞内のウイルス貯蔵庫が宿主からウイルスを排除することを不可能にしているため、AIDSへの進行が回避され、薬剤管理されたHIV感染が慢性化していることを意味する(Bai et al.)。実際、広範な研究が、HIV関連神経疾患(HAND)の一部として、感染患者におけるADに見られるような認知、運動、行動の症状を強調している。さらに、脳に局在する免疫細胞における感染の慢性化が、加齢に伴うAD様症状の悪化に関係しているように思われる(Chan and Valcour, 2022,Chemparthy et al. 2021,Filgueira et al., 2021,Jha et al., 2020,Magaki et al., 2022,Nir et al., 2021,Ojeda-Juárez and Kaul, 2021)。
Esiriら(1998)は、30歳から69歳の間にAIDSで死亡した97人のコホートの前頭葉と側頭葉におけるアミロイド斑の有病率を、年齢をマッチさせた125人の非HIV感染者対照コホートと比較した最初の研究を行った(Esiri et al., 1998)。このコホートを4つの年齢階級(30-39歳、40-49歳、50-59歳、60-69歳)に分類したところ、両者とも年齢が高くなるにつれてアミロイド斑が有意に増殖するという一般的傾向が示された(対照群とAIDS群でそれぞれp値=0.005と0.048)。しかし、対照群全体と比較した場合、AIDS群全体ではアミロイド斑の有病率が有意に高く(それぞれ39%、13%;p値<0.004)、また、40歳代に注目した場合(HIV感染者では18%、対照群では0%;p値=0.014)にも、アミロイド斑の有病率が有意に高かった(Esiri et al.、1998)。Jennifer Lamらによる最近の2つの研究は、HIV感染者(PWH)と非感染者(PWOH)で抗レトロウイルス療法(ART)を受けている人の認知症リスク(Lam et al.実際、米国では、ART時代にHIV関連認知症の有病率は1~2%に低下し、発症率の低下も指摘されている(Brew and Chan, 2014,McArthur et al.)しかし、ARTによる神経認知機能障害に対する予防効果はよくわかっておらず、HIV感染者の最大50%がHAND症状を示している(Brew and Chan, 2014,McArthur et al.)最初の観察コホート研究で、Lamらは2013年から2017年の間に5381人のPWH(平均年齢57±7歳、女性9%)と119022人(平均年齢58±9歳、女性10%)の人口統計学的に一致するPWOHを同定し、2019年まで追跡した。PWHの8%、PWOHの13.8%が認知症と診断され(HR=1.58、95%CI=1.31-1.92、p値<0.05)、HIVのART治療にもかかわらず、PWHの認知症リスクが58%高いことが浮き彫りになった(Lam et al. 2021).2つ目の研究では、2000年から2016年の間に認知症の記録が得られた、ARTを受けているPWH13296人(平均年齢53.9±5.5歳、女性11%)とPWOH155354人(平均年齢53.5±5.5歳、女性12%)のコホートを対象とした。著者らは、両群とも認知症発症率は経時的に減少したが、ART治療の影響の可能性として、PWOH(-3.1%/期間)よりもPWH(-8%/期間)の方が高かったと報告している。しかし、調整後の認知症発生率(aI=1.80、95%CI=1.60-2.04)および有病率(aP=1.86、95%CI=1.70-2.04)は依然としてPWHの方が高く、性別にかかわらず同様であった(P-interaction=0.84:aI;0.39:aP)、民族性(P-interaction=0.36:aI;0.31:aP)にかかわらず、また最終調査年まで(それぞれaI=1.58、95%CI=1.18-2.12;aP=1.75、95%CI=1.56-1.97)同様であった(Lam et al. 2022).
最近の研究では、知覚、運動、認知機能の性差による障害も浮き彫りになっている(Duarte et al., 2021):HIV感染女性は、健常女性および男性(ステータスに関係なく)と比較すると、著しい感覚運動障害と神経細胞の完全性の低下を示しており、免疫炎症反応がより強いことが示唆されている(Liang et al.)Sundermannらによるアメリカ人を対象とした別の観察研究(2018年)でも、15項目の神経心理学的検査について、HIV陽性1362人とHIV陰性702人(それぞれ女性204人と214人)を比較したところ、HIVに関連する神経認知機能障害は女性により多くみられ、これらの結果はアフリカ系祖先の人々でも同様であったが、一般にHAND症状における性差は他の祖先では変動があったことが強調されている(Sundermannら、2018年)。彼らは、アフリカ系祖先の女性はHAND発症リスクが最も高いグループを構成し、これは教育の質の違いによって媒介される可能性があり、神経認知症状の悪化を説明するために生物心理社会モデルと不平等の交差的枠組みが適用される可能性があると結論づけている。429人のHIV陽性女性と281人のHIV陰性女性、およびそれにマッチした人数の男性を対象とした多施設共同研究が連続して行われ、神経認知障害(NCI)に対する性、血清陽性、抑うつ症状の役割を明らかにしようとした(Rubin et al.)その結果、うつ病は血清陽性コホートと血清陰性コホートの両方で複数の領域にわたってNCIを悪化させたが、HIV陽性のうつ病女性は、HIV陰性女性およびHIV陽性男性と比較した場合、実行機能の点で有意な影響を受けたことが明らかになり、うつ病を治療することでHIV感染患者の認知機能が改善する可能性があることが提案された。
HIV感染者における神経認知障害の発現には、いくつかのメカニズムが関与していると考えられる。最近、高齢のHIV-1感染HAND患者とトランスジェニックラットの両方で、背外側前頭前野と海馬のニューロンにおいて細胞内Aβ凝集が検出されることが明らかになったが、いずれの場合も神経外アミロイド斑(進行したADの典型)は認められなかった(Liら、2022a)。さらに、このウイルスは、Aβの正しいプロセシングを担うセクレターゼである ADAM10という酵素をダウンレギュレートすることによって神経毒性を発揮し、神経細胞における有害なAβの産生を促進することが明らかにされている(Lichtenthalerら、2022,Lopez Lloredaら、2022)。正確な分子機構が不明な場合もあるが、ウイルスが産生するいくつかのタンパク質もまた、脳におけるタンパク質の凝集とクリアランスのリモデレーションを誘導する。例えば、ウイルス転写制御因子であるHIV-Tatは、細胞外マトリックス中のAβポリマーと直接接触し、クリアランスや貪食では検出されない、より神経毒性の高い線維性複合体への蓄積を刺激する(Hateganら、2017)。同様に、タウのリン酸化は、HIV表面糖タンパク質によって多くの経路を通じて刺激され(Sathlerら、2022、Vijayanら、2022)、脳におけるこのタンパク質の病原効果を増強する。実際、Aβもタウも、凝集、分布、クリアランスの変化、患者における行動反応の点で、同じHIVタンパク質産物の影響を大きく受けているようである(Bhargavanら、2021、Ditiatkovskiら、2020、Hateganら、2019、Trunfioら、2023年)。複数の著者はまた、認知障害は、特に高齢の被験者において、ウイルスが抑制されたHIVによって誘導される持続的な低グレードの神経炎症状態によって引き起こされる可能性があり、HANDとADは別個のものであり、Aβ負荷とは無関係である可能性があると報告している(Canet et al. 2018,Howdle et al., 2020,Jha et al., 2020)、うつ病などの他の病態が関与してくる可能性がある(Afridi and Suk, 2021,Mudra Rakshasa-Loots et al., 2023,Mudra Rakshasa-Loots et al., 2022)。
APOEがどのようにHIVと相互作用して細胞侵入と感染性を調節するのか、そしてこのことがどのように長寿の達成に反映されるのかについて記述した文献も数多く見られる(Abondio et al.)APOEは実際、脂肪とコレステロールを結合させ、それらの再分布とクリアランスを担うタンパク質である。脳では、神経細胞のコレステロールの主要な供給源であるアストロサイトで高発現しており、そこでは、これらの細胞タイプ間のコレステロール輸送と細胞シグナル伝達を担っている(Mederosら、2018、Montague-Cardoso. 2021、Shanら、2021、H.Wangら、2021)。数多くの研究が、APOEアイソフォーム(同じ塩基性タンパク質の代替型)が、マクロファージで過剰発現が誘導されると感染性を阻害することもあれば(Siddiqui et al、2018)、特に慢性HIV感染の長寿者における老化過程と相関して、疾患の進行を促進する(Burtら、2008、De Vliegerら、2022、Olivierら、2018)(Changら、2014、Changら、2011、Geffin and McCarthy. 2018、Valcourら、2004)。
4.2.肝炎グループ
肝炎ウイルスは、肝臓の炎症を特異的に引き起こす、主に5つの無関係なウイルス種(AからEまでの文字で示される)を識別するために使用される総称である(Nagraら、2022、OdenwaldとPaul. 2022)。これらは肝細胞で増殖するため「肝向性」ウイルスと呼ばれる(Lanini et al., 2019,Xiang et al., 2022)。エプスタイン・バーウイルスのような非肝向性ウイルスとは対照的で、主に体の他の部位に感染するが、特に小児では時折肝不全を引き起こすことが知られている(Gupta et al., 2015,Kelgeri et al., 2022,Wang and Xie, 2022)。この事象は、急速に発症する最近の急性感染エピソードとして現れることもあれば(Alves, 2018,Manka et al., 2016)、診断、治療、治療戦略が病原体とその病原体が作り出す疾患に関する知識とともに発展途上にある慢性疾患として現れることもある(Abu-Freha et al., 2022,Ma et al., 2022,Metin et al., 2022,Phillips et al.)
A型およびE型肝炎ウイルスは、自己限定性の急性かつ軽度の肝炎を誘発し、初感染から最大6週間、最大8週間持続するが、約6ヵ月間症状が再発するという報告もある(Langan and Goodbred, 2021,Migueres et al., 2021,Pintó et al.)感染自体には症状がないこともあり、症状があっても肝不全に至ることはまれである。ウイルスに初めて接触した後、対象者は一生免疫があり、日常の簡単な衛生管理や、少なくとも20年間は予防効果があるA型肝炎ワクチンなどの予防措置が講じられている(Almeidaら、2021;Caoら、2021;Castanedaら、2021)。これらの条件はウイルスの潜伏と神経系への拡散を防ぐとされているため、A型およびE型肝炎に関連した認知症様症状やADの報告はこれまでない。しかし、いくつかの研究でHEVのBBBを乗り越える能力が指摘されている(Shi et al. 2016,Tian et al., 2022,Tian et al., 2019)、具体的なメカニズムはまだ解明されていないものの、肝外症状や神経症状の可能性が強調されている(Jha et al., 2021,Lhomme et al., 2021,Mclean et al., 2017,Pischke et al.
B型肝炎は急性および慢性の肝炎を引き起こし、肝硬変、線維症、肝細胞癌へと進展する可能性があり、肝移植が推奨されることもある(Almeida et al ., 2021;Castaneda et al .)しかし、慢性感染症に対する抗ウイルス薬や迅速なワクチン接種は、伝染性の血液や体液を介したウイルス伝播(水平感染)や、出産時の母親から新生児へのウイルス伝播(垂直感染)を避けるために実施される措置である(Bassitら、2021年、Fungら、2022、Phillipsら、2022)。C型肝炎についても同様の状況が観察されるが、主な違いは、この感染症に対するワクチンの開発が困難であることである(ただし、直接作用型経口抗ウイルス薬による治療は極めて効率的であるようだ)(Abu-Frehaら、2022、Campolloら、2022、Rafatiら、2022)。興味深いことに、これらのウイルス(特にC型肝炎ウイルス)による急性および慢性感染症は、多くの場合、全般的な免疫反応と炎症状態に媒介される多くの肝外症状と関連している(Dashら、2020、Larrubia. 2014、Popa and Popa. 2022)。二次的な神経・精神障害としては、脳血管障害、脳症、脊髄炎、脳脊髄炎、認知障害、脳霧、抑うつ、不安、疲労などがあり、末梢神経障害も運動能力や感覚能力を低下させる(Abutalebら、2018、Faccioliら、2021、Tianら、2022) 。慢性炎症と代謝障害は、最終的に神経伝達物質の変化、 神経細胞のアポトーシス、脱髄を誘発し 、それが神経変性の顕在化の原因となることが示唆されて いる(Moretti et al 、2022,Suhail et al., 2022)、HBVとHCVの特異的な神経栄養機構はまだ完全に解明されておらず、認知症やADとの関係は矛盾している可能性がある(Bassendine et al., 2020,Choi et al., 2021b;L. Huang et al., 2022;Piekut et al.)
D型肝炎ウイルスは、肝臓に感染し増殖する際にHBVに依存するため、HBVのサテライトウイルスとしての役割を果たす(Dandriら、2022年、Khalfiら、2023、Robinsonら、2023)。感染は、HBVとの同時感染(同時感染)か、すでにB型慢性肝炎を発症している人にHDVが感染する(重複感染)ことで進行する(Dandriら、2022年、Khalfiら、2023、Robinsonら、2023年)。HDVによる二重感染は、肝硬変、肝がん、死亡のリスクを大幅に高めるが、神経学的影響の可能性については、今のところ何も明らかになっていない。
4.3.SARS-CoV-2
重症急性呼吸器症候群-コロナウイルス2(SARS-CoV-2)は2020年2月に同定されたウイルス株で、コロナウイルス疾患2019(COVID-19)の原因ウイルスである。SARS-CoV-2はポジティブセンスの1本鎖RNAウイルスで、1本の直鎖RNAセグメントと、スパイク(S)、エンベロープ(E)、膜(M)、ヌクレオカプシド(N)タンパク質として知られる4つのタンパク質構造を持つ。実験によると、このウイルスは受容体 アンジオテンシン変換酵素2(ACE2)に親和性が あり、これを利用して細胞内に侵入することが示唆 された(Naqviら、2020)。COVID-19の大流行はまだ続いており、毎日何千人もの人々がSARS-CoV-2に感染し続けている。主に感染者からの飛沫やエアロゾルを介して感染する(Hui et al.)診断は分子検査や迅速抗原検査によってSARS-CoV-2を検出し、感染の有無を確認することによって行われる(Naqvi et al.)
COVID-19は、症状がない場合(無症状)から、咳、咽頭痛、寒気、発熱、脱力感、疲労感、筋肉痛を呈する場合まで、重症度によって異なる一連の症状を引き起こす。その他の一般的な症状としては、頭痛、呼吸困難、悪寒、嘔吐や下痢、嗅覚(無嗅覚)や味覚の喪失(味覚障害)、発疹、結膜炎などがある(Adhikari et al.)興味深いことに、症例の約36%が神経症状を呈し、そのうち25%は中枢神経系に直接関与していることが示唆された(Mao et al.)さらに、COVID-19に罹患した人のかなりの部分は、感染に関連した徴候や症状を持ち続けており、このため、この症候群は「Long-COVID」として知られている。Long-COVIDの症状には、疲労、呼吸困難、心臓の異常、心的外傷後ストレス障害の症状、胃腸障害だけでなく、認知障害、睡眠障害、集中力の問題、頭痛、筋肉痛などの神経症状があり、まれにGBSを発症することもある(Crook et al., 2021)。
SARS-CoV-2が中枢神経系にダメージを与える可能性を提唱する研究が増えており、ADを含む神経変性疾患の発症に有利な脳の老化を促進する可能性がある(de Erausquin et al.)Ciaccioら(2021)は、ADとCOVID-19の関連を仮定している。まず、高齢、APOEε4遺伝子型、糖尿病、性別、高血圧などのいくつかの危険因子や併存疾患は、ADとCOVID-19の両方に共通している(Ciaccioら、2021)。興味深いことに、COVID-19の非常に頻度の高い症状である無嗅覚は、MCIからADへの転換とも関連していることが判明している(Lennon, 2020)。さらに、AD患者の脳ではACE2タンパク質の発現が上昇していることが報告されており、このことがウイルスの体内への侵入を促進し、結果としてCOVID-19に感染するリスクを高めている可能性がある(Ciaccioら、2021、Dingら、2021)。AD患者におけるCOVID-19のリスク上昇に関連するその他の要因は、社会的な性質のものである。監禁中、一部のAD患者は、無気力、抑うつ、記憶障害のために、COVID-19の感染を減らすための公衆衛生当局の勧告(例えば、手の消毒、フェイスマスクの着用、他者との物理的距離を保ち、隔離する)に従うことができなかった(Brownら、2020年)。
興味深いことに、最近の仮説では、SARS-CoV-2がAD発症リスクを増加させる可能性があるとしている。特に、Wang氏らは、2020年2月から2021年5月までの間に米国で治療を受けた620万人以上の男女の医療記録を再検討し、そのサンプルを、その期間にCOVID-19に感染した人(n=410748、平均年齢73.7±7.75歳、女性53.6%)と感染していない人(n=5834534、平均年齢73.0±7.34歳、女性55.6%)の2群に分けた(Wang et al.)著者らは、SARS-CoV-2感染者は、COVID-19診断後約1年以内にADと新たに診断されるリスクが増加したと報告している(HR=1.69、95%CI=1.53-1.72、p値<0.05)。このリスクは85歳以上(HR=1.89、95%CI=1.73-2.07、p-value<0.05)と女性(HR=1.82、95%CI:1.69-1.97、p-value<0.05)で有意に増加する。これらの予備的なデータを考慮すると、COVID-19感染とADまたは他の神経変性疾患の発症との相関の可能性を確認するためには、他のコホートで実施されたさらなる回顧的および縦断的研究が必要である。
4.4.リュンガン・ウイルス
リュンガンウイルス(LV)はパレコウイルス属のピコルナウイルスファミリーに属する陽性鎖RNAウイルスである(Tolf et al., 2009)。このウイルスはリュンガン渓谷(スウェーデン)のバンクハタネズミから最初に分離され、その後デンマークと米国のげっ歯類からも分離された(Krous and Langlois, 2010,Niklasson et al.)LVのウイルスRNAゲノムは長さ約7.6 kb、ビリオンの直径は27 nmで、RNAがコードするタンパク質配列は既知である(Johansson et al.、2002)。ゲノム配列の解析と系統関係に基づき、これまでに分離され塩基配列が決定された8株のLVは、4つの遺伝子型に分類された:LV-87-012およびLV-174 F(遺伝子型1)、LV-145SL、LV342およびLV340(遺伝子型2)、M1146(遺伝子型3)およびLV-7855(遺伝子型4)である(Pounderら、2015、Tolfら、2009)。臨床的には、LVはI型糖尿病、心筋炎、胎児死亡(Niklasson et al., 2007,Tolf et al., 2009)などのヒトの疾患や、脳炎(Krous and Langlois, 2010)、ギラン・バレー症候群(Niklasson et al., 1998)、水頭症、無脳症(Niklasson et al.)さらに最近、Niklassonらは、ルンド大学脳バンク(3例、2例)およびオランダ脳バンク(15例、9例)から入手した18例のAD患者と11例の年齢をマッチさせた対照者(平均年齢74歳、SDは報告されていない、女性52.4%)の死後海馬組織におけるLVの存在を免疫組織化学的に分析した、2020).これらの結果は興味深いものであるが、AD発症におけるLVの役割の可能性をより詳細に検討し、この可能性のある関連性の根底にある分子メカニズムを解明するためには、他のコホートを対象としたさらなる研究が必要である。
4.5.ボルナ病ウイルス
ボルナ病ウイルス(BDV)の遺伝物質は、N、P、M、G、L、p10タンパク質をコードするネガティブセンスRNAであり、これらはグリコシル化(MとG)またはリン酸化(PとL)されていることがあり、しばしば会合してヘテロ複合体を形成する(Brieseら、1995、Dittrichら、1989)。BDVは、1885年に伝染性脳炎の流行で多くのウマが死亡したドイツの町にちなんで名付けられたが(Carbone, 2001)、疫学的にはほぼ知られている(Eisermannら, 2021)。臨床的には、BDV感染は運動失調と不安、攻撃性、認知障害、多動などの行動障害を特徴とする(Carbone, 2001,Zhai et al.)1996年に行われた最初の研究では、海馬硬化症患者5人(平均年齢84±5歳、男女比報告なし)の海馬にBDVゲノムが存在することが報告されたが、AD患者(n=26、平均年齢77±1.5歳、男女比報告なし)には存在しなかった(De La Torreら、1996)。その1年後、Salvatoreらは、北米およびヨーロッパのAD患者の死後脳19検体において、BDVのP遺伝子mRNAが検出されなかったことを報告した(Salvatoreら、1997)。1999年には、Czyganらによって、AD患者の14の脳におけるBDVの存在が調べられ、同様の結果が得られている(Czyganら、1999)。さらに、Igataらは、AD患者(n=10、平均年齢85.8歳、範囲71-94、60%女性)の末梢血単核球からBVD RNAゲノムと抗体を発見していない(Igataら、1998)。これらの結果を総合すると、BDV感染はADの病因には関与していないことがわかる。しかし、動物およびヒトの予備的データから、BDVはAbの蓄積を減少させることが示唆された(Sakai et al., 2018,Stahl et al.
4.6.インフルエンザA型ウイルス
A型インフルエンザウイルス(IAV)ゲノムは、表面糖タンパク質であるヘマグルチニン (H)とノイラミニダーゼ(N)を含む11種類のタンパク質をコードする8本の一本鎖陰性RNAセグメントから構成されている (Bouvier and Palese, 2008,Dou et al.)これら2つのタンパク質は、それぞれウイルスの細胞受容体への接着と、複製プロセスが完了した後の放出に必須であるため、標的細胞への感染に極めて重要である(Kosik and Yewdell, 2019; F.Wang et al.)インフルエンザウイルスは、16種類のヘマグルチニンのうちの1つをコードする1つの遺伝子(HA、セグメント4)と、9種類のノイラミニダーゼのうちの1つをコードするもう1つの遺伝子(NA、セグメント6)を持つ。亜型H1、H2、H3、N1およびN2は、144通りの組み合わせ(16Hx9N=144HN)のうち3通り(AH1N1、AH2N2およびAH3N2)のみで対をなし、ヒトに適応したウイルスで発見されたため、季節的流行やパンデミックを引き起こす可能性がある(例えば、1918年の「スペインかぜ」)。例えば、AH1N1亜型による1918年の「スペインかぜ」、1977年の「ロシアかぜ」、2009年の「豚かぜ」、AH2N2亜型による1957年の「アジアかぜ」、AH3N2亜型による1978年の「香港かぜ」)(Belshan et al. 2014,Bouvier and Palese, 2008,Harrington et al., 2021,Piret and Boivin, 2021,Ray et al., 2017)。それにもかかわらず、他の亜型の組み合わせによるまれな人獣共通感染症IAV感染症が、ヒトの散発例や死亡例の原因として最近報告されている(例えば、鳥インフルエンザ亜型AH5N1、AH5N8、AH7N9)。これらはヒトへの感染力は弱いが、上気道ではなく肺組織に感染するため、より致命的である(Amerら、2021、Changら、2023、De Vriesら、2015、Rafiqueら、2023)。インフルエンザは一般に、発熱、悪寒、筋肉痛、咳、咽頭痛、頭痛など、多数の突発的な非特異的症状を伴う急性感染症として特徴づけられるため、多くの非特異的な疾患は「一般的なインフルエンザ」と分類されることが多く、正しい診断が遅れ、時には有害な結果を招くこともある(Jutel and Banister, 2013)。実際、医療従事者以外の人々の間では、「インフルエンザ様症状」に基づいてインフルエンザを自己誤診することが通例となっている。特に、IAVが媒介する疾患の具体的な定義や特有の症状について明確なコンセンサスが得られていないようだからである(Cedraschiら、2013、Jutel. 2019、Mayrhuberら、2018)。迅速抗原検査、インフルエンザPCRやマルチプレックスPCR、呼吸器ウイルスパネルなど、いくつかの検査方法が存在し、診断検査ごとに感度や特異性が異なる(Merckxら、2017、Ravinaら、2023、Rodriguezら、2022)。疫学調査では、すべての年齢層で、インフルエンザ様呼吸器症状で入院した人がAH1N1亜型に感染する頻度はAH3N2の2倍であるが、40歳から65歳の人は5倍であること、AH1N1は40歳以上のすべての年齢層に同程度の割合で感染するが、AH3N2は65歳以上の人が40歳から64歳の人よりも有意に感染する頻度が高いこと、AH1N1は18歳から65歳の人の感染率が最も高いこと(Almeida et al. 2021,Almeida et al., 2021;Belazi et al., 2021;Lytras et al., 2020;Wong et al., 2019)。
ウイルス性インフルエンザの神経学的合併症と呼吸器病態との関連は、小児と成人の両方で明らかにされており(Bohmwald et al., 2018,Froggatt and Heaton, 2022,Goenka et al., 2014,Paksu et al., 2018,Popescu et al., 2017)、臨床転帰はせん妄や幻覚などの精神神経障害(Manjunatha et al. 2011,Mizuguchi, 2013)から、発作(Paksu et al., 2018)、髄膜炎(Liang et al., 2018)、脳炎(Newland et al., 2003)、脊髄炎(Ruisanchez Nieva et al., 2017,Shafiq et al., 2022,Xia et al., 2014)、GBS(Grisanti et al., 2021,Sivadon-Tardy et al., 2009,Yamana et al., 2019)まで多岐にわたる。IAV感染とADの進行との間の特異的な関連は、AH3N2への長期末梢感染(生後2ヵ月から)が誘導された本疾患のトランスジェニックマウスモデル(APP/PS1)において、つい最近確立された(Hosseiniら、2021年) 。この研究により、感染したトランスジェニックマウスは 、野生型マウスとトランスジェニックマウスで神経細胞の数が同程度であるにもかかわらず、 ミクログリアの活性化、Aβ沈着、認知障害がより顕著 であり、樹状突起スパインの密度が減少していることが明らかに なった。著者らは、末梢AH3N2感染はミクログリアの活性化を誘発することで免疫反応を刺激し、ADの症状を悪化させる可能性があると結論づけている(Hosseini et al.、2021)。しかし、すでに発表された論文では、神経細胞におけるIAVの拡散を抑制し、リンパ球による取り込みを促進し、 単球におけるウイルスタンパク質の合成とインターロイキン 産生を減少させるAβの役割が解明されていた (White et al.)実際、大規模コホート研究では、インフルエンザ感染とADリスク上昇との直接的な関連は報告されていない(Imfeldら、2016)が、IAVに対するワクチン接種を繰り返すことで、特に65歳以上のADリスクが低下することが確認されている(Bukhbinderら、2022、Wiemkenら、2021)。これらの結果は、IAVワクチンが免疫系を訓練し、長期的な炎症反応の可能性を減少させることによって認知症のリスクを減少させる可能性があることを考えると、ADに対する病原性感染の間接的な役割を示唆している(Wiemkenら、2021年)。
5.結論
感染性ウイルス疾患は、世界で最も一般的で広く蔓延しているヒトの病気のひとつである。これらの多くは、特に潜伏状態(自然あるいは薬物療法によって)が維持されている場合、直接(ヘルペスウイルス群のような向神経性ウイルスの場合 )、免疫系の調節異常(例えばHIV)によって、あるいは恒常的な免疫活性化と炎症状態を刺激することによって、中枢神経系や末梢神経系に影響を及ぼす可能性がある。 これらのウイルスをめぐる研究はまだ矛盾しているが、これらのウイルスは多くの精神医学的合併症(意識障害、幻覚、現実離れ、せん妄)および神経学的合併症(発作、筋肉痛、神経痛、頭痛、脳炎、脊髄炎、髄膜炎、GBSなど)、さらには本格的な痴呆に発展する可能性のある行動障害や心理的障害に関与しているようである。アミロイド斑や神経原線維凝集体にいくつかの神経向性および非神経向性ウイルスが関与し、ADの発症(というよりもおそらく増悪)に関与していることを示す限定的ではあるが説得力のある証拠が提示されている。神経変性疾患の発症にウイルスが関与している可能性をより明確にするためには、対照群とAD患者の死後脳サンプルにおけるウイルスゲノムと、神経変性に影響を及ぼす可能性のあるウイルス経路に関するさらなる調査が必要である。それにもかかわらず、認知症やADだけでなく、他の神経変性疾患に対する新規の薬理学的治療としてワクチンや抗(レトロ)ウイルス療法を用いる可能性について、新たな光が当てられつつある、2023、Bukhbinderら、2022、Lehrer and Rheinstein. 2022、Wiemkenら、2022、Wiemkenら、2021、Wuら、2022)。この効果が、感染症の発生を抑えることに直接関係しているのか、あるいは、免疫システムを訓練することによって、免疫活性化の影響が少なくなり、長期的な炎症が抑えられるのかを理解するためには、さらなる研究が必要である。
著者ノート
著者らは、本論文の研究、執筆、および/または出版に関して、潜在的な利益相反がないことを宣言した。本研究は資金提供を受けていない。我々は、この原稿のいかなる部分も他所に投稿されておらず、また他所での出版を検討されていないことを確認する。本研究を支援し、参加してくださったすべての方々に感謝する。
利益相反宣言
著者らは、本論文の研究、執筆、出版に関して、潜在的な利益相反はないと宣言した。