コンテンツ
An Update on Mitochondrial Reactive Oxygen Species Production
www.ncbi.nlm.nih.gov/pmc/articles/PMC7346187/
オンライン版2020 Jun 2.
概要
ミトコンドリアは,スーパーオキシド(O2●-)および過酸化水素(H2O2)の最も重要な発生源である。これらの分子の過剰生産は、主にヒトの病気の発症や老化の文脈で研究されてきた。しかし、H2O2をはじめとするミトコンドリア活性酸素の生成を制御することは、細胞の情報伝達にも重要な役割を果たしている。H2O2をセカンドメッセージングに利用する一方で、その有害な影響を回避するためのバランスをとるには、高度なフィードバック制御とH2O2の分解機構を利用する必要がある。
ミトコンドリアにはH2O2分解酵素が豊富に含まれており,酸化還元シグナルを脱感作する。また、ミトコンドリアは、プロトンの漏出やタンパク質のS-グルタチオニン化など、一連の負のフィードバックループを利用して、H2O2の生成を抑制する。ミトコンドリアがどのようにして活性酸素を産生するのかを理解することは、これらのオルガネラがどのようにしてH2O2を用いてイーストレスシグナルを発するのかを理解する上でも重要である。実際,栄養代謝や酸化的リン酸化(OXPHOS)に関連する12種類の酵素が,重要な活性酸素源となる。これには、いくつかのフラボタンパク質や呼吸器複合体I-IIIも含まれる。
ミトコンドリアがシグナル伝達のためにH2O2を生成する仕組みを理解するには、性差や抗酸化物質をコードする遺伝子やミトコンドリアの生体エネルギーに関与するタンパク質の遺伝的差異など、活性酸素の生成に強く影響する重要な生理的要因も考慮しなければならない。
今回の総説では、ミトコンドリアが細胞内のH2O2産生をどのように予算化しているかについて、最新の見解を示す。ここでは,2つのアシル-CoAデヒドロゲナーゼを活性酸素生成酵素のリストに加える可能性と,組織型,マウス系統,性別などの重要な表現型および生理学的因子がこれらの個々の部位による生成に与える影響に焦点を当てる。
キーワード
ミトコンドリア、活性酸素種、生体エネルギー、過酸化水素、性差、基質嗜好、等電位群
1. はじめに
機能不全に陥ったミトコンドリアによる活性酸素の過剰産生と、その発病や老化との関連性は、長年の研究テーマである。従来、ミトコンドリア活性酸素の唯一の発生源は、呼吸鎖複合体IとIIIであると考えられてきたが、活性酸素が大量に発生すると細胞にダメージを与え、病気を誘発する。例えば、複合体IIからIへの逆電子伝達(RET)の際にO2●-が大量に生成されると、心筋の虚血再灌流障害につながるとされている[1]。しかし、活性酸素の有害な作用の一部は、ミトコンドリアを標的とした抗酸化物質などによって実験的に逆転または防止することができるが、臨床的には抗酸化療法は有益ではないことが示されている[2]。さらに、最近では、ミトコンドリアの活性酸素産生量が短時間で高くなると、いくつかの生物が寿命を延ばすことが明らかになっている[3]。このように、活性酸素は有害なものであると同時に、細胞の生存や適応的なシグナル伝達に不可欠なものでもある。このようなミトコンドリア活性酸素の有益性と有害性の二面性は、「ミトホルミシス」と定義されている。軽度の酸化ストレスは細胞の適応反応を引き起こすが、無秩序な過剰生産は組織の損傷につながる[4]。活性酸素が細胞に及ぼすプラスの効果を説明するために、「酸化ストレス」の元々の定義から直接拡張して、「酸化ユーストレス」(oxidative eustress)と「酸化ストレス」(oxidative distress)という新しい用語が導入された[5]。酸化ユーストレスとは、可逆的で部位特異的なタンパク質のシステイン残基の酸化/還元に伴う細胞の適応反応やアロスタシスの誘導を意味し、後者は、有益な生理学的範囲を超えた酸化ストレスの生成が細胞の損傷や疾患につながることを意味している。
ミトコンドリアとROSの複雑な関係は,(1)ミトコンドリアには,栄養代謝と酸化的リン酸化 (OXPHOS) に関連した12の発生源があること [6],(2)一部の発生部位では,O2●-とH2O2の混合物が発生すること [7],(3)ミトコンドリアは,細胞質または細胞外の発生源から発生したH2O2のシンクとして機能すること [8]を示す証拠によって強調されている。さらに,ミトコンドリアは,細胞内および細胞外からの刺激に応じて,活性酸素の産生を微調整する高度なメカニズムを備えている [9]。しかし,他のセカンドメッセンジャーと同様,H2O2シグナルは,生理的な合図に反応した後,脱感作する必要がある。これは,抗酸化物質による防御,スーパーコンプレックスの生成,組み立て,分解を抑制する負のフィードバックループ,プロトンリークによって達成され,細胞はミトコンドリアのH2O2をシグナル伝達に用いる一方で,その有害な影響を回避することができる([10]に詳細なレビューあり)。
ミトコンドリアの活性酸素生成とその恒常性は,いくつかの因子に強く影響される。これには,基質の種類,濃度,利用可能性,複数の基質がミトコンドリアに電子を供給しているかどうか,活性酸素生成物質の濃度と酸化還元状態,ミトコンドリア内膜(IMM)の極性,電子供与部位の酸素分子へのアクセス性などが含まれる[11]。また,私たちのグループは最近,ミトコンドリアが細胞内の活性酸素バランスを維持する仕組みを研究する際には,他の重要な生理学的・表現型的要因も考慮しなければならないことを明らかにした。これには,マウスの系統や性別,組織の種類などの要因が含まれ,α-ケト酸脱水素酵素などの「非従来型」の活性酸素生成酵素によるH2O2生成速度に強い影響を与える可能性がある[12]。さらに,脂肪酸酸化 (FAO) 経路の2つの不可欠な構成要素である長鎖脂肪酸デヒドロゲナーゼ (LCAD) および超長鎖脂肪酸デヒドロゲナーゼ (VLCAD) などの他の活性酸素源の同定においても重要な進歩があった [13,14]。したがって,本レビューの目的は,ミトコンドリアの活性酸素生成とホメオスタシスに関する最近の進歩について,最新情報を提供することである。
2. ミトコンドリアの活性酸素源と逆電子移動による生成
現在,レドックスバイオロジー分野が直面している最も重要な課題の一つは,ミトコンドリアのどの酵素がH2O2の主な供給源として機能しているかを解読することである。S1QUELSとS3QUELSは,呼吸を損なうことなく,それぞれ複合体IとIIIによる活性酸素生成を阻害する化合物であり,大きな進歩を遂げている[15]。これらの化合物は,細胞内の活性酸素生成に対するミトコンドリアの全体的な寄与を定量的に評価することを可能にし,ミトコンドリアが細胞内で最も重要なH2O2源であることを実証するのに成功している[15]。一般に,ミトコンドリア活性酸素の供給源は,複合体IとIIIのみであると考えられており,後者の呼吸器複合体は,酸化還元シグナル伝達のためのミトコンドリアの主要なプラットフォームとして機能している[16]。この一般的な仮定の注意点は、ミトコンドリアには、燃料の燃焼や酸化的リン酸化に関連する最大12個のROS発生源が存在することである(図1)[6,11]。最近の研究では、これらの “型破り “な活性酸素発生源の中には、複合体Iよりも多くの活性酸素を発生させるものがあること、また、これらの活性酸素発生源の中には、複合体IIIと同様の活性酸素発生率を示すものがあることが明らかになっている[11,17]。例えば,雄のSprague Dawleyラットから採取した筋肉ミトコンドリアでは,α-ケトグルタル酸デヒドロゲナーゼ (KGDH),ピルビン酸デヒドロゲナーゼ (PDH),分岐鎖ケト酸デヒドロゲナーゼ (BCKDH) が,クレブスサイクルに関連する代謝物が酸化されているときに,複合体Iよりも高い活性酸素生成率を示すことが明らかになっている[18]。また,C57BL6Nマウスの肝臓ミトコンドリアにおいても同様の結果が得られており,KGDHとPDHは生成される活性酸素の最大45%を占めてた[17]。
図1 NADH/NAD+基とUQH2/UQ基の等電位図
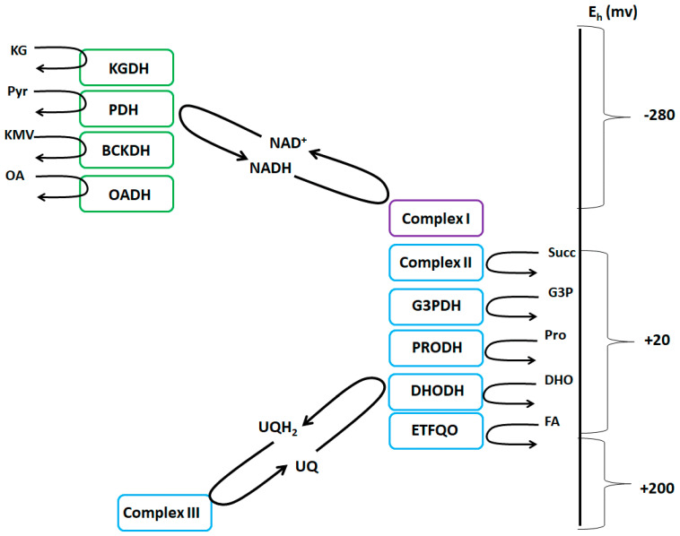
NADH/NAD+グループ(緑)は、KGDH(α-ケトグルタル酸デヒドロゲナーゼ)PDH(ピルビン酸デヒドロゲナーゼ)BCKDH(分岐鎖ケト酸デヒドロゲナーゼ)OADH(2-オキソアジピン酸デヒドロゲナーゼ)および複合体Iから構成されている。UQH2/UQ等電位群(青)は、複合体II、G3PDH(sn-グリセロール-3-リン酸デヒドロゲナーゼ)PRODH(プロリンデヒドロゲナーゼ)DHODH(ジヒドロオロチン酸デヒドロゲナーゼ)ETFQO(電子伝達-フラボタンパク質:ユビキノン酸化還元酵素)複合体IIIからなる。複合体Iは、活性酸素の生成に両方の等電位基を使用し、フラビンモノヌクレオチド基とユビキノン結合部位の両方からそれぞれ活性酸素を生成することができるため、紫色で示されている。
2.1. RETによる活性酸素生成とその生理的効果および病理学的帰結
複合体Iは、複合体IIからRETを行う際の重要な活性酸素源である[1]。伝統的に、RETが複合体Iに続いて活性酸素を発生させることは、心臓病を含むいくつかの疾患の病因と関連している(図2)[1]。また、最近では、コハク酸の蓄積とそれに続くRETによる高い活性酸素生成の誘導が、臓器移植時の組織損傷に寄与することが明らかになっている[19]。しかし、コハク酸からRETに続く活性酸素生成の短時間のバーストは有益である。例えば、ミトコンドリアによるROS産生の短時間のバーストは、虚血再灌流傷害から心筋を保護するためのプレコンディショニングとなる(図2)。これは、抗酸化物質の防御力を増強し、酸化ストレスから保護するストレスシグナルと適応経路が、ROSによって誘導されることで達成される(図2)[20]。しかし、他のいくつかの研究では、虚血再灌流後の心筋組織の損傷は、複合体IのRETによるものではないことが示されていることに留意すべきである。実際、複合体Iの部分的な喪失は、複合体IIIによる活性酸素生成の増加により、再灌流後の心筋の損傷を実際に増加させることが最近示された[21]。同様に、Andrienkoらは、心筋障害はRETによるミトコンドリアのROS産生とは無関係であり、伝染性遷移孔の開口部に関係していることを示した[22]。最近の研究では、複合体Iに対する適度なRETが長寿をもたらすことも実証されている。例えば、複合体IIからIへの適度なRETは、D. melanogasterの寿命を延ばし、熱ストレスへの適応に不可欠であることが示されている(図2)[3,23]。さらに、この経路を無効にすると、適応的なシグナル伝達にRETを使用することの利点が損なわれる[3,23]。また、コハク酸蓄積後のRETによる複合体Iによる活性酸素生成が、褐色脂肪の熱発生を促進することも示されている(図2)[24]。他の酵素によるRET誘導性の活性酸素産生も、適応型シグナル伝達に重要な役割を果たしている可能性がある。精製したKGDHとPDHはNADHからRETによって活性酸素を産生する[7]。当初、NADHからKGDHへのRETは、複合体Iの活性が低下したときの病的な条件や酸化的な苦痛のもとでのみ起こると考えられてた[25]。しかし、ある研究では、精製したKGDHとPDHによるROS産生が少量のNADHで刺激され、伝染性ミトコンドリアで再現できることが観察されており、生理的な濃度のNADHからこれら、2つの酵素複合体へのRETは、細胞のコミュニケーションにも有益な役割を果たしている可能性があることが示されている[7]。さらに、推測ではあるが、複合体IIからIへのRETは、KGDHやPDHによるNADH駆動の活性酸素生成をサポートする可能性もある。実際、コハク酸からNAD+結合部位への電子の移動が成功すると、プロトンリターンがNADHの生成に結びつく(図2)。これにより、NADHの酸化に続いて、α-ケト酸デヒドロゲナーゼによる活性酸素の生成がRET主導で行われることになる。
図2
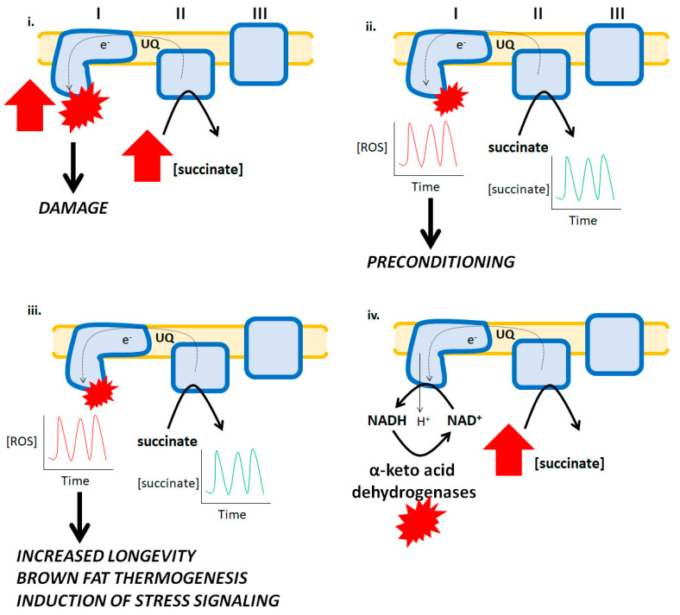
i. 虚血時にコハク酸が蓄積されると、複合体Iによる活性酸素の生成が急増する。コハク酸は複合体IIによって酸化され、ミトコンドリア内膜の過分極とUQプールの過剰減少により、電子が複合体Iに逆流して大量の活性酸素を生成し、心筋組織の損傷と心臓病の発症につながる ii. 虚血性プレコンディショニングは、ミトコンドリアによる一時的な活性酸素の産生に関連しており、これにより適応シグナルに関わる細胞プログラムが活性化され、心筋細胞を酸化ストレスから保護する抗酸化システムが強化される。この仮定のシナリオでは、ROS産生の短時間のバーストは、コハク酸の時空間的な増減によって引き起こされ、その結果、RETによるROS産生が短時間かつ一時的にバーストすることになる。コハク酸の増減は、褐色脂肪やその他の組織におけるRETを介した活性酸素産生の駆動に不可欠であり、熱発生、ストレスシグナル、長寿などの重要な生理機能に貢献している iv. コハク酸から複合体IへのRETが、α-ケト酸デヒドロゲナーゼによる活性酸素生成を促進する仮説的なメカニズム。逆電子の流れにより、複合体Iがプロトンをマトリックスに戻すと、NADHが形成され、続いてデヒドロゲナーゼがこれを酸化する。これにより、これらの酵素による活性酸素の生成が起こる。
2.2. ミトコンドリア活性酸素生成酵素のサブカテゴリー化とLCADおよびVLCADの同定
ミトコンドリアの代謝や好気性呼吸に伴う12の活性酸素生成部位は,H2O2生成に関与する電子供与基に基づいて,NADH/NAD+等電位群とUQH2/UQ等電位群の2つのグループに細分化できることがわかっている(図1)[11]。簡単に説明すると,前者のグループは,ニコチンアミドを還元または酸化するフラビン依存性デヒドロゲナーゼで構成されている。これには,α-ケト酸デヒドロゲナーゼのKGDH,PDH,BCKDH,2-オキソアジピン酸デヒドロゲナーゼ(OADH),および複合体Iのフラビンモノヌクレオチド群が含まれる(図1)[26]。第2の等電位グループには,ミトコンドリアのユビキノン(UQ)プールを直接還元または酸化して活性酸素を生成する酵素が含まれる。これらの酵素は,複合体I(RET中のUQ結合部位),複合体II,複合体III,sn-グリセロール-3-リン酸デヒドロゲナーゼ(G3PDH),プロリンデヒドロゲナーゼ(PRODH),ジヒドロオロチン酸デヒドロゲナーゼ(DHODH),および電子伝達-フラボタンパク質:ユビキノンオキシドレダクターゼ(ETFQO)である(図1)[26]。これらの部位によるH2O2生成のネイティブな速度については,広範囲にわたってレビューされているが [11,15,26] ,ここでこの分類について議論するのは,このリストにさらに2つのフラビン依存性酵素,すなわち,最近活性酸素を生成することが明らかになったLCADとVLCADが加わる可能性があるからである [13,14]。
Zhangらは最近,LCADが肝組織におけるH2O2の重要な供給源となりうることを報告している[14]。アシル-CoAデヒドロゲナーゼは,ミトコンドリアの脂肪酸酸化 (FAO) の第一段階を触媒する[14]。ミトコンドリアには,短鎖,中鎖,長鎖,超長鎖の脂肪酸を酸化する複数のフラボタンパク質(SCAD,MCAD,LCAD,VLCAD)が存在する。FAOでは、FAD中心が還元され、電子伝達物質であるフラボプロテインとETFQOを介してUQプールに電子が伝達される。興味深いことに、LCADによるH2O2の生成は、心臓や筋肉のようにATPの供給をFAOに大きく依存している組織には存在しないため、見過ごされがちであった。しかし,Zhangらが報告しているように,LCADは肝臓で高い発現を示し,腎臓,膵臓,肺でも発見されている[14]。これと相まって,Zhangらは,LCADが高いH2O2生成速度を示すことを初めて報告した[14]。実際,LCAD-/-マウスの肝ミトコンドリアの活性酸素生成量は著しく少なく,HepG2細胞でLCADを過剰発現させると,H2O2生成量がしっかりと増加した[14]。さらに,精製したリコンビナントLCAD酵素は,高い活性酸素生成率を示した。これらの知見に基づき,著者らは,おそらくLCADが肝疾患の発症に重要な活性酸素源として機能しているのではないかと推測した。LCADが活性酸素源であるという知見を検証し,H2O2のネイティブな産生速度を他の確立された12の産生部位と比較して,肝臓におけるミトコンドリアの活性酸素放出に対する全体的な貢献度を確認する必要がある。PDH,KGDH,および複合体IIIがミトコンドリアの総O2●-/H2O2容量の約90%を占めることが報告されているのに対し,肝臓のミトコンドリアROS源の中にはごくわずかな量しか生成しないものがあるため,これは極めて重要である[17]。
このリストに加えられる2番目の酵素は,VLCADである。LCADとは異なり,VLCADはほ乳類の組織でより広く発現しているため,その酵素特性に関心が寄せられている。柿本らは,パルミチン酸を補給した肝臓のミトコンドリアによるH2O2生成を調べ,6週齢のスイスマウスに高脂肪食を与えると,活性酸素生成量が著しく増加することを観察した[13]。さらに著者らは,活性酸素の生成速度はpHに敏感で,pH〜8.5で最大の生成速度に達することを確認した[13]。これを踏まえて,著者らは,C16-C18脂肪酸の酸化を担うアシル-CoAデヒドロゲナーゼである組換えVLCADが活性酸素源として機能するかどうかを検証した。柿本らは,精製したVLCADがH2O2を生成することを明らかにした[13]。さらに,その生成速度はパルミトイル-CoAの濃度に比例することが確認された[13]。これらの知見は,同グループが発表した研究と一致しており,高脂肪食を短期間摂取した後に超長鎖脂肪酸を酸化する際にミトコンドリア活性酸素が過剰に産生されることで,肝内脂質の蓄積と脂肪肝の誘発が起こることを実証している[27]。この結果、ミトコンドリア機能障害に先立って酸化的損傷が誘発され、脂肪肝疾患に続いて脂肪性肝炎が発症する病態は、VLCADによる活性酸素の過剰産生から始まることが示された[27]。これらの研究に続いて,Zhangらは,VLCADがH2O2を産生するが,その速度はLCADよりも15倍遅いことを明らかにした[14]。さらに,VLCAD-/-マウスから採取した肝ミトコンドリアではH2O2生成量に差がなかったのに対し,LCAD-/-マウスから採取したサンプルではH2O2生成量の減少が観察された[14]。LCADと同様に,VLCADによる個々のネイティブなROS産生速度を,他の既知のミトコンドリアROS産生物質と比較して,FAO時のO2●-/H2O2放出全体に対する貢献度を確認する必要がある(例えば,複合体IIIとの比較,RETと複合体IおよびIIとの比較など)。しかし,今回の予備的な証拠に基づいて,ミトコンドリア活性酸素生成物質の候補を14種類に拡大し,LCADとVLCADをUQH2/UQの同位体グループに加えることができるかもしれない。
3. 活性酸素の発生源は組織の種類によって異なる
3.1. 骨格筋ミトコンドリアによる活性酸素の生成
これまで、12の部位における活性酸素生成のネイティブな速度については、ほとんどがラットから単離した伝染性筋ミトコンドリアを用いて研究されてきた。このモデルシステムでは,KGDHとPDHが複合体Iよりもそれぞれ8倍,4倍多くの活性酸素を生成することが示されるなど,重要な知見が得られている[18]。また,これらの重要な研究では,複合体IIがミトコンドリアの活性酸素生成に大きく寄与していること,OADHが複合体Iよりも多くの活性酸素を生成することが明らかにされた[28]。注目すべき点は、全体的な活性酸素生成の主な要因は、ミトコンドリアにエネルギーを与えるために利用される燃料によって決まるということである。例えば,グルタミン酸とリンゴ酸を燃料とするミトコンドリアでは,KGDHと複合体I,II,IIIが重要な活性酸素発生源となるが,コハク酸が酸化されると複合体I,II,IIIが重要な発生源となる[29]。筋が静止しているときの生理的な基質の利用可能性を模した緩衝液中でインキュベートした単離ラット筋ミトコンドリアでは,複合体I-IIIおよびETFQOが主要な発生源となっている[29]。一方,激しい運動を模した培養条件では,複合体Iのみが主要な生成源となる[29]。さらに、基質の種類と組み合わせによって、伝染処理した筋肉のミトコンドリアによる全体的なROSの生成速度が決まる。例えば,筋ミトコンドリアをコハク酸でインキュベートすると,最も高い活性酸素生成率が得られるが,グルタミン酸とリンゴ酸またはパルミトイル-CoAでサンプルを培養すると,生成率は低くなる[29]。このように,ミトコンドリアは,基質の種類や利用可能性の生理的変化に強く影響される動的な「ROS放出シグネチャ」を採用できることが,これらの重要な発見によって明らかになった。
3.2. 肝臓ミトコンドリアによる活性酸素の生成
基質の種類と利用可能性に関して注目すべき点は、食事の変化や生理的要求の変化に応じて、異なる組織が基質の選好性を示すことである(例えば、肝細胞は飢餓時に脂肪酸を燃料として燃焼させ、糖新生を利用して血糖値を維持するようになる)。このように、異なる組織のミトコンドリアは、12種類の潜在的な活性酸素源の中から選択したものに依存して、細胞内のH2O2の主な発生源として機能していると考えられる。2016年には,ブタ心臓由来の精製KGDHとPDHの両方が,順方向および逆方向の電子流によってH2O2を生成できることが報告された[7]。このことから、KGDHとPDHは、心筋の虚血再灌流傷害時にも重要なROS源として機能するのではないかという仮説が生まれた。興味深いことに,心臓のミトコンドリアでは,KGDHとPDHの両方とも活性酸素の産生率が低く,一方で複合体IとIIIが主なH2O2源として同定された。さらに調査を進めると,心臓組織から採取したサンプルと比較して,KGDHとPDHは肝臓のミトコンドリアでより多くのROSを産生することが明らかになったが,両組織におけるいずれの酵素複合体の発現レベルにも差はなかった[7]。2017年に行われた同じグループによるフォローアップ研究では、KGDHとPDHが肝臓のミトコンドリアで産生される全ROSの~45%を占めているのに対し、心臓組織では両酵素とも低いネイティブな産生率を示すことが明らかになった(図3)[17]。さらに,α-ケトグルタル酸またはピルビン酸で活性化された肝臓のミトコンドリアは,心臓のミトコンドリアよりも7倍も高いH2O2生成率を示す[30]。これらの観察結果は,グルタレドキシン-2(GRX2)のトランスジェニックマウスモデルを用いた研究で裏付けられている。GRX2は,タンパク質のS-グルタチオン化によるミトコンドリア酵素の可逆的な阻害を触媒するチオール酸化還元酵素である。GRX2は,グルタチオンプールの酸化に応答して標的タンパク質をS-グルタチオニル化し,活性酸素の生成を抑制するのに必要である[30]。グルタチオンプールの酸化還元電位が回復すると,GRX2はこれらの標的タンパク質のデグルタチオニル化を触媒する.GRX2を欠損させたマウスから採取した肝臓のミトコンドリアでは,活性酸素の産生が著しく低下する[30].これは,KGDHおよびPDHのグルタチオニン化が亢進し,両酵素によるROS産生が減少することと関連している[30]。興味深いことに,心筋組織では逆の傾向が観察された。GRX2の欠損は,ROS産生を増加させた[30]。さらに、この増加は、呼吸器系複合体のグルタチオニン化に起因するものであった[30]。しかし,注目すべきは,筋肉と同様,肝臓のミトコンドリアも,酸化される基質の種類に応じて,ROS源を動的に変化させることができることである。例えば、UQプールに直接電子を供与する基質であるコリンとジメチルグリシンが酸化されているとき、肝臓のミトコンドリアが産生する活性酸素の95%は複合体IIとIIIが占めている(図3)[31]。同様に,コハク酸が基質となっている場合には,複合体IIとIIIが唯一の生産者となる。コハク酸、コリン、ジメチルグリシンを酸化する肝臓のミトコンドリアによる活性酸素生成のもう一つの驚くべき特徴は、複合体Iがごくわずかな供給源として機能していることである[7,31]。このように、肝臓のミトコンドリアは、どの燃料が代謝されているかにかかわらず、複合体IIIが主な供給源となり、複合体Iはごくわずかな量しか生成しないというように、どの基質が酸化されているかに応じて、動的な活性酸素シグネチャを採用することも可能である。
図3 肝臓のミトコンドリアは、どの基質が燃料として使われているかに応じて、異なる活性酸素放出シグネチャーを採用している
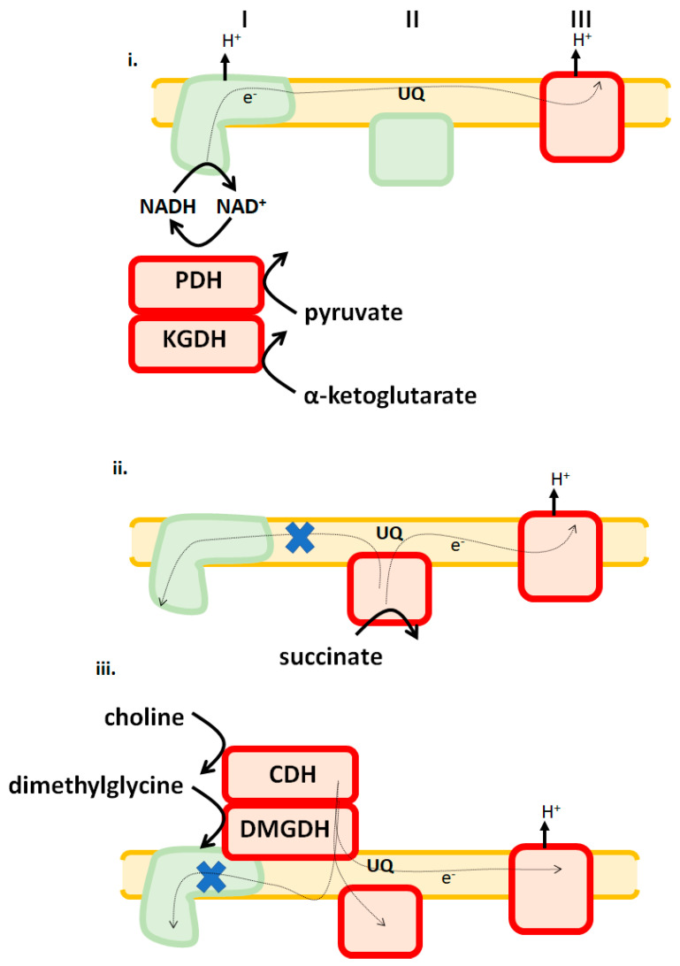
i. ピルビン酸デヒドロゲナーゼ(PDH)α-ケトグルタル酸デヒドロゲナーゼ(KGDH)および複合体IIIは、クレブスサイクルに関連する代謝物が酸化されているときに活性酸素の主要な発生源となる。 ii. 複合体IIおよびIIIは、コハク酸がUQプールに直接電子を供給して酸化されるときに主な原因となる。 iii. コリンとジメチルグリシンは、コリン脱水素酵素(CDH)とジメチルグリシン脱水素酵素(DMGDH)によって酸化され、RETによる複合体IIと複合体IIIへのフォワードフローによってROSを生成する。XはRETがブロックされていることを示す。赤で示された酵素は重要なROS源である。緑は、その生体エネルギー条件では無視できるほどの発生源であることを示す。
3.3. 心筋ミトコンドリアによる活性酸素の発生
心筋ミトコンドリアは、ほとんどが複合体I、II、IIIによって活性酸素を生成する。コハク酸のみを酸化する心筋ミトコンドリアのH2O2生成率は,同じマウスから単離した肝臓サンプルと比較して,約4倍高かった(図3)[30]。GRX2を欠損させると,コハク酸,α-ケトグルタル酸,ピルビン酸を酸化するミトコンドリアの活性酸素生成量が2倍に増加した[30].さらに,コハク酸,α-ケトグルタル酸,ピルビン酸をエネルギー源とする心臓のミトコンドリアでは,主な活性酸素源として複合体IおよびIIIが同定され,KGDHとPDHは全体の生成量にほとんど寄与していなかった[30]。したがって,肝臓や筋肉とは対照的に,心臓のミトコンドリアは,主な活性酸素供給源として複合体IおよびIIIに依存している。上述したように、両組織ともKGDHおよびPDHの発現量に違いはなく、呼吸器複合体サブユニットのレベルにも大きな変化はない。現時点では推測の域を出ないが、どの部位が最も多くの活性酸素を発生させるかの違いは、これらのミトコンドリアの生体エネルギーに関係しているのかもしれない。実際,肝臓のミトコンドリアでは呼吸速度が低いが,これは複合体IによるNADHの代謝が低いことと関係しているのかもしれない。ピルビン酸または乳酸をリンゴ酸で酸化する心臓のミトコンドリアの状態3呼吸は,肝臓のミトコンドリアと比較して約5倍高い[32]。同様の観察は骨格筋のミトコンドリアでも行われており,3倍程度高かった[32].NADHの回転速度が低下すると,PDHやKGDHのアロステリック阻害が起こり,それに伴ってROS産生量が増加すると考えられる。さらに、上述したように、PDHとKGDHはNADHからRETによってROSを生成することができる。このような生体エネルギーの違いは、MIMの折り畳みとクリスタの形成の程度に関係していると考えられる[33]。受け入れられた12の個別生成部位のROS放出率の組織特異的な違いを完全にカタログ化するには、さらに多くの研究が必要である。上述の研究は、異なる組織から分離されたミトコンドリアが、燃料の嗜好性に差異を示すことを示した初めての研究ではない。
4. げっ歯類の系統が活性酸素生成の各部位に与える影響
ミトコンドリアがどのように活性酸素を利用して適応的なシグナル伝達を行っているのか、また、酸化還元シグナル伝達の欠陥がどのように疾患の誘発に寄与しているのかについての総合的な理解を深めるために、いくつかのげっ歯類の系統が利用されている。C57BL6N(6N)およびC57BL6J(6J)は、ヒトの疾患モデルに最もよく用いられるマウス系統であり、特に、さまざまな組織のミトコンドリアによる活性酸素の過剰産生と、ダイエットによる肥満や肥満関連疾患(脂肪肝やインスリン抵抗性など)心臓疾患、虚血再灌流後の心筋損傷などの発症との関係を研究する際に用いられる。しかし,これらの研究では,ミトコンドリアのエネルギー代謝に関連する12種類の生成器によるH2O2生成速度に,負荷に依存した影響があるかどうかは,ほとんど考慮されていない。細胞のレドックス緩衝能力に対する歪みの影響は調査されているが [34],12の生成部位のいくつかのH2O2生成能力を直接比較した研究は1つしかない。この研究は,マウス,ラット,ヒトの伝染処理した筋肉を用いて行われた[35]。この場合,3種ともPDHによる生成速度はGSHの有無に依存することが示された[35]。トランスレーショナルメディシンでは,ヒトの疾患を正確にモデル化するためにげっ歯類を利用することが目標となるため,こうした比較は極めて重要である.第二に、いくつかのげっ歯類は、細胞の酸化還元バランスの維持に不可欠なタンパク質に機能喪失変異を持っている。これは、レドックス緩衝能の変化を通じて、個々の部位のROS放出プロファイルに影響を与える可能性がある。例えば,NADPHの供給に不可欠なミトコンドリア内膜タンパク質であるNNTの機能喪失変異は,6Jマウスに耐糖能異常,インスリン抵抗性,食事誘発性肥満,グルココルチコイド欠乏症を発症させることが示されている[26].最近の研究では,これらの疾患の発症が,ミトコンドリアによる活性酸素の過剰産生とそれに続く酸化ストレスの誘発に起因するかどうかを見極めようとしている.興味深いことに、Fisher-Wellmanらは、高脂肪食を与えた6Jマウスと6Nマウスから分離した筋肉ミトコンドリアによる全体的な活性酸素生成量には、有意な差がないことを観察した[36]。しかし,同グループは別の研究で,6Jマウスの筋ミトコンドリアは6Nマウスと比較してより多くのH2O2を産生したが,それはピルビン酸を基質とした場合に限られていたことから,このマウス系統の筋ではPDHがより強力な活性酸素発生源として機能している可能性があるとしている[37]。同様に,我々のグループは,6Nマウスから単離した肝臓のミトコンドリアにおいてKGDHとPDHが優れた活性酸素発生剤であることを何度か報告している[17,30].しかし,B6.129S4マウスではそうではなく,KGDHとPDHは肝ミトコンドリアから放出される活性酸素のネイティブレート全体にはほとんど寄与していなかった[21]。これらの予備的知見を総合すると、マウスの系統は、12の活性酸素生成部位のうち、どの部位が主要な活性酸素生成者として機能するかに強く影響することを示している。
4.1. マウス系統による肝組織の活性酸素源の違い
我々のグループは最近、6Nおよび6Jマウスから採取したミトコンドリアを用いて、いくつかの「型破り」な発生源による固有の活性酸素生成率をプロファイリングした。これには,肝臓のミトコンドリアではKGDH,PDH,BCKDH,complex II,PRODH,G3PDH,心臓のミトコンドリアではKGDH,PDH,PRODH,G3PDHの生成速度の測定が含まれている[12]。ミトコンドリアをTriton-Xで伝染させ,電子輸送系による活性酸素の生成を抑制するために,複合体IおよびIII阻害剤で処理した。さらに,PRODHおよびG3PDHの測定を行う際には,複合体II阻害剤を加えた。当然のことながら,6Nマウスから採取した肝臓のミトコンドリアでは,PDHとKGDHが高い割合でH2O2を生成することがわかった[12]。また,BCKDH,PRODH,G3PDHの生成量はごくわずかであったが,Complex IIも重要な生成部位であった[12]。また,無傷のミトコンドリアを用いた測定では,PDH,KGDH,および複合体IIが重要な活性酸素発生源であることが確認されたが,BCKDH,PRODH,およびG3PDHはより高い発生率を示したことから,これらの部位によるH2O2の発生は,ミトコンドリアの膜電位に影響を受けていると考えられる。一方,6Jマウスから採取した肝ミトコンドリアは,全く異なる活性酸素生成プロファイルを示した。3つのα-ケト酸脱水素酵素はすべて,伝染処理した肝臓ミトコンドリアおよび無傷の肝臓ミトコンドリアにおいて,中程度から高い割合でH2O2を産生することがわかった[12]。さらに,測定された3つのUQH2/UQアイソペンシャル酵素も,中程度の生成速度を示した。また,6J肝のミトコンドリアでは,全体的な活性酸素生成量が有意に低いことが判明したが,この効果は,ミトコンドリアのカタラーゼおよびグルタチオンペルオキシダーゼのレベルが高いために,レドックス緩衝能が代償的に増加したことに起因すると考えられた[12]。さらに,6Jのミトコンドリアは,状態3または状態4の呼吸条件下で,活性酸素の発生が有意に少なかった。これらの結果から,6Jマウスでは,NNTの欠損を補うために,代謝経路の再構築やカタラーゼおよびグルタチオンペルオキシダーゼの発現量の増加など,いくつかの適応策がとられていることがわかった。
4.2. 心筋細胞内の活性酸素源はマウス系統の影響を受ける
6Nマウスと6Jマウスの心筋ミトコンドリアでは、活性酸素の発生源にも基本的な違いが見られた。PDHとKGDHは低い活性酸素生成率を示し,我々のグループによる以前の観察結果と一致していた[12]。G3PDHは、両方のマウス系統から採取したミトコンドリアで高い生成率を示した[12]。興味深いことに,PRODHも高い産生率を示したが,6Jのミトコンドリアでのみであった。さらに、これらの部位による個々の活性酸素産生率の傾向は、無傷のミトコンドリアでも観察された。また、プロリン、ピルビン酸、α-ケトグルタル酸、グリセロール-3-リン酸を添加したミトコンドリアの全体的な活性酸素生成量を測定したところ、6Jの心臓サンプルはより多くの活性酸素を生成しており、これは呼吸鎖での電子伝達が非効率的であることが原因であると考えられた[12]。PRODHは、多くのげっ歯類の組織で発現量が少なく、したがって活性酸素の放出量が少ないことが報告されている[38]。飛翔昆虫のような特定の生物は、プロリンが翼の機能に利用される主な燃料であるため、PRODHを大量に発現する[38,39]。しかし、これはPRODHがこれらの生物における主要な活性酸素生成者であることも意味する[39]。げっ歯類や人間では、PRODHの発現増加は、しばしば癌を含むいくつかの疾患の病因と関連している。PRODH発現の増加は、哺乳類細胞における酸化的苦痛、DNA損傷、老化、及びアポトーシスの誘導と関連しており、これはROSの過剰生産に関係している[40]。さらに,Collaborative Crossにおける急性心筋梗塞に対する反応の特徴を調べたところ,6Jマウスは,調査した8つの近交系品種の中で最も高い死亡率を示したが,これは,NNTが存在しないために,活性酸素の産生が増加し,酸化ストレスからの保護機能が低下したためであると考えられた[41]。我々の研究でも指摘されているように、PRODHはH2O2産生が約2倍に増加することが判明しており、これも酸化的苦痛の誘発と心筋組織の損傷の誘発に寄与している可能性がある[12]。以上のことから,ヒト疾患のげっ歯類モデルを用いてミトコンドリア活性酸素産生と細胞シグナルの関係を評価する際には,系統差を強く考慮する必要があることが明らかになった。
5. ミトコンドリア活性酸素産生の性差
生理的・生化学的形質の性差は、哺乳類やヒトでは一般的であり、遺伝的・エピジェネティックな要因や細胞のシグナル伝達・コミュニケーションの違いに起因する。性が生理学に与える影響の大きさは、寿命やいくつかの疾患の発現に与える影響によって強調されている[42]。例えば,閉経前の女性は,男性に比べてメタボリックシンドロームや腎臓病の発症率が低いが,この効果は,卵巣卵胞の顆粒膜細胞による17-β-エストラジオールの産生量が急激に減少することで失われる[42,43]。細胞やミトコンドリアレベルでのレドックス緩衝能の性差を調べることは、多くの疾患の発現や進行に及ぼす性の影響を理解する上で大きな焦点となっている。細胞のレドックス緩衝システムは、環境因子(例えば、ホルモンシグナル)に応答して細胞の行動を変化させる重要なインターフェースとして機能しているので、これは驚くべきことではない[44]。性は、細胞のレドックス緩衝能に強い影響を与える。雌のげっ歯類の肝臓のミトコンドリアは、高脂肪食を摂取すると、第3呼吸状態の割合が高くなり、カルジオリピン含有量が増加し、酸化的リン酸化が増加する[42]。さらに,これらのミトコンドリアは,活性酸素の生成量が少なく,抗酸化物質の含有量も多い[39]。同様に,雌のげっ歯類の脳や心臓のミトコンドリアは,活性酸素の発生が少なく,高い酸化還元緩衝能を持っている[24]。
細胞のレドックス緩衝能に対する性の影響を理解することは、最近では、17-β-エストラジオールがミトコンドリアの活性酸素生成や生体エネルギーに与える影響や、これらのパラメータとメタボリックシンドロームの発症との関係を調べることにまで拡大された。最近の研究では,雌マウスの卵巣を外科的に摘出すると(卵巣摘出術(OVX):更年期障害類似の症状モデル),ミトコンドリアの酸化還元緩衝ネットワークが酸化され,ミトコンドリアの活性酸素生成量が大幅に増加することがわかった[45]。興味深いことに,これらの影響はOVXマウスを17-β-エストラジオールで処理することで逆転することができる[45]。ミトコンドリアの活性酸素産生,生体エネルギー,レドックスバランスに対する17-β-エストラジオールの好影響は,ミトコンドリア膜の流動性を改善するMIMへの取り込みに起因すると考えられた[45]。しかし,17-β-エストラジオールは,抗酸化防御やミトコンドリアの増殖,生体エネルギーに関わる遺伝子の発現を増強する細胞シグナルを誘導することも報告されている[46]。
現在までに、ミトコンドリア内の12の個別部位による活性酸素の産生における性差に着目した研究は1件のみである。これらの概念はせいぜい予備的なものであるが,PDH,KGDH,および呼吸鎖それぞれによるミトコンドリアのROS産生に関して,いくつかの興味深い性差を明らかにした[47]。一つの興味深い違いは,肝臓のミトコンドリアにおけるPDHとKGDHによるROS産生の速度であった。PDHとKGDHは,雌の同胞と比較して,雄の肝ミトコンドリアではH2O2の生成速度が〜3.5倍,〜5倍高かった[47]。一方,スクシン酸刺激による活性酸素生成量は,雌の肝臓ミトコンドリアで有意に高かった。興味深いことに,著者らは同時に,タンパク質のS-グルタチオン化を介したミトコンドリアのレドックスシグナル伝達における初めての性差を確認した[47]。実際,S-グルタチオニル化は,PDH,KGDH,および複合体IとIIによるミトコンドリアの活性酸素産生の調節に不可欠な負のフィードバックループとして同定されている[48]。Grx2遺伝子を欠損させると,PDHとKGDHのグルタチオニン化が亢進し,雄マウスから採取したミトコンドリアの活性酸素産生が抑制される[47].しかし,雄マウスと比較して,Grx2を欠失させても,雌の同腹仔から採取した肝ミトコンドリアにおけるPDH,KGDH,および呼吸鎖によるROS放出には影響がなかった。このことは,雌の肝臓ミトコンドリアは,グルタチオン化によるROS産生の負の制御に依存していないことを示しており,このことは,雌の肝臓が高い酸化還元緩衝能力を持っていることに起因すると考えられる[47].筋肉では,驚くべきことに,PDH,KGDH,および呼吸鎖が,女性のミトコンドリアでより多くのROSを生成していた(PDHとKGDHでは約3倍,呼吸鎖では約5倍)[47].しかし,この違いにもかかわらず,雌の筋肉ミトコンドリアは,活性酸素産生の負の制御にS-グルタチオン化を必要とせず,性別が細胞のレドックス状態に強く影響することがさらに示された。
6. おわりに
H2O2を検出するタンパク質ベースのプローブや、ミトコンドリアの呼吸を妨げない新規の活性酸素産生阻害剤など、新しいアプローチや高感度の細胞内技術の登場により、活性酸素が細胞シグナル伝達に不可欠なセカンドメッセンジャーであることが確立された。このシグナル伝達は、タンパク質のシステインチオールの可逆的な酸化を介して直接行われることもあれば、グルタチオンなどの細胞のレドックスバッファーの酸化を介して間接的に行われ、その結果、タンパク質がグルタチオニン化されることもある。アロスタティック・イーストレス・シグナリングにおけるH2O2とレドックスバッファーのバランスのとれた使用は,「健康な生活の黄金律」と呼ばれており,これは,細胞が経験する環境的・生理的エクスポージャーの合計に対応して,新たなレベルの適応的ホメオスタシスを達成するために必要とされるものである [49]。したがって,ミトコンドリアがどのようにH2O2を生成するかを解明することは,哺乳類の細胞がどのようにしてこの「黄金比」を達成するかについての理解を深めるために,極めて重要である。この最新のレビューでは,ミトコンドリアのH2O2生成を理解することに関連する複雑さと課題について,新たな洞察を提示している。これには,ミトコンドリアのROS生成の可能性を高めるリストにLCADとVLCADを加えることや,異なる組織における全体的な生成の主要な要因となる個々の部位を検討することが含まれている。最も重要なことは、NADH/NAD+およびUQH2/UQ同位体群のさまざまな酵素による活性酸素生成率に、性および組織に依存した基質嗜好が与える影響についての情報がほとんどないことである。このことは、これらの因子がミトコンドリアや細胞の酸化還元緩衝能力や活性酸素の生成に大きな影響を与えることを考えると、極めて重要である。全体として,ミトコンドリアがセカンドメッセージングでH2O2を利用する方法についての総合的な理解を深める上で,大きな前進があった。しかし,ここで紹介したように,組織に依存した基質の好みや燃料供給の変化が,個々の部位での活性酸素生成に及ぼす影響や,性差やホルモンの二型が活性酸素生成率に及ぼす影響を完全に理解するには,さらなる研究が必要である。
