
covid19criticalcare.com/wp-content/uploads/2023/06/Cancer-Care-July-31-2023.pdf
目次
- 序文
- まえがき
- 第1章 はじめに
- がんの社会的影響
- 第2章 癌とは何か:その病因を理解する
- 別の理論:がんは代謝疾患である
- がんのシグナル伝達経路
- がん免疫
- 血小板と癌
- 血管新生と転移
- 癌幹細胞(CSC)
- 第3章 がんを予防する
- 第4章 癌を治療するための代謝的アプローチ
- 食事によるカロリー制限、ケトジェニック食、および「本物の」食品
- がん悪液質の管理
- 間欠的絶食、オートファジー、そしてがん
- 癌に対するインスリン増強療法?
- 第5章 がん治療のための代謝および生活習慣への介入
- 1. グルコース管理とケトジェニックダイエット
- 2. 運動(有酸素運動とレジスタンストレーニング)
- 3. ストレス軽減と睡眠
- 第6章 再利用薬
- がんを制御するための再利用薬の要約
- 第7章 第1段階の再利用薬-強く推奨
- 4. ビタミンD
- 5. メラトニン
- 6. 緑茶
- 7. メトホルミン
- 8. クルクミン
- 9. メベンダゾール/フェンベンダゾール/アルベンダゾール
- 10. オメガ3脂肪酸
- 11. ベルベリン
- 12. アトルバスタチンまたはシンバスタチン
- 13. ジスルフィラム
- 14. シメチジン
- 15. ヤドリギ
- 16. ホスホジエステラーゼ5阻害薬:シルデナフィル、タダラフィル、バルデナフィル
- 第8章 第2段階の再利用薬-弱い推奨
- 17. 低用量ナルトレキソン(LDN)
- 18. ドキシサイクリン
- 19. ウィートグラス
- 第9章 第3段階の再利用薬-曖昧なエビデンス
- 20. レスベラトロール
- 21. シクロオキシゲナーゼ阻害薬-アスピリン(ASA)と非ステロイド性抗炎症薬(ジクロフェナク)
- 22. ニゲラサティバ
- 23. 霊芝(Ganoderma lucidum)およびその他の薬用キノコ類
- 24. イベルメクチン
- 25. ジピリダモール
- 26. ビタミンC大量静注
- 27. ジクロロ酢酸(DCA)
- 28. カンナビノイド
- 29. フェノフィブラート
- 30. パオペレイラ
- 第10章 第4段階 再利用薬-反対を勧める
- 31. サメ軟骨
- 32. レトリル(アミグダリン)
- 第11章 補助療法の可能性
- 腫瘍治療分野
- 光線力学的療法
- 高圧酸素療法
- 第12章 化学療法:基本的な入門書
- メトロノミック投与
- 化学療法の基本
- 付録1:再利用薬/栄養補助食品の層別化のためのエビデンスの階層構造
- 付録2. 抗がん活性のエビデンスが限られているその他の潜在的薬剤
- 補遺3. 図10の脚注
- 参考文献
免責事項
本書は、がん治療に使用可能な再利用薬および生活習慣/食事療法の選択肢を示す発表文献の総説である。本書は、がん治療のための独立した手引きとして意図されたものではない。本書のいかなる内容も、指導なしに治療を開始したり、主治医が処方した治療を回避したりする根拠とされるべきではない。この情報は、相互の意思決定を支援するための基礎として提供されるものである。がんの治療は、常に医療提供者の監督を受けるべきである。がん患者は、かかりつけの腫瘍専門医に加え、統合医療提供者/腫瘍専門医にも必ず相談すべきである。
このモノグラフに概説されている治療介入は、腫瘍専門医による治療に加えて、補助療法として使用されるべきである。その目的は、標準的な化学療法/放射線療法の毒性を軽減し(可能であれば化学療法の投与量を減らし)、標準的な化学療法による重度の免疫抑制、臓器毒性、死亡を予防することである。本書では、抗酸化剤と化学療法剤との相互作用など、考慮しなければならない潜在的な相互作用について言及していることに注意されたい。
標準的な化学療法は急速に分裂する癌細胞集団を標的とする;これらの薬剤は一般的に腫瘍微小環境に悪影響を及ぼし、癌幹細胞の増殖を促進し、転移の可能性を増大させる可能性がある。本書に列挙された介入はほとんどすべて、腫瘍微小環境への悪影響を制限するものである。加えて、ここに記載された薬剤の多くは癌幹細胞も標的とする。このデータは、患者にとって最良の転帰を得るためには、これらの介入療法を従来の化学療法と同時に行うべきであることを示唆している。
本書は 「生きた」文書であり、継続的に更新され、改良されていくことに留意されたい。最新版を確認していただきたい。
対象読者
本情報は、がん患者にとって特に興味深いものであり、がん治療に再利用薬や生活習慣の改善を用いるという複雑な問題を解決するための指針となるものである。しかし、上述のように、患者が自己治療のために使用すべきではなく、資格を有する医療提供者の監督を受けるべきである。がん患者のプライマリ・ケア提供者や統合医療提供者は、この文書の中で必要不可欠な情報を見つけることができるだろう。
さらに、がんに罹患するリスクを減らしたい人にとっても有益であろう。既存のがん患者は、食事によるカロリー制限と術後補助(同時)再利用薬の話題について、かかりつけのがん専門医と話し合うことを試みるべきであるが、明らかな理由(既得権益)から、多くのがん専門医はこれらの話題について話したがらないかもしれない。
患者への注意
本書は最高レベルの科学的証拠に基づいている。患者はこの情報を検討し、データの信頼性を独自に検証し、家族/医療擁護者と治療選択肢について話し合うべきである。患者は、医療提供者とともに、自分の価値観や目標に合った治療計画を立てるべきである。しかし、患者は、不誠実な開業医を利するだけの、証明されていない非科学的な介入を断固として避けるべきである。
再利用薬とは、処方の一般的な根拠である。「適応外」で使用される薬のことであるが、これはその適応症について米国食品医薬品局(FDA)の審査・承認を受けていないことを意味する。推奨事項の中には、医学的権威の間で論争や意見の相違が生じるものもある。このモノグラフは、確かなエビデンスと病態生理学的原則に基づくものであり、科学の現状について正確な見解を提供するものであると確信しているが、公衆衛生機関や規制機関は反対の立場をとる可能性がある。
本書は、教育的資料を提供するための著者の努力であり、査読を経た出版物ではない。著者、FLCCCおよびその代表者、FLCCCに関係するいかなる個人も、提供された情報の使用または誤用について責任を負うものではない。また、有益性や有害性がないことを保証するものではなく、提供された情報を信頼することは、あくまでも自己責任において行うものとする。
謝辞
ピエール・コリー博士、「ジャスタス・ホープ」博士、モビーン・サイード博士、ネイサン・グッドイヤー博士の貴重な貢献に感謝したい。ペイ・ハリス博士は、このモノグラフを支えるために使われた何百もの文献を丹念に調査してくれた。Kelly Bumann、Kristina Morros、Zahra Sethnaには、校閲、編集、有益なフィードバックをいただいた。
さらに、代謝腫瘍学に関するいくつかの書籍の著者が、私の考えを導く上で非常に役に立ったことを感謝したい。Thomas Seyfried(Cancer as a Metabolic Disease)、オットー・ワールブルク(The Metabolism of Tumors)、Jane McLelland(How to Starve Cancer)、Travis Christofferson(Trying over the Truth)、Nasha Winter & Jess Higgins Kelley(The Metabolic Approach to cancer)など: 深い栄養とケトジェニックダイエット、そして無毒の生物学的個別化療法を統合する)。また、この研究の枠組みを提供してくれたCare Oncology、Anticancer Fund、Repurposing drugs in oncology(ReDO)グループなどにも感謝している。
一般的な略語
- AKT:プロテインキナーゼB(PKBまたはAkt)
- ALA:α-リノレン酸
- AMPK:アデノシン一リン酸活性化キナーゼ
- ARG-1:アルギナーゼ1
- BRACA1:乳がん遺伝子1
- BAX/BAK:アポトーシス蛋白質Bcl-2ファミリーのメンバー
- CCR6:ケモカイン受容体6
- CSC:がん幹細胞
- CI:信頼区間
- CGM:持続グルコースモニター
- COX:シクロオキシゲナーゼ
- DC:樹状細胞
- FOXO1:フォークヘッドボックスO1
- EGFR:上皮成長因子
- EGCG:エピガロカテキンガレート
- ERK:細胞外シグナル制御キナーゼ
- FGF:線維芽細胞成長因子
- GI:グリセミック・インデックス
- GTC 緑茶カテキン
- GDH:グルタミン酸脱水素酵素
- HDL:高密度リポタンパク質
- HIF:低酸素誘導因子
- HR:ハザード比
- HK2- ヘキソキナーゼ-2
- HSP:熱ショックタンパク質
- Hh ヘッジホッグ経路
- HER2:ヒト上皮成長因子受容体2
- IGF-1:インスリン様成長因子1
- IκBα:核因子κBインヒビター
- INF:インターフェロン
- 試験管内試験:試験管や培養皿の中で行う。
- 生体内試験:生体内で行う。
- GH:成長ホルモン
- IL:インターロイキン
- JAK2:ヤヌスキナーゼヤヌスキナーゼ
- JNK:c-ジュンN末端キナーゼ
- MAPK:マイトジェン活性化プロテインキナーゼ
- MAM:転移関連マクロファージ
- MDSC:骨髄由来幹細胞
- MMPs:マトリックスメタロプロテアーゼ
- mTOR:哺乳類ラパマイシン標的酵素
- NAD:ニコチンアミドアデニンジヌクレオチド
- NF-ΚB:核因子カッパベータ
- NOS:一酸化窒素合成酵素
- NK細胞:ナチュラルキラー細胞
- NSAID:非ステロイド性抗炎症薬
- Nrf2:核内因子E2関連因子
- OR:オッズ比
- PDE5阻害薬:ホスホジエステラーゼ5阻害薬
- PD-1/PD-1L:プログラム細胞死タンパク質1/リガンド
- PI3K:ホスホイノシチド3キナーゼシグナル伝達経路
- PGE2:プロスタグランジンE2
- RCT:ランダム化比較試験 REM:急速眼球運動
- ROS:活性酸素種
- ReDO: Repurposing Drugs in Oncology(がん領域における薬剤の再利用
- RFS:無再発生存期間
- RR:相対リスク
- STAT3:シグナル伝達物質および転写活性化物質3
- TAM:腫瘍関連マクロファージ
- TGF:トランスフォーミング増殖因子
- TG:トリグリセリド
- TME:腫瘍微小環境
- TCR:T細胞受容体
- TLR:トール様受容体
- TCGA:がんゲノムアトラスプログラム
- TNF:腫瘍壊死因子
- TRAIL:腫瘍壊死因子関連アポトーシス誘導リガンド
- treg: T調節細胞
- USPSTF:米国予防サービス専門委員会
- UV:紫外線
- VDAC:電位依存性アニオンチャネル
- VCAM1:血管細胞接着分子1
- VEGF:血管内皮増殖因子
- WNT:WNTシグナル伝達経路
序文
ジャスタス・ホープ博士
医師として、また認定専門医として、私は30年以上にわたり、主に難治性の痛みに苦しむ患者たちのケアにあたってきた。2020年1月、私の友人が膠芽腫に罹患したとき、私は彼を助ける方法を見つけるために研究を始めた。医師が彼の化学療法、放射線療法、手術に再利用された薬剤カクテルを加えれば、私の友人ははるかに良くなる可能性がある。
ハーバード大学の教授が、1990年代に初めてがんの再利用薬に出合い、それを使って自分の膠芽腫を治した。その教授は今も生きている。
私が繰り返し目にする最も重大な問題は、がんが抵抗性の転移を伴って再発することである。その時点では、たとえ再利用された薬を使っても、負け戦になることが多い。このような悲劇が起こるのは、手術、放射線、化学療法といった標準的な治療が、がん幹細胞の増殖を刺激するからである(図1参照)。可能な限り早い段階で積極的に再利用薬を追加することで、がん幹細胞が腫瘍をより抵抗力のある、時には破壊不能な形態に再生するのを防ぐことができる。もし、すべての患者と担当の腫瘍医にこの文書を読んでもらい、がんと診断された時点で、生活習慣の改善とともに再利用薬のカクテルを追加してもらうことができれば(そして、手術、化学療法、放射線治療など、治療計画と連携してこれを行うことができれば)、より多くの患者が生き延びるだけでなく、より良く、より長く生きることができるだろう。
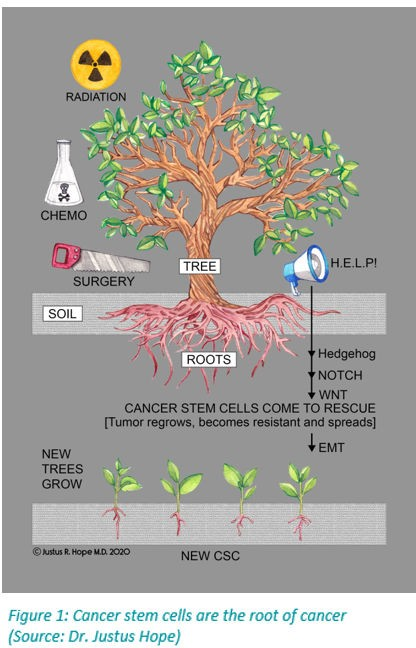
ジャスタス・ホープはペンネームである。著者は自分の名前で医療活動を行っている。『がんからの生還』『COVID-19』『Disease』『The Repurposed Drug Revolution』などの著書がある。
まえがき
ポール・マリク博士著
「どのような人がどのような病気にかかっているかを知ることは、その人がどのような病気にかかっているかを知ることよりも重要である」
ヒポクラテス(紀元前460-370)
「助ける力があれば、そうする義務がある」
ミルコ・ベルヤンスキー(1923-1998)
数年前、髪の毛がもっとふさふさで、COVID-19がまだ誰の目にも輝いていなかった頃、私は病院での死因の中で最も多いもののひとつである医療敗血症の治療法を開発したことで知られるようになった。私の 「カクテル」は、敗血症に再利用できる安全で安価な、入手しやすい3種類の薬で構成されていた。ビタミンC、ヒドロコルチゾン、チアミンを患者に投与すると、数時間以内に容態が好転した(1)。
薬の再利用は目新しいことではない。新薬の上市には何十年もかかり、何十億ドルもの費用がかかるが、認可された既存薬であれば、安全で手ごろな価格の効果的な治療薬を短期間で提供することができる。
フロントラインCOVID-19クリティカルケアアライアンス(FLCCC)は、過去数年間、COVID、長期COVID、コロナワクチン合併症の治療に、ビタミン、サプリメント、生活習慣の改善だけでなく、再利用薬を用いて大きな成功を収めてきた。 (3) 上記の症状に対するプロトコルを研究・開発している間に、私は膨大な量の情報を読み始め、興味深いパターンが浮かび上がってくるのを見て、間欠的断食のような驚くべき非薬物的介入とともに、がんの治療において再利用薬が果たしうる役割について調べるようになった。そうすることで、がんの原因や治療方法について私がかつて理解していたことの多くが間違っていたこと、あるいは少なくとも見当違いであったことを知った。
この文書をまとめるにあたり、私は何千時間もの時間を費やし、900以上の査読済み論文を読み、何十人もの医師や専門家に相談した。はっきりさせておきたいのは、私はがんの治療法を発見したと言っているわけではなく、がんに対する再利用薬の使用を最初に提案したわけでもないということである(4-7)。私は、がん患者をケアする医療従事者が視野を広げ、患者の転帰を改善する可能性のある、有効性を科学的に裏打ちされた、容易に利用可能な治療法について創造的に考えるきっかけになることを目指している。
私はもう患者を直接診ることはないが、「まず害を与えない」というヒポクラテスの誓いは永遠に守るつもりである。そのための私の最新の貢献として、この情報の大要を提供する。
第1章 はじめに
補完代替医療(CAM)戦略には、従来の医学のパラダイムから外れた、健康をサポートするための薬や実践が含まれる。CAMには、ハーブやサプリメントなどの生物学的根拠に基づく療法、心身への介入、中国伝統医学のような代替システムが含まれる。CAMの使用は腫瘍科領域で頻繁にみられ、がん患者の半数近くが診断後にCAMを使用し、91%が化学療法や放射線治療中にCAMを使用したと報告している(8, 9)。 したがって、がん専門医が患者や家族とオープンに話し合い、CAMの潜在的なリスクとベネフィットを理解し、オープンで包括的な話し合いを促進することが不可欠である。このことは、従来の治療にCAM戦略を安全に統合し、患者と医療者間の知識の共有を促進する可能性がある。(10)
がんの社会的影響
がんは人間の生命に深刻な影響を及ぼす世界的脅威であり、毎年1,000万人以上が死亡している。2023年には200万人近くのアメリカ人ががんと診断され、約60万9820人が死亡すると予想されている(表1参照)。(11)
米国では、がんは心臓病に次いで2番目に多い死因である。この国で新たに診断された癌の少なくとも42%は、潜在的に回避可能であり、そのうちの19%は喫煙が原因であり、少なくとも18%は体重過多、飲酒、栄養不良、運動不足の組み合わせが原因である。(11)
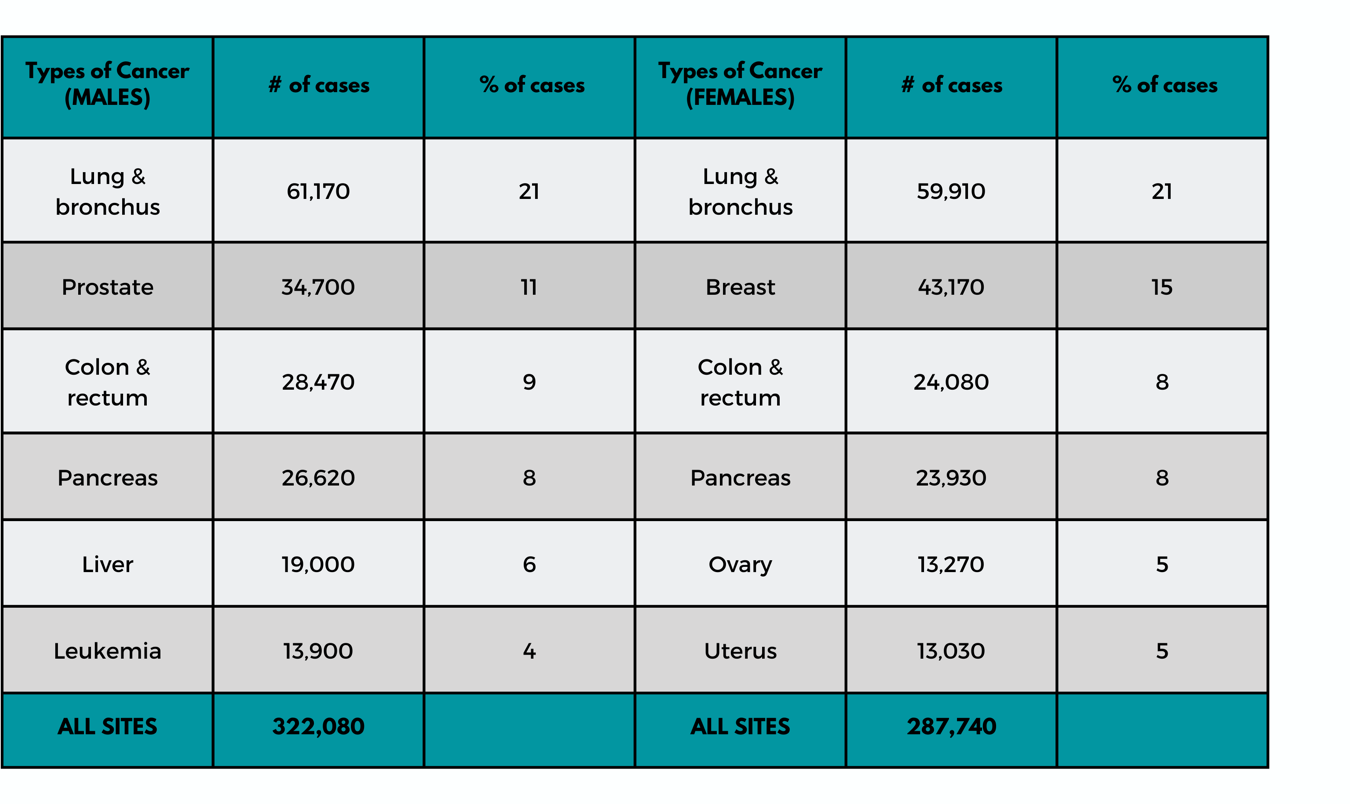
表1:がん死亡の主要部位-2023年推計(出典:米国がん協会)
加えて、私たちの社会が「化学化」しているため、人間は毎日数多くの発がん物質にさらされている。(12)こうした環境発がん物質が、がんリスクの増加に寄与している可能性は高いが、その影響を定量化することは難しい。
『ジャスタス・ホープ』というペンネームで、がんと再利用薬に関する本を書いた医師によれば、がんになる人はほとんど全員、少なくとも一つの共通した危険因子をもっているという。タバコ(40%)、インスリン抵抗性(40%)、ウイルス(10%)、家族性大腸腺腫症、BRACA突然変異などの遺伝性がん(10%)などである。(13)
不思議なことに、がんに最も関係しているのは体重過多や肥満ではなく、インスリン抵抗性の存在である。(13)さらに、インスリン抵抗性があり、TG/HDL比(コレステロール値の指標)が高い患者は、心臓病やアルツハイマー病だけでなく、がんのリスクも高い。(13, 14)
がんに対する現在の治療法は非常に複雑で、複数の治療法に基づいている(図2参照)が、その多くは非常に高価で、(QOLや5年生存率の点で)恩恵は限定的であり、またその多くは毒性も強い。米国国立がん研究所は、2020年の米国におけるがん関連医療費は2,089億ドルであると推定しているが、これは個々の薬剤の費用が増加しているため、総計としては過小評価である可能性が高い。(11)
2000年には、10億ドル以上の売上をあげたがん治療薬はわずか2つしかなかった。それからわずか10年後、がん治療薬のトップ10はそれぞれ売上高10億ドルを超えた。2010年までに、米国では10人のがん専門医に対して3人のがん治療薬の販売代理店が存在するようになった。がんはビッグビジネスなのだ。(15) 患者とその家族は、がん治療の結果、極度の経済的負担と苦痛に直面することが多い。(16)
肺がん、乳がん、大腸がん、前立腺がん、膵臓がんなどの一般的ながんの治療に膨大な費用が費やされているにもかかわらず、年齢調整死亡率は1930年以降、驚くほど安定しているか、むしろ上昇している。(11) 心臓病の予防と治療の改善に比べ、がんの死亡率は過去30年間、比較的横ばいのままである。(17)
Morganらは、最も一般的な22の悪性腫瘍について1992年から1997年の間に収集されたデータに基づき、成人の5年生存率に対する根治的および術後補助的細胞毒性化学療法の全体的な寄与率は、オーストラリアでは2.3%、米国では2.1%と推定した(18)。米国のより最近のデータによると、過去25年間(1995年から2018)、がんの5年生存率は63%から68%にしか上昇していない。このデータは、がん治療に何十億ドルも費やされているにもかかわらず、「伝統的な」アプローチはほとんど失敗していることを示唆している。
図2:「現代的な」がん治療は高価で、効果も限られている(出典:FLCCC)
第2章 癌とは何か?その病因を理解する
医学の基本的な考え方は、病気を治療するためには、その病気を理解する必要があるということである。癌とは、簡単に言えば、細胞の増殖と分裂が制御不能になり、それを抑えるための様々な自然プロセスが部分的あるいは完全に機能しなくなった病気である。
従来の理論では、癌は遺伝子の突然変異やゲノムの不安定性によって引き起こされ、それによって以下の6つの 「古典的」生物学的性質を持つ細胞集団が形成されるとされている:(19)
- 1. 増殖シグナルを持続する
- 2. 増殖抑制因子を回避する
- 3. 細胞死(アポトーシス)に抵抗する
- 4. 複製不死を可能にする
- 5. 血管新生を誘導する
- 6. 浸潤と転移の活性化
これらの 「がんの特徴」を解明したハナハンとワインバーグは、すべてのがん細胞における最も重要で普遍的な発見、すなわち、好気的解糖によるがん細胞の代謝再プログラミング、いわゆる。「ワールブルグ効果」を除外した(20)。(21, 22)
従来の考え方では、がんは1つの細胞から発生し、その細胞内の特定の突然変異が患者の 「がんゲノム」を特徴づける。DNA損傷の感知と修復に関与するゲノムの 「管理人」あるいは 「保護者」の喪失が、腫瘍細胞の変異しやすさの増加を説明するために提唱されてきた。このような世話役システムの喪失は、ゲノムの不安定性を可能にし、その結果、前悪性腫瘍細胞が癌の6つの重要な特徴に到達することを可能にする。
ヒトゲノムプロジェクトに倣った癌ゲノムアトラス計画(TCGA)は、一般的な癌の特徴的な変異を決定する試みであった(23)。TCGAは、4,645の全ゲノム配列と19,184のエクソーム配列から得られた84,729,690の体細胞変異を用いて変異シグネチャーを評価した。(24,25)この大規模プロジェクトの発見は、がんの突然変異説に重大な疑問を投げかけるものである。
TCGAは、49の一塩基置換、11の二塩基置換、4つのクラスター化塩基置換、17の小さな挿入と欠失のシグネチャーを同定した。しかし、特定の癌に特徴的な変異はなかった(CMLとフィラデルフィア染色体を除く)。多くの腫瘍では変異は見られず、同じ細胞型の腫瘍間(腫瘍間不均一性)や同じ腫瘍内(腫瘍内不均一性)でも変異の不均一性が顕著であった。(7)髄芽腫のような小児腫瘍では、ドライバー遺伝子の数は少なかった(0〜2個)。膵臓がん、大腸がん、乳がん、脳腫瘍などの一般的な成人腫瘍では、変異したドライバー遺伝子の数は3〜6個であることが多かったが、ドライバー変異が1〜2個しかない腫瘍もいくつかあった。がんは主要遺伝子の突然変異のみによって引き起こされるという考え方は、維持するのが難しくなってきている。(7) その矛盾はあまりにも多く、顕著である。
別の理論:癌は代謝疾患である
トラビス・クリストファーソンは、その著書『真実につまずく』の中で次のように述べている:
「どの研究者も、単一の突然変異や突然変異の組み合わせを指摘して、それだけが癌の原因であると自信を持って言うことはできない。また、突然変異によって機能不全に陥った一連の細胞システムを指して、同じことを自信を持って主張することもできない。(7)」
「DNAの父」として知られるノーベル賞受賞者、ジェームズ・ワトソンは 2009年の『ニューヨーク・タイムズ』紙への寄稿で、「われわれは研究の主眼を、がんの背後にある遺伝的命令の解読から、がん細胞内の化学反応の理解に向けなければならないかもしれない」と示唆した(26)。
悪性化の根底には非常に特異的なプロセスがあるが、放射線、化学物質、ウイルス、炎症など、多くの非特異的な影響が病気を引き起こす可能性がある。実際、環境中のほとんどあらゆる刺激物質に長期間さらされると、がんを引き起こす可能性があるようだ。(27)非常に特異的なプロセスが、非常に非特異的な方法で開始される可能性があるということは、セント-ジャイによって、「発癌のパラドックス」とみなされた(27)。このパラドックスはまだほとんど解決されていない。(28)
それでもなお、遺伝子変異と遺伝的不安定性という概念は、従来のがん治療のほとんどを支えている。大手製薬会社と医療機関は、非常に高価で有毒な化学療法薬の使用を促進するために、この概念を広めてきた。前述のように、がんは製薬業界にとって利益をもたらすものである。前述したように、がんは製薬業界にとって利益をもたらすものである。
遺伝子突然変異説が完全には正しくないかもしれないという証拠はかなりある。Thomas Seyfried博士は、癌は遺伝病というよりもむしろ代謝病であるという説得力のある議論を展開している(28, 29)。彼の基本的仮説は、癌は酸化的リン酸化とエネルギー産生が障害されたミトコンドリア障害であり、ゲノム異常はエネルギー産生と細胞代謝の障害による二次的なものである可能性が高いというものである。
Seyfried博士は、ミトコンドリア機能の障害とエネルギー産生の障害がすべての癌に共通することを明確に示した。(28,29)がんを主として代謝性疾患として捉えることは、がんの管理と予防に対するアプローチに劇的な影響を与えるであろう。
しかし、遺伝的不安定性とミトコンドリアの機能障害との間には、非常に複雑で双方向の関係が存在することは明らかである。
癌が代謝性疾患であるという考えは、オットー・ワールブルクが1927年に初めて指摘したもので、彼はその発見により1931年にノーベル医学生理学賞を受賞している(21, 22)。。
Warburg博士は、がん細胞は好気的解糖(グルコースから乳酸への分解)に依存しており、酸化的リン酸化(ピルビン酸がミトコンドリアのクレブスサイクルに入らない)が障害されていることを報告した(21, 22)。 簡単に言えば、癌はグルコースを糧としているということである。
正常な分化細胞が、細胞プロセスに必要なエネルギーを生成するために、主にミトコンドリアの酸化的リン酸化に依存しているのとは対照的に、ほとんどの癌細胞は、代わりに好気的解糖に依存している。(30)ワールブルグ博士は、呼吸に対する不可逆的な損傷が癌の主要な原因であると提唱した。癌細胞における好気性解糖は、酸素存在下で乳酸産生を伴うグルコース取り込みの上昇を伴う。(28)
腫瘍の代謝に関する広範な研究の後、ウォーバーグ博士は次のように述べている: 「癌は、他のどの病気よりも、無数の二次的原因を持っている。しかし、癌にも一つの原因がある。一言で言えば、癌の主な原因は、正常な体細胞の酸素呼吸が糖の発酵に置き換わることである。(21, 22)
この代謝表現型は、標識グルコースアナログを用いた腫瘍イメージングの基礎であり、癌の発見と管理のための重要な診断ツールとなっている。解糖系遺伝子は検査された癌の大部分で過剰発現している(28)。 多くの研究から、腫瘍のミトコンドリアは構造的にも機能的にも異常であり、正常レベルのエネルギーを生成できないことが示されている(31-36)。さらに、RTG応答(ミトコンドリアストレスシグナル伝達)を主に介して作動するミトコンドリアの機能障害が、腫瘍細胞の変異体表現型の根底にあることを示す説得力のある証拠がある(37-41)。(37-41)ミトコンドリア機能の障害は、癌抑制遺伝子や癌遺伝子の異常を誘発する可能性がある。
核出しをした正常細胞の細胞質を腫瘍細胞と融合させてサイブリッドを形成すると、腫瘍原性が抑制されることはよく知られており、このことは正常なミトコンドリアが腫瘍原性の表現型を抑制できることを示唆している(42, 43)。Singhと共同研究者らは、ミトコンドリアが枯渇した細胞(rho0細胞)に野生型ミトコンドリアを外因的に移入すると、APE1多機能タンパク質の発現変化と腫瘍形成表現型を逆転させることができることを示し、腫瘍形成抑制におけるミトコンドリアの役割についてさらなる証拠を提示した(44) 。(44)また、がん細胞の核を正常な細胞質に移植すると、由来組織の細胞には腫瘍に関連したゲノム欠損が存在し続けるにもかかわらず、正常組織を形成するように再プログラムできることもよく知られている。(45, 46)
ウイルスは長い間、いくつかの癌の原因として認識されてきた。いくつかの癌関連ウイルスがミトコンドリアに局在する、あるいはミトコンドリアに蓄積することは興味深い。ウイルスがミトコンドリアの機能を変化させることで、エネルギー代謝が阻害され、腫瘍抑制遺伝子や癌遺伝子の発現が経時的に変化する可能性がある。ミトコンドリア機能に影響を及ぼす可能性のあるウイルスには、エプスタイン・バーウイルス(EBV)、カポジ肉腫関連ヘルペスウイルス(KSHV)、ヒトパピローマウイルス(HPV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)、ヒトT細胞白血病ウイルス1型(HTLV-1)、SARS-CoV-2などがある。(47-49)
がん化に対する細胞の第一の防御手段はアポトーシスである。アポトーシス経路は、抗アポトーシス因子によって抑制されている。これら2つのシステムはバランスよく機能し、どちらか一方が優勢になると、細胞はアポトーシスするか、アポトーシスシグナルに抵抗する。がん治療に対する代謝的アプローチは、アポトーシス経路を促進する。
ミトコンドリアとミトコンドリア関連膜の超微細構造異常に加えて、酸化的リン酸化(OxPhos)に寄与するクリスタに富むリン脂質であるカルジオリピンの含有量や組成が正常ながん細胞は見つかっていない。
カルジオリピンは、電子輸送鎖(ETC)超複雑構造の適切な機能にとって必須であり、それはクリステの超微細構造と直結していることが認識されている(50)。ミトコンドリアの構造と機能におけるこれらの文書化された異常とは別に、ミトコンドリア機能を変化させる遺伝子異常も多くのがんで認められている。多くのがんに見られるp53変異は、ミトコンドリアのOxPhosを破壊する可能性がある。網膜芽細胞腫の癌抑制タンパク質Rbは、ミトコンドリア量とOxPhosの機能異常と関連している(50)。 構造的であれ機能的であれ、ミトコンドリアの異常がない癌はほとんどなく、OxPhosの機能不全は癌の特徴的な代謝的特徴となっている。腫瘍細胞は浸潤のためにかなりのATP/ADP比を必要とするので、OxPhosの非効率性を補うために、ATP合成のための代替システムが必要である。細胞質(解糖)およびミトコンドリアの基質レベルリン酸化(SLP)に依存することで、好気的または嫌気的な増殖環境において、腫瘍細胞の増殖と浸潤に必要なATPと代謝ビルディングブロックの両方を供給することができる。(50)
ATP合成に酸素消費を利用する細胞は、低酸素状態やシアン化合物で処理されると速やかに死滅する。多くの癌細胞は、シアン化物や低酸素で処理しても生存できるので、これらの細胞におけるATP合成は、OxPhos以外の供給源に由来しているに違いない(50)。ほとんどのがんで見られるゲノムの不安定性やランダムな体細胞突然変異は、主に活性酸素の産生とOxPhosの機能不全の下流での随伴現象として生じている。
1950年代から、腫瘍は増殖と生存のために大量のグルタミンを必要とすることが認識されてきた(それゆえ、ほとんどの培地にグルタミンが含まれている)。高親和性グルタミン輸送体Slc1a5(ASCT2)は、多形性神経膠芽腫(GBM)を含む複数のタイプのがんで発現が上昇し、グルタミンの正味取り込みに関与していることが示唆されている(51) 。
- (51) 数十年後、グルタミンがGBMを含む腫瘍細胞における主要なエネルギー源であることが認識された。(28, 29, 50-53)正常細胞では、グルタミンとグルタミン酸の相互変換は双方向的であり、グルタミン合成酵素がグルタミン生成を触媒する。しかし腫瘍では、グルタミナーゼの過剰発現とグルタミン合成酵素の抑制により、グルタミン酸への順方向反応が促進される。グルタミナーゼ活性は生体内試験での腫瘍増殖率とよく相関している。グルタミンはヌクレオチドやNEAAの合成に窒素を供給するだけでなく、クエン酸サイクルにおける基質レベルでのリン酸化を介してATP合成の前駆体として機能するa-ケトグルタル酸を供給する。
がん細胞のミトコンドリアネットワークに異常があると、OxPhosの効率が低下し、ATP合成をSLPに依存せざるを得なくなる。コハク酸-CoAリガーゼ(SUCL)はミトコンドリアのマトリックス酵素で、コハク酸-CoAとADPからCoA-SH、コハク酸、ATPへの変換を触媒する。注目すべきは、SUCLがATP形成に向かうとき、それは”ミトコンドリア基質レベルリン酸化”’(mSLP)と呼ばれ、酸素のない状態で高エネルギーリン酸を得ることができるプロセスである。mSLPによるエネルギー生成は、いくつかの代謝経路において決定的に重要であり、がん細胞におけるOx- Phosによる非効率的なエネルギー生成を補う可能性がある。グルタミノリシス経路は、グルタミン→グルタミン酸→α-ケトグルタル酸→スクシニルCoA→スクシネートの順次代謝を通して、高エネルギーリン酸塩の産生をサポートする。(28, 29, 50-53)グルタミンは長い間、腫瘍細胞の増殖に必須の代謝産物と考えられてきた。(54)グルタミナーゼは、アミノ酸グルタミンからグルタミン酸を生成し、TCAサイクルに供給する触媒酵素である。
Chenらは、影響を受ける特定のOxPhos複合体にかかわらず、OxPhosに部分的な欠損を持つ細胞ではグルタミン利用が共通の特徴であることを示した。(55)OxPhosの非能率は、癌のグルタミン中毒の大部分を占める可能性がある。グルタミンを供給されたmSLPは、低酸素あるいは正常酸素のいずれの増殖環境においても、OxPhosの欠乏を補うことができる。
全てではないにしても、ほとんどの腫瘍細胞は増殖のためにグルコースとグルタミンに依存していることはよく知られている。グルタミン以外のアミノ酸もmSLPを通じてエネルギーを供給することができるが、グルタミンはコハク化CoAを生成するのに必要な代謝相互変換にエネルギーを消費する必要のない唯一のアミノ酸である(50)。
TCAサイクルのコハク酸-CoAリガーゼ反応によって実質化された、グルタミン駆動のグルタミン分解経路におけるミトコンドリアの基質レベルリン酸化(mSLP)は、Ox-Phosと解糖の両方によるATP合成の減少を部分的に補うことができる。OxPhosの不足が長期化し、解糖が亢進し、補助的にmSLPが完全に作動するようになると、細胞は抑制されない増殖のデフォルト状態に陥り、その結果、脱分化とアポトーシス抵抗性、すなわち癌化することになる。(50)グルコースとグルタミンを同時に制限することは、癌を管理するための治療戦略を提供する。
COVID-19、スパイクプロテイン、そして、「ターボ癌」
スパイクプロテイン、特にCOVID-19のmRNAワクチン接種後のスパイクプロテインへの暴露は、「ターボ癌」と関連していることがソーシャルメディアや非伝統的なニュースで報告されている。これには、悪性度の高い新しいがん、多くの場合若い患者やまれな細胞型/部位、寛解後の患者の腫瘍再発が含まれる。COVID-19の長期投与は、回復した患者に癌を発生させやすくし、癌の進行を促進させる可能性があることが提唱されている(56)。 米国国防総省医療疫学データベース(DMED)(57)は、軍におけるCOVID-19 mRNAワクチン接種の展開後、悪性新生物が664%増加したと報告している(このデータが誤って削除されるまで)。
SARS-CoV-2は、中心的な代謝経路を調節したり、ゲノムの完全性機構を阻害したりすることによって正常細胞を癌細胞に変え、その結果アポトーシス機構を阻害したり、細胞増殖を亢進させたりすることが示唆されている(56, 58)。 SARS-CoV-2および/またはスパイクプロテインが腫瘍形成を促進する具体的な病原メカニズムはまだ十分に研究されていないが、いくつかの可能性のあるメカニズムが存在する。スパイクプロテインはミトコンドリアを損傷し、ミトコンドリア機能を変化させる;これは癌細胞の発生と増殖に中心的な役割を果たすと考えられる。(59-62)SARS-CoV-2は自然免疫と適応免疫の調節障害を引き起こす。CD8+細胞とナチュラルキラー細胞の枯渇は免疫監視機能を低下させ、腫瘍の増殖と転移を促進するように腫瘍の微小環境を変化させる。(63) レチノブラストーマタンパク質(pRB)は腫瘍抑制タンパク質であり、細胞が分裂する準備が整うまで細胞周期を阻害することにより、過剰な細胞増殖を防ぐ。コロナウイルスの非構造タンパク質15(Nsp15)は、pRBの核外輸送とユビキチン化を誘導し、プロテアソームを介した分解に導く。(SARS-CoV-2のオープンリーディングフレーム8(ORF8)タンパク質は、主要なオートファジーのカーゴレセプターであるp62と相互作用し、オートファジーを阻害する。(IFNシグナル伝達は、p53や様々なサイクリン依存性キナーゼ阻害因子のアップレギュレーションを介して、細胞周期を停止させることにより、がん細胞の増殖を抑制する。(67, 68) 代謝的リプログラミングはSARS-CoV-2の特徴であり、腫瘍形成に関与している可能性がある。代謝の初期化にはアミノ酸と脂質の代謝、炭水化物とエネルギーの代謝、免疫関連の経路が含まれる。(56)最近では、COVID-19ワクチンのバイアルからシミアンウイルス40(SV40)のDNAプラスミドが分離された(社会報道)。SV40は発癌性ウイルスとして知られている。(69)
がん患者において、SARS-CoV-2/スパイクプロテインとの因果関係を立証するのは難しいかもしれない。しかし、腫瘍をスパイクプロテインで染色することにより、この因果関係を立証することができる。これらの 「ターボ」がんは悪性度が高いことが多いので、このモノグラフのガイダンスを含め、積極的な治療が推奨される。
癌シグナル経路
シグナル伝達経路は、細胞が様々な生理学的プロセスを制御し、外部刺激に応答するための中核的システムである。通常、細胞はシグナル受信、カスケード伝達、そして最終的な遺伝子発現を開始および/または抑制するための調節機構を完全に備えているが、がん細胞では通常、シグナル伝達経路が過剰に活性化され、バランスが崩れている。本書に記載されている栄養補助食品やリパーポーズド医薬品のほぼ全ては、重要なシグナル経路の複数のリンクを標的として制御することにより、シグナル伝達を促進および/または阻害することで抗がん作用を有する。最も関連性の高い経路は以下の通り:
ヘキソキナーゼ-2(HK2)経路
1977年、Pete Pedersenはワールブルグ効果の原因となる代謝異常を単離した:正常なヘキソキナーゼがヘキソキナーゼII(HK2)に乗っ取られ、次いでその大量過剰産生が起こるのである(7, 70)。(ヘキソキナーゼは細胞質における解糖の第一段階である。
がん細胞は、ヘキソキナーゼの胚型(HK2)に切り替わり、その後、細胞質からミトコンドリア外膜に移動し、そこで電圧依存性アニオンチャネル(VDAC)に結合する(71-73)。(71-73)VDACは外膜にある孔のような開口部で、ミトコンドリア内外への栄養素やシグナル伝達分子のシャトリングに関与している。HK2は、ワールブルグ効果を示すがん細胞で発現する主要な結合型ヘキソキナーゼアイソフォームである。HK2はミトコンドリア外膜上に存在することで、がん細胞の不死化を助け、生成物の阻害を免れ、グルコースをリン酸化するために新たに合成されたATPを優先的に利用できるようになる。(74)HK2がミトコンドリア外膜上のVDACに結合することで、アポトーシス抵抗性の状態が作り出され、解糖をサポートするためにATPがミトコンドリアから細胞質へとシャントされる。HK2と結合すると、VDACゲートは 「ロック」され、シトクロムcの放出を防ぎ、アポトーシスを防ぎ、細胞を効果的に不死化する。いくつかの薬剤はHK2を標的とし、酵素をミトコンドリア外膜から分離する。これらには、3-ブロモピルビン酸、クルクミン、レスベラトロール、その誘導体であるプテロスチルベン、ケルセチンなどがある。
p53経路(腫瘍抑制経路)
(75)p53経路は、細胞のDNAに損傷やエラーがないか監視するセンサーキナーゼによって活性化される。損傷が検出されると、センサーキナーゼはp53癌抑制タンパク質の核局在因子をリン酸化し、細胞核に転移してp21、p16、p15、p19を発現し始める。これにより細胞周期停止経路が活性化され、DNA修復が開始され、細胞分裂が阻止される。修復が失敗したと判断されると、BAX、BAK、PUMAなどが発現し、ミトコンドリアのカスパーゼカスケードが開始され、アポトーシスが始まる。
TGF-β経路
TGF-β経路は、細胞の成長、分化、アポトーシスを制御する上で重要な役割を果たしている。(76)細胞表面レセプターに結合すると、TGF-βはSMAD転写因子を活性化し、抗アポトーシス遺伝子の抑制とプロアポトーシス遺伝子の活性化を引き起こす。この経路は、異常細胞のアポトーシスを促進し、前がん細胞の増殖を抑制することにより、腫瘍抑制因子として働く。この経路に欠陥があると、細胞の増殖が制御できなくなり、癌の発生につながる。
Wntシグナル伝達経路
Wntシグナル伝達経路は、細胞の増殖と分化の制御に重要な役割を果たしている。(77)正常な状態では、Wntシグナル伝達は細胞増殖とアポトーシスのバランスを保ち、健全な組織成長を保証している。しかし、この経路が過剰に、あるいは不適切に活性化されると、癌の発生につながる。
ノッチシグナル伝達経路
ノッチシグナル伝達経路は、細胞の分化、増殖、アポトーシスに関与するシグナル伝達機構である。(78)ノッチ受容体やリガンドの変異などのノッチ経路の障害は、細胞増殖と分化の調節不全を引き起こし、癌の発生に寄与する。
PI3K/AKTシグナル伝達経路
ホスホイノシチド3-キナーゼ(PI3K)シグナル伝達経路は、成長制御とグルコース代謝の両方に関連している。PI3K/AKTシグナル伝達経路の活性化は、細胞表面の成長因子レセプターがリガンドに結合し、PI3Kの活性化を引き起こすことで起こる。(一旦活性化されると、AKTはBADやFOXOなどのアポトーシス促進タンパク質をリン酸化し、その活性を阻害する。AKTはmTORC1も活性化し、細胞代謝を制御し、抗アポトーシス遺伝子Bcl-2やBcl-xLの発現を刺激することによって細胞の生存を促進する。
ヘッジホッグ経路
ヘッジホッグ(Hh)は、発生過程で細胞間コミュニケーションに頻繁に使われる数少ないシグナル伝達経路の一つである。(80)Hhは哺乳類のほとんど全ての器官の器官形成に重要であり、また再生や恒常性維持にも重要である。
さらに、Hhシグナル伝達は様々なタイプのがんで障害されている。メベンダゾールは、神経膠腫、黒色腫、肺癌、卵巣癌、大腸癌によく見られるヘッジホッグ経路の活性を低下させる。(81)
インスリン様成長因子-1(IGF-1)経路
インスリン様成長因子-1(IGF-1)は、内分泌ホルモンとして主に肝臓で産生され、パラクリン/オートクリン様式で標的組織でも産生される。IGF-1のシグナル伝達は、主にその特異的受容体であるインスリン様成長因子1受容体(IGF-1R)との結合によって媒介され、AKTシグナル伝達経路の活性化をもたらし、その結果、細胞の成長、増殖、プログラムされた細胞死の抑制をもたらす。循環IGF-1レベルの上昇は、多くのがん種の確立された危険因子であり、一方、IGF-1レベルの低下は、がん罹患率の低下と関連している。
がん免疫
炎症は免疫防御の重要な柱である。しかし、慢性炎症は癌の発生と進行の特徴であると考えられている。慢性炎症は分子、細胞、臓器レベルで複雑な変化を引き起こし、それによって腫瘍微小環境(TME)を変化させる可能性を示している。がん細胞は骨髄造血を刺激し、骨髄細胞をTMEに動員するいくつかの成長因子を頻繁に分泌する(図3参照)。(82,83)そのため、様々ながんのTMEは、単球、マクロファージ、顆粒球、樹状細胞の浸潤が多いという特徴がある。TME内のほとんどの骨髄系細胞は未熟な状態で存在する。しかし、がん由来の増殖因子は、これらの骨髄系細胞を、増殖、遊走、転移を促進し、がん細胞の生存と免疫回避を可能にすることによって、発がんを支援する細胞へと変化させる。従って、アポトーシスの異常に加えて、がん患者は免疫系ががん細胞を異物として認識できない免疫異常を持っている。以下の細胞はTMEを変化させ、発癌を促進する上で大きな役割を果たしている。
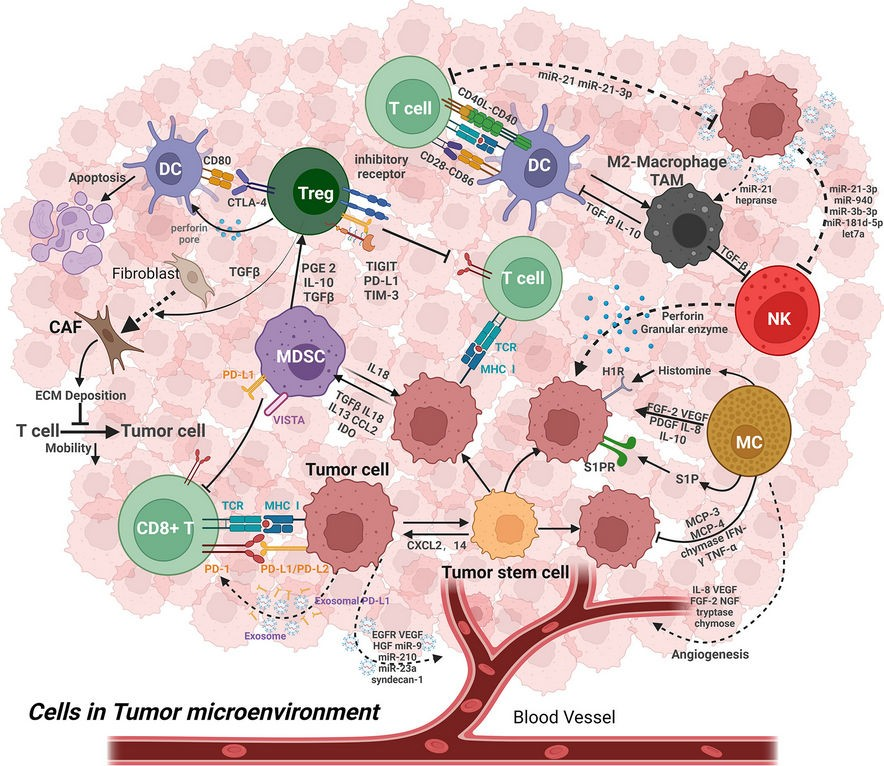
図3 腫瘍微小環境における細胞成分と構造成分(出典:Wang et al: 出典:Wangら、Creative Commons Attribution International licenseの下で複製)(83)
骨髄由来幹細胞(MDSC)
転移と呼ばれる遠隔臓器への原発性腫瘍細胞の定着は、がん死亡の主な原因である。原発巣を 「根治的」に切除したにもかかわらず、多くの患者は診断時に腫瘍細胞が播種している。腫瘍細胞は、原発性腫瘍の切除時にがん患者の骨髄で発見されることがある(84)。これらの患者は、数ヵ月、数年、あるいは数十年後に顕性転移を起こすことがある。がん細胞が増殖せず、静止状態または平衡状態にあるこの潜伏期間を 「がん休眠」と呼ぶ。転移休眠の時間軸は、腫瘍とその微小環境、血管新生、腫瘍抗原特異的T細胞応答との相互作用によって制御されている。このような休眠のメディエーターの一つが骨髄由来抑制細胞(MDSC)であり、浸潤腫瘍におけるその数は、広範な腫瘍病態において、癌の病期、悪性度、患者の生存率、転移と関連している(図4参照)。(85, 86)
広範な研究により、MDSCが適応免疫応答や自然免疫応答から腫瘍を逃避させ、腫瘍の進行や転移を促進する役割が明らかにされている(85, 87-91)。(85, 87-91) 腫瘍特異的細胞傷害性Tリンパ球を介した宿主免疫により、播種された腫瘍細胞の増殖を制御することができ、その結果、宿主T細胞応答を逆転させるMDSCsの増加に伴って休眠状態から解除されるまで、数年から数十年にわたって休眠病変を維持することができる。MDSCsは、活性酸素種、アルギナーゼ-1(ARG1)、一酸化窒素合成酵素(NOS)の産生を介してT細胞の機能不全を誘導し、免疫回避に寄与している。ARG1は細胞外のL-アルギニンを尿素とオルニチンに加水分解する。L-アルギニンはT細胞の増殖、サイトカイン産生、T細胞レセプターの発現に必要である。(92)
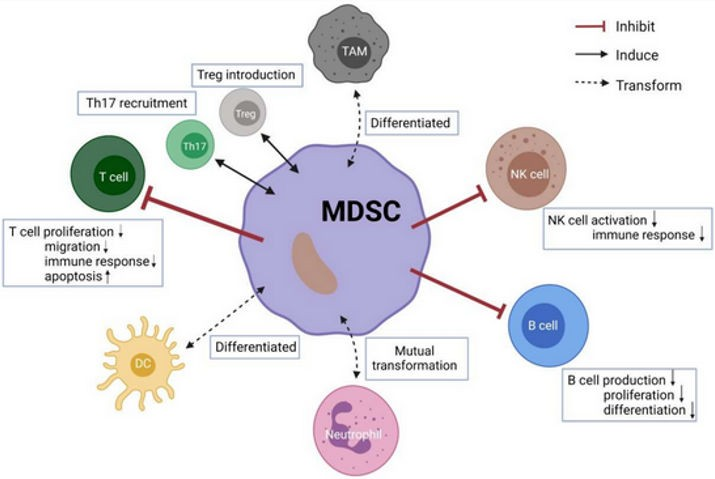
図4 MDSCsと他の免疫細胞とのクロストーク
上矢印は増加、下矢印は減少を意味する。(出典:Maら、クリエイティブ・コモンズ表示国際ライセンスに基づき複製)(86)
MDSCは、活性化エフェクターT細胞のクローン拡大を抑制するだけでなく、腫瘍特異的Tregリンパ球を誘導し、腫瘍宿主におけるT細胞寛容をさらに確立・維持することができる(90, 93, 94)。 さらに、インターフェロンをダウンレギュレートし、炎症性サイトカインを過剰発現し、細胞外マトリックスと基底膜の完全性を損なうマトリックスメタロプロテアーゼ9や他のリモデリング因子を過剰発現することでリーキー血管系を形成することで、MDSCsはがん細胞の浸潤を促進する。(89)
T制御細胞(Tregs)
CD4+CD25+Foxp3+CD127low/-で普遍的に標識されるTregは、従来のTリンパ球から分化している。(95-98)免疫恒常性を維持するために、Treg細胞は自己および非自己抗原に対する異常または過剰な免疫反応を抑制する。エフェクターT細胞、NK細胞、樹状細胞の抗腫瘍免疫反応を抑制することにより、Treg細胞はTMEにおける腫瘍の増殖と転移に寄与する。(96,98,99)様々なタイプのがん患者において、予後不良はTMEにおけるTreg細胞の高い浸潤と関連している(99-105)。(99-105)Treg細胞は、免疫抑制性サイトカインの産生、インターロイキン2およびIL 2レセプターの消費、樹状細胞によるCD80およびCD86発現の調節、およびエフェクターT細胞の直接的な殺傷により、免疫抑制を引き起こす。(99)Tregはまた、VEGF/VEGFR経路を介した血管新生にも大きく寄与している。
ナチュラルキラー細胞(NK細胞)
ナチュラルキラー(NK)細胞は、自然免疫系の中で最も癌と闘う細胞である。NK細胞は、免疫系において、がん細胞や感染細胞を含む異常細胞を認識し、それに応答する上で重要な役割を果たしている。T細胞はT細胞レセプター(TCR)を持ち、細胞表面のMHC-I-ペプチド複合体と結合し、免疫反応が開始されるかどうかを決定する。抗原プロセシングに関連するトランスポーター(TAP)複合体やβ2-ミクログロブリンの発現に障害が起こると、MHC-I自己抗原輸送能や表面提示能が失われ、NK細胞ががん細胞を破壊できなくなる。
腫瘍関連マクロファージ
循環単球から腫瘍にリクルートされ、がんの存在に影響されて腫瘍の悪性化と進行を促進するマクロファージは、しばしば腫瘍関連マクロファージ(TAM)と呼ばれる(図5参照)。(106-108)マクロファージは、形態学的、表現型的、機能的多様性に基づいて、M1とM2のサブグループに分けられる。一方、M1マクロファージは抗腫瘍免疫に重要な役割を果たし、腫瘍微小環境(TME)における炎症活性を主に媒介する。(108-110)転移性腫瘍では、マクロファージは原発性腫瘍とは異なる表現型と機能を持ち、しばしば転移関連マクロファージ(MAM)と呼ばれる。
TAMはほとんどが骨髄由来の単球から生じ、腫瘍細胞が産生するケモカインCCL2が主要なリクルート因子である。骨髄由来の単球には、古典的な単球と単球性MDSC(M-MDSC)の両方が含まれ(111)、免疫応答の負の制御に極めて重要である(112, 113)。
MDSCがIL-10を放出し、マクロファージによるIL-12の分泌を阻害するため、免疫系は腫瘍促進反応に偏る。マクロファージはまた、MDSCにIL-10を多く産生させ、マクロファージ中のIL-6とTNF-レベルを上昇させる。(112)MDSCのIL-6は腫瘍細胞によって上昇し、逆もまた同様であることが報告されている。(112)腫瘍細胞とMDSCおよびマクロファージの比率は固形腫瘍内の炎症を制御しており、これらの細胞間の相互作用は腫瘍微小環境内の炎症環境を劇的に変化させる可能性がある。ヒトの固形がんでは、マクロファージの浸潤が多いと臨床転帰が不良である(109, 112)。(108-110,112-121) 同様に、マクロファージ増殖因子や、CSF1やCCL2のようなマクロファージの化学誘引物質の腫瘍や循環における発現は、しばしば予後不良と関連している。(106)
TAMはTMEにおいて重要かつ支配的な免疫細胞であり、血管新生を促進し、T細胞の機能を阻害することにより腫瘍の免疫抑制を媒介し、腫瘍微小環境におけるT制御細胞のリクルートに寄与するケモカインを分泌し、VEGF発現を介して腫瘍細胞の浸潤を促進することにより、腫瘍の進行に大きく寄与する(図5参照)。TAMは、Th2、Treg細胞、IL-10、TGF-βなどの腫瘍浸潤リンパ球から分泌されるメディエーターによって活性化される(122)。(122)抗腫瘍免疫を低下させることにより、Foxp3+制御性T(Treg)細胞と腫瘍関連マクロファージ(TAM)はともに腫瘍の成長を助ける。研究者らは、TAMとTregが腫瘍免疫の直接的回避を担っていることを同定した。(123)TAMとTregは、部分的に冗長な細胞ネットワークを形成し、腫瘍免疫抑制の頑健性と免疫療法への抵抗性に寄与している。(109, 123)
TAMは腫瘍転移において主要な役割を果たしている(124)。癌関連線維芽細胞は、腫瘍の成長過程で内皮細胞が間葉系に移行するために産生され、熱ショックタンパク質-90α(Hsp90α)を分泌する。(125)腫瘍を促進するTMEを変化させる様々なメディエーターを分泌することで、TAMは腫瘍の増殖を促進することができる。血管内皮増殖因子(VEGF)、血小板由来増殖因子(PDGF)、線維芽細胞増殖因子(FGF)、形質転換増殖因子(TGF-)などの血管新生増殖因子、アポトーシスを阻止するNF-kB媒介因子、がん細胞の遊走と転移を促進する血管新生増殖因子(116)などである。(109)TAMはまた、IL-1raのような免疫抑制性サイトカインの放出をアップレギュレートする腫瘍幹細胞性を増加させる。(109, 126)がん細胞の増殖を促す上皮成長因子受容体(EGFR)のような成長因子を放出することで、TAMはがん細胞の増殖を直接促進する可能性がある。(127)肝細胞がんでは、より多くのマクロファージが浸潤することで活性化されたWnt/カテニンシグナル伝達が腫瘍前駆細胞の増殖を促進し、マクロファージを標的的に減少させることでWntを減少させ、腫瘍の増殖を遅らせることができる。(128)
がん細胞のPI3k/Akt経路を制御することで、TAMは腫瘍壊死因子関連アポトーシス誘導リガンド(TRAIL)のようなアポトーシス促進性サイトカインを阻害する可能性がある。(129)大腸がんや膵管腺がんなどのがん細胞にmiRNAを導入することで、M2マクロファージが産生するエクソソームは悪性腫瘍を拡大する。(130) 転移細胞は、システイン-システインモチーフケモカインリガンド20(CCL20)、マクロファージ炎症性タンパク質-3α(MIP3α)としても知られる)-ケモカイン受容体6(CCR6)軸/経路を用いて単球を引き寄せ、T細胞を抑制することで腫瘍細胞の生存と転移をサポートする転移関連マクロファージ(MAM)に分化させる。(109,115) さらに、TAMはマトリックスメタロプロテアーゼ(MMP)やシクロオキシゲナーゼ2型(COX-2)などのいくつかの酵素を放出するが、これらはすべてマトリックスを破壊し、内皮細胞の浸潤を可能にすることによって血管新生を促進するように働く。(131)TAMは腫瘍形成促進性の特徴を持つにもかかわらず、腫瘍細胞を取り込み、NO、活性酸素、IL-12を放出することで腫瘍のアポトーシスを引き起こし、特定の状況下では抗腫瘍反応を促し、腫瘍の増殖を抑えることができる。(132)このことは、免疫抑制性TAMと免疫刺激性TAMが同じ腫瘍内に共存しうることを示唆している。(109, 112, 133)
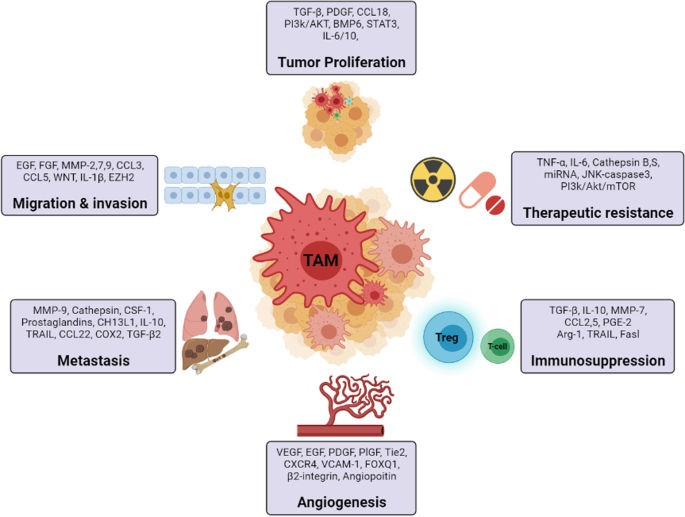
図5 癌における腫瘍関連マクロファージの役割
(出典:Kumari et al: 出典:Creative Commons Attribution 4.0 International Licenseの下、Kumari et alより転載)。(108)
血小板とがん
血小板は、免疫排除から腫瘍細胞を守り、腫瘍細胞の停止と浸出を促進することによって、転移を成功させ、がん患者の予後を悪化させることに関与している。(134-136)血小板とがん細胞間の直接的なシグナル伝達は、上皮間葉様転移を誘導し、転移を促進する。血小板由来のTGFβと血小板と腫瘍細胞の直接的な接触は、相乗的にがん細胞のTGFβ/SmadおよびNF-κB経路を活性化し、その結果、がん細胞は浸潤性の間葉様表現型に移行し、生体内試験での転移が促進される。(134) 共生的な方法で、腫瘍由来の生理活性分子は血小板の活性化と産生増加を促すことが示されている。(137, 138)
血管新生と転移
血管新生には、新生血管、すなわち既存の血管から新しい毛細血管が形成されることが関与しており、組織の炎症、創傷治癒、腫瘍形成の過程に関連している。ほとんどの腫瘍が0.2-2.0mmの大きさ以上に成長するためには血管新生が必要である。低酸素に反応して解糖をアップレギュレートする役割に加えて、HIF-1αは血管新生を刺激する血管内皮増殖因子(VEGF)の主要な転写因子である。
転移とは、癌細胞が原発巣から周辺組織や遠隔臓器に広がることを表す一般的な用語であり、癌の罹患率と死亡率の主な原因である。転移カスケードを完成させるためには、癌細胞は原発巣から剥離し、循環系やリンパ系に侵入し、免疫の攻撃を回避し、遠くの毛細血管床で外浸潤し、遠くの臓器に侵入し増殖しなければならない。転移のマクロファージ仮説は、転移細胞はマクロファージや骨髄由来の造血細胞と腫瘍細胞との融合によって生じることを示唆している(124)。
がん幹細胞(CSC)
がん幹細胞(CSC)は、1990年代に急性骨髄性白血病(AML)で初めて同定された(139)。さらなる研究により、神経膠芽腫、乳がん、子宮内膜がん、膵臓がん、前立腺がん、肺がん、大腸がんなど、さまざまな悪性腫瘍でがん幹細胞が観察された(139-141)。癌幹細胞は全体として、自己複製能、分化能、活性な抗アポトーシス経路、CD44、アルデヒド脱水素酵素、CD133の発現、その他正常組織特異的な体性幹細胞も発現するマーカーなど、独特の重要な性質を持つことが特徴である。(139, 142)
最初は単一の細胞から発生するにもかかわらず、ほとんど全ての腫瘍は非常に不均一になり、異なるマーカーを発現し、増殖細胞と分化度の高い細胞を含むようになる。腫瘍の不均一性は、腫瘍の進行、転移、治療に対する抵抗性、再発の原因となりうる。(143)増殖の速い癌細胞は腫瘍の大部分を占め、癌幹細胞(CSC)の集団は少ない。CSCは幹細胞に似た細胞集団で、腫瘍組織における自己複製能と分化能の特徴を持つ。(144)CSCは機能面では幹細胞に似ているが、幹細胞の自己複製に対する負のフィードバック制御機構がないため、その強力な増殖と多方向への分化能は無制限であり、化学療法や放射線療法中も一定の活性を維持することができる。外部環境が整えば、CSCsは急速に増殖し、腫瘍の形成と増殖を再び活性化する(142)。
CSCsはその機能的特性によって定義され、自己複製を行い、長期間にわたって腫瘍を増殖させ、原発性腫瘍に見られる様々な細胞系列を再現することができる。CSCsは特定の腫瘍微小環境ニッチに存在し、その増殖、再生、分化、幹細胞性の制御に重要な役割を果たす。(143)炎症と低酸素は、CSCの表現型の獲得とその維持を促進する。(143)化学療法は、CSCの生存と腫瘍の再発を支持する腫瘍微小環境の変化を誘導する。
CSCコロニーは成長が遅く、多くの点で正常細胞に似ている。化学療法と放射線療法はすべて分裂の速い癌細胞を殺そうとするが、毛髪、消化管の内壁、骨髄など分裂の速い正常細胞も殺してしまう(13)。さらに、化学療法も放射線治療もCSC集団を刺激する効果があり、抵抗性のある新しい腫瘍細胞を増殖させ、切除されたものの大部分に取って代わる(図1参照)。(13,143,145)Hope博士は、これを「木を剪定して新しい成長を促す」効果のようなものと考えている(まえがき参照)。乳癌の脳転移患者の腫瘍は、癌幹細胞のような細胞に富んでいることが報告されており、脳転移はおそらく幹細胞の特徴を持つ癌細胞の播種によって生じることが示唆されている(146)。膀胱がんでは、化学療法に対する腫瘍細胞の抵抗性は、化学療法のサイクルの間に増殖するように刺激された、サイクルの遅いCSCsによって引き起こされた。(147)CSCsの増殖反応は、化学療法によって死滅したがん細胞によるプロスタグランジンE2(PGE2)の放出によって促進された。モノクローナル遮断抗体やシクロオキシゲナーゼ-2阻害剤の投与によってPGE2を標的とすると、化学療法抵抗性が弱まり、化学療法のサイクル間にこの経路を標的とすることで、膀胱癌の治療効果が高まる可能性が示唆された。
癌の除去に成功するには、分化した癌細胞とCSCの両方に影響を与える抗癌剤治療が必要である。現在のところ、放射線療法、化学療法、免疫療法を含む従来の治療法は、急速に増殖し分化した細胞を死滅させる。これらの治療法は腫瘍を縮小させるかもしれないが、再発を防ぐことはできない。したがって、急速に増殖する癌細胞と静止しているか増殖の遅い癌幹細胞の両方を標的とする治療法の併用が必要である。(74)
CSCを攻撃する再利用医薬品の追加は優先されるべきであり、化学療法や放射線療法の開始時に行うべきである(13)。(13)CSCを攻撃できる一般的な再利用薬には、緑茶エキス、メラトニン、ビタミンD3、メトホルミン、クルクミン、スタチン(アトルバスタチン)、ベルベリン、メベンダゾール、ドキシサイクリン、イベルメクチン、レスベラトロール、アスピリン、ジクロフェナクホスホジエステラーゼ5阻害薬、オメガ3脂肪酸などがある。(13, 148-151)
化学療法がいかに癌の攻撃性を活性化するか
化学療法のもう一つの問題点は、薬剤が体内の大規模な炎症を活性化することによって、がんをより攻撃的にすることである。化学療法は炎症のマスターコントローラーであるNF-ΚBを活性化し、炎症性サイトカインIL-6を産生する。(152)この化学療法によって誘発される大規模な炎症の増加は、以下のような結果をもたらす: (74)
- より急速な癌の成長(増殖)を刺激する
- アポトーシス(プログラム細胞死)に対する抵抗性が増す。
- 癌の浸潤性、転移性を高める。
- 血管新生を促進する。
- 化学療法抵抗性の癌細胞集団を形成する。
これらの知見から、患者は化学療法剤と同時に抗炎症療法を受けるべきであることが示唆される。加えて、このモノグラフに列挙されているほとんど全ての再利用抗癌剤は、標準的な化学療法剤の効果を増強するため、これらの薬剤の投与量を減らすことが可能である。
第3章 がんの予防
前述したように、米国で新たに診断される癌の少なくとも42%は回避できる可能性がある。(11) 癌のリスクを減少させるための最も重要な介入には、禁煙、飲酒の制限(または中止)、栄養状態の改善、時間制限食の採用(絶食と健康的な食事に関するFLCCCガイドを参照)、メタボリックシンドローム/インスリン抵抗性の治療(FLCCCインスリン抵抗性プロトコルを参照)、適度な運動、ビタミンD3の補給などがある。(11)燻製肉や加工肉は、いくつかのがん、特に胃がんに関係していることは明白であるため、避けるべきである(153, 154)。 さらに、発がん性物質の外用、摂取、吸入はできるだけ制限すべきである。(12)
DO-HEALTH試験は、3年間の多施設共同、2×2×2要因デザインの二重盲検ランダム化比較試験で、ビタミンD3(2000IU/日)、および/または海洋性オメガ-3(1日1g)、および/または簡単な家庭用筋力運動プログラムの単独および併用による有益性を検証した。これらは、プラセボや対照運動と比較された(155, 156)。それぞれの介入は個々に癌のリスクを減少させたが、併用は相乗的に癌のリスクを減少させるのに非常に有効であった(調整HRの調整ハザード比は0.39)。否定的な研究として報告されたが、NIHが資金提供したVitamin D and Omega-3 Trial (VITAL)では、ビタミンDのがん死亡率に対する予防効果がさらに裏付けられ、ビタミンD3投与群とプラセボ投与群に無作為に割り付けられた参加者のがんによる死亡率が低いことが報告された(HR、0.72 [95% CI、0.52-1.00])。(157)さらに、他の多くの栄養補助食品もがん予防に非常に効果的であるようである。発表された査読済みの研究では、緑茶カテキンが多くのがんのリスクを減少させることが強く支持されている(158, 159)。(158,159)さらに、メラトニンは健康寿命を延ばし、神経変性疾患のリスクを低下させるなど、多くの健康上の利点がある。
メトホルミンは腫瘍の発生、成長、転移を抑制し、非糖尿病患者にも有効な抗がん剤として認められている。メトホルミンを服用している糖尿病患者は、服用していない通常の非糖尿病患者よりも全死因死亡率が低かった。(160)メトホルミンは、2型糖尿病の男性における前立腺がんのリスクを低下させることが証明されている。(161)メタアナリシスでは、がんの一次予防におけるメトホルミンの役割が検討されており、メトホルミンはがん罹患率全体を有意に減少させることが明らかにされている。(162,163)メトホルミンは、がん発症のリスクが高い患者、すなわち、強い家族歴、がんの既往、遺伝的リスクの増加などでは、追加薬として考慮すべきである。
これらのデータに基づき、我々は、すべての患者に対して、がんのリスクを減らすために以下の介入を行うことを提案する:
- 禁煙する。
- アルコールの使用を減らすか制限する。
- 体重を減らす:健康的な食事を取り入れ、インスリン抵抗性を管理し、時間制限のある食事計画に従う。
- 加工食品や加工植物油を避ける。(164)
- 甘い飲料や純粋なフルーツジュースを避ける。(165, 166)
- ビタミンD3:5000u/日、ビタミンD3レベルに応じて調整する(表3を参照)。
- オメガ3脂肪酸:2~4g/日。
- 緑茶カテキン:500~1000mg/日 (158, 167) 緑茶抽出物は空腹時ではなく、食中/食後に摂取する。 (168) 「緑茶」の項の注意事項を参照のこと。
- メラトニン:0.75~5mg(徐放性/徐放性)を夜間に服用する。(148, 169)
- メトホルミン:糖尿病、糖尿病前症、インスリン抵抗性、慢性ウイルス感染、喫煙、遺伝のいずれに起因するかにかかわらず、がんのリスクが高い場合はメトホルミンを考慮すべきである。医師の評価、承認、処方が必要である。(推奨用量は1日250~2000mgである)(13)
- 定期的な有酸素運動とレジスタンストレーニングを1日30分行う(ウォーキング、自宅での筋力トレーニングなど)。
- ストレスを軽減する(瞑想、ヨガ、マインドフルネス運動など)。(170-172)
- 少なくとも8時間の質の高い睡眠をとる(十分な睡眠衛生を確保する)。(172-175)
- 既知の発がん物質を避ける(12)
家族性大腸腺腫症(FAP)は、若くして大腸がんを発症する遺伝性疾患である。多くの患者は、致命的な癌発生のリスクを冒すよりも、20歳までに大腸全摘術を受けることを選択する。FAPのマウスモデルにおいて、メベンダゾールとスリンダク(NSAID)の併用はポリープの数を90%減少させた(176)。これらの前臨床所見は、FAP患者だけでなく他の高リスク癌患者に対する臨床試験の検討を支持するものである。ホスホジエステラーゼ-5阻害剤(例えば、シルデナフィル)の使用は、良性大腸新生物の男性における大腸癌のリスク低下と関連している(177)。BRACA1および2変異を有する女性患者は、乳癌発症の生涯リスクが約70%、卵巣癌発症のリスクが20~40%である(178)。これらの患者の管理は複雑であり、個々に対応する必要がある。予防的手術を選択した患者であっても、このモノグラフに示されたガイダンスを考慮すべきである。
第4章 がん治療への代謝的アプローチ
ミトコンドリア補充療法は、原理的には腫瘍細胞により正常なエネルギー代謝と分化状態を回復させる可能性があるが、この治療法が当面利用できる可能性は低い(28, 29)。(28,29)しかしながら、もしがんが主としてエネルギー代謝の疾患であるならば、がん管理の合理的なアプローチは、エネルギー代謝を特異的に標的とする療法に見出すことができる。
代謝補助治療の目標は、がん細胞の生存に重要なエネルギー経路を調節することによって「がん細胞を飢餓状態にする」ことであり、それによってがんの増殖とがん転移(がん患者の90%以上の死因)を抑えることである。従来の化学療法と並行して、代謝をターゲットにした薬剤カクテルを使用することで、素晴らしい結果が得られるという研究結果が発表され、がん治療へのアプローチが生まれている。代謝プロトコルは、主にがん細胞がエネルギーを取り込んで利用する(すなわち「代謝」する)能力を全体的に制限することによって機能するように設計されている。がん細胞のエネルギー基質を飢餓状態にすることで、代謝介入は化学療法や放射線療法に対するがん細胞の防御能力を低下させる可能性がある。代謝プロトコルはまた、がん細胞内の多くの調節不全シグナル伝達経路に作用し、アポトーシス、すなわち「プログラムされた細胞死」を可能にすることで、化学療法や放射線療法がより効果的にがん細胞を死滅させることを可能にするかもしれない。
がんの代謝治療において最も重要で中心的なアプローチは、食事によるカロリー(グルコース)制限である。これに加えて、特定のがん経路を標的とする薬理学的および栄養補助食品的化合物や、「正常な」抗がん免疫を回復させる介入が行われる。
単一の 「魔法の弾丸」は存在せず、複数の介入が相乗的かつ同時に作用してがん細胞死を促進することを強調することが重要である。このアプローチはケアオンコロジークリニックのものと類似しており、特許を取得したMetabolic Oncology COC Protocol™を使用している。このCOC Protocolは、従来の医薬品(メトホルミン、アトルバスタチン、メベンダゾール、ドキシサイクリン、非ステロイド性抗炎症薬)を組み合わせたもので、理論的には、がん細胞がエネルギーを取り込み使用する能力を全体的に制限するように作用する。(179) しかしながら、Jane McLellandの研究(4)と同様に、われわれは、グルコース制限とケトジェニックダイエットを組み合わせた、より広範で的を絞った薬理学的および栄養補助食品的化合物のリストを提案する。
がんに対する代謝的アプローチは、がん治療に対するより、「伝統的」なアプローチの補助的なものとして考慮されるべきである。代謝治療は、より伝統的なアプローチと相乗的に作用し、腫瘍の奏効率を高め、標準的な化学療法の毒性を抑制し、転移のリスクを抑え、全体的なQOLの改善につながる可能性が高い。この併用療法により、標準的な化学療法剤の投与量を減らし、毒性を劇的に軽減することが可能となる(メトロノミック投与、第12章参照)。
食事によるカロリー制限、ケトジェニックダイエット、および 「本物の」食品
多くの研究が、食事によるエネルギー制限は、循環グルコースレベルを自然に低下させ、乳がん、脳腫瘍、大腸がん、膵臓がん、肺がん、前立腺がんなど、多くの種類の腫瘍の増殖と進行を有意に抑制する一般的な代謝療法であることを示している(180-186)。印象的な証拠の数々は、腫瘍内に発現している特定の遺伝的欠陥に関係なく、食事によるエネルギー制限が多くの腫瘍の増殖速度を遅らせることを示している。(180-186)
オットー・ワールブルク博士によって実証されたように、ほとんど全ての癌細胞は好気性解糖を介した代謝燃料としてグルコースに依存しており(21, 22)、高血糖は腫瘍細胞増殖の強力な促進因子であり、生存率の低下と関連している(187)。カロリー制限を介した腫瘍形成抑制のメカニズムはまだ明確に特定されていないが、成長シグナルやサーチュイン経路の変化だけでなく、カロリー制限によって誘発されるエピジェネティックな変化が関与している可能性がある。(188)
インスリン抵抗性は、がんの発生と増殖に大きな役割を果たしている(189)。したがって、インスリン抵抗性を回復させることは、がん患者における大きな目標である。食事によるエネルギー制限は、IGF-1/PI3K/Akt/HIF-1αシグナル伝達経路を特異的に標的とする。このシグナル伝達経路は、細胞増殖、アポトーシスの回避、血管新生など、いくつかのがんの特徴の根底にある。IGF-1の産生は成長ホルモン(GH)によって刺激され、カロリー制限によって抑制されることから、カロリー制限の保護効果において中心的な役割を果たしている可能性が示唆される。この点に関して、GH受容体に変異を持つヒト(ラロン症候群として知られる)は血清IGF-1濃度が低く、がん発症のリスクが著しく低い。(188)グルコースの減少は、インスリンを減少させるだけでなく、腫瘍細胞の代謝と成長を促進するのに必要なIGF-1の循環レベルも低下させる。
食事によるエネルギー制限は、炎症と腫瘍血管新生に関与するシグナル伝達経路を標的とする。実際、カロリー制限は腫瘍の血管新生と炎症を標的とするシンプルで効果的な治療法と考えられている。カロリー制限は、解糖を制御する複数の遺伝子と代謝経路のダウンレギュレーションをもたらす。食事によるエネルギー制限は、循環グルコースレベルを低下させるだけでなく、脂肪酸とケトン体(β-ヒドロキシ酪酸とアセト酢酸)の循環レベルを上昇させる。脂肪、特にケトン体は、カロリー制限下では主要な代謝燃料としてグルコースに取って代わることができる。これは、飢餓の期間中にタンパク質を節約するために進化した、保存された生理学的適応である。しかし、多くの腫瘍では、ケトン体をエネルギーとして代謝するのに必要な遺伝子や酵素に異常がみられる。ケトン体の増加は、腫瘍増殖の主要な原動力である血中グルコースレベルと解糖を抑制できることがよく知られている。エネルギー源を炭水化物からケトン体へ移行させることは、正常細胞の代謝効率を高めつつ、解糖依存性腫瘍細胞のエネルギー代謝を標的とする簡単な方法である。ケトン体と脂肪酸をエネルギーとして代謝するには、ミトコンドリア内膜の完全性と効率的な呼吸が必要であるが、腫瘍細胞にはこれがほとんど欠けている。絶食条件下では、脳の主なエネルギー源として脂肪酸からケトン体が肝臓で産生される。ケトン体は細胞質で解糖経路をバイパスし、ミトコンドリアで直接アセチルCoAに代謝される。
ケトン体はヒストン脱アセチル化酵素を阻害することが示されており、腫瘍の成長を抑える可能性がある。さらに、ケトン体のβ-ヒドロキシ酪酸は内因性のヒストン脱アセチル化酵素阻害剤として作用し、酸化ストレスから保護する下流のシグナル伝達をもたらす(190-193)。血糖値を下げ、血中β-ヒドロキシ酪酸を上昇させるカロリー制限は、リン酸化NF-kB(p65)の核発現、リン酸化IkBの細胞質発現、総IkB発現、活性化NF- kBのDNAプロモーター結合活性を低下させる(194)。(194)NF-kBは腫瘍微小環境における炎症の主要な促進因子である。
Chiらによるランダム化比較試験では、カロリー制限食を6カ月間続けることで、前立腺癌の成長を遅らせるという治療効果が得られることが述べられている(195)。(195)対照群の男性には食事の変更を避けるよう指導したのに対し、カロリー制限群の男性には栄養士から食事の炭水化物を20g/日未満に制限するよう指導した。著者らは、3カ月後および6カ月後の血清ケトン体(3-ヒドロキシ-2-メチル酪酸)濃度の上昇が、前立腺がんの増殖速度の指標である前立腺がん抗原倍加時間の有意な延長(p<0.0001)と関連していることを発見した。
これらの所見は、ケトン体の上昇が腫瘍増殖の抑制に関連するという概念を支持するものである。
化学療法と放射線療法を終了した後のケトン食は、転移性非小細胞肺癌患者の長期生存と関連していることがさらに報告された。(196)ケトジェニック食による膠芽腫患者の 「長期」生存が報告されている。(196, 197)さらに、治療的ケトーシスが従来の化学療法薬、放射線照射、手術と相乗的に作用してがん管理を強化し、その結果、無増悪生存期間と全生存期間の両方を改善できることを示す証拠もある。(197)さらに、治療的ケトーシスは、本書で検討した再利用抗がん剤と相乗的に作用する可能性が高い。治療的ケトーシスには、血中グルコース<90mg/dl、血中ケトン体>2mmol/lが必要で、Glucose-Ketone Index<2を目指す(198)。カロリー制限のセクションのGlucose-Ketone Index Calculatorを参照のこと。カロリー制限ほど多くの腫瘍関連シグナル伝達経路を同時に標的とできる薬剤は知られていない。従って、エネルギー制限は、食事によるエネルギー制限よりも毒性が強く、費用がかかり、一般的に治療作用が集中的でない従来の化学療法や放射線療法の補助療法として費用対効果の高い療法となりうる。
Seyfried博士は言う: 「ヒトの転移性癌の多くはマクロファージの特徴を複数持っている。われわれは、マクロファージの特徴を持つ腫瘍細胞は、増殖のためにグルタミンに大きく依存していることを発見した。我々は、グルコースとグルタミンの長期間の制限下で非常に長く生存できる腫瘍細胞をまだ発見していない。さらに、成長代謝産物としてグルコースやグルタミンのいずれかに取って代わる脂肪酸やケトン体もまだ見つかっていない。従って、がん管理を成功させるためには、栄養ケトーシス状態に置きながら、グルコースとグルタミンを同時に制限することが不可欠となる。
食事によるエネルギー制限と抗糖化抗がん剤は、増殖の大部分を解糖とグルコースに依存する多くの腫瘍に対して治療効果を発揮するだろうが、これらの治療アプローチは、エネルギーとしてグルコースよりもグルタミンに大きく依存する腫瘍細胞に対しては効果が低い可能性がある。グルタミンは多くの腫瘍細胞、特に造血系や骨髄系の細胞にとって主要なエネルギー代謝産物である。緑茶ポリフェノール(EGCG)は、低グルコース条件下でグルタミン酸デヒドロゲナーゼ活性を阻害することにより、グルタミン代謝を標的とする(以下のセクションを参照)。(158,199-203)さらに、メベンダゾール、クルクミン、レスベラトロールはグルタミノリシスを阻害する。(13,204)膠芽腫、乳癌、膵臓癌、肺癌、前立腺癌、リンパ腫は、エネルギー源としてグルタミンを利用している可能性がある。(13)
リアルフード: バンティング食
患者には、加工食品ではなく「本物の食べ物」を食べることが強く勧められる。食べ物のように見えるなら、それは食べ物である可能性が高い。箱や紙パックに入っていて、食品表示があり、化学物質や添加物の長いリストがあり、複雑な名前がついていれば、それは食品ではない。加工食品中毒は「薬物使用障害」(SUD)として認められており、そのように扱われるべきである。
(205)動物実験では、砂糖と果糖はコカインやヘロインよりも中毒性が高く、炭水化物中毒者はSUD患者の行動の多くを示した。(205)
低炭水化物-高脂肪(LCHF)食パターンはがん患者にとって特に重要である。すでに述べたように、低炭水化物ケトン食は血糖値をコントロールするのに不可欠である。さらに、水溶性食物繊維と不溶性食物繊維の両方と発酵食品を多く含む実食は、マイクロバイオームを正常化するために重要である。マイクロバイオームの変化は、腫瘍形成と腫瘍増殖の両方に重要な役割を果たしている。腸内細菌叢の変化は化学療法薬に対する抵抗性と関連しているが、一方で正常な微生物叢を回復させると抗がん剤に対する反応が改善する。(206-209)抗生物質は重篤な腸内細菌叢異常を引き起こす;これは癌のリスク上昇と化学療法に対する反応性の低下と関連している。(210, 211)
バンティング・ダイエットは理想的なリアルフード・ダイエットの基準に近い。(212-214) ビクトリア朝の葬儀屋であったウィリアム・バンティング(1796-1878)は、低炭水化物食の父とみなされている。1863年、バンティングはLetter on Corpulence, Address to the Publicという小冊子を書いた。(212, 214) それは個人的な証言の形で公開書簡として書かれたものであった。バンティングは、過去に失敗した断食、ダイエット、スパ、運動療法をすべて説明した。これまで失敗した試みは、さまざまな医学専門家の助言によるものだった。そして彼は、別の医学専門家の助言に従って、ようやく効果があった食生活の変化について述べた。”私の親切で大切な医学顧問は肥満の医者ではなく、別の病気の治療で名声の頂点に立っている。彼の食事は肉、緑黄色野菜、果物、辛口のワインであった。砂糖、糖質、でんぷん、ビール、牛乳を避けることに重点を置いていた。バンティングのパンフレットはその後何年も人気を博し、現代のダイエットのモデルとして使われることになる。
バンティングの食事は主に動物性タンパク質(鶏肉、卵、魚を含む)、飽和動物性脂肪(ラード、アヒルの脂肪、バターを含む)、ココナッツオイル、オリーブオイル、マカダミアオイル、若干のチーズと乳製品、若干のナッツ類と種子類、主に地上で栽培された新鮮な野菜、そして若干のベリー類で構成されている。(213)バンティング・ダイエットでは、「ファーストフード」だけでなく、加工された「食品」、包装済みの「食品」、箱入りの「食品」もすべて排除する。砂糖、果糖、麦芽糖、穀物製品(小麦、大麦、オート麦、ライ麦)、大豆製品を含む食品はすべて除外する。(213)大豆製品は遺伝子組み換えの有害な非食品である。(213)すべての種子油(キャノーラ、ヒマワリ、ベニバナ、綿実油、大豆)を健康的な飽和脂肪に置き換える。高脂肪乳製品は推奨されるが、脱脂乳製品や無脂肪乳製品は推奨されない。
がん悪液質の管理
がん患者の高い割合が栄養障害であり、栄養不良のリスクがある(215)。がん関連悪液質は、骨格筋および脂肪組織の特異的な減少を伴う体重減少を特徴とする疾患である(216, 217)。これは、負のタンパク質およびエネルギーバランスによって特徴づけられる。がん悪液質は、食物摂取量の減少と、エネルギー消費量の増加、過剰な異化、炎症などの代謝の変化との様々な組み合わせによって引き起こされる。(216)がん悪液質は、体重減少が5%を超えるか、BMIが20未満で体重減少の程度が2%を超えるか、またはサルコペニアと一致する骨格筋指数(男性7~26kg/m²未満;女性5~45kg/m²未満)と定義される。 218)がん悪液質は、身体機能の低下、抗がん療法に対する耐容能の低下、および生存率の低下と関連している。(216, 217)がん性悪液質は進行がん患者によくみられる。
治療戦略は、共存する治療可能な因子に対処することである。がん悪液質の治療は、患者の状態やライフスタイルに応じて継続可能な方法を選択すべきである。運動プログラムを完了できる進行がん患者は、身体機能とQOLの改善を示す(がん治療のための生活習慣介入に関するセクションの運動[介入2]を参照のこと)。進行がん患者を対象としたRCTでは、栄養療法単独では体重、QOL、生存に対する一貫した有効性は実証されていない(219, 220)。それでもなお、栄養密度の高い1日3食の食事(バンティングダイエットに従う)を推奨する。間欠的絶食/時間制限食は避けるべきである(化学療法中を除く);しかしながら、患者は食間の間食を避けるべきであり、(睡眠中のオートファジーを促進するため)睡眠前3~4時間以内の食事は避けるべきである。
さらに、植物性タンパク質、スーパーグリーン、オメガ3脂肪酸、ビタミン、アダプトゲンハーブ、プロバイオティクス、食物繊維、キノコ類、ベリー類などのスーパーフードを含む完全栄養の「シェイク」を勧める(Ka’Chava™ www.kachava.com/や 310 Shakes™ …310nutrition.com/など)。通常のプロテインシェイクよりも、こうした「スー�経管栄養はQOLに悪影響を及ぼす可能性があるため、避けるべきである。
悪液質に対する薬理学的療法は、有効性に限界があり、悪液質患者の著しく減少した筋肉量を改善することは困難である。(217) グレリン受容体作動薬であるアナモレリンは、現在、限られた国でがん性悪液質の適応で使用可能な唯一の薬物である(221)。しかし、アナモレリンは腫瘍の増殖を促進するIGF-1を上昇させることが報告されている(222)。
間欠的絶食、オートファジー、およびがん
[より詳細な情報については、『FCCC Guide to Fasting and Healthy Eating』を参照されたい。]
断食は、免疫系の恒常性を促進し、ミトコンドリアの健康を改善し、幹細胞の産生を増加させる大きな効果がある。(223-227)断食は、損傷したミトコンドリア(マイトファジー)、誤った折り畳み方や異物となったタンパク質、損傷した細胞(オートファジー)の除去を促す。断続的な絶食/時間制限食は、オートファジーを活性化する唯一で最も効果的な方法である。しかし、がんにおける間欠的絶食とオートファジーの役割は複雑である(下記参照)。
2016年のノーベル生理学・医学賞は、1990年代にオートファジーの形態学的・分子的メカニズムを最初に解明した大隅良典氏に授与された。(228, 229) マクロオートファジー(本明細書ではオートファジーと呼ぶ)は、高分子の細胞内リサイクル、損傷した小器官やミスフォールディングしたタンパク質のクリアランスを行い、細胞の恒常性を確保するための保存されたリソソーム分解経路である。(230)オートファジーの機能不全は、癌を含む多くの疾患の一因となっている。しかし、オートファジーは腫瘍の発生段階や種類によって、腫瘍を抑制したり促進したりする。がん治療のためにオートファジーを調節することは、現在熱心に研究されている治療法である。
オートファジーの際、細胞質構成成分(損傷タンパク質、ミスフォールドタンパク質、外来タンパク質)はオートファゴソームと呼ばれる二重膜小胞に取り込まれ、その後リソソームと融合してオートリソソームを形成し、そこで荷物は分解または再利用される(図6参照)。オートファジーは、生理的条件下では基礎レベルで起こるが、低酸素、栄養欠乏、DNA損傷、細胞毒性物質などのストレス刺激に応答して、アップレギュレートされることもある(230)。オートファジー過程を仲介する分子機構は、高等真核生物において進化的に保存されており、特定の遺伝子(ATG遺伝子)によって制御されている。
間欠的絶食/時間制限食は、インスリン抵抗性、メタボリックシンドローム、II型糖尿病の治療に最も効果的な治療法である。断食は、健康寿命を延ばし、多くの慢性疾患の症状を緩和し、治癒させ、心血管疾患や癌を予防するという、さらなる利点がある(231)。(231)間欠的断食の代謝効果は数多くあり、インスリン感受性の向上、血糖値の低下、インスリンレベルの低下、インスリン様成長因子の低下、サーチュイン経路の活性化、オートファジーの活性化などが含まれる。間欠的絶食は、オートファジーを活性化する最も効果的な手段であり、その有益な効果の多くを占めている。オートファジーは癌の発生を予防する上で重要な役割を果たすと思われるが、逆説的に癌細胞の増殖を促進する可能性もある。いったん腫瘍が形成されると、オートファジーの主な機能は、低酸素、栄養や成長因子の欠乏、損傷刺激などの細胞ストレス因子に対処する手段を提供することであり、その結果、腫瘍の適応、増殖、生存、播種を可能にする。オートファジーは、高分子や欠陥のある小器官を分解することにより、代謝産物を供給し、ミトコンドリア機能をアップレギュレートし、常にストレスのかかる環境下でも腫瘍細胞の生存能力を支えている。がん細胞は、増殖のためにエネルギーと高分子の構成要素に対する代謝要求が高まっており、栄養を再利用するためにオートファジーのレベルが上昇している。(232)しかしながら、逆説的ではあるが、過剰なオートファジーはがん細胞の死につながる可能性がある。(233)ここに挙げた再利用薬(ビタミンD、ホスホジエステラーゼ阻害薬など)の多くは、オートファジー経路を活性化することによって腫瘍細胞死を促進することが証明されている。
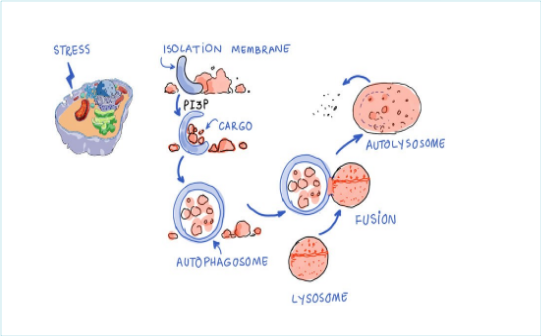
図6 オートファジー経路(出典:Mobeen Syed博士)
齧歯類の研究は限られており、ヒトを対象とした研究では、間欠的絶食が癌の進行を調節する独立した効果を評価したものはない。高脂肪駆動閉経後乳癌モデルマウスの研究では、間欠的絶食は、カロリー制限や体重減少のない自由摂取マウスと比較して、腫瘍の発生、進行、転移を顕著に抑制した(234)。(234)この間欠給餌の有益な効果は、おそらく少なくとも部分的には、インスリンシグナルの減少によって媒介された。(234)その他の動物モデルでも、間欠的絶食が癌の進行に有効であることが証明されている(235-237)。
最近の試験管内試験および生体内試験モデルでは、グリオーマ、神経芽腫、黒色腫、線維肉腫および乳癌、結腸癌、膵臓癌、肝細胞癌および肺癌のモデルにおいて、絶食がシスプラチン、ドキソルビシン、シクロホスファミド、オキサリプラチン、ソラフェニブ、ミトキサントロン、ゲムシタビン、エトポシド、テモゾロミドおよびチロシンキナーゼ阻害剤に対する化学療法反応を改善することが示された。(230)
興味深いことに、絶食と細胞傷害性薬剤の併用は、正常細胞と癌細胞で差のある反応を引き起こし、これは差次的ストレス抵抗性(DSR)として知られる現象である。DSRでは、正常細胞は栄養が欠乏すると維持経路を優先し、成長因子シグナル伝達を不活性化する。一方、がん細胞はがん遺伝子の活性化により、ストレス抵抗性経路を抑制しないため、細胞毒性治療に弱くなる。間欠的絶食と抗がん剤の併用は有望な結果であるが、その分子メカニズムは完全には明らかになっていない。結腸癌モデルにおいて、間欠的絶食はマウスの体重を永久に減少させることなく腫瘍の増殖を抑制し、腫瘍関連マクロファージのM2分極を減少させた(238)。(238)乳がん、黒色腫、神経芽細胞腫の動物モデルにおいて、間欠的絶食サイクルを化学療法と併用すると、腫瘍増殖が抑制され、全生存期間が延長した。(239)
オートファジーはがん細胞の細胞保存経路であり、がん細胞に必要な代謝基質を提供するものである可能性がある。実際、オートファジーを阻害する薬剤は腫瘍細胞の増殖を抑える可能性がある。(240-244)間欠的絶食は、腫瘍細胞の増殖を制御する可能性のある多くの代謝効果を持つが、腫瘍細胞においてオートファジーを活性化するという事実は問題かもしれない。その結果、断食とオートファジーの亢進の役割は、確立したがん患者においては複雑である。動物モデルでは、いくつかの腫瘍モデルにおいて間欠的絶食の有益性が証明されているが、ヒトにおける臨床データは不足している。しかし、ヒトでは、オートファジーが活性化するのは絶食後約12〜16時間後であることから、絶食が12時間を超えない限定的な形態の間欠的絶食(時間制限食)が適切な妥協点であると考えられる。すなわち、i)化学療法や放射線療法を受けている患者、ii)肥満、メタボリックシンドローム、2型糖尿病のインスリン抵抗性患者である。インスリン抵抗性の患者は、インスリンの循環レベルが高い。インスリンは腫瘍の強力な増殖因子であり、インスリンレベルを下げることはオートファジーへの影響を相殺する可能性がある。時間制限摂食(間欠的絶食)は理論的にはがん細胞の増殖を促進する可能性があるが、この概念はがん患者では観察されていない。さらに、24〜96時間という長時間の絶食は、がん患者において忍容性が高く、QOLと疾患症状を改善するようである(12)。このデータは、間欠的絶食へのアプローチは、がん患者において各患者の反応に応じて個別化されるべきであることを示唆している。
がんに対するインスリン増強療法?
In vitroの研究では、インスリンが化学療法薬の効果を増強する可能性が示唆されている(245)。
しかし、この概念を支持する臨床研究はない。さらに、このような治療は危険であり(重篤な低血糖を引き起こす)、腫瘍細胞の増殖を促進する可能性があるため、逆に危険である。インスリンは、がん細胞における細胞内グルコース取り込みと分裂促進シグナル伝達カスケードを担っており、細胞増殖、生存、浸潤、血管新生、免疫調節、化学療法抵抗性を促進する可能性がある(本書で概説)。(246)腫瘍細胞は、正常な効果と比較して、細胞表面に有意に多くのインスリン受容体を発現している。(12)インスリンはさらに解糖を促進し、がん細胞に代謝燃料を供給する!それではなぜ、インスリンとブドウ糖の使用はがん患者の転帰を改善し、がん治療の脱スケーリングを促進すると主張する医療者がいるのだろうか?(74, 247)
癌患者に対するインスリン増強療法(IPT)および低用量化学療法併用療法(IPTLD)の支持者は、インスリン受容体が癌細胞に多く発現しているため、周囲の健常組織に対する癌細胞の化学療法薬に対する伝染性がインスリンによって高まると主張している(246)。他の支持者は、抗がん剤はグルコースと同じメカニズムで細胞に入り込むとし、グルコース輸送と多剤取り込み輸送を混同している。
インスリン増強療法を評価した臨床試験は2つしか発表されていない。Damyanovらは16人の去勢抵抗性前立腺癌患者を登録し、インスリン(0.4U/kg)とドセタキセルまたは非標準的薬剤の併用療法を行った(246)。インスリンと化学療法を受けた患者の転帰は不良であった(生存期間中央値11カ月、18.9カ月)。2番目の前向き研究では、転移性乳癌患者30人を対象にメトトレキサートの反応性と毒性を検討した。(248)メトトレキサート単独投与群に比べ、メトトレキサート+インスリン投与群では病勢が安定する頻度が高いと報告されたが、患者中心の転帰は示されていない。
インスリン治療と細胞内糖濃度の上昇は、腫瘍の進行と化学療法抵抗性の両方を促進するという科学的証拠があるため、インスリン増強療法を推奨することはできない。(246)
第5章 がん治療のための代謝および生活習慣への介入
1. 糖質管理とケトジェニックダイエット
飽和脂肪酸とオメガ3脂肪酸を多く含む糖質制限食(炭水化物1日当たり25g未満)が推奨される(ケトジェニック食)。すべての加工食品を避ける(より詳細な指針はFCCC Guide to Fasting and Healthy Eatingを参照)(164) 現在のドグマに反して、飽和脂肪酸は「健康的」であるが、加工されたオメガ6系植物油は避けるべきである(下記参照)(249, 250) 血糖指数の高い食品は避け、血糖曲線を平坦にする「ハック」に従う(下記参照)(251)
血糖値の変化を追跡するには、持続血糖モニター(CGM)が不可欠である。患者は、血糖値を急上昇させる可能性のある食物を特定(および回避)するために、正確な記録をつけなければならない。ベースライン血糖値は50~80mg/dl(2.7~4.4mmol/l)、食後血糖値は120mg/dl(6.6mmol/l)未満を目標とする。理想的な血糖曲線は平坦で、食後に血糖が20mg/dl以上上昇しないことである。さらに、患者がケトーシスに入ったことを確認するために、血中ケトン測定器(β-ヒドロキシ酪酸の血中濃度)を使用することが推奨される(正常値<0.5mmol/l)。血中ケトン濃度は2mmol/l以上が理想的である。最適な治療範囲は3~5mmol/lである。空腹時と運動時の血糖値とケトン体の変化を追跡することが重要である。治療的ケトーシスには、血中グルコース<90mg/dl、血中ケトン体>2mmol/lが必要で、グルコース・ケトン指数(GKI)<2を目指す(198)。
GKIは keto-mojo.com/glucose-ketone-index-gki/
perfectketo.com/glucose-ketone-index-calculator/
グリセミック指数
グリセミック指数は、食品が血糖値の上昇を引き起こす速度と急上昇の度合いに基づいて食品に割り当てられる値である。グリセミック指数は食品を0から100の間でランク付けする。純粋なブドウ糖には任意に100という値が与えられ、これは2時間後の血糖値の相対的な上昇を表している(図7参照)。特定の食品のグリセミック指数は、主にそれが含む炭水化物の量と種類によって決まる(表2参照)。グリセミック指数(GI値)が低い食品は、グルコースをゆっくりと安定的に放出する傾向がある。グリセミック指数が高い食品はグルコースを急速に放出する。グリセミック指数は個人差があることに注意すべきである。(252, 253) CGMを使用すると、さまざまな食品のグルコース上昇(グリセミック指数)を個別に評価することができる。
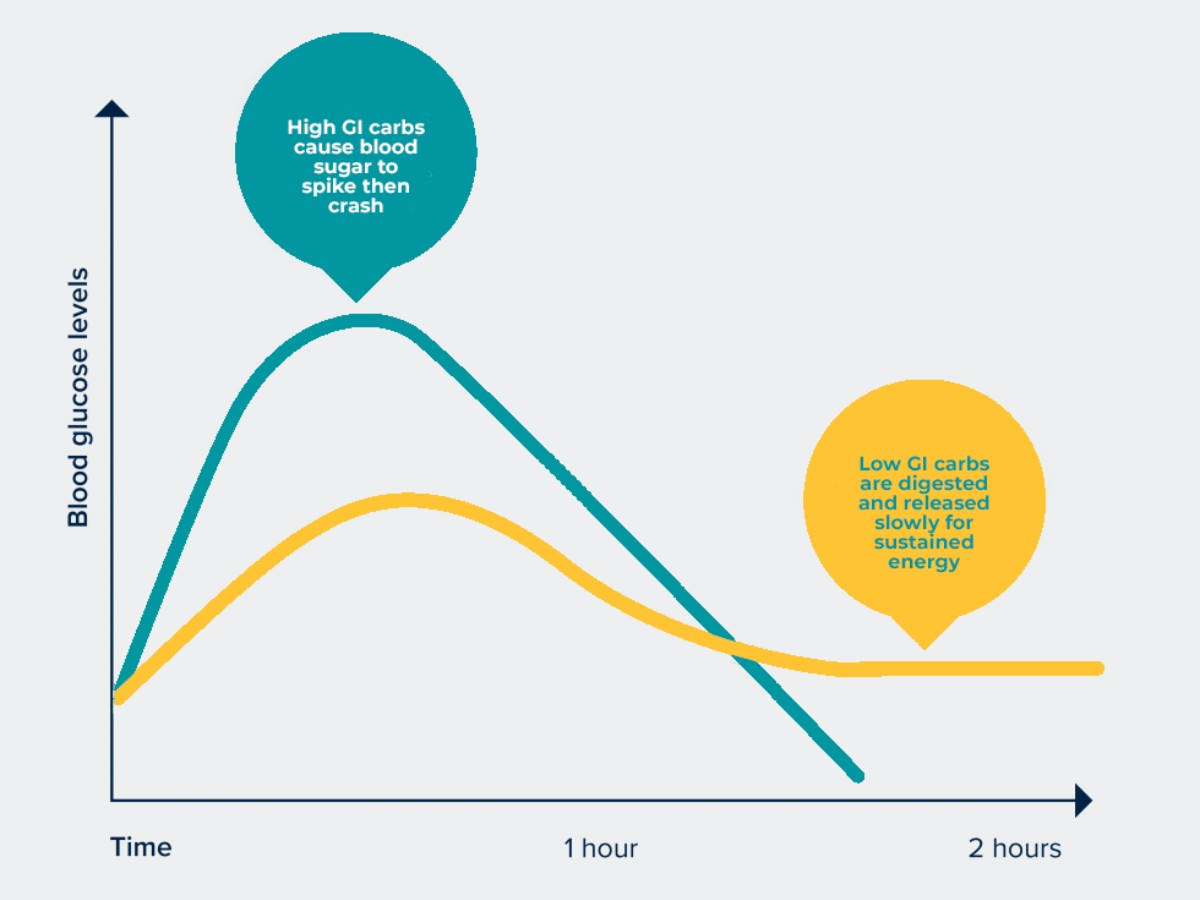
図7:グリセミック指数の高い食品と低い食品の血糖プロファイル(出典:Glycemic Index Foundationより引用)
何を食べ、何を食べないか
肥満、メタボリックシンドローム、Ⅱ型糖尿病、がん、心疾患、神経変性疾患、自己免疫疾患などを減らすための最も重要な介入は、加工食品ではなく本物の食品を食べることである(164, 205, 254)。見た目が食品であれば、それは本物である。箱に入っていたり、食品ラベルが貼ってあれば、加工食品である可能性が高い。製品のラベルに記載されている原材料の数が多ければ多いほど、また、奇妙で発音しにくい名前の化学物質が多ければ多いほど、その製品はより加工されていることになる。最近のエビデンスによると、加工食品はそれ自体がインスリン抵抗性を引き起こす可能性があるという。(255)
健康的な食品には次のようなものがある:
- 野菜全般(特にアボカド、アブラナ科の野菜と葉野菜)
- ナッツ類(アーモンド、ブラジルナッツ、カシューナッツ、ピスタチオ)
- ピーナッツバター(ただし、白パンとブドウゼリーは避ける!)、チアシード
- 魚(天然の新鮮な魚、特にアラスカ産/太平洋産のサーモンとイワシ)
- 鶏胸肉(放し飼い、ホルモン剤、抗生物質不使用)
- 卵(卵の評判が悪い!放し飼いの「オーガニック」卵を推奨する
- 肉(牧草飼育、ホルモン剤不使用、加工肉は避ける)
- ブルーベリー(インスリン抵抗性がある場合は量を制限する)
- 砂糖や人工甘味料よりステビア(エリスリトールなし)を選ぶ。
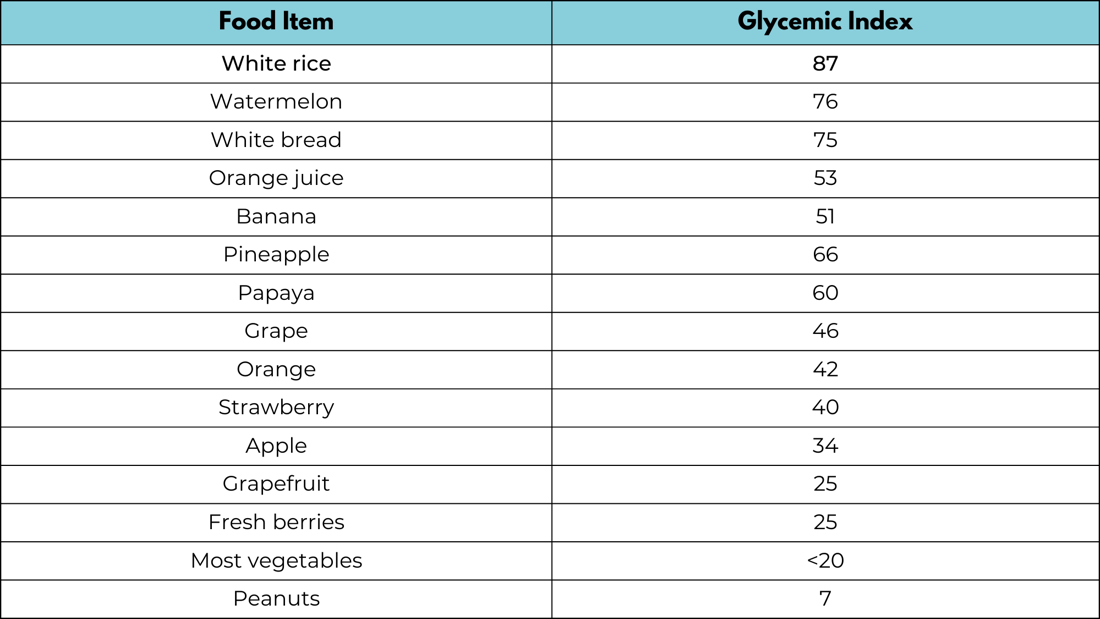
表2:特定の食品のグリセミック指数(出典:FLCCC)
グルコース曲線を平坦にする
糖質制限/ケトジェニック・ダイエットや時間制限食とは別に、いくつかの簡単な介入法(ハック法)は、がんの燃料となる高グルコース・スパイクを防ぐ。ジェシー・インチャウスペ著『グルコース革命』は非常にお勧め、血糖曲線を平坦にするための介入方法について、以下のような詳細が記載されている(251) 。

食品を正しい順番で食べる
野菜(緑黄色野菜/食物繊維)を最初に食べ、タンパク質と脂肪を次に食べ、デンプン(糖質)を最後に食べる。これにより、胃の排出が遅くなり、ブドウ糖の分解と吸収も遅くなる。果物は最後に食べ、必ず食物繊維を先に食べる。食事の最初にパン(でんぷん)を食べない。
- すべての食事はサラダか緑黄色野菜から始める。サラダのドレッシングにはオリーブオイルと酢を使う。
- 食物繊維のないでんぷん質の食品は避ける。
- フルーツジュースやスムージーは、グルコースを大きく上昇させるので避ける。
- 朝食を抜く。朝食は砂糖やでんぷん質を食べるのに最も悪い時間帯である。朝食にシリアルを食べると、グルコースが急激に上昇する。
- 一日を通して間食を避ける
- でんぷんや甘いものを食べる前に、大さじ1杯の酢を背の高いコップ1杯の水に混ぜて飲む。リンゴ酢がおすすめだ。酢に含まれる酢酸は、デンプンの酵素分解を減少させ、グリコーゲン合成(およびグルコース取り込み)を増加させ、脂肪酸酸化を増加させる。(256-259)酢は、デンプン食の20分後までに摂取しても効果がある。リンゴ酢は通常殺菌されていないので、妊娠中は避けるべきである。
- 酢がすぐに手に入らない場合は、でんぷん質のものや甘いものを食べる前に、食物繊維の錠剤(特にグルコマンナンの錠剤)を数錠摂取する。
- でんぷん質の食品を食べてから1時間以内に、20分程度のウォーキングをする。運動中、筋肉はミトコンドリアの酸化能力を高めながら、エネルギーとしてグルコースを取り込む。(260-262)ジムに通ったり、レジスタンス運動をするのも一つの方法である。職場で階段を数段上るのも選択肢の一つである。座りっぱなしの場合は、シッティングカーフレイズ(ヒラメ筋ポンプ)を行う。食後グルコースを約50%減少させ、高インスリン血症を抑制し、脂質代謝を改善することが証明されている。(263)食事をしていない状態で運動をすると、つまり絶食状態で運動をすると、肝臓は筋肉のミトコンドリアに燃料を供給するために血液中にグルコースを放出する。これは、コルチゾール、エピネフリン、ノルエピネフリン(グルカゴンは減少している)の放出の増加、すなわち有害なストレスホルモンの放出によって媒介される。食前に運動する場合は、通常のプロテインシェイクの代わりに、植物性タンパク質、スーパーグリーン、オメガ3脂肪酸、ビタミン、適応ハーブ、プロバイオティクス、食物繊維、スーパーマッシュルーム、ベリー類などの「スーパーフード」を含むシェイク(例:Ka’Chava™ www.kachava.com/、310 Shakes™ 310nutrition.com/collections/mealreplacement-shakes)をお勧めする。
「正常な」マイクロバイオームを確立する/回復させる
マイクロバイオームは血糖値とインスリン感受性に顕著な影響を及ぼす。(264-270)正常なマイクロバイオームを確立することは、血糖値を調整し、インスリン感受性を改善するために重要である。さらに、マイクロバイオームの変化は、腫瘍形成と腫瘍増殖の両方に重要な役割を果たしている。正常なマイクロバイオーム」を確立するために、以下の提案を実践しよう:
- 多様な食品を食べる
- 野菜、豆類、豆をたくさん食べる。
- ヨーグルト(無糖)、ケフィア、リンゴ酢、コンブチャ、ピクルス、ザワークラウト、テンペ、キムチなどの発酵食品を食べる。
- ポリフェノールが豊富な食品(色の濃い果物)を食べる。レスベラトロールのサプリメントを摂る。
- プレバイオティクス食物繊維を摂る。グルコマンナンはこんにゃくの根から作られる食物繊維(水溶性と不溶性)である。
- 不溶性と水溶性の食物繊維を多く含むチアシードを食べる。
- 砂糖や甘味料を控える。
- ストレスを減らす。
- 不必要な抗生物質の服用を避ける。
- 間食をやめる。
- 定期的に運動する。
- 屋外の自然界で過ごし、何百万もの微生物(その多くはマイクロバイオームの多様性に有益である)に触れる。
- 十分な睡眠をとる。
飽和脂肪とコレステロールのデマ
コレステロール-飽和脂肪酸デマ(249, 271, 272)は1960年代に広まり始めた。
アンセル・キーズ博士は、飽和脂肪酸と高コレステロールが動脈硬化性心疾患の主な原因であるという考え方、いわゆる食事-心臓仮説を広めた(273, 274)。この考え方は、多くのランダム化比較試験を含めて精力的に研究され、説得力を持って誤りであることが証明された(249, 275, 274)。(249, 275, 276)実際、飽和脂肪酸を植物油(リノール酸)の多い食事に置き換えると、死亡率、心血管疾患、冠動脈性心疾患の割合が高くなり、癌のリスクも有意に増加した(277)。
健康に良い油と悪い油
リノール酸を多く含む種子油は避ける。リノール酸はオメガ6脂肪酸の一種で、私たちの体に必要な量はわずかである。残念なことに、種子油を使った食品を過剰に摂取しているために、多くの人が望ましいリノール酸量の10倍ものリノール酸を摂取している。リノール酸の摂り過ぎは、炎症、肥満、心臓病、その他の好ましくない状態に関連している。したがって、避けるべき:
- 大豆油
- トウモロコシ油
- 綿実油
- ひまわり油
- ゴマ油
- グレープシードオイル
- サフラワー油
- 米ぬか油
- マーガリン
代わりに、以下のようなヘルシーな油脂を選ぶこと。高品質のものだけを使い、製造年月日と賞味期限を確認すること。
- オリーブオイル(オレイン酸、オメガ9系一不飽和脂肪酸)。オリーブオイルは煙が出るほど加熱しないこと。
- アボカドオイル(オレイン酸、オメガ9系一不飽和脂肪酸)
- ココナッツオイル(中鎖脂肪酸)
- 亜麻仁油(α-リノレン酸、ALAオメガ3)
- クルミとピーカンのオイル;腐敗を防ぐため冷蔵保存が必要である。
- バター(飽和脂肪酸)
2. 運動(有酸素運動とレジスタンストレーニング)
運動、健康的な食事、ストレス軽減に重点を置いた生活習慣の改善は、がんによる死亡リスクの低下と生活の質の改善に大きな役割を果たす。(278, 279)すでに述べたように、肥満とメタボリックシンドロームはがん患者の死亡リスクを高める。早期乳癌を対象とした研究では、メタボリックシンドロームの患者は、そうでない患者に比べて遠隔転移のリスクが有意に高かった(HR 2.45,95%CI 1.24-4.82)。(280)
がん治療中の患者には、有酸素運動とレジスタンストレーニングの両方を組み合わせた定期的な運動が推奨される。ウォーキング、高強度インターバルトレーニング(HIIT)、サイクリング、水泳などの有酸素運動は、全般的な心血管系体力を向上させ、疲労の軽減、不安や抑うつの減少による認知や気分の改善など、QOLの指標を改善する。(281-286)レジスタンストレーニングは除脂肪体重(筋肉量)を維持し、インスリン抵抗性を低下させ、グルコースコントロールを改善し、サルコペニアはがん患者における主要な予後不良因子であるため、全生存期間を延長させる重要な因子となりうる。(287)
CARE(Combined Aerobic and Resistance Exercise:有酸素運動とレジスタンス運動の併用)試験では、乳がん化学療法中に実施する運動の種類と量を比較した。(288) この研究では、有酸素運動とレジスタンス運動を50~60分間組み合わせて週3回実施した場合、有酸素運動のみを実施した場合と比較して、患者報告アウトカムおよび健康関連の改善が有意にみられた。特定のがん種に焦点を当てたメタアナリシスでは、補助化学療法および/または放射線療法を受けた乳がん、化学療法を受けた大腸がん、化学療法を受けた肺がん、放射線療法を受けた前立腺がん、および血液悪性腫瘍での有益性が報告されている。(281) 22件のプロスペクティブコホート研究のメタアナリシスでは、乳がん診断後にレクリエーション的身体活動に参加していると報告した女性では、乳がん死亡率が有意に低下していた(HR 0.59,95%CI 0.45-0.78)。(289)
患者には、主要筋群のエクササイズを含む週2~3回の筋力トレーニングセッションとともに、少なくとも週5日、少なくとも30分の中強度の身体活動、または75分の強度の運動を行うよう奨励すべきである。(278,286)しかし、より多くの運動時間(より活発な運動は含まない)を行うことで、有益性が増す可能性がある。2つの解析で、身体活動に従事する週当たりの時間と乳がん死亡率との間に実質的な逆量反応効果が示された。(290, 291)ウォーキング、特に日光の下でのウォーキングは、身体的、感情的、心理的に非常に有益である。(292, 293)
3. ストレス軽減と睡眠
ストレスに関連する心理社会的因子とがんの転帰との関連については、多くの研究がなされている。(294) このデータは、がんと診断された患者において、心理社会的ストレスががんの高い発生率および生存率の低下と関連していることを示している。(294) 患者がストレスを軽減する活動(瞑想、ヨガ、マインドフルネス運動など)に取り組み、少なくとも8時間の質の高い睡眠をとる(十分な睡眠衛生を確保する)ことが決定的に重要である。(170-175, 295)
アダプトゲンとはストレスに対抗するためのハーブである。これらのハーブは生理的プロセスを正常化し、身体がストレスに適応するのを助ける。アーユルヴェーダ医学(インド原産の伝統医学)では、アシュワガンダが安全で効果的なアダプトゲンであることが証明されている。ランダム化比較試験では、ストレスの軽減、認知や気分の改善、睡眠の質という点で有意な効果が示されている。(296-298)二重盲検プラセボ対照無作為化比較試験では、慢性的なストレスを抱える参加者をアシュワガンダ抽出物(300mgを1日2回)とプラセボに無作為に割り付け、60日間投与した。(299)60日後、積極的治療群の参加者は、ストレススコアが44%(p< 0.001)減少し、コルチゾールレベルが28%(p< 0.001)減少した。同様の研究で、アシュワガンダは不眠症患者の睡眠の質を著しく改善した。(300) 12のRCTのメタアナリシスでは、アシュワガンダのサプリメントは、プラセボと比較して、不安(p=0.005)とストレスレベル(p=0.005)を有意に減少させることが示された。(301)この研究では、非線形の用量反応分析により、アシュワガンダのサプリメントは、不安に対しては1日12,000mgまで、ストレスに対しては1日300~600mgまで好ましい効果があることが示された。
アシュワガンダは免疫系活性化剤(NF-κBを阻害)であるため、タクロリムスやシクロスポリンなどの免疫抑制剤との併用は避けるべきである。
さらに、妊娠中や授乳中の女性におけるアシュワガンダの安全性は確立されていない。
健康的な睡眠は、神経の発達、学習、記憶、心血管、代謝の調節に不可欠である。十分な睡眠は、先行する覚醒活動の後の回復と、その後の覚醒時の最適な機能を確保するために必要である。(302) National Sleep Foundationが推奨しているように、健康な人の場合、若年成人の推奨睡眠時間は7~9時間、高齢者は7~8時間である。(303)十分な睡眠時間以外に、健康的な睡眠は質の良い睡眠からなる。
全米睡眠財団は、以下の睡眠の質の指標を推奨している: 1)睡眠潜時が15分以下、2)一晩に5分以上の覚醒が1回以下、3)入眠後の覚醒時間が20分以下、4)睡眠効率が85%以上である。(304)不眠症は、入眠困難、睡眠維持困難、早朝覚醒の訴えによって定義され、疲労、認知障害、気分障害(うつ病)などの1つ以上の日中症状を伴う。(305) ある系統的レビューでは、24時間あたりの睡眠時間が6時間未満と定義される短時間睡眠は、死亡率の有意な上昇と関連することが示された。(306)
5つのRCTのメタアナリシスにより、アシュワガンダのサプリメントは、特に不眠症と診断された成人のサブグループにおいて、睡眠を有意に改善することが示された。(305)アシュワガンダは、睡眠の質尺度、入眠潜時、総睡眠時間、入眠後の覚醒時間、睡眠効率において、プラセボと比較して睡眠の改善を示した。
第6章 :再利用薬
驚くべきことに、ほとんどが単一の細胞生物学的経路を介して作用する従来の化学療法薬とは異なり、がんの補助的治療薬として使用される再利用薬/栄養補助食品はほとんどすべて、複数の作用機序を持っている。これらの作用機序は、一般に大きく2つのグループに分けられる:
i.がん細胞の経路に直接作用して細胞死(アポトーシス)を促進するもの、ii.腫瘍微小環境(TME)を変化させ、免疫機能とT細胞の細胞毒性を回復させ、血管新生と転移を抑制し、がん幹細胞を阻害するものである。
がんの発症リスクを低下させることが実証された栄養補助食品や再利用された医薬品は、がん治療に非常に有効であると考えられる。がん予防に関与する代謝経路は、がんの増殖や転移を抑える上で大きな役割を果たしていると考えられる。従って、がん予防における再利用薬の有効性を評価することは、がん治療におけるその薬の役割を考える上で重要である。
栄養補助食品や再利用薬の有用性を示す発表された研究のほとんどは、試験管内試験でのメカニズム実験や動物モデルで行われた研究である。プロスペクティブな研究は一般的に小規模で、作用機序や有効性の代用マーカーに焦点を当てたものである。実際、発表されている臨床データのほとんどは、疫学研究、小規模な症例シリーズ、症例報告で構成されており、前向き臨床研究はほとんどない。これは、大手製薬会社とその支持者が繰り広げている。「再利用薬戦争」のためであり、予想されたことではない。安価で、潜在的に有効で、人命を救う可能性のある薬剤を用いた、十分にデザインされた臨床研究を支援する資金はほとんどない。
2014年のProPublicaの調査によると、「大手製薬会社がブロックバスターの抗がん剤に注力するあまり、より安価な潜在的治療法の研究が絞り込まれている」(307)。(307)乳がんに対するアスピリンの効果に関する研究の資金を見つけようと長年努力してきたハーバード大学医学部の研究者は、記者にこう語っている。「特許が取れるような薬であれば、なぜか無作為化試験が行われるのに、驚くべき特性を持つアスピリンは、CVSで99セントだからという理由で、未解明のままなのです」(307)
製薬会社が資金を提供する大規模な無作為化二重盲検比較試験(RCT)は、医学界の権威や象牙の塔にいる人々からゴールドスタンダードとみなされているが、多くの限界があり、実際の臨床を反映していないことが多い。さらに、よく実施された観察研究では、従来のRCTと統計的に類似した結果が得られるという強力な科学的データがあり、コンセンサスも高まっている(308)。したがって、がんに対する代謝的アプローチ、特に複数の再利用薬の併用による臨床的有効性を研究するために、前向き観察研究を計画することは可能であり、実際に望ましいことである。がんに対する代謝的アプローチでは、カロリー削減やケトジェニックダイエットなどの介入と複数の適応外抗がん剤の併用が必要であるため、二重盲検ランダム化試験をデザインすることはほぼ不可能であり、実際、そのようなアプローチは非倫理的であると考えられる。
METRICS試験(NCT02201381)は、膠芽腫患者の治療に対する適応外薬物プロトコルの一例である(179)。(179)METRICS試験は、膠芽腫およびその他の腫瘍に対する補助的がん治療として、4つの適応外代謝標的薬(メトホルミン、アトルバスタチン、メベンダゾール、ドキシサイクリン)を併用した場合の安全性、忍容性、および有効性に関する質の高いエビデンスを収集するためにデザインされた、参加者が資金を提供する新規の非盲検非ランダム化単一群実臨床試験である。(179)METRICS試験のレトロスペクティブ群では、対照群と比較して患者の無病生存期間が有意に延長するという、非常に有望な結果が得られている。
The Repurposing Drugs in Oncology (ReDO)プロジェクトでは、抗がん作用を持つ268の承認薬がカタログ化されている(5)。再利用された医薬品、栄養補助食品、植物薬品の略歴は付録2を参照のこと。この単行本でReDoのデータベースにある全ての薬剤をレビューすることは不可能である。これらのリパーポーズされた薬剤は、裏付けとなる臨床的およびメカニズム的エビデンスの強さに従って優先順位が付けられている(層別化の方法について概説した付録1を参照)。
がん患者は、少なくとも最初にリストアップされた10種類の治療法の服用を考慮すべきである。さらに、これらの介入の多くは互いに、また従来の化学療法と相加的/相乗的に作用することを認識することが重要である。メトロノミック化学療法が望ましい(下記参照)。患者は3カ月ごとにPETスキャン(グルコース取り込みスキャン)で治療に対する反応を観察し、寛解/がんが安定した後は少なくとも6カ月ごとに観察すべきである。患者は腫瘍マーカーを同時に追跡する必要がある。循環腫瘍DNA(血液検体中)は、腫瘍進行のモニタリングに有用であることが証明されつつある技術である。(309, 310)患者および医療従事者は、腫瘍マーカーを動的に追跡し、それに応じて治療プロトコルを調整すべきである。
良好な臨床効果を示した患者は、治療プロトコルを突然中止すべきではない。これは再発を引き起こす可能性があるからであり(4)、むしろ介入回数を動的に減らすべきである。
原則として、化学療法や放射線療法を受けている患者には抗酸化剤(ビタミンA、C、E、コエンザイムQ10、N-アセチルシステイン)の投与は避けるべきである。(311,312)逆説的なことに、ビタミンCの経口投与は強力な抗酸化剤であるが(313) 、ビタミンCの大量静注は活性酸素種を生成し、化学療法や放射線療法の効果を増強する(ビタミンC静注の項を参照)。
癌を制御するための再利用薬の概要
エビデンスの質に基づいて層別化し、優先度の高い順に列挙した(付録1参照)。以下で詳細に検討する。
第1段階 再利用薬 強く推奨
- 4. ビタミンD3:1日20,000~50,000IU – 注:血中ビタミンD濃度に応じて投与量を調節し、少なくとも55~90ng/dlの25-OH濃度を目指す。
- 5. メラトニン:1mgから開始し、夜間に20~30mgまで増量する(徐放性/徐放性)。
- 6. 緑茶カテキン:1日500~1,000mgを摂取する。
- 7. メトホルミン:1,000mgを1日2回服用する。
- 8. クルクミン(ナノクルクミン): 1日600mg、またはメーカーの推奨用量に従う。
- 9. メベンダゾール: 1日100~200mg
- 10. オメガ3脂肪酸:1日2~4g
- 11. ベルベリン: 1日量1,000~1,500mgまたは500~600mgを1日2~3回服用する。(血糖値によっては、メトホルミンとベルベリンを併用したり、月ごとに交互に使用することもある)。
- 12. アトルバスタチン:40mgを1日2回。(シンバスタチン20mgを1日2回投与する方法もある)。
- 13. ジスルフィラム: 80mgを1日3回または500mgを1日1回投与する。
- 14. シメチジン:400~800mgを1日2回投与する。
- 15. ヤドリギ:(統合腫瘍専門医により皮下投与される)
- 16. シルデナフィル:1日20mg。(タダラフィル5mg1日1回投与も可能である)
第2段階 再利用薬: 推奨度は低い
- 17. 低用量ナルトレキソン:1~4.5mg/日
- 18. ドキシサイクリン:1日100mg(2週間サイクル-控えめに使用する)。
- 19. ウィートグラス
第3段階 再利用薬: 曖昧なエビデンス(賛成も反対も強くない)
- 20. レスベラトロール:1日1,000mg(生物学的利用能を高めた製剤)。
- 21. シクロオキシゲナーゼ阻害薬:アスピリン325mg/日またはジクロフェナク75~100mg/日
- 22. ニゲラサティバ:カプセル化したオイル400~500mgを1日2回摂取する。
- 23. 霊芝(Ganoderma lucidum)およびその他の薬用キノコ類
- 24. イベルメクチン:12~60mgを週2回服用する。
- 25. ジピリダモール: 100mgを1日2回服用する。
- 26. 高用量ビタミンC点滴静注(プロトコルに従って50~75gを点滴静注する)
- 27. ジクロロアセテート500mgを1日2~3回投与する。
- 28. カンナビノイド
- 29. フェノフィブラート
- 30. パオペレイラ
第4段階 再利用薬:推奨されない
- 31. レトリル(アミグダリン)
- 32. サメ軟骨
第7章 :第一段階 リパーポーズド医薬品 – 強く推奨
4. ビタミンD
ビタミンDは、紫外線B(波長280-315nm)の影響下で7-デヒドロコレステロールが光異性化し、プレビタミンD3となった後、ヒトの皮膚で合成される。(314)このプロセスに影響を与える主な要因は、環境的要因(緯度、季節、時間帯、オゾンや雲、地表の反射率)または個人的要因(肌タイプ、年齢、衣服、日焼け止めの使用、遺伝)である。(315)親ビタミンD3(コレカルシフェロール)は皮膚から全身循環に入り、肝臓で25-ヒドロキシビタミンD3 [25(OH)D3] (カルシフェジオール)に代謝される。25(OH)D3は、活性型ビタミンD3である1,25-ジヒドロキシビタミンD3 [1,25(OH)2D3](カルシトリオール)の前駆代謝産物であり、主に腎臓の近位尿細管上皮細胞に限局したミトコンドリアCYP27B1-水酸化酵素の産物である。(315, 316)
ビタミンDは25(OH)D3よりも半減期がはるかに短いため(2-3週間に対して1-2日)、25(OH)D3がビタミンDの状態を示す最良の指標であると考えられている;したがって、25(OH)D3はビタミンDの状態を示す最も広く用いられている検査である(315, 316)。315,316)ビタミンD値が30ng/mlを超えると広く「正常」とみなされ、20〜30ng/lの間はビタミンD不足、20ng/ml未満はビタミンD欠乏とみなされる(315-317)。(315-317)しかし、最近のデータでは、50ng/ml以上が望ましく、理想的には55-90ng/mlを目標とすることが望ましいとされている。(314, 318-320)
ビタミンD濃度が低い(20ng/ml未満)患者が、標準的な推奨量である5,000IU/日を摂取して最適な濃度に達するには、何ヶ月も、あるいは何年もかかる可能性がある。したがって、十分な循環濃度を得るためには、ビタミンD補給の最適なレジメンに従うことが重要である(表3参照)。(319, 320) 市販されているビタミンD3の最高用量は50,000 IUカプセルであり、その手頃な価格(低コスト)と消化管吸収の良さから、地域の設定には50,000 IU D3カプセルの使用を推奨している(314, 319, 320)。合わせて、これらのカプセルの数をボーラス用量として摂取することができる[すなわち、100,000~400,000 IUのような単回先行投与]。しかし、肝臓でビタミンDを25(OH)Dに変換する25-ヒドロキシラーゼの能力には限りがあるため、50,000IUのカプセルを数日間にわたって服用した方が、より良好な生物学的利用能が得られる。(314, 319, 320)
ビタミンD2は酵母由来のエルゴステロールに紫外線を照射して製造され、ビタミンD3はラノリン由来の7-デヒドロコレステロールに紫外線を照射して合成される。(315)ビタミンD2の生物学的活性はビタミンD3の30%である。ビタミンDを8,000IU/日以上摂取する場合は、ビタミンK2(メナキノン[MK7]100mcg/日、または800mcg/週)とマグネシウム(250-500mg/日)の両方を摂取するのが最善である(321, 322)。 ビタミンK2自体には抗がん作用があり、ビタミンK2(K1ではない)の摂取量とがん死亡率との間には逆相関があることに注意すべきである(323-326)。
表3 体内のビタミンD貯蔵量を補充するための先行負荷量レジメンの指針
血清ビタミンD濃度が入手できる場合、血清25(OH)D濃度を50ng/mL(125nmol/L)以上に長期的に維持するために、この表に示した投与量を用いることができる。この表は、体重70kgの非肥満成人における、緊急時以外のビタミンD経口投与の初回ボーラス投与量、1週間の投与量、投与回数、投与期間を示したものである。
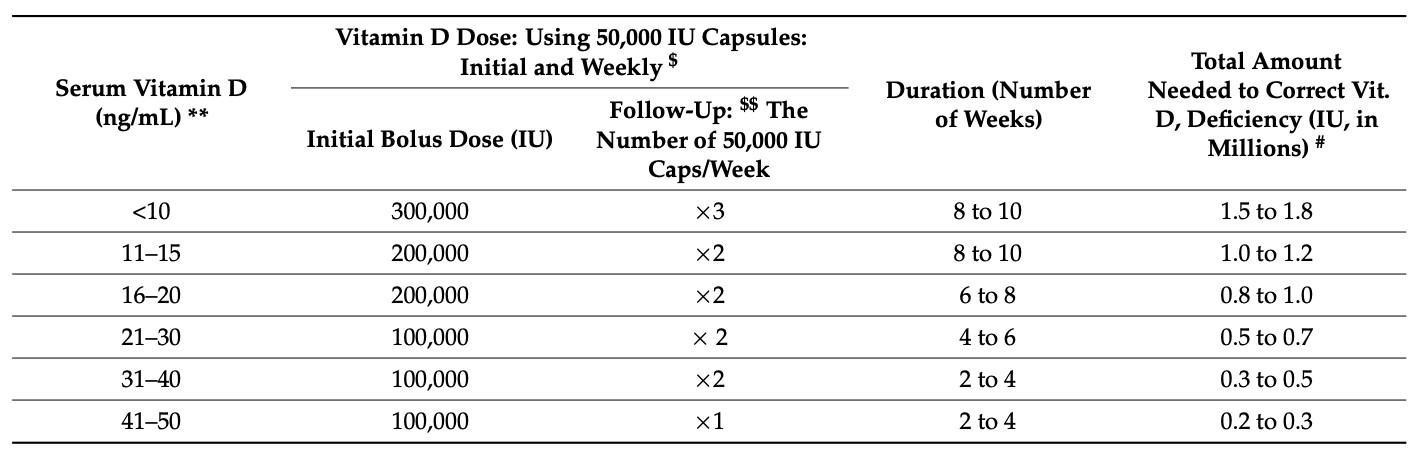
表3 ビタミンD貯蔵量の補充(出典:栄養素-特集号: 「ビタミンD-カルシフェロールとCOVID」(319) 著者より許可を得て転載。
ビタミンDは、エネルギー代謝、免疫、細胞増殖および分化の経路において多面的な機能を有し、カルシウムのホメオスタシスの制御にも明らかに及んでいる。(327)ビタミンDの生物学的活性型である1,25(OH)D3は、ヒトゲノム内の1,200以上の遺伝子を制御している(314)。 ビタミンDの骨格外機能で最も重要なのは、免疫系の調節における役割である。ビタミンDレセプターは免疫細胞上に存在し、このビタミンは自然免疫と適応宿主免疫の両方において重要な役割を果たしている(328, 329)。
ビタミンDは、直接的には腫瘍細胞の分化、増殖、アポトーシスを制御することにより、間接的には悪性腫瘍の微小環境に影響を及ぼす免疫細胞を制御することにより、抗がん作用を有する。観察研究およびランダム化比較研究から得られたエビデンスによると、ビタミンDの低値は、がんや心血管系疾患など生命を脅かす疾患による死亡率の上昇と関連している(330, 331)。 UK Biobankコホートの40-73歳の445,601人の実臨床解析では、ビタミンDの欠乏と不足の両方が全死因死亡率と強く関連していた。(332)
コクラン分析では、ビタミンD3(コレカルシフェロール)の補充は全死因死亡率を減少させた(RR 0.94,95%CI 0.91〜0.98、p=0.002);しかしながら、ビタミンD2、カルシフェジオール、カルシトリオールの補充は死亡率に影響を及ぼさなかった。(333)
ビタミンDの欠乏は乳癌のリスクを増加させるが、ビタミンDの補充摂取はこの転帰と逆相関を示した(334)。(334)プロスペクティブおよびレトロスペクティブの疫学研究では、25-ヒドロキシビタミンD濃度が1ml当たり20ng未満では、結腸がん、前立腺がん、乳がんの発生リスクが30~50%増加し、これらのがんによる死亡率も高くなることが示されている。(315)高緯度に住む人はビタミンD欠乏のリスクが高く、低緯度に住む人に比べて、ホジキンリンパ腫、結腸癌、膵臓癌、前立腺癌、卵巣癌、乳癌、その他の癌のリスクが高く、これらのがんで死亡する可能性が高いことが報告されている。(233,315)Bischoff-Ferrariらによる前向き研究(がんの一次予防の項を参照)で強調されているように、ビタミンDの補充はがんの予防に重要な役割を果たしている可能性が高い。(155,156)さらに、Zhangらは、合計74,655人が参加した50の試験のメタアナリシスにおいて、ビタミンDの補充はがん死亡リスクを有意に減少させたと報告している(0.85,0.74~0.97,0%)。(335)サブグループ解析では、ビタミンD3補充を行った試験では、ビタミンD2補充を行った試験よりも全死因死亡率が有意に低かった。25(OH)D-がん罹患率の解析によると、ビタミンD濃度が80ng/mLと10ng/mLを比較すると、がん罹患率は70±10%減少する。(233)
抗がん経路とメカニズム
ビタミンDには多様な抗腫瘍活性があることが実験的に示されている(図8参照)。ビタミンDがその標的であるビタミンDレセプターに結合すると、標的遺伝子の転写活性化と抑制が起こり、その結果、分化とアポトーシスの誘導、癌幹細胞の抑制、増殖、血管新生、転移能の低下が起こる。(336)ビタミンDはがん細胞のアポトーシスを誘導し、(337) 異常なWNT-βカテニンシグナル伝達を抑制し、(338) 核因子Κβのダウンレギュレーションとシクロオキシゲナーゼの発現抑制を介して広範な抗炎症作用を有する。(339)結腸、前立腺、乳がん細胞において、1,25-(OH)2D3は、いくつかのアポトーシス促進タンパク質(BAX、BAK、BAG、BAD、G0S2)をアップレギュレートし、生存および抗アポトーシスタンパク質(チミジル酸シンターゼ、サバイビン、BCL- 2、BCL- XL)を抑制する。(340)このようにして、ミトコンドリアからのシトクロムCの放出と、アポトーシスにつながるカスパーゼ3と9の活性化を促進する。1,25-(OH)2D3とメトホルミンは、結腸癌や他のタイプの細胞において、相加的/相乗的な抗増殖作用とアポトーシス促進作用を持つ。(341)
多くの癌細胞において、1,25-(OH)2 D3は、サイクリン依存性キナーゼをダウンレギュレートし、サイクリンD1およびCをコードする遺伝子を抑制することにより、細胞周期をG0/G1期に直接停止させる。
(342)1,25-(OH)2D3は、上皮成長因子受容体(EGFR)の発現を減少させ、インスリン様成長因子(IGF)-I/II経路を阻害する。(233)ビタミンDは、Ras/MEK/ERK経路を標的とすることにより、ヒト乳がん細胞株に対して活性を有する。(340)さらに、1,25-(OH)2D3は、エストロゲン合成とエストロゲン受容体(ER)αを介したシグナル伝達を阻害することにより、乳がん細胞の増殖を抑制する。(343)結腸癌細胞において、1,25-(OH)2 D3は、E-カドヘリン、オクルディン、クローディン-2および-12、ZO-1および-2などの接着接合部やタイトジャンクションを構成する細胞間接着分子の配列をアップレギュレートする。(344)
Wnt/β-カテニン経路は癌において重要な役割を果たしている。1,25-(OH)2-D3によるWnt/β-カテニン経路の拮抗作用は、結腸癌細胞において二重のメカニズムによって報告された:(a)リガンド化したVDRが核内のβ-カテニンと結合し、転写活性のあるβ-カテニン/TCF複合体の形成を妨げる、(b)新たに合成されたβ-カテニンタンパク質を細胞膜のアドヘレンズジャンクションに引き寄せるE-カドヘリンの発現を誘導する。そのようにして、β-カテニンの核内蓄積を減少させる。(345)
1,25-(OH)2-D3は免疫系の重要な調節因子であり、それはほとんどすべてのタイプの免疫細胞がビタミンD受容体を発現していることからもわかる。1,25-(OH)2D3は、マクロファージ、ナチュラルキラー(NK)細胞、好中球を活性化することにより、腫瘍細胞に対する自然免疫反応を促進する。(233)1,25-(OH)2D3の重要なメカニズムは、NF-ΚB経路の阻害である。その結果、複数のサイトカインとその作用がダウンレギュレーションされる。1,25(OH)2D3は、COX-2を阻害することにより、PG E2および2つのPG受容体(EP2およびFP)のレベルを低下させることで、前立腺がん細胞におけるPG E2の増殖促進作用を低下させる。(346)
オートファジーは、細胞質の老廃物や機能不全に陥った小器官を排除するプロセスであり、細胞保護機構として機能するが、過剰になると細胞死につながる。(233)癌においては、VDRリガンドは、いくつかの癌細胞型において重要な遺伝子を誘導することにより、オートファジー死を引き起こす。このように、1,25-(OH)2 D3は、重要な自食作用MAP1LC3B(LC3B)遺伝子を抑制し、50-AMP活性化プロテインキナーゼ(AMPK)を活性化する。カポジ肉腫細胞や骨髄性白血病細胞では、ビタミンD化合物はPI3K/AKT/mTORシグナルを阻害し、ベクリン-1依存性のオートファジーを活性化する。1,25-(OH)2D3は、上皮性遺伝子の直接的なアップレギュレーションおよび/または主要な上皮間葉系転写因子(EMT-TFs)の抑制のいずれかによって、いくつかのタイプのがん細胞に対して分化促進作用を有する。(347)
様々なタイプの癌細胞(結腸、前立腺、乳房)において、1,25-(OH)2 D3の抗血管新生作用は、2つの主要な血管新生促進因子を阻害するその能力に大きく依存している:それは、低酸素誘導性血管新生における重要な転写因子である低酸素誘導因子(HIF)-1αと血管内皮増殖因子(VEGF)の発現と活性を抑制する。(233)1,25-(OH)2D3はまた、腫瘍由来の内皮細胞に対しても阻害作用を持つ。1,25-(OH)2D3は、試験管内試験での増殖と萌芽を抑制し、がんモデルにおける血管密度を減少させる。(348)
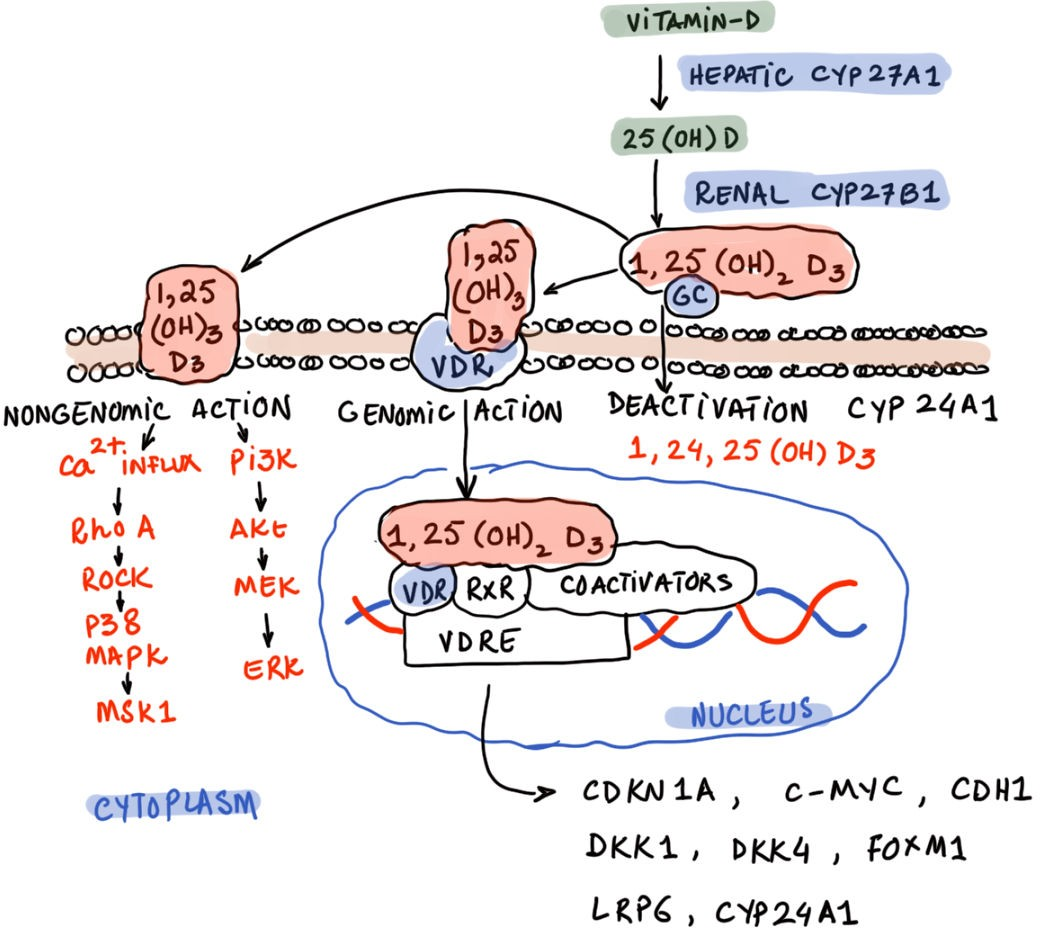
図8 ビタミンDの代謝経路の概要(出典:Dr: Mobeen Syed博士による。
図9の脚注:CYP27A1:シトクロムP450ファミリー27サブファミリーAメンバー1、CYP27B1: シトクロムP450ファミリー27サブファミリーBメンバー1,25(OH)D:25-ヒドロキシビタミンD、1,25(OH)2 D3:1,25-ジヒドロキシビタミンD3、GC:ビタミンD結合タンパク質(Gcタンパク質)、VDR:ビタミンD受容体、RXR:レチノイドX受容体、VDRE:ビタミンD応答エレメント、CDKN1A:サイクリン依存性キナーゼインヒビター1A、C-MYC: 細胞性骨髄球腫症腫瘍遺伝子、CDH1:カドヘリン-1、DKK1:ディックコップ-1、DKK4:ディックコップ-4、FOXM1: フォークヘッドボックスタンパク質M1、LRP6:低密度リポタンパク質受容体関連タンパク質6、PI3K:ホスファチジルイノシトール3キナーゼ、Akt: プロテインキナーゼB、MEK:Mitogen-activated protein kinase kinase、ERK:Extracellular signal-regulated kinase、Rho A: Rho A:Ras homolog gene family member A、ROCK:Rho associated protein kinase、P38:p38 mitogenactivated protein kinase、MAPK:Mitogen-activated protein kinase、MSK1:Mitogenand stress-activated protein kinase
臨床研究
がん患者の大多数がビタミンD欠乏症(20ng/ml未満)であるというデータがある。(331, 336, 349, 350)いくつかの前向き観察研究では、血漿中25-ヒドロキシビタミンD濃度が高いほど大腸癌患者の生存率が改善することが示されている。(349, 351-353)同様に、乳がん、胃がん、リンパ腫患者においても、25-OH D値の上昇は全生存率の改善と関連していた。(354) 乳癌、結腸癌、肺癌、リンパ腫の患者を対象とした集団ベースの研究では、診断時の25-OHD値が18ng/ml未満では生存期間が短かった。(355)19の研究のメタアナリシスでRobsahmらは、25-ヒドロキシビタミンDとがんの生存率との間に逆相関があることを報告している。(356)
Chenは、観察コホート研究とランダム化試験のメタアナリシスを行い、がん患者における診断後のビタミンDサプリメント摂取が生存に果たす役割を評価した(357)。(357) このメタアナリシスには、5つのRCTと6つの観察コホート研究からなる11の論文が含まれた。コホート研究とランダム化試験をプールしたビタミンDサプリメント使用と非使用の全生存期間の要約相対リスク(SRR)は0.87(95%CI、0.78-0.98;p = 0.02)であった。Vaughan-Shawらは、大腸癌患者におけるビタミンDサプリメントの使用を評価した7つの研究のメタアナリシスを行った(358)。 この研究では、有害転帰が30%減少し、無増悪生存期間に有益な効果があることが報告された(HR = 0.65; 95%CI:0.36-0.94)。Kuzniaらによるメタアナリシスでは、サブグループ解析により、ビタミンD3はボーラス補充とは対照的に、毎日投与することでがん死亡率を12%減少させることが明らかにされた(359)。このメタアナリシスに含まれる研究では、800IUから4000IUの間が毎日投与され、ビタミンDレベルはモニターされていないことが認識されるべきである。もし患者にもっと適切なビタミンDが投与されていれば、死亡率はもっと劇的に減少したであろう。
SUNSHINEは、転移性結腸直腸癌患者において、標準量のビタミンD3を標準化学療法と併用した場合と比較して、「高用量」ビタミンD3の有効性を評価するためにデザインされた二重盲検多施設無作為化臨床試験である(336)。高用量群では、1サイクル目に1日8,000IU(4,000IUカプセル2個)のビタミンD3を負荷投与し、その後のサイクルでは1日4,000IUを投与した。標準用量投与群では、すべてのサイクルでビタミンD3を400IU/日投与した。このパワー不足のRCT(n=139)では、無増悪生存または死亡の多変量HRは0.64(95%CI、0-0.90;p=0.02)で高用量群に有利であった。ECOG performance statusで層別化したlog-rank検定によるビタミンD3高用量群と標準用量群との無増悪生存期間の比較は統計学的に有意であった(p = 0.03)。ベースライン時の血漿中25-ヒドロキシビタミンD濃度の中央値は、高用量ビタミンD3群(16.1ng/mL[IQR、10.1~23.0ng/mL])、標準用量ビタミンD3群(18.7ng/mL[IQR、13.5~22.7ng/mL])ともに不足していた。
ベースライン時に25-ヒドロキシビタミンDが十分なレベル(≧30ng/mL)であったのは、試験集団全体のわずか9%であった。治療中止時、高用量ビタミンD3投与群の25-ヒドロキシビタミンD値の中央値は34.8ng/mL(IQR、24.9-44.7ng/mL)であった。 7ng/mL)であったのに対し、標準用量ビタミンD3投与群では依然としてビタミンDが欠乏しており、25-ヒドロキシビタミンD値の中央値は18.7ng/mL(IQR、13.9-23.0ng/mL)であった(差、16.2ng/mL[95%CI、9.9-22.4ng/mL];P<0.001)。これらのレベルに基づくと、「高用量」群はビタミンD投与量が著しく不足していたことに注意することが重要である。上に示したように、ビタミンDの投与は50ng/mlを超える血清レベル(目標55-90ng/ml)を目指して行われるべきである。本試験のデータから、ビタミンD濃度が得られるまで、ビタミンD3を1日20,000〜50,000IU/日投与することを推奨する。がん患者には、150ug/dl程度のさらに高い値が必要な可能性がある。
Wangらは、食道切除術を受けた食道癌患者において、術後のビタミンD補充がQOLの改善と無病生存率の向上に関連することを示した(360)。同様に、診断後のビタミンD投与は乳癌特異的死亡率の低下と関連することが明らかになった(361)。 前立腺がん患者を対象とした最近の2件の臨床試験では、ビタミンDの補充が前立腺がんの進行を予防する可能性が示唆されている。(362, 363) ビタミンDは、従来の化学療法と併用すると相加的または相乗的な効果を示す。(341)Zeichnerらは、HER2陽性非転移性乳癌におけるネオアジュバント化学療法中のビタミンDの使用が、無病生存率の改善と関連することを示した(HR、0.36;95%CI、0.15-0.88;p=0.026)。(364)
ビタミンDが有効な癌の種類
ビタミンDの補充はほとんどのがんで有益であると考えられるが、特に乳がん、結腸直腸がん、胃がん、食道がん、肺がん、前立腺がん、リンパ腫、黒色腫の患者において有益である。
投与量と注意事項
ほとんどすべてのがん患者は重度のビタミンD欠乏状態にある。ビタミンDの血中濃度に応じて投与量を漸増し、50ng/ml以上(目標55~90ng/ml)を目指す。しかし、現在のデータでは、ある種の癌が増殖と転移を止めるためには、150ng/mLまでのレベルが必要であることが示唆されている。ビタミンD中毒は、血清中の25-ヒドロキシビタミンD濃度が150ng/ml(374nmol/l)を超えると起こる。(315)高カルシウム血症は通常、250ng/mlを超えるまで起こらない。したがって、ビタミンD値が得られるまで、1日20,000~50,000IUを投与することを推奨する。提案された用量では、血清25(OH)D濃度は1~2週間で100ng/mLを超えるが、適切な高用量の維持量(~10,000IU/日)を用いない限り、3週間ほどでベースラインまで低下し始め、ビタミンDの効果は失われる。ビタミンD濃度を測定することが不可能な場合は、100,000IUを負荷量とし、その後10,000IU/日を投与することをお勧めする。1日10,000IUのビタミンD3を5カ月間投与しても毒性はなく、安全であることが報告されている(315, 318)。(315,318)ビタミンDは1日80,000IUまでが安全であることが報告されている(365,366)。(365,366)血清25-ヒドロキシビタミンDレベルを維持する上で、ビタミンD2はビタミンD3より約30%有効であるため、我々はD2よりビタミンD3を推奨した。(315)さらに、ビタミンD3は間欠的な大量ボーラス投与ではなく、毎日投与すべきである。ビタミンDを8,000IU/日以上摂取する場合は、ビタミンK2(メナキノン[MK4/MK7]100mcg/日、または800mcg/週)とマグネシウム(250-500mg/日)の両方を摂取するのが最善である。(321, 322)クマジンを服用している患者は、ビタミンK2を服用する前に、注意深く観察し、PCPと相談する必要がある。さらに、PTH(副甲状腺)値とカルシウム値を測定し、PTH値に応じてビタミンDの投与量を次のように漸増することを推奨する(コインブラプロトコル):(367, 368) i)もしPTH値が
i)PTH値が基準範囲の下限を下回っている場合は、ビタミンDの投与量を減らす。ii)PTH値が基準範囲の下限にある(または近い)場合は、投与量を維持する。iii)PTH値が基準範囲内にあるが、基準範囲の下限に近くない場合は、ビタミンDの投与量を増やす。
5. メラトニン
メラトニン(N-アセチル-5-メトキシトリプタミン)は、松果体から分泌される親油性の低分子で、その合成は概日パターンを示す。メラトニンは主に暗闇に反応して松果体から分泌される。(369)夜間、メラトニンレベルは上昇し、早朝から一日を通して減少し始める。夜間のメラトニン濃度の上昇は、標的臓器を刺激し、適切な恒常性代謝リズムに移行させる。(169)
夜間に身体を光にさらすと、メラトニンの産生と概日リズムが乱れる可能性がある。血中のメラトニン濃度のピークは個人差があり、年齢にもよるが、40歳を過ぎると急激に低下する。(370)
メラトニンは、多くの生理機能を調節する特異的な受容体、すなわちMT1とMT2を持っている。両者とも7回膜貫通型Gタンパク質共役型受容体ファミリーのメンバーである(371)。メラトニン受容体は全身に存在し、その複数の生物学的機能を説明している(369)。(369)さらに、すべての細胞のミトコンドリアは、近赤外線照射の影響下で、オートクライン様式でメラトニンを産生する。(372, 373) メラトニンは、強力な抗酸化物質として直接的、間接的に作用する数多くの生物学的特性を持っている。(369)メラトニンは正常なミトコンドリア機能において重要な役割を果たしており、酸化的リン酸化を強力に誘導する。
抗がん経路とメカニズム
低メラトニンレベルは、がんの病因に関与している。いくつかの研究で、ある種のがん患者では、同年齢の健常人と比べてメラトニンレベルが低下していることが示されている。(370) 夜勤労働者における夜間のメラトニン分泌の乱れは、乳がんや他のがん種に対するリスクの中程度の上昇と関連している。26の観察研究のメタアナリシスでは、航空会社の女性客室乗務員における乳がん罹患率の有意な増加が認められた。(374)国際がん研究機関は、この関係を認め、「概日リズムの乱れを伴う交代勤務」をヒト発がん物質の可能性から可能性ありに再分類した。(375)
実験モデルにおいて、メラトニンは幅広い抗がん活性を示し、その基礎となる複数のメカニズムが提唱されている(図9参照)。(148,169)メラトニンは乳がん細胞において、細胞毒性、抗有糸分裂、アポトーシス促進作用を発揮する。メラトニンの抗増殖活性は、ER陽性およびER陰性のヒト乳がん細胞株の両方で証明されている。これらの報告の多くでは、メラトニンはMT1膜受容体を介して作用した。さらに、メラトニンはがん細胞のアポトーシスを活性化する。これはPUMAのアップレギュレーションによって媒介されるのかもしれない。メラトニンは、BAX/BAK、Apaf-1、カスパーゼ、p53などのアポトーシス促進メディエーターの発現を増加させる(376)。(377)メラトニンは、がん幹細胞の増殖を抑制し、Ki67とマトリックスメタロプロテアーゼ9の発現を減少させることが証明されている。これにより、がん細胞の増殖活性が低下し、転移能が低下し、アポトーシスを起こすようになる。メラトニンは、ミトコンドリア酵素のピルビン酸デヒドロゲナーゼキナーゼを阻害することにより、ピルビン酸からアセチルCoAの合成を刺激する(378)。ある研究では、メラトニンがワールブルグ効果を阻害することにより、ユーイング肉腫の代謝プロフィールを変化させることが示された(379)。(379)前立腺がん細胞では、メラトニンは解糖とペントースリン酸経路のダウンレギュレーションを介してグルコース代謝を減少させることができた。(380)メラトニンの抗エストロゲン作用は、ホルモン感受性乳がんの増殖を抑えるこのホルモンの能力を高める可能性もある。(148)
抗血管新生は、メラトニンが抗がん作用を発揮する主なメカニズムの一つである。メラトニンは低酸素誘導因子1-αを阻害し、それによって血管内皮増殖因子(VEGF)の発現を阻止する。メラトニンはまた、内皮細胞の遊走、内皮細胞の浸潤、内皮細胞の管形成を阻害する。メラトニンはまた、PI3KおよびMAPKシグナル伝達経路の変化を介して、受容体依存性および非依存的にがん細胞の遊走を阻害する(377)。(377)メラトニンは、T細胞とナチュラルキラー(NK)産生を刺激し、制御性T細胞(Treg)を減少させることが証明されている。(381, 382)
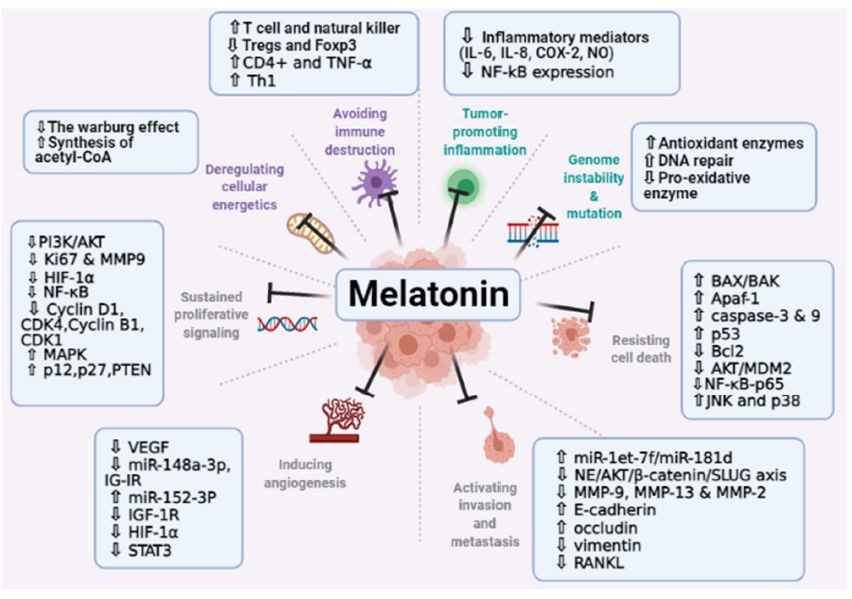
図9 メラトニンが影響する複数の抗がん経路(出典:Talib et alよりCreative Commons 4.0ライセンスの下で複製)(169)
メラトニンは、化学療法、放射線療法、支持療法、緩和療法を受けているがん患者の生存率を向上させ、化学療法の副作用を改善することで、がん患者に利益をもたらす可能性がある。
臨床研究
症例研究に加えて(383, 384)、がん患者におけるメラトニンの臨床的有益性は、RCTのメタアナリシスという最高レベルの証拠によって支持されている(385, 386)。Seelyらは、化学療法、放射線療法、支持療法、緩和ケアと併用したメラトニンの1年生存、完全奏効、部分奏効、病勢安定、および化学療法関連毒性に対する効果を系統的に検討した(386)。 この解析には、固形がんを研究した21のランダム化研究が含まれた。1年死亡率のプール相対リスク(RR)は0.63(95%CI = 0.53-0.74;P< 0.001)であった。完全奏効、部分奏効、病勢安定において改善効果が認められた。メラトニンと化学療法を併用した試験では、アジュバントメラトニンは1年死亡率を減少させた(RR = 0.60; 95%CI = 0.54-0.67)。
メラトニンが有効な癌の種類
メラトニンは、乳がん、卵巣がん、膵臓がん、肝臓がん、腎臓がん、口腔がん、胃がん、結腸・直腸がん、脳腫瘍、肺がん、前立腺がん、頭頸部がん、各種白血病、肉腫など、いくつかのがんに有効である。(148, 169)
投与量と注意事項
レム睡眠による悪夢を最小限に抑えるため、徐放性/徐放性製剤が推奨される(就寝1時間前の服用が最適)。耐容性に応じて、20~30mgまで増量すべきである。メラトニンのLD50は無限大である(工業用量のメラトニンで動物を殺すことは不可能である)。報告されている唯一の副作用は、早朝の眠気と「悪い夢」(用量を急激に増やした場合)である。(369)
6. 緑茶
抗がん経路とメカニズム
緑茶には、エピガロカテキンガレート(EGCG)、エピガロカテキン(EGC)、エピカテキンガレート(ECG)、エピカテキン(EC)など、カテキンと呼ばれるフラボノイドの一種が豊富に含まれている。新鮮な茶葉に最も多く含まれる個々のカテキンはEGCGで、カテキンの総含有量の40%以上を占める。(158)緑茶カテキン(GTC)は、いくつかの実験モデルにおいて、がんの成長を抑制する効果があることが証明されている(387-389)。(387-389)さらに、GTCは他の植物化学物質、特にレスベラトロールと組み合わせることで、相乗的な抗がん活性を発揮する可能性がある。(390,391)GTC、特にEGCGは、特にエネルギー源としてグルタミン酸経路に依存する癌(392) の予防と治療の両方に役割を果たす可能性がある。ミトコンドリアのグルタミン酸デヒドロゲナーゼ(GDH)は、L-グルタミン酸の酸化的脱アミノ化を触媒する。GDHの活性化は、グルタミン分解の亢進と密接に関連している。さらに、グルタミン酸はグルコースが酸化される際のミトコンドリア細胞内メッセンジャーとして機能し、GDHはグルタミン酸を合成することによってこのプロセスに関与している。(393)Liたちは、EGCGがナノモル濃度でGDHをアロステリックに阻害することを試験管内試験で証明した。(201, 202)
GTCは、がん細胞で活性化または阻害されるシグナル経路の複数のリンクを標的的に制御することにより、シグナル伝達を促進および/または阻害することにより、重要な抗がん作用を有する。(158)EGCGは、膜受容体と相互作用することにより、シグナル伝達経路を調節する。EGCGはVEGFの発現を有意に阻害し、VEGF受容体を減少させた。VEGFシグナル伝達経路の不活性化は、発がんを阻害するための一般的な戦略である血管新生を抑制する。EGCGはPKAを活性化し、腫瘍抑制因子マーリンなどの関連タンパク質を脱リン酸化し、がん細胞の増殖を抑制する。(394) EGCGはJAK2のリン酸化を阻害することにより、STAT3のリン酸化を抑制する。STAT3は抗腫瘍免疫応答を抑制し、がん細胞の増殖と遊走を促進する。EGCGは、下流タンパク質のリン酸化部位を競合することにより、MAPKシグナル伝達を阻害する。EGCGは、β-カテニンをリン酸化してその分解を促進することにより、Wnt経路を阻害する。EGCGは、ソニックヘッジホッグ経路の活性化に関与する転写因子を阻害する。EGCGは、MMP2およびMMP9の活性を阻害し、TIMp1/2の発現を促進し、腫瘍細胞の浸潤および転移を抑制した。(394)緑茶抽出物はがん幹細胞を抑制することが実証されている(395, 396)。
GTCはさらなる経路を介して抗がん作用を持つ。(158)GTCは、いくつかの経路を介して、試験管内試験および生体内試験で、がん細胞に対して強力かつ選択的なアポトーシス促進活性を発揮する(387, 388, 397)。GTCは、A549細胞の細胞周期停止を制御し、p21およびp27の発現を増加させ、p-ACTおよびサイクリンE1の発現を用量依存的に阻害することによって、がん細胞を抑制する(398)。 EGCGは、上皮成長因子受容体(EGFR)シグナル伝達経路を標的とすることにより、ヒト肺がん細胞の増殖を阻害した。
GTCは腫瘍微小環境(TME)を変化させ、それによって免疫抑制と転移のリスクを減少させることが実証されている。(391)GTC(およびレスベラトロール)を含むフラボノイドは、炎症性遺伝子発現の強力なモジュレーターであるため、炎症性TME内の分子標的を選択的に抑制する薬剤として非常に興味深い。GTCは、腫瘍における活性型細胞傷害性Tリンパ球とTregの比率を増加させることが証明されており、これは、抗腫瘍免疫治療薬が著しく改善されることで、「冷たい」腫瘍が、「熱い」腫瘍に切り替わることを示している(399)。 GTCsは、PD-1軸とTLR4経路を介して抗がん免疫を増強することにより、抗がん作用を示す。(400,401)さらに、GTCは腫瘍関連マクロファージ(M2からM1マクロファージ)を再分極させ、免疫反応を誘発し、転移を抑制する。(402)GTCは、MDSCが介在する免疫抑制を減弱させ、CD4+およびCD8+T細胞の割合を増加させることが証明されている。(403)
研究によると、がん関連死の20%はTLR誘発性がん悪液質に直接起因しており、がん細胞はマクロファージ、骨格筋、脂肪細胞においてTLR-4アゴニストとして作用する熱ショックタンパク質を放出し、下流のシグナル伝達を引き起こした。EGCGはTLR-4シグナル経路を効果的にダウンレギュレートする。(404)
GTCはMDSCの蓄積を阻害し、IFN-γの回復、CD8+T細胞の活性の増強、CD4+とCD8+T細胞の比率の改善をもたらし、腫瘍細胞に対する免疫系の攻撃の改善に有益である。(158)さらに、GTCを含む植物化学混合物は、M2極化マクロファージの再分極によって抗腫瘍活性を発揮し、IL-12の産生を誘導して、腫瘍微小環境に細胞傷害性Tリンパ球とナチュラルキラー細胞(NK)をリクルートした。(402)
これらすべての有益な効果に加えて、GTCは従来の化学療法剤の効果を増強する。生体内試験での重要なシグナル伝達経路に対する作用から、カテキンはしばしば化学療法剤との併用で増感剤として使用される。抗がん剤とカテキンの併用は、薬剤投与の前であれ後であれ、これらの薬剤の毒性を軽減し、がん細胞のアポトーシスを促進することで臨床効果を高めた(158)。重要なことは、多くの化学療法薬とGTCの併用により、薬物に対する細胞の化学療法感受性が向上し、化学療法薬の投与量を減らすことが可能になることである。(158)
臨床研究
数多くの実験モデルにより、GTCの抗がん作用のメカニズムが検討されている。このデータは、疫学的データ、B細胞悪性腫瘍患者のケースシリーズ(405)、いくつかの症例報告(406, 407)、RCTによって裏付けられている。18の前向きコホートと25の症例対照研究を含むメタアナリシスでは、茶カテキンの摂取と様々ながんのリスクとの間に有意な逆相関が示され、相対リスク(RR)は0.935(95%CI = 0.891-0.981)であった。(158)同様に、64の観察研究(症例対照研究またはコホート研究)を含むKimらによる包括的レビューとメタアナリシスでは、GTCが胃腸がん(口腔がん、胃がん、大腸がん、胆道がん、肝臓がん)、乳がん、婦人科がん(子宮内膜がん、卵巣がん)、白血病、肺がん、甲状腺がんのリスクを有意に減少させることが示された。(167)慢性リンパ性白血病患者を対象とした第1相用量探索試験において、EGCGは良好な忍容性を示し、大半の患者で絶対リンパ球数および/またはリンパ節腫脹の減少が観察された(408) Lemanneらは、高用量のEGCG投与後に慢性リンパ性白血病(CLL)の完全かつ持続的な寛解を示した患者について報告した。 (407) ランダム化二重盲検プラセボ対照試験において、緑茶カテキン600mg/日の投与は、高悪性度前立腺上皮内新形成の男性において、前立腺がんのリスクを30%から3%に減少させた。(203)
緑茶が有効ながんの種類
緑茶カテキンは、前立腺がん、乳がん、子宮がん、卵巣がん、結腸直腸がん、神経膠腫、肝臓がん、胆嚢がん、黒色腫、肺がんなど、さまざまな腫瘍に効果がある可能性がある。(158)GTCは、乳癌だけでなく前立腺癌にも特に有益であるようである。(199, 203, 387-390, 403, 409)
服用と注意
緑茶カテキンは、500~1000mg/日の用量で摂取すべきである。緑茶抽出物は空腹時よりも食中/食後に摂取すべきである。 緑茶抽出物は肝毒性と関連することはほとんどない。(410)緑茶エキスの安全性は、米国薬局方(USP)の栄養補助食品情報専門委員会(DSIEC)によって評価された。(168)DSIECは、「緑茶抽出物を含む栄養補助食品が適切に使用され、配合されている場合、委員会は、モノグラフの開発を禁止するような重大な安全性の問題を認識していない」と結論づけた。(168) このデータに基づき、緑茶エキスはメーカーが推奨する量を摂取することを推奨する。緑茶エキスを服用している患者には、定期的な肝機能検査が推奨され、緑茶エクストラクトは、基礎的な肝疾患のある患者には、使用を避けるか、慎重に使用すべきである。
7. メトホルミン
糖尿病の治療に日常的に使用されているメトホルミンは、がん細胞の発生も阻害し、がん細胞の増殖を抑えることが、多くの試験で示されている。
抗がん経路とメカニズム
メトホルミンは生体内試験および試験管内試験の両方で抗がん活性を有することが示されている(411)。メトホルミンの抗がん作用は、がん細胞に対する直接的作用、特にAMPK/mTOR経路の阻害による作用(412)と、血糖降下作用や抗炎症作用による宿主に対する間接的作用の両方から生じることが提唱されている。
メトホルミンはミトコンドリアの電子伝達連鎖複合体Iを阻害し、がん細胞を生体エネルギーストレス下に置き、ATP合成を解糖に頼らざるを得なくする(413)。(413)メトホルミンによるGPD2活性の阻害は、細胞質の酸化還元バランスを変化させ、酸化還元依存性の基質が糖新生経路に入るのを妨げる。(414)メトホルミンは、ATM(ataxia telangiectasia mutated)、LKB1(liver kinase B1)、アデノシン一リン酸活性化キナーゼ(AMPK)を活性化することにより、タンパク質合成と細胞の発達を抑制する。これによってmTORの作用が低下する。(415)AMPKをオンにすることによって、メトホルミンはp53を活性化し、最終的に細胞周期を停止させることができる。(415)ペルオキシソーム増殖因子活性化受容体-γコアクチベーター1-α(PGC-1)は、別個の分子経路であるが、メトホルミン暴露後のAMPK活性化によりアップレギュレートされる。PGC-1の低レベルは予後不良と関連しており、ミトコンドリアの生合成に関与する転写コアクチベーターである。メトホルミンはPGC-1を増加させ、糖新生の活性化を抑制する。(414)メトホルミンはS1RT1経路と相互作用する: 脱アセチル化酵素活性を持つNAD(+)依存性タンパク質サーチュイン1(SIRT1)によって活性化されるサーチュイン1(SIRT1)経路は、代謝と細胞増殖を結びつけるもう一つの重要なメカニズムである。(414)ほとんどの標準的な化学療法とは異なり、メトホルミンはがんの根源であるがん幹細胞を抑制する。(416)
メトホルミンはEGFRとIGFR経路を制御し、これらの経路は細胞の成長、増殖、いくつかの代謝プロセスの調整に関与している。同様の回路はアポトーシスと細胞増殖に深く関与し、代謝と細胞増殖の重要な軸となっている。さらなる研究により、予後不良、転移、疾患の進行は、IGF-1およびIGF-2の発現上昇とIGFBP-3の異常と関連していることが明らかになった。
メトホルミン治療がこれらの変化の一部を予防し、抗腫瘍効果を発揮する可能性を示唆する証拠がある。EGFRとIGFRの両経路は、協調的に代謝細胞の変化を促進し、新生物プロモーターとして働き、フィードバックシステムを形成することができる。(414)
臨床研究
メタアナリシスでは、がんの一次予防におけるメトホルミンの役割が検討されており、そこではメトホルミンはがん罹患率全体を有意に減少させることが明らかにされている(162, 163)。(162,163)Legaらは、21の観察研究のメタアナリシスを行い、メトホルミンを投与された糖尿病がん患者の転帰を評価した。(417)この研究では、メトホルミンは全死亡[HR, 0.73;95%信頼区間(CI), 0.64-0.83]と癌特異的死亡率(HR, 0.74;95%CI, 0.62-0.88)の低下と関連しており、結腸直腸癌患者が最大の有益性を示した。Yinらによる同様の解析では、メトホルミンは肺癌、乳癌、前立腺癌患者の全生存期間を改善した。(418)大腸癌の糖尿病患者において、Meiらはメトホルミンが全死亡リスクを44%減少させ、大腸癌特有の死亡リスクを34%減少させることを示した。(419) Coyleらは、癌の補助療法としてのメトホルミンの使用を検討した27の観察研究のメタアナリシスを行った(420)。(420)この研究の結果、メトホルミンは結腸直腸がんと前立腺がん患者の早期治療、特に根治的放射線療法を受けている患者の早期治療において有意な利益と関連することが示唆された。
メトホルミンが有効な癌の種類
メトホルミンを使用することにより、様々な悪性腫瘍を予防することができる。一般的に、メトホルミンは、i) 癌の発生率を低下させる、ii) 癌の死亡率を低下させる、iii) 放射線療法や化学療法に対する癌細胞の反応を改善する、iv) 腫瘍の遊走を最適化し、悪性度を低下させる、v) 再発リスクを低下させる、vi) アンドロゲン誘導体の有害な影響を軽減する、などの効果がある。(414,415)メトホルミンは、乳癌、膵癌、胃癌、結腸直腸癌、子宮内膜癌、膵前立腺癌、非小細胞肺癌(NSCLC)、膀胱癌に対して幅広い抗癌活性を有することが、一連の知見から示されている。(414, 419-425)しかし、特に補助療法として使用した場合、最大の効果は結腸直腸がんと前立腺がん患者においてであろう(419, 425)。
投与量と注意事項
メトホルミンとして1,000mgを1日2回投与することが推奨される。メトホルミンはきわめて安全な薬物であり、副作用はほとんどない。主な副作用は、腹部または胃の不快感、咳、嗄声、食欲減退、下痢などである。長期使用はビタミンB12欠乏症と関連する;したがって、ビタミンB複合体の補給が推奨される。メトホルミンはベルベリンと併用すると非常に低い血糖値を引き起こす可能性がある。したがって、この併用療法を受けている患者では血糖値を非常に注意深くモニターすべきである。低血糖が起こる場合は、メトホルミンとベルベリンを交互に(毎月)服用することを勧める。
8. クルクミン
クルクミンは、一般に「カレー粉」またはターメリックと呼ばれ、クルクマ・ロンガから抽出されるポリフェノールである。クルクミンには抗酸化作用、抗炎症作用、抗菌作用、抗ウイルス作用、抗がん作用がある。(426)
抗がん経路とメカニズム
クルクミンは、以下のようながん細胞における複数の細胞シグナル伝達経路を阻害することが示されている(図10参照): (細胞周期(サイクリンD1およびサイクリンE) ii. アポトーシス(カスパーゼの活性化と抗アポトーシス遺伝子産物のダウンレギュレーション)、増殖(HER-2、EGFR、AP-1) iii. 生存(PI3K/ACT経路) iv. 浸潤(MMP-9および接着分子) v. 血管新生(VEGF) vi. 転移(CXCR-4) vii. 炎症(NF-κB、TNF、IL-6、IL-1、COX-2,5-LOX)
NF-κBの異常な活性化は癌に特徴的であり、NF-κBは癌の血管新生、増殖、転移、炎症、そして細胞生存経路の誘導とアポトーシスの阻害を通して主要な役割を果たしている。リン酸化されたNF-ΚBはDNAと結合し、アポトーシスを阻害するがん遺伝子の転写を開始し、細胞増殖と血管新生を開始する。(426)クルクミンは、IκBキナーゼによるリン酸化を阻害し、NF-ΚB p65サブユニットの核内移行を阻害することにより、NF-ΚB活性を抑制する。STAT3は、がん遺伝子を制御するいくつかのシグナル伝達経路の共通標的であり、炎症性サイトカインや成長因子の伝達を調節している。(426)STAT3はがん細胞の増殖と生存に寄与し、Bcl-2やBcl-xLなどの抗アポトーシスタンパク質の発現を増加させ、アポトーシスを阻害する。IL-6やEGFR、PDGFなどいくつかの因子がSTAT3の活性化因子であることが報告されている(445)。(445)STAT3は、いくつかの腫瘍において、直接的に、またIL-6の阻害によって間接的に、クルクミンの分子標的であることが報告されている。(446)Treg、Th17、MDSCのような免疫抑制細胞の蓄積と活性化、マクロファージのM2表現型への分化、機能的DCの不在は、すべてSTAT3の活性化によって引き起こされる。クルクミンはSTAT3のリン酸化を有意に減少させる。
(435) クルクミンは、HER2-チロシンキナーゼを阻害することにより、乳がん細胞株を阻害する。(447) クルクミンは、Akt、mTOR、およびそれらの下流タンパク質のリン酸化を阻害し、様々な乳がん細胞株において細胞周期停止をもたらす。(448)
クルクミンはヘキソキナーゼ-2をダウンレギュレートし、HK-2をミトコンドリアから解離させてアポトーシスを誘導する。(449)クルクミンはまた、がん細胞の増殖、接着、遊走、分化に関連することが報告されている受容体チロシンキナーゼのファミリーであるEGFRの細胞シグナル伝達経路を阻害することができる。(450, 451)クルクミンは、EGFRシグナル伝達を減少させ、EGFRとAktのレベルを低下させることにより、乳がん細胞の成長と増殖を阻害した。(450)クルクミンは、EGFRの発現を阻害することにより、トリプルネガティブ乳がん細胞のアポトーシスを誘導することが実証されている。(451)膵臓がん細胞において、クルクミンは、NF-κB、増殖、血管新生、および細胞増殖と浸潤の亢進に関連するCdc20の発現の阻害を介して、ゲムシタビンの抗がん活性を増強する。(452)
クルクミンは、腫瘍微小環境内の低酸素状態下でも血管新生を阻害することにより、腫瘍微小環境に影響を与える。(432)さらに、クルクミンはアポトーシスを促進するだけでなく、がん幹細胞に対しても活性を持つ。(432,436,443,453) クルクミンは、活性酸素が介在する小胞体(ER)ストレスとミトコンドリア依存性の経路を介して、腫瘍細胞にアポトーシスを誘導する(427)。(432)さらに、クルクミンはWnt/カテニン経路を介して作用する。(434, 444)
臨床研究
実験モデルにおけるクルクミンの広範な抗がん作用にもかかわらず、その臨床使用はその低い生物学的利用能によって制限されてきた。クルクミンの経口バイオアベイラビリティは、その吸収の悪さ、広範な第1相および第2相生体内変換、胆嚢を介した迅速な排泄のために低い。(454)水への溶解度が低く、吸収が悪いため、従来は吸収を高める全脂肪乳や黒胡椒と一緒に摂取されてきた。生物学的利用能を改善するために、様々なクルクミン類似体や新規の薬物送達システム(リン脂質、レシチン化クルクミン、ナノ粒子、リポソームなど)が研究されている。
がんにおけるクルクミンの使用を記述した症例シリーズがいくつか発表されているが(428, 441, 455-459)、クルクミンの臨床的有効性は限られた数の研究で評価されている。多発性骨髄腫患者を対象とした試験的無作為化臨床試験では、メルファランとプレドニゾンによる治療にクルクミン(1回4g、1日2回、28日間)を追加すると、寛解率が上昇した([75% vs. 33.3%, p=0.009])。(430)この研究では、NF-ΚB、VEGF、TNFレベルはクルクミン群で有意に低く、TNFレベルは寛解と強い相関があった[OR=1.35; 95% CI=1.03-1.76, p=0.03]。第2a相非盲検試験において、転移性結腸直腸癌患者は、フルオロウラシル/オキサリプラチン化学療法(FOLFOX)とFOLFOX+クルクミン2g経口投与/日(CUFOX)に無作為に割り付けられた。(460)intention-to-treat集団において、全生存期間のHRは0.34(95%CI:0.14,0.82;P = 0.02)であった(中央値はFOLFOXで200日、CUFOXで502日)。Pastorelliらは前向き単群第2相試験において、進行膵癌患者におけるゲムシタビンとの併用療法としてのクルクミンのフィトソーム複合体(2g/日)の使用を評価した。(461)ゲムシタビン単剤治療を受けた患者の全生存期間中央値は5.7カ月である。(462)これらの研究者らは奏効率27.3%、病勢安定34.1%、全病勢コントロール率61.4%を報告した。無増悪生存期間中央値は8.4カ月、全生存期間中央値は10.2カ月であった。Saghatelyanらは、進行転移性乳癌の女性150人をパクリタキセル+プラセボまたはパクリタキセル+クルクミンを週1回12週間投与する群に無作為に割り付け、3カ月の追跡調査を行った。(463)この研究では、クルクミンは静脈内投与された。intention-to-treat解析の結果、4週間の追跡時点でクルクミンの客観的奏効率はプラセボのそれよりも有意に高かった(51%対33%、p<0.01)。治療を完了した患者(61%対38%、オッズ比=2.64、p<0.01)だけを含めると、群間の差はさらに大きかった。
用量漸増試験では、1日10gまでのクルクミンの忍容性が示されている。6g/日のクルクミンを7週間摂取した乳がん患者、および3g/日のクルクミンを9週間摂取した前立腺がん患者は、副作用を示さなかった。[301,353,389]

図10. クルクミン-多面的抗がん剤 [出典:Mobeen Syed博士]図10の脚注。付録3を参照のこと。
クルクミン(ウコン)が有効な癌の種類
大腸がん、肺がん、膵臓がん、乳がん、前立腺がん、慢性骨髄性白血病、肝臓がん、胃がん、脳腫瘍、卵巣がん、皮膚がん、頭頸部がん、リンパ腫、食道がん、骨髄腫。(426, 444)
製剤と注意点
クルクミンの使用は、その溶解性、吸収性および生物学的利用能の低さによって制限されてきた。クルクミンを操作してナノキャリア製剤にカプセル化することで、これらの大きな欠点を克服し、はるかに優れた治療効果をもたらす可能性がある。ネズミのホジキンリンパ腫モデルにおいて、クルクミンを固体脂質ナノ粒子に製剤化すると、クルクミン単独と比較してより高い抗がん作用が認められた。(464)したがって、ナノクルクミン製剤や吸収を高めるように設計された製剤が推奨される。(465-468)
米国では、ウコンの栄養補助食品市場の大部分(55%)が、クルクミンの生物学的利用能を高めるために配合された製品で占められている。これには、クルクミノイド抽出物を何らかの親油性担体と組み合わせて吸収性を高めた独自の製品や、クルクミンとピペリンを組み合わせて代謝を低下させた製品などが多い。(469)しかし、これらの製品は品質にばらつきがあるため、USPグレードのサプリメントの使用を推奨する。さらに、ナノフォーミュレーションに基づく併用療法は、薬物送達システムの有力なアプローチとして浮上してきた。(470)化学療法剤を組み込んだナノ薬物共同送達システムは、がん細胞の感受性がより高いことを示した。(471, 472)
クルクミンは、米国食品医薬品局(FDA)によって「一般的に安全」と評価されている。(473)1日8~10gまでの投与量では毒性は見られない(441, 442, 444, 458, 474, 475)が、特に1日の投与量が4gを超えると、下痢が頻繁に起こる副作用となる(441)。肝障害(肝炎)はまれな合併症であるため、長期使用中は肝機能検査をモニターすべきである(476)。
クルクミンには明らかな悪影響はないようであるが、この化合物はCYP2C9やCYP3A4など、いくつかのシトクロムP450サブタイプを阻害する可能性があることが指摘されている(444, 477)。 その結果、クルクミンは抗うつ薬、抗生物質、クマジンやクロピドグレルのような抗凝固薬など、いくつかの異なる薬物と相互作用することが報告されている(444, 478)。(444, 478)クルクミンには抗凝固作用があり、抗凝固薬を使用している人の出血を長引かせる可能性がある。(444, 479)
9. メベンダゾール/フェンベンダゾール/アルベンダゾール
抗がん経路とメカニズム
もともと寄生虫の治療薬として開発された化合物であるメベンダゾール(MBZ)は、異常ながん細胞において、細胞が分裂しようとする際に生じる細胞の微小管形成を致命的に破壊することによって作用する。他のベンズイミダゾールと同様、メベンダゾールはチューブリンのコルヒチン結合ドメインに結合し、p53依存性および非依存性の両方のメカニズムで作用するようである。(480)MBZは、チューブリン重合、血管新生、生存促進経路、マトリックスメタロプロテアーゼ、多剤耐性タンパク質トランスポーターなど、腫瘍の進行に関与する多くの因子を阻害する。(481)MBZは癌幹細胞を阻害する。この作用機序は転移を防ぐのに重要である。(149,481)さらに、若年性膠芽腫マウスモデルにおいて、MBZはグルタミノリシス経路と解糖経路の両方を阻害することにより、in-vitroおよびin-vivo条件下で評価した場合、腫瘍細胞の増殖と浸潤を抑制した。(204)この研究では、ケトーシスとMBZの腫瘍増殖抑制効果は相乗的であった。
MBZは、神経膠腫、黒色腫、肺癌、卵巣癌、大腸癌によくみられるヘッジホッグ経路の活性を低下させる。(81)MBZはBcl-2を不活性化し、カスパーゼを活性化してがん細胞のアポトーシスを促進し、シトクロムcの放出も悪性細胞のアポトーシスを誘発することが示されている。ベンズイミダゾールは、通常過剰に活性化されるMAPK経路を調節し、抗アポトーシス経路ではなくアポトーシス経路を活性化するように切り替える; MBZはまた、ほとんどのがんが優先的に依存しているがん細胞の解糖依存性代謝を阻害し、ミトコンドリアの酸化的リン酸化(OXPHOS)の阻害剤としても機能し、通常の代謝ATP産生経路で利用可能な残存エネルギーを減少させる。
MBZは血液脳関門を通過することができ、細胞増殖、アポトーシス、浸潤、遊走に関与するシグナル伝達経路を標的とすることによって、また従来の化学療法や放射線療法に対して神経膠腫細胞をより感受性にすることによって、神経膠腫の成長を遅らせることが実証されている(482)。
MBZはまた、化学療法や放射線療法といった従来の治療法に対してがん細胞を感作し、それらの併用による抗腫瘍効果を高めることができ、MBZが従来の化学療法と併用する補助療法として有用であることが確認された(482)。低用量化学療法と併用した場合、これらの薬剤が、癌の増殖に有利な環境を維持するのに役立っている可能性のある腫瘍関連マクロファージ細胞を破壊するのに役立つという証拠もある。
臨床研究
癌におけるベンズイミダゾールの使用は、少数の症例報告(483,484)と小規模のケースシリーズに限られている。(485)メベンダゾールは、METRICS研究で使用された多剤カクテルの一成分である。
(179)ベンズイミダゾール、特にフェンベンダゾールの使用は、Joe Tippensの報告された経験により、がんに対する再利用薬として注目されている。(74)2016年、ティペンズは広範な転移を伴う非小細胞肺がんと診断された。友人の獣医師の勧めで、フェンベンダゾールとナノクルクミンを一緒に服用したところ、服用開始から3カ月後のPET検査では完全に異常がなかった。彼は現在に至るまで病気もなく生きている。しかし、明らかに治癒したと思われる彼にはいくつかの疑問がある。
メベンダゾールが有効な癌の種類
NSCLC、副腎皮質がん、大腸がん、化学療法抵抗性黒色腫、多形性膠芽腫、大腸がん、白血病、骨肉腫/軟部肉腫、急性骨髄肉腫、乳がん(ER+浸潤性乳管がん)、腎臓がん、卵巣がんなど、多種多様ながんがMBZを含むベンズイミダゾールに反応することが示されている。(176, 480-482, 486-495)
投与量と注意事項
メベンダゾール100-200mg/日を推奨する。この薬にがんに対する活性があることが発見されると、米国ではメベンダゾールの価格が高騰した(100mg1錠で555ドル)。しかし、メベンダゾールは国際的な調剤薬局(インド)では100mg錠27c程度で入手可能である。


10. オメガ3脂肪酸
オメガ3多価不飽和脂肪酸(オメガ3FA)という用語は、炭素鎖のメチル末端から3番目の炭素原子(n-3位)に二重炭素結合を含む多価不飽和脂肪酸(PUFA)群を指す。α-リノレン酸(ALA、植物由来の炭素数18のPUFA)、エイコサペンタエン酸(EPA、魚由来の炭素数20のPUFA)、ドコサヘキサエン酸(DHA、海洋由来の炭素数22のPUFA)は、最も一般的なオメガ3系脂肪酸である。(496)
過去数十年にわたり、心血管疾患や神経変性疾患、がんなど、さまざまなヒトの疾患に対するオメガ-3多価不飽和脂肪酸(オメガ-3 FA)の治療効果について、広範な研究が行われてきた(496)。これらの研究は、これらの天然由来物質の臨床的有用性と安全性を実証してきた。さらに最近では、オメガ3系FAは、ある種のがんに対する予後を改善し、化学療法の有効性と忍容性を改善し、QOL指標を改善することが実証されている。(496)さらに、オメガ3FAは癌性悪液質を改善する。
抗がん経路とメカニズム
提唱されている4つの主な抗腫瘍活性は、(i)シクロオキシゲナーゼ(COX)活性の調節、(ii)膜動態および細胞表面受容体機能の変化、(iii)細胞酸化ストレスの増加、および(iv)レゾルビン、プロテクチンおよびマレシンを含む新規抗炎症性脂質メディエーターの産生である。(497, 498)
オメガ3系脂肪酸はリノール酸(LA)と癌における重要な栄養素として競合している。オメガ3系とオメガ6系は同じ生化学的経路を共有しており、両者の間で競合してバランスを崩す可能性があるため、2種類のFAの比率は重要である。オメガ6系FAの前駆体であるLAは、炎症反応に関連している。癌の進行は、オメガ-3/オメガ-6 FAを単独で摂取することよりも、食事中のオメガ-3/オメガ-6 FA比に影響されるようである(496)。LAが腫瘍細胞の生存を促進し、その死を防ぐのに対して、オメガ3系FAは腫瘍細胞の自己破壊を促進し、がんの拡大を抑える。オメガ3脂肪酸、特にEPAとDHAは、がん細胞の複製、細胞周期、細胞死に影響を与える。この観点から、試験管内試験および生体内試験の研究では、オメガ3系FAsが抗がん剤に対して腫瘍細胞を感作することが示されている。オメガ3系FAsはまた、NF-κB、ノッチ、ヘッジホッグ、Wnt、およびマイトジェン活性化プロテインキナーゼ(MAPK)を含む複数のシグナル伝達経路に関与する遺伝子発現を調節するなど、いくつかの経路を調節する。 (499)オメガ3系FAは、炎症反応、細胞増殖、アポトーシス、血管新生、転移に関与するアラキドン酸由来のプロスタノイド(プロスタグランジンE2)の形成を抑制する(500)。EPAとDHAは、EGFR活性化の低下とともに、Bcl2発現とプロカスパーゼ-8の活性化により、乳がん細胞株におけるアポトーシスを誘導する。(500)オメガ3系FAは、自己複製する結腸がん幹細胞(CSC)の活性を阻害することができる。(501, 502)
臨床研究
プロスペクティブRCTにおいて、オメガ-3 FAsとビタミンDの摂取は、がんの発症リスクの劇的な低下と関連していた(156)。 閉経後の女性を対象に実施されたVITALコホート研究において、魚油の現在の使用は、乳がんのリスク低下と関連していた(HR 0.68,95%CI:0.50-0.92)。 (503)海洋性オメガ-3 FAsの摂取を検討した16の前向きコホート研究のメタアナリシスでは、海洋性PUFAの摂取量が最も多い人と最も少ない人を比較した場合、乳がんリスクが低下することが示唆されている(504)。2つの大規模観察研究では、u-オメガ-3 FAsの摂取と大腸新生物のリスクとの間に有意な逆相関があることが示されている(505, 506)。
6つの前向き症例対照研究と5つのコホート研究の最近のメタアナリシスでは、乳がんの発症リスクとの関連において、血清リン脂質におけるオメガ-3:オメガ-6摂取比率および/またはオメガ-3:オメガ-6比率が評価された(507)。(507)著者らは、食事のn-3:n-6比が1/10増加するごとに乳癌リスクが6%減少し、血清のn-3:n-6リン脂質比が1/10増加するごとに乳癌リスクが27%減少すると結論づけた。
大腸切除と回腸吻合を受けたことのある家族性大腸腺腫症患者を、EPA2g/日群とプラセボ群に無作為に割り付けた。このRCTでは、EPA群でポリープ数が22.4%減少した(p=0.01)。(508) 第2相研究では、転移性乳がんに対するアントラサイクリン系化学療法レジメンに1日1.8gのDHAを追加することが評価された。DHA投与群では、病勢進行までの期間と全生存期間が有意に延長した(中央値34カ月 vs 18カ月)(509)。小規模のRCTでは、進行した非小細胞肺癌患者において、魚油の補充が一次化学療法の有効性を増加させた(510)。
早期乳がんの女性3,000人以上の大規模コホートにおいて、食事からのEPAとDHAの摂取量が多いと、乳がんの再発が25%減少し、全死亡率が改善することが報告された(中央値7年)。(511) 前立腺がん死亡リスクと魚のオメガ-3 FAs摂取量を評価したコホート研究では、魚の摂取量の増加と前立腺がん関連死亡リスクの減少との関連が示唆されている(512)。小規模RCTでは、化学療法を同時に受けている白血病またはリンパ腫患者を、魚油2g/日またはプラセボを9週間投与する群に無作為に割り付けた(513)。全体的な長期生存率は魚油群で高かった(p<0.05)。12のRCTおよび1184人のがん悪液質患者を含むメタアナリシスでは、オメガ-3 FAsの使用は、QOLおよび生存期間の有意な改善と関連していた(生存期間中央値、1.10;95%CI、1.02-1.19;P = 0.014)。(514)
オメガ3脂肪酸が有益と考えられるがんの種類
オメガ-3脂肪酸は、乳がん、結腸直腸がん、白血病、胃がん、膵臓がん、食道がん、前立腺がん、肺がん、頭頸部がんに有益である可能性がある(496)。
摂取量と注意事項
1日2~4gのオメガ3脂肪酸の摂取を推奨する。オメガ-3脂肪酸は出血のリスクを高める可能性があり、抗凝固剤を使用している患者では慎重に使用すべきである。
11. ベルベリン
患者の血糖値に応じて、メトホルミンとベルベリンを併用するか、交互に使用する(一度に1カ月間、前後に切り替える)ことを検討することができる。
抗がん経路とメカニズム
ベルベリンの抗がん機序には、がん細胞の増殖抑制、転移予防、アポトーシスの誘導、オートファジーの活性化、腸内細菌叢の制御、抗菌作用に着目した他のがん治療の効果増強などがあり、これには腸内細菌叢の制御や腫瘍内微生物の予防も含まれる。(515-519)
ベルベリンは、miR-214-3pのアップレギュレーション、SCTタンパク質レベルのダウンレギュレーション、カテニンの調節、テロメラーゼ活性の阻害、MAPKシグナル伝達経路の不活性化を通じて、がん細胞の増殖を防ぐ可能性がある。(520-522)p21、p27、p38を増加させ、CDK1、CDK4、サイクリンA、サイクリンD1を低下させることにより、ベルベリンはがん細胞の増殖を阻害する可能性がある。(515, 523) AMPK-p53、PI3K/ACT/mTOR、miR19a/TF/MAPKシグナル伝達経路、CASC2/ AUF1/B細胞/Bcl-2軸の調節を介して、ベルベリンはがん細胞のアポトーシスを促進する。(517, 524-526)ベルベリンは、PDGFRB、COL1A2、BMP7を含む多くのTME関連遺伝子をダウンレギュレートし、E-カドヘリンをアップレギュレートすることで、転移の広がりを抑制する。(527-529)
ベルベリンは腸内細菌叢に影響を与えることによって抗がん作用を示す。例えば、ベルベリンは、ファーミキューテス/バクテロイデーテス比を増加させ、クロストリジウム属、ラクトバチルス属、バクテロイデス属、アッカーマンシア・ムチニフィラ属の相対存在量を増加させる。(518, 519)
ベルベリンは放射線感受性を高め、シスプラチン、5-フルオロウラシル、ドキソルビシン、ニラパリブ、イコチニブなどの抗がん剤の効果を増強する。(530-533)
臨床試験
ベルベリンの有益性に関する臨床データは限られているが、ランダム化二重盲検試験では、ベルベリン300mgを1日2回投与することで、ポリープ切除後の大腸腺腫の再発リスクが有意に低下することが示された。(534)
ベルベリンが有効な癌の種類
ベルベリンは、乳がん、肺がん、胃がん、肝臓がん、大腸がん、卵巣がん、子宮頸がん、前立腺がんなど、さまざまながんに抗がん作用を示す。(515-517, 520-526, 528-533, 535)
投与量と注意事項
1日総量1000~1500mg(500mgを1日2~3回または600mgを1日2回服用)が推奨される。インスリン分泌はグルコース依存性であるため、このハーブによる低血糖症は報告されていない;しかしながら、血糖値をモニターし、血糖プロファイルに対するメトホルミンの相加的/相乗的効果を決定すべきである。ベルベリンはシクロスポリンを服用している患者には服用すべきではない。この併用はシクロスポリン濃度を上昇させるからである(絶対禁忌)。ベルベリンは以下の薬剤の代謝を変化させる可能性があるため、注意して使用する必要がある(影響を監視する):抗凝固薬、デキストロメトルファン、タクロリムス(プログラフ)、フェノバルビトン、ロサルタン(効果を阻害する)、鎮静薬(https://www.webmd.com/vitamins/ai/ingredientmono-1126/berberineを参照)。手術の予定がある場合は、ベルベリンを服用していることを麻酔科医に知らせること。手術の1週間前にベルベリンの服用を中止する必要があるかもしれない。
12. アトルバスタチンまたはシンバスタチン。親油性スタチンはいくつかの癌の治療に非常に有効である。
抗癌経路とメカニズム
スタチンは主に4つの方法で腫瘍細胞に直接作用すると考えられる:i)増殖抑制、ii)アポトーシス誘導、iii)抗浸潤・抗転移作用、iv)抗血管新生作用。第一の作用は、スタチンがコレステロール産生酵素HMG CoAの活性を阻害することで、急速に増殖する腫瘍において新しい細胞壁を産生するために利用できるコレステロールの量が少なくなることである。急速に増殖する癌細胞は、細胞膜を作るためにより多くのコレステロールを必要とする。(536, 537)コレステロールの利用可能性が減少すると、癌の増殖と転移に必要な細胞増殖が制限される可能性がある。さらに、スタチンは癌の生命を促進するタンパク質と死を促進するタンパク質のバランスを調節する遺伝子の発現を変化させ、癌細胞を死滅させる上で多くの利点があると考えられる。スタチンはカスパーゼを再活性化し、細胞死をプログラムするもう一つのタンパク質であるPPARγの産生をアップレギュレートすることも研究で示されている。スタチンはまた、細胞表面のGLUT-1グルコースレセプターの数を減少させ、利用可能なエネルギー量を制限することでがん細胞の活性を低下させる。さらに、スタチンによるHMGCRの直接阻害は、体内のイソプレノイドの貯蔵量を減少させる。イソプレノイドはがん細胞の増殖と転移を制御する上で重要な役割を果たす。(538)
臨床研究
親油性スタチンは多くの癌の発生率と全死因死亡率を減少させることが証明されている。Farwellらによる10年間のレトロスペクティブコホート研究では、降圧薬を服用している退役軍人の集団におけるスタチン使用を比較し、スタチン使用者は平均して前立腺がんの発生リスクが31%低いことが明らかになった。(539) NSAIDsは前立腺がんリスクを有意に低下させることが分かっており、前立腺がんを予防するためにスタチンと相乗的に作用する可能性がある。(540)
Nielsenらは、1995年から2007年の間にがんの診断を受けたデンマーク全人口の患者における死亡率を評価した。(541) この研究では、スタチン使用者の多変量調整ハザード比は、スタチンを使用したことのない患者と比較して、がんによる死亡で0.85(95%CI、0.82〜0.87)であった。スタチン使用者におけるがん関連死亡率の低下は、スタチンを使用したことのない患者と比較して、13のがん種で観察された。Zhongらは、がんと診断された後にスタチンを使用した患者では、非使用者と比較して全死因死亡率のHRが0.81(95%CI:0.72-0.91)であったことを示した;その有益性は大腸がん、前立腺がん、乳がんで最も顕著であった。(542)
前立腺がんと診断された後のスタチン使用について調べた集団ベースのレトロスペクティブコホート研究では(543)、診断後のスタチン使用は前立腺がん死亡率(HR、0.76;95%CI、0.66~0.88)および全死亡率(HR、0.86;95%CI、0.78~0.95)の低下と関連しており、投与期間が長く投与量が多いほど、死亡率および遠隔部位転移の発生率が低下した。
10件の研究のメタアナリシスでは、スタチンの使用は乳癌女性における無再発生存率(RFS;HR 0.64,95%CI 0.53-0.79)の改善と関連していた。(544)さらに、この生存ベネフィットは親油性スタチンの使用に限定されるようであった。同様に、AhernらはステージI-IIIの乳癌女性の集団研究を行い、親油性スタチン(最も一般的なのはシンバスタチン)を処方された女性では乳癌の再発が10%減少したことを報告している(545)。(545)同様に、大腸癌と肝細胞がんでは、スタチンの使用は癌特異的死亡率を低下させる。(546-548) 肺がんでは、スタチンが癌特異的死亡率を低下させることがレトロスペクティブ研究で示されている。(549)
スタチンが有効な癌の種類
乳癌、前立腺癌、大腸癌、肝細胞癌、肺癌、精巣癌、膵臓癌、胃癌、卵巣癌、白血病、脳腫瘍、腎臓癌。(422, 538, 541, 550)
13. ジスルフィラム
ジスルフィラム(DSF)は、アルデヒド脱水素酵素(ALDH)の阻害剤として、現在同定されているすべての細胞質およびミトコンドリアのALDHアイソフォームを阻害し、その結果、アルコールを摂取したときに不快な作用を引き起こすアセトアルデヒドを特異的に蓄積させるので、抗アルコール薬として機能する。最近、DSFは前臨床試験でがん治療薬として強力な効果を示したため、再利用されるようになった。
DSFの抗腫瘍効果は、多くの前臨床試験で報告されており、最近ではヒトの7種類のがん(非小細胞肺がん(NSCLC)、肝臓がん、乳がん、前立腺がん、膵臓がん、膠芽腫(GBM)、メラノーマ)に対して報告され、NSCLCとGBMの治療においてブレイクスルー成功を収めている。(551)
抗がん経路とメカニズム
DSFはNF-kBシグナル伝達、プロテアソーム活性、アルデヒド脱水素酵素(ALDH)活性を阻害する。DSFは小胞体ストレスとオートファジーを誘導し、放射線や化学療法の補助療法として用いられてきた。DSFは正常ながん細胞を殺すだけでなく、がん幹細胞も標的にする(552)。ジスルフィラムは核タンパク局在化タンパク4(NPL4)に結合し、その固定化と機能不全を誘導し、最終的に細胞死に導く。
DSFの細胞毒性は銅(Cu)に依存する(553)。DSFはがん細胞に浸透し、細胞内でCuをキレート化する。正常組織と比較して、多くのがんは細胞内の銅濃度が高い(2〜3倍)。(554)銅は酸化還元反応において重要な役割を果たし、活性酸素種(ROS)の発生を誘発する。DSF/Cuは活性酸素産生の強力な誘導剤であり、効果的なプロテアソーム阻害剤であるため、NF-κBを阻害する。NF-κBは強い抗アポトーシス活性を持つ活性酸素誘導転写因子であり、活性酸素のプロアポトーシス効果を低下させる(553, 555)。DSF/Cuは同時にROS-JNKプロアポトーシス経路を活性化し、NF-κBシグナルのような抗アポトーシス経路をダウンレギュレートする(556)。 (556)c BaxとBcl2タンパク質の比率の増加などの実行型カスパーゼの活性化は、内在性アポトーシス経路がDSF/銅によるアポトーシスに関与している可能性を示した(557)。二価の金属イオンキレーターとして、DSFは銅と複合体(DSF/銅)を形成すると考えられてきた。銅は細胞により取り込まれやすく、正常細胞を温存しながら、様々ながん細胞に対して細胞毒性作用を発揮する。銅とキレート化すると、DSFはDNA修復経路に関与するいくつかの遺伝子の発現を低下させる。
最近、ジスルフィラムやその代謝物と銅との結合が抗腫瘍効果をもたらすという仮説を検証する臨床試験が増えつつある。頭頸部扁平上皮がんを対象とした研究では、DSF/銅の注射は50mg/kgの濃度で腫瘍の成長を著しく阻害したが、DSF単独では銅と併用したDSFと比較して効果は限定的であった(558)。DSFは最終的に、主に自食細胞死を誘導することによって頭頸部がん細胞株に対して阻害効果を発揮し、異種移植モデルでは腫瘍の進行を抑制した。
DSFは試験管内試験で、乳がん、肺がん、膵臓がん、前立腺がん、肝臓がん、卵巣がん、急性骨髄性白血病、神経膠芽腫、メラノーマなど、いくつかのモデルがん細胞株に対して細胞毒性を示し、がん細胞にアポトーシスを効果的に誘導する。例えば、DSFはテモゾロミド抵抗性の膠芽腫(GBM)細胞の増殖を阻害するが(IC90=100nM)、正常なヒトのアストロサイトには影響を与えない。これらの古典的なテモゾロミド耐性細胞は、72時間にわたって腫瘍細胞の増殖を抑制するのに十分な濃度である500 nMのDSFに感受性を示し、これらの細胞の自己複製能も完全に阻害された(559, 560)。(559, 560)腫瘍関連マクロファージ(TAM)は腫瘍の進行と化学療法剤に対する抵抗性に影響する。
FROUNTはマクロファージに高発現しており、その骨髄特異的欠失は腫瘍の成長を阻害する。さらに、DSFはFROUNTの強力な阻害剤として働き、マクロファージの腫瘍促進活性を低下させる。(561)
前臨床試験において、DSFを他の従来の治療法と組み合わせて投与すると、癌に対して相乗的な治療効果を発揮する。生体内試験の研究によると、シスプラチン、テモゾロミド、シクロホスファミド、5-フルオロウラシル、スニチニブ、オーラノフィンなどの化学療法薬の活性はすべてDSFによって増強される(551)。
臨床試験
二重盲検試験において、64人の乳癌女性がジチオカルブナトリウム(ジエチルジチオカルバミン酸塩)またはプラセボで治療された(562)。6年後、ジチオカルブ群ではプラセボ群よりも有意に高い全生存率が観察された(それぞれ81対55%)。無病生存率は、ジチオカルブ群で76%、プラセボ群で55%であった。Ditiocarbは人体におけるDSFの主要代謝物であり、その作用機序に寄与している。
第2b相臨床試験において、シスプラチンとビノレルビンの併用療法にDSFを追加したところ、忍容性は良好で、新たに非小細胞肺癌と診断された患者の生存期間を延長した(563)。テモゾロミドにDSFと銅を追加したところ、膠芽腫患者の無病生存期間を延長したようである(564-566)。
ジスルフィラムが有効ながんの種類
DSFは、乳癌、肺癌、膵癌、前立腺癌、肝癌、卵巣癌、および急性骨髄性白血病、神経膠芽腫、黒色腫に有効である。DSFと銅は、神経膠芽腫の患者において、特に重要な役割を持つかもしれない。(551, 553)
投与と注意
DSFは安価であり、その忍容性と安全性は多くの患者に対する長年の臨床経験で実証されている。DSFは一般に、80mgを1日3回、または500mgを1日1回投与されるが、これが最大耐容量と思われる。(564, 566) 銅は1回2mgを1日3回投与する。(565)
14. シメチジン
抗がん経路とメカニズム
潰瘍や胃食道逆流症の治療によく使われるシメチジンは、4つの異なる抗腫瘍効果を持つことが証明されている: すなわち、抗増殖作用、免疫調節作用、抗細胞接着作用、抗血管新生作用である。(567)
抗増殖作用:マスト細胞の主要なメディエーターであるヒスタミンとその受容体(HR1-HR4)は、いくつかの悪性腫瘍で増加し、癌の生存、転移、TMEへの抑制細胞のリクルートと関連していた。マスト細胞とそのメディエーターは、以前から腫瘍の進行と転移に関連してきた。(568)
ヒスタミンを産生する酵素であるL-ヒスチジンデカルボキシラーゼ(HDC)は、試験管内試験でも生体内試験でも様々なタイプの腫瘍で発現している。腫瘍はまた、パラクリンおよび/またはオートクリン的にヒスタミンを大量に分泌することができる。ヒスタミンには、炎症作用や免疫学的作用を含む幅広い作用がある。4つのヒスタミン受容体、そのうちH2とH4はがん細胞の増殖、浸潤、血管新生に関与し、これらの生理学的作用を媒介する。H2受容体を遮断することにより、シメチジンは癌細胞の増殖を抑える。(567,569-571)さらに、シメチジンはカスパーゼ3レベルをアップレギュレートしてがん細胞のアポトーシスを誘導し、ビタミンCと併用すると相乗効果を発揮する(569) 。
免疫調節: シメチジンは骨髄由来幹細胞(MDSC)を殺し、Tregを減少させ、ナチュラルキラー細胞(NK)を増加させることが証明されている。ヒスタミンは、CD4+CD25+制御性T細胞(Treg)活性の上昇、樹状細胞(DC)抗原提示活性の低下、NK細胞活性の低下、骨髄由来抑制細胞(MDSC)活性の上昇を含む、がんにおける免疫抑制性腫瘍微小環境と関連している。(567, 572, 573). MDSCはH1-H3レセプターを発現しており、H1(H1RAセチリジンを使用)またはH2(シメチジンを使用)を遮断することで、これらの細胞の免疫抑制作用を逆転させることができるという試験管内試験および生体内試験の証拠がある(567, 573)。(567,573)シメチジンは、心肺バイパス手術を受けた患者において、シメチジンを投与していない対照群と比較して、NK活性の上昇を引き起こす。(567, 574)
さらに、結腸直腸がんおよび胃がん患者において、周術期のシメチジンはヒスタミンによるリンパ球増殖の抑制を逆転させ、腫瘍浸潤リンパ球(TIL)数を増加させることが証明されている(575, 576)。(575, 576)腫瘍浸潤リンパ球の増加は、これらの研究で予後の改善と関連しており、乳癌、卵巣癌、脳腫瘍、頭頸部癌など、他のいくつかの癌種においても重要であると考えられている。(567)
ヘテロ二量体サイトカインであるインターロイキン12は、主に単球とマクロファージによって産生され、Th1細胞の成長、増殖、活性を促進するため、細胞媒介性免疫の重要な誘導因子である(567)。IL-12の過剰産生は自己免疫疾患の病因に関与している可能性がある。ヒスタミンのH2受容体への結合は、IL-12の抑制とIL-10の産生亢進に関係し、免疫反応のTh1/Th2バランスのTh2優位へのシフトと関連している。研究では、シメチジンがヒト末梢血単核球においてこの効果を阻止することが示された。(567, 577-579)
抗細胞接着: シメチジンは、がん細胞のH2RA活性に影響を与えることなく、がん細胞が内皮細胞に接着する能力を阻害することが証明されている。(567)
抗血管新生: 血管新生は腫瘍の発生と進行を促進する。(569)マウスおよびラットの膀胱がんモデルから得られた証拠から、シメチジンの抗血管新生作用は、H2R/cAMP/PKA経路を介した血小板由来内皮増殖因子(PDECGF)および血管内皮増殖因子(VEGF)の発現低下と関連している可能性が示唆された。(567,569,575,580,581)TNF-αはTME内で様々な役割を果たし、いくつかの方法によって腫瘍の増殖を促進する。シメチジンはTNF-αをダウンレギュレートすることにより、抗血管新生作用を有する。(569)
臨床研究
がん患者におけるシメチジンの臨床的有用性に関するデータは限られている。研究のほとんどは、大腸手術を受けた患者の術後に行われたものである。(567)大腸癌の根治的外科的切除の補助としてシメチジンを処方した5つの研究(n=421)のCochraneメタアナリシスでは、統計学的に有意な全生存期間の改善(HR 0.53;95%CI 0.32〜0.87)が示された。(582)黒色腫患者の2つの小規模シリーズにおいて、シメチジンとインターフェロンの併用は、完全な退縮から部分的な退縮、病勢安定の延長までの臨床的奏効と関連していた。(583, 584) デンマークからの報告では、シメチジン400mgを1日2回、2年間経口投与した胃癌患者の全生存期間が評価された。この二重盲検試験では、181人の患者が手術直後にシメチジン群とプラセボ群に無作為に割り付けられた。生存期間中央値はシメチジン群で450日、プラセボ群で316日であった(p = 0.02)。(585) 1年後の相対生存率(シメチジン/プラセボ)は45%/28%であった。
シメチジンが有効な癌の種類
シメチジンは大腸癌(567, 575, 579, 586- 588)、黒色腫(567, 589)、胃癌(567, 570, 575, 576, 587)の患者に有益であると思われるが、この薬剤は膵癌(567、 590)、卵巣がん(567, 591)、前立腺がん(567) 、カポジ肉腫(567) 、唾液腺腫瘍(567, 592)、腎細胞がん(567, 589, 593, 594)、乳がん(567, 569, 595)、膠芽腫(567, 596)および膀胱がん(567, 581)の患者において、本薬剤が一定の効果を示す可能性がある。
投与量と注意事項
ほとんどの研究では、1回400mg、1日2回の標準用量が用いられている。シメチジンの副作用はほとんどなく、最も頻度が高いのは女性化乳房である。
15. ヤドリギ
ヨーロッパヤドリギ(Viscum album L.)は、樹木に半寄生して生育する常緑植物で、特にヨーロッパ大陸では、がん患者の治療に長い伝統がある。がん患者の多くが、病気や治療に関連した症状を軽減し、生活の質(QoL)を改善するために、ヤドリギエキスを補助的に使用している。(597)ヤドリギ抽出物は、ヨーロッパヤドリギの水性全植物抽出物であり、腫瘍学を適応症とする注射薬として製造・販売されている。ヤドリギ抽出物は、通常週に2~3回皮下投与される。また、統合腫瘍医によって静脈内投与されることもある。
抗がん経路とメカニズム
ヤドリギ抽出物は、がんのモデルにおいて、多くの抗腫瘍、抗アポトーシス、抗増殖、免疫調節効果を媒介する。ヤドリギには、レクチン、フラボノイド、ビスコトキシン、オリゴ糖や多糖類、アルカロイド、膜脂質などの生物学的に活性な分子が含まれている(598)。ヤドリギの正確な薬理作用様式は完全には解明されていないが、レクチンに焦点をあてた生物学的研究は増えつつある。レクチンは、ナチュラルキラーの細胞傷害性や活性化リンパ球の数を増加させるなど、多くの免疫学的活性を媒介し、抗酸化系を増加させ、ヤドリギは顆粒球マクロファージコロニー刺激因子(GMCSF)、インターロイキン5、インターフェロンガンマの産生を刺激した。(599, 600) ヤドリギエキスの細胞毒性作用は、タンパク質合成阻害、細胞周期阻害、アポトーシス誘導の結果であると報告されている(601, 602) Ben-Aryeらは、ヤドリギがシスプラチン感受性卵巣細胞と耐性卵巣細胞で有意な抗がん作用を示し、両方のがん細胞株で化学感受性を増加させることを示した(603)。(603)また、ヤドリギには血管新生阻害作用があることも示唆されている。
臨床研究
30以上のRCTを含む50以上の前向き研究で、がん患者におけるヤドリギの役割が評価されている。2008年に発表された21の研究を含むコクラン・レビューでは、QoL、パフォーマンス指数、症状尺度、化学療法の副作用軽減の点で有益性が示された(604)。2010年、KienleとKieneは、がん患者のQoLに対するヤドリギエキスの効果を評価した系統的レビューの結果を報告した(605)。 この研究には、26のRCTSと10の非RCTSが含まれている。研究の半数は、化学療法、放射線療法、手術とヤドリギの併用について検討したものであった。このレビューに含まれるほぼすべての研究で、ヤドリギはQoLを改善することが報告されている。2020年に発表されたLoefとWalachによる最新のメタアナリシスでは、ヤドリギ抽出物による治療後のグローバルQoLの標準化平均差をプールしたところ、SMD=0.61(95%CI 0.41-0.81、p<0,00001)であったと報告している(598)。著者らは、がん患者の生存に対するヤドリギの効果を評価する追加のメタアナリシスを行った(606)。RCTについて、ヤドリギの生存に対するプール効果推定値は、HR = 0.81 (95% CI 0.69-0.95, P = 0.01)であった。12のRCTを含むメタアナリシスでは、ヤドリギががんに関連した疲労を軽減することが示された(SMD -0.48; 95%CI -0.82 to -0.14; p = 0.006)(607)。進行がん患者を対象としたヤドリギ抽出物静注の第1相試験では、23.8%の病勢コントロール率(完全/部分奏効および病勢安定の割合)が示された。 8%であり、QoLの指標も改善した(608)。まとめると、ヤドリギはQoLを改善し、化学療法の忍容性を高め、腫瘍の制御と生存に利益をもたらす可能性があるとして、統合腫瘍医によって使用されている。
ヤドリギが有効な癌の種類
ヤドリギはほとんどの癌患者のQoLを改善する。ヤドリギは乳癌、膀胱癌、婦人科癌(子宮頸癌、子宮体癌、卵巣癌)、大腸癌、胃癌、膵臓癌、神経膠腫、頭頸部癌、肺癌、黒色腫、骨肉腫に使用されている。
服用と注意
ヤドリギの限界は、非経口的(皮下または静脈内)に投与されることであり、したがって、個別化された治療プロトコルの構成要素として使用される統合腫瘍専門医の監督下で投与されることである。(609)
16. ホスホジエステラーゼ5阻害薬:シルデナフィル、タダラフィル、バルデナフィル
シルデナフィル、タダラフィル、バルデナフィルなどの選択的ホスホジエステラーゼ5阻害薬は、勃起不全や肺動脈性肺高血圧症の治療に広く用いられている。これらの薬剤は癌治療にも有効である。
抗がん経路とメカニズム
硫化スリンダク(NSAID)によるPDE5の阻害は、ヒト乳癌細胞においてアポトーシスを選択的に誘導し、発癌性のWnt/β-カテニンを介する転写を減弱させる。(610)シルデナフィル投与は、がん細胞の増殖と生存率に重要な役割を持つセリンスレオニンキナーゼであるPKD2の分解を促進するシャペロンタンパク質であるHSP90の発現に影響を与える。(611)
シルデナフィルとタダラフィルは、アフラトキシンB1誘発肝細胞癌の発生と進行を抑制することが示された。(612)
PDE5阻害薬は、cGMPを介して上皮のホメオスタシスを変化させることにより、腸癌の発生率を低下させることができる。げっ歯類モデルでは、シルデナフィルを投与したマウスは、分化、増殖、炎症が少なく、ポリープ形成が少なかった。(613)
Boothらは、PDE5阻害剤が多くの細胞毒性剤と相加的以上に相互作用して細胞死を引き起こすことを示した(614)。(614)最も強力なPDE5阻害剤はシルデナフィルであった。この研究では、PDE5阻害剤と化学療法剤による治療がオートファジーを促進し、ベクリン1をノックアウトすることで薬物併用による致死率が約50%減少した。
さらに、セレコキシブ(非ステロイド性抗炎症薬)とPDE5阻害薬は、ヒト神経膠腫細胞を含む複数の腫瘍細胞を死滅させるために、相加的以上の相互作用を示すことが示された(615)。セレコキシブの効果はCOX2とは無関係であった。この薬剤の併用はmTORを不活性化し、オートファジーのレベルを上昇させ、JNK経路を活性化した。プラチナベースの化学療法剤とPDE阻害剤の併用は、プラチナ単剤療法よりも肺がん細胞に対する抗増殖効果が高い。(616) シルデナフィルとクルクミンの併用は、5-フルオロウラシルの結腸直腸腫瘍抑制効果を高める。(617)
シルデナフィルは、MDSCsのリクルートを阻害することにより、大腸腫瘍の発生を抑制する可能性がある。(618)シルデナフィルの投与は、原発性腫瘍や転移病巣に浸潤するMDSC数を減少させ、CD8+ T細胞を増加させた。(619)PDE5阻害剤はTregとがん幹細胞を減少させ、MDSCの機能を障害する。(619,620)Klutznyらは、PDE5阻害がPKAシグナル伝達の誘導を介して癌幹細胞を排除することを示した。(621)
臨床研究
192,661人の患者を対象とした研究で、PDE5阻害薬の使用は結腸癌の発症リスクの低下と関連することが示された(622)。 PDE5阻害薬の使用は、良性大腸新生物の男性における大腸癌リスクの低下と関連している。(177) 頭頸部扁平上皮がん患者を対象に実施された最近の2つの臨床試験では、タダラフィルは、MDSCs、制御性T細胞を減少させ、T細胞機能を改善することにより、腫瘍特異的免疫だけでなく、系統的な免疫応答性を高めることができると報告されている。(623, 624) Huangらは、大腸癌患者において、診断後のPDE5阻害薬の使用は、癌特異的死亡率の低下(調整HR=0.82,95%CI 0.67-0.99)、転移リスクの低下(調整HR=0.85,95%CI 0.74-0.98)と関連することを示した。(625) 2003年から2015年の間に根治的前立腺摘除術を受けた前立腺癌患者3100人のレトロスペクティブコホート解析において、患者はPDE-5阻害薬投与群と非投与群(対照群)に分けられた。この研究では、多変量解析により、PDE-5阻害薬の投与が生化学的再発および死亡のリスクの低下と関連することが示された。(626)
ホスホジエステラーゼ5阻害薬が有効な癌の種類
前立腺がん、乳がん、肝細胞がん、結腸直腸がん、肺がん、頭頸部がん、神経膠芽腫、白血病。(619)
用法と注意
シルデナフィル1日20mgまたはタダラフィル1日5mg。PDE5阻害薬は、硝酸塩投与中または非動脈炎性前部虚血性視神経症の既往歴のある患者には禁忌である。シルデナフィルは治療域が広いにもかかわらず、患者に重篤な心血管系の副作用を示すことがある。
第8章 :第2層の再利用薬-弱い推奨
17. 低用量ナルトレキソン(LDN)
ナルトレキソンはオピエート受容体拮抗薬で、オピエートの刺激を防ぐ。モルヒネやヘロインの娯楽的使用によって誘発される多幸感を防ぐため、オピエート中毒の治療薬として数十年にわたって使用されてきた。オピオイド中毒のためにナルトレキソンによる治療を受けているある患者において、ナルトレキソンから離脱する際に二次的な有意な効果が報告された。この患者グループは慢性炎症と自己免疫疾患を有しており、ナルトレキソンの低用量使用中に改善がみられたと報告している。また最近、低用量のナルトレキソン(LDN)の使用により癌が消失したという逸話的報告がある。(627)注目すべきは、LDNに対する反応に関するこれらの逸話的報告の多くが、単剤投与または通常他の薬剤との併用投与の両方で報告されていることである。
抗がん経路とメカニズム
1980年代に行われた生体内試験研究では、臨床的に一般的な用量である10mg/kgで投与されたマウスでは、オピオイド受容体の持続的な占有が誘導され、これが腫瘍増殖の増加と関連していたことから、全体的な効果を決定する上での用量の重要性が強調された(628)。(628)しかし、投与量を1mg/kgまたは0.1mg/kgに減らすと、受容体の遮断は不完全になった。そのため、外因性オピエートおよび内因性エンドルフィンの結合部位が利用可能となり、その結果、それらの抗腫瘍作用が活性化された。投与量に加えて、ナルトレキソンの投与スケジュールも重要であり、低用量ナルトレキソンの間欠投与が最大の抗腫瘍効果を示した。
すなわち、(a)IL-6抑制につながるtoll様受容体7-9を含むLDNが結合する受容体の拮抗作用、(b)患者の免疫機能の調節、(c)プロアポトーシス経路のプライミングを含む、がん細胞の制御に関与するシグナル伝達経路の直接阻害である。(627)
LDNには強力な抗炎症作用があり、免疫系のさまざまな要素を調節・修正するようである。免疫の各要素のモデルを用いた試験管内試験の研究では、ナルトレキソンが免疫細胞の細胞内シグナル伝達とそれに続くサイトカイン産生を変化させることが報告されている(627)。LDNを投与された患者では、G-CSF、IL-4、IL-6、IL-10、IFN-α、TNF-βなど、人為的炎症と細胞媒介性炎症の両方を引き起こすサイトカインの全身レベルが、8週間後に有意に減少した(629)。ナルトレキソンは、TLRに拮抗することによって末梢血単核球によるサイトカイン産生を阻害し、免疫反応を混乱させる可能性がある。(630) より具体的には、Liuらは、利用可能な炎症受容体のパネルをスクリーニングし、ナルトレキソンが免疫細胞上のTLR-9を完全にブロックし、TLR-7とTLR-8に若干の活性があることを確認した(627)。さらに、LDNによる培養後に樹状細胞(DC)上の成熟マーカーの発現が増加することが研究で示されているように、LDNはまた、専門的な抗原提示細胞の成熟を促進することによって、適応免疫応答を改善すると考えられている。(631)
ナルトレキソンを低用量で投与すると、細胞シグナル伝達を阻害することにより腫瘍の増殖を抑えることができる。μオピオイド受容体(MOR)は、非小細胞肺がんを含むいくつかのタイプのがんで発現が増加している。MORは癌の進行を制御する重要な因子である。In vitroモデルでMORを過剰発現させると、AktとmTORの活性化、細胞増殖、腫瘍増殖、転移が増加した(632)。(632)Liuらは、LDNの抗がん作用が、pERKとPl3-Kシグナル伝達の変化と一部関連していることを示した(633) 。Tripoldらは、オピオイドに暴露された乳がん細胞が、遊走の亢進と強いSTAT3の活性化を示し、これはアヘン受容体拮抗薬によって効率的に阻害されることを示した(634) 。(634)さらに、オピオイド治療は、E-カドヘリンのダウンレギュレーションと上皮間葉転換マーカーの発現増加をもたらした。
LDNは、細胞死を制御するプロアポトーシスタンパク質とアンチアポトーシスタンパク質のバランスを変化させる。具体的には、試験管内試験および生体内試験のモデルでは、LDNに短期間暴露されると、プロアポトーシスタンパク質であるBAXとBADがどのように増強されるかが示されている(627, 635)。(627, 635)LDNはオピオイド成長因子受容体(OGFr)拮抗薬として作用し、OGF-OGFr軸はヒトのがん細胞や組織に存在する抑制性の生物学的経路であり、ナルトレキソン低用量(LDN)による治療の標的となっている。 (636) In vitroモデルにおいて、Maらは、LDNがM1様マクロファージレベルを増加させ、アポトーシスを誘導するためにBax/Bcl-2/カスパーゼ-3/PARPシグナル伝達経路を活性化することにより、腫瘍サイズを縮小させることを示した(635)。
臨床研究
がん患者におけるLDNの有用性は、いくつかの症例報告と小規模のケースシリーズに限られている。症例報告では、肺腺がん、腺様嚢胞性舌がん(ビタミンD3との併用)、腎細胞がん(αリポ酸(ALA)との併用)、B細胞リンパ腫(ALAとの併用)、膵臓がん(ALAとの併用)患者におけるLDNの有用性が報告されている。(637-642)Lissoniらは、IL-2とLDNで治療した腎細胞癌患者9人において、4例の部分奏効と1例の病勢安定を報告している。(643)しかし、これらの患者はIL-2単独では病勢が進行していた。
LDNが有効な癌の種類
LDNは膀胱、乳房、肝臓、肺、リンパ節、結腸、直腸の原発性がん患者に対して有望な結果を示している(636)。
投与量と注意事項
1日2mg~4.5mgの投与が推奨される。2mg/日から開始し、4.5mg/日まで増量する。LDNの抗炎症作用が逆説的に低下するため、4.5mgを超えて増量すべきではない。さらに、がん患者の疼痛コントロールに従来量のアヘン剤を使用すると、発がん経路を活性化する可能性がある(634)。
18. ドキシサイクリン
抗がん経路とメカニズム
ドキシサイクリンとミノサイクリンは、より強力で活性が高く、安定した半合成テトラサイクリン系抗生物質として医療に導入された。一般に、ミノサイクリンとドキシサイクリンによる副作用の発生率は非常に低い。さらに、抗炎症作用、抗酸化作用、神経保護作用、免疫調節作用、抗がん作用など、抗生物質以外の多くの特性を示している(644, 645)。最近発表された研究や分析では、抗黒色腫薬としてのミノサイクリンとドキシサイクリンの再利用が検討されている(644, 645)。
ドキシサイクリンとミノサイクリンの抗がん活性のメカニズムには、STAT3リン酸化の減少、NF-ΚB活性化の防止、腫瘍壊死因子(TNF)α発現の抑制、マトリックスメタロプロテアーゼの阻害が関与している(645, 648)。ミノサイクリンとドキシサイクリンは抗黒色腫効果を発揮することが証明されている(645, 648)。これらの薬剤は、細胞増殖を阻害し、細胞生存率を低下させ、アポトーシスを誘導した(646, 647)。Rokらは、無色素性黒色腫細胞においても同様の所見を示した(644)。この研究では、処理によって細胞周期プロファイルに変化が起こり、細胞内の還元チオールレベルとミトコンドリア膜電位が低下した。さらに、メラノーマ細胞をミノサイクリンとドキシサイクリンに暴露すると、シトクロムcの放出が誘発され、イニシエーターとエフェクターのカスパーゼが活性化された。この研究では、ドキシサイクリンはミノサイクリンよりもこれらの抗がん作用において強力な薬剤であった。
ドキシサイクリンはメタロプロテアーゼの活性を阻害する。メタロプロテアーゼは細胞外マトリックスの分解に関与するため、個々のがん細胞は遊離し、体中に新たな転移性がんを増殖させる。メタロプロテアーゼに対するテトラサイクリンの強力な阻害作用を考慮すると、その抗がん作用については、メラノーマ、肺がん、乳がん、前立腺がんなど、さまざまながんで研究されている(649) 。(649)セレコキシブと併用すると、ミノサイクリンは腫瘍細胞死を増加させ、MMP-9とVEGFの腫瘍発現を減少させることにより、ヌード(ヘアレス)マウスにおける乳がんの骨転移を阻害した。(650)ミノサイクリンは、マウス腎腺癌の試験管内試験浸潤と実験的肺転移を阻害することが示されている。さらに、これらの薬剤は試験管内試験で非メタロプロテアーゼ依存性の機序で血管新生を阻害することが証明されている。(651)
Weilerらは、ミノサイクリンがTNF-αによって誘導されるがん細胞と乳房上皮細胞との融合を阻害することを証明した。ミノサイクリンは肝細胞癌の治療においてシスプラチンと相乗的に作用することが証明されている(652)。ミノサイクリンの抗増殖性および抗転移性は、腎腺癌、(653)乳癌、(650)悪性神経膠腫など、他の様々なタイプのがんでも証明されている。(654)
臨床研究
数多くの実験モデルがあるにもかかわらず、がん患者におけるこれらの薬剤の臨床的有用性を調査した公表された報告はない。
ドキシサイクリンが有効ながんの種類
臨床データがないにもかかわらず、ドキシサイクリンは以下のがんに臨床効果を示す可能性がある:黒色腫、腎腺がん、乳がん、前立腺がん、悪性神経膠腫。
投与量と注意事項
ドキシサイクリンの標準用量は1日100~150mgである。がん患者における治療期間は研究されていない;したがって、2週間を超えないコースが推奨される。重篤な副作用はまれで、最も一般的な副作用は頭痛と吐き気である。抗生物質はマイクロバイオームに影響を及ぼすため、ドキシサイクリンの長期投与は避けるべきである。
19. ウィートグラス
小麦の若草であるウィートグラスには、さまざまな健康効果があるとされている。クロロフィル、フラボノイド、ビタミンCとEが含まれる。ウィートグラスは、化学組成の70%を占めるクロロフィルを多く含むため、「緑の血液」とも呼ばれる(655)。また、ウィートグラスには抗酸化酵素であるスーパーオキシドジスムターゼとシトクロムオキシダーゼが含まれており、活性酸素を過酸化水素と酸素分子に変換する可能性がある。小麦若葉の形態には、フレッシュジュース、冷凍ジュース、錠剤、粉末などがあり、その組成は製造工程や小麦若葉の生育条件によって異なる。実験室での試験管内試験研究では、主に発酵小麦胚芽エキスを用いて抗がん作用が実証され、そのメカニズムとしてアポトーシスが挙げられている(656)。がん患者におけるウィートグラスの役割に関する臨床データは限られている。
結腸がん患者を対象とした研究では、抗がん剤治療に小麦胚芽エキスを6カ月間補充したところ、介入群で転移性疾患の再発と死亡率が低下したことが報告されている(657)。(657)この非盲検コホート試験では、抗がん剤治療と小麦胚芽エキスの併用と抗がん剤治療のみの併用が比較された。66人の患者が6カ月以上ウィートグラスサプリメントの投与を受け、104人の患者が対照となった。エンドポイント解析の結果、小麦若葉投与群では進行関連事象の発生頻度が有意に低かった: 新たな再発:3.0 vs 17.3%、P= 0.01、新たな転移:7.6 vs 23.1%、P= 0.01: 7.6対23.1%、P=0.01;死亡:12.1対31.7%、P=0.01)。生存期間分析では、無増悪生存期間(P=0.0184)および全生存期間(P=0.0278)に関して、コムギ群で有意な改善がみられた。ステージII-IIIの結腸直腸癌患者100人を対象とした対照前向き試験で、Avisarらは化学療法に加えて小麦若葉ジュースを毎日摂取することが、IL-6、IL-8、IL-10、IL-12を含む免疫パラメータと白血球数(WBC)に及ぼす影響を検討した(658)。この試験では、抗炎症性サイトカインIL-10濃度が小麦若葉群で有意に高く、WBC数の減少が小麦若葉群で有意に低かった。IL-10の濃度が高く、化学療法中のWBCの減少が抑制されたことは、標準治療の補助として小麦若葉を摂取した場合、免疫パラメーターに有益な効果があることを示す予備的証拠になるかもしれない。補助化学療法を受けている乳がん患者を対象とした研究では、ハトムギは好中球減少性発熱および好中球減少性感染症の減少と関連していた。(659)
第9章 :第3段階の再利用医薬品-曖昧なエビデンス
20. レスベラトロール
レスベラトロール(3,40,5-trihydroxy-trans-stilbene)は非フラボノイド系ポリフェノールで、ピーナッツ、ブドウ、ベリー類など多くの植物種に天然に存在する。(660)プテロスチルベンは、天然に存在するレスベラトロールの類似体である。
前臨床研究、臨床研究、疫学研究を含む多くの研究により、野菜や果物に多く含まれるポリフェノールを食事から摂取することで、がんを含む様々な疾患の発生を予防できる可能性が指摘されている。(660)レスベラトロールやその他のフラボノイド(ケルセチン、ウコン)には、数多くの抗がん作用がある。
抗がん経路とメカニズム
レスベラトロールはまた、様々な前臨床動物モデルにおいて重要な抗がん作用を有することが報告されている。(660)レスベラトロールは、細胞の増殖と分裂、炎症、アポトーシス、転移、血管新生を制御する多様なシグナル伝達経路に影響を与えることで、癌の発生と促進から進行に至るまで、様々な癌のステージに影響を与える。レスベラトロールは、試験管内試験で、骨髄性がん細胞やリンパ系がん細胞、乳がん、皮膚がん、子宮頸がん、卵巣がん、胃がん、前立腺がん、結腸がん、肝臓がん、膵臓がん、甲状腺がんなど、さまざまなヒト腫瘍細胞に対して細胞毒性作用を示すことが示されている(660-663)。
試験管内で行われた研究では、レスベラトロールがアポトーシスを誘導することによって抗増殖活性を発揮することが発見された。レスベラトロールはサイクリンとサイクリン依存性キナーゼ(CDK)のバランスを変化させ、G0/G1期の細胞周期を阻害する。(664)レスベラトロールはp53依存性経路の活性化を引き起こす。(665)レスベラトロールによるBcl-2ファミリーの抗アポトーシスタンパク質の阻害と、Bad、Bak、Baxなどのプロアポトーシスタンパク質の活性化は、カスパーゼ活性化とシトクロムc放出のメカニズムであることも示されている。(666)レスベラトロールは、PI3K/Akt/mTOR経路を阻害し、マイトジェン活性化プロテインキナーゼ経路(MAPK)を調節し、NF-ΚBの活性化を阻害することによって、アポトーシスを誘導することも示されている。(660)レスベラトロールはまた、シグナル伝達物質と転写活性化因子3(STAT3)の阻害を引き起こし、そのアポトーシス促進能と抗増殖能をさらに高める。(667)さらに、レスベラトロールはがん幹細胞を抑制する可能性がある。(668)
フラボノイドは抗酸化物質として、炎症メディエーターの制御に重要な制御酵素や転写因子を阻害する。さらに、DNAと相互作用してゲノムの安定性を高めることにより、細胞の酸化ストレスを調節する。(391)レスベラトロールはまた、核内因子E2関連因子2(Nrf2)の活性化を通じて、抗酸化酵素と第二相解毒酵素の活性と発現を増強する。
前臨床研究では、炎症に関連した癌の進行に対するフラボノイドの有効性が実証されている。(391)腫瘍細胞における炎症と血管新生との関連から、フラボノイドが血管新生と腫瘍転移を減少させることが実験モデルで証明されている。
レスベラトロールは、MMP(主にMMP-9)とVEGF、EGFR、FGF-2などの血管新生マーカーの発現を阻害することにより、転移の広がりを抑制することが示唆されている。(660, 669). ルテオリンは、HIF-1α/VEGFシグナル伝達と血管新生を標的とする強力な能力を示した。(670)
レスベラトロールは、がん細胞の多剤耐性を逆転させることができ、臨床的に使用されている薬剤と併用すると、標準的な化学療法剤に対してがん細胞を感作することができることが報告されている(660)。(660)さらに、レスベラトロールはGTCと併用することで、がんに対して相乗作用を示す可能性がある。
臨床研究
レスベラトロールは優れた抗がん作用を示しているが、研究のほとんどは細胞培養や前臨床モデルで行われたものである。さらに、レスベラトロールの生物学的利用能の低さは、その効果をヒトに外挿する上で重要な問題である。(660)
レスベラトロールが有効な癌の種類
レスベラトロールは、乳癌、前立腺癌、結腸直腸癌、肝細胞癌、膵臓癌、肺癌、卵巣癌の患者において抗癌作用を有する可能性が高い。(660)
投与と注意
レスベラトロールの生物学的利用能を高めるために、様々なアプローチが考案されており、様々な食品と一緒に摂取する、追加の植物化学物質であるピペリンと組み合わせて使用する、プロドラッグアプローチ、微粉化粉末、ナノテクノロジー製剤を使用するなどがある。(660) レスベラトロールは、1回500mgを1日2回摂取することが推奨されている。イタドリ由来のトランスレスベラトロールを含むバイオ強化製剤は、生物学的利用能が改善されているようである。
21. シクロオキシゲナーゼ阻害剤-アスピリン(ASA)とNSAIDs(ジクロフェナク)
20種類以上の非ステロイド性抗炎症薬(NSAIDs)があり、化学構造によって6つの主要クラスに分類されている。NSAIDsの主な作用は、シクロオキシゲナーゼ(COX)を阻害し、アラキドン酸からプロスタグランジン、プロスタサイクリン、トロンボキサンへの変換を阻害することである。COX阻害は、アスピリンと非サリチル酸系NSAIDsの作用機序の中心である。
COX酵素にはCOX-1とCOX-2という2つのアイソフォームがある。COX-1はほとんどの組織で発現しているが、その発現量にはばらつきがあり、「ハウスキーピング」酵素と呼ばれ、正常な細胞プロセスを制御している。COX-2は高度に制御された酵素で、脳、腎臓、骨で恒常的に発現している。その発現は炎症時に増加する。酵素阻害の程度はNSAIDsの種類によって異なる。特定のNSAIDがシクロオキシゲナーゼのアイソフォームを阻害する程度は、その活性と毒性の両方に影響する。
NSAIDsには、好中球の活性化阻害、誘導性一酸化窒素合成酵素(iNOS)の発現阻害、核因子(NF)-κβの活性化阻害、Erkキナーゼの活性化阻害など、COX阻害以外の作用機序もある。化学予防におけるアスピリン(ASA)や非ステロイド性抗炎症薬(NSAIDs)の使用には長い間関心が持たれてきたが、現在では、このような薬剤が治療の場においても活性を示す可能性があるという新たな証拠も出てきている。
アスピリン
アスピリンはアセチルサリチル酸(ASA)としても知られ、鎮痛、解熱、抗血小板作用を含む広範な薬理作用を示すNSAIDである。低用量(通常75~81mg/日)はシクロオキシゲナーゼ(COX)-1を不可逆的にアセチル化する。この作用は血小板のトロンボキサンA2の生成を阻害し、抗血栓作用をもたらす。中用量(650mg~4g/日)は、COX-1およびCOX-2を阻害し、プロスタグランジンの生成を阻害し、抗炎症作用、鎮痛作用、解熱作用を示す。高用量(4~8g/日)は、リウマチ性疾患における抗炎症薬として有効である;しかし、これらの高用量におけるアスピリンの有用性は、耳鳴り、難聴、胃不耐性などの毒性によって制限される。ASAの1日325mg投与は、心血管系および脳血管系の保護という点では、少なくとも1日75mg投与と同程度の効果があるようである。さらに、75-325mgの低用量範囲では、安全性に差はないようである。 白血球、内皮細胞、粘膜細胞、血管平滑筋細胞はCOX-2を発現している。COX-2を選択的に標的とすると、血管の炎症部位でプロスタグランジン、特にプロスタサイクリンが抑制される。癌において、アスピリンが有益であると考えられる機序は、癌細胞そのものに対する直接的な阻害作用から、血小板と腫瘍細胞の相互作用を減少させたり、血管新生因子や増殖因子、サイトカイン、ケモカインの血小板分泌を減少させるなどの抗血小板作用まで多岐にわたる。(672)炎症性で抗アポトーシス性の腫瘍微小環境内の悪性腫瘍は、COX-1とCOX-2を異常に発現していることが示されている(673, 674)。したがって、アスピリンはCOXに関連した炎症とアポトーシスの阻害によって抗腫瘍効果を発揮する可能性がある。例えば、卵巣がんにおけるCOX-1とCOX-2の相対的発現は、がんの組織学的悪性度とサブタイプによって異なることが示されている(674)。674)さらに、IκBキナーゼβや細胞外シグナル調節キナーゼによるシグナル伝達の抑制を含む、COXとは独立したメカニズムが示唆されており、炎症と増殖の抑制につながる(676, 677)。
臨床研究
1991年に発表されたCancer Prevention Study IIでは、662,424人の患者コホートにおいて、アスピリンの常用に関連した結腸癌死亡率の40%減少が示された(678)。 その後 2003年にNew England Journal of Medicine誌に発表された2つの試験では、大腸癌の二次予防における低用量アスピリン(81〜325mg/日)の明らかな有用性が示された(679, 680)。 これらの試験の後に否定的な研究が続いたため、問題はより複雑になり(681, 682) 2007年にU.S. Preventive Services Taskforce (USPSTF) は、がん予防のためにアスピリンを日常的に使用することに反対するよう勧告した(683)。
USPSTFの勧告の直後、心血管疾患に対するアスピリンのプロスペクティブ試験の大規模なメタアナリシスが発表され、がん罹患率と死亡率の両方に対するアスピリンの明らかな有益性が明らかになった(135, 684)。(135,684)2016年、USPSTPはその立場を翻し、50~69歳の成人は低用量アスピリン(1日325mg以下と定義)の予防的使用から実際にがんベネフィットが得られると述べた(685) 。(685)しかし、がんの既往歴のない患者における有益性は小さく、大出血のリスクがそれを上回った(686)。
これに続いたのが、2018年に発表されたARRIVE試験である。ARRIVE試験には平均年齢64歳の約13,000人の患者が登録された。ARRIVEの患者は、腸溶性アスピリン100mgまたはプラセボに無作為に割り付けられ、平均5年間追跡された。
癌発生率の差は有意ではなかったが、プラセボに有利であった。(687)1カ月後に発表されたASPREE試験は、ARRIVE試験よりも大規模で、癌のリスクが高いと推定される高齢者集団が登録され、19,114人の患者が腸溶性アスピリン100mgとプラセボに無作為に割り付けられた。(688, 689) 意外なことに、アスピリンは全死因死亡率の増加(HR, 1.14; 95%CI,1.01-1.29)と関連していたが、これは主に癌による死亡の増加(HR, 1.31; 95%CI,1.10-1.56)によってもたらされた。
最新のUSPSTFガイドラインでは、アスピリンの使用は心血管疾患死亡率および全死因死亡率の低下とは関連していなかった。(690)大腸癌に関する研究は非常に不均一であったが、RCT期間内に発生した事象に限ってみると、低用量アスピリンは5〜10年の追跡調査において大腸癌発生率と統計的に有意な関連を示さなかった。まとめると、大腸癌予防におけるアスピリンの役割は不確実である。
癌予防におけるアスピリンの役割を支持する臨床的証拠は、リンチ症候群患者を対象としたCAPP2試験で示されたように、大腸癌の高リスク者において最大である(691)。しかし、他のいくつかのがん種においても示唆的なエビデンスがある。慢性ウイルス性肝炎患者では、低用量アスピリンの使用で肝細胞癌の発生率が低かった(692)。アスピリンの使用は膵臓癌のリスク低下と関連しているかもしれない。(693, 694)さらなる研究がなされるまでは、がん予防のためのアスピリンの使用は特定の高リスク患者に限定される。
がんの治療におけるASAの役割は、がんの予防と同様に矛盾している。観察研究では、ASAの使用による生存優位性が示される傾向がある;しかし、この有益性は前向き研究では再現されていない。18の異なるがんを対象とした70の研究を含む観察研究において、Elwoodはアスピリンががん死亡の20%減少に関連すると報告している(HR 0.79;95%信頼区間:0.73-0.84)。(695) Wangらは、診断後の低用量アスピリン使用に関連するがん特異的死亡の全リスクを推定するために、65,768人の患者を対象とした13の発表済みコホート研究を評価した(696)。 著者らは、がん特異的死亡率の有意な低下を報告し、そのオッズ比(OR)は0.84(95%CI 0.75-0.93)であった。しかし、これらの所見はプロスペクティブ臨床試験では再現されていない。(697,698)ABC試験は、高リスクHER2-2陰性乳癌の術後補助療法としてのアスピリンに関する無作為化第3相二重盲検プラセボ対照試験である。この試験では、3,021人の患者が5年間、1日300mgのアスピリンまたはプラセボに無作為に割り付けられた。(698)アスピリンとプラセボを比較した浸潤性無病生存期間のHRは1.27であり、事前に規定した無益性のHRを上回った。
非ステロイド性抗炎症薬(ジクロフェナク)
ジクロフェナク(DCF)はよく知られ、広く使用されている非ステロイド性抗炎症薬(NSAID)であり、腫瘍学的に注目される様々な作用を有する。(699)NSAIDsの種類によってCOX-1/COX-2選択性にかなりの差があり、DCFが他の一般的に使用されている薬剤とは異なるメカニズムでCOX-2に結合するという証拠もある。(700)DCFはチバガイギー社によって開発され、現在ではジェネリック医薬品として世界中で入手可能である。一般的な商品名には、Voltaren、Voltarol、Cataflam、Cambia、Zipsor、Zorvolexなどがある。一部の国では、経口DCFの低用量製剤(通常25mg錠)が市販されている。米国では、DCFは処方箋が必要であり、25mg、50mg、75mg、100mgの遅延放出錠として入手可能である。
COX-2およびプロスタグランジンE2合成の強力な阻害剤であるDCFは、免疫系、血管新生カスケード、化学療法および放射線感受性、腫瘍代謝に対してさまざまな作用を示す。PGE2は様々なタイプの癌に認められ、腫瘍の微小環境に見られる慢性炎症と関連している。(701)
抗がん経路とメカニズム
DCFの多様な抗がん作用を説明するために、複数の作用機序が仮定されている。これらには、抗血管新生作用、免疫調節作用、アポトーシス促進作用、血小板機能への影響、Mycおよびグルコース代謝への影響、治療感受性の亢進などが含まれる。さらに、NSAIDsはホスホジエステラーゼ(PDE)5阻害とcGMPシグナル伝達の活性化に関連しており、これらは腫瘍細胞のアポトーシス誘導能と密接に関連している。(610)
実験モデルでは、DCFが腫瘍の血管新生を減少させることが証明されており、これはPGE2合成の減少と関連していた。(702)1つのメカニズム的説明は、PGE2がVEGFの産生をアップレギュレートするというものである。(703)実験モデルでは、DCFはVGEFと単球走化性タンパク質(MCP-1)の両方の発現を減少させた。 704)PGE2は、多くのがん動物モデルにおいて、骨髄幹細胞のMDSCへの分化を誘導することが示されている。PGE2が減少すると、PGE2-MDSC拡大の正のフィードバックループが破綻する。(705)自己腫瘍モデルにおいて、PGE2合成の遮断はMDSCsによるARG1発現と活性酸素産生のダウンレギュレーションをもたらし、次いで抗腫瘍T細胞機能の改善とがん化学予防をもたらすことが示されている。(706, 707)
Fujitaたちは、神経膠腫のマウスモデルにおいて、COX-2遮断がPGE2産生を抑制し、腫瘍の進行を遅延させることを示した(708)。(708)これは、MDSCの蓄積の減少と細胞傷害性Tリンパ球の存在の増加と関連していた。選択的COX阻害剤と非選択的COX阻害剤の両方を用いた腫瘍誘導性PGE2の減少は、T-regの集団と活性を減少させることが示されている(709)。(709)DCFはマウス膠芽腫モデルにおいて、T-regの腫瘍内蓄積と活性化を減少させることができた。(710)血管新生と免疫抑制の調節に加えて、癌におけるDCFのアポトーシス促進作用のメカニズムについても、いくつかの証拠がある。(699, 711)COX阻害剤としての作用とは別に、DCFが腫瘍の代謝に影響を与えるという証拠もある。
Gottfriedたちは、DCFが試験管内試験および生体内試験メラノーマモデルにおいて、多くの白血病、前立腺癌、メラノーマ細胞株でMyc遺伝子発現とグルコース代謝をダウンレギュレートすることを示した(712)。
Wnt β-カテニン/Tcfシグナル伝達経路の調節異常は、腫瘍の進行に寄与する。Sareddyらは、ジクロフェナクとセレコキシブがWntβ-カテニン/Tcfシグナルの活性化を抑制することにより、膠芽腫細胞に対する潜在的な治療薬であることを示した(713)。(713)DCFは、従来の化学療法剤だけでなく、他の補助療法剤とも相乗的に作用すると考えられる。実際、Gerhoferはメトホルミンとジクロフェナクの併用療法が脳腫瘍発生細胞に対して相乗的な抗移行・抗増殖効果を示すことを示した(714)。
臨床研究
試験管内試験および生体内試験でのさまざまな結果とは対照的に、DCFの抗がん剤としての使用に関する臨床データは比較的少ない。Forgetたちは、温存手術を受けた乳癌患者を対象に、術中非ステロイド性抗炎症薬(DCFまたはケトロラク)を使用した場合と使用しなかった場合のレトロスペクティブ解析を報告した(715) 。(715)切開前にケトロラク(20mg-30mg)またはDCF(75mg)を投与した患者では、NSAIDsを投与しなかった患者と比較して、無病生存率(HR=0.57,95%CI:0.37-0.89、P=0.01)と全生存率(HR=0.35、CI:0.17-0.70、P=0.03)が改善した。(716) しかしながら、この研究結果はプロスペクティブRCTでは再現されなかった。(717)
ジクロフェナクが有効ながんの種類
限られたデータしかないが、ジクロフェナクは以下の腫瘍に有効である;(699)デスモイド腫瘍、炎症性筋線維芽細胞腫瘍、神経芽細胞腫、骨肉腫、頭頸部がん、食道がん、乳がん、卵巣がん、非小細胞肺がん。
投与量と注意事項
ジクロフェナクとして75~100mg/日の投与が推奨される。強力なCOX2阻害剤として、DCFは消化性潰瘍疾患のリスクを高める可能性がある。このため、DCFは消化性潰瘍の治療/予防に使用されるシメチジンと併用することを推奨する;この薬物の併用は相乗的な抗がん作用を有する可能性が高い。NSAIDsは、心筋梗塞や脳卒中などの重篤な心血管血栓性イベントのリスクを増大させ、致命的となる可能性がある。ジクロフェナクは冠動脈バイパス手術の際には禁忌である。しかし、メタボリックシンドロームを管理する(そしてTG/DHL比を最適化する)介入はこのリスクを軽減する可能性がある。
22. ニゲラサティバ
抗がん経路とメカニズム
ニゲラサティバに含まれる主要な生理活性物質であるチモキノン(TQ)は、抗炎症作用と化学療法作用を有し、細胞増殖を抑制し、がん細胞死を増加させ、細胞の浸潤と転移を防ぎ、血管新生を阻害することができる。TQは、腫瘍細胞増殖のシグナル伝達経路に関与するいくつかの上流チロシンキナーゼ(MAPK、Akt、mTOR、PIP3など)のリン酸化とそれに続く活性化を阻害する。(718-720)
TQの抗がん作用には、核因子(NF)-κB、ホスホイノシチド3キナーゼ(PI3K)/Akt、ノッチ、トランスフォーミング増殖因子(TGF)-β、c-Jun N-末端キナーゼ(JNK)が主に関与している、 およびp38マイトジェン活性化プロテインキナーゼ(MAPK)シグナル伝達経路、ならびに細胞周期、マトリックスメタロペプチダーゼ(MMP)-9発現、ピルビン酸キナーゼアイソザイムタイプM2(PKM2)活性の調節に関与する。(718,719,721-725)さらに、TQは、細胞保護酵素(グルタチオンS-トランスフェラーゼ、スーパーオキシドジスムターゼ、オキシドレダクターゼなど)をアップレギュレートし、発癌物質代謝酵素(CYP 1A2、CYP 3A4など)をダウンレギュレートし、炎症性メディエーター(サイトカイン、ケモカイン、プロスタグランジンなど)の産生を抑制することにより、化学予防特性を示す。(719, 721, 726)
臨床研究
残念ながら、がん患者におけるニゲラサティバの効果を調査した臨床研究は発表されていない。
ニゲラサティバが有益と考えられるがんの種類
In vitroおよび生体内試験の実験結果から、ニゲラサティバは卵巣がん、(719, 727, 728)骨髄芽球性白血病およびその他の血液がんを含む様々な悪性腫瘍に対して抗がん作用を有する可能性が示唆されている、 (729)子宮頸がん、(720, 730, 731)結腸がん、(720, 726, 732-734)肝がん、(726, 735-738)前立腺がん、(718, 739)乳がん、(718, 732, 734)腎がん、(720, 740)膵がん、(718, 725, 741)肺がんなどである。(718, 732, 742, 743)
服用と注意
患者には、種子(80mg/kgを1日1回)またはカプセル化されたオイル(400~500mgを1日2回)を摂取するよう指示することができる。妊娠中のNigella sativaの安全性は確立されておらず、おそらく避けるべきである。
23. 霊芝(Ganoderma lucidum)およびその他の薬用キノコ類
霊芝、ツガエ霊芝、スパラッシス・クリスパ、ツボクサ霊芝、ツボサイ霊芝、トラメツボクサ霊芝など、50種類以上のキノコが薬用キノコとして使用されている。rhinoceros、Trametes robiniophila Murill、Coriolus versicolor、Lentinus edodes、Grifola frondosa、Flammulina velutipesなどであり、試験管内試験、生体内試験、ヒトの悪性腫瘍において、抗がん作用や免疫調節作用を持つ潜在的な免疫補助食品が生産されている。(744)
最も研究が進んでいるのは霊芝である。β-グルカン多糖類とトリテルペンが霊芝に含まれる生理活性化合物である(745)。
抗がん経路とメカニズム
アントロキノノール、コルジセピン、ヒスポロン、レクチン、クレスチン、多糖類、硫酸化多糖類、レンチナン、マイタケDフラクションは、キノコから発見された主な抗がん化合物である(744)。 これらの化合物の治療効果には、がん細胞増殖の抑制、オートファジーと貪食の誘導、免疫系反応の改善、およびプロアポトーシス因子のアップレギュレーションとアンチアポトーシス遺伝子のダウンレギュレーションによるアポトーシス細胞死の誘導が含まれる。(746)カスパーゼ-3、-8、-9、AKT、p27、p53、BAX、BCL2、NF-kB経路、mTOR(747) の発現が、これらの活性に有意に関与していた。(746, 748)
キノコに由来する生理活性物質は、免疫細胞の成熟、分化、増殖に影響を与えることで免疫系を刺激および/または制御し、がん細胞の拡散と増殖を防ぐ。(745)キノコから発見された最も強力な抗がん・免疫調節化学物質は多糖類である。(745)病原体認識レセプターに結合することで、キノコから生成される化学物質は免疫細胞を刺激し、がん細胞に対して細胞媒介性または直接的な細胞毒性を引き起こす。(745, 749, 750)さらに、キノコ由来の化合物は、単球、マクロファージ、NK細胞、B細胞(745, 748-753)に影響を与えることによって、がんに対する免疫監視を強化し、自然免疫および適応免疫を誘導する。(744)キノコ化合物の摂取はまた、直接細胞傷害性Tリンパ球(CTL)による抗腫瘍サイトカインの分泌と免疫器官の活性化を促進し、それによってがん細胞を排除し、弱体化した免疫システムを強化する。(745, 751)
PI3K/Akt経路、Wnt/カテニン経路、MAPK経路など、特定のシグナル伝達経路の単一分子を制御したり、同一または異なるシグナル伝達経路に多くの標的を持つことで、キノコ化合物は抗がん作用の可能性を示す。PD-1/PD-L1とCTLA-4/CD80の相互作用に注目した研究では、多剤耐性(MDR)を逆転させる単独治療薬や補助治療薬としてのキノコ由来成分の有効性が実証されている(745)。 さらに、薬用キノコのプレバイオティクスの利点は、腸内マイクロバイオームの回復に役立つ可能性がある。(745)
パイロトーシスと呼ばれる新しい炎症性のプログラム細胞死は、実行タンパク質のガスデルミンが細胞膜に孔を作り、細胞を溶解させて内容物を排出させることで定義される。(751,754)カスパーゼ3を活性化し、さらにガスデルミンE(GSDME)タンパク質を切断して細胞膜に孔を作ることで、霊芝エキス(GLE)はパイロトーシスを引き起こし、乳がん細胞に多くの炎症因子を放出する。(751)GLEは、接着、遊走、浸潤、コロニー形成、血管新生など、腫瘍転移の多段階を阻害する。(751)
臨床試験
大腸腺腫患者を対象とした試験において、水溶性霊芝エキス(1.5g/日、12カ月間投与)は、介入群では対照群と比較して腺腫の数と全体の大きさを有意に減少させた。(755)5.4g/日の霊芝は、進行大腸がん患者において免疫調節作用を持つことが実証された。(756)霊芝多糖体製剤を摂取した進行がん患者は、ナチュラルキラー細胞活性の増加を示した。(757)文献のレビューにおいて、Huberらは、薬用キノコは従来のがん治療中および治療後のQOLを改善すると報告している。(758)
霊芝やその他の薬用キノコが有効である可能性のあるがんの種類注目すべきは、キノコ抽出物が乳がんに対して最も強い抗がん作用を持つことである。(744, 745, 759)キノコは、大腸がん、(744, 745, 747, 758, 759)子宮頸がん、卵巣がん、子宮内膜がん、(744, 758, 759)肺がん、(744, 758)星細胞腫、(759)膀胱がん、(744, 759)食道がん、(759)線維肉腫、(759)胃がんに対しても活性がある可能性がある、 (744,759)膠芽腫、(759) 肝細胞がん、(744,745,759)腎臓がん、(759) 喉頭がん、(759) 白血病、(744,759)黒色腫、 (745,759)神経芽細胞腫、(759) 口腔がん、(759) 膵臓がん、(759) 前立腺がん、(744,759)肉腫、(759) 皮膚表皮がん。(759)
摂取量と注意事項
1日6~12gの霊芝エキスを摂取することが推奨されている。(760) 霊芝には抗血小板作用があるため、特に抗凝固剤と併用した場合、出血のリスクを高める可能性がある。
24. イベルメクチン
イベルメクチンはマクロライド系抗寄生虫薬で、河川盲目症、象皮病、疥癬など多くの寄生虫疾患の治療に広く使用されている。大村智とウィリアム・C・キャンベルは、寄生虫症に対するイベルメクチンの優れた有効性の発見により、2015年のノーベル生理学・医学賞を受賞した。イベルメクチンは1978年にFDAによってヒトへの使用が承認された。近年、科学者たちはイベルメクチンに強い抗がん作用があることを発見した。イベルメクチンは、複数のシグナル伝達経路を制御することにより、いくつかの腫瘍細胞の増殖を阻害することが報告されている(761, 762)。
抗がん経路とメカニズム
イベルメクチンが複数の乳がん細胞株の増殖を阻害することが、実験データによって示された(763) 。(イベルメクチンによるAkt/mTOR経路の阻害がオートファジーを誘導するメカニズムである。イベルメクチンは、Wnt経路の阻害に関連する細胞周期を阻害することにより、イヌの乳がん細胞株の増殖を阻害することが実証されている。(764) Wnt経路阻害剤をスクリーニングした研究では、イベルメクチンはWnt経路を阻害することにより、大腸がん細胞を含む複数のがんの増殖を阻害し、アポトーシスを促進した。(765)活性型WNT経路を示し、イベルメクチンによって阻害される他のがんには、肺、胃、子宮頸部、子宮内膜、肺のがん、メラノーマ、グリオーマなどがある。(765)
トリプルネガティブ乳がん(TNBC)は、エストロゲン受容体、プロゲステロン受容体、ヒト上皮成長因子受容体2(HER2)が陰性のがんを指し、乳がんの中で最も侵攻性が高く、予後が最も悪いサブタイプである(766)。また、現在、臨床応用可能な治療薬もない。TNBCを対象とした薬剤スクリーニング研究では、イベルメクチンがSIN3相互作用ドメインを阻害することにより、試験管内試験ではクローン自己複製を阻害し、生体内試験では腫瘍増殖と転移を抑制することが示された(767)。イベルメクチンはオートファジー経路を通して抗腫瘍効果を発揮する。オートファジー阻害剤のクロロキンやワートマニンを用いたり、siRNAでBclin1やAtg5をノックダウンしてオートファジーを阻害すると、イベルメクチンの抗がん活性は著しく低下した。(763)
イベルメクチンは、主にミトコンドリア経路を介してがん細胞のアポトーシスを誘導する。(761) Chenらは、イベルメクチンがミトコンドリア依存性の経路を介して食道扁平上皮がん細胞の生存率を阻害し、アポトーシスを誘導することを示した。(768)熱ショックタンパク質27(HSP27)は、多くのがんで高発現し、がん遺伝子の発現をサポートしている。
イベルメクチンは、MAPKAP2を介するHSP27のリン酸化と解重合を阻害し、HSP27が制御する生存シグナル伝達とクライアントとタンパク質の相互作用を阻害する。(769) Chenらは、イベルメクチンがミトコンドリア依存的に食道扁平上皮肉腫細胞の生存能力を阻害し、アポトーシスを誘導することを示した。さらに、Sharmeenらは、イベルメクチンが白血病細胞において塩化物依存性の膜過分極と細胞死を誘導することを示した。(770)
イベルメクチンは、腫瘍微小環境に影響を与えることによって抗がん活性を示す。イベルメクチンはMDSCとTregを減少させ、がん幹細胞を標的とする。(151,771)さらに、イベルメクチンはTAMの作用を抑制する作用があり、TAMはそうでなければ、多くの経路、特にTGF-βを介して腫瘍のアポトーシスを抑制するように作用する異常なサイトカインシグナルを産生し、p53腫瘍抑制遺伝子の発現もアップレギュレートする。
臨床研究
多くの試験管内試験研究で複数のがんに対するイベルメクチンの有効性が証明されているが、臨床的有効性は小規模なケースシリーズに限られている。(772, 773)
イベルメクチンが有効ながんの種類
イベルメクチンは、乳がん(TNBCを含む)、肺がん、胃がん、子宮頸がん、食道がん、子宮内膜がん、肝臓がん、前立腺がん、腎臓がん、卵巣がん、胆管がん、黒色腫、白血病、リンパ腫、神経膠腫に対して試験管内試験で活性を示している。(761)
投与と注意
イベルメクチンの最適な投与戦略は不明である。De Castroらは、難治性AMLの3人の小児患者において、1mg/kg/日を最長6カ月間使用したが、副作用はなかったと報告している(772)。 Ishiguroらは、イベルメクチン12mgを週2回使用したことを報告している。(773)
25. ジピリダモール
抗がん経路とメカニズム
ジピリダモールは血管拡張薬であり、抗血栓薬である。その主な作用は、ヌクレオシドの取り込みを阻害し、ホスホジエステラーゼを阻害することで、細胞内のcAMPレベルを上昇させることである。ジピリダモールは非選択的ホスホジエステラーゼ5阻害剤である。(619) いくつかの研究から、試験管内試験で、ジピリダモールは様々な化学療法剤の細胞毒性および抗腫瘍活性を有意に増加させることが示されている。(774) さらに、血小板が腫瘍細胞と相互作用して凝集塊を形成し、転移形成に寄与している証拠がある。がん細胞と血小板の相互作用は血小板の活性化と血小板の転移促進活性を引き起こす(775)。その結果、血小板凝集を阻害する薬剤は腫瘍の転移を防ぐ可能性がある。(776)
マウストリプルネガティブ乳癌モデルにおいて、ジピリダモールは原発性腫瘍の増殖と転移形成を有意に減少させた。(774)この研究では、ジピリダモールの効果はWnt、ERK1/2-MAPK、NF-kB経路によって媒介された。さらに、ジピリダモールは原発性腫瘍における腫瘍関連マクロファージ(TAM)と骨髄由来抑制細胞(MDSC)の浸潤を有意に減少させた。分子シャペロンHSP90は抗癌剤開発の有望なターゲットと考えられてきた。ジピリダモールは、HSP90とホスホジエステラーゼとの結合を介した細胞周期制御因子のダウンレギュレーションとアポトーシス細胞シグナルのアップレギュレーションによって、ヒトがん細胞の成長と増殖を阻害する。(777)
臨床研究
ジピリダモールは多くの小規模臨床試験で細胞毒性薬と併用されてきた。(778-781)これらの試験におけるジピリダモールの有益性の有無を確かめるのは難しい。
26. 高用量ビタミンC静注
高用量ビタミンCのがん治療への使用は、ノーベル賞受賞者ライナス・ポーリングの研究によるところが大きく、1970年代にさかのぼる(782)。 1970年代初め、キャメロンとポーリングは、アスコルビン酸は血清中の生理的ヒアルロニダーゼ阻害剤の内在性産生を増強し、それによって癌細胞の拡散を防ぐことができると主張する論文を発表した。(783) 1976年、これらの著者らは、100人の末期がん患者に日常管理の一環としてアスコルビン酸(10gを10日間静脈内投与し、その後10gを経口投与)を補充し、マッチさせた1,000人の対照群と比較した観察症例対照研究の結果を発表した(784)。この研究では、アスコルビン酸塩を投与した被験者の平均生存期間が4倍以上長いことが示された。CameronとPaulingが得たデータを受けて、Creaganらは1979年、進行がんと末期がん患者123人を対象に、症状の重症度と生存率に対するビタミンC(経口投与で1日10g)の効果を評価する無作為化対照二重盲検試験を行った(785)。この研究では、アスコルビン酸塩投与群と対照群との間で生存期間に差はなく、ビタミンC効果の欠如が証明された。同様に、Moertelらは100人の進行大腸癌患者を対象とした二重盲検プラセボ対照試験で、ビタミンC(経口10g)の有益性を証明できなかった。(786)
CreagenらとMoertelらの研究により、その時点でビタミンCの癌への使用は実質的に終了した。しかし、これらの研究は経口ビタミンCを用いたものであり、キャメロンとポーリングの研究を再現したものではないことを理解すべきである。その後、ビタミンCは約500mgの投与で飽和するビタミンCトランスポーターを通して腸から吸収されることが確立された。
2004年、Padayattyらは、1.25gのビタミンCを経口投与した場合、180umol/lのピーク濃度が得られることを示した。その後、ミリモル濃度のビタミンCはがん細胞に対して毒性があり、そのような濃度は静脈内投与によってのみ達成できることが証明された(788-791)。
逆説的であるが、ビタミンCは経口投与では強力な抗酸化作用を持つが、静脈内投与で達成されるミリモル濃度のビタミンCは酸化作用を持ち、これが癌細胞に対する細胞毒性作用の主な原因である。(313)リポソーム型ビタミンCは静脈内投与と同じような血清中濃度を示すと広く宣伝されているが、この主張は誤りであり、リポソーム型ビタミンC製剤は経口投与された通常のビタミンCとほとんど同じ血清中濃度を示す。(792-795)
抗がん経路とメカニズム
Benadeらは、アスコルビン酸の主な細胞毒性機序が、ビタミンCの酸化に伴って生成される過酸化水素(H2O2)の細胞内生成と関連していることを最初に提唱した(796)。これは、がん細胞がグルコースに対する代謝的必要性の増加により、グルコーストランスポーター(GLUT)の関与する促進輸送により、正常細胞に比べて選択的に多くのアスコルビン酸を取り込むために起こる。カタラーゼはH2O2を酸素と水に分解する。がん細胞におけるカタラーゼ活性は、正常細胞の10~100倍低く、アスコルビン酸に対して過敏になっている。(796)
Yunらは、KRASやBRAFに変異のある培養ヒト大腸癌細胞を高濃度のビタミンCに暴露すると選択的に死滅し、その効果はGLUT1グルコーストランスポーターを介したデヒドロアスコルビン酸(DHA)の取り込みの増加に起因すると報告している(797) 。(797)細胞内では、DHAはGSH、NADH、NADPH依存性酵素によって還元され、グルタチオン、チオレドキシン、NADPHの枯渇を招き、細胞内酸化ストレスを増大させる。細胞内の活性酸素蓄積はグリセルアルデヒド3-リン酸デヒドロゲナーゼ(GAPDH)を不活性化し、解糖系アデノシン5′-三リン酸(ATP)とピルビン酸の生成を減少させ、細胞死を誘発するエネルギー危機を引き起こす。(797) ビタミンCを非経口投与した実験ネズミでは、H2O2産生の増加だけでなく、タンパク質合成、細胞周期の進行、血管新生に関与する遺伝子の発現の変化、HIF-1とVEGFのレベルの低下も観察された。(782)
臨床研究
癌の完全寛解や転移病変の減少の症例報告があるが(798-800)、単回抗癌剤治療として高用量IVCを投与した症例シリーズでは有益な結果は得られていない(782, 801, 802)。(782, 801, 802)
In vitroおよび動物実験では、ビタミンCと多くの化学療法剤および放射線療法との併用投与が相乗的に作用し、腫瘍の縮小と生存期間の延長をもたらすことが証明されている(803)。(803)これらの所見は、現在までに行われた小規模の臨床試験では再現されていない。(782, 804, 805)第3相RCTでは、高用量ビタミンCと化学療法の併用は優れた効果を示さなかった。化学療法との併用療法は、転移性大腸癌患者の一次治療として化学療法と比較して優れた無増悪生存期間を示さなかった(806)。以上のことから、高用量ビタミンCの静脈内投与は、有望で安価な抗癌剤治療の選択肢であり、現在のところ支持的な臨床データは限られているが、臨床試験でさらに検討されるべきである。
投与量と注意点
高用量ビタミンCの静脈内投与は、適切な予防措置を講じる限り、比較的良好な安全性プロファイルを有すると考えられているが、一部の患者では重篤な副作用を引き起こすこともある(782)。グルコース-6-リン酸デヒドロゲナーゼ(G6PD)欠乏症の患者には、血管内溶血を起こす危険性があるため、ビタミンCのグラム投与は禁忌である。
27. ジクロロ酢酸(DCA)
ワールブルグ効果は、がん細胞がピルビン酸デヒドロゲナーゼ複合体(PDC)と呼ばれる重要な酵素複合体を不活性化することによって一部媒介される。ピルビン酸はグルコース(解糖)から誘導され、ミトコンドリアの酸化的リン酸化の主燃料となる。ミトコンドリアのPDCはピルビン酸をアセチルコエンザイムAに不可逆的に脱炭酸し、解糖とトリカルボン酸サイクルを結びつけ、細胞の生体エネルギーの決定的なステップとなる。(807)がん細胞は、ピルビン酸デヒドロゲナーゼキナーゼ(PDK)をアップレギュレートすることによってPDCをオフにする。がん細胞におけるPDCの阻害は、代謝リプログラミングの重要なステップである。
解糖阻害剤ジクロロ酢酸(DCA)はPDKを阻害する。DCAによるPDKの阻害は、癌細胞における解糖の減少をもたらし、癌細胞はミトコンドリアにおける酸化的リン酸化をATPの主な供給源として使わざるを得なくなる(807, 808)。(DCAには、保護的オートファジーの誘導、低酸素誘導因子(HIF-1)と血管新生の抑制、がん幹細胞の根絶など、他の抗がん作用もある(807, 808)。(807)メトホルミン、クルクミン、フェンベンダゾール、イベルメクチン、ドキシサイクリンは相乗的に作用し、DCAの有効性を高める。(773,809)チアミンとαリポ酸はともにPDCの補酵素であり、DCAとの併用が日常的に推奨されている。
臨床試験
切除されていない局所進行頭頸部扁平上皮がんに対する化学放射線療法とジクロロ酢酸塩の併用による第2相研究では、治療終了時の完全奏効率はプラセボ群と比較してDCA群で有意に高かったことが報告されている(71.4% vs 37.5%、p=0.03);しかしながら、生存成績は群間で有意差はなかった。(810)DCAで治療された転移性黒色腫、結腸癌、非ホジキンリンパ腫患者の「長期安定化」が症例報告で証明されている。(811-813)
ジクロロ酢酸塩が有効ながんの種類
非ホジキンリンパ腫、結腸直腸がん、子宮内膜がん、乳がん、神経膠芽腫、肺がん、膵がん、胃がん、肝細胞がん、多発性骨髄腫。
投与量と注意事項
1日1,000mgまたは1日3回500mgの経口投与が推奨されている。神経毒性はDCAの可逆的な副作用としてよく知られており、末梢神経障害が最も一般的な症状である。重篤な脳症も報告されており(814)、DCAによる治療を受けている患者を注意深く監視することが示唆されている。
DCAは栄養補助食品として入手可能であるが、配合薬としての使用はFDAによって中止された。FDAは、有益性の証拠と、適切に投与されなかった場合の潜在的な毒性に関する懸念は、承認された化学療法や他のがん治療薬の使用を支持する証拠を上回るものではないとの見解を示した。
28. カンナビノイド
カンナビスは古来より癒しのハーブとして使用されており、現在多くの国で娯楽用および薬用として承認されている。がんおよびがんに関連した副作用の治療におけるカンナビスおよびカンナビノイドの使用については、一般の関心が非常に高い。
米国、カナダ、イスラエルで実施された調査では、さまざまな悪性診断を受けた患者における大麻使用の有病率は18%から40%であった。(815)がん治療におけるカンナビノイドの有効性に対する一般の熱意にもかかわらず、カンナビノイドの使用を支持する証拠は矛盾しており、議論の余地がある(816) 。
カンナビス・サティバ植物には400種類以上の化学化合物が含まれている。そのうちの100種類以上が炭素数21のテルペンフェノール系カンナビノイドである。主な精神作用成分であるデルタ-9-テトラヒドロカンナビノール(THC)は、雌株の花から滲み出る樹脂に最も高濃度で含まれている。ドロナビノールとナビロンは、1986年以来、化学療法による悪心・嘔吐の治療薬として認可・承認されているデルタ-9-THC製剤である。
人体にはCB1とCB2という2つのカンナビノイド受容体が同定されている。これらは7回膜貫通型Gタンパク質共役型受容体である。(815)CB1受容体は、ヒトの脳内で最も密に存在する受容体の一つである。CB2受容体は当初、マクロファージと脾臓の辺縁帯で検出され、Bリンパ球とナチュラルキラー細胞で高濃度に検出された。受容体はすべての動物種で同定されている。
動物がこれらの受容体を持っているのは、大麻を使用するためではなく、内因性オピオイドと同様に内因性カンナビノイドも存在するからである。エンドカンナビノイドとカンナビノイド受容体のシステムが存在する理由は、痛みの調節を容易にするためであることが示唆されている。
経口摂取されたカンナビスは、バイオアベイラビリティが低く(6~20%)、変化しやすい。(816)吸入した場合、カンナビノイドは血流に速やかに吸収され(ピーク濃度は約2~10分、30分間急速に低下する)、精神作用のある11-OH代謝物の生成は最小限に抑えられる。喫煙は依然として最も一般的で最速の投与経路であり、急性症状の治療に特に有用である。天然カンナビノイドまたは合成カンナビノイドまたはカンナビノイド類似体をベースとする薬剤は数多くある。(816)ドロナビノール(Marinol®、Mariette GA)は9-テトラヒドロカンナビノール(THC)であり、食欲増進薬、制吐薬、鎮痛薬として使用される。ナビロン(Cesamet®、カリフォルニア州アリソビエホ)は、天然のTHCより10倍強力な経口合成THCアナログであり 2006年に化学療法による悪心・嘔吐の適応で承認された。Nabiximolsは、THCとカンナビジオール(CBD)を混合した口腔粘膜スプレー剤である。
大麻は、乱用の可能性が高く、医療上の適応が限定されているスケジュールI物質として、米国連邦政府のステータスを維持している。カンナビノイドは、成人における化学療法誘発性の吐き気と嘔吐の治療、および成人における食欲増進に有効であることが実証されている(10)。 デルタ-8-THCは、化学療法を受けている小児において有効な制吐薬であると報告されている。(817)23のランダム化比較試験を含む2015年に発表されたコクラン・レビューでは、大麻ベースの医薬品は難治性の化学療法誘発性の吐き気と嘔吐の治療に有用である可能性があると結論づけられている。(818)実施された制吐療法の研究のほとんどは、医療用大麻治療とプラセボまたはさまざまな神経遮断薬とを比較したものであった。しかしながら、これらの研究では、化学療法誘発性の悪心・嘔吐の治療における燻煙大麻の潜在的役割として、カンナビノイドと抗嘔吐性の新薬との比較は行われていない。
したがって、大麻は従来の制吐療法が無効であった場合にのみ、制吐薬として処方されるべきである。(816) 実際、米国臨床腫瘍学会は専門家パネルを招集し、「化学療法や放射線療法を受けているがん患者の吐き気や嘔吐の予防に医療用大麻を推奨するには、まだエビデンスが不十分である」と結論づけた(819)。
慢性的なオピオイド投与にもかかわらず鎮痛効果が不十分ながん疼痛患者177人を対象とした無作為化プラセボ対照試験では、THC/CBD投与群はプラセボ投与群と比較して統計学的に有意な疼痛軽減を示したが、THC投与群は有意な改善を示さなかった。(820)THC/CBDを服用した患者の2倍は、プラセボと比較して、ベースラインの痛みの数値評価尺度(NRS)スコアから30%以上の減少を示した。THC/CBDスプレーの長期使用は一般的に忍容性が高く、長期使用によるがん関連疼痛の緩和効果の消失は認められていない。(821)進行がんでオピオイド抵抗性の疼痛を有する患者を対象とした無作為化二重盲検プラセボ対照漸増投与試験では、低用量(1~4スプレー/日)のナビキシモールが疼痛コントロールに有効であることが証明された。(822)しかし、2つの二重盲検無作為化プラセボ対照第3相試験では、最適化されたオピオイド療法では軽減されない慢性疼痛を有する進行がん患者において、nabiximols(Sativex®)は自己報告による疼痛NRS(Numerical Rating Scale)スコアの低下においてプラセボに対する優位性を示さなかった。(823)
試験管内試験や動物モデルから、カンナビスやカンナビノイドが抗腫瘍活性を有するというエビデンスが得られているが、ヒトにおける有用性についてはまだ説得力がない。(815)カンナビノイドはCB1受容体と複合体化することで、直接的な殺腫瘍効果を発揮する。この相互作用はオートファジーとアポトーシスの増加をもたらす。さらに、カンナビノイドは血管内皮増殖因子を阻害し、血管新生を阻害し、腫瘍の生存率を低下させることが証明されている。In vitroの研究では、カンナビノイドがマトリックスメタロプロテアーゼ-2を阻害することも明らかにされている。したがって、カンナビノイドはいくつかのメカニズムによって腫瘍の成長と増殖を阻害する可能性があることが前臨床試験で示唆されている。
大麻を使用しているがん患者の40%近くが、大麻が自分のがんを治療すると信じており、ソーシャルメディアを通じてオンラインで数多くの逸話的報告が共有されている。症例報告は査読付き学術誌に掲載されているが、抗癌の主張を検証するための重要な臨床情報が欠けていることが多い。Guggisbergらは、査読付き学術誌に掲載された症例報告をレビューし、抗がん作用を支持するエビデンスの質に基づいて、weak、moderate、strongのいずれかに評価した(824)。 合計77のユニークな症例報告が、大麻を使用した様々ながん(乳がん、中枢神経系がん、婦人科がん、白血病、肺がん、前立腺がん、膵臓がん)の患者について記述していた。著者らの評価では、症例報告の14%が強い、5%が中等度、残りの81%が弱いと考えられた。彼らは、臨床データのレビューから、発表された査読済みの症例報告のほとんどは、抗癌剤としての大麻の主張を支持するには不十分なデータであることが示唆されると結論づけた。しかし、Likarらは、最大限の切除に続いて放射線化学療法を行うという標準的な治療手順にCBDを1日量400mg併用投与した膠芽腫患者9人のケースシリーズを報告している(825) 。(825)追跡調査終了時までに、1人を除くすべての患者が生存しており、平均生存期間は22.3カ月であった。
Guzmanらは、多形性膠芽腫の再発患者9人にTHCを腫瘍内に投与するパイロット第1相試験を行った。(826)カンナビノイド投与開始からのコホートの生存期間中央値は24週間であった。D9-テトラヒドロカンナビノールを2人の患者に投与したところ、試験管内試験での腫瘍細胞増殖が抑制され、腫瘍細胞の免疫染色が減少した。Twelvesらは、第1b相RCTにおいて、GBMの初回再発患者を対象に、nabiximols口腔粘膜カンナビノイドスプレーと高用量テモゾロミド併用療法を検討した。(827)1年後の生存率はナビキシモルズ投与群で83%、プラセボ投与群で44%であった(p = 0.042)。
まとめると、臨床データは矛盾しているが、カンナビノイドは癌患者、特にGBM患者の生存期間を延長する可能性がある。したがって、エビデンスの現状では、大麻の広範な使用を推奨することはできない。(816)しかし、THC/CBDスプレーの使用は、進行がんでオピオイド抵抗性の疼痛を有する患者には有用であろう。
カンナビノイドはまた、難治性の化学療法誘発性の悪心・嘔吐の患者にも有用であろう。
29. フェノフィブラート
1975年に第3世代のフィブラート系薬として臨床導入されて以来、フェノフィブラートは高コレステロール血症および高脂血症の治療に広く用いられている。フェノフィブラートの脂質低下作用は、ペルオキシソーム増殖剤活性化受容体α(PPARα)の刺激によってもたらされると考えられている。最近では、PPARα特異的アゴニストが、急性骨髄性白血病、慢性リンパ性白血病、肝臓、卵巣、乳房、皮膚、肺などの固形がんを含むヒトのがんで抗がん作用を示すことが報告されている(828)。 フェノフィブラートは、アポトーシス、細胞周期停止、浸潤、遊走に関与する様々な経路を介して抗がん作用を示す可能性がある。フェノフィブラートは、乳がん、肝臓がん、神経膠腫、前立腺がん、膵臓がん、肺がんなど、いくつかのヒトがん細胞株で抗腫瘍効果を示した。フェノフィブラートは、アポトーシスと細胞周期停止を誘導することにより、乳癌MDA-MB-231細胞株の増殖を阻害することが見出された。フェノフィブラートは、Badの発現を増加させたが、Bcl-xLとSurvivinの発現は減少させ、カスパーゼ-3を活性化させた(829)。フェノフィブラートはまた、p21、p27/Kip1のアップレギュレーション、サイクリンD1とCdk4のダウンレギュレーションにより、G0/G1期での細胞周期停止を誘導した。NF-κB経路の活性化は、フェノフィブラートによるアポトーシス誘導に重要な役割を果たしていた。
フェノフィブラートは、ヒト肝細胞がんHepG2細胞の生存率を、一部壊死細胞死によって低下させることが立証されている(830)。フェノフィブラートはまた、肝がん細胞の細胞周期停止を引き起こすこともある。フェノフィブラートは、ヒト膠芽腫細胞株において細胞増殖を有意に阻害し、アポトーシスを誘導した。(831)さらに、この薬剤は、おそらくCD133の発現を減少させることにより、神経膠腫幹細胞(GSC)の浸潤を明らかに減少させた。フェノフィブラートはまた、Fork-head box(FOX)ファミリーへの影響を通して細胞増殖を阻害することができる。(832)FOXは転写因子のファミリーで、細胞の成長、増殖、分化、長寿に関与する遺伝子の発現制御に重要な役割を果たしている。低濃度のフェノフィブラートは、アンドロゲン依存性前立腺がん細胞株において、細胞周期停止とアポトーシスを誘導した。(833)
フェノフィブラートの抗がん作用を支持する実験データがあるにもかかわらず、この薬剤の使用を支持する臨床データはない。
30. パオペレイラ
パオ・エキスは、アマゾンの熱帯雨林に生育する樹木Geissospermum vellosii Allemao(パオ・ペレイラとして親しまれている)の樹皮から抽出されたエキスで、南米のインディアン部族によって薬として使用されてきた。1990年代、ミルコ・ベルヤンスキーは、試験管内でパオエキスがメラノーマや膠芽腫細胞に対して抗がん作用を示したと報告している(834, 835)。 フランスの元大統領フランソワ・ミッテランは、転移性前立腺がんに対してパオエキスで治療し、やや成功したようである(6)。
その後、パオエキスはいくつかのがん細胞株に対して評価された。Changらは、パオエキスがアポトーシスと細胞周期の停止を誘導することで、去勢抵抗性前立腺がん(CRPC)の細胞増殖を用量と時間に依存して抑制することを示した(836)。さらに、パオエキスは、プロアポトーシスBaxのアップレギュレーションを誘導し、抗アポトーシスBcl-2、Bcl-xL、XIAPの発現を減少させ、これらはPARPタンパク質の切断と関連していた。さらに、パオ抽出物処理はCRPC細胞の遊走と浸潤を阻害した。
Chenらは、薬用植物であるPao Pereira(Pao)とRauwolfia vomitoria(Rau)からそれぞれ抽出した2種類の植物エキスについて、卵巣がん幹細胞に対する活性を調べた(837) 。(837)パオもラウもヒト卵巣癌細胞株の全体的な増殖を抑制し、正常な上皮細胞に対する細胞毒性は限られていた。さらに、パオとラウの両投与は卵巣癌幹細胞集団を有意に減少させた。核内β-カテニンレベルは減少し、Wnt/β-カテニンシグナル伝達経路の抑制を示唆した。同様に、Dongらは、パオの抽出物がヒト膵臓がん細胞株の増殖を抑制し、正常上皮細胞に対する細胞毒性は限定的であることを示した。(838)
Bemisらは、パオペレイラ抽出物がヒト前立腺がん細胞株(LnCaP)の細胞増殖を用量依存的に有意に抑制し、アポトーシスを誘導することを示した(839)。さらに、LNCaP細胞を異所性に異種移植した免疫不全マウスに、パオペレイラエキスまたはビヒクルコントロールを6週間にわたって毎日投与した。Yuらは、パオペレイラが卵巣がん細胞の増殖を選択的に阻害することを示した。(840)パオは用量および時間依存的にアポトーシスを誘導した。パオはカルボプラチンの細胞毒性を大幅に増強した。さらに、Paoをカルボプラチンと併用すると、腫瘍抑制率は97%に達し、腹水は完全に消失した。同様に、これらの著者らは、ゲムシタビンとの併用で相乗効果を示す膵臓細胞株に対する活性を示した(841)。
試験管内試験および動物モデルのデータにもかかわらず、患者におけるPao Pereiraの安全性と有効性を裏付けるヒトでのデータはない。
第10章 :第4段階 再利用医薬品-推奨しない
31. サメ軟骨
1992年にW・レーンの『サメはがんにならない』が出版されて以来、サメ軟骨は1990年代の新しい「がん治療薬」として注目された。1995年には、サメ軟骨製品の世界市場は年間3,000万米ドルを超え、通常は食品サプリメントとして、数十種類の製品が市場に出回っている。(842)
粗悪なサメ軟骨エキスを癌の治療薬として宣伝した結果、サメの個体数が激減し、効果的な癌治療から患者が遠ざかるという、少なくとも2つの重大なマイナス結果を招いた。(843)
サメにガンがないことが、その使用を正当化する重要な理由となっている。(843)この治療法の支持者は、サメの体積の大部分は軟骨であるため、サメの軟骨に含まれる何かが、この動物にガンが少ない理由であるに違いないと考えている。したがって、患者がこの軟骨(おそらく粉砕して錠剤にしたもの)を任意の量摂取するだけで、がんは退縮するという主張である。この説明は単純で表面的には魅力的であり、無害な物質ががんを除去できるという希望を与えてくれる。残念なことに、サメ軟骨の効能に関する主張は、対照臨床試験から得られた客観的データによって全く裏付けされていない。
サメ軟骨の抗腫瘍作用のメカニズムとしては、直接的または間接的な血管新生阻害が提案されている。シュモクザメの軟骨から2つの糖タンパク質、スフィルナスタチン1と2が単離され、強い血管新生阻害活性と腫瘍の新生血管を阻害することが報告されている(844)。
Millerらは、進行がんの治療におけるサメ軟骨の安全性と有効性を評価する第1/II相臨床試験を行った(845)。 60人の患者に、1日1g/kgのサメ軟骨を3回に分けて経口投与した。5人の患者は胃腸毒性またはサメ軟骨に対する不耐性のため試験を中止した。12週時点の進行性病変は27例にみられた。完全奏効(CR)や部分奏効(PR)は認められなかった。
全試験集団における腫瘍進行までの期間中央値は7+/-9.7週であった。進行期癌患者において、サメ軟骨はQOLに何ら影響を及ぼさないと結論された。16.7%の病勢安定率は、支持療法のみで治療された進行癌患者の結果と同様であった。
North Central Cancer Treatment Group試験では、標準治療を受けている乳がんまたは大腸がん患者を対象に、サメ軟骨製品または同じ外観と香りのプラセボを毎日3~4回投与する群に無作為に割り付けた。(846)合計83人の評価可能な患者のデータが解析された。標準治療+サメ軟骨製品投与群と標準治療+プラセボ投与群との間で、全生存期間に差はなかった。同様に、サメ軟骨を投与された患者は、プラセボを投与された患者と比較して、QOLの改善が示唆されなかった。
32. レトリル(アミグダリン)
アミグダリンは、ビターアーモンドやモモなど、いくつかの食用植物の種子に含まれる天然の青酸配糖体である。ビターアーモンドは古来より、発熱や頭痛の治療(瀉下作用による)、利尿剤として用いられてきた。(847) アミグダリンは2分子のグルコースと、ベンズアルデヒドとシアン化水素の各1分子からなる。アミグダリンの抗がん活性は、酵素的に放出されたHCNと非加水分解シアノゲン配糖体の細胞毒性作用に関係していると考えられている。
1952年、Ernst Theodore Krebs, Jr.は、アミグダリンにグルコースのサブユニットを1つ加えた、より害の少ないアミグダリン誘導体を合成し、これをLaetrileと呼んだ。アミグダリンとその改良型の混合物は、文字通りの意味ではアミグダリンもレトリルもビタミンではないが、クレブスによって「ビタミンB17」と表現された。 (847) 1977年、米国FDAは、レトリルの安全性と有効性の証拠がないことを示す声明を発表した。アメリカとヨーロッパでは、アミグダリンとレトリルの販売は禁止されている。
アミグダリンに由来するレトリルは、30年以上前から癌治療の補完代替自然療法(CAM)として使用されてきた。一方では、この化合物は試験管内試験で抗がん作用を示すが、酵素分解やシアン化水素の産生により毒性を示すことがある(847)。さらに、がん細胞株に対する抗がん活性を証明する研究があるにもかかわらず、アミグダリンの抗がん活性に関する臨床的証拠は確立されていない。さらに、アミグダリンへの高用量曝露はシアン化物毒性を引き起こす可能性がある。(847)
In vitroの細胞培養研究では、がん治療に有益と思われるいくつかのアミグダリン活性が示されている。例えば、アミグダリンにはアポトーシスタンパク質とシグナル伝達分子を制御する能力があり、これが腫瘍増殖の減少の説明となる可能性がある。アミグダリン投与は、ヒトDU145およびLNCaP前立腺がん細胞において、Baxの発現を増加させ、Bcl-2の発現を減少させ、カスパーゼ-3の活性化を誘導し(848)、内因性ミトコンドリア経路を介するHeLa子宮頸がん細胞のアポトーシスを誘導し(849)、フォーカルアドヒージョンキナーゼ(FAK)の活性化とβ1インテグリンの調節を介して、UMUC-3およびRT112膀胱がん細胞の接着と遊走を減少させた(850)。 試験管内試験での抗がん作用は臨床データでは支持されていない。
1982年、レトリルを投与された178人のがん患者の臨床試験がNew England Journal of Medicine誌に発表された(851)。(851)がんの治癒、改善、安定化、がんに関連した症状の改善、寿命の延長という点では、実質的な利益は観察されなかった。アミグダリン治療の危険性は、何人かの患者でシアン中毒の症状によって証明された。論文は次のように結んでいる: 「アミグダリン(レトリル)は有毒な薬物であり、癌治療としては効果がない。2007年に発表されたシステマティックレビューでは
2007年に発表されたシステマティックレビューには36の研究が含まれ、そのどれもが、「レトリルの有効性を証明するものではなかった」(849)2015年に発表されたコクランのシステマティックレビューでは、組み入れ基準を満たす研究を特定できなかった。(852)このレビューの著者は、「レトリルまたはアミグダリンががん患者に有益な効果をもたらすという主張は、現在のところ、確かな臨床データによって裏付けられていない」と結論づけた。
第11章 :潜在的な補助療法
腫瘍治療野
腫瘍治療磁場(TTF)は、Optune®システムを介して交互に電場を照射する非侵襲的な抗有糸分裂療法である(853)。TTFは100~400kHzの交流電界で、2組の直交するトランスデューサーアレイを用いて腫瘍に経皮的に照射する。トランスデューサー・アレイは1秒ごとに順次作動し、標的への入射電界の方向を変化させる。(854)TTFの作用機序には、分極可能な細胞内構造と分裂破壊が関与している。TTFは細胞周期停止につながる有糸分裂紡錘体集合チェックポイントの停止を誘導し、次いで有糸分裂のスリップ、それに続く細胞死や老化を引き起こす(854)。さらにTTFは、AMPK、miR29b、その他のオートファジーのドライバーを誘導することにより、オートファジーを促進する。TTFは、STING経路の活性化、樹状細胞上のMHC ll、CD80、CD40の発現の増加、M1マクロファージの極性化などの免疫学的効果を持つ(854)。(854)TTFは実験モデルにおいて、LN-18神経膠腫細胞の遊走と浸潤を抑制することが示されている。TTFは、経口療法や静脈内療法のような全身的な半減期を持たず、電界が活発に分裂しているがん細胞のみに作用している間は治療効果を発揮するが、健康な細胞には作用しない。従って、効果を最大にするためには、治療を遵守することが重要である。(853)
TTFは、多形性膠芽腫(GBM)患者において最も広く研究されている。TTFは現在、NSCLC、膵臓癌、卵巣癌患者の補助療法として評価中である(854)。GBM患者では、TTFは患者の頭皮に設置されたトランスデューサーアレイを介して腫瘍領域に投与される。新たにGBMと診断された患者を対象とした第3相EF-14 RCT(n=695)では、TTFを維持療法であるテモゾロミド(TMZ)と併用した場合、TMZ単独と比較して、無増悪生存期間(HR、0.63;95%CI、0.52-0.76;P<0.001)および全生存期間(HR、0.63;95%CI、0.53-0.76;P<0.001)が有意に改善することが示された。(855, 856)NCCN(National Comprehensive Cancer Network)は、新たに膠芽腫と診断された患者と再発の膠芽腫患者の両方に対して、TTFとTMZの併用を推奨している。(857)この情報に基づき、GBM患者は、可能であればTTFを補助的治療の選択肢として考慮すべきである。(858)
光線力学的療法
光線力学的療法(PDT)は、光増感剤と酸素の存在下で可視光線により組織破壊を引き起こす治療法である。(859)増感剤分子が光エネルギーを受けると、低エネルギー一重項状態の電子が高エネルギー一重項状態にジャンプし、一部は自発的に励起三重項状態に変換する。励起三重項状態は、酸素と相互作用して活性酸素種を生成する。活性酸素種は、アポトーシス、ネクローシス、オートファジー関連細胞死の複雑な相互作用を通して、局所的に細胞死を引き起こす。(860)
光は数千年前から治療の可能性があることが知られている。3,000年以上前、古代インド文明や中国文明の時代から、主に反応性化学物質と組み合わせて、さまざまな病気の治療に使われてきた。例えば、白斑、乾癬、皮膚がんなどの症状を治療するために。太陽光線は、紫外線B(UVB)と皮膚でのビタミンDの合成、近赤外線(NIR)放射(太陽光線の約40%)の両方により、莫大な治療効果があり、ミトコンドリアのメラトニン合成を含む莫大な健康効果がある。(861, 862) 現代のライフスタイルにより、現代人は近赤外線への曝露が著しく不足している。(862)
太陽光のあらゆる波長の中で、NIR-A放射は組織への浸透力が最も深く、最大23cmである。1918年のインフルエンザの大流行時には、「インフルエンザ患者の野外治療」(日光浴)が重症患者に対する最も効果的な治療法であったようである(863) 。(863)最近の前向き研究では、日光浴を避けることが全死因死亡の危険因子であることが示された(864)。 この研究では、日光浴を避けた人の死亡率は、日光浴が最も多かった群に比べ、約2倍高かった。
皮膚科医は、局所光増感剤を用いたPDTを、光線性角化症や初期の非黒色腫皮膚がんの治療によく用いるが、固形がんを含め、PDTの潜在的応用範囲ははるかに広い。(859)悪性腫瘍や前悪性腫瘍の治療にPDTが利用される場合、患者には新生物病巣に優先的に集積し、光によって活性化されて細胞死を引き起こす増感剤が投与される。(860)
皮膚に対するPDTでは、プロトポルフィリンIXの前駆体である5-アミノレブリン酸やアミノレブリン酸メチルなどの局所光増感剤を用いるのが一般的である。(859)内臓腫瘍の治療には、静脈内または経口の光増感剤が必要であり、この適応で最も一般的に使用される光増感剤はポルフィマーナトリウムである。ポルフィマーナトリウムは630nmの光(赤色光)を吸収する。PDTは、レーザー、白熱灯、レーザー発光ダイオード、経皮光ファイバー装置、昼光など、さまざまな光源を用いて行われてきた。(865)
がん細胞を死滅させるPDTの有効性は実験モデルで証明されているが(866)、皮膚以外の悪性腫瘍患者におけるこの治療法の有用性を示す臨床研究は限られている(865, 867-867)。(865, 867-869)非皮膚がん患者におけるPDTと光バイオモジュレーションの役割については、さらなる評価が必要である。しかしながら、ミトコンドリア機能を改善するために、すべての患者に可能な限り(少なくとも週3回)、真昼に約30分間の日光を浴びることを勧める;これは真昼の早歩きで達成するのが最もよい。
高気圧酸素療法
低酸素状態は固形癌の重要な特徴であり、細胞の生存、血管新生、解糖代謝、転移の亢進に関与する。高気圧酸素療法(HBOT)は、血漿中の溶存酸素量を増加させ、それによって組織への酸素供給を増加させることにより、低酸素および虚血を伴う障害を改善または治癒するために何世紀にもわたって使用されてきた。(870)
HBOTは高酸素状態と活性酸素種(ROS)レベルの上昇を引き起こし、これががん細胞の抗酸化防御を圧倒して細胞死に至る(871, 872)。(871, 872)高酸素誘発性細胞死の背後にある分子メカニズムには、プロテインキナーゼやRAGE、CXCR2、TLR3、TLR4などの受容体を含む複雑なシグナル伝達系が関与している。(873) さらに、予想に反して、HBOTは腫瘍モデルにおいて血管新生阻害効果を誘発することが示されている。(871, 874)
HBOTのがん増殖に対する効果は限られているように見えるが、他の治療法の効果を増強する可能性がある。Hoffらは、ケトジェニック食とHBOの併用が全身転移性がんの自然モデルにおいて有意な抗がん作用を示すことを証明した(875)。低酸素症は化学療法抵抗性の重要な因子として報告されている(875)。(870)化学療法補助剤としてのHBOTに関する研究では、試験管内試験と生体内試験の両方で増強効果が示されている。(870) しかし、Mayerらは5つの化学療法剤(ドキソルビシン、ブレオマイシン、ジスルフィラム、シスプラチン、酢酸マフェニド)を挙げており、これらは毒性の増強の可能性があるため、HBOTとの併用では強く矛盾することを強調している。放射線治療とHBOTの併用は、(a)晩期放射線障害の治療薬として、(b)放射線治療の効果を高めることを目的とした放射線増感剤として、2つの異なる用途で臨床的に使用されている(870)。更新されたCochraneの系統的レビューでは、「HBOTが頭頸部の腫瘍の局所腫瘍制御と死亡率を改善するというエビデンスがいくつかあるが、その結果は通常とは異なる分画法の使用に関連しているようであり、HBOTの有益性は慎重に解釈されるべきであると結論づけている」(876)。(876)HBOTは、特に他の治療法と併用した場合、抗がん介入として有望かもしれないが、この介入を支持する臨床データは現時点では限られている。
第12章 化学療法:基本的な入門書
メトロノミック投与
メトロノミック療法は新しいタイプの化学療法であり、抗がん剤を最大耐容量よりも低用量で長期間反復投与することにより、副作用を少なくしてがんを治療するものである。(877)メトロノミックセラピーは、腫瘍微小環境と腫瘍細胞の両方に作用して治療効果を発揮することが示されている。メトロノミックセラピーは、従来の化学療法と比較して使用量が少ないため、費用対効果も高い。メトロノミック療法は、低用量を継続的に投与することで副作用を回避し、有効性は急速な腫瘍反応ではなく、無増悪生存期間や全生存期間の延長として見られるべきである。メトロノミックケモセラピーは、転移性乳癌、非小細胞肺癌、膠芽腫の患者に最もよく用いられている(878)。(878)22の臨床試験のメタアナリシスでは、進行乳癌患者において有望な結果が報告されている。(879)
化学療法の基本
悪性細胞内の特定の分子経路を標的とする新規のがん治療薬が相当数導入されているにもかかわらず、DNA損傷性の細胞毒性化学療法の使用は、現在のところほとんどの悪性腫瘍の管理において依然として主流である(880)。 化学療法薬は通常、すべての細胞のDNA合成を阻害することによってがん細胞を死滅させるが、最も急速に増殖している細胞を最も顕著に阻害する。ほとんどの化学療法薬はDNAの構造/機能を変化させることによって作用し、それによって細胞分裂を阻止する。(881-883)分裂紡錘体阻害剤は、紡錘体微小管の機能/形成を変化させ、分裂停止と細胞死を引き起こす。化学療法剤は、DNAを直接阻害するか、細胞分裂に必要な主要タンパク質を標的とすることにより、アポトーシスによる細胞死を引き起こす(884)。残念ながら、化学療法剤は正常な分裂細胞、特に骨髄や粘膜のようなターンオーバーの激しい細胞に対しても「細胞毒性」を示すことがある。化学療法剤は一般に、急速に分裂する細胞を殺すことによって作用する。したがって、これらの薬剤は急速に増殖する癌細胞集団に作用する。腫瘍が大きくなるにつれて、細胞の不均一性の程度は増加する。不均一性の程度が高ければ高いほど、化学療法に対する反応性は低くなる。転移性疾患では、腫瘍の負担が大きく、細胞集団が非常に不均一であり、非常にゆっくりと分裂する癌幹細胞の集団が存在するため、化学療法の効果が乏しいことが多い。さらに、すでに述べたように、化学療法は癌幹細胞を死滅させるのではなく、癌幹細胞の増殖と播種を促進する可能性がある。
生殖細胞腫瘍とリンパ腫を除くと、転移性疾患と診断された固形腫瘍患者のほとんどは治癒不能であり、治療は緩和を目的としている(表4参照)(883) 1940年代に導入されて以来、悪性疾患の治療薬として認可されている薬剤は現在50種類以上ある(883) 化学療法薬はその起源によって2つのクラスに分けられる。それらは植物由来か合成由来である(881, 882)。(881, 882)作用機序によって、アルキル化剤、代謝拮抗剤、トポイソメラーゼ阻害剤、分裂紡錘体阻害剤などに分けられる(図11参照)。(881, 882, 884)
臨床におけるほとんどの化学療法レジメンは、異なるクラスの複数の薬剤を併用することで構成されている(883, 884)。(883,884)多くの細胞毒性薬剤の欠点には、骨髄抑制、消化管病変、脱毛、吐き気、臨床抵抗性の発現などがある。これらの副作用は、細胞傷害性薬剤が腫瘍細胞と健常細胞の両方に作用するために起こる。(882)
細胞周期の期間は腫瘍と健常組織で同様であるが、腫瘍では有糸分裂を行う細胞の割合が高い。転移巣は通常、原発巣のほぼ2倍の増殖率を示す。固形腫瘍のがん細胞のうち、活発に分裂しているのは常に10%未満である。(885)細胞周期の特定の時点で作用する化学療法剤は細胞周期特異的薬剤と呼ばれ、最大限の効果を発揮するためには癌細胞が活発に分裂している必要がある。細胞周期特異的化学療法薬には、タキソール、エトポシド、ビンクリスチン、ブレオマイシン、代謝拮抗薬のメトトレキサートや5-フルオロウラシルなどがある。細胞周期特異的ではない一般的な化学療法薬としては、シクロホスファミド、シスプラチン、ドキソルビシンなどがある。
化学療法に関する個々の決定は、腫瘍の期待される反応性(治癒可能性)、病期と範囲(腫瘍の大きさ)、転移の有無、化学療法の毒性と相殺される患者の併存疾患に基づいて行われるべきである。化学療法に対する様々な癌の治癒可能性を表4に示す。(11, 139)転移性固形がん患者は一般に治癒不能である。一般的な腫瘍の転移部位を表5に示す。局所病変を有する患者は、手術により治癒する可能性がある(表6参照)(11)。「化学療法が可能な腫瘍」を有する患者には、標準的な完全化学療法プロトコルが推奨され、治療は可能な限り早期に開始すべきである。「化学療法が可能な悪性腫瘍」の治癒可能性は、これらの腫瘍のがん幹細胞の自然なアポトーシス感受性に関係している可能性がある。(139, 886, 887) 再利用医薬品と代謝療法は、患者の個々の嗜好に合わせて、すべてのがん種(治癒可能性)において強く考慮されるべきである(図12参照)。従来の化学療法と再利用抗がん剤の対照的な効果を表7に示す。

表4 化学療法に対する反応性による腫瘍の層別化。
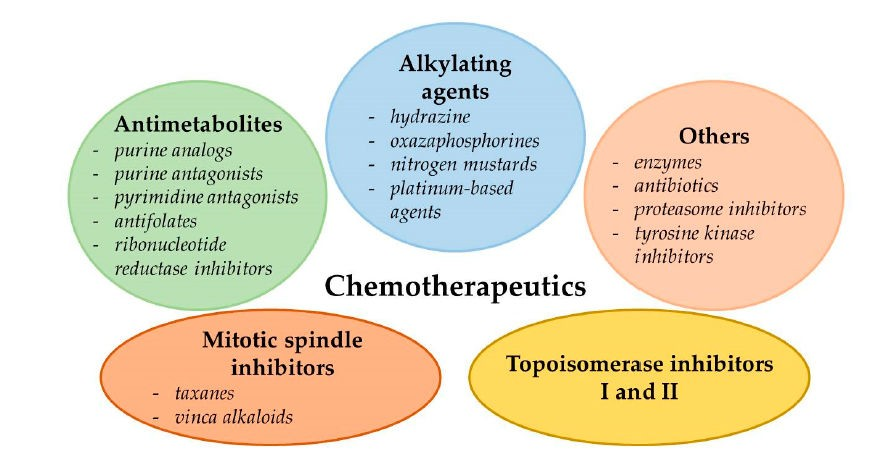
図11 一般的に使用されている化学療法薬の分類、Creative Commons Attribution International licenseの下で複製)
(881)
従来の化学療法は、以下の理由により固形がんに対してしばしば失敗する:
- 固形がんは不均一な細胞集団から構成されており、その多くはゆっくりと増殖する。
- 腫瘍細胞のほとんどは細胞周期の休止期にある。
- 化学療法は癌の微小環境(癌細胞の増殖を促進する)を是正せず、悪化させる可能性が高い。
- 化学療法は癌幹細胞を殺すのではなく、むしろ増強する。
- がん細胞は化学療法剤に対して耐性を持つようになる。(881)
表5 一般的な癌と転移部位。(888)
表6 外科的に「治癒可能」ながん: 外科的切除による局所病変の5年生存率。(11)局所病変-浸潤性の悪性がんで、発生臓器に完全に限局しているもの。
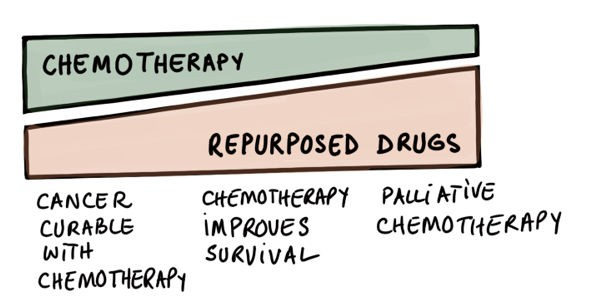
図12. 化学療法の治癒可能性」に応じた化学療法と再利用薬の役割 [出典:Mobeen Syed博士]。
腫瘍増殖の動態は予後を決定する上で極めて重要であり、化学療法に対する反応を決定する要因でもある。倍加時間とは腫瘍細胞が倍加するのに要する時間のことである。倍加時間が早ければ早いほど、がんが化学療法に反応する可能性が高くなるが、(治療を行わなかった場合)がんが人を死に至らしめるのも早くなる。一般に、腫瘍が臨床的に検出可能な大きさ(1cm大)に達すると、すでに約30回の倍加を経て109個の細胞に達すると考えられている(図13参照)。通常致死的となる約1kgの腫瘍を形成するには、さらに10回の倍加が必要である。乳癌の平均倍加時間は180日と報告されているが、小細胞肺癌(SCLC)のそれは平均86日である。(889-892)
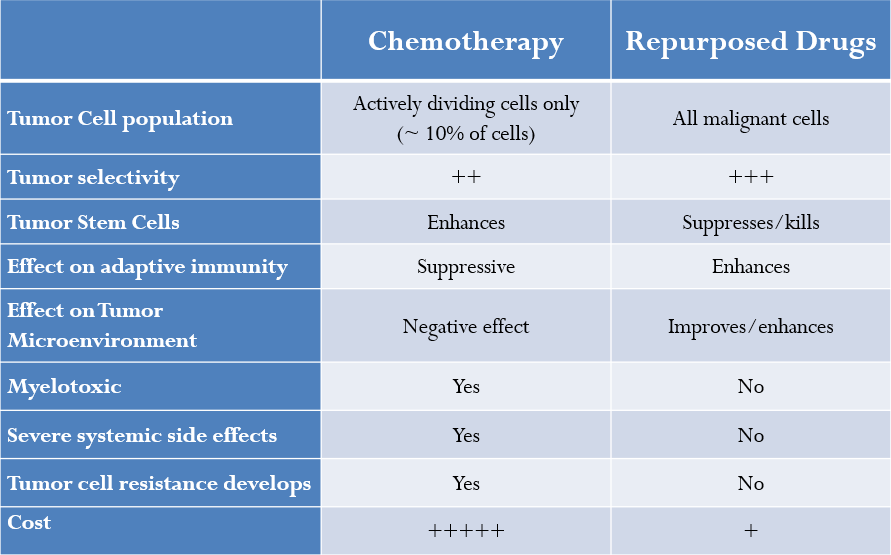
表7がん治療における従来の化学療法と代謝療法および再利用薬の効果の対比
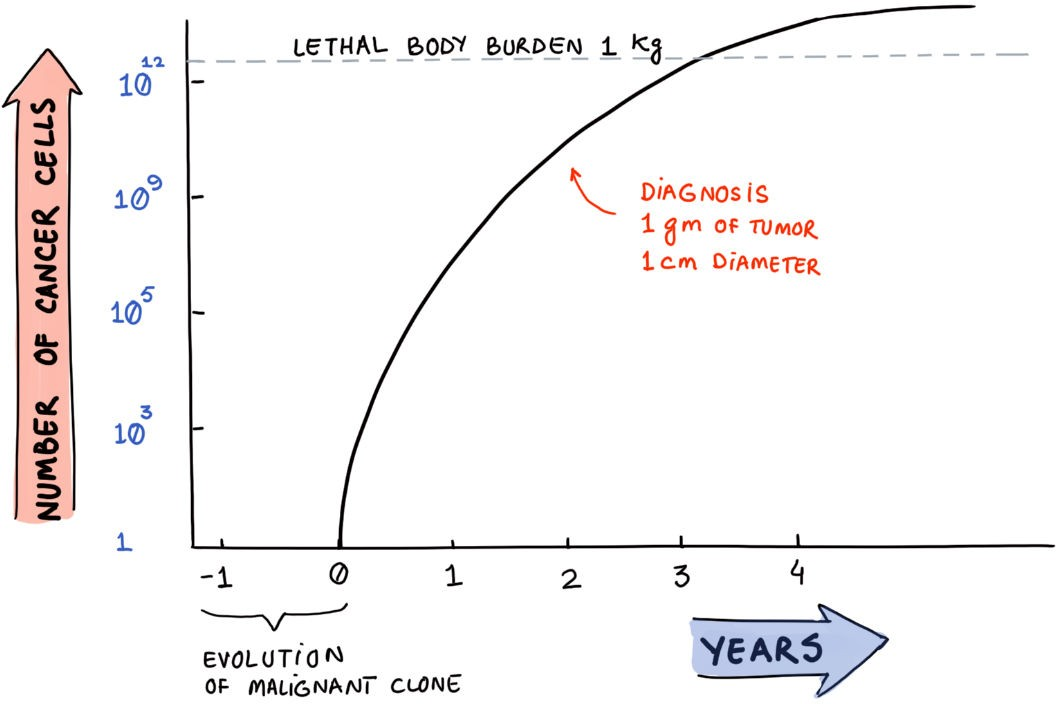
図13. 腫瘍負荷と腫瘍増殖動態[出典:Mobeen Syed博士]。
付録1:再利用薬/栄養補助食品の層別化のためのエビデンスの階層構造
臨床介入を正当化するためには、最高レベルの科学的証拠を用いることが決定的に重要である。ある観察が科学的に妥当であれば、それは何度でも再現可能である。
従来、ランダム化比較試験(RCT)のメタアナリシスが最高レベルのエビデンスと考えられてきた。しかし、RCTには、現実の医療を反映していないこと、一般的に単一の介入(例えば、薬剤A対プラセボ)しか検証できないことなど、多くの限界がある。さらに、RCTの実施には非常に費用がかかるため、そのほとんどは利益相反を内在する大手製薬会社から資金提供を受けている。それにもかかわらず、よく実施された前向き縦断的研究の結果が、RCTの結果と定量的に類似した結果をもたらすことが、新たなデータから示唆されている(308)。したがって、このモノグラフでは、前向き観察研究およびこれらの研究のメタアナリシスを、エビデンスの階層においてRCTと同等とみなす。
試験管内試験および生体内試験の実験的研究は、再利用された医薬品や栄養補助食品が抗がん作用を有することを証明するために不可欠な出発点であるが、このデータは、対象疾患を有するヒトにおける化合物の安全性と有効性を証明する臨床データによって補完されることが不可欠である。さらに、試験管内試験と生体内試験の研究は、異なる介入間の相乗効果と腫瘍微小環境に対するこれらの介入の効果を評価する上で重要である。しかし、このデータはその効果を患者に外挿するには不十分である。心強い実験データにもかかわらず、レトリルが癌患者の予後を改善できなかったことは、この問題の一例である。さらに、症例研究は有用な情報(特に安全性データ)を提供することができるが、一般に交絡変数が多すぎるため、観察された結果に別の説明を与える可能性がある。このような理由から、よく報告された症例シリーズ(レトロスペクティブ)、前向き縦断研究、疫学研究またはRCTが、特定の介入を支持するエビデンスとして望ましいレベルである。
エビデンスの階層
- 1. 観察研究および/またはランダム化比較試験(RCT)のメタ解析。
- 2. プロスペクティブRCTおよび/または観察研究。
- 3. その薬剤ががんのリスクを減少させ、がん患者の生存を改善することを証明する疫学的データ。
- 4. ケースシリーズ(3例以上)。
- 5. 個々の症例報告(少なくとも2例)。
- 6. In Vivoモデルで腫瘍微小環境に対する良好な効果を示したもの。
- 7. In Vivo/In Vitroモデルで、がん化学療法剤存在下での相乗的/相加的ながん細胞死滅を示す。
- 8. In Vivoモデルで、腫瘍細胞および/またはがん幹細胞の殺傷を証明する。
- 9. 癌細胞の死滅を示す。In Vitro モデル(細胞培養)。
付録2. 抗がん活性のエビデンスが限られているその他の潜在的薬剤
リストアップされた薬剤/栄養補助食品/植物薬*は、in-vitro、in-vivo、そして(ほとんどの場合)抗がん活性を証明するヒトでのデータが限られている。このリストはReDOデータベースからの引用である。(5)
「薬」が臨床使用に推奨されるためには、その化合物ががん細胞を死滅させ(アポトーシス)、この死滅作用が化学療法薬の存在下で増強されること、その薬剤ががん幹細胞(CSC)を死滅/阻害すること、その化合物が動物モデル(生体内試験)でがん細胞を死滅させ、これらのモデルにおいてその薬剤が腫瘍微小環境を良好に変化させることを示す試験管内試験データが必要である。さらに、ヒトへの投与が推奨されるためには、その薬剤が「安全かつ有効」であるという十分な科学的根拠が必要である。これには 「ゴールドスタンダード」のRCTではなく、症例報告、症例シリーズ、観察研究による十分で再現性のあるデータが必要である。これはダイナミックなプロセスであり、十分なエビデンスが蓄積されれば、その薬剤を推奨薬剤リストに含めることができる。
リストアップされた薬剤の層別化に使用された基準は、付録1に示されている。「逸話」はエビデンスの総体としては重要であるが、逸話は客観的な科学的エビデンスを示すものではなく、付録2には記載されていないことに注意すべきである。ある治療家が、ある治療法で「何百人もの患者を治した」と主張する場合、そのデータを査読のある医学雑誌に発表するのは比較的簡単なはずである。
- アセトアミノフェンアロプリノールアルファ-リポ酸
- ニンニクアミノフィリンアミオダロン
- Annona muricata(サワーソップ、グラビオラまたはグアナバナ)
- アプロチニンアルテスネートアトバコン
- 心房性ナトリウム利尿ペプチドアジスロマイシン
- ボセンタンブロモクリプチンカフェインカンナビジオールカプトプリルカルベジロールクロロキンクラリスロマイシン
- クロピドグレルコルヒチンシプロヘプタジンタンポポ抽出物ダパグリフロジンデフェロキサミンジゴキシン
- エナラプリルエノキサパリンエソメプラゾールファモチジンフェノフィブラートフィナステリド
- 没食子酸(他の植物茶) ガンシクロビルヒドロキシクロロキンイミプラミン
- イルベサルタンイトラコナゾールケトコナゾールレボフロキサシン甘草根ロラタジンロサルタンメクリジンメトクロプラミドミコナゾールニカルジピンニフェジピンニクロサミドニトログリセリンオメプラゾールペントキシフィリンフェニトインプロプラノロール
- プロポリス(ミツバチ抽出物) ピリドキシン(ビタミンB6) スピロノラクトンスルファサラジン
- スルフォラファン(ブロッコリー)
- バルプロ酸
イタリック体で示した栄養補助食品/植物薬。
付録3.図の脚注
細胞周期。p21:タンパク質21、p16:タンパク質16、p53:タンパク質53、EZH2:Enhancer of Zeste Homolog 2、サイクリンA:サイクリンA、サイクリンB1:サイクリンB1: サイクリンB1: Cyclin B1, サイクリンD1: Cyclin D1: サイクリンD1: Cyclin D1, サイクリンE: Cyclin E: サイクリン。アポトーシス。切断型カスパーゼ-3,7、9:切断型カスパーゼ-3,7、9、切断型PARP: Cleaved Poly (ADP-ribose) polymerase, Caspase 3: カスパーゼ-3, miR-15a: マイクロRNA-15a, miR-16: マイクロRNA-16, TAZ: PDZ結合モチーフを持つ転写コアクチベーター, YAP: Yes-associated protein, EZH2: Enhancer of Zeste Homolog 2. 転写因子。ERE: エストロゲン応答エレメント、PPAR-γ: Peroxisome Proliferator-Activated Receptor Gamma, Nrf-2: Nuclear factor erythroid 2-related factor 2, p21: Protein 21, p53: Protein 53, FOX03: Forkhead box O3, Betacatenin: βカテニン, STAT-1: Signal Transducer and Activator of Transcription 1, STAT-3: Signal Transducer and Activator of Transcription 3, STATE-4: Signal Transducer and Activator of Transcription 4, STAT-4: Signal Transducer and Activator of Transcription 4, CREB-BP: cAMP応答要素結合タンパク質, AP-1: Activator Protein 1, Notch-1: Notch receptor 1, HIF-1: Hypoxia-Inducible Factor 1. シグナル伝達経路。AKT:プロテインキナーゼB(Aktとしても知られる)、AXL: AXL受容体チロシンキナーゼ、β-カテニン: β-カテニン、Slug:Snail Family Transcriptional Repressor 2、Vimentin:ビメンチン: ビメンチン(中間フィラメントタンパク質)、STAT3:Signal Transducer and Activator of Transcription 3、NF-kB:Nuclear Factor-kappa B、レセプター。DR-5:デスレセプター5、Fas-L: Fasリガンド, IR: インスリン受容体, Fas: Fas受容体、R:受容体、H2R:ヒスタミンH2受容体、HER-2:ヒト上皮成長因子受容体2、IL-8:インターロイキン-8、CXCR4:C-X-Cケモカイン受容体4型、AHR:アリール炭化水素受容体、AR:アンドロゲン受容体、ER-α. エストロゲン受容体α、EGFR:上皮成長因子受容体、EPCR: 内皮蛋白C受容体。成長因子。DR-5:デスレセプター5、Fas-L: Fasリガンド、CTGF:結合組織成長因子、FGF:線維芽細胞成長因子、HGF:肝細胞成長因子、TF:転写因子、NGF:神経成長因子、EGF:上皮成長因子、PDGF:血小板由来成長因子、TGF-β1:トランスフォーミング成長因子β1、VEGF:血管内皮成長因子。プロテインキナーゼ。JNK:c-ジュンN末端キナーゼ、AMPK:AMP活性化プロテインキナーゼ、ASK1:アポトーシスシグナル調節キナーゼ1、FAK:局所接着キナーゼ、EGFR-K: 上皮成長因子受容体キナーゼ、Pp60C-tk: プロテインチロシンキナーゼp60c-src、JAK2: ヤヌスキナーゼ2、PI3K:ホスホイノシチド3キナーゼ、PGK1:ホスホグリセリン酸キナーゼ1、PAK:p21活性化キナーゼ、PKA:プロテインキナーゼA、PKB:プロテインキナーゼB(Akt)、PTK:プロテインチロシンキナーゼ、MAPK:ミトジェン活性化プロテインキナーゼ。酵素。テロメラーゼ: Telomerase、デサチュラーゼ: Desaturase: デサチュラーゼ、GCL:グルタミン酸-システインリガーゼ、MMP:マトリックスメタロプロテアーゼ、GICL:グルタチオン誘導がん様タンパク質、iNOS:誘導性一酸化窒素合成酵素、NQO-1:NAD(P)Hキノンデヒドロゲナーゼ1、FPT:ファルネシルタンパク質転移酵素: ファルネシルタンパク質転移酵素、Src-2:ステロイド受容体コアクチベーター2、DNA pol: DNAポリメラーゼ、TMMP-3:組織マトリックスメタロプロテアーゼ-3、GST:グルタチオンS-トランスフェラーゼ、ODC:オルニチン脱炭酸酵素、PhP:ホスホヘキソースイソメラーゼ、D:D-アミノペプチダーゼ、5-LOX:5-リポキシゲナーゼ、COX-2:シクロオキシゲナーゼ-2、ATPase: アデノシン三リン酸化酵素、ATFase: アデノシン三リン酸化酵素(ATPase)活性化因子、AATF-1:アポトーシス拮抗転写因子1。炎症性サイトカイン IL-1:インターロイキン-1、IL-2:インターロイキン-2、IL-6:インターロイキン-6、IL-8:インターロイキン-8、IL-12:インターロイキン-12、IL-18: インターロイキン-18、MCP:Monocyte Chemoattractant Protein、MIP:Macrophage Inflammatory Protein、MaIP:Macrophage-activating Inflammatory Protein、TNF-α: 腫瘍壊死因子α。小胞体ストレスマーカー。XBP-1:X-Box結合タンパク質1、IRE1:イノシトール要求性酵素1、GADD153: GADD153:Growth Arrest and DNA Damage-Inducible Protein 153、CHOP:C/EBP Homologous Protein、ATF6:Activating, Transcription Factor 6、GRP78:Glucose-Regulated Protein 78。接着分子。ICAM-1:細胞間接着分子-1、VCAM-1:血管細胞接着分子-1、ELAM-1:内皮白血球接着分子-1。
寄付のお願い
この素晴らしい記事があなたの役に立ちましたら、記事のオリジナル著者、マリク博士-FLCCCへのご寄付をお願い申し上げます。
covid19criticalcare.com/donate/

