Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC8033982/
Curr Neuropharmacol. 2021 Feb; 19(2): 114-126.
2021年2月オンライン公開
要旨
活性窒素種(RNS)および活性酸素種(ROS)は、活性酸素・窒素種(RONS)と総称され、通常の細胞代謝の産物であり、核酸、タンパク質、膜脂質などのいくつかの重要な生体分子と相互作用して、その機能を不可逆的に変え、細胞死を引き起こす可能性がある。
酸化ストレスは、認知機能障害や神経損傷の発症・進行において重要な役割を担っている。神経変性疾患、炎症、虚血などの多くの病態では、一酸化窒素(NO)の産生量が増加し、同時にニトロソ化/酸化ストレスの上昇が起こる。一酸化窒素合成酵素(NOS)は、L-アルギニン(Arg)をL-シトルリンに変換することにより、様々な細胞でNOを生成する役割を担っている。
したがって、NOシグナル伝達経路は有力な治療標的である。NOシグナル伝達経路を標的とする天然由来のポリフェノールは、神経変性および関連する合併症の分野で重要な役割を果たす可能性がある。
ここでは、人体におけるNOの重要性とその生成について包括的にレビューし、その後、NO生成に影響を及ぼす様々な天然物の重要性とその神経変性疾患に対するメカニズムに焦点を当てる。
キーワードアルツハイマー病、NO、iNOS、神経炎症、神経伝達、神経毒性
1. はじめに
神経変性疾患は、神経細胞系の徐々に進行する選択的な損失によって描かれる障害の異種グループであり、人間の健康に対する大きな脅威と考えられている[1, 2]。アルツハイマー病(AD)、筋萎縮性側索硬化症(ALS)、ハンチントン病(HD)、パーキンソン病(PD)など、いくつかの神経変性疾患の特徴として、タンパク質の異常凝集が挙げられる。また、線維性沈着などの他の特異的な特徴も、異なる病態で観察される。ADでは細胞外アミロイド斑や神経原線維変化、HDでは核内封入体、PDではレビー小体などである[3, 4]。
* *
神経細胞の異常な活動、神経伝達物質受容体の変化、関連するシグナル伝達経路の猛烈なサイクルの引き金となり、シナプス障害や神経ネットワークの崩壊による神経機能の不全に至るまでには、異常なタンパク質集合体が重要な役割を担っている[5]。
神経変性疾患の発生率はここ数十年で急速に増加しているにもかかわらず[6]、これらの衰弱した障害を治癒するための効率的な治療アプローチを得るための臨床試験の結果は満足のいくものではない[5]。神経伝達物質受容体を標的とする様々な薬剤がうまくいかない背景には,異常なタンパク質の集合体によって関連するシグナル伝達経路が破壊されている可能性がある[5]。
* *
神経変性疾患の共通の特徴として、細胞エネルギーの低下、マイトファジー、神経細胞死の引き金となる脳のミトコンドリア機能およびダイナミクスの変化が挙げられる[7-10]。また、ミトコンドリアDNA(mtDNA)変異の蓄積や機能不全ミトコンドリアによる活性酸素種(ROS)の過剰産生によるミトコンドリア機能の変化は、神経変性疾患の主要な危険因子である老化過程と関連している[1]。
活性酸素・窒素種(RONS)、興奮毒性、ミトコンドリア複合体の阻害、カルシウムイオンの侵入、栄養因子の脱離、ミスフォールドしたタンパク質など、様々な要因によるプログラム細胞死(PCD)の引き金も、神経変性疾患と関連している[9]。
神経変性とその関連疾患では、主要な臨床疾患のほとんど全てに関与していることから、様々なシグナル伝達経路が特に注目されている[11]。これとは別に,大量の糸状タウ封入体の蓄積を特徴とするタウオパチー(タウタンパク質は微小管関連タンパク質(MAP)ファミリーのメンバー)も,神経変性疾患の病態生理に関与している[12]。これらのタウパチーは、AD、進行性核上性麻痺、ピック病、皮質基底部変性症、アルギロイド穀物病などに存在する[14]。
* *
一酸化窒素(NO)は、小さく、不安定で、親油性の高い気体であり、いくつかの細胞種によって内因的に合成され、免疫反応、神経伝達、血小板凝集など様々なプロセスに関与している[15-21]。また、NOは、神経調節や神経伝達物質の作用など、いくつかの生理学的プロセスを媒介することが示されている[20]。
NOはもともと内皮由来の弛緩因子として同定され、血管の拡張のメディエーターとして作用している[22-25]。神経変性や神経炎症などの多くの病的状態において、より多くのNOが生成され、通常、ニトロソ化/酸化ストレスの上昇を伴っている[26]。
* *
本総説では、NOの生化学および機能についての簡単な説明から始めて、神経保護および/または神経毒性を媒介するNOおよび酸化的/硝酸的ストレスの役割について議論する。虚血中の低酸素の結果として細胞障害が起こる。これは、虚血組織の酸素供給が過剰に回復するのに伴い、活性酸素種も生成されるため、再酸素化による虚血組織の再灌流時にさらに悪化する。
したがって、虚血時の低酸素状態や再灌流時のスーパーオキシドの大量発生は、NOの産生を低下させることになる。その結果、内皮機能に異常が生じる。その結果、eNOSの補酵素であるテトラヒドロビオプテリン(BH4)がeNOSの脱共役を促し、eNOSはNOを合成する代わりにスーパーオキシドラジカルを生成するようになる。
同時に、神経細胞の虚血再灌流傷害は、メタボトロピックグルタミン酸受容体を介したnNOSの刺激とNOの合成を引き起こし、スーパーオキシドラジカルと結合して一酸化窒素ラジカル(ONOO-)を形成する。虚血再灌流による神経細胞障害では、炎症カスケードが生じ、ミクログリア、好中球、グリア細胞でiNOSによるNO合成が誘発される。
このようにして生成されたNOは、スーパーオキシドラジカルと結合してONOO-となり、核酸、タンパク質、膜脂質などの重要な生体分子と相互作用して、その機能を不可逆的に変化させ、タンパク質チロシンナイトレーション、ミトコンドリア機能不全、DNA損傷、ポリ(ADP-リボース)ポリメラーゼ(PARP)活性化などの原因となり神経毒性を引き起こす(図1)。その後、神経変性疾患の治療戦略として、天然化合物によるNO産生抑制とNOシグナル伝達経路のターゲティングに焦点を当てた包括的な知見が示されている。
図(1)神経保護および神経毒性に関与するNOシグナル伝達経路のスキーム
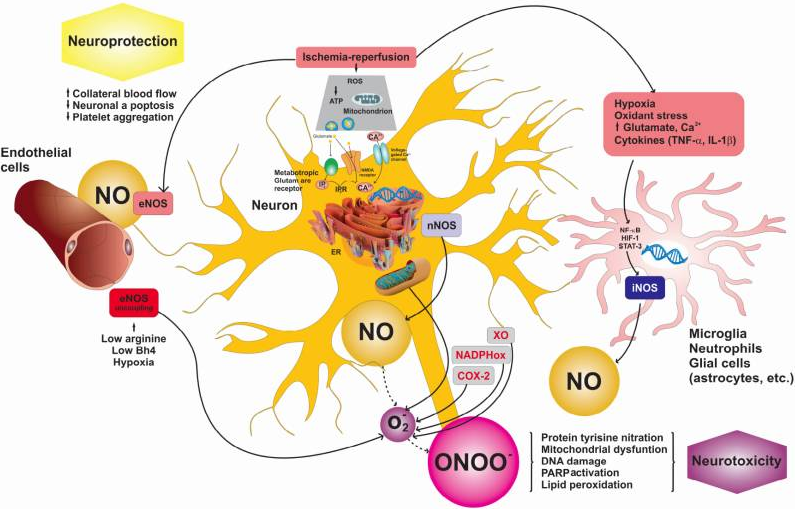
(この図の高解像度/カラーバージョンは論文の電子版に掲載されている)。
2. 一酸化窒素と細胞内レドックス状態
一酸化窒素は不対電子を持つ短寿命のフリーラジカルガスであり、人体内で急速に生成される。様々な細胞膜を自由に拡散し、反応性が高いといったNO特有の特徴により、この分子は様々な身体システム、例えば、免疫系、循環器系、神経系におけるいくつかの生物学的プロセスに関与している[27-29]。
NOの様々な細胞プロセスへの影響は、非常に濃度依存的である。生理的なNO濃度は、中枢神経系(CNS)内の異なる脳刺激に応答する神経調節物質または神経伝達物質として作用し、食欲、睡眠、神経分泌、体温を制御することによって海馬の長期増強およびシナプス可塑性に重要な役割を果たす[27、30-32]。
* *
食事とL-アルギニン-NO 合成酵素経路は、体内の亜硝酸塩と硝酸塩の2 大源泉である[33]。NOは血液や組織で酸化され、亜硝酸塩と硝酸塩が生成される[19, 34]。キー酵素 NOSは、ニコチンアミドアデニンジヌクレオチドリン酸 (NADPH)、分子酸素、L-アルギニンを共基質として含む変換の2 ステッププロセスを介してNOとL-シトルリンの合成に関与している。
フラビンモノヌクレオチド(FMN)、テトラヒドロビオプテリン(BH4)、フラビンアデニンジヌクレオチド(FAD)は必須の補因子であり、ヘムとカルモジュリンはこのプロセスの重要な補欠基である[35, 36]。病的・生理的事象に応答して、アミノ酸L-アルギニンからNOを生成する3つの主要酵素(他はニューロン一酸化窒素合成酵素(nNOS)および内皮型一酸化窒素合成酵素(eNOS)の一つである誘導型一酸化窒素合成酵素(iNOS)は、神経発生において敏感な調節因子として重要な役割を果たすと考えられる。nNOS由来のNOはin vivoで神経発生を負に制御するにもかかわらず、nNOSによる抑制作用はニューロンから生成されるNOによるものであることも証明された[37]。
一酸化窒素合成酵素(NOS)アイソフォーム
| NOSアイソフォーム | 所在地 | 機能 | 細胞質/膜結合型? | 酵素活性の特徴 |
|---|---|---|---|---|
| 内皮性NOS (eNOS) | 血管の内皮組織 | 筋肉や軟部組織の血管拡張と弛緩。 | 膜結合型 | 低濃度のNOを長期間にわたり生成する。 |
| 神経性NOS (nNOS) | 中枢神経系と末梢神経系 | 細胞間通信 | サイトゾル | 低濃度のNOを長期間にわたり生成する。 |
| 誘導性NOS(iNOS) | 免疫細胞、グリア細胞 | 病原体に応答する細胞死を媒介する | サイトゾル | 短時間で高濃度のNOを発生させることができる |
| ミトコンドリアNOS (mtNOS) | ミトコンドリア内膜 | Ca2+の制御 | 膜結合型 | Ca2+のフィードバックループの一部 |
* *
Drogeの研究[38]によると、レドックスシグナルは「レドックス化学によってシグナルが伝達される調節プロセス」と定義されている。このプロセスでは、シグナル伝達タンパク質の特定の精密なアミノ酸残基の翻訳後修飾がRONSによって行われる[38, 39]。
酸化還元細胞シグナルは主要な細胞プロセスとして受け入れられており,酸化還元細胞シグナルの機能不全は,癌,虚血再灌流障害,動脈硬化,糖尿病を含むいくつかの疾患の病因と関連している[38, 40-42]。いくつかの研究では、異なる濃度において、神経保護作用だけでなく、神経毒性作用の両方が報告されている。
しかし、NOは神経保護作用があるとされているが、細胞内濃度が上昇すると神経毒性を示すと考えられている[32, 43, 44]。さらに、いくつかの酸化還元シグナルメディエーターの産生は、酵素的または酸化的プロセスによって高度に制御された形で行われる。
これらのプロセスに含まれる酵素は、NOS、シクロオキシゲナーゼ(COX)、NADPHオキシダーゼ(NOX)、リポキシゲナーゼ(LOX)、ヘムオキシゲナーゼ(HO)、シスタチオニン-β-シンターゼ(CBS)である[31]。病原体の制御に関与するNOX2は、高いスーパーオキシド(O2–)レベルの発生と相関している。NOX1、3、4、5、および6は、さらなる制御的役割に関連し、より少ないO2–のフラックスを生成する[31, 45-47]。
* *
酵素NOSはNOの生成に関与し、NOSの発現上昇によって実質的に増加し、Niemann-Pick type C病のマウスにおける神経新生の減少と関連する。一方、NOS阻害剤であるL-NAMEは、神経幹細胞(NSCs)の分化能力を部分的に回復させ、その結果、Fluoro-Jade C陽性の変性神経細胞の量を減少させることができた[48]。
さらに,Chenら[49]は,脳卒中モデルにおける神経新生におけるeNOS制御機構を示した.脳卒中の損傷により、障害された脳の部位でNSCの増殖と移動が誘導され、損傷したニューロンを入れ替えることができると推測される[49]。
NSCsのニューロン新生と増殖は、nNOSの活性化およびニューロン由来の外因性NOの増加を通じて修復刺激によって促進されるが、一方で、これらの効果を抑制する能力もある。あるいは、iNOSの阻害剤は、反応性ミクログリアやNSCsから産生される病的なNOも同時に抑制することができる。
したがって、iNOSによって産生されるNOの抑制は、神経保護効果を有する可能性がある[50, 51]。血管拡張はまた、様々な経路を通じてNOによって促進され得る[52, 53]。一般的には、平滑筋細胞の可溶性グアニル酸シクラーゼ(sGC)が関与し、結果としてcGMP依存性プロテインキナーゼ(PKG)が活性化される。ミオシン軽鎖の脱リン酸化はPKGによって促進され、最終的に血管弛緩をもたらす[54, 55]。
* *
NOは、CNSにおけるグルタミン酸作動性神経伝達のシグナル伝達中間体である[56]。NOはグルタミン酸作動性シナプスにおける重要な逆行性メッセンジャーとして考えられており、GABA作動性シナプスにおいても重要な役割を担っている[57]。
NOのシグナル伝達はグルタミン酸作動性伝達と密接な関係がある。NOの合成はグルタミン酸受容体の活性化と密接に関連しており[55, 58]、また神経血管-神経エネルギー結合軸の確立に重要な役割を持つ[55]。それでもなお、神経血管の結合におけるNOの重要性を唱えるいくつかの証拠が存在する。
NOが細胞間拡散性メッセンジャーとして同定されたとき,脳血流(CBF)に関連する神経活動の調節に重要な役割を果たすことが提唱された[55, 59]。また、逆行性NOシグナルシステムは、一般的なシナプス前制御の役割に非常に適しており、生後初期のGABA作動性伝達が脱分極している間に、ネットワーク活動を微調整する可能性があることも報告されている[57]。
2.1. NOと活性酸素代謝・チオール反応との相互作用
酸素は好気性生物において代謝と正常なフリーラジカルの形成に不可欠であり、その結果、神経伝達物質の放出、電気化学的勾配、膜脂質の安定性を維持するために代謝エネルギーを多く必要とするため、脳細胞の生存に重要な酸化還元恒常性を維持する[60]。
様々なフリーラジカルは通常の代謝の産物であり、血管運動、免疫反応、シグナル伝達などの多くの細胞プロセスで利用され、その後、細胞の抗酸化機構によって中和される。フリーラジカルは、スーパーオキシド(O2–)、ペルオキシルラジカル(ROO●)、一酸化窒素(-NO)、ヒドロキシルラジカル(-OH)、さらにペルオキシナイトライト(ONOO-)や過酸化水素(H2O2)などのラジカルではない分子も生成される[61]。
これらはさらに,O2–,-OH,ROH,H2O2などを持つRONSと,-NOやONOO-などのRNSに分けられる[60]。RONSの生成は、例えば、ミエロペルオキシダーゼのように、過酸化水素を利用して亜硝酸塩を二酸化窒素に酸化することができる様々なペルオキシダーゼによって触媒されることもある[62]。
* *
チオールを含む多くのタンパク質は、様々な細胞内プロセスにとって極めて重要であり、チオールの酸化やニトロソ化によってその機能が変化することがある。チオールのニトロソ化とNOやスーパーオキシドによる酸化は、それぞれ相対的なフラックスで見積もることができ、生理学的に重要であることが報告されている[63]。
NOによるニトロソ化ストレスは、抗酸化神経保護タンパク質であるペルオキシレドキシン2のSニトロソ化を引き起こし、神経細胞の機能性、生存、構造の維持に重要な防御的細胞機構の障害につながる[64]。したがって、NOのレベルが高くなると酸化還元反応が引き起こされ、タンパク質のミスフォールディング(神経変性疾患の特徴)に関連する。
さらに、ParkinのS-ニトロシル化は、E3ユビキチンリガーゼ活性の活性を乱すため、レビー小体の形成に影響を与え、神経細胞の細胞死を誘発する[65]。NOの酸化還元機構については、多くの著者により詳細に検討されている[66-69]。
3. 神経変性における酸化的・硝酸的ストレス
フリーラジカルに加え、様々な酸化還元活性種が多くの生体分子を変化させるが、これは様々な病的メカニズムの不可欠な部分であると考えられている。酸化還元反応では、電子とロンの交換が重要である。例えば、チオールの翻訳後修飾やヘム鉄・非ヘム鉄標的との相互作用など、正確な標的でRNSとROSの結合が行われる古典的な受容体媒介シグナル伝達経路を含む2つの主要メカニズムに基づいている[31]。
2つ目のメカニズムは「酸化還元調律」で、シグナル伝達経路の全体的な活性の制御は、酸化還元反応とアミノ酸残基に依存し、タンパク質機能の調節を担っている[70]。分子状窒素のアンモニアと硝酸塩への変換は、窒素同化の促進が行われ、一般的なN2よりも還元的で酸化的な中間種の生成と一緒に行われる窒素サイクルの中で行われる[31]。原核細胞や真核細胞における代謝の様々な側面は、レドックスバイオロジーによって支配されている。
* *
酸化ストレスの原因としては、不健康な生活習慣、疾病状態、睡眠制限、カロリー過剰摂取、栄養失調、過度のアルコール摂取、睡眠時無呼吸症候群など、多くの原因がある[71-75]。酸化的/硝酸的ストレス経路は、いくつかの心血管、神経変性、および全身性の障害に関与しており[26、76]、認知障害および神経損傷に不可欠な役割を果たしている[74、77、78]。ADなどの神経変性疾患では、酸化ストレスによる損傷が早期かつ共通の特徴である。神経毒性RONSのレベルは、認知機能の低下と関連する神経炎症プロセス中に増加する[75]。
* *
セクション2で述べたように、NOの代謝に関与する3つの主要なNOSは、iNOS、eNOS、およびnNOSである[26, 79]。これらの酵素は、中枢および末梢神経系に存在する。これらのアイソフォームは、異なる遺伝子でコードされている。
2つは構成的酵素(cNOS)として知られており、NOS3によってコードされるeNOSとNOS1遺伝子によってコードされるnNOSが含まれる[36]。RONSは、核酸、タンパク質、膜脂質などの重要な生体分子と相互作用し、その機能を不可逆的に変化させ、時には細胞死を引き起こすこともある[80]。
4. 神経変性における一酸化窒素の役割と機構
末梢神経系および中枢神経系におけるNOの重要な役割はいくつかある.神経保護と神経毒性の両方に関与している。eNOSの存在は、血管内皮に見られ、血流の調節、神経細胞のアポトーシスの減少、血小板凝集に関与している。神経保護と神経毒性におけるNOと他のフリーラジカルの関与の詳細を図11に示す。
11.また、神経細胞の弛緩がNOを生成する薬剤によって模倣されることが報告されており[81, 82]、神経を介した腸の弛緩がNOS阻害剤によって阻止されるというデータによって裏付けられている[81-83]。神経変性疾患におけるNOの重要な関与については、ヒトの剖検脳を用いた研究はほとんどないが、数多くの研究がなされている。
内皮NOの減少は、脳血管系におけるAβ発現のアップレギュレーションとアミロイド前駆体タンパク質(APP)の調節に重要な役割を演じている[84]。Dudaと共同研究者は、抗3-ニトロチロシンポリクローナル抗体による免疫標識法を利用して、レビー小体とアルツハイマー病の患者の剖検皮質におけるレビー亜硝酸塩の広範な窒化を証明した[85]。
さらに、多系統萎縮症患者では、剖検した小脳白質のグリア細胞におけるα-シヌクレインの硝化、脳鉄蓄積型神経変性症患者では、剖検した淡蒼球におけるレビー小体様封入体および神経軸索スフェロイドの硝化が確認された[85]。
同様に、n847モノクローナル抗体を介した免疫反応により、堀口らは、AD、17番染色体に関連したパーキンソニズムを伴う前頭側頭型認知症、ピック病、皮質基底核変性症、進行性核上性麻痺およびダウン症罹患者の剖検脳における広範囲の硝酸タウ蛋白質を証明した[86]。
別の研究では、NO供与物質であるニトロプルシドナトリウム(SNP)が、HSV-1感染および非感染初代神経細胞培養細胞および混合グリア培養細胞におけるAβ蓄積を有意に上昇させ、iNOS阻害物質であるアミノグアニジンがこれを阻害することが示された[87]。
* *
AD病態におけるNOとその反応生成物(スーパーオキシドラジカルとの)ペルオキシナイトライトの関与は、AD患者の海馬における神経原線維絡まりの硝化レベルが年齢をマッチさせた対照群と比較して異常に上昇したことから、AD患者のヒト脳の死後研究からも報告されている[88](※1).1-メチル4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)(ミトコンドリア呼吸鎖複合体Iを阻害する神経毒であり、黒質ニューロンの変性を通じてPD症状を模倣する)誘発神経毒性の動物モデルに基づくいくつかの研究は、NOS阻害が疾患病理の進行を遅延することを示した。
また、PD患者の死後脳の研究から、NOとペルオキシナイトライトの関与が報告され、黒質コンパクト部の変性したニューロンでチロシン残基のニトロ化が上昇することが報告された[89]。さらに、タンパク質のチロシン残基のニトロ化は、幅広い神経変性疾患の病因における重要な因子として浮上している[90]。NOを介した神経変性疾患の病態の大半が、ニトロ化を介していることも、ここで興味深い点である。
4.1. タンパク質のチロシン残基のニトロ化の経路
NOラジカルとスーパーオキシドラジカルが反応すると、ペルオキシナイトライトが生成される。ペルオキシナイトライトは二酸化炭素と反応してニトロソペルオキシカルボキシレートを形成し、さらにNOラジカルと炭酸ラジカルを発生させる。
NOと炭酸ラジカルは最終的にチロシン残基のニトロ化を引き起こす[90, 91]。ペルオキシナイトライトがプロトンと反応すると、ペルオキシナイトライト酸が生成され、ヒドロキシルラジカルと二酸化窒素ラジカルに分解される。二酸化窒素とヒドロキシルラジカルは、チロシンからプロトンを引き出してチロシンラジカルを生成し、さらにチロシンラジカルとNOラジカルの再結合により、3-ニトロチロシンを生成する[90, 91]。
* *
あるいは、ペルオキシナイトライトは遷移金属種と反応し、ニトロニウムイオンが生成される。このニトロニウムイオンは、タンパク質中のチロシン残基のニトロ化に関与する[90]。NOは、NOを介したミトコンドリア呼吸の阻害により表面化するグルタミン酸を介した興奮毒性を通じて、神経変性における神経細胞の壊死を誘導する。
このことは,Bal-PriceとBrownによってリポポリサッカライド活性化アストロサイトとミクログリア細胞培養物において示された[92]。
* *
NOSのアイソフォームからのNOの産生は、それぞれのアイソフォームによって異なる。ナノモル濃度のNOはnNOSによって生成され、生理的な神経保護機能を持つが、マイクロモル濃度のNOはiNOSによって合成される。マイクロモル濃度の炎症性刺激は神経毒性を示す[93, 94]。
NOの異常な過剰産生によるフリーラジカルの特性は、神経炎症において重要な役割を果たす。この結果、生存率および細胞の完全性の低下を通じて、ミトコンドリア分裂によるミトコンドリアの機能不全が生じる[94]。
* *
当初,NOSは海馬の歯状回とCA1領域,大脳皮質,視床下部の室傍核と上室核,嗅球,腹内側核,側坐核,嗅核,脚柱節と外側背側核,視床,小脳扁桃,線条体など脳の様々な部位で同定された[43]。さらに、GI管や骨格筋のNANCニューロンなど、末梢神経系の一部でもその発現が認められた[93, 94]。
CNSにおけるnNOSの存在は,脳血管やアストロサイトで報告されている.nNOSのスプライスバリアントはα,β,γ,µの4つである[94]。末梢系では、血流の調節に関与する血管内皮にeNOSの存在が認められる。iNOSとeNOSの欠乏はよく耐えられるが、一方、nNOSの欠乏は脊髄のニューロンのアポトーシス細胞死を引き起こす[93, 94]。
4.2. 神経変性における神経性一酸化窒素合成酵素
nNOSの毒性作用は,ロテノン,MPTP,6-ヒドロキシドーパミン(6-OHDA)などの異なるPDのモデルで報告された[95-97]。Parathathら[98]は,組織プラスミノーゲン活性化因子を介した興奮毒性に伴う神経変性にNOが重要な役割を果たし,C57B16マウスの海馬領域におけるカイニン酸を介した興奮毒性による神経変性にnNOSが不可欠な役割を果たすと報告した[98]。Long Evansラットの脳におけるNOS3の発現が増加すると、Aβ、APP、Tauタンパク質、グリア線維性酸性タンパク質レベルの上昇、およびコリンアセチルトランスフェラーゼの発現低下を伴うADで見られるのと同様の神経変性が誘発されると報告されている[100]。
亜鉛によって誘導された黒質ドパミン神経変性からの保護は、NO/nNOSによって媒介されることが示された。この効果は、nNOSの阻害を介して亜鉛によってNOが減少し、酸化ストレスの増加によって引き起こされる内在性アポトーシスを介した神経細胞死をもたらすことに起因するものであった。さらに,nNOSはZnによるパーキンソニズムに対して負の制御を示した[101]。
* *
nNOSは、CNSにおけるNOの生成に関与し、神経変性および神経発生を含む様々な病的および生理学的機能の制御に起因している[102, 103]。いくつかのケースでは、内因性nNOSは神経発生に正の役割を果たすことが示された[104]。
nNOSは主に神経細胞の細胞質で発現するが、アストロサイトおよび神経幹細胞(NSCs)でも見出される[105-107]。nNOSによる神経発生の負の制御は、いくつかの研究によって明らかにされた[108-110]。ある研究では,脳虚血後の歯状回における神経新生制御において,nNOS由来とiNOS由来のNOが逆の役割を示すことを報告し,虚血によって誘導される海馬の神経新生には,iNOSの発現上昇とcAMP response element-binding proteinのリン酸化を介してnNOSの低下が関与していることを明らかにした[110]。さらに、nNOS生成物は、時に神経外傷に続いて起こるニューロンの喪失において決定的な役割を担っている[111]。
外傷性脳損傷(TBI)において、nNOSは有害な役割を果たし、nNOSの阻害はTBIにおいて神経保護的な役割を示した[112, 113]。研究により,リン酸化または脱リン酸化の他に,nNOSのS-ニトロシル化がnNOSの活性を可逆的に制御することが明らかにされた[113-116]。このことは、nNOS活性の調節におけるnNOSのS-ニトロシル化の役割を明らかにし、その調節は神経退行性疾患の治療介入の開発において潜在的に重要である可能性がある。
4.3. 神経変性における誘導性一酸化窒素合成酵素
リポ多糖やサイトカインなどの薬剤に対する反応は、炎症性細胞におけるNOの産生を引き起こすが、一般に、これは主にiNOSによって調節されている[117]。したがって、iNOSの抑制を介してNOの生成を抑制することは、炎症性疾患の治療において重要な側面である[118]。
正常な機能組織の破壊は、iNOSを介したNOの過剰産生によって、急性および慢性炎症時に起こる[119]。iNOSの発現は比較的低く、ミクログリアやアストロサイトで高度にアップレギュレートされ、外傷性、神経毒性炎症性、虚血性障害を引き起こす[43, 120-122]。
tumour necrosis factor-α (TNF- α), interleukin-1 (IL-1), and interferon-γ, LPS, and other cytokinesに応答して,マイクログリアとアストロサイト由来のiNOSによりNOが生成される[123-126]。
* *
また、ポリ-L-オルニチンによる神経前駆細胞のiNOSの増強も報告されている[107]。さらに、iNOS+/+ミクログリアにおいてERKシグナル伝達経路の遮断が報告されている[127]。Niemann-Pick type C病マウスから得られたNSCsでは、iNOSの発現が上昇していることが実証された[48]。
さらに、単離されたNSCsでは高濃度のNOが報告され、その後、培養ニューロスフィアの成長が著しく低下し、カスパーゼ3およびGSK 3活性化の濃縮によるアポトーシスカスケードが誘導された[48, 122]。NSCsのNOレベルは低いが、Niemann-Pick type C病 [48]、poly-L-ornithine [107]、corticosterone [128]およびleukaemia inhibitory factor [122, 129]への暴露後にそのレベルは著しく増加する。
* *
炎症は、NOの生成が行われるほとんどの脳病変の主な要因である[130-135]。複数の研究者が、培養物中の活性化グリアによる神経細胞死を導く異なる作用機序を同定した[131, 132]。主にグリアにおけるiNOSの発現によって生成される高レベルのNOは、神経細胞のミトコンドリアチトクロム酸化酵素の阻害を介して神経細胞死を誘導することが判明した[92, 136]。
N-methyl-D-aspartate(NMDA)受容体の活性化に伴う神経細胞の脱分極,グルタミン酸の放出,およびその後の興奮毒性は,NOによる神経細胞の呼吸阻害によって引き起こされる[92, 137-139]。興奮毒性の増強はまた、iNOSが生成したNOが細胞内に存在する貯蔵物からのカルシウムイオン動員の増加によりアストロサイトからのグルタミン酸の放出を導き、小胞グルタミン酸エキソサイトーシスを刺激するという異なる作用様式により起こる[140]。
このメカニズムは、iNOS発現の上昇からNOの生成が非常に高い場合にのみ起こる[130]。iNOS生成NOは、脳内の細胞死をブロックすることにより保護作用を有すると考えられる[141, 142]。
逆に、低レベルのiNOS発現は、低酸素などの特定の他の条件との相乗効果で、細胞死を説得する役割を果たすかもしれない[143, 144]。NOは酸化ストレスを誘発することもでき[145]、酸化的リン酸化がない場合、様々なソースからのオキシダントとともにiNOSから生成されるNOは細胞を殺す可能性がある[130, 145]。
5. 一酸化窒素の産生を阻害する
天然と同様に、いくつかの合成阻害剤は、NO産生を阻害する可能性を持っている。NO産生の阻害に関するこれまでの総説では、NOの合成阻害剤またはアルギニンに基づく阻害剤に焦点が当てられている[35, 146]。別のレビューでは、NOハイブリッド誘導体についてまとめられている[147]。
ここでは、NO産生に潜在的な効果を持つ天然物に注目する。Garcinia mangostana L.から得られる2つのキサントン、α-mangostinとγ-mangostinは、iNOSの発現抑制を介したLPS刺激RAW264.7細胞における有意なNO産生抑制活性を示した[118, 148]。
Xiaらは,Curcuma phaeocaulisから単離されたいくつかの植物成分について,NO産生抑制作用に関する実験を行い,いくつかの化合物がIC50値の範囲が17.34~30.02μMで,NO合成に対して中程度の抑制作用を有することを見いだした.しかし、これらの化合物の作用機序は未解明であった[149]。
C. phaeocaulisから単離された4種のカジナン型セスキテルペンであるphacadinanes A-DのNO阻害作用をLPS活性化マクロファージで検討したところ、これらの化合物のうち2種はIC50値が3.88±0.58および2.25±0.71μMと強い阻害活性を持っていることが判明した[150]。さらに、フェルラ酸の親水性誘導体である1-フェルロイルグリセロールと1-フェルロイルジグリセロールについて、ラットの初代アストロサイトにおけるNO産生とiNOS発現を調べたところ、濃度依存的にiNOS発現とNO産生を抑制することが分かった。この効果のメカニズムは、Nuclear factor-κB経路の抑制であると考えられた[151]。
* *
ステモフォリンとステマントレンCからなるStemona javanica根エキスも、LPS刺激マウスマクロファージ様細胞株J774.1におけるNO産生に対して阻害活性を示した。ステモフォリンの作用機序は、J774.1細胞におけるiNOS発現の抑制であり、ステマントレンCはより高いラジカル消去活性を示し、それがNO抑制につながると推定された[152]。
Sarcocephalus pobeguiniiの葉抽出物はLPSで活性化されたRAW264.7マクロファージにおいて有意なNO阻害活性を示した[153]。最近の研究では、新しいゲドニン型リモノイド、カラパンシンC、フラグマリン型リモノイド、カラパノシンAおよびB、および5つの既知のリモノイド化合物がCarapa guianensis種子から分離され、LPS活性化マウス腹膜マクロファージで研究された。
その結果、カラパンサインCと2種類の既知リモノイドは、NO合成阻害を介してマクロファージ活性化に対して強力な抑制作用を示すことが明らかになった[154]。Nepeta menthoidesとメタドンを用いて、NOの過剰産生抑制によるモルヒネ依存と耐性の予防が報告された[155]。
Pteris multifidaの根の80%メタノール抽出物から、LPSで活性化されたBV-2ミクログリア細胞において有意なNO阻害活性が見出された。この抽出物から単離された成分のいくつかはまた、LPS刺激BV-2細胞におけるNO産生の強力な阻害を示し、COX-2タンパク質発現を減少させ、さらにTNF-α、プロスタグランジンE2(PGE2)、IL-1β、IL-6のレベルを阻害した[156]。
初代ミクログリアにおいて、植物フィーバーフュー(Tanacetum parthenium)に天然に存在するセスキテルペンラクトンのパルテノライドは、iNOS/NO合成の阻害剤として実証された。パルテノライドがiNOS/NO合成を阻害する分子メカニズムは、p42/44マイトジェン活性化プロテインキナーゼ(MAPK)の阻害であるが、IκBα分解やNF-kB p65活性化ではないと示唆された(Fiebichら、2002年)。
* *
また、漢方薬の大傳生方剤[Ligusticum chuanxiongとGastrodia elataの根茎を4:1(w/w)で乾燥]には、LPS刺激RAW264.7細胞におけるiNOSによるNO産生およびCOX-2発現抑制作用があると報告された[157]。
Salvia plebeianのテルペノイドは、新規ジテルペノイド2種、新規メロディテルペノイド2種、セスキテルペノイド2種、既知のメロディテルペノイド1種からなり、BV-2細胞のLPSによるNO産生を抑制することが示された。
さらに、分子ドッキングによって検討したところ、これらの天然化合物のいくつかのiNOSタンパク質と相互作用する可能性があることが明らかになった[158]。深海堆積物由来のBacillus subtilis B5由来の7,13-epoxyl-macrolactin Aと同定されたマクロラクチン誘導体は、LPS刺激RAW264.7マクロファージにおけるiNOS、IL-6、IL-1βのmRNA発現を有意に抑制することが報告された[159]。
Bridelia ferrugineaの抽出物は、BV2ミクログリアにおけるNF-kBおよびp38 MAPKシグナルを阻害することにより、iNOSおよびNO合成を防止することによる抗神経炎症活性を明らかにした(Olajiideら、2012)。

まとめと今後の展望
NOは様々な病態、特に神経変性において多大な役割を担っている。神経伝達物質として、それは様々なメカニズムで機能する。したがって、NOの産生および異なるNOS酵素経路を標的とすることは、神経変性疾患と戦うための重要な戦略である可能性がある。
NOを標的とする天然物質は、非常に重要な意味を持つ可能性がある。臨床的な証拠は、主に血管拡張の領域に存在し、神経変性についてはあまりない。したがって,NOの阻害を標的としたさまざまな天然物の有効性の分野でさらに研究を進めれば,神経変性および関連する合併症の潜在的なメカニズムとして役立つ可能性がある。
略語一覧
- 6-OHDA 6-ヒドロキシドーパミン
- AD アルツハイマー病
- ALS 筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis
- APP アミロイド前駆体タンパク質
- CBF 脳血流
- CBS シスタチオニン-β-シンターゼ
- CGMP 環状グアノシン一リン酸
- CNS 中枢神経系
- COX シクロオキシゲナーゼ
- eNOS 内皮型NOS
- FAD フラビンアデニンジヌクレオチド
- FMN フラビンモノヌクレオチド
- HD ハンチントン病
- HO ヘムオキシゲナーゼ
- iNOS 誘導性NOS
- L-NAMA NGモノメチル-L-アルギニン
- L-NAME N-オメガ-ニトロ-L-アルギニンメチルエステル
- LOX リポキシゲナーゼ
- MAP 微小管結合蛋白質(Microtubule Associated Protein
- MPTP 1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン
- mtDNA ミトコンドリアDNA
- NADPH ニコチンアミドアデニンジヌクレオチドホスフェート
- nNOS 神経性NOS
- NO 一酸化窒素
- NOS 一酸化窒素合成酵素
- NOX NADPHオキシダーゼ
- NSC 神経幹細胞
- O2・・・スーパーオキシド
- PCD プログラムされた細胞死
- PD パーキンソン病
- RNS 窒素種
- ROS 活性酸素種
- sGC 可溶性グアニル酸シクラーゼ
