Contents
Natural product agonists of peroxisome proliferator-activated receptor gamma (PPARγ): a review
pubmed.ncbi.nlm.nih.gov/25083916
Biochem Pharmacol.2014 Nov 1; 92(1):73-89.
PMCID: PMC4212005
PMID:25083916
GPT-4+Alzhacker 解説
PPAR
- PPARは脂肪、脂質代謝、炎症、代謝の恒常性に関わる遺伝子を制御する核内受容体である。PPARα、PPARβ/δ、PPARγの3つのアイソタイプが存在する。
- PPARは、脂肪生成や脂質代謝、炎症、代謝の安定性を維持するための遺伝子発現を制御します。脂肪酸やその代謝物によって活性化され、脂質センサーとして機能する。
PPARγ
- 人体では、PPARγは脂肪細胞分化や脂質代謝、グルコースの恒常性維持、免疫細胞の代謝や炎症調節、細胞増殖を制御する役割がある。また、多くのがん細胞で増殖やアポトーシスを調節し、がん治療のターゲットになり得る。
- PPARγアゴニストは、メタボリックシンドロームや2型糖尿病の治療に効果的であるが、副作用が問題となっており、新しいリガンドの開発が求められている。天然物は創薬に有望な素材であり、伝統的な薬用植物や食用天然物からのPPARγ活性化能の研究が盛んに行われている。
- PPARγはがん細胞の増殖やアポトーシスを調節するため、新たながん治療のターゲットとして期待されている。
医薬
- メタアナリシスでは、ロシグリタゾンの長期使用が心筋梗塞や心不全のリスクを上げ、心血管死亡のリスクも増加することが示されている。一方、ピオグリタゾンは2型糖尿病患者のインスリン抵抗性を大幅に改善する。
植物製剤
- 植物製剤の伝統的な使用法は、成分の薬理作用に関するヒントを提供し、多くの植物由来の医薬品が伝統的な使用法に関連する疾患に使用されている。また、一般的な食物源の植物からもPPARγリガンドが見つかっている。
- 天然物から同定されたアゴニストのほとんどは、それ自体では弱いPPARγアゴニストであるが、その代謝物の効果はさらなるPPARγアゴニストは、メタボリックシンドロームや2型糖尿病の治療に役立つが、現在使用されている薬には副作用があり、新しいリガンドを見つけることが重要である。
- 天然物は創薬に有望であり、近年では様々な薬用植物や食品由来の天然物からPPARγを活性化する成分が研究されている。
食物のPPARγアゴニスト
- 表1では、研究で特に興味深い例、伝統医学での使用、そして同定されたPPARγ活性化成分がまとめられている。特筆すべきことは、伝統的な薬として使われる植物やキノコだけでなく、PPARγリガンドが一般的な食物源の植物からもよく見つかることである。
- 表1では、研究で特に興味深い例、伝統医学での使用、そして同定されたPPARγ活性化成分がまとめられている。特筆すべきことは、伝統的な薬として使われる植物やキノコだけでなく、PPARγリガンドが一般的な食物源の植物からもよく見つかることである。例として、茶植物、大豆、パーム油、生姜、ブドウとワイン、そして多くの料理で使われるハーブやスパイス、ローズマリー、セージ、タイムなどが挙げられる。
- 食事介入によって、PPARγの活性を調節することができる可能性がある。
デュアルアゴニスト
- 天然物から見つかった6種類のPPARγアゴニストは、糖尿病動物モデルで効果があり、副作用が少ないことが示されており、PPARγとPPARαの両方を活性化できるデュアルアゴニストとして機能することが示されている。これらの天然物はゲニステイン、ビオチャニンA、サルガーキノ酸、サルガヒドロキノ酸、レスベラトロール、アモルファスチルボルである。
- ゲニステインは、低濃度ではエストロゲン活性を示し、濃度が高くなるとPPARγまたはエストロゲン受容体を優先的に活性化する。この結果、骨の生成と脂肪の生成に対して反対の効果がもたらされる。
- 追記:ゲニステインが豊富に含まれている食品には、大豆製品が代表的である。特に、納豆、豆腐、味噌、大豆ミルク、枝豆などが含有量が高いことで知られている。
- さらに、糖尿病動物モデルにおいて、ホノキオール、マグノロール、レスベラトロール、アモフルチン1、アモフルチンB、アモルファスチルボールは、血糖値や関連パラメータの改善に効果があり、副作用が少ないことが示されている。特に、ホノキオール、アモルフルチン1、アモルフルチンB、アモルファスチルボルは、動物モデルで体重増加を抑制する効果がある。
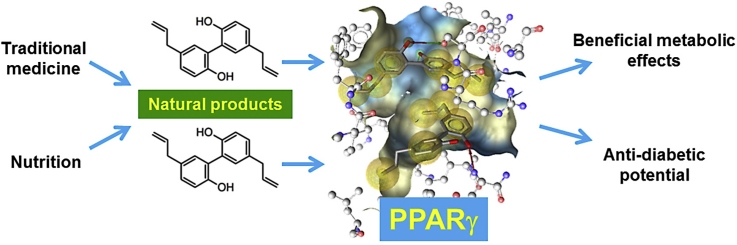
グラフィカル要旨

キーワード PPARγ、核内受容体、天然物、栄養、糖尿病
略語 9-(S)-HODE、(9S,10E,12Z)-9-ヒドロキシオクタデカ-10,12-ジエノイン酸、AF-2、活性化機能-2、CAP、c-Cbl-関連タンパク質、Cdk5、サイクリン独立キナーゼ5、DCM、ジクロルメタン、DIO、食事誘導性肥満。DPP-4、ジペプチジルペプチダーゼ4、EMA、欧州医薬品庁、FDA、食品医薬品局、Glut4、グルコーストランスポータータイプ4、HDL、高密度リポタンパク質、HUVEC、ヒト臍帯静脈内皮細胞。LBD、リガンド結合ドメイン;LDL、低密度リポタンパク質;MAPK、マイトジェン活性化タンパク質キナーゼ;MeOH、メタノール;NF-κB、核因子-κB;PPAR、ペルオキシソーム増殖因子活性化受容体.RXR、レチノイドX受容体;PDB、タンパク質データバンク;PPRE、ペルオキシソーム増殖剤応答要素;SPPARMs、選択的PPARγモジュレーター;TCM、伝統中国医学;TNF-α、腫瘍壊死因子α
今回研究した化学物質 ピオグリタゾン(PubChem CID:4829)、マグノロール(PubChem CID:72300)、ホノキオール(PubChem CID:72303)、ファルカリンジオール(PubChem CID:5281148)、レスベラトロール(PubChem CID:445154)、アモルフルチン1(PubChem CID:10132170)、ロシグリタゾン(PubChem CID:77999)、ケルセチン(PubChem CID:5280343)、(-)-カテキン(PubChem CID:73160)、リノール酸(PubChem CID:5280934)。
要旨
核内受容体PPARγのアゴニストは、メタボリックシンドロームや2型糖尿病に伴う高血糖の治療薬として使用されている。現在使用されているチアゾリジン系のPPARγアゴニストは、血糖値の正常化に有効であるにもかかわらず、重大な副作用があり、新規リガンドの発見が重要視されている。
天然物は、歴史的に創薬に有望な構造体であることが証明されており、近年、伝統的な薬用植物や食用由来の幅広い天然物のPPARγ活性化能を探索するための重要な研究努力が行われている。
同定された化合物の多くは、選択的PPARγモジュレーター(SPPARM)であり、部分アゴニストとしてPPARγ依存性レポーター遺伝子の発現をトランスアクティブ化する。これらの天然PPARγリガンドは、完全なチアゾリジン系アゴニストと比較して、受容体への結合様式が異なり、場合によってはPPARα(例:ゲニステイン、ビオカニンA、サルガーキノ酸、サルガヒドロキノ酸、レスベラトロール、アモルファスチルボル)またはPPARγダイマーのパートナーのレチノイドX受容体(RXR:例:新リグナン類のマグノロール、ホノキオール)にも作用する。多くの生体内試験研究により、PPARγの天然物活性化剤(例:honokiol、amorfrutin 1、amorfrutin B、amorphastilbol)は、糖尿病動物モデルの代謝パラメータを改善し、一部は完全チアゾリジン作動薬と比較して副作用が軽減されている。これらの活性化合物や植物抽出物の生物活性パターンや食事利用については、今後、治療の可能性や食事介入や食品サプリメントによるPPARγ活性化の調節の可能性について研究する必要がある。
1.代謝異常の意義
メタボリックシンドロームは、現在、世界的な大流行となっている。メタボリックシンドロームは、肥満、インスリン抵抗性、2型糖尿病、心血管疾患と強く関連しており、これらは世界中で死亡率や罹患率の原因となっている主要な病態である。現在、メタボリックシンドロームは、すでに世界の成人人口の4分の1以上に影響を及ぼしている。高カロリー栄養と低運動を特徴とする生活スタイルにより、その有病率は大人と子供の両方でさらに増加している[1],[2].
メタボリックシンドロームは、エネルギーの利用と貯蔵の不均衡に関連する疾患と定義されている。その特徴は、腹部肥満、高血圧、脂質異常症(血清トリグリセリドの増加、高密度リポタンパク質(HDL)および低密度リポタンパク質(LDL)コレステロール値の低下)、空腹時血糖値の上昇を伴うインスリン抵抗性、グルコース不耐性、ならびに血栓促進および炎症促進状態の確立にある[3].メタボリックシンドロームに罹患した人は、心血管疾患や2型糖尿病の発症リスクが高くなると言われている。さらに、最近の研究では、メタボリックシンドロームに関連した肥満が、慢性的な低悪性度の局所組織の炎症を引き起こし、脂肪肝、睡眠障害、コレステロール胆石、多嚢胞性卵巣症候群、喘息、ある種の癌などの他の疾患状態への感受性を高めることが示されている[3],[4].
メタボリックシンドロームの管理における2つの主要なアプローチは、第一に、摂取カロリーの削減と身体活動によるエネルギー消費の増加によってエネルギーバランスを回復することを目的とした生活様式の修正であり、第二に、薬物介入である[1],[3].使用される薬剤は、体重や脂肪分布、インスリン抵抗性、高血圧、脂質異常症、高血糖、あるいは確立した血栓症や炎症性状態など、メタボリックシンドロームのさまざまな関連する側面をターゲットとしている[3]。2型糖尿病患者の治療には、生活習慣の改善以外に、まずインスリンとインスリンアナログが適用された[5]。その後、スルホニル尿素(インスリン分泌を増加させる)[7]、ビグアナイド(インスリン感作薬、例:メトホルミン)、α-グルタミン酸(α-グルタミン酸ナトリウム)[6]など、多くの経口高血糖改善薬が開発され、うまく使用されている。メトホルミン)、α-グルコシダーゼ阻害剤(小腸でのデンプンの消化を遅らせる)、メグリチノイド(インスリン分泌を増やす)、ジペプチジルペプチダーゼ4(DPP-4)阻害剤(インスリン分泌を増やす)[6]、チアゾリジンソン(PPARγのアゴニスト)等である。また、最近の研究戦略では、核因子-κB(NF-κB)経路[8]、マイトジェン活性化タンパク質キナーゼ(MAPK)シグナル[9]、脂肪酸結合タンパク質[10]、および脂肪酸代謝に関わる他のターゲット[11],[12]を標的とした研究も行われている。チアゾリジン系薬剤の分子標的であるPPARγは、インスリン感受性、炎症、脂肪酸貯蔵、グルコース代謝の制御に特に関与しており、したがって、メタボリックシンドロームの基礎となるいくつかの病態を同時に調節することができる、特に興味深い薬理学の標的となっている[13],[14].
2.PPARγと代謝制御
PPARは、核内受容体スーパーファミリーのリガンド誘導型転写因子のサブファミリーに属している[15]。現在までに、別々の遺伝子によってコードされる3つのPPARアイソタイプ、PPARα[16]、PPARβ/δ、PPARγ[17]が確認されている。
PPARは主に、脂肪形成、脂質代謝、炎症、代謝の恒常性の維持に関わる遺伝子ネットワークの発現を制御している。食事の脂肪酸やその代謝物によって活性化されるため、脂質センサーとして機能し、活性化されると代謝を著しく変化させることができる[18],[19],[20].遺伝子の転写過程は、3つのPPARサブタイプすべてで同じである(図1)。リガンド結合後、PPARはもう一つのリガンド活性化核内受容体であるレチノイドX受容体(RXR)とヘテロ二量体を形成する。PPAR-RXRヘテロ二量体は、それぞれの標的遺伝子のプロモーター領域にあるペルオキシソーム増殖剤応答要素(PPRE)に結合する。そして、様々な転写補因子[21],[22],[23],[24]の働きにより、転写プロセスが開始される(図1)。

図1 PPARγの転写活性
(1) PPARγおよびその二量体パートナーであるRXRへの活性化リガンドの結合 (2) リガンド結合後、受容体のコンフォメーション変化が起こり、転写複合体の再配列と関連転写補因子の変化が起こる。(3) この再配列の結果、転写複合体が活性化して制御されるPPARγ標的遺伝子の発現変化が開始される。
3種類のPPARアイソタイプは、それぞれ異なる組織分布を持ち、エネルギー代謝の制御において異なる機能を有している。PPARαは筋肉、肝臓、心臓、腎臓で高発現し、主に脂質とリポ蛋白の代謝に関わる遺伝子を制御する[20],[25],[26],[27].PPARβ/δは、全身に豊富に発現しているが、肝臓では低レベルである。主に脂肪組織、骨格筋、心臓において、脂質代謝とエネルギーバランスの重要な制御因子として浮上している[25],[28],[29].PPARγタンパク質は、異なるプロモーターと5′エクソンを利用して同じ遺伝子から発現する2つのアイソフォームが存在する。PPARγ2はPPARγ1とは異なり、N末端のリガンド非依存性ドメインに30アミノ酸残基が追加されており、PPARγ1と比較して高い転写活性を持つ[30],[31],[32]。2つのPPARγアイソフォームはまた、異なる発現パターンを示している。PPARγ1は脂肪組織、大腸、造血細胞に多く発現し、腎臓、肝臓、筋肉、膵臓、小腸にはあまり発現しない。PPARγ2は生理的条件下では白色脂肪組織と褐色脂肪組織に限定されている[25],[33],[34].
PPARγの内因性リガンドには、脂肪酸やプロスタノイド[19],[35]があり、強力な合成チアゾリジン系アゴニスト[36],[37]と比較して弱いアゴニストとして作用する。PPARγが非常に特異的な内因性リガンドを持っているのか、それとも様々な脂肪酸やエイコサノイドによって協調的に活性化される、むしろ乱雑な生理的脂質センサーとして働いているのかという疑問は、まだ明確に解決されていない[38],[39],[40],[41],[42],[43].
人体では、PPARγは脂肪細胞分化のマスターレギュレーターであり、脂質代謝とグルコースのホメオスタシスにおいて重要な役割を果たし、免疫細胞における代謝と炎症を調節し、さらに細胞増殖を制御する[44],[45],[46].PPARγは、前駆脂肪細胞から脂肪細胞への分化の際に誘導される[47],[48],[49]。PPARγ欠損マウスが脂肪組織を完全に欠くという事実は、PPARγが脂肪細胞の分化に必須であることを明確に示している[50]。さらに、PPARγは、脂肪細胞の脂質貯蔵に関与する多くの遺伝子を直接活性化する[51]、[52]。また、脂肪組織は、チアゾリジン系PPARγリガンドのインスリン感作作用を担う主要な組織である。PPARγは、脂肪組織から分泌される多数の因子の発現を制御し、インスリン感受性にポジティブ(例:アディポネクチン、レプチン)またはネガティブ(例:レジスチン、腫瘍壊死因子-α)に影響する。さらに、PPARγは、グルコースホメオスタシスに関与する遺伝子の発現を直接調節することができ、例えば、グルコーストランスポーター4型(Glut4)およびc-Cbl-associated protein(CAP)の発現をアップレギュレートする[53], [54].PPARγはまた、様々な免疫系関連細胞、特にマクロファージや樹状細胞のような抗原提示細胞で発現している。これらの細胞では、PPARγは脂質代謝に関連する遺伝子だけでなく、免疫や炎症に関連する遺伝子も制御している[55],[56],[57],[58]。また、動物モデルで観察されたPPARγ活性化チアゾリジン系薬剤の抗動脈硬化活性は、主にマクロファージにおけるPPARγ制御遺伝子発現の調節を介して生成されると考えられている[44]、[59]。PPARγは、代謝および抗炎症作用に加えて、多くのがん細胞タイプの増殖およびアポトーシスを調節し、肺がん、乳がん、結腸がん、前立腺がんおよび膀胱がんを含む多くのヒト腫瘍で発現している。天然および合成のPPARγ活性化剤は、試験管内試験および動物モデルでがん細胞の増殖を抑制することが判明しているため、PPARγは新しいがん治療のターゲットとなる可能性もある[44],[60],[61].
アゴニストや補酵素の利用可能性とは別に、PPARγの転写活性はそのリン酸化状態によっても制御され、微調整の可能性がさらに広がる[62],[63].サイクリン依存性キナーゼ5(Cdk5)によるPPARγのSer273でのリン酸化は、最近、肥満と関連しており、抗糖尿病PPARγリガンド(例えば、チアゾリジン系ロシグリタゾン)は、脂肪組織におけるCdk5媒介のPPARγのリン酸化を阻害することが示された[62]。さらに、アゴニストとしての活性は低いが、invivoで強力な抗糖尿病効果を示すいくつかのPPARγリガンドは、Cdk5によるPPARγのリン酸化を強く阻害することが明らかになった。これらのリガンドが持つSer273のリン酸化を抑制する能力は、抗糖尿病効果とよく相関していたが、現在臨床で使用されているPPARγリガンドの副作用に含まれる古典的な作動性効果とは無関係であった。その結果、PPARγのSer273リン酸化を標的とした阻害は、新世代の抗糖尿病薬の開発に有望なアプローチであることが示唆された[62]。
PPARγアゴニストの応用は様々な病態で研究されているが、今のところPPARγリガンドとして承認されているのは、2型糖尿病におけるチアゾリジン系薬剤(完全PPARγアゴニスト)の応用だけだ。チアゾリジン系薬剤は、1990年代後半に2型糖尿病患者のインスリン抵抗性を緩和する新しいクラスの薬剤として初めて登場した[64],[65],[66].このクラスの薬剤で最初に承認されたのは、1997年3月に発売され 2000年3月に米国市場から撤退したTroglitazone(CS-045)であった[67]。トログリタゾンはPPARγを優先的に活性化するが、PPARαのリガンドにもなっている。2型糖尿病対策薬として、トログリタゾンは肥満被験者のインスリン感受性と耐糖能を向上させる[68],[69],[70],[71],[72],[73],[74],[75].また、動脈硬化の初期病変の進行を抑制し、血圧を下げるだけでなく、他の既知の心血管危険因子に好ましい影響を与えることが実証された[76],[77],[78].心血管疾患における利点にもかかわらず、トログリタゾンは、糖尿病患者に対する利点を上回る重篤な、あるいは致命的な肝毒性を引き起こすため、市場から排除された[79],[80],[81],[82],[83],[84],[85].
ロシグリタゾン(BRL-49653)とピオグリタゾンは、2型糖尿病の血糖コントロールのために多くの国で臨床使用されているチアゾリジン系薬剤であるが、欧州ではロシグリタゾンを含む糖尿病治療薬が欧州医薬品庁(EMA)の販売許可停止勧告を受けて市場から排除されている(2010年9月23日プレスリリース:EMA/585784/2010)。米国では、2010年9月にFDA(米国食品医薬品局)によりロシグリタゾンの使用が制限され、2013年11月には再び制限が解除されたが、FDAが公式に発表したDrug Safety Communication(2013年11月25日付)によると、「ロシグリタゾン医薬品の心血管系の安全性に関するいくつかの科学的不確実性は依然として残る」とある。ロシグリタゾンは、インスリン抵抗性を低下させる効果が証明されている[86],[87],[88],[89],[90]。しかし、いくつかのメタアナリシスでは、耐糖能異常または2型糖尿病患者において、ロシグリタゾンを12カ月以上使用すると、心筋梗塞および心不全のリスクが有意に上昇し、心血管死亡のリスクも上昇することが示された[91],[92],[93],[94],[95].さらに、いくつかの症例報告では、ロシグリタゾンの適用が肝細胞障害[96]や肝不全[97]といった、トログリタゾンで観察されたものと同様の副作用と関連するかもしれないと懸念されている。ロシグリタゾンと同様に、ピオグリタゾンによる2型糖尿病患者の治療は、インスリン抵抗性を著しく低下させる[98]。ロシグリタゾンと比較して、ピオグリタゾンは血漿脂質プロファイルに有益な効果を発揮し、急性心筋梗塞、脳卒中、心不全のリスクを低下させる[99],[100],[101],[102],[103].しかし、ピオグリタゾンの臨床使用は、体重増加、体液貯留、そしておそらく膀胱癌を含むいくつかの有害事象の発生によって制限されている[104],[105],[106].
3.天然物によるPPARγの活性化
チアゾリジン系薬剤の重篤な副作用が市場からの撤退や臨床応用の制限につながったのは、脂肪酸やプロスタノイドなどの内因性PPARγリガンドの弱いアゴニスト作用とは対照的に、PPARγが完全に活性化した結果であると考えられている[19],[107].そのため、最近、選択的PPARγモジュレーター(SPPARM)、すなわち、選択的な受容体-因子相互作用と標的遺伝子制御に基づく部分的なPPARγアゴニズムにより、グルコースの恒常性を改善しながら副作用を軽減する化合物の可能性を探るために、大きな研究努力がなされている[107],[108],[109].最近同定されたSPPARMの例として、N-アセチルファルネシルシステインが挙げられる。この化合物は、試験管内試験および生体内試験において、調査したPPARγ標的遺伝子に応じて、完全アゴニストおよび部分アゴニストとして有効である[110]。さらに、2つまたは3つのPPAR受容体を同時に活性化するデュアルPPARおよびパンPPARアゴニストの治療可能性を探ることも検討されている[111],[112],[113],[114].
薬用植物は何千年も前から様々な病気の治療に使われており、19世紀以降、これらの植物から単離された多くの生理活性純粋化合物が非常に成功した薬となった[115]。さらに、今日でも天然物は、新薬の発見と開発のための重要な材料となっている[116]。天然物は高い化学的足場多様性を持ち、異なる生物学的機能を果たすように進化的に最適化されているため、高い薬剤親和性を持ち、新薬のリード化合物を同定するための優れた材料となる[117],[118],[119].植物製剤の伝統的な使用法は、その成分の薬理作用について強いヒントを与えることが多い。臨床的に使用されている119種類の植物由来の医薬品を調査したところ、その74%が、物質が分離された薬用植物の伝統的な使用法に関連する疾患の適応症に実際に使用されていることがわかった[120]。当然のことながら、薬用植物に由来する広範な天然物のPPARγ活性化の可能性を探るために、重要な研究努力が行われた。表1には、研究対象となった最も興味深い例、伝統医学におけるその使用、および同定されたPPARγ活性化成分がまとめられている。注目すべきは、伝統的な薬に用いられる植物やキノコとともに、PPARγリガンドが一般的な食物源である植物からしばしば同定されたことである。例えば、茶植物(Camellia sinensis)、大豆(Glycine max)、パーム油(Elaeis guineensis)、生姜(Zingiber officinale)、ブドウとワイン(Vitis vinifera)、多くの料理のハーブとスパイス(e.Origanum vulgare、Rosmarinus officinalis、Salvia officinalis、Thymus vulgarisなど)(表1)。食品にPPARγリガンドが存在することから、この核内受容体が栄養補助食品(機能性食品または栄養補助食品)の摂取によって効果的に活性化されるかどうかを調べる必要がある。食品から同定されたアゴニストのほとんどは、それ自体では弱いPPARγアゴニストであるが、その代謝物の効果は、予防の可能性をよりよく見積もるためにさらなる研究に値する。この方向での研究はほとんど行われていないが、以前の研究では、アカツメクサ(Trifolium pratense)のフラボノイド成分のいくつかの主要代謝物が、その前駆体よりも最大100倍高いPPARγ結合親和性を持つことが報告されている[121]。
表1 PPARγリガンドの供給源として調査された種、その伝統的な使用法、および活性化天然物の同定
| 種族名 | 伝統的な使い方 | PPARγ活性化天然物の同定 |
|---|---|---|
| 鰍沢 | 中国、日本、韓国で高血圧、血腫、挫傷の治療に伝統的に使用されている[201]。 | アモルフルチン類(果実中)[187件] |
| 椨の木 | 中医学では、気を補い、表面的な抵抗を強化し、膿の排出と新しい組織の成長を促進するために使用される[202]。 | フォルモノネチン(エタノール抽出物中)[138]。 |
| オレルナ | インドの伝統医学では、植物のさまざまな部分が利尿剤、下剤、抗不安剤、制吐剤、収斂剤として、血液浄化剤、黄疸、赤痢に、また傷の予防として外用されている[203]。 | ビキシン、ノルビキシン(アNATO抽出物中)[204]。 |
| くっしゅ | インドの伝統医学では、興奮剤、利尿剤、収斂剤として使用されている。中国では、下痢や赤痢の治療に使用される[203]。 | (-)-カテキン(緑茶に含まれる)[205]。 |
| 大麻草 | インドの伝統医学では、幻覚剤、催眠剤、鎮静剤、鎮痛剤、抗炎症剤として使用されている[203]。 | Δ9-テトラヒドロカンナビノール[170]の場合 |
| クロモレナ・オドラータ(L.) R.M. King & H. Rob.(キク科) | タイの伝統医学では、傷、発疹、糖尿病の治療、虫除けとして使用される[206]。 | (9S,13R)-12-オキソ-フィトジエノイン酸(全草のクロロホルム可溶性エキス中)[207]、オドラチン(DCMエキス中)[208]。 |
| まゆうえん | 中医学では、脾臓の機能を活性化し、排尿を促進し、関節炎を緩和し、下痢を止め、熱を取り除き、膿の排出を促進するために使用される[202]。 | ヒドロキシ不飽和脂肪酸(種子からのアセトン抽出物中)[209]。 |
| ムックル | オレオガムレジンは、インドの伝統医学で、肥満の解消や、関節リウマチ、変形性関節症、坐骨神経痛の治療に用いられている[203]。 | コミフェリン酸(樹木のガムの酢酸エチル抽出物であるググリピッドに含まれる)[210]。 |
| 山茱萸 | 中医学で強壮、鎮痛、利尿剤として用いられる[211]、[212]。 | Kaempferol-3-O-β-glucopyranoside(乾燥葉からの90%メタノール抽出物中)[211]。 |
| タカノツメ | インドの伝統医学では、葉は興奮剤、発汗剤、抗生理剤、抗タール剤として、精油は駆風剤、抑圧剤、鎮痛剤、解熱剤、抗菌剤、抗真菌剤として使用される[203]。 | シトラール(レモングラス油に含まれる)[213] |
| べにふうき | アメリカ先住民の土着薬に使われる:傷、火傷、虫刺されに外用、歯痛や喉の感染症に根を噛む、痛み、咳、胃痙攣、蛇に噛まれたときに内用[214]。 | アルカミド(花のn-ヘキサン抽出物中)[215]。 |
| ギネンシス | アフリカの伝統医学では、植物のさまざまな部分が下剤や利尿剤として、毒消しとして、淋病、月経、気管支炎の治療薬として、頭痛やリューマチの治療、生傷の治癒促進や皮膚感染症の治療に使用されている[216]。 | トコトリエノール(パーム油に含まれる)[217件] |
| エレファントパス | 植物のさまざまな部分は、収斂剤、心臓強壮剤、利尿剤、潰瘍や湿疹の治療、リューマチ、解熱、膀胱結石の除去としてインドの伝統医学に使用されている[203]。 | デオキシエレファントピン(218) |
| Epimedium elatumC. Morren & Decne.(メギ科) | 中医学では、腎陽を補強し、腱や骨を強化し、リウマチの症状を緩和するために使用される[202]。 | アシル化フラボノール配糖体(全草のエタノール抽出物中)[219]。 |
| ニセアカシア | 中医学では、月経を促進するために瘀血を促進し、毒物を取り除き、腫れを鎮め、虫や寄生虫を殺すために使われる[202]。 | ケンフェロール、ケルセチン[134件] |
| 麻呂 | の食用豆は、食品および植物性タンパク源として世界中で利用されている[203]。 | ゲニステイン(大豆に含まれる)[135件] |
| カンゾウ | 中医学では、脾の機能を強化し気を補う、熱を取り除き毒を打ち消す、痰を払い咳を和らげる、痙攣性の痛みを和らげる、薬物の作用を緩和する、などの目的で使用される[202]。 | 5′-ホルミルグラブリジン、(2R,3R)-3,4′,7-トリヒドロキシ-3′-プレニルフラバン、エキナチン、(3R)-2′,3′,7-トリヒドロキシ-4′-メトキシイソフラバン、カンゾノールX。kanzonol W、shinpterocarpin、licoflavanone A、glabrol、shinflavanone、gancaonin L、glabrone(根からのエタノール抽出物中)[220]。 |
| 葛根湯 | モロッコのマラケシュ地方の伝統医学で、胃や喉の不調の治療に用いられる[221]。 | アモルフルチン(食用根に含まれる)[187]。 |
| 葛根湯 | 中医学では、脾の機能を強化し気を補う、熱を取り除き毒を打ち消す、痰を払い咳を和らげる、痙攣性の痛みを和らげる、薬物の作用を緩和する、などの目的で使用される[202]。 | リコカルコンE(根の部分)[222] |
| カンゾウ(Glycyrrhiza uralensis)Fisch.ex DC.(マメ科) | 中医学では、脾の機能を強化し気を補う、熱を取り除き毒を打ち消す、痰を払い咳を和らげる、痙攣性の痛みを和らげる、薬物の作用を緩和する、などの目的で使用される[202]。 | フラボノイド、3-アリルクマリン(根のエタノール抽出物中)[136]。 |
| スイングル | ベトナムの伝統医学では、植物のさまざまな部分が去痰薬、鎮咳薬、滲出液、風邪や熱の治療薬として使用されていた[223]。 | メランジン(葉からのエチルアルコール/水(90/10、v/v)抽出物中)[224]。 |
| Lycium chinenseMill.(ソラマメ科) | 中医学で、寝汗、肺炎、咳、吐血、炎症、糖尿病の治療に用いられる[225]。 | 脂肪酸(根皮DCMエキス中)[128]。 |
| モクレンか | 中医学では、湿と痰を取り除き、膨満感を和らげるために使用される[202]。 | マグノロール[140]、[193]、[194]、ホノキオール[175]、[190]、[191]、[192]。 |
| 芒種 | オーストリアの伝統医学で痛風やリウマチの治療に用いられる[122]、[129]。 | ルヌラリンと脂肪酸(空中部のDCMとMeOH抽出物中)[129]。 |
| ウリ科モモルディカ属 | インドの伝統医学では、植物の様々な部分が糖尿病の緩和、胃薬、下剤、抗不安薬、嘔吐薬、駆虫薬として使用されている。また、咳、呼吸器疾患、皮膚疾患、傷、潰瘍、痛風、リウマチの治療にも使われる[203]。 | ククルビタン型トリテルペン配糖体[226] |
| ちょうせんか | 中医学でリウマチ、風邪、頭痛の治療に用いられる[227]。 | ポリアセチレン類(根および根茎のDCM抽出物中)[228]。 |
| はなかんざし | 世界中で料理用ハーブとして使用される。インドの伝統医学では、催乳、鎮痙、駆風、去痰薬として使用されている[203]。 | ビオチャニンA(乾燥葉中)[137] |
| オタネニンジン(Panax ginsengC.A. Mey.(ウコギ科) | 中医学では、生命エネルギーを強化し、虚脱を改善し、正常な脈を回復させ、脾臓と肺を益し、体液の生産を促進し、心を安らげるために使用する[202]。 | ジンセノサイド20(S)-プロトパナクサトリオール[229]、ジンセノサイドRb1(高麗人参の根に含まれる)[230]。 |
| カワラナデシコ | 中医学では、湿と痰を取り除き、吐き気と嘔吐を和らげ、胸と上腹部の痞えをなくすために使われる[202]。 | 脂肪酸(根茎からの異なるアポラー抽出物中)[130]。 |
| キアゲハ | インドの伝統医学における樹脂の用途:駆風剤、利尿剤、刺激剤、収斂剤として[203]。 | オレアノン酸(キオスマスティックガム中)[131] |
| アマビリス(Pseudolarix amabilis)(J.Nelson)レーダー(Pseudolarix kaempferiGordonとして出版)(松科)。 | 中医学で皮膚科の抗真菌薬として用いられる[231]。 | シュードラ酸B(根皮・幹皮の抽出物中)[232] |
| プエラリア・トムソニイBenth.(マメ科) | 中医学で、発熱、急性赤痢、下痢、糖尿病、心血管疾患の治療に用いられる[233]。 | ダイゼイン(エタノール抽出物中)[138]。 |
| Robinia pseudoacaciavar.umbraculiferDC.(マメ科) | インドの伝統医学では、Robinia pseudoacaciaのさまざまな部位が下剤、鎮痙、利尿剤として使用されている[203]。 | アモルファスチルボル(種子エキス中)[234件] |
| オニバス | インドの伝統医学では、花と葉の精油を抗炎症剤、収斂剤、消毒剤、健胃剤、駆風剤として、また循環障害に外用する。花の頂部と葉は駆風剤と利尿剤として使用される[203] | カルノシン酸、カルノソール(ローズマリーのエタノール抽出物に含まれる)[235]。 |
| オキナグサ | インドの伝統医学では、植物のさまざまな部分が収斂、抗炎症、駆風、鎮痙、防腐、血糖降下、抗喘息、胆汁分泌促進、発汗、解熱剤として、また喉の痛み、喉頭炎、扁桃炎、口内炎の治療に使用される[203]。 | カルノシン酸とカルノソール(セージのエタノール抽出物に含まれる)[235]、および12-O-メチルカルノシン酸とα-リノレン酸(セージのDCM抽出物に含まれる)[132]。 |
| ニガウリ | インドの伝統医学では、植物のさまざまな部分が抗炎症剤、抗カタル剤、利尿剤、吐剤として、また風邪、インフルエンザ、鼻カタル、副鼻腔炎の治療に使用されている[203]。 | α-リノレン酸、リノール酸、ナリンゲニン(エルダーフラワーのMeOH抽出物中)[133]。 |
| Saururus chinensis(Lour.) Baill.(サウラ科) | 韓国の伝統医学では、植物の空中部分は、浮腫、黄疸、淋病、およびいくつかの炎症性疾患の治療に使用される[236]。 | サウルフランA(インルーツ)【237件 |
| マリアージュ | 様々な肝疾患の治療におけるサポート剤として世界中で広く使用されている。中医学では、熱を取り除き、毒物を取り除くために、肝臓を落ち着かせ、胆汁の流れを促進するために使用されている[202]。 | イソシルビンA(植物の果実から得られるフェノール混合物であるシリマリンに含まれる)[238]。 |
| 弁慶草 | 果実はインドの伝統医学で貧血、喘息、癌、下痢、高血圧、炎症、リウマチの治療に使用されている[239]。 | ガロタンニン(果実に含まれる)[240] |
| 黄耆 | 世界中の料理用ハーブとして使用される。インドの伝統医学では、殺菌剤、抗菌剤、抗真菌剤、抗ウイルス剤、鎮痙剤、軽い鎮静剤、去痰剤として、咳や風邪に用いられる[203]。 | カルバクロール(タイムオイルに含まれる)[241件] |
| プラタナス | インドの伝統医学において、消炎剤、鎮痙剤、去痰剤、鎮静剤、抗炎症剤、抗皮膚炎剤として使用されている[203]。 | イソフラボン(レッドクローバー抽出物中)[121]。 |
| ヴィティス・ヴィニフェラL.(ブドウ科) | インドの伝統医学では、咳、呼吸器系のカタル、肝臓や脾臓の肥大の亜急性の場合の処方や、アルコールベースのトニック(Aasavs)に使用されている[203]。 | エラグ酸、エピカテキンガレート、フラボノイド(ブドウ、ワインに含まれる)[242]。 |
| Wolfiporia extensa(Peck) Ginns (published asPoria cocosF.A. Wolf) (Polyporaceae) | 中医学では、このキノコは排尿を促し、脾臓の機能を活性化させ、心を落ち着かせるために使われる[202]。 | デヒドロトラメテノール酸(乾燥硬化体中)[243] |
| 金糸雀牙 | 中医学では、生の根茎は外邪を払い、中気を温めて嘔吐を止め、痰を取り除き、咳を止めるのに用いる。乾燥した根茎は、脾胃の冷えを払い、虚脱からの回復を促進し、肺を温めて滞留した病的な液体を排出するのに用いる[202]。 | 6-ショウガオール(ショウガの根に含まれる)【244件 |
表1に示した種の伝統的な使用法が、PPARγ活性化に関連する生物活性のヒントになる場合もあるが、伝統的な製剤の用途は、PPARγ作用に関連するとは考えにくい幅広い症状に及ぶことが多いことを強調しておきたい(例えば、以下のようなものである。エキナセア・プルプレアは、傷、火傷、虫刺され、歯痛、喉の感染、痛み、咳、胃痙攣、蛇に噛まれた時の治療に伝統的に使用されている。この例では、伝統的な使用範囲は、異なる分子標的との相互作用から生じる多様な生物活性に関連していることが非常に高いと考えられる)
さらに多くの植物抽出物がPPARγを活性化することが報告されているが[122],[123],[124],[125],[126],[127],表1は、主にそれぞれの抽出物に含まれる生物活性化合物を特定した研究の要約である。生物活性化合物の同定を頻繁に省略する理由の1つは、一般的にPPARγ活性化を誘導する薬用植物抽出物の数が非常に多いためかもしれない。例えば、オーストリアの伝統的な薬用植物からの抽出物のPPARγ転写能を調べた最近の研究では、10μg/mLの濃度で試験した場合、研究した71の生薬のうち40(ヒット率56%)がPPARγ活性化を誘導することができることが確認されている[122]。このように活性の高い抽出物の数が多いため、それぞれの抽出物に含まれる生理活性化合物を同定することが困難である。さらに、手間のかかる植物化学分析では、興味深い新規PPARγリガンドが同定されることはなく、脂肪酸[128],[129],[130],[131],[132],[133]やフラボノイド[121],[133],[134],[135],[136],[137],[138]など、受容体を活性化しているどこにでもある植物成分の再単離に終わることが多い。
抽出物のテストやバイオガイド的なアプローチに加え、バーチャルスクリーニングは、天然資源から新規PPARγリガンドを発見するための有効な戦略として浮上した。Ruppらは、144種類のPPARγリガンドが公表されているデータセットに基づき、記述子ベースのガウス過程回帰を用いてPPARγアゴニストを検索した[139]。予測モデルと殺害予定者リストの手動検査の組み合わせにより、15化合物が得られ、PPARαおよびPPARγの活性化に対して実験的に評価された。8つの化合物は、これらの受容体のいずれか、または両方に対してアゴニスト活性を示した。最も活性の高い化合物であるトルキシル酸誘導体は、EC50が10μMの選択的なPPARγアゴニストであった。Petersenらは、57,000以上の伝統的な漢方薬の成分を含むデータベースのファーマコフォアに基づく仮想スクリーニングを実施した[131]。リガンドベースのファーマコフォアモデルは、1つの水素結合受容体と3つの疎水性機能で構成され、13の選択的な部分的PPARγアゴニストのセットに基づいていた。バーチャル殺害予定者リストには939のエントリーが含まれていた。例えば、Pistacia lentiscusに存在する1つのバーチャルヒットは、Pistaciaoleoresinエキスのテストと活性エキスのバイオガイド分画を含む実験的に調査された。これらの努力の結果、オレアノン酸は部分的なPPARγアゴニストとして中程度の活性を持つことが発見された。Fakhrudinらは、部分的なPPARγアゴニストとしてdieugenol、magnolol、およびtetrahydrodieugenolを発見した[140]。彼らは、構造ベースのファーマコフォアモデルを使用して、天然化合物データベースをスクリーニングした。高ランクのヒットのうち、いくつかのネオリグナンが単離または合成され、PPARγに対する試験管内試験活性について実験的にテストされた。また、EC50値が低マイクロモルまたはサブミクロモルの範囲にあるDieugenol、tetrahydrodieugenol、およびMagnololは、3T3-L1脂肪細胞において脂肪細胞分化を誘導した。Lewisらは、PPARγに対する評価と過敏性腸疾患マウスモデルでの評価のために、ドッキングを使用して天然物を選択した[141]。ドッキングから得られたトップランクのバーチャルヒットであるα-エレオステアリン酸は、PPARγ結合アッセイ、細胞ベースのレポーターアッセイ、および過敏性腸症候群の生体内試験マウスモデルで活性を示した。Salamらは、マルチステップドッキングプロトコルを用いて、社内の小規模天然物ライブラリーをスクリーニングした[142]。彼らは、200のドッキング化合物から29のヒット化合物を選び、機能的なPPARγ活性アッセイで実験的に分析した。サイバプティゲニン、ヘスペリジン、アピゲニン、クリシン、ビオチャニンA、ゲニステインの6つの化合物は、低マイクロモル領域でEC50を示した。最後に、Tanrikuluらは、異なるアゴニストとの複合体における4つのPPARγのX線結晶構造の共通の相互作用に基づく構造ベースのファーマコフォアモデルを使用した[143]。彼らは、天然物やその半合成誘導体を含むAnalyticonデータベースをスクリーニングした。その結果、2種類のα-サントニン誘導体がPPARγ活性化剤として発見されたが、α-サントニン自身は受容体に対して活性化しなかった。以上のように、2次元および3次元のバーチャルスクリーニングにより、天然物由来の多様なPPARγ活性化物質の発見に成功し、天然物が新規PPARγアゴニストの豊富な供給源となることが示された。
PPARγリガンドとしてよく特徴付けられている天然物の選択を表2に示す。内因性(例えば脂肪酸、プロスタノイド)[19]、[26]、[144]、[145]、[146]、[147]、[148]、[149]、[150]、[151]および合成[13],[151],[152],[153]受容体のリガンドのPPARγ 拮抗作用は多数の過去記事でレビューされているのでここでは説明しないことにする。50μMを超えるEC50またはIC50でPPARγを活性化または結合すると報告された天然物は、関連性が低いと考えられ、したがって表2から除外された。これまでに、多数の天然物がPPARγ活性または発現を阻害することが示されたが(表1および参考文献[142]、[154]、[155]、[156]、[157]、[158]、[159]、[160]、[161]、[162]。[163]、[164]、[165]、[166]、[167]、[168]、[169]、[170]、[171]、[172]、[173])、表2に示す化合物は、PPARγ活性化に応答する細胞モデルにおいて有効性を示しただけでなく(例:PPARγ依存性レポーター遺伝子発現の活性化PPARγ依存性レポーター遺伝子発現の活性化)だけでなく、精製PPARγタンパク質を用いた試験管内試験結合アッセイにおいて、受容体に直接結合することが示された。精製された受容体を用いた結合アッセイは、化合物がPPARγと物理的に相互作用する可能性を確認するための最も直接的なアプローチの1つであるが、タンパク質ベースの試験管内試験アッセイの適用だけでは、それぞれの化合物が無傷の細胞でも作用できることを保証するには十分ではない(化合物が細胞核の中にあるPPARγに届かないかもしれないから。は、細胞膜を伝染できない、膜排出トランスポーターによって細胞から押し出される、PPARγと結合しない生成物への代謝変換など、さまざまな理由によるものである。).一方、ルシフェラーゼレポーターモデルで観察されるPPARγ活性化は、間接的な効果(PPARγタンパク質発現の増加、PPARγ二量体パートナーRXRの活性化など)により引き起こされる可能性もあるため、細胞モデルの使用だけでは、研究対象化合物が直接的な受容体リガンドであるとは言い切れない。表2で取り上げた20種類の天然物には、7つの構造クラス(フラボノイド、ネオリグナン、スチルベン、アモルフルチン、ポリアセチレン、セスキテルペンラクトン、ジテルペンエキノン誘導体)の代表が含まれている。このような構造の多様性は、PPARγリガンド結合ドメイン(LBD)が、結合部位のキャビティの大きさと側鎖の柔軟性による適応性によって、多様な化学的足場を収容することができることが知られていることと一致している[43],[174].6-hydroxydzeinと(-)-catechinを除いて、表2に示した化合物はすべて、PPARγ依存性のレポーター遺伝子発現に対して部分的にアゴニスティック効果を示すSPPARMであることが明らかになった。ゲニステイン、ビオチャニンA、サルガーキノ酸、サルガヒドロキノ酸、レスベラトロール、アモルファスチルボルは、PPARγとともにPPARαも活性化できるデュアルアゴニストであることが示された(表2)。また、ゲニステインは低濃度でエストロゲン活性を示し、濃度依存的にPPARγまたはエストロゲン受容体を優先的に活性化し、骨形成と脂肪形成に反対の効果をもたらす[135]。天然物のうち6種類、すなわちホノキオール[175]、マグノロール[176]、レスベラトロール[177]、[178]、[179]、[180]、[181]、[182]、[183]、[184]、[185]、[186]、アモフルチン1[187]、アモフルチンB[188]、アモルファスチルボール[189]。は、糖尿病動物モデルにおいて血糖値やその他の関連パラメータを改善し、場合によっては完全なチアゾリジン系PPARγリガンドと比較して副作用を低減することが実証されている(表2)。特に、ホノキオール、アモルフルチン1、アモルフルチンB、アモルファスチルボルは、糖尿病動物モデルにおいて体重増加を抑制した。さらに、これらの化合物の中には、肝腫大(amorphastilbol)や肝毒性(amorfrutin 1, amorfrutin B)といった肝臓への悪影響が見られないものもあり、amorfrutin Bも骨芽細胞形成や水分保持に伴う悪影響が見られなかった(表Table )。研究された天然物の中で、アモルフルチン1は、PPARγのSer273リン酸化への干渉についてこれまでに研究された唯一のもので、食事誘発性肥満(DIO)マウスの内臓白色脂肪組織においてこの残基でのリン酸化を抑制することが判明した[187]。PPARγとその二量体活性化パートナーであるRXRのデュアルアゴニストであるネオリグナンのホノキオールとマグノロールは、興味深い異なるアゴニズムのモードを発揮する[140],[175],[190],[191],[192],[193],[194].
表2 PPARγを活性化する天然物
| 生理活性化合物 | 備考 |
|---|---|
| フラボノイド | |
 |
精製ヒトPPARγにIC50 = 3.9[127]または7.2 μM[137]で結合し、部分作動薬としてキメラGal4-PPARγ依存性のレポーター遺伝子発現を活性化する(EC50 = 15.6 μM、最大効果はロシグリタゾンの約3倍低い)[195]、ロシグリタゾン(1 μM)の共投与による効果に拮抗する(IC50 = 21.8 μM)[195]、3T3-L1細胞におけるロシグリタゾン(1 μM)の脂肪形成誘導作用を共投与により拮抗する(5-20 μM)[195]、いくつかのPPARγ依存遺伝子を弱い部分アゴニスト/アンタゴニストとして制御するが、3T3-L1細胞のGLUT4発現に対してフルPPARγアゴニストとして作用(10-20 μMでμM)[195]、高張力ストレスまたはPPARγアンタゴニストGW9662(1μM)に曝露したヒト角膜上皮細胞におけるIL-8分泌を抑制(1〜5μM)[195]、PPARγ LBDと共結晶化し、ルテオリンとミリスチン酸が同時にLBDに結合した(PDB.3sz1)[195]。 |
 |
リコンビナントヒトPPARγに結合し(IC50は26.0[134], 5.7[242], または2.8 μMと報告されている。8 μM[127])、単独投与ではパーシャルアゴニストとしてPPARγ依存性レポーター遺伝子発現を活性化し、併用投与ではロシグリタゾンの作用に拮抗する(1-100でμM)[134]、3T3-L1細胞においてインスリン依存性のグルコース取り込みを誘導するが脂肪形成は誘導しない(5~50μM)[134]、ロシグリタゾンによる3T3-L1細胞の分化を阻害する(5~50μM)[134]。 |
 |
リコンビナントヒトPPARγに結合する(IC50 = 23.1[134], 30[242]or 49.9 μM[245])、単独投与ではパーシャルアゴニストとしてPPARγ依存性レポーター遺伝子発現を活性化し、併用投与ではロシグリタゾンの効果に拮抗する(1-100でμM)[134]、3T3-L1細胞においてインスリン依存性のグルコース取り込みを誘導するが脂肪形成は誘導しない(5~50μM)[134]、ロシグリタゾンによる3T3-L1細胞の分化を阻害する(5~50μM)[134]。 |
 |
精製PPARγ-LBDにIC50 = 9.9 μMで結合し[205]、EC50が約2 μMのフルアゴニストとしてPPARγ依存性レポーター遺伝子発現を活性化[205]、PPARγ標的遺伝子発現を調節し、ヒト骨髄間葉系幹細胞の脂肪細胞分化を促進[205]。 |
 |
精製PPARγに結合し(IC50 = 3.8 μM)、パーシャルアゴニストとしてキメラGal4-PPARγ依存性レポーター遺伝子発現を活性化する(EC50 = 3.8 μM、最大効果はロシグリタゾンの3倍程度低い)[127],[245]。 |
 |
精製ヒトPPARγにIC50 = 19.6[121]または23.7μMで結合し[137]、パーシャルアゴニストとしてキメラGal4-PPARγ依存性レポーター遺伝子発現を活性化(EC50 = 39.5 μM、最大効果はピオグリタゾンの約3倍低い)[121]、3T3-L1細胞における脂肪生成を誘導する(1-5μMでμM)[138]、PPRE-レポータープラスミドをトランスフェクトしたHUVECのPPARγプロモーター活性を活性化し、フロー存在下でTNF-α活性化HUVECへの単球接着を阻害する(1μM時)[246]、キメラGal4-PPARα依存レポーター遺伝子発現も活性化[138]、[247]。 |
 |
精製ヒトPPARγにKi= 5.7[135]または22.5μMで結合し[121]、パーシャルアゴニストとしてキメラGal4-PPARγ依存性レポーター遺伝子発現を活性化(EC50 = 18.7μM、最大効力はピオグリタゾンの約4倍低い)[121]、3T3-L1細胞における脂肪形成を誘導する(1〜30μMで)[138]、PPRE-レポータープラスミドでトランスフェクトしたHUVECのPPARγプロモーター活性を活性化して、フロー存在下でTNF-α活性化HUVECへの単球接着を阻害する(1μM時。単球接着効果はPPARγのsiRNAサイレンシングにより消失した)[246]、PPARαの転写活性も活性化する[138],[247],[248],[249], 低濃度(≦1μM)ではエストロゲンとして、高濃度(>1μM)ではPPARγのリガンドとして働き、骨形成と脂肪形成に対して濃度依存的に反対の作用を示すことが明らかになった[135]。 |
 |
精製ヒトPPARγにIC50 = 3.3 μMで結合[121]、キメラGal4-PPARγ依存性レポーター遺伝子発現をフルアゴニストとしてEC50 = 48.6 μMで活性化[121]。 |
 |
精製ヒトPPARγにIC50 = 16.7 μMで結合し[121]、EC50 = 27.7 μMの部分作動薬としてキメラGal4-PPARγ依存性レポーター遺伝子発現を活性化し、最大効果はロシグリタゾンの5倍程度低い[121]。 |
| ネオリグナン | |
 |
PPARγとRXRのデュアルアゴニスト[175],[190],[191],[192], 精製ヒトPPARγに結合(Ki= 22.9 μM)[175], 部分アゴニストとしてPPARγ依存性のレポーター遺伝子発現を活性化(EC50 = 3.9 μM)[175]、3T3-L1細胞においてグルコース取り込みを誘導するが脂肪化は誘導しない(1-10 μM時)[175]、糖尿病性KKAyマウスにおいて血糖値を低下させ、同時に体重増加を抑制する[175]。 |
 |
PPARγとRXRαのデュアルアゴニスト[140],[193],[194], 精製ヒトPPARγに結合し(Ki= 2.0 μM)[140], 部分アゴニストとしてPPARγ依存性のレポーター遺伝子発現を活性化(EC50= 1.6 μM)[140]、精製 PPARγへのTRAP220/DRIP-2 コアクチベーターペプチドのリクルートを誘導する(EC50 はおよそ 0.5 μM、最大効果はピオグリタゾンの約3倍低い)[140]、3T3-L1細胞における脂肪形成[140]、[194]、グルコース摂取[194]を誘導する(10μM)、2型糖尿病の五島柿崎ラットの空腹時血糖値および血漿インスリン値を低下させ、糖尿病性腎症を予防または遅延させる[176]、RXRα-LBD(PDB.3r5 m)、PPARγ-LBD(PDB: 3r5n)[193]と共結晶化した。 |
| スチルベン | |
 |
精製ヒトPPARγに結合し(Ki= 1.37 μM)[250]、部分作動薬としてキメラGal4-PPARγ依存性レポーター遺伝子発現を活性化(50-100 μM時)[251]、ロシグリタゾンによるPPARγルシフェラーゼレポーター転写をIC50 = 27で抑制する。4μM[250]、いくつかの試験管内試験および生体内試験動物モデルにおいてPPARγの干渉によりグルコースおよび脂質代謝、ならびに炎症に影響を与え[177],[178],[179],[180],[181],[182],[183],[184],[185]、2型糖尿病の患者のインスリン感受性を向上させ[186], PPARαのリガンドでもある[250],[252] PPARγ-LBD (PDB.4jaz)と共同結晶化した。4jaz)[250]と共結晶化した。 |
 |
精製ヒトPPARγに結合し(IC50 = 0.85μM)、ヒトPPARγ依存性ルシフェラーゼレポーター遺伝子発現を活性化する(EC50 = 5μM;フルアゴニストであるトログリタゾンと比較して最大83%の活性化)[234]、PPARαとも同様の効力を持って結合・活性化する[234]、体重増加や肝肥大などの大きな副作用なしにdb/dbマウスにおける糖・脂質障害を改善する[189]。 |
| アモルフルティン | |
 |
精製PPARγに結合し(Ki= 0.24 μM)、パーシャルアゴニストとしてキメラGal4-PPARγ依存性レポーター遺伝子発現を活性化する(EC50 = 0.46μM、最大効果はロシグリタゾンより61%低い)[187]、合成PPARγアゴニストと比較して異なるパターンでヒト脂肪細胞におけるPPARγ遺伝子発現ネットワークを選択的に調節する[187]。は、食事誘発性肥満マウスおよびdb/dbマウスにおいて、脂肪蓄積の増加や肝毒性などの望ましくない副作用を伴うことなく、インスリン抵抗性およびその他の代謝・炎症パラメーターを改善し[187]、DIOマウスにおいてPPARγ Ser273 リン酸化をブロックし[187]、PPARγ-LBDと共結晶化した(PDB.2yfe)[187]と共結晶化した。 |
 |
精製PPARγに結合し(Ki= 0.29 μM)、パーシャルアゴニストとしてキメラGal4-PPARγ依存性レポーター遺伝子発現を活性化する(EC50 = 1.2 μM、最大効果はロシグリタゾンより70%低い)[187]、合成PPARγアゴニストと比較して異なるパターンでヒト脂肪細胞のPPARγ遺伝子発現ネットワークを選択的に調節する[187]、PPARγ-LBD(PDB:4a4v)と共結晶化した[197]。 |
 |
精製PPARγに結合し(Ki= 0.019 μM)、パーシャルアゴニストとしてキメラGal4-PPARγ依存性レポーター遺伝子発現を活性化する(EC50 = 0.073μM、最大効力はロシグリタゾンの4倍低い)[188]、いくつかのPPARγ転写コアクチベーターの部分的なリクルートを誘導する[188]、ヒト脂肪細胞においてPPARγ依存的に遺伝子発現を制御する[188]、インスリン耐性マウスにおいて。は、肝臓保護作用を示し、インスリン感受性、耐糖能、血中脂質変数を改善し、体重増加や骨芽細胞形成や体液保持への悪影響はない[188]が、PPARγ-LBDとの共結晶化(PDB.4a4w)[197]と共結晶化した。 |
| ポリアセチレン類 | |
 |
精製ヒトPPARγに結合(Ki= 3.1 μM)[228]、パーシャルアゴニストとしてPPARγ依存性レポーター遺伝子発現を活性化(1~30 μM時)、ロシグリタゾンの共投与により拮抗[228]、10 μMで3T3-L1脂肪細胞の脂肪形成とグルコース取り込みを誘導[228]。 |
| セスキテルペンラクトン | |
 |
精製PPARγ-LBDに結合する(KD= 3.4μM)するが、PPARα-LBDやPPARβ/δ-LBDには結合しない[218]、部分アゴニストとして全長PPARγおよびGal4-PPARγ-LBDキメラの転写活性を高める(1~20μM)[218]、飽和しない濃度のロシグリタゾンと共処理するとPPARγの転写活性が高まる[218]。 |
| ジテルペンエキノン誘導体 | |
 |
精製PPARγに結合する(IC50 = 0.255 μM)[253]、部分アゴニストとしてPPARγ依存性レポーター遺伝子発現を活性化(1~30 μM時)[253]、脂肪細胞表現型に重要な遺伝子の発現を増加させることにより3T3-L1細胞の脂肪細胞分化を促進(10 μM時)[253]、PPARαも活性化(1~30 μM時)[253]。 |
 |
精製PPARγに結合する(IC50 = 0.725 μM)[253]、部分アゴニストとしてPPARγ依存性レポーター遺伝子発現を活性化(1~30 μM時)[253]、脂肪細胞表現型に重要な遺伝子の発現を増加させることにより3T3-L1細胞の脂肪細胞分化を促進(10 μM時)[253]、PPARαも活性化(1~30 μM時)[253]。 |
PPARγのLBDとの結合に関する構造の詳細は、いくつかの天然物について解かれた受容体-リガンド結晶構造によって明らかにされている(表2および図2)。PPARγタンパク質は、N末端の調節ドメイン、中央のDNA結合ドメイン、C末端のLBD(アミノ酸204-477)から構成されている[43],[195].LBDは13個のαヘリックスと小さな4本鎖のβシートからなる[196]。リガンド依存性活性化ドメイン(活性化機能-2、AF-2)のヘリックスH12は、リガンド結合とPPAR機能に必須である。H12とH2′とH3の間のループはLBDの中で最も可動性の高い部分である。リガンドが結合すると、LBDはより硬いコンフォメーションとなり、コアクチベーターのリクルートを引き起こし、結果として標的遺伝子の転写を引き起こす[197].PPARγのLBDは大きなY字型の空洞で、入口ドメインと2つのポケット、アームIとアームIIで構成されている(図2A)[198]。大きなサイズと結合ポケットの柔軟性により、PPARγは構造的に異なるリガンドと相互作用することができる。この大きな空洞を完全に満たすリガンドは知られていない[43]。しかし、場合によっては2分子、あるいは3分子の同時結合が可能であり、それらは結合ポケットと相互作用し、より安定な結合コンフォメーションとなる[199]。さらに、異なるリガンドはPPARγLBDの異なる領域に結合し、異なる結合様式を表す。図2は、PPARγのLBDと共結晶化したリガンドの結合様式を示したもので、チアゾリジン系アゴニストであるロシグリタゾン(プロテインデータバンク(PDB)[200]entry PDB: 4ema[199],図2B);ホモ二量体として結合する代表的な内因性リガンドとして(9S,10E,12Z)-9-hydroxyoctadeca-10,12-dienoic acid (9-(S)-HODE) (PDB: 2vsr[43],図2C)、天然物のアモルフルチンB(PDB: 4a4w[197]、図2D)、ホモ二量体として結合するネオリグナンのマグノロール(PDB: 3r5n[193]、図2E)、ミリスチン酸と同時に結合するフラボノイドのルテオリン(PDB:3sz1[195]、図2F)。
図2 PPARγと共結晶化した選択したPPARγリガンドの結合様式
(A) 1つの入口ドメインと2つのアーム(アームIは実質的に極性、アームIIは主に疎水性)からなるY字型のPPARγ LBD[174].ヒト PPARγ LBDと(B) 合成アゴニスト rosiglitazone (PDB: 4ema), (C) ホモ二量体として結合する内因性アゴニスト 9-(S)-HODE (PDB. 2vsr), 天然アゴニスト 9-(S)-HODEの間で観察されるタンパク質-リガンド相互作用を示す。2vsr)、天然リガンド(D)アモルフルチンB(PDB:4a4w)、(E)マグノロールのホモ二量体としての結合(PDB:3r5n)、(F)ルテオリンのミリスチン酸との混合二量体としての結合(PDB:3sz1)である。相互作用は、ソフトウェアLigandScout[254]を用いて、水素結合アクセプター(赤矢印)、水素結合ドナー(緑矢印)、疎水性相互作用(黄球)、マイナスイオン化可能領域(赤星)のカラーコードで可視化した。リガンド結合ポケットは表面として描かれ、その色は親油性と親水性に基づいている。活性部位水分子との接触は示していない。
一般に、チアゾリジン系などの強力なPPARγアゴニストはH12に結合することが知られているが、部分アゴニストはβシートとH2′/H3領域を安定化する。フルアゴニストのロシグリタゾンは、Tyr473と水素結合を構築することでH12を安定化し、コアクチベーターのリクルートにつながる[199].ロシグリタゾンのようなチアゾリジン系アゴニストは1分子でLBDに結合するのに対し(PDB: 4ema[199],図2B)、9-(S)-HODEのようないくつかの内因性リガンドはホモダイマーとして受容体を活性することが示された(PDB:2vsr[43],図2C)。最初の9-(S)-HODE分子は、H12のTyr 473に水素結合を介してカルボキシ基を持つように結合する。この相互作用は、カルボキシル基を持つリガンドに典型的なものである。尾部は、非常に強力なアゴニストも存在する領域にあり、Phe363や他のアミノ酸とファンデルワールス接触を介して相互作用している。2番目の分子は、H3とβシートの間に位置し、合成部分アゴニストも占有する領域である。この分子のカルボキシレート基は、チアゾリジン系化合物の結合には関与しないアミノ酸であるArg288と塩橋を形成している[43]。
部分PPARγアゴニストであるアモルフルチン1,2、B(それぞれPDB: 2yfe, PDB: 4a4 v, PDB: 4a4w,[187],[197] )はPPARγLBDにほぼ同じ位置と向きをもって存在することがわかった。これらは、水素結合とファンデルワールス接触によって、PPARγのH3だけでなく、βシートにも結合し、安定化させる。アモルフルチンのPPARγに対する高い親和性の理由は、カルボキシル基が水素結合を介してβシートのSer342と相互作用するためだ。また、H3のArg288はアモルフルチンによって安定化される。PPARαおよびPPARβ/δにおいてArg288がスレオニンに置換されていることが、アモルフルチン1,2、Bの選択的なPPARγ活性の理由と考えられるが、LBDとの相互作用にも相違があることがわかった。Amorfrutin Bは、他の報告されているAmorfrutinと比較して、rosiglitazoneと同様に有意に高い親和性を示している。これは、長いゲラニル側鎖が、特にH3のArg288とH4/5に追加の疎水性相互作用を形成することに起因する[197]。
PDB:3sz1によると、PPARγ部分作動薬のルテオリンは、長鎖脂肪酸のミリスチン酸と同時にPPARγ LBDに結合する。この2つの分子は、βシートとH2′とH3間のループを安定化させる。ルテオリンは、H2′とH3をつなぐループのLys265およびHis266と水素結合を介して相互作用し、様々なアミノ酸と疎水性接触を構築している。ミリスチン酸はH3、H5、H7を占め、Arg288(H3)と塩橋を経由して相互作用する。ルテオリンとミリスチン酸のカルボン酸塩は、水分子を介して水素結合でつながっている。この水分子はルテオリンをLBDに留めておくのに重要であると思われる[195]。
9-(S)-HODEなどの内因性リガンドと同様に、2つのマグノロール分子がPPARγのLBDを協調的に占有することが示された。1つのマグノロール分子はAF-2を、もう1つのマグノロール分子はβシートを占有する。AF-2では、マグノロールの水酸基がH3のSer289と水素結合し、Tyr473とは水を介した水素結合を形成している。βシートでは、2番目のマグノロールの水酸基がSer342と水素結合を形成している。さらに、βシートでは、水を介したマグノロールへの水素結合も存在する。マグノロールの構造は、2つの5-ally-2-hydroxyphenyl部位をつなぐ単結合により、非常に柔軟である。マグノロールを2分子および1分子結合するPPARγおよびRXRαに結合する際に3つの異なるコンフォメーションを示す[193]。
4.おわりに
天然物は、新規PPARγリガンドを発見するための豊富な情報源であり、最近、伝統的に使用されてきた薬用植物や食品から、多くの構造的に多様な受容体のアゴニストが同定されている。興味深いことに、同定された天然化合物の大半はPPARγの弱いアゴニストであり、しばしば部分アゴニストとして受容体を活性化し、完全なチアゾリジン系アゴニストとは異なる活性化パターンで、脂肪酸やプロスタノイドなどの弱い活性化能を持つ内因性リガンドにより似ている。注目すべきは、いくつかのPPARγアゴニストが、料理のスパイス、飲料、または食品として使用される植物から同定されたことで、食事介入によってこの核内受容体の活性を調節することを検討できる可能性がある。同定された天然物の多くは、SPPARMとしてPPARγのみを活性化するが、一部はPPARαも活性化するデュアルアゴニストである(表2)。特に興味深い活性化パターンは、PPARγとその二量体活性化パートナーRXRの両方に対するリガンドであるネオリグナンのマグノロールとホノキオールに観察される。ネオリグナンのホノキオールや他のいくつかの天然物も、糖尿病動物モデルにおいて、完全なチアゾリジン系アゴニストと比較して副作用が少なく、有益な代謝効果を実証している。PPARγ活性化剤として文献に報告されている多くの薬用植物からの抽出物は、今のところ十分に研究されていない。今後、これらの活性成分の同定により、さらに興味深いリガンドが提供されるかもしれない。
結論として、最近、PPARγを活性化する天然物や植物エキスが報告され、治療効果をさらに検討するとともに、メタボリックシンドロームや2型糖尿病に対する栄養補助食品として研究される可能性があることがわかった。
謝辞
本研究は、オーストリア科学基金(FWF)の支援を受けた。S10702/S10711, S10703, S10704, S10705, and S10706 (NFN ‘Drugs from Nature Targeting Inflammation’) and P25971-B23 (‘Improved cholesterol efflux by natural products’), and the Tyrolean Science Fund (TWF).