Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC5401944/
Am J Physiol Cell Physiol. 2017 Mar 1; 312(3): C254-C262.
2016年12月14日オンライン公開
要旨
一酸化窒素(NO)は、血管系の重要な成分の1つであり、健康における重要なシグナル伝達経路を制御している。大血管では、NOは細胞の炎症と接着を抑制する機能を持つ。このように、血栓を抑制し、血流を促進する。また、血管の収縮や血管壁のリモデリングを抑制する働きもある。
微小血管、特に毛細血管では、NOは成長因子とともに、血管新生と呼ばれる新しい血管の形成を促進する上で重要である。加齢や心血管系疾患により、NOの産生量の減少、組織内半減期の短縮、効力の低下など、様々なレベルで制御が難しくなっていることが、動物やヒトでの研究により確認されている。
また、神経伝達や癌に関連する疾患にもNOが関与しているが、これらの過程には、より高濃度のNOや非血管細胞由来のNOが関与していると思われる。逆に、NOおよびNOシグナルを直接的または間接的に増加させる薬剤は、加齢関連疾患および若年者における臨床応用が見出されている。
本総説では、酵素産生、受容体機能、相互作用パートナー、シグナル伝達の局在、マトリックス-細胞間および細胞-細胞間のクロストークなど、いくつかのレベルにおいてNOシグナル伝達制御の分野で最近報告された進歩を考察するとともに、これらの新しく記述されたメカニズムが健康や疾病に与える影響の可能性を考察する。
キーワード:一酸化窒素、循環器、心臓、NOS、シグナル伝達、トロンボスポンジン-1、CD47、チトクロームb5還元酵素3、マトリクス細胞
心血管系疾患は、世界の疾病関連死亡の重要な要因の一つである(78)。一酸化窒素(NO)は、生理的に関連したガス伝達物質として初めて認知され、その調節異常が心血管疾患に関与していると考えられている。一酸化窒素(NO)が高圧の閉鎖循環系の機能を維持するために様々な役割を担っているという認識は、医学におけるパラダイムシフトであった。
しかし、NOは酸素のような単純な分子と比較して、その複雑さについての研究が盛んに行われている。このレビューでは、NOの合成を制御するシグナル伝達経路、NOを介した標的の活性化に関する過去10年間の最近の知見に焦点を当て、これらの新しく記述されたメカニズムが恒常性と病態生理に与える影響について述べる。
一酸化窒素シグナル伝達の制御機構
一酸化窒素合成酵素(NOS)は、NADPHとテトラヒドロビオプテリン(BH4)に依存したl-アルギニンのl-シトルリンへの酸化反応を触媒し、反応生成物の1つとしてNOを生成する(105)。細胞内アルギニンの利用可能性は細胞内NO産生の律速因子であり、シトルリンをアルギニンに戻すアルギニノコハク酸リアーゼは、細胞内アルギニン合成のみならず、細胞外アルギニンをNOS依存性NO合成に利用するために重要であることが明らかにされている(28)。
哺乳類のNOSには神経型(nNOS)、内皮型(eNOS)、誘導型(iNOS)の3つのアイソフォームが存在する。l-アルギニンまたはBH4がない場合、eNOSは非結合型であり、eNOSの単量体はNOよりもスーパーオキシドを優先的に合成する(20)。
単量体eNOSは他のeNOS単量体のヘム中心に電子を送ることができず、代わりに酸素と相互作用する場所に電子を移動させ、スーパーオキシドの形成を促進する(20)。その結果、eNOSの二量体化は、適切な酵素活性とNO産生に必須である。
この過程は熱ショックタンパク質90 (HSP90)によって制御されており、HSP90のサイレンシングやゲルダナマシンによる阻害はeNOS二量体を不安定にし、分解に導く。逆に、S1179とT497のリン酸化状態は、内皮細胞や精製eNOSタンパク質の無細胞調製物におけるeNOS二量体/単量体比に影響を与えないことから、リン酸化はこのプロセスにおいて重要な役割を担っていないようである(20)。
最近、エンドセリン-1は、ヒト微小血管内皮細胞にエンドトキシンを作用させると、eNOSを介してスーパーオキシドの産生を促進することが示された(38)。eNOSのシグナル伝達の制御は複雑で、主にドメイン上の複数の部位でのアミノ酸残基のリン酸化によって制御されているが、他の様々なタンパク質との相互作用や細胞内分布によって、さらに高度な制御が行われている。
eNOSのリン酸化と活性の制御
ヒトでは、eNOSはCOOH-末端還元酵素ドメインのS1177、カルモジュリン(CaM)結合ドメインのT495、FMN結合ドメインの自己抑制エレメントのS633、S615、Y657、NH2-末端酸素添加ドメインのS114とY81など複数のアミノ酸残基でリン酸化される(95)。
NH2-末端オキシゲナーゼドメインは亜鉛、ヘム、テトラヒドロビオプテリン(BH4)に結合し、eNOSのホモダイマーの形成を調整する。シアストレス、インスリン、レプチン、スタチン、ブラジキニン、VEGF、IGF-Iなどは、S1177をリン酸化することによりeNOSを活性化し、NO産生を促進する因子である(112).S1177のリン酸化を担うキナーゼには、CaMKII、AMPK、PKA、Akt、Chk1、PKGなどがある(83, 95)。
最近、eNOSはSrcによるGPCR キナーゼ相互作用タンパク質-1 (GIT1)のチロシンリン酸化によって活性化されることが示され、AktがSrcのGIT1 リン酸化能とGIT1-eNOS 組合を制御していることがわかった(72).
* *
機械的せん断応力、VEGF、スタチン、8-Br-cAMP、ブラジキニンなどの他のシグナルも、AktによるS615、PKAとPim1によるS633、PYK2によるY657、PKCによるT495などのeNOSの部位のリン酸化または脱リン酸化を引き起こす(32, 114)。
S615/S633のリン酸化はeNOSのカルシウム感受性と活性を高めるが、Y657とT495のリン酸化はeNOS活性のダウンレギュレーションと関連している(18, 109)。酸素化酵素ドメインでは、Y81がpp60srcキナーゼによりリン酸化され酵素を活性化し、S114がERKによりリン酸化され酵素活性とNO産生を低下させる(15, 33)。
eNOSのリン酸化は、eNOSの脱リン酸化に比べてより広範囲に研究されていることは明らかであり、おそらくタンパク質の脱リン酸化を研究する上で固有の課題があるのだろう。また、これらの競合するタンパク質修飾がどのように調整されているかは明らかでない。
eNOSと様々なタンパク質との相互作用
カルシウム-カルモジュリン
eNOSはNH2-末端のオキシゲナーゼドメインとCOOH-末端のレダクターゼドメインの間にある正規の結合部位を通してカルシウム活性化カルモジュリン(CaM)に直接結合し、この相互作用はその活性に必須である(19). CaMはHSP90の存在下でeNOSをカベオラから追い出し、eNOS活性の正のレギュレーターとして働く(39)。
カベオリン-1.
カベオリと呼ばれる細胞膜構造の発見と、そのような「ホット」スポット内でのNO産生の空間的局在と制御は、NOシグナルの理解における新時代を象徴していた。カベオリン-1(Cav-1)はカベオリン足場ドメインの領域でeNOSに結合し、CaMとは対照的にeNOS活性とNO産生の負のレギュレーターである(79)。
Cav-1はカルシウム濃度が低いときにCaMの結合を阻害し、eNOS活性を低下させることが示されている(85)。マウスからCav-1を欠損させると、eNOS活性の負の調節因子が除去されたような表現型、すなわち血圧の低下と内皮依存性の弛緩の増強が見られた(121)。
その他の蛋白質間相互作用
eNOSはHSP90, NOSIP, NOSTRIN, PIN1, PP2A, PP1, SIRT1, VDAC1/2, GPCR (B2), GRX-1, β-actin, CAT-1, CHIP (carboxyl terminus of HSP70-interacting protein), endoglin, 及びHDAC3 (2, 17, 20, 24, 40, 55, 65, 66, 70, 76, 93, 94, 117, 122)と相互作用すると言われている。
eNOSの細胞内分布と細胞膜の標的化
eNOSはゴルジ体および細胞膜の両方で検出される(57)。eNOSはタンパク質脂肪酸アシル化によって異なる細胞内コンパートメントに標的化される。まず、eNOSは不可逆的にミリストイル化され、細胞膜との結合を助け、この過程で可逆的なパルミトイル化が起こり、ゴルジ体で起こってeNOSを細胞膜に誘導する(31)。
細胞膜は、eNOSが正常に機能するために必要なイオンチャネル、キナーゼ、リガンド活性化GPCRに近接できるため、NOの合成に理想的な場所である。しかし同時に、細胞膜を標的としたeNOSは、酸化低密度リポタンパク質などの細胞外因子に対してはるかに脆弱であり、分解されにくいゴルジ型eNOSとは対照的にeNOS活性を低下させる(120)。
このことは,成熟した血管内皮細胞では,細胞膜に存在するeNOSは全体のごく一部であり,大部分は比較的保護されたゴルジ複合体に存在するという観察結果を説明できるかもしれない.逆に、NOSIP, NOSTIN, CHIP (carboxyl terminus of HSP70-interacting protein)を含むいくつかの異なる因子は、eNOSの細胞膜から細胞内コンパートメントへの解離を促進し、その結果、eNOS活性が低下することが示されている(24, 55, 122)。このように、eNOSの活性やNO産生の調節には、脂肪酸の付着とそれに続く細胞内分布が重要な役割を担っているようである。
マトリックス細胞タンパク質は「外から内へ」NOを抑制する作用がある
可溶性グアニル酸シクラーゼ(sGC)は、NOの細胞内主要受容体である。NOはsGCを刺激し、sGCはGTPを第二伝達物質の環状グアノシン一リン酸(cGMP)に変換する(118)。cGMPはその後、血小板凝集、白血球接着を抑制し、血管平滑筋細胞を弛緩させて、血流を促進させる。
しかし、NOは一度生成されると、バイオガスとして、ほぼ瞬時にその受容体であるsGCを活性化することが可能である。恒常性を維持するために、phosphodiesterase type 5, 6, 9 (PDE 5, 6, 9)などの多くのフィードバック機構が存在し、細胞質レベルのcGMPを特異的に減少させるように働いている(21)。
しかし、新しい研究によると、NOの分子的な制限因子がさらに組み込まれている可能性がある。トロンボスポンジン-1(TSP1)は、そのようなNOリミッターの1つで、マトリセルラーファミリーのタンパク質の中に存在することがわかった。
この名前は、これらのタンパク質が傷害後に分泌され、構造的な支持を与えずに細胞外マトリックスに結合し、細胞膜受容体のリガンドとして機能することに由来している(13)。TSP1は、sGCの両方を直接標的とすることで、eNOS活性とNOシグナルを制限し、いくつかの細胞では、第二メッセンジャーcGMPの標的を直接阻害することが分かっている(51, 87) (図 1)。
これらのNOシグナル伝達経路に対するTSP1の多重制限作用は、血管膜受容体CD47との相互作用を必要とし(49)、ピコモル以下のTSP1量で起こるため、これまで定義された中で最も強力な活性の1つであると言える。
実際、TSP1はsGCの普遍的な阻害剤として提案されている(77)。機能的には、TSP1は、CD47を介して、内皮依存性の動脈弛緩を阻害し、アセチルコリンによる低血圧を抑制する(5)。興味深いことに、若い雌ラットの単離冠状動脈は、TSP1を介した血管拡張の抑制に抵抗性であった(81)。
一方、TSP1およびTSP1と同様に受容体を活性化する機能を持つCD47アゴニスト抗体の静脈内投与は、動物において血圧を上昇させる。逆に、TSP1およびCD47の欠損マウスでは、cGMPおよびリン酸化eNOSのレベルが構成的に増加する(5)。リガンドであるTSP1あるいは受容体CD47を欠損した動物は、温度、虚血、再灌流などの様々なストレスに対して、血管新生が促進され、組織血流が増加する(47)。
最近の知見では、TSP1-CD47シグナルは低酸素内皮細胞(6)、血管平滑筋、腎尿細管上皮細胞において活性酸素種(ROS)産生の増加を促し、後者はNADPH酸化酵素の活性化を介している(22、116)、これはTSP1のNO阻害活性に一部関係するかもしれないが未解明である。健康なヒト肺動脈では、TSP1は血管収縮を増強し、NOを介した血管拡張を抑制する(91)。
同様に、病気のヒトの動脈では、TSP1とCD47の発現が増加し、これはNOに対する感受性の喪失と関連している(91)。TSP1-CD47シグナル伝達を阻害する治療薬は、病気のヒトの動脈でNOを介した血管拡張剤に対する感受性を改善し(91)、ネズミとブタではこれらの薬剤は虚血に反応して血流を増加させる(50, 90)。最近、心血管疾患ではないものの、CD47を標的とした治療法の臨床試験が開始され、ヒトの疾患におけるCD47への関心が高まっていることを裏付けている(71)。
図1 最近の知見により、一酸化窒素(NO)制御のレベルがさらに上がっている
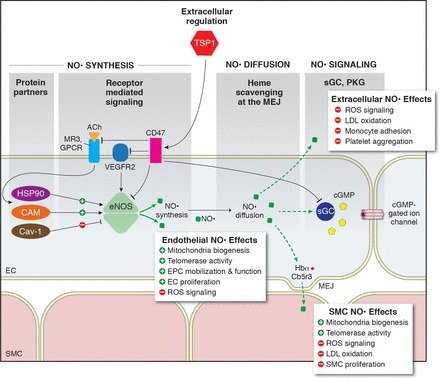
血管内皮増殖因子受容体2(VEGFR2)やアセチルコリン(ACh)などの受容体を介したシグナル伝達と、熱ショックタンパク質90(HSP90)、カルモジュリン(CaM)、カベオリン1(Cav-1)などのタンパク質パートナーが、血管壁における内皮NO合成酵素(eNOS)活性とNO生成量を調節している。
一旦生成されたNOは、内皮から血管平滑筋細胞、血小板、単球などの様々な細胞に拡散し、受容体の可溶性グアニル酸シクラーゼ(sGC)を活性化して環状グアノシン一リン酸(cGMP)の生産を増大し、細胞機能を制御する。NOは、パラクラインプロセスに加えて、ミトコンドリア生合成、テロメラーゼ活性、活性酸素種(ROS)生成、低密度リポタンパク質(LDL)酸化などの細胞内機能を制御・変化させる。
ヘモグロビンαなどのヘム捕捉タンパク質は、内皮細胞(EC)に発現し、内皮(MEJ)と平滑筋細胞の接合部でチトクロームb5還元酵素3(Cb5r3)により制御されるプロセスであるNO拡散の「緩衝剤」として機能する。
トロンボスポンジン-1(TSP1)-分化クラスタ47(CD47)などの細胞外の「アウトサイドイン」シグナルも、eNOS、sGC、cGMP依存性タンパク質キナーゼ(PKG)の活性阻害を介してNOシグナルを制限する能力を持っている。EPC、内皮前駆細胞、MR3、ムスカリン受容体3、MEJ、筋内皮接合部、SMC、平滑筋細胞、GPCR、Gタンパク質共役型受容体。
血管壁におけるNOの「回廊」
血管内では、NOは球状の勾配を描きながら拡散し、その結果、無方向に拡散する(14, 67, 68, 108)。このような性質から、NOがどのようにして受容体であるsGCを活性化するのに十分な濃度で正確に標的化するのかについては、依然として不明である。
細胞はNOSを空間的に局在させることができるため、NOが方向性のあるシグナル伝達を管理する方法についていくつかのヒントが得られている(34, 52)。最近、筋内皮接合部(MEJ)にNOコリドーが存在することが提唱されている(101)。
MEJは、典型的には内皮から生じ、血管平滑筋細胞(VSMCs)を並置し、小動脈および細動脈における内皮と血管平滑筋との間のクロストークを促進する接続部として機能する細胞拡張部である(89、104)。最近の研究では、eNOSもMEJに局在し、いくつかの動脈ではMEJに濃縮されていることが証明された(101)。
MEJでのeNOSの発現は、長距離のNO拡散を制限し、VSMC sGCの近くに位置し、局所タンパク質をS-ニトロソ化し、活性酸素によるNO消去を減少させると考えられる(101)(図1)。最近では、MEJの脂質組成が、NOの拡散とシグナル伝達を制御する別のレベルを追加することが示されている(9)。
MEJにおけるeNOSの局在に加え、NOの強力なスカベンジャーであるヘモグロビンα(Hb-α)は、偏りのないプロテオミクススクリーニングによってMEJに濃縮されている(103)。機能的には、Hb-αは、硝酸塩とメトヘモグロビン-αを形成する二酸素化反応によって、内皮から平滑筋細胞へのNO拡散を緩衝することにより、「NOシンク」として機能し、それによって、NOS媒介シグナルと動脈血管反応性の制御をさらに制御している(103)。
このNO拡散制御の持続的なメカニズムとして、メトヘモグロビン-αのヘム鉄はチトクロームb5還元酵素3によって還元される(86、103)。さらなる研究により、Hb-α模倣ペプチドによるeNOSおよびHb-α結合の破壊が、in vivoでのNOシグナル伝達を増強し、血圧を低下させ、それによって心血管疾患の治療のための新しい標的を特定することが実証された(102)。
心臓におけるNOシグナル伝達
一酸化窒素合成酵素(NOS)も心筋細胞における内因性NOの供給源である。eNOSはカベオリン-3と結合して細胞膜のカベオラに存在し、nNOSは心筋細胞の小胞体でリアノジン受容体と結合して存在する。NOSアイソフォームが生成するバイオガスの空間的分布と濃度が異なるため、それぞれのNOSは心臓に異なる影響を与え、ある状況では心臓を保護する機能を示し、他の状況では心臓を損傷する機能を示す実験結果が得られている。
* *
NOは心臓のβ-アドレナリン反応に重要である。βアドレナリン刺激により、心筋細胞内のNOの量は増加する。nNOSによって産生されたNOは、SRカルシウムの放出を刺激し、最終的にβ-アドレナリン刺激を助ける(60)。nNOSノックアウトマウスは、強心反応の抑制と力-頻度関係(FFR)の減少を示し、おそらくSRカルシウム貯蔵量の減少に起因すると考えられる(37, 60)。
NOは、S-ニトロソ化とそれに続くカルシウム/カルモジュリン依存性プロテインキナーゼIIの活性化 (23, 41)またはリアノジン受容体2のS-ニトロソ化によりβアドレナリン刺激を増大し、SRカルシウムの放出を増加させると考えられる(37)。
さらに、nNOSを阻害すると、心筋細胞のβ-アドレナリン刺激に対する感受性が低下し、カルシウムの放出が減少する(27)。このように、nNOSはSRからのカルシウム放出に重要である。しかし、NOから生成されるペルオキシナイトライトとスーパーオキシドは、phospholambanのリン酸化を減少させ(63)、nNOSの結合を解除してβ-adrenergic応答を阻害する(98, 106)。
心筋細胞内のペルオキシナイトライトとスーパーオキシドは、NOの産生を減少させ、スーパーオキシドの形成を増加させ、さらにnNOSの不活性化に寄与している(106)。さらに、ペルオキシナイトライトは、サルコ/小胞体Ca2+-ATPase(SERCA)を介して、心筋細胞の活動電位を変化させ(11)、過酸化脂質の増加を通じてミトコンドリアに損傷を与え(64)、一般に心筋機能を抑制する(26)。また、ペルオキシナイトライトの増加は、SERCAを介したCa2+の隔離と心筋細胞の弛緩をもたらす(8)。
* *
逆にeNOSはL型カルシウムチャネルの調節によるβ-アドレナリン強心反応の抑制を介して心筋保護作用を示す(111).従って、eNOS-nullマウスは高血圧や心臓の肥大を伴う収縮力の増強と正常なFFR (60)を示し(4, 15)、β-adrenergic刺激に対してより敏感である。
特に、S1177のリン酸化はeNOSの活性化と一致し、運動中(30, 62, 88)やエピネフリン刺激中(16)に増加し、運動の心臓保護効果に寄与していると考えられる。β3アドレナリン受容体アゴニストであるネビボロールはphospho-eNOSレベルを増加させたことから、このリン酸化の増加はβ3アドレナリン受容体依存性の経路で起こっている可能性がある(3)。
β3-アドレナリン受容体ヌルマウスはp-S1176(マウスリン酸化部位)eNOSの存在量が減少する(3, 16)ことから、心臓におけるeNOS活性化にはβ3アドレナリン受容体刺激が重要であることが示唆される。高脂肪食を与えたマウスでは、β3アドレナリン受容体タンパク質の発現とeNOS活性の低下が見られ、これは観察された運動の心筋保護効果とは相関がなかった(62)。
さらに、eNOSの二量体/単量体比は運動後に増加し、蛋白質のニトロ化量(ペルオキシナイトライト生成の指標)は減少していることがわかった。したがって、eNOSの二量体化と活性化は、ペルオキシナイトライトの形成を減少させることにより、心筋保護につながる可能性がある(30)。
iNOSの発現の変化もまた、運動の心筋保護効果に寄与しているかもしれない。高脂肪食のマウスでiNOSの発現を抑制すると梗塞の大きさが減少する(62)。ミトコンドリアのnNOSもまた、酸素消費量を増加させることにより、運動中の心筋保護作用があると考えられる(46, 58, 92)。
* *
iNOSは心臓の炎症反応に関連しているが、反応性肥大の発生に関与している可能性がある。iNOS-nullマウスは、野生型マウスと比較して、横大動脈収縮(TAC)による左室圧負荷に弱く、駆出率の改善と心臓サイズの縮小が見られる(119)。
これは、eNOS-およびnNOS-nullマウスが加齢とともに心臓の肥大を示すが、前者のみが同時に血圧の上昇を示すのに反している(4)。iNOSは、ROS産生の増加、あるいはプロテインキナーゼB、ラパマイシン機構標的、ERKなどのタンパク質の活性化などいくつかのメカニズムによって肥大化に寄与すると考えられる(119)。
さらに、iNOSの発現は、phosphoinositide 3-kinase (PI3K)-nuclear factor of activated T cells (NFAT) 経路を通じて制御されていると考えられる。PI3Kγ-nullマウスではiNOS量が増加し、NFATを阻害するとiNOS量が減少するためだ(80).
* *
NOは心臓のミトコンドリア呼吸にも重要である。NO刺激によりミトコンドリア酸素消費量(MV⑭O2)が増加する。例えば、nNOS-nullマウスの心筋細胞は、NO産生を刺激する化合物であるブラジキニンやカルバコールに対して感受性が高く、MV_307が大きく低下することが示されている(73)。
さらに、nNOS-null筋細胞はスーパーオキシドが多く、NOが減少しているが、これはXOを活性化するp38のリン酸化の増加により、キサンチンオキシダーゼ(XO)(92)の活性が上昇したためと思われる(61)。アンジオテンシンIIは、ミトコンドリアでのNOSシグナル伝達も制御している可能性がある。
例えば、アンジオテンシンIIはnNOSの発現を増加させ、NADPHオキシダーゼと活性酸素種(ROS)の減少を引き起こす(56)。しかし、NOの阻害とアンジオテンシンII投与の組み合わせは、ミトコンドリアの呼吸とROSの産生を増加させる(43)。従って、アンジオテンシンIIはミトコンドリアのNOSと協力して呼吸を調節しているのかもしれない。
* *
心臓における部位および細胞特異的なNOシグナル伝達に関する新しい発見は、重要であるが、TSP1-CD47シグナル伝達が心臓機能を制限することを示唆する研究に照らして、さらに重要な意味を持つ。TSP1-/-およびCD47-/-マウスの若い雄の心臓全体では、環状グアノシン一リン酸および環状アデノシン一リン酸レベルが野生型と比較して上昇し(48)、一方、野生型マウスのTAC後の低酸素右心室 (91)と圧力過負荷左心室 (96)でTSP1の発現が増加した。
TSP1-CD47シグナルを欠くマウス(TSP1-/-またはCD47-/-マウス)は、野生型動物に比べ、慢性低酸素症(6、91)およびTAC(96)による心室機能障害とリモデリングに抵抗性であった。TSP1-CD47シグナルが血管細胞におけるNOを阻害し、動脈機能を制限する役割を果たすことを考えると、これらの効果が心筋細胞にも及ぶかどうかを明らかにすることは重要であろう。
* *
心筋細胞の機能に関連するもう一つの重要な側面は、NOの拡散とNOのコンパートメント化の制御である。前述のように、NOSアイソフォームの発現と局在は、局所的なNO合成と機能に大きな役割を果たす(4)。さらに、ミオグロビンやサイトグロビンなどのヘム中心タンパク質は、通常の生理的条件下でNOの拡散速度やシグナルの微調整に機能していると予想される。
先行研究では、ミオグロビンの欠損が細胞内NOスカベンジャーとして働き、心筋収縮力を制御していることが示された(113)。サイトグロビンは心筋細胞に発現し、高いNO消去能力を持つことから、ミオグロビンと同様にNO拡散を制御している可能性がある(42, 99)。
現在のところ、Hb-αが心筋のNOシグナルの調節因子としてどのような役割を担っているかは不明である。生理学的および病態生理学的な環境における心筋細胞のNOのコンパートメント化のメカニズムを解明するための専門的な研究が必要である。
NOおよびNO関連治療薬
NOおよびNO 関連薬は、NO シグナル伝達の喪失が一因と考えられる様々な心血管疾患 (74)および中枢神経系疾患 (7)において治療効果を発揮している。NOは、吸入ガスとして、肺高血圧症(PH)とそれに伴う新生児の呼吸不全の治療薬として、米国と欧州で承認されている(1)。
僧帽弁手術(44)や心臓移植(35)で報告されているように、吸入NOは周術期の肺高血圧が発生した場合に有益である可能性がある。NO供与体を既存の薬物に結びつけるNO運搬薬が開発されており、有機硝酸塩(10、110)および亜硝酸塩(25、97)、いわゆるNONOates(53、59)、ニトロプルシドナトリウム(84)などのNO-金属錯体など、前臨床および臨床研究中のさまざまなNO供与体分子がある。
非ステロイド性抗炎症薬は、NOドナーを運ぶ薬剤開発のための賢明なプラットフォームを提供したが、NO-デリバリーに関する疑問が残っている(12)。この考えを洗練された形で応用した結果、緑内障を治療するための外用薬にNOドナーを結合させることに成功した(29)。
ニトロキシル(HNO)(82)やS-ニトロチオール(100)などの他のNO関連種は、細胞培養や動物実験では有効であったが、臨床試験ではまだ証明されていない。NOデリバリー剤の下流には、cGMPの産生を刺激する新しい薬剤が開発されている。
これらの薬剤の効果の中心は、ヘム非依存的にsGCを刺激することである(75)。そのような薬剤の1つであるリオシガットは、肺動脈性肺高血圧症の患者の運動能力を高め、息切れや肺血管抵抗を減少させる効果があった(36)。最近の特許出願では、これらの薬剤が緑内障の治療に応用される可能性が示唆されている(WO 2015095515 A1)。
* *
NOシグナル伝達の減少によって媒介される疾患とは対照的に、最近の研究では、iNOS発現の増加によって明示されるような過活動性NOシグナル伝達が、乳癌の進行および患者の転帰と関連している(107)。iNOSをブロックすると、マウスにおける乳がん(45)およびメラノーマ(115)の転移が有意に制限された。
しかし、臨床において選択的なiNOSの抑制が可能であるかは明らかではない。さらに、NOは腫瘍細胞の増殖を抑制し(69)、iNOSは動物における腫瘍の成長を制限することが分かっており(54)、がんとの関連でNOを標的とした最終的な結果はまだ確定していないことが示されている。
まとめ
網羅的ではないものの、最近の知見を概観すると、ガス伝達物質であるNOは、依然として実りある研究の源であることが浮き彫りになった。様々な背景を持つ科学者が、NOの制御に関する予想外の繊細さを明らかにし続けており、それはおそらく、人間の健康や疾病に良い影響を及ぼすと思われる。
NOシグナル伝達に関する研究成果の多くは、雄のげっ歯類や大型哺乳類で確認されている。今後、一般的なガス・トランスミッターシグナル伝達、特にNOシグナル伝達における性別の役割を、固定された原理と新しく報告された制御メカニズムの両面から評価する必要がある。
助成金
この研究は、National Institutes of Health (NIH) National Heart, Lung, and Blood Institute Grants R01 HL-108954, 1R01 HL112914, and 1R21EB017184 (to J. S. Isenberg) and R01 HL 133864, R01 HL 128304 (to A. C. Straub)によって支援された。
さらに,Institute for Transfusion Medicine,Hemophilia Center of Western Pennsylvania,The Vascular Medicine Institute of the University of Pittsburgh School of Medicineから支援を受けた(J. S. Isenberg,A. C. Straubの両氏)。
ディスクローズ
J. S. IsenbergはRadiation Control Technologies, Inc. (Jersey City, NJ)の科学諮問委員会の委員長を務めており、同社とTioma Therapeutics (St. Louis, MO)の株式を保有している。その他の利益相反は、金銭的なものであれ、その他のものであれ、著者は一切申告していない。
