Neuropharmacological efficacy of the traditional Japanese Kampo medicine yokukansan and its active ingredients
pubmed.ncbi.nlm.nih.gov/27373856/
2016年7月1日

kampo.ca/herbs-formulas/formulas/yokukansan/
要旨
認知症は、認知機能障害を伴う進行性の神経変性疾患であり、興奮、攻撃性、幻覚などの認知症の行動・心理症状(BPSD)を合併することが多い。BPSDの治療には、代表的な抗精神病薬や非定型抗精神病薬が用いられるが、有害事象を誘発する。
日本の伝統的な漢方薬である義観山を起源とする抑肝散は、重篤な副作用を伴わずにBPSDを改善することが報告されている。前臨床基礎研究では、抑肝散の神経薬理学的有効性を示す研究論文が70編を超えている。本レビューでは、まず、抑肝散の神経薬理作用とその生理活性成分について述べる。
抑肝散には、セロトニン作動性、グルタミン酸作動性、コリン作動性、ドーパミン作動性、アドレナリン作動性、GABA作動性などの神経伝達作用のほか、神経保護作用、抗ストレス作用、神経可塑性促進作用、抗炎症作用など、複数の潜在的な作用が確認されている。また、抑肝散の薬理作用には、Uncaria hookに含まれるゲイッソシジンメチルエーテル(ゲイッソシジンメチルエーテル)やGlycyrrhizaに含まれる18β-グリチルレチン酸(18β-グリチルレチン酸)が関与していることが明らかになった。その後、ラットにおけるゲイッソシジンメチルエーテルと18β-グリチルレチン酸の薬物動態を記述する。抑肝散をラットに経口投与した場合、これらの成分は血液中に吸収され、血液脳関門を通過し、脳に到達した。また、オートラジオグラフィーの結果、[3H]ゲイッソシジンメチルエーテルは前頭皮質に、[3H]18β-グリチルレチン酸は海馬に優勢に分布していることがわかった。
このように、抑肝散は多様な神経薬理作用を持つ汎用性の高い漢方薬であり、様々な有効成分を含む多成分医薬品として作用する可能性がある。
1. 序論
認知症は加齢に伴う神経認知障害の中で最も頻度が高い疾患である。認知症の医療負担と社会経済的コストは、高齢化と長寿化に伴い増加し続けている。興奮、攻撃性、幻覚、不眠、不安、徘徊、抑うつなどの認知症の行動的・心理的症状(BPSD)は、認知症患者の20%~80%に認められる(Lawlor, 2004, Cerejeira er al)。 また、症状の重症度は介護負担と正の関連がある(Nagaratnam et al 1998年、Tanji et al 2005)。BPSDの治療には、典型的な抗精神病薬や非典型的な抗精神病薬が使用されてきた。しかし、これらの薬剤は錐体外路症状やその他の有害事象を誘発し、その結果、生活の質を低下させ、日常生活動作(日常生活動作)を維持することの困難性を増大させる。2005,米国食品医薬品局(FDA)は、非定型抗精神病薬で治療された認知症関連精神病患者は早死にするリスクが高いと警告した(FDA 2005)。また、従来の抗精神病薬も非定型抗精神病薬と同様のリスクがあると報告されている(Wang et al 2005)。2008,FDAはさらに、従来型抗精神病薬と非定型抗精神病薬の両方が、認知症関連精神病の治療を受けた高齢者患者の死亡リスクの増加と関連していることを警告した(FDA, 2008)。それ以来、副作用のない新たな治療法が求められている。
そのような中、(岩崎 et al 2005)は、漢方薬の易観山を起源とする日本の伝統的な漢方薬である抑肝散が、アルツハイマー病 (AD)レビー小体型認知症(DLB)などの老人性認知症患者52名を対象に、幻覚、焦燥感、攻撃性などの興奮性BPSDを改善したことを報告し、抑肝散はBPSDの新たな治療薬として期待されている。その後の臨床試験では、認知症患者における抑肝散の有効性が確認されている。
例えば、(Mizukami et al 2009)は、アルツハイマー病またはDLBと診断された106名の患者さんを対象とした無作為化クロスオーバー試験において、抑肝散の有効性と安全性を評価し、重篤な副作用を伴わないBPSDに対する有効性と忍容性を確認した。(Monji et al 2009)は、高齢のアルツハイマー病患者15人のBPSD治療に抑肝散が有効であることを示し、BPSD治療に必要な抗精神病薬の投与量を減らすことができることを示唆している。
同様に、岡原 et al 2010)は、63名のアルツハイマー病患者を対象とした非盲検無作為化並行群間比較試験において、抑肝散の高い有効性と安全性を報告している。
さらに、(松田 et al 2013)は、認知症患者236名を含むBPSDに対する抑肝散の4つの無作為化比較試験(岩崎 et al 2005,水上 et al 2009,門司 et al 2009,岡原 et al 2010)のメタ解析を行い、抑肝散は忍容性が高く、神経精神科インベントリや日常生活動作スコアに有益な効果があると結論づけている。
また、アルツハイマー病患者(岡原 et al 2010,林 et al 2010年)DLB患者(岩崎 et al 2012)に加え、血管性認知症患者においても、抑肝散は刺激性や抑制性などのBPSDにも副作用なく有効であることが報告されている(永田 et al 2012)。
これらの結果から、抑肝散は認知症のタイプに関係なくBPSDを改善する可能性があることが示唆された。また、抑肝散は、
- 境界性パーソナリティ障害(宮岡 et al 2008a)
- 神経遮断薬による遅発性ジスキネジア(宮岡 et al 2008b)
- 治療抵抗性統合失調症(宮岡 et al 2009)
- 広汎性発達障害(宮岡 et al 2009)
などの他の神経精神疾患の対症療法にも有効であることが示されている。
- 広汎性発達障害(PDD-NOS)アスペルガー障害(宮岡 et al 2012)
- 術後せん妄(斉藤 et al 2010)
- 術前不安(新井 et al 2014)
- 神経障害性疼痛(中村 et al 2009)
- じんましん・かゆみ(加藤 et al 2010)などがある。
このような臨床研究と並行して、抑肝散の生理活性成分やメカニズムの解明を目的とした前臨床基礎研究が急速に進んでいる。漢方薬は、多数の成分を含む複数の生薬の抽出物である。この分子の複雑さが漢方薬の治療メカニズムを研究する上で大きな障害となっているが、様々な薬理作用を発揮する上では利点となっている。抑肝散は7種類の乾燥生薬から構成されており、三次元高速液体クロマトグラフィー分析により、多量の化学成分が同定されている(水上 et al 2009,永田 et al 2012,辻 et al 2014)。これまでに、抑肝散とその構成ハーブや成分の薬理学的な有効性やメカニズム、有効成分の薬物動態、代謝、脳内分布などに関する基礎研究論文が70編以上発表されている。本総説では、これらの基礎研究を中心に、抑肝散の神経薬理学について述べる。
2. 抑肝散(抑肝散)
抑肝散は元々、明代(1555)に中国で雪海が書いた「Bâo yïng cuö yào」という乳児保護書の中に、子供の落ち着きのなさや焦燥感を和らげる薬として「義観三」として登場したものである。日本には17世紀後半に伝わり、18世紀後半には成人用の処方が開発された。現在、抑肝散は小児の神経症、不眠症、イライラ・夜泣きなどの治療薬として厚生労働省に認可されている伝統的な生薬として普及している。乾燥させた7種類の薬草、Atractylodes lanceaの根茎(4.0g、Atractylodes lancea De Candolleの根茎)茯苓丸(4.0g、茯苓丸の根茎)Cnidiumの根茎(3.0g、Cnidium officinale Makinoの根茎)Uncaria hook(3.0g、Uncariaのとげ)の7種類の乾燥薬草から構成されている。 0 g、Uncaria rhynchophylla Miquelのとげ)ニホンアンゲリカの根(3.0 g、Angelica acutiloba Kitagawaの根)ブプルラムの根(2.0 g、Bupleurum falcatum Linnéの根)グリチルリザ(1.5 g、Glycyrrhiza uralensis Fisherの根と茎)などがある。各植物素材は、日本薬局方の方法及び当グループ基準に準じて、その外形形態により同定し、植物標本のマーカー化合物により鑑定している。乾燥抑肝散エキス粉末を製造するには、7成分のハーブの混合物を95℃の精製熱水で1時間抽出し、抽出液を不溶性の老廃物と分離し、噴霧乾燥して乾燥エキス粉末を製造する。品質は、厚生労働省が定めた「優良製造基準」に基づいて標準化されている。図1に示すように、抑肝散抽出物のメタノール画分中に含まれる少なくとも25種類の成分を、紫外線検出による三次元高速液体クロマトグラフィー分析により同定した(水上 et al 2009,永田 et al 2012,辻 et al 2014)。
図1 抑肝散抽出物の三次元クロマトグラム
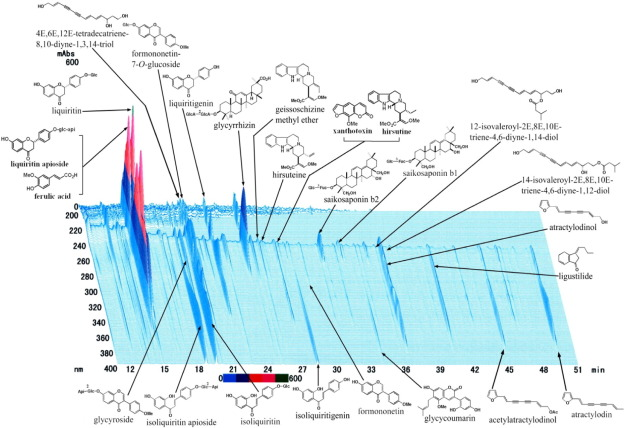
抑肝散の乾燥エキス(1g)をメタノール20mlに超音波下で30分間溶解し、3000rpmで5分間遠心分離した。上清を0.45μmのメンブランフィルターで濾過した。濾液の30μlのサンプルを、紫外線検出器を備えた高速液体クロマトグラフィーシステムに注入した。
3. 神経薬理作用
抑肝散の神経薬理作用は、セロトニン作動性、グルタミン酸作動性、コリン作動性、ドーパミン作動性、アドレナリン作動性、γ-アミノ酪酸(GABA)作動性などの神経系への作用のほか、神経保護作用、抗ストレス作用、神経可塑性促進作用、抗炎症作用などが報告されている。これらがBPSDに対する抑肝散の治療効果と関連していると考えられている(図2)。
図2 抑肝散の神経薬理作用 抑肝散の神経薬理作用
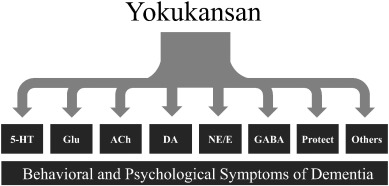
5-HT、セロトニン作動性神経伝達;Glu、グルタミン酸作動性神経伝達;ACh、コリン作動性神経伝達;DA、ドーパミン作動性神経伝達;NE/E、アドレナリン作動性神経伝達;GABA、GABA作動性神経伝達、Protect. 神経保護;「その他」には、抗ストレス、神経可塑性、神経新生、抗炎症が含まれる。
3.1. セロトニン作動性神経伝達
3.1.1. セロトニン1A(5-HT1A)受容体
このように、臨床試験において、抑肝散は陽性BPSD様攻撃性を改善した(岩崎 et al 2012,松田 et al 2013)。動物では、攻撃的行動は脳内セロトニン作動系の機能不全と関連している(Nichols, 2004)。実際、私たちは、脳内5-HT欠損ラットに5-HT神経毒であるρ-クロロアンフェタミンを投与したところ、攻撃的行動が有意に増加し、社会的行動が減少したことを示した(Kanno er al)。 抑肝散は、5-HT1A受容体部分作動薬であるブスピロンや5-HT2A受容体拮抗薬であるケタンセリンと同等の効果を示した。この結果から、抑肝散の改善効果は、5-HT1A受容体のアゴニストまたは5-HT2A受容体のアンタゴニストによるものではないかと推測された。これらの可能性を区別するために、ヒト組換え5-HT1Aまたは5-HT2A受容体を安定的に発現させたチャイニーズハムスター卵巣細胞の膜における5-HT受容体の競合的結合アッセイを行った(Terawaki er al)。 抑肝散は、[3H](±)-8-ヒドロキシ-2-(ジプロピルアミノ)テトラリン臭化水素酸塩(8-OH-DPAT)の5-HT1A受容体への結合を競合的に阻害したが、[3H]ケタンセリの5-HT2A受容体への結合は阻害しなかった。35S]GTPγS結合アッセイでは、抑肝散の存在下での最大[35S]GTPγS結合率は、完全アゴニストである5-HTの約50%であったため、抑肝散は5-HT1A受容体に対して部分的なアゴニスティック効果を有することが示された。同様の結合特性は、抑肝散の7つの構成ハーブの中でUncaria hookのみに認められた。さらに、抑肝散の5-HT1A受容体への結合特性は、抑肝散からUncaria hook(釣藤鉤)を除去することで著しく減衰したが、他の成分を個別に除去した場合にはほとんど変化しなかった。その後、Uncaria hook(釣藤鉤)から有効成分を同定するための試験管内試験結合試験を行ったところ、7種のアルカロイドのうち、ガイソスキジンメチルエーテル(ゲイッソシジンメチルエーテル)のみが5-HT1A受容体に強く結合し、抑肝散やUncaria hook(釣藤鉤)と同様の効果を有する部分的アゴニストとして作用することが示された(Nishi er al)。
次に、社会的に隔離されたマウスを対象に、Uncaria hook(釣藤鉤)の攻撃性改善効果や社会的行動の軽減効果を試験管内試験で検証した(Nishi et al 2012)。抑肝散(1.0g/kg)の緩和効果はUncaria hook(釣藤鉤)を除去することで完全に消失し、抑肝散(1.0g/kg)と同量のUncaria hook(釣藤鉤)150mg/kgを経口投与することでも抑肝散と同様に攻撃性を有意に低下させ、社会行動を促進させることができた。さらに、1.0g/kgの抑肝散に相当する150μg/kgのゲイッソシジンメチルエーテルを経口投与した場合も、抑肝散やUncaria hook(釣藤鉤)と同様に攻撃性を改善し、社会性を低下させた。これらの抑肝散、Uncaria hook(釣藤鉤)及びゲイッソシジンメチルエーテルの効果は、5-HT1A受容体拮抗剤WAY-100635の併用投与により打ち消された。これらの結果から、Uncaria hook(釣藤鉤)中のゲイッソシジンメチルエーテルは強力な5-HT1A受容体アゴニストであり、抑肝散の攻撃性と社会的孤立によって誘発される社会性の低下に対する効果を媒介する生理活性物質の候補であることが示唆された。他の生体内試験研究では、様々な動物モデルで観察された攻撃性行動、社会性の低下、不安に対する抑肝散の改善効果をWAY-100635が打ち消すことが報告されている(菅野 et al 2009,西 et al 2012,山口 et al 2012)。
興味深いことに、植木 et al 2015a)は、抑肝散が社会的に隔離されたマウスの前頭前野(PFC)における5-HT1A受容体の密度を増加させ、また、5-HT1A受容体アゴニストである8-OH-DPATによって誘導される行動反応(すなわち、飼育行動の減少)を増強することを実証しており、抑肝散が5-HT1A受容体の発現および機能活性を増加させることを示唆している。また、ゲイッソシジンメチルエーテル は 5-HT1A 受容体の部分的なアゴニストとして作用することから、抑肝散 は 5-HT1A 受容体の発現をアップレギュレートすることで ゲイッソシジンメチルエーテル の効果を高める構造を持っていることが示唆された。
3.1.2. セロトニン2A(5-HT2A)受容体と他のサブタイプ受容体
(江頭 et al 2008)は、5-HT2A受容体アゴニストである2,5-ジメトキシ-4-ヨードアンフェタミン(DOI)が誘発する頭ひっくり返し反応(マウスの幻覚様行動)を、抑肝散を正常マウスに経口投与することで、PFCにおける5-HT2A受容体の発現をウエスタンブロット法によりダウンレギュレートすることで改善したことを報告している。さらに最近、我々は、抑肝散が孤立ストレスを受けたマウスにおけるDOI誘発性ヘッドスイッチ反応を抑制し、ストレスを受けたマウスのPFCにおける5-HT2A受容体密度の上昇をダウンレギュレーションすることを明らかにした(Ueki er al)。 このように、抑肝散の幻覚様行動に対する改善効果は、現在のところ正確なメカニズムは不明であるが、複数の抑肝散成分による5-HT2A受容体のダウンレギュレーションに起因している可能性がある。Carrasco et al 2007)およびWielandら(1993)は、5-HT1A受容体の活性化が5-HT2A受容体を脱感作することを実証しており、抑肝散が5-HT1A受容体に対する部分的なアゴニスティック作用を介して5-HT2A受容体のダウンレギュレーションを誘導する可能性を示唆している。
(上田 et al 2011)は、抑肝散の薬理作用の候補であるゲイッソシジンメチルエーテルが、5-HTおよびドーパミン(DA)受容体、すなわち5-HT1A受容体に第三世代の抗精神病薬様作用を有することを、単細胞ベースのCa2+イメージングアッセイで報告している。ゲイッソシジンメチルエーテルは、アリピプラゾールのように、5-HT1A受容体では部分アゴニスト、5-HT2A受容体、5-HT2C受容体、5-HT7受容体ではアンタゴニスト、D2L受容体では部分アゴニスト/アンタゴニストとして振る舞う。また、植木 et al 2013)は、ヒト組換え5-HT7受容体を安定的に発現させたHEK293細胞の細胞内cAMPレベルを測定した結果、ゲイッソシジンメチルエーテルが5-HT7受容体に対してアンタゴニスティック効果を有することを報告している。5-HT2A 受容体については、抑肝散 抽出物を用いた実験では 5-HT2A アンタゴニスト効果は検出できなかったが、ゲイッソシジンメチルエーテル は測定可能な 5-HT2A アンタゴニスト活性を有していた。これは、粗抽出物の 抑肝散 と単成分の ゲイッソシジンメチルエーテル の違いによるものと考えられる。後述するように、抑肝散を経口投与したラットの血中および脳内でゲイッソシジンメチルエーテルが検出されるという証拠(Imamura et al 2011)は、抑肝散がゲイッソシジンメチルエーテルを介して5-HT受容体に対して複数の作用を有することを示唆している。
Uncaria hook(釣藤鉤)には、ゲイッソシジンメチルエーテル以外にも、ヒルスチン、ヒルスチンなどのインドールアルカロイドや、リンコフィリン、イソリンコフィリン、コリノキセイン、イソコリノキセインなどのオキシンドールアルカロイドが含まれている(図3)。これらのオキシインドールアルカロイドは、インドールアルカロイド構造の5つの炭素環のC2位置にカルボニル基を有しており、5-HT1Aおよび5-HT7受容体への結合活性を示さなかった。あるいは、ゲイッソシジンメチルエーテルはこれらの受容体に対して強い結合活性を示したが、ゲイッソシジンメチルエーテルと非常に類似した構造を有するヒルスチンはこれらの受容体には結合しなかった。図3に示すように、C3の構造とC20の側鎖(ゲイッソシジンメチルエーテルはC19-20に二重結合、ヒルステインはC18-19に二重結合)が異なり、その結果生じる立体変化が5-HT1Aまたは5-HT7受容体の結合活性に関係している可能性がある。
図3 Uncaria hook(釣藤鉤)由来のインドールアルカロイドの化学構造

A)Uncaria hook(釣藤鉤)由来のインドールアルカロイド(ガイソシジンメチルエーテル(ゲイッソシジンメチルエーテル)ヒルスチン、ヒルスチン)オキシンドールアルカロイド(リンコフィリン、イソリンコフィリン、コリノキセイン、イソコリノキセイン)の化学構造。およびフラボノイド(プロシアニジンB1)および
B)グリチルリチン由来のトリテルペノイド(グリチルリチンおよび18β-グリチルレチン酸(18β-グリチルレチン酸))およびフラボノイド(リキリチンアピオシド、リキリチン、リキリチゲニン、リキリチゲニン、リキリチゲニン、およびグリシコウマリン)。
3.1.3. セロトニン(5-HT)の放出
(溝口 et al 2010)は、抑肝散が高齢ラットのPFCにおける5-HT放出量の減少を逆転させたことを報告しており、これは抑肝散の抗不安作用と関連している可能性がある。しかし、有効成分は明らかにされていない。
3.2. グルタミン酸神経伝達
3.2.1. グルタミン酸の放出
亜鉛欠乏は、マウスの脳組織におけるグルタミン酸濃度の上昇、ラットの海馬における細胞外グルタミン酸濃度の上昇を示すことが示されている(武田 et al 2008a、玉野 et al 2010)。さらに、亜鉛欠乏マウスの社会的孤立は攻撃的行動を誘発した。抑肝散はこの攻撃的行動を改善し、それに伴うグルタミン酸濃度の上昇を正常化した(武田 et al 2008a、玉野 et al 2010,武田 et al 2012)。このようなグルタミン酸濃度の正常化は、海馬におけるエクソサイトーシスの減少を介した過剰なグルタミン酸放出の抑制によるものである(Takeda et al 2008b)。さらに最近では、玉野 et al 2016)は、ゲイッソシジンメチルエーテルとグリチルリチンに含まれるグリチルリチンの主要代謝物である18β-グリチルレチン酸(18β-グリチルレチン酸)が、細胞内Ca2+シグナル伝達の増加を抑制することで、モスファイバーブートンからの過剰なグルタミン酸放出を改善することを示唆した。
3.2.2. グルタミン酸輸送
チアミン欠乏症は記憶障害や不安、攻撃的行動、社会行動の低下などのBPSD様症状を引き起こすことをラットで実証した(Ikarashi et al 2009,飯塚 et al 2010)。脳の電子顕微鏡検査では、脳幹、海馬、大脳皮質を含むいくつかの脳領域で、神経細胞よりもアストロサイトの方が深刻な変性が認められた。チアミン欠乏脳では細胞外グルタミン酸が上昇していることがマイクロダイアリシス試験で明らかになった。抑肝散は、チアミン欠乏に起因する記憶障害やBPSD様行動、アストロサイトの変性、脳内グルタミン酸値の上昇を抑制した。アストロサイトが過剰な細胞外グルタミン酸を除去する役割を担っていることを考えると、チアミン欠乏症はグルタミン酸トランスポーターを介したアストログリアの取り込みを減少させることで細胞外グルタミン酸を増加させ、抑肝散はこれらの機能障害を予防していることが示唆される。実際、抑肝散はチアミン欠乏によるラット培養アストロサイトへのグルタミン酸取り込みの低下と、それに伴うグルタミン酸アスパラギン酸トランスポーター(GLAST)のmRNAとタンパク質の発現低下を改善した(Kawakami er al)。 さらに、グルタミン酸トランスポーター阻害剤であるDL-スレオ-β-ヒドロキシアスパラギン酸により、抑肝散のグルタミン酸輸送の低下に対する改善効果は完全に消失した。以上の結果から,抑肝散がチアミン欠乏によるアストロサイトの損傷からアストロサイトを保護し,グルタミン酸トランスポーターの機能を維持していることが強く示唆された。
抑肝散の7つの構成ハーブの中で、グルタミン酸輸送を有意に促進することが明らかになったのはグリチルリザであった。さらに、グリチルリザの8成分(図3)のうちグリチルリチンと18β-グリチルレチン酸が、チアミン欠乏による培養アストログリアのグルタミン酸取り込み量の減少を濃度依存的に改善することを見出した(川上 et al 2009,川上 et al 2010)。グルタミン酸トランスポーターの発現およびグルタミン酸輸送活性は、プロテインキナーゼC(PKC)活性化性のあるホルボルエステル(Conradt and Stoffel, 1997, Gonzalez et al 1999)によって低下し、これらの成分はPKC活性を阻害した。さらに、チアミン欠乏下のアストロサイトにおけるグルタミン酸取り込みおよびグルタミン酸トランスポータータンパク質発現の両方の減少は、PKC阻害剤H-7で処理することによって逆転した(Hazell et al 2003)。これらの証拠は、アストロサイトにおけるグルタミン酸輸送の機能障害に対する抑肝散のPKC阻害による改善効果には、グリチルリチンと18β-グリチルレチン酸が関与している可能性が高いことを示唆している。
抑肝散のグルタミン酸関連メカニズムは他の動物モデルでも報告されている。ハロペリドール誘発性の遅発性ジスキネジアを示すラットでは、抑肝散はグルタミン酸トランスポーターmRNAの発現を増加させることで、線条体細胞外グルタミン酸の増加を改善した(Sekiguchi er al)。 また、神経障害性疼痛のラット慢性狭窄損傷モデルにおいて、抑肝散 はブラシやアセトンによる脳脊髄液グルタミン酸濃度の上昇を抑制し、非特異的グルタミン酸トランスポーター-1(GLT-1)および GLAST 阻害剤 DL-threo-β-hydroxy-aspartic acid の髄腔内注射や選択的 GLT-1 阻害剤ジヒドロカイネートの投与により、これらの抗アロディニア作用が相殺された(Suzuki er al)。 グルタミン酸取り込みに対する18β-グリチルレチン酸の促進作用が、抑肝散のこれらの効果に関与している可能性がある。
また、脳内で支配的な高速興奮性神経伝達物質であるグルタミン酸の制御は、神経毒性(興奮毒性)の抑制にも重要であり、抑肝散は神経保護効果を有している。これらについては、後述の神経保護の項で説明する。
3.3. コリン作動性神経伝達
In vitro生化学的アッセイでは、抑肝散はアセチルコリンエステラーゼおよびコリンアセチルトランスフェラーゼ活性に影響を与えず、また、コリノレセプターおよびコリントランスポーターに結合しないことが示された(Sekiguchi er al)。 しかし、脳血管虚血を受けたラット(Nogami et al 2013)やアミロイドβ(アミロイドβ)タンパク質の脳血管内注射+虚血・再灌流傷害を受けたラット(Uchida et al 2013)では、抑肝散処理により海馬のアセチルコリン遊離が増加した。これらの著者らは、抑肝散のアセチルコリン放出作用は、シナプス小胞のリサイクルに重要な役割を果たすことが知られているダイナミン1の増加と関連しており、学習・記憶機能障害の改善と関連していることを示唆した。認知障害の治療において、他の漢方薬(チョトサン、トキシャクヤクサン)の有用性が実証された研究がいくつかある。これらの漢方薬には、抑肝散に含まれる成分(チョトサンに含まれるUncaria hook(釣藤鉤)、トキシャクヤクサンに含まれるアンカリア根、トキシャクヤクサンに含まれるアトラクトロデスランスア根茎、トウキョウチクトウ、トキシャクヤクサンに含まれるクヌギ根)と類似した成分が含まれていることから、重複する成分が有効成分である可能性を推察している(内田 et al 2013)。残念ながら、ダイナミン1の発現に関与する有効成分は不明のままである。
3.4. ドーパミン神経伝達
ゲイッソシジンメチルエーテルはD2L受容体の部分的なアゴニスト/アンタゴニストとして作用するが(上田 et al 2011年)試験管内試験競合結合アッセイにより、抑肝散自体はDA受容体サブタイプ特異的な放射性物質の結合に影響を及ぼさないことが示された(Sekiguchi et al 2012)。DA欠損やDA受容体遮断によって誘導される運動抑制やカタレプシーなどの錐体外路症状は、抑肝散を投与した様々な動物モデルでは観察されなかった(Sekiguchi et al 2009, Kanno et al 2009, Nishi et al 2012)。溝口 et al 2010)は、抑肝散が加齢に伴うPFCのドーパミン作動性伝達の低下(細胞外濃度の上昇によって証明される)を改善することを報告しており、これは抑肝散の加齢に伴う認知障害に対する改善効果と関連していると考えられる(Mizoguchi er al)。 さらに最近では、石田 et al 2016)が、ニグロストリアタルドーパミン経路の片側6-ヒドロキシドーパミン病変を有するラットにおいて、抑肝散がカテコール-O-メチルトランスフェラーゼ阻害を介してL-DOPAによるDA補給を促進したことを報告している。また、Uncaria hook(釣藤鉤)アルカロイドゲイッソシジンメチルエーテルとコリノキシンが抑肝散のこれらの作用に寄与している可能性が示唆された。
3.5. アドレナリン神経伝達
抑肝散のアドレナリン作動性神経伝達に対する作用は、これまでマウスのモルヒネ依存性の文脈でのみ研究されてきた(中川 et al 2012)。抑肝散はモルヒネの鎮痛効果に影響を与えることなく、モルヒネ耐性とナロキソンに起因するモルヒネ離脱症状(ジャンプや体重減少)を有意に減少させた。モルヒネ離脱時のジャンプに対する抑肝散の阻害効果は、α2-アドレナリン受容体拮抗薬ヨヒンビンによる1回の前処理でブロックされたが、α1-アドレナリン受容体拮抗薬プラゾシンではブロックされなかった。ヨヒンビンの反復投与により、離脱ジャンプに対する同様の抑制効果が観察された。モルヒネ離脱時にはポン髄質のα2A受容体の発現が低下したが、抑肝散またはヨヒンビンの反復投与によりその低下は抑制された。また、抑肝散とその構成ハーブであるUncaria hook(釣藤鉤)とグリチルリザがα2Aアドレナリン受容体に対して拮抗作用を示し、ゲイッソシジンメチルエーテル、グリチルリチン、18β-グリチルレチン酸を含む特定の化学成分がこの活性を共有していることが、試験管内試験での受容体結合アッセイで明らかになった。さらに、Uncaria hook(釣藤鉤)、グリチルリザ、またはそれらの成分(ゲイッソシジンメチルエーテルまたはグリチルリチン)を投与すると、モルヒネの離脱症状が有意に抑制された。これらの結果から、抑肝散中のゲイッソシジンメチルエーテルおよびグリチルリチンは、α2Aアドレナリン受容体を阻害することで、脳幹における受容体発現低下を抑制し、モルヒネ耐性および身体依存性を抑制していることが示唆された。
3.6. GABA作動性神経伝達
抑肝散は、社会的に隔離されたマウスにおいて、ペントバルビタール誘発睡眠時間の短縮を逆転させることが報告されている(Egashira er al)。 この効果はGABAA-ベンゾジアゼピン受容体複合体に関与していると考えられるが、5-HT1A受容体には関与していないと考えられた。亀井 et al 2009)は、抑肝散の抗不安様作用はGABAA受容体刺激を媒介している可能性があり、有効成分は抑肝散の水溶性画分に含まれていることを示唆している。Liaoら(1995)は、抑肝散の構成ハーブであるヒノキ根の水抽出物が試験管内試験でGABAA受容体と結合することを報告している。しかし、抑肝散には水溶性の植物性GABAが含まれていることがわかった(Nishi er al)。 抑肝散に含まれるGABAを蒸留水で完全に洗浄した後、メタノール抽出物を得たところ、試験管内試験での結合アッセイでは、GABAとベンゾジアゼピンのいずれの結合部位にも結合していなかった。これらの結果から、メタノール抽出物には有効成分が含まれていなかったため、抑肝散のGABAAA/ベンゾジアゼピン受容体に対する結合は、抑肝散に含まれる植物性GABAによるものであることが示唆された。しかしながら、経口投与されたGABAは、血液脳関門(BBB)を効率的に通過しない(Cooper er al)。 したがって、抑肝散は脳内のGABAA/ベンゾジアゼピン受容体に直接作用しないことが示唆される。むしろ、受容体に対する抑肝散の作用は間接的なものである可能性があり、例えば、GABAA受容体におけるGABA作用の強力な陽性アロステリックモジュレーターであるアロプレグナノロンが抑肝散の作用に関与している可能性がある(Matsumoto et al 1999)。
3.7. 神経保護
3.7.1. グルタミン酸神経毒性
グルタミン酸は中枢神経系の主要な高速興奮性神経伝達物質であり、グルタミン酸シナプスにおけるシナプス可塑性は、ある種の学習や記憶に不可欠である。しかしながら、細胞外グルタミン酸濃度が高いか、または長時間の上昇は、興奮性神経細胞死を誘導する(Choi, 1988, Cheung et al 1998)。すでに述べたように、抑肝散はアストログリアのグルタミン酸輸送の障害を緩和し、それによって興奮毒性を防止する。さらに、抑肝散は神経細胞を直接的に保護する効果があることが実証されている(川上 et al 2011a);抑肝散(100μg/mL)は、100μMのグルタミン酸誘発性神経細胞死からラット初代培養皮質神経細胞を保護した。抑肝散の7つの構成ハーブの中で、Uncaria hookとGlycyrrhizaが最も高い保護力を示しており、これらのハーブには神経保護成分が含まれていることが示唆された。図3に神経保護効果を調べた成分を示す。Uncaria hook(釣藤鉤)の4成分(10μM ゲイッソシジンメチルエーテル、ヒルスチン、ヒルスチン、リンコフィリン)とグリチルリザの4成分(10μM glycycoumarin、isoliquiritigenin、liquiritin、およびグリチルリチン)に神経保護効果が認められ、個々の成分が付加的および/または相乗的に抑肝散の神経保護効果に寄与していることが示唆された。N-methyl-D-aspaetate(NMDA)受容体結合および受容体連動型Ca2 + influx試験では,イソリキリチゲニンのみがNMDA受容体に結合して拮抗し,グルタミン酸誘導性Ca2 + influxを阻害した。しかし、NMDA受容体への実質的な結合(100μM以上)やCa2+流入の阻害(300μM)に必要な濃度は、神経保護効果(10μM)よりも高かったため、イソリキリチゲニンの神経保護効果はNMDA受容体拮抗によるものではない可能性が示唆された。これらの結果から、抑肝散の神経保護効果をイソリキリチゲニンのNMDA受容体拮抗作用で説明することは困難であり、抑肝散の神経保護効果はNMDA受容体拮抗作用以外のメカニズムで説明する必要があることが示唆された。
3.7.2. システイン/グルタミン酸アンチポーター系Xc-を介したヨクカンサン(抑肝散)の抗酸化作用
グルタミン酸神経毒性に関しては、グルタミン酸受容体媒介性神経毒性とシスチン/グルタミン酸アンチポーター系Xc-阻害媒介性神経毒性の2つのメカニズムが提案されている(Choi, 1988, Murphy er al)。 1990, Schubert er al)。 1992, Froissard and Duval, 1994, Pereira and Oliveira, 2000, Penugonda er al 2005, Edwards er al 2007, Lo er al 2008)。システムXc-は、システインの酸化形態であるアミノ酸シスチンを、グルタミン酸の1:1のカウンター輸送で細胞内に輸入する。このシステムは、ヘテロ二量体の膜局在化に必要な4F2重鎖と、トランスポーター活性を担うxCTタンパク質の2つのタンパク質成分から構成されている。システインは、シスチンとともに、抗酸化物質グルタチオン(GSH)の合成のための律速基質である(Lo er al)。 PC12細胞は、システムXc-を発現するが、正常なNMDA受容体サブユニットプロファイルは発現しない(Pereira and Oliveira, 2000, Penugonda et al 2005, Edwards et al 2007, Lo et al 2008, Vazhappilly et al 2010)。さらに、PC12細胞におけるグルタミン酸誘導細胞死は、グルタミン酸誘導神経細胞死をブロックするのに十分な100μM MK-801によってブロックされなかった(Lysko et al 1989)。逆に、神経細胞死を誘導するのに十分な100μMのNMDA(Zhu et al 2003)は、PC12細胞の細胞死を誘導しなかった。これまでの報告では、PC12細胞は機能的なNMDA受容体を発現していないことが示されている(Kawakami et al 2011b)。これらの知見は、グルタミン酸によって誘導されたPC12細胞死はNMDA受容体の刺激によるものではなく、PC12細胞はシステムXc-阻害によるグルタミン酸介在性細胞毒性の改善効果を選択的に評価するための貴重なモデルであることを示唆している。我々は、PC12細胞において、抑肝散がグルタミン酸介在性細胞毒性に対して細胞保護効果を有することを見出した(川上 et al 2011b、菅野 et al 2014)。抑肝散に含まれる7つの構成ハーブのPC12細胞死に対する効果を個別に検討したところ、Uncaria hook(釣藤鉤)が最も高い細胞保護力を有しており、Uncaria hook(釣藤鉤)の成分ゲイッソシジンメチルエーテル、ヒルスチン、ヒルスチン、プロシアニジンB1はいずれも細胞保護効果を有していた。これらの成分は、システムXc-サブユニットxCTおよび4F2重鎖の遺伝子発現を増強し、グルタミン酸による抗酸化GSHレベルの低下を改善した。また、抑肝散とこれら4種のUncaria hook(釣藤鉤)由来成分の細胞保護効果は、システムXc阻害剤である(S)-4-カルボキシフェニルグリシンとの共処理により相殺された。これらの結果は、これら4つの成分によるシステムXc-遺伝子の発現亢進が、細胞の抗酸化能(GSHサイクル)を維持することにより、抑肝散の細胞保護効果の少なくとも一部に寄与している可能性を示唆している。GSH減少に対する抑肝散の同様の保護効果は、ポリイノシン-ポリシチジル酸で処理したマウスの脳で観察された(Makinodan et al 2009)。さらに最近では、ゲイッソシジンメチルエーテルは、活性酸素種の発生を抑制し、解糖をアップレギュレーションすることにより、培養細胞におけるグルタミン酸誘発性神経毒性を保護することが報告されている(Sun et al 2016)。
3.7.3. アミロイドβ(Aβ)神経毒性
アルツハイマー病患者の脳内では、アミロイドβが凝集して不溶性フィブリルを形成し、老人斑の主成分となっている。近年、アミロイドβオリゴマーは生体内試験および試験管内試験においても神経毒性を示すことから、アルツハイマー病の病態のメカニズムとして注目されている。抑肝散は、初代培養皮質神経細胞において、アミロイドβオリゴマー誘発性の神経細胞アポトーシスを抑制することが示されている(Tateno et al 2008,Kanno et al 2013)。さらに、GlycyrrhizaのGlycycoumarinやUncaria hook(釣藤鉤)のprocyanidin B1がアポトーシスエフェクターであるカスパーゼ3の抑制を介して抑肝散の神経保護効果に寄与していることも明らかにした(Kanno er al)。
アミロイドβ凝集に関しては、(Fujiwara et al 2006)は、Uncaria hook(釣藤鉤)が試験管内試験でアミロイドβタンパク質に対して強力な抗凝集作用を有することを報告している。田淵 et al 2009)は、アミロイド前駆体蛋白質トランスジェニックマウスの脳内アミロイドβ蓄積に対する抑肝散の影響を検討し、抑肝散がアミロイドβの組織学的沈着や可溶性・不溶性形態のアミロイドβの産生を阻害しないことを示した。一方、(Fujiwara et al 2011)は、同じ動物モデルで抑肝散とUncaria hook(釣藤鉤)が脳内アミロイドβの蓄積を抑制することを示した。現在のところ、抑肝散のアミロイドβ蓄積に対する生体内試験での効果については議論の余地があるが、いずれの研究においても抑肝散が記憶障害や攻撃的行動を抑制することが示されている。このような抑肝散の予防効果は、抗アミロイドβ凝集作用ではなく、神経保護や神経伝達に関連したメカニズムに起因している可能性があり、Uncaria hook(釣藤鉤)に起因している可能性がある。
3.7.4. 1-メチル-4-フェニルピリジン(MPP+)/1-メチル-4-フェニル1,2,3,6-テトラヒドロピリデン(MPTP)神経毒性
Doo et al 2010)は、MPP+/MPTP誘発細胞毒性に対する抑肝散の神経保護効果を試験管内試験および生体内試験で検討した。SH-SY5Yヒト神経芽腫細胞を抑肝散で前処理すると、MPP+誘導性細胞死から保護され、カスパーゼ-3活性が有意に低下し、同時にリン酸化活性化Akt(プロテインキナーゼB)の発現が増加した。また、ホスファチジルイノシトール3-キナーゼ(PI3K)の阻害剤LY294002は、抑肝散のこの保護効果を有意に減少させた。また、マウスでは、抑肝散治療により運動機能障害が有意に改善され、パーキンソン病モデルであるMPTPチャレンジに関連したドーパミン作動性神経細胞の消失が抑制された。これらの結果は、抑肝散がPI3K/Aktシグナル伝達経路の活性化を介して、ドーパミン作動性ニューロンをMPP+/MPTPの毒性から救うことを示唆している。最近、久保田 et al 2013)は、PC12細胞において、抑肝散が神経成長因子様リン酸化を誘導し、神経細胞の保護、増殖、および分化を制御することが知られている細胞外シグナル制御キナーゼ1/2およびPI3K/Akt経路を含むプロテインキナーゼおよび脂質キナーゼ経路の活性化を誘導することを実証した(Vaudry et al 2002)Chen et al 2012)。また、Atractylodes lancea の根茎から単離されたセスキテルペノイドである β-Eudesmol は、神経栄養作用の候補の一つであることが示唆されている (Obara et al 2002, Kubota et al 2013)。
3.7.5. 小胞体(ER)ストレス
ERストレスは、生存経路とアポトーシス経路の2つの経路を活性化することが知られている。生存経路は、タンパク質の折り畳みを促進するグルコース調節タンパク質/結合免疫グロブリンタンパク質(GRP78/Bip)GRP94,およびタンパク質ジスルフィドイソメラーゼを含む、ERストレス常駐シャペロンをコードする遺伝子の転写の増加を伴う(Kozutsumi er al)。 1988,Sidrauski et al 1998,Tirasophon et al 1998,Oyadomari et al 2002)アポトーシス経路は、成長停止およびDNA損傷誘導性遺伝子153(18β-グリチルレチン酸DD153)としても知られるC/EBP相同タンパク質(CHOP)の誘導を伴う(Oyadomari et al 2002,OyadomariおよびMori 2004)。抑肝散は、低酸素曝露やタプシガルギンによって誘導されたERストレスに起因するSK-N-SHヒト神経芽腫細胞やneuro-2aマウス神経芽腫細胞の死を抑制した(Hiratsuka er al)。 これらの保護効果は、GRP78/Bip 発現のアップレギュレーションと CHOP 誘導の阻害の両方を介していることが示唆された。また、抑肝散およびCnidium rhizomeは、ERストレス下でのカスパーゼ-4活性化を抑制した。また、根茎に含まれるフェルラ酸が抑肝散のこのような保護効果に重要な役割を果たしていることが示唆された。
3.8. 抗ストレス効果
重度で累積的なストレスは、ヒトおよび動物において、不安、抑うつ、および認知障害に関与したり、悪化させたりすると考えられている(Anisman and Zacharko, 1990, Mazure, 1995, Mizoguchi et al 2000)。ストレスは視床下部-下垂体-副腎軸を活性化し、その結果、ストレスに対する適応能力を高めるグルココルチコイドホルモンの放出をもたらす(Sapolsky et al 1986年、Porter et al 2001)。しかし、過剰なグルココルチコイドは、神経細胞に対して細胞毒性があると考えられている。上述のように、抑肝散の反復投与は、c-Fos発現によって測定されるように、ラットPFCおよび扁桃体におけるストレス誘発性ニューロン興奮を減衰させた(Shoji & Mizoguchi, 2013)。また、中谷 et al 2014)は、マウス初代培養海馬ニューロンにおいて、抑肝散がコルチコステロン誘発性神経毒性を保護したことを報告している。さらに最近、Shimizu et al 2015a)Shimizu et al 2015b)は、抑肝散がストレス誘発性の血漿コルチコステロンの上昇を正常化したことを実証し、おそらくマイクロRNA依存性のメカニズムを介していると考えられる。マイクロRNAは、翻訳を阻害し、および/または標的mRNAの安定性を低下させ、最終的に標的タンパク質発現を低下させるノンコーディングRNAである(Carthew, 2006, Wang et al 2007)。マイクロRNA-18および/または124aは、脳内のグルココルチコイド受容体(GR)発現のネガティブレギュレーター候補であり(Vreugdenhil et al 2009)GRシグナルの増強は視床下部-下垂体-副腎軸の活性を減衰させる。マウスでは、抑肝散はストレスによる視床下部傍室核や冠状体のオリゴデンドロサイトにおけるGRタンパク質の減少を逆転させた。また、抑肝散は、いずれの領域においてもGR mRNAレベルに有意な変化は認められなかったが、視床下部傍室核のmicroRNA-18とカロッサルオリゴデンドロサイトのmicroRNA-124aを減少させた(Shimizu et al 2015a, Shimizu et al 2015b)。これらの結果は、抑肝散がmicroRNA-18および124aの発現レベルをダウンレギュレーションし、その後GR mRNAの翻訳を阻害することで、ストレスによるGRタンパク質の減少を正常化していることを示唆している。
3.9. 神経可塑性、神経新生、増殖、分化
コンドロイチン硫酸プロテオグリカンなどの細胞外マトリックス関連糖タンパク質は、脳内の神経幹細胞の増殖、遊走、神経突起の伸長を制御し、成体神経細胞の構造と機能を維持する働きをしている。田中・溝口(2009)は、老化ラットのPFCと海馬・歯状回におけるブロモデオキシウリジン(BrdU)取り込みにより同定された神経幹・前駆細胞の増殖・遊走に及ぼす、主要なコンドロイチン硫酸プロテオグリカンであるアグレカンの発現に対する抑肝散の影響とその改善効果を検討した。老化ラットのPFCと海馬では、アグレカンの発現増加とBrdU標識細胞数の減少が観察されたが、抑肝散処理によりこれらの変化は逆転した。これらの結果から、加齢は脳の微小環境に影響を与え、神経幹細胞や前駆細胞の増殖や移動に影響を与えている可能性があり、抑肝散は脳の微小環境に成長を許容する変化を誘導していることが示唆された。このような神経新生の亢進は、抑肝散処理したGunnラットの歯状回でも実証されている(Furuya et al 2013)。また、抑肝散は上述のように細胞外シグナル制御キナーゼ(Erk)1/2やPI3K/Aktの活性化を介してPC12細胞の神経突起の伸長を促進した(久保田 et al 2013)。
また、抑肝散は精製マウス皮質オリゴデンドロサイト前駆細胞の増殖とオリゴデンドロサイトへの分化を促進し、ゲイッソシジンメチルエーテルはこの効果に関与する有効成分の一つであった(植木 et al 2014)。この結果は、キュプリゾン処理マウスの脱髄に対するゲイッソシジンメチルエーテルの効果を検討したMorita et al 2014)によって支持され、ゲイッソシジンメチルエーテルがBrdU標識GSTpi+成熟オリゴデンドロサイトを有意に増加させ、内側PFCにおけるミエリン塩基性タンパク質免疫反応性の低下を減衰させることが示された。これらの結果から、ゲイッソシジンメチルエーテルはオリゴデンドロサイト前駆細胞の増殖とオリゴデンドロサイトへの分化を促進する可能性が示唆された。
3.10. 抗炎症作用
(Liu et al 2014)は、脳虚血/再灌流傷害を受けたガービルを対象に、抑肝散の抗炎症性および抗酸化性を調べた。抑肝散は、脳虚血/再灌流傷害による炎症反応(Iba1免疫反応性ミクログリアの増加)DNA酸化損傷(8-ヒドロキシ-2′-デオキシグアニシンの高レベル)その後の海馬CA1領域における神経細胞のアポトーシスを減衰させた。Furuya et al 2013)は、抑肝散がIba1標識細胞におけるCD11b免疫反応性の亢進により評価されるミクログリアの活性化を減衰させ、Gunnラットの海馬歯状回における神経新生を促進することを実証した。また、抑肝散に含まれるいくつかの成分は抗炎症作用を有しており、Uncaria hookに含まれるhynchophyllineやisorhynchophylline(Yuan et al 2009,Song et al 2012)Glycyrrhizaに含まれる18β-グリチルレチン酸やliquiritigenin(Khaksa et al 1996年、Kim et al 2008年)saikosaponin、saikosaponin、saikosaponin、saikosaponin、saikosaponin、saikosaponinの3種類がある。ブプルーム根のsaikosaponin a, c, d, e(Lu et al 2012)Atractylodes lancea根茎のβ-eudesmol(Seo et al 2011)Cnidium根茎のsenkyunolide A, Z-ligustilide, and ferulic acid(Cheng et al 2008,Or et al 2011)Poria scletotiumのpachymic acid(Nukaya et al 1996)。これらの知見を総合すると、抑肝散の薬理活性は、一部では抗炎症作用によって媒介されている可能性が示唆される。
4. 薬物動態
4.1. 血漿と脳におけるガイシジンメチルエーテル(ゲイッソシジンメチルエーテル)と18β-グリチルレチン酸(18β-グリチルレチン酸)の検出と血液脳関門伝染性
これまでに、抑肝散の複数の向精神作用とその構成成分、およびその薬理学的メカニズムについて説明してきた。多くの有効成分が同定されていない可能性もあるが、いくつかの証拠から、ゲイッソシジンメチルエーテルと18β-グリチルレチン酸が抑肝散の薬理学的有効性に大きく寄与していることが示唆されている。その後の薬物動態研究では、抑肝散(0.5-4.0 g/kg)を経口投与したラットの血漿中にゲイッソシジンメチルエーテルと18β-グリチルレチン酸が検出されたことが示された。ゲイッソシジンメチルエーテルの最高濃度(Cmax)は4.0 g/kg 抑肝散投与で8.46±1.38 ng/ml,18β-グリチルレチン酸の最高濃度(Cmax)は1.0 g/kg 抑肝散投与で839±112 ng/mlであった。最大薬物濃度(tmax)までの時間は、ゲイッソシジンメチルエーテルは1.2±0.6時間、18β-グリチルレチン酸は8.7±0.7時間であり、両成分は脳内で検出された(今村 et al 2011,田淵 et al 2012,串田 et al 2013)。ラット初代脳内皮細胞、周皮細胞、アストロサイトを共培養した試験管内試験でのBBB伝染性試験では、ゲイッソシジンメチルエーテルと18β-グリチルレチン酸が脳内皮細胞を横断できることが示されている(Imamura et al 2011, Tabuchi et al 2012)。グリチルリチン(18β-グリチルレチン酸の配糖体)の多くは腸内で細菌叢によって18β-グリチルレチン酸に代謝され、その後血中に吸収されることを考えると(赤尾 et al 1994年、武田 et al 1996年、Ploeger et al 2001年)ゲイッソシジンメチルエーテルが直接血中に吸収されるか、グリチルリチンが代謝物である18β-グリチルレチン酸となってBBBを介して脳に到達することが示唆されている。さらに最近、クロスオーバー無作為化試験において、抑肝散を経口投与した健康な日本人ボランティアの血漿中でほぼ同等のデータが得られた(Kitagawa et al 2015)。これらの結果は、ラット(Wang et al 1994)およびヒト(Cantelli-Forti et al 1994)にグリチルリチンまたはグリチルリザを経口投与した後、血漿中に18β-グリチルレチン酸が検出可能であったという以前の知見と一致している。
腸から血漿中に吸収されたゲイッソシジンメチルエーテルは1.7時間の半減期(t1/2)で速やかに消失する。 組換えヒトシトクロムP450(CYP)アイソフォームとヒト肝臓ミクロソームを用いた研究から、ゲイッソシジンメチルエーテルはCYPアイソフォームによって水酸化型、脱水素型、水酸化プラス脱水素型、脱メチル化型、水付加体型に代謝されることが示唆されている(Kushida et al 2015,Matsumoto et al 2016)。これらのCYPアイソフォームのうち、CYP3A4は主にゲイッソシジンメチルエーテル代謝に寄与することが明らかになっている。一方、18β-グリチルレチン酸はゲイッソシジンメチルエーテルよりも実質的に長いtmax(8時間)およびt1/2(11時間)の値を示す。グリチルリチンの成分であるグリチルリチンは吸収性が悪く、血漿中には検出されなかった。グリチルリチンは、主に消化管内の腸内細菌叢によって全身性加水分解された後、その活性代謝物である18β-グリチルレチン酸として吸収される。血に吸収された 18β-グリチルレチン酸 は容量制限されたキャリアによって肝臓に取り込まれ、グルクロニドおよび硫酸塩の抱合体に代謝される。これらの抱合体は胆汁に効率的に運ばれる。胆汁から十二指腸に流出した後、共役体は常在菌によって加水分解されて18β-グリチルレチン酸に戻り、その後再吸収され、血漿中の末端濃度に到達するまでに顕著な遅延が生じる(Ploeger et al 2001)。
このように、抑肝散は半減期が比較的短い成分(1.7時間)と比較的長い成分(11時間)の混合物である。さらに、血漿中および脳内のゲイッソシジンメチルエーテルおよび18β-グリチルレチン酸の測定、およびそれらのBBB伝染性の測定を含む薬物動態学的証拠は、これらが抑肝散の向精神作用を付与する有効成分である可能性を支持している。
4.2. ガイソスキジンメチルエーテル(ゲイッソシジンメチルエーテル)と18β-グリチルレチン酸(18β-グリチルレチン酸)の脳内分布
ラットでは、ゲイッソシジンメチルエーテル と 18β-グリチルレチン酸 の両方が 抑肝散 経口投与後に BBB を横断して脳に到達する。次に、脳内でのゲイッソシジンメチルエーテルと18β-グリチルレチン酸の結合部位を同定し、その特徴を明らかにするために、ラットの脳切片を用いて、トリチウム標識ゲイッソシジンメチルエーテルまたは18β-グリチルレチン酸を用いたオートラジオグラフィーを行った(Mizoguchi et al 2014a、Mizoguchi et al 2014b)。3H]ゲイッソシジンメチルエーテルの特異的な結合は、様々な精神症状に関連し、学習および記憶機能に重要な領域であるPFC(前辺前皮質など)海馬、尾状体、扁桃体、中央内側視床核および背側ラッパ核を含む前頭前皮質で観察された。比較的高い親和性を有する特異的結合は、前頭皮質領域で密で、背側頭葉核では中程度、小脳ではまばらであった。3H]ゲイッソシジンメチルエーテルの特異的結合は、5-HT1A受容体アゴニスト8-OH-DPAT、5-HT2A受容体アンタゴニストケタンセリン、5-HT2B受容体アゴニストBW723C86,5-HT2C受容体アゴニストRO60-0175によって有意に阻害された。その結果、α2A受容体拮抗薬ヨヒンビン、L型Ca2+チャネル遮断薬ベラパミル、μ-オピオイド受容体拮抗薬ナロキソンを投与した場合、前大脳皮質、前頭皮質、後頭葉核に[3H]ゲイッソシジンメチルエーテル信号が分布していることが明らかになった。マイクロオートラジオグラフィーにより、[3H]ゲイッソシジンメチルエーテルシグナルは神経細胞様の大細胞を含む前頭前野全体に分布していることが明らかになった。これらの結果は、ラットの脳内にゲイッソシジンメチルエーテルの特異的な結合部位が存在することを示しており、ゲイッソシジンメチルエーテルの薬理作用は主に前頭前野と背側菜核の5-HT受容体と関連していることを示唆している(溝口 et al 2014b)(図4)。
図4 グリチルリチン(GL)と18β-グリチルレチン酸を介した抑肝散の神経薬理学的効果の根底にある可能性のあるメカニズム

抑肝散を経口投与すると、グリチルリチン(GL)は腸内フローラによって18β-グリチルレチン酸に代謝され、未代謝のゲイッソシジンメチルエーテルと18β-グリチルレチン酸は血液中に吸収され、BBBを越えて脳に到達する。その後、代謝されなかったゲイッソシジンメチルエーテルと18β-グリチルレチン酸は血中に吸収され、BBBを越えて脳に到達する。脳内では、ゲイッソシジンメチルエーテルは前頭皮質の5-HT1A受容体に部分アゴニストとして優勢に結合し、抗攻撃性や抗不安作用を媒介し、18β-グリチルレチン酸は海馬のアストロサイトに分布し、過剰なグルタミン酸(Glu)を減少させ、興奮を抑制することが考えられる。
3H]18β-グリチルレチン酸の特異的な結合は海馬で最も高く、尾状柱状体、後頭葉核、扁桃体、嗅球、大脳皮質、視床、および中間の脳で中等度であり、脳幹および小脳でより低かった。いくつかのステロイド、ギャップジャンクション遮断試薬、グルタミン酸トランスポーター認識化合物、およびグルタミン酸受容体アゴニストは、[3H]18β-グリチルレチン酸結合を阻害しなかった。マイクロオートラジオグラフィーは海馬の[3H]18β-グリチルレチン酸信号がアストロサイトに似た小さな非神経細胞に分布していることを示した。免疫組織化学的分析の結果、11β-ヒドロキシステロイドデヒドロゲナーゼ1型(18β-グリチルレチン酸によって認識される定義された分子)に対する免疫反応性は、神経細胞では強く、アストロサイトでは中程度、海馬のミクログリア細胞ではごくわずかに検出された(Irie er al)。 これらの結果は、18β-グリチルレチン酸の特異的な結合部位がラット脳内に存在することを示しており、18β-グリチルレチン酸の薬理作用がアストロサイトにおける11β-ヒドロキシステロイド脱水素酵素1型に関連している可能性を示唆している(Mizoguchi et al 2014a)(図4)。
5. 結論
高齢化は現代の社会問題の一つであり、認知症は加齢に伴う代表的な疾患の一つである。日本では、現在の認知症患者数は4億6,000万人を超えている。つまり、65歳以上の4人に1人が何らかの認知症や軽度の認知障害を持っていることになる。認知障害やBPSDは、アルツハイマー病、DLB、血管性認知症、その他の老人性認知症の典型的な特徴である。臨床研究では、抑肝散が、激越・攻撃性、過敏性、幻覚、不安、睡眠障害、運動異常などの様々なBPSDや、痛みやかゆみを含むその他の症状を改善することが示されている。
本レビューでは、抑肝散の神経薬理学的有効性を示す前臨床基礎試験で得られたエビデンス、生理活性成分、薬物動態に焦点を当てて検討した。その結果、図2に示すように、抑肝散は複数の神経薬理作用を有していることが明らかになった。有効成分を同定するための研究では、Uncaria hook(釣藤鉤)に含まれるアルカロイド、グリチルリザに含まれるトリテルペンやフラボノイドが抑肝散の神経薬理作用に大きく寄与していることが示唆された(図3)。その中でも、ゲイッソシジンメチルエーテルと18β-グリチルレチン酸はセロトニン作動性、グルタミン酸作動性に特に重要な生理活性成分であることが明らかになった。薬物動態学的な知見から、これらの成分は脳に到達し、ゲイッソシジンメチルエーテルは前頭皮質の5-HT1A受容体への部分的なアゴニスト作用により攻撃性や不安感を改善し、18β-グリチルレチン酸はアストロサイトのグルタミン酸トランスポーターに作用して過剰なグルタミン酸を減少させる可能性があることが明らかになった(図4)。
それにもかかわらず、抑肝散は無数の化学成分を含む7つの乾燥薬草から構成されている。推測ではあるが、抑肝散の処方は、神経症や不眠症を重篤な副作用なく治療するために統合された複数の神経薬理作用を発現するように変更され、臨床上の効果を最大限に発揮する可能性がある。一般に、伝統的な生薬は、いくつかの生薬の混合物であり、多数の成分または成分からなり、多数の生体分子によって形成された複雑なネットワークシステムを全身的に制御することができる。このような生薬は多成分薬理論(北野 2007)に沿ったものであり、抑肝散の広範な有効性はこの理論に合致している。また、伝統的な生薬は、成分の多くが式中の統計的分布のロングテール上にあると考えられていることから、「ロングテール」医薬品と考えられる(北野 2007)。抑肝散の向精神作用の主な寄与者としてゲイッソシジンメチルエーテルと18β-グリチルレチン酸を同定したが、抑肝散の内在的利益は、個々の成分や成分ではなく、処方全体の複雑な活動に起因していると考えられる。この考えは、米国国立がん研究所が12,000種の植物の根と果実の35,000サンプル中に有効な薬剤を3つしか同定していないという知見(Yuan & Lin, 2000)によって支持されており、複数の成分の相加的および/または相乗効果が、漢方薬を含む天然植物の薬理作用に関連している可能性があることを示唆している。本レビューに記載された情報は、多成分医薬品の薬理学的理解を容易にし、システム指向のドラッグデザインアプローチに基づく認知症治療薬の開発にも利用できる可能性がある(北野 2007)。
さらに最近では、抑肝散を投与された3,156例の患者を対象に、最大52週間の副作用の安全性と頻度を調査した(久田 et al 2014)。抑肝散投与後に副作用が発現したのは136例(4.3%)であった。主な副作用は代謝・栄養障害であり、低カリウム血症が主症状(1.4%)全身障害・投与部位の状態(1.0%)下痢・悪心を主症状とする消化器障害(0.6%)であった。これらの発生率は比較的低いが、抑肝散にはグリチルリザが含まれているため、低カリウム血症には注意が必要である。抑肝散をより広く臨床応用するためには、有効性、生理活性成分の分子機構、相互作用に関するさらなるエビデンスに加え、より多くの安全性情報、副作用プロファイルの蓄積が必要である。
