コンテンツ
- 要旨
- 1. はじめに
- 2. マイコトキシンの主なグループ 発生・生産・毒性
- 2.1. アフラトキシン類
- 2.2. オクラトキシン類
- 2.3. トリコテセン類(トリコテセン系マイコトキシン類)
- 2.4. デオキシニバレノール(トリコテセンの一種)
- 2.5. フモニシン類
- 2.6. 新興フザリウム・マイコトキシン(エニアチン、NX-2 トキシン、ボーベリシン、モニリフォルミン、フサプロリフェリン)
- 2.7. ステリグマトシスチン
- 2.8. エルゴットアルカロイド
- 2.9. ゼアラレノン
- 2.10. アルテルナリア毒素(アルテヌエン、テントキシン、テヌアゾン酸、アルタートキシン、オルタナリオールメチルエーテル、オルタナリオール)
- 2.11. パツリン (PAT)
- 2.12. その他の一般的なマイコトキシン
- 3. マイコトキシンの作用機序。
- 4. カビ毒の予防対策、除染、解毒のアプローチ
- 5. 結論と今後の展望
- 謝辞
- 資金提供
- 利益相反
- 脚注
www.ncbi.nlm.nih.gov/pmc/articles/PMC8228748/
Foods. 2021 Jun; 10(6): 1279.
2021年6月3日オンライン公開
要旨
マイコトキシンは真菌が生産する物質で、人および動物に対して毒性があることが知られている。一般的なカビ毒には、アフラトキシン、オクラトキシン、ゼアラレノン、パチュリン、ステリグマトシスチン、シトリニン、エルゴアルカロイド、デオキシニバレノール、フモニシン、トリコテセン、アルテルナリア毒素、トレモルゲン性カビ毒、フサリン、3-ニトロプロピオン酸、サイクルクロチン、スポリジンなどがある。
これらのマイコトキシンは、動物と人間の両方に、死亡を含むいくつかの健康被害を与える可能性がある。自然界、特に食品や飼料には複数のマイコトキシンが同時に存在するため、マイコトキシンの無毒化や完全除去は依然として困難である。さらに、マイコトキシンに関する科学的文献は増加の一途をたどっており、継続的な知識の統合が求められている。
そこで、本研究では、動物、食品、ヒト、植物に影響を及ぼすマイコトキシンについて、その種類、毒性、予防法、無毒化・除去法などの知識を整理し、既存の情報を補完することを目的としている。その結果、マイコトキシンの汚染除去、制御、無害化戦略は、プレハーベストとポストハーベストの予防策にまたがることが明らかになった。
特に、プレハーベスト対策には、適正農業規範、施肥・灌漑、輪作、耐性品種の使用、虫害の回避、早期収穫、適切な湿度の維持、先行収穫の残骸の除去が含まれる。一方、ポストハーベスト対策には、加工、化学的、生物学的、物理的な対策が含まれることがある。さらに、マイコトキシンを無害化するための化学的手法やその他の新しい戦略として、キトサン、オゾン、ナノ粒子、植物抽出物の利用が挙げられる。
キーワード:マイコトキシン、食品、作用機序、毒性課題、無毒化、予防戦略
1. はじめに
マイコトキシンは、カビ、特に真菌が放出する二次代謝産物であり、収穫前、収穫時、収穫後の農産物を汚染し、主に動物やヒトに対して毒性を示す[1,2,3]。一般的なマイコトキシンには、アフラトキシン、オクラトキシン、ゼアラレノン(ZEA)、パツリン、ステリグマトシスチン(STC)、シトリニン、エルゴタミン、デオキシニバレノール(DON)、フモニシン、トリコテセン、その他が含まれている。
これらのマイコトキシンのヒトへの曝露は、吸入、摂取、接触を介して起こり、おそらくフードサプライチェーン内での(食材の)汚染に起因する[4,5]。歴史的な洪水、戦争、飢饉の時代には、マイコトキシンは人類を荒廃させる壮大な割合の毒物の発生につながった[4]。
また、マイコトキシンは新興の有害汚染物質と考えられており [6]、動物と人間の健康に多様な影響を与える重要な汚染物質として世界的に注目されており、フードサプライチェーン全体で経済的負担も増加している [1,7]。予防は、マイコトキシンと戦うための重要な戦略の一つであり、収穫前、加工食品、そして原材料に至るまで適用する必要がある。
* *
500 以上のマイコトキシンが報告されており、そのほとんどが規制または試験中である一方、新しいマイコトキシンがしばしば発見されている [8,9,10]。植物の代謝により、親化合物の同定に用いられる分析方法では検出されない可能性のある修飾物質である「隠れマイコトキシン」が放出されることがある[3,10]。
人々が暴露されるマイコトキシンと発生する問題は、国による暴露の違いに起因している可能性がある。アフリカやアジアの一部の国では、トウモロコシやピーナッツなどのマイコトキシンに感染しやすい作物に大量に依存していることが、マイコトキシンへの曝露に大きく関係している。

そのような場合、汚染レベルが低くても、マイコトキシンへの曝露は実際に安全レベルを超えてしまう可能性がある[4]。子どもは、免疫、神経、内分泌、神経毒の影響に対する感受性が高いだけでなく、体格を考慮すると全体的な曝露量が多く、大人とは全く異なることがあるため、マイコトキシンの毒性作用に対して最も敏感で脆弱である [11] 。
まだ十分に解明されていない環境腸症の病態にマイコトキシンが関与していることを研究することで、不顕性病態が例えば腸の吸収能力の低下として現れ、それが子どもの発育阻害と関連している可能性がある。これに関する知識は、基礎的なメカニズムとそれを回避する可能な方法を理解するのに十分な情報を提供することで、子どもの成長を改善するための戦略を提供することができるかもしれない[12]。
* *
マイコトキシンの中には、臨床医薬品に応用されているものもある。例えば、エルゴタミンは血管性頭痛の治療に応用されている。テトラサイクリンやエリスロマイシンなどの一部の抗生物質や、HIVプロテアーゼ阻害剤などのチトクロームP450阻害剤と併用した場合のエルゴ中毒症例が報告されている [13,14]。マイコトキシンの生物学をよりよく理解するためには、主に影響を受けるシステムまたは器官が、異なる種の動物で大きく異なる可能性があることを認識することが重要である。
このことを念頭に置いて、マイコトキシン感染後に出現する病原体に関連する分子経路を完全に理解することは、少々困難である。例えば、フモニシンは、ヒトでは食道がん、ネズミでは肝毒性および腎毒性、ウマでは馬白質脳軟化症、ブタでは重度の肺水腫、左心室機能障害および肝毒性を引き起こす [3,15,16]。マイコトキシンは通常、農産物の中に共存している。
一部の真菌は、2 種類以上のマイコトキシンを放出することがある。フザリウム種は、ZEA、トリコテセン、フモニシンを生成することができます [10,17]。生物学的影響は一般的に個別に研究されてきたが、マイコトキシンへの曝露は、相互作用する可能性のある複数のマイコトキシンを併発することが多い。オクラトキシンA(OTA)は、アフラトキシンB1、ペニシリン酸、シトリニン、またはフモニシンB1と一緒に作用することがある。
しかし、マイコトキシン共汚染への暴露は、個別のマイコトキシンへの暴露と比較して、比較的注目されていない [18]。
* *
マイコトキシン症(マイコトキシンに起因する疾患)の発症には、遺伝的、生理的、および環境的な側面から複数の要因が相互に影響し合っている可能性がある。このようなマイコトキシンに特有の要因は、しばしば問題視されるが、曝露や診断を確認する代謝や毒性を形成しているのである。
自然界、特に食品や飼料には複数のマイコトキシンが同時に存在するため、マイコトキシンの無毒化や完全除去は依然として困難である。さらに、マイコトキシンに関する科学文献は増加の一途をたどっており、継続的な知識の統合が必要とされている。そこで、本研究では、動物、食品、ヒト、植物に影響を及ぼすマイコトキシンについて、その種類、毒性、予防法、無毒化・除去法などの知識を整理し、既存の情報を補完することを目的としている。
2. マイコトキシンの主なグループ 発生・生産・毒性
ここでは、アフラトキシン類からフサリン類などの一般的なカビ毒まで、カビ毒の主要なグループを取り上げ、それぞれの発生、生成、毒性を説明することを試みる。一般的なマイコトキシンの化学構造を図1に示す。主な共通マイコトキシンとその毒性(確立/進化)、最大許容濃度および関連する注意事項をTable 1に示す。
表1 主な共通マイコトキシン、毒性(確立・進展)、最大許容濃度
| マイコトキシン | 一般的な真菌の種類 | よく見られる食品 | 毒性 | 最大許容値および関連する備考 | 参考文献 |
|---|---|---|---|---|---|
| アフラトキシン類(アフラトキシンB1、B2、G1、G2、M1、M2) | Aspergillus parasiticus,
Aspergillus flavus, Aspergillus bombycis, A. pseudotamarii, A. nomius など。
|
穀類、豆類、果実、種子、野菜、ナッツ類など。
|
肝臓がん、肝細胞がん、標的DNA、変異原性及び催奇形性作用 | EUでは、人間が直接摂取するナッツ類、ドライフルーツ、穀物類に含まれる総アフラトキシンとAFB1の許容量をそれぞれ4μg/kgと2μg/kgと定めている。
牛乳中のAFM1最大残留基準値は、EUで50 ng/kg、米国で500 ng/kgの生乳に設定されている。泌乳牛の飼料中の AFB1 の最大残留基準値は、EU、中国、米国でそれぞれ 5 μg AFB1/kg, 10 μg/kg, 20 μg/kg に設定されている。
|
[19, 26 |
| オクラトキシン類(オクラトキシンA、B、C) | Aspergillus ochraceus、
Aspergillus niger Aspergillus carbonarius Penicillium verrucosumなど、Aspergillus属と Penicillium属の種 |
穀類、豆類、種子類、果実、野菜、ナッツ類など。
|
免疫毒性、催奇形性、神経毒性、肝毒性、腎毒性作用、豚の腎症、ヒトではオクラトキシンAと尿路上皮腫瘍、慢性間質性腎症、腎不全、バルカン風土病の関連性など。
|
EUでは、輸入食品のOTA規制値は、インスタントコーヒーが10.0μg/kg、焙煎コーヒーが5μg/kg、ブドウジュースが2μg/kg、ワインが2μg/kg、穀類加工食品が3μg/kg、未加工穀類が5μg/kgに設定されています。
|
[1,81] |
| トリコテセン類(トリコテセンマイコトキシン)、例えば、デオキシニバレノール(ボミトキシン)、3-及び15-アセチルデオキシニバレノール、ニバレノール、アンギジン、T-2トキシン、HT-2トキシン、クロトシン、ジアセトキシシルペノール、大環状体などである。
|
フザリウム属(Fusarium crookwellense,
F culmorum, F graminearum, F poae) ミロテシウム属 バーティシモノスポリウム属 トリコテシウム属 トリコデルマ属 セファロスポリウム属 スタキボトリス属 スピセラム属の各種類。
|
米、麦、ライ麦、大麦、トウモロコシ、小麦、野菜など、および卵、牛乳、レバー、腎臓などの動物性食品 | 細胞内に拡散し、真核生物のリボソームと相互作用することにより翻訳を阻害する。
これが主な作用機序である。その他の作用機序としては、DNA、RNA、タンパク質合成の阻害、脂質過酸化、アポトーシス、ミトコンドリア機能の阻害、神経伝達物質の変化、サイトカインの活性化などが挙げられます。トリコテセン類への暴露は、脊椎動物のほぼすべての主要なシステムに影響を与える…ヒトにおける消化器毒性アレウキア(ATA)等。
|
米国 FDA はデオキシニバレノールについて 1ppm の規制値を定めている。EFSA は T-2 毒素と HT-2 毒素の合計で 100 ng/kg bw という TDI の範囲を使用している。
|
[16, 96
, 98] |
| フモニシン類(フモニシンB1、B2、B3など) | Fusarium verticillioides
Fusarium nyagamai F. oxysporum F. globosum F.fujikuroi F. proliferatumなどのFusarium属 Aspergillus awamori A. niger などのAgilus属など。
|
トウモロコシおよびトウモロコシ食品とともに、アスパラガス、ソルガム、ビール、米、大豆、豆類などでもフモニシンの存在が報告されています。
|
フモニシン類は、サルの動脈硬化、ヒトの食道がんや肝臓がん、ウマの白質脳軟化症、ブタの肺水腫や肺動脈肥大、ネズミの腎臓がんや肝臓がんと関連があると言われています。フモニシン類はスフィンゴ糖脂質の合成を阻害する。
|
国際がん研究機関(IARC)は、フモニシンB1をヒトに対して発がん性がある可能性があると分類しています(グループ2B)。
EUは、フモニシン(フモニシンB1およびB2)の総量規制を、人間が直接消費するトウモロコシおよびトウモロコシ製品については1000μg/kg、トウモロコシから製造されるスナックおよび朝食シリアルについては800μg/kgとしました。 米国FDAは、フモニシンの総量規制を、人間が直接消費することを意図したトウモロコシおよびトウモロコシ製品では2~4 mg/kg、ポップコーンに使用されるトウモロコシでは3 mg/kgに設定しました。FAO/WHO合同食品添加物専門家委員会は、フモニシンB1、B2、B3の組み合わせまたは単独での1日あたりの最大耐容摂取量を2μg/kg bwとした。
|
[19, 114, |
| フザリウム・マイコトキシンの出現(エニアチン、NX-2トキシン、ビューベリシン、モニリフォルミン、フサプロリフェリン、他) | Fusarium verticillioides,
Fusarium subglutinans, Fusarium proliferatum Fusarium acuminatum, F.venaceum, F. arthrosporiodes, F. chlamydosporum, F. redolens, F. oxysporum, F. beomiforme 等のフザリウム属種 Beauveria bassiana。
|
トウモロコシ、米、トウモロコシ製品、種子、ナッツ類、コーヒー、木の実、ドライフルーツ、豆類、植物油など | 食品や飼料に多く含まれ、ヒトや動物に毒性を示す可能性があることから、新興マイコトキシンへの関心が高まっています。ボーベリシンは殺虫、抗真菌、抗菌作用を持ち、哺乳類の細胞株ではアポトーシス誘導、細胞質カルシウム濃度の上昇、DNAの断片化などの毒性作用を示すことがある。
|
使用不可 | [126, 127 |
| ステリグマトシスチン | A. versicolor(主な生産者)
A. sydowi A. quadrilineatus A. aureolatus A.amstelodami A. ruber A. chevalieri などのAspergillus種 およびPenicillium Emiricella、Chaetomium Bipolarisの各種類。
|
ピーナッツ、トウモロコシ、大麦、米、小麦、穀物製品など。
|
ステリグマトシスティンは催奇形性、変異原性、発がん性を有するが、AFB1より効力が弱く、ほとんどの動物で肝毒性を引き起こす;ラットで肝細胞癌および扁平上皮癌;牛で血性下痢および死亡;マウスのLD50は800mg/kg以上である。
|
IARCはSTCをクラス2Bの発がん性物質に位置づけた。カリフォルニア州保健局は、がんポテンシーデータベースのTD50値を用いて、ヒトに対する「有意なリスクなし」の摂取量を算出した。その結果、70kgの成人で1日8mcg/kgbwとなった。
多くの国で制限値が設定されていない |
[140,144] |
| エルゴットアルカロイド | Clavicipitaceae
(Neotyphodium、Clavicepsなど) Trichocomaceae (Penicillium、Aspergillusなど)科が 生産するインドールの誘導体の複合体で構成される。
Claviceps purpureaは主要な生産者である。
|
ライ麦(最も一般的な宿主)、ライ小麦、大麦、小麦、オーツ麦など。
|
エルゴット中毒を引き起こす;エルゴットアルカロイドは人間にとって有害でもあり有益でもある;せん妄発作、発作、聖アンソニーの火などを引き起こす;壊疽や痙攣性の中毒を引き起こす可能性がある。
|
最大許容限界はEU委員会のパイプラインにあるが、現在のエルゴット硬化体の含有量は未加工の穀物で最大0.05%と設定されている。
米国では、ライ麦と小麦は重量比0.3%以上の強角膜を含む場合、人間による消費には安全でないとされ、大麦、ライ小麦、オート麦は0.1%以上含むと等級付けされることになっています。欧州連合の定めるエルゴットレベルの上限は、普通小麦およびデュラムで0.05%、すなわち500 mg/kgw/wの硬化体である。
|
[147] |
| ゼアラレノン(旧名称:F-2トキシン) | Fusariumcrookwellense,
Fusarium cerealis, Fusarium semitectum, Fusarium equiseti, Fusarium graminearum, Fusarium culmorum などのFusariumの種が挙げられる。
|
トウモロコシ、大豆、米、ライ麦、ソルガム、オーツ麦、大麦、小麦、穀物製品など。
|
ゼアラレノンまたはその代謝化合物は、生合成経路の酵素の発現に関与するプレグナンX受容体などの転写因子と結合することが知られている。ゼアラレノンを慢性投与すると、マウスで子宮筋腫、下垂体腺腫、肝細胞癌、肝臓障害、ラットで慢性進行性血毒、精巣萎縮、白内障、網膜症、ネフローゼが起こり、他の動物の中でも豚がより毒性を持ちやすいとされる。
|
ゼアラレノンの耐容一日摂取量(TDI)は、EFSAによって0.25μg/kg bw/dayに設定され、FAO/WHO合同食品添加物専門家委員会(JECFA)など他の国際機関でも推奨されています。
|
[155,156] |
| アルテルナリア毒素(アルテヌエン、テントキシン、テヌアゾン酸、アルタトキシン、オルタナリオールメチルエーテル、オルタナリオール) | Alternaria triticina,
Alternaria tenuissima, Alternaria solani, Alternaria japonica, Alternaria dauci, Alternaria brassicae, Alternaria alternata などのAlternaria属。
|
青果物、種子、穀物、植物、ビール、フルーツジュース、野菜ジュース、ワイン、ピーマン、生鮮・乾燥トマト、小麦粉、ふすま、小麦、ドライフルーツ、穀物製品(米、オートフレークなど)、ひまわり油、ひまわりの種、など | テヌアゾン酸は植物毒性、抗菌性を持ち、イヌ、ニワトリ、マウスに急性毒性を示し、さらにヒトには血液学的障害を示す。
Alternariaの毒素の多くは低い急性毒性を示すが、Alternariol methyl etherとAlternariolは、哺乳類と細菌細胞を用いたin vitroの毒性試験から科学的根拠に基づく知見が得られ、遺伝毒性、細胞毒性、発がん性、変異原性の作用があるため毒性がほとんどであるとされている。
|
EFSAは毒性学的懸念閾値(TTCアプローチ)を導入し、遺伝毒性を有するアルテルナリア毒素(AMEとAOH)については1日あたり2.5ng/kg体重、非遺伝毒性を有するアルテルナリア毒素(TENとTEA)については1日あたり1500ng/kg体重をTTC値として設定した。
|
[162,164] |
| パチュリン | Penicillium expansum,
A. clavatus,Penicillium patulum(Penicillium griseofulvumandPenicillium urticae), Penicillium crustosum, etc. |
りんご、りんご製品、果物、野菜、穀類、豆類、種子、ナッツ類など。
|
また,細胞培養では,変異原性,催奇形性,発がん性,免疫毒性,神経毒性などの慢性および急性作用が認められました.動物では神経毒性、免疫毒性を示しますが、ヒトへの発がん性については信頼できる証拠はありません。しかし、ヒトに対する毒性として、出血、潰瘍、嘔吐、悪心などが報告されています。
|
米国、EU、中国当局はいずれもフルーツとアップルジュースのパツリン上限値を50μg/L/kgに設定した。EUは食品の種類に応じて10μg/kgから50μg/kgの規制値を設定した。
|
[164,174
,175] |
| その他一般的なマイコトキシン(トレモージェニック・マイコトキシン、フサリン(フサリンA~F)、3-ニトロプロピオン酸、シクロクロロチン、スポリデスミン)。
|
トレモージェニック・マイコトキシンはAspergillus terreus や
Penicillium属の種などで生産される。
Pithomyces chartarumは スポリデスミン Penicillium islandicumは シクロクロロチン Arthriniumは3-ニトロプロピオン酸 Fusariumverticillioides(formerly Fusarium moniliforme), Fusarium graminearum(Fusarium venenatum), Fusarium poae, Fusarium sporotrichioides, Fusarium oxysporumは フサリウムの種で生産される。
|
数種類の食品・飼料 | トレモージェニック・マイコトキシンは、家畜に「よろめき症候群」を引き起こし、ヒトでは発作、震え、精神錯乱、さらには死亡などの神経症状と関連がある。
フサリンは変異原性、3-ニトロプロピオン酸はミトコンドリアの電子輸送を阻害、シクロクロロチンは筋原線維を阻害、動物では肝毒性、スポリデスミンは疎水性のため細胞膜に容易に組み込まれ、そこで二重層の組織を変化させる。
|
EU、米国、WHOなどでは、これらのマイコトキシンに様々な規制値を設けている | [175,176 |
図1 一般的なマイコトキシンの化学構造
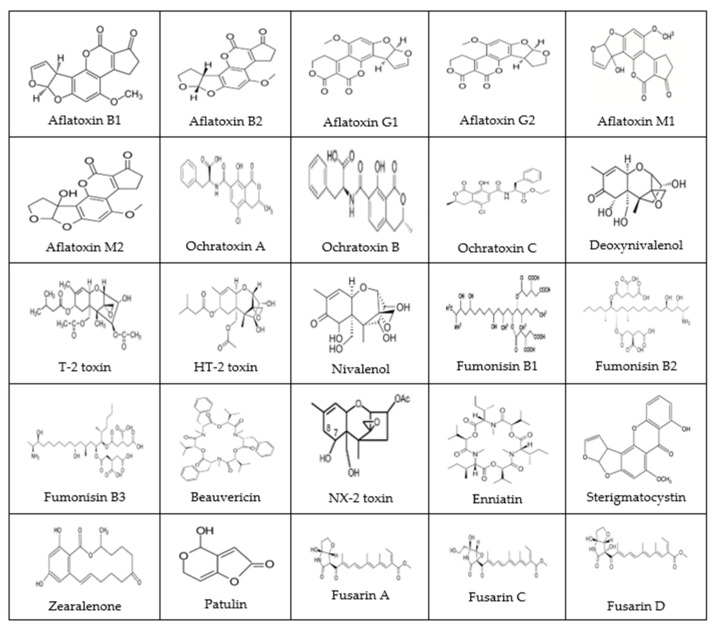
(出典 [1,3,7,9,19] から転載/引用)。
2.1. アフラトキシン類
アフラトキシンは、主にAspergillus flavus, A. bombycis, A. pseudotamarii, A. nomius, A. parasiticusによって生産される一群のマイコトキシンであり、いくつかの作物、食品、農産物を侵すことがある [19,20]。アフラトキシンは、1960年代にカビに侵されたピーナッツミールを与えられた七面鳥、鶏、アヒルが死亡し、重度の肝障害を引き起こした七面鳥「X」病の流行で重要視されるようになった[21,22]。
アフラトキシンは、フラノクマリン類と呼ばれる20種類の関連した多環式構造からなる化合物である。日和見病原体であるA. flavusは、主に木の実、綿、ピーナッツ、トウモロコシなどの油糧作物で繁殖している[20,23]。[20,23]。

A. flavusは、植物組織では菌糸として、土壌では硬化体や分生子として存在し、通常、緯度16度から35度の温暖な気候で発生し、45度以上ではあまりみられない [20]。綿実の貯蔵脂質、特にトリグリセリドは、アフラトキシン B1 (AFB1) の産生をサポートすることが示されている。
綿実から脂質を除去した後、アフラトキシンの生産は少なくとも 800 倍に減少した。綿実の脂質を用いて種子を再構成すると、マイコトキシンの生産は初期レベルに戻った [24]。A. parasiticusが地上作物のみに感染するのに対して、A. flavusは複数の植物に感染する[20]。
いくつかのカビ菌株のアフラトキシン生産能力の量的および質的差異が研究されてきた。A. flavusのおよそ半分の株はアフラトキシンを生産することができる[25]。味噌、酒、醤油の製造に用いられるA. sojaeとA. oryzaeは、Aspergillus parasiticusとA. flavusと密接な関係にあり、多くのアフラトキシンの生合成遺伝子のホモログを構成するがアフラトキシンを生成することは報告されていない[25]。
* *
アフラトキシンは、その発生、人体への影響、毒性、および存在量に関して最も重要なマイコトキシンである[2]。アフラトキシンは、アフラトキシンB1(AFB1)、アフラトキシンB2(AFB2)、アフラトキシンG1(AFG1)、アフラトキシンG2(AFG2)の4大グループに分類されている。
アフラトキシンの名称において「2」は、「1」に対応するアフラトキシンに対して二重結合を欠いた構造異性体であることを示す[26]。食品に関連する主要な4つのアフラトキシンの名称は、紫外線における緑色(G)または青色(B)の蛍光とクロマトグラフィー移動度に基づいている[27]。
さらに2つのアフラトキシン、アフラトキシンM1(AFM1)とアフラトキシンM2(AFM2)は穀物とは関係ないが、AFB1およびAFB2が蔓延した飼料を食べた哺乳類の乳から検出され、それらの代謝産物である。毒性レベルは、AFB1、AFB2、AFG1、AFG2の順に低下する[28]。AFB1は他のアフラトキシンと比較して最も毒性が強く、肝細胞癌との関連が指摘されている[2,3,26]。
* *
1つの菌が2種類以上のアフラトキシンを産生することもある。例えば、Aspergillus parasiticus は AFB1, AFB2, AFG1, AFG2 を生産し、その結果、これらのアフラトキシンは通常、食品中に混合物として存在することになる。
Aspergillus flavusは、形態学的に直径400μm未満の硬葉を持つS株と、直径400μm以上の硬葉を持つL株に分類される[20]。この2つの株はAFB1とAFB2を生産し、S株はAFG1とAFG2も生産することができる[20]。
汚染された空気や食品を通して、アフラトキシンは、熱帯・亜熱帯地域などの湿度が高く暖かい気候条件の地域で50億人以上に影響を与えると推定され、その発生は食品の保存や乾燥方法が不十分な地域でより一般的である [29,30]。サハラ以南のアフリカや中国南部のような特定の集団の大部分は、アフラトキシンへの定期的な曝露に直面しており、子宮内時期から始まって、曝露は個人の寿命を通して続く可能性がある[31]。
食品からのアフラトキシンへの曝露を決定することは、通常アフラトキシンを含む多数の食品品目と、正確な個人の食品消費パターンを推定することの難しさのために、ほとんど課題となりうる[1,31]。我々は、多くの場合、複数の食品を組み合わせて食べている。
アフラトキシンの暴露に関するバイオマーカーはより有用であり、アッセイの1つはアルブミンに結合するアフラトキシンの量を測定することだ。ネズミを用いた研究では、AFB1-アルブミンの付加体は用量依存的に形成され、肝臓DNAとAFB1の間に付加体が形成されることが示された[1]。
アフラトキシン-アルブミン付加体レベルの推定は、曝露が季節的にどのように変化するかを示した。ガンビアの小児における付加体レベルは、11月に比べて5月に有意に高いことが報告されており、おそらく貯蔵作物への曝露(または消費)を示していると思われる[1]。
ほとんどの活性化型AFB1のDNAの標的は、DNAの大溝に位置し、反応にアクセスできるグアニンN7原子である。AFB1-N7-guanine 付加体は、最近の曝露を示すだけであるが、最も信頼性が高く、情報量の多い尿バイオマーカーの一つである[25,32]。ラットにおけるAFB1-ホルムアミドピリミジン付加物は、最も多く存在する2番目のDNA付加物であると報告されている[33]。
* *
アフラトキシンは熱に安定で、変異原性、催奇形性を持つ。アフラトキシンは、ヒトでは強い発がん性物質であり、また、鳥類、げっ歯類、非ヒト霊長類などでも発がん性がある。[27,30]。 摂取後、AFB1 と AFB2 はそれぞれ AFM1 と AFM2 に代謝される[28]。
AFB1 から AFM1 への変換は、ジフラノクマリン環の 3 位炭素が水酸化されて行われ、-OH 基が水への溶解性を促進し、糞便、尿、牛乳に速やかに排泄される [19]。動物モデルを用いた研究では、AFB1のおよそ6%が乳汁中にAFM1として代謝・分泌されるが、その変換率は動物によって異なり、また動物の健康状態、消化率、食餌などの多くの要因によって変化することが示されている。
[19]。 牛乳のAFM1汚染は、季節、農業システムの多様性、地理的位置、環境条件などのいくつかの要因に基づいて、世界中の牛乳および乳製品に見られる。多くの研究が、暖かい季節に生産された牛乳および乳製品は、寒い季節に生産されたものより汚染が少ないと報告しているが、これはおそらく、寒い季節に長期間保存された牛の飼料が菌の増殖に適した条件であるためである[19]。

乳牛のミルクでは、AFM1 に汚染された飼料を摂取してから 12 時間以内に AFM1 が検出される[34]。ヒトの AFM1 暴露は、通常、牛乳への曝露を介して起こる。牛乳中の AFM1 の最大残留基準値は、EU では生乳の 50 ng/kg に、米国では 500 ng/kg に設定されている。また、キャリーオーバーを避けるために、泌乳牛の飼料中のAFB1の最大残留基準値は、EUで5μg AFB1/kg、中国で10μg/kg、米国で20μg/kgに設定されている[34]。
* *
作物のアフラトキシン汚染は、植物の生殖段階における熱または干ばつが原因のストレスにより、収穫前に発生する可能性がある[25,35]。作物のポストハーベスト汚染は重要な課題であり、通常、昆虫の活動や過剰な水分など、不適切な保管条件に関連している[20]。
昆虫による被害は、作物におけるアフラトキシンの存在と関連しており、おそらく植物における被害が真菌の侵入を可能にするためだろう [23]。アフラトキシンの生産を増加させる他の要因は、ストレス要因と考えることができる。ストレッサーの例としては、植物の病気、過剰な植物密度、雑草との競争、植物の酸化ストレス、不十分な植物栄養などが挙げられる[35,36]。
アフラトキシンの生合成は、28 ℃から35 ℃の温度範囲内で最適となるが、36 ℃を超える温度では阻害されることがある[27,37]。A. flavus遺伝子のゲノムワイドな発現は、28〜37 ℃の温度上昇に伴い減少する可能性がある[37]。
アフラトキシン生成に影響を与える栄養因子として最も研究されているのは、炭素源と窒素源に関連するものである [38,39,40,41,42,43,44,45,46,47]。さらに、グルコース、マルトース、フルクトースなどの単糖はアフラトキシン生産をサポートし、ラクトースなどの複合糖はアフラトキシン生産を阻害する可能性がある[27]。
窒素利用率の低下、酸性 pH(約4.5)、35℃以下の温度、酸化ストレスはアフラトキシンの生合成を助長するが、塩基性 pH(約8)、36℃以上の温度、抗酸化物質の存在、酸化窒素源はアフラトキシンの生合成を助長しない [48]。
A. flavusによるAFB1およびAFB2の生産は、それぞれチロシンを増加させ、トリプトファンを減少させると考えられる。一方、A. parasiticusによるAFB1とAFG1の生産ではトリプトファンが増加し、チロシンはAFG1の生産を減少させるがAFB1とAFB2の生産は増加させる[49]。
* *
AFB1への曝露による発がんに対する脆弱性には種差があり、マウスが最も抵抗性が高く、ラットが最も感受性が高い[50]。マウスの発がん抵抗性は、ヒトには存在しないグルタチオンSトランスフェラーゼA3サブユニット(mGSTA3)がマウスの肝臓で高度に構成的に発現しているためであると考えられる[51]。
アフラトキシンに暴露されたヒトでは、多くの種類のアフラトキシ症が報告されている。1回以上の曝露による急性アフラトキシ症は、重症例では死に至ることもあるが、慢性アフラトキシ症では、肝細胞癌、免疫系の抑制、成長阻害が生じることもある[20,23]。
1974年にインド西部の200以上の村で死亡率の高い大規模な集団発生が起こった。罹患者は門脈圧亢進症、急速に進行する腹水、黄疸を呈していた。この大発生は、すべての村で同時に発生したため、感染症が原因であるとの説が有力である。
アスペルギルス・フラバスに高度に侵されたトウモロコシの摂取が原因であると報告された。汚染されたサンプルの研究によると、罹患者は1日2〜6mgのレベルのアフラトキシンを最大1ヶ月間食べていた可能性があることが示された[52]。
* *
1988年、マレーシア北西部の都市ペラックで発生した急性肝性脳症により、13人の中国人の子供たちが命を落とした。疫学的研究によると、罹患者は死亡する数時間前に中華麺を摂取していたことが判明した。罹患者は、工場から供給された麺が配給される途中の2地区6町に地理的に分散していた。
死後調査の結果、アフラトキシンの存在が確認された[53]。2004年4月にケニアで大規模なアウトブレイクがあり、これは史上最大のアフラトキシン症のアウトブレイクで、少なくとも125人が死亡し、317人の患者が発生した。この特定のアウトブレイクは、アフラトキシンに汚染された自家栽培のトウモロコシに関連していた[54]。
急性アフラトキシ症は、ヒトと動物の両方で報告されている。研究では、600頭の飼養豚の3分の2が、マイコトキシンの生産を好む条件で保管されたドラフトストレスのかかったA.フラバスに汚染されたトウモロコシの飼料中のキログラムあたり2500から3500μgのアフラトキシンにさらされた後に命を落としたことが示されている [55]。

アフラトキシンに汚染された市販のドッグフードを摂取した犬では肝障害と死亡が報告されており、アフラトキシンに汚染されたトウモロコシを摂取した馬でも病気が報告されている[56,57]。ヒトでは、AFB1への慢性的な曝露は肝細胞癌と関連していた。
実際、AFB1 はヒトに肝細胞癌を引き起こすことができる最も強力な化合物の一つであり続け、大部分が強力な発癌物質と考えられている [29,30]。国際がん研究機関(IARC)は、AFB1、AFB2、AFG1、および AFG2 を、ヒトにおける発がん性を支持する十分な証拠がある物質を含むグループ 1 に分類した [26,58](The International Agency of Research on Cancer, IARC)。また、免疫抑制剤として、アフラトキシンは免疫抑制を誘発する可能性がある[29]。
* *
動物およびヒトにおいて、アフラトキシンの発がん性の原因となる代謝物は、短命の AFB-2,3-epoxide で、現在 AFB1-8,9-epoxide (AFBO) として知られており、DNA およびタンパク質と付加体を形成する能力を持ち、結果として突然変異を引き起こす [29,59]。シトクロム P-450 3A4 と 1A2 は、AFB1 を AFBO に変換する主要な肝酵素である。
グルタチオン S-トランスフェラーゼ (GST) は、AFBO とグルタチオンの抱合を触媒する解毒酵素であり、肝障害作用から保護する[29]。AFBO の主な解毒経路はグルタチオン S-トランスフェラーゼとの酵素的抱合であり、多くのげっ歯類における曝露による肝臓発がんへの脆弱性は、グルタチオン S-トランスフェラーゼのレベルに反比例している[60]。
さらに、広く研究されている AFB1 の突然変異による影響は、ヒトでは p53 遺伝子が関与している。アフラトキシンに暴露されるリスクのある地域に居住する肝細胞癌患者の約半数は、p53遺伝子に変異を保有しており [61,62]、これは位置だけでなくその性質によっても異なるだろう [63]。
アフラトキシンへの曝露後に肝細胞癌を示す約50%の個体は、エクソン7からコドン249のp53遺伝子クラスターに、アルギニン残基をセリンに置換するG-T転位を持っていると考えられている[63]。ヒト肝癌細胞でラットマイクロソーム活性化AFB1を用いてコドン247-250での変異誘発を評価したところ、多くのコドンで変異が起こりうることがわかり、G-T変換はコドン249の3番目に位置していることがわかった[62]。
この変異のホットスポットは、p53遺伝子の癌に関連する6つの最も一般的な変異のうちの1つである[64]。変異p53のタンパク質は、肝細胞の成長を刺激し、p53が仲介する転写やアポトーシスを妨害する[63]。これらの結果は、アフラトキシンに暴露された結果、肝細胞のクローン拡大の選択性にp53変異が関与していることを説明するものである[65]。
* *
AFB1とB型肝炎の慢性感染との相乗的な相互作用が報告されており、多くの潜在的なメカニズムが説明されている。そのようなメカニズムの例としては (a) B型肝炎ウイルスがチトクロームP450によって変異原性中間体を形成すること、(b) B型肝炎ウイルスがヌクレオチド切除の修復を妨害すること、および (c) ウイルスによって引き起こされる肝細胞の損傷が最終的に突然変異の可能性を増大させることである [66]。
別の研究では、18,244人の中国人男性を調査し、尿中代謝物の検出によって評価したアフラトキシンへの曝露が肝細胞癌のリスクを約2倍、B型肝炎の抗原が約5倍、共同曝露が約60倍増加させることを示した [67]。
C型肝炎ウイルスとの相乗的な相互作用が報告されているが、B型肝炎ウイルスと同様にその関係はまだ完全に解明されていない[68]。リスク評価分析により、世界の肝細胞癌症例の約25%がアフラトキシン曝露と関連する可能性があり、これは中国、東南アジア、サブサハラアフリカなどのB型肝炎の流行が高い場所で一般的に発生することが示された[69]。
ヒトにおけるアフラトキシンが肺を含む臓器のがんと関連していることは、動物モデルを用いて証明されており、アフラトキシンへの暴露による肺の発がんが実証されている[70,71,72]。これは多くの場合、摂取によるものではなく、呼吸器系を介したものである。
* *
これまでに知られているアスペルギルス属のすべての種は、8本の染色体を持っている。2005年、Aspergillus flavusの全ゲノムが公開された。Aspergillus oryzaeと同様に、Aspergillus flavusのゲノムサイズは約37 Mbpで、Aspergillus fumigatusの約30 Mbpよりやや大きく、12000以上の機能遺伝子をコードしている [20,73,74,75,76]。アフラトキシンの生合成には23以上の生化学反応が必要であると考えられており、これらの生化学反応に関与する遺伝子がアノテーションされ、配列が決定されている[77,78]。
アフラトキシンの生合成をより深く理解することを目的としたいくつかの研究が、農作物の汚染に最もよく関連しているAspergillus parasiticusとAspergillus flavusを対象に行われている[48]。アフラトキシンの生合成は複雑で、多くの制御層があり、湿度や温度などいくつかの環境条件に影響される[48]。
2.2. オクラトキシン類
オクラトキシンは、アスペルギルス属およびペニシリウム属の菌類が生産する二次代謝物である。その化学組成は、フェニルアラニン部位とイソクマリン部位がアミド結合で結合したものである[79,80]。ペニシリウム属は温帯気候の地域でより重要であり、アスペルギルス属の種は熱帯および亜熱帯でより重要である。
オクラトキシンA(OTA)、オクラトキシンB(OTB)、オクラトキシンC(OTC)は自然界に存在する主要なオクラトキシンである[81]。オクラトキシンAは、1965年に初めて報告された[82]。OTAはAspergillus ochraceus, A. niger, A. carbonarius, Penicillium verrucosumによって生産され、穀物(例:穀類、豆類)、ベビーフード、乳児用ミルク、コーヒー、牛乳、肉、スパイス、甘草、ビール、ワイン、果物、ナッツなどいくつかの農作物と食品に含まれる [3,83]。
OTAは塩素処理されており、これが特徴の一つである[81]。塩素化されていないOTBや、OTAのエチルエステルであるOTCは毒性が低く、あまり一般的でない[80]。A. ochraceusによるオクラトキシンの生産は、pH 3〜10、温度31℃、水分活性0.8以上で至適となる。P. verrucosumによるオクラトキシンの生産は、pH 6-7、温度20 °C、水分活性0.86以上で至適である[84]。オクラトキシンの生産は、鉄、亜鉛、銅の存在下で最適となる[85]。
* *
オクラトキシンによる穀物の汚染は、収穫前、収穫周辺、収穫後の条件に大きく依存する。OTAは主に穀物の殻に濃縮されており、穀物から果皮(外側の層)を取り除くと、OTAの濃度が少なくとも50%減少することが知られている[85]。
米国北部と北西部のグレートプレーンズ地域で穀物加工に携わるいくつかの商業企業が異なる期間保管した大麦、硬質赤色春小麦、デュラム小麦のサンプルを分析した研究では、約12%のサンプルにOTAがあり、約81%のサンプルは少なくとも6ヶ月間保管されたものである。

ドイツでは、異なる期間保管された1991年から1993年の穀物サンプルを分析し、サンプルの約54%にOTAがあり、2%ではOTAのレベルが3ng/g以上であったと報告した[86]。ヨーロッパで行われた多くの研究は、従来のビール、オートブラン及び人間による消費を意図した小麦試料と比較して、有機作物におけるOTAのレベルが高いことを報告した[87,88]。
ヨーロッパの国々では、食品中の汚染の平均レベルは低いようで、これまでのところ、報告されたOTAの汚染の最高レベルは、動物飼料用のカビたパンで80mg/kgであった[81]。OTAは、アチャ、レーズン、ワイン、スパイス、カカオ、豆類、米、トウモロコシ、ライ麦、小麦、ソルガム、ギニアコーン、大麦、さらに豚肉製品と牛乳から検出されている[80]。
オクラトキシンAを産生するカビの株は、作物や地理的な場所によって異なる[80]。多くのマイコトキシンと同様に、OTAは高い安定性を有しており、従来の食品調理の手順では分解されない。しかし、汚染された試料を250℃を超える温度に何分間もさらすと、OTA濃度が低下する可能性がある[79]。OTA濃度を安全なレベルまで低下させることは重要であるが、一般的な食品調理の手順では達成できないかもしれない。
* *
OTAは、その高いタンパク質親和性、特にアルブミンに対する親和性により、動物の臓器に蓄積し、汚染のキャリーオーバーを引き起こす可能性がある[81]。ほとんどの個体は、極めて低レベルではあるが、血液中に検出可能なレベルのOTAを有している。
スウェーデンとノルウェーでは、OTAは母乳と血漿のサンプルで報告されたが、ブラジルでは、ほとんどの母乳サンプルはOTA陰性であることが証明された。フランスの研究では、22%近くの人の血中OTA濃度が0.1~1.30ng/mLであり、イタリアの研究では97%の人の血中OTA濃度が0.12~2.84ng/mLで、男性の濃度が女性に比べ有意に高かった [89]。
一般に、血中のOTAのレベルは、健常者と比較して、腎症に罹患している患者において高い[80]。動物モデルを含む研究に基づき、OTAはヒト発がん性物質(グループ2B)の可能性が高いと認識されており、がんの脆弱性は種と性別の両方に特異的である[90]。
* *
動物実験では、OTAは、免疫毒性、催奇形性、神経毒性、肝毒性、及び腎毒性を有することが示されている。OTAの急性毒性は腎臓に最も影響を与え、ブタは暴露後腎臓病で最も高い感受性を示した[84]。催奇形性は、ニワトリ、ウズラ、ウサギ、ハムスター、ラット、マウスなど多くの動物実験で報告され、頭蓋顔面異常と出生時体重減少が最も多かった [81,90]。
ラットの妊娠5-7日目は極めて感受性が高いと思われる。この日数内に1.75mg/kgのOTAを単回皮下投与すると、最大吸収数、胎児体重の減少、骨格奇形及び軟組織の量が最も多くなった[91]。低用量のOTAへの慢性的な曝露は、高用量の急性曝露よりも高い毒性を有する可能性がある[90]。
* *
ヒトにおいて、OTAは、尿路上皮腫瘍、慢性間質性腎症及びバルカン風土病性腎症(BEN) と関連している。さらに、疫学的研究により、早期のOTA曝露が精巣癌と関連することが明らかにされている[80]。ヒトにおける腎腫瘍は、70μg/kgを超えるOTAを含む食品を毎日摂取した場合に生じると考えられている[84]。
いくつかの研究は、飼料/食品中のオクラトキシンA(または血中濃度)とバルカン半島風土病の腎症発生率との疫学的関連を報告している[84,89]。BENは、ボスニア・ヘルツェゴビナ、マケドニア、セルビア、クロアチア、ルーマニア、ブルガリアといった地理的な地域で報告されている。
ブルガリア北西部の研究では、1日あたり1.21μgのOTAを消費することがBENと関連していると報告したが、OTAは、環境中の他の毒素との相乗効果、及び/又は、その素因となるいくつかの遺伝子型との相互作用において、この状態を引き起こすことができると強調した [89]。急性腎不全は、何ヶ月も閉鎖されていた穀物貯蔵施設に夫(農民)と8時間滞在した女性の24時間後にA. ochraceusが放出したオクラトキシンを吸引したことと関連している。
* *
ヒトでは、OTAの半減期は単回経口摂取後35日(840時間)と長くなることがある。これは、腸肝循環での再吸収、タンパク質との広範な結合、あるいは尿細管分泌に伴う尿からの再吸収で説明されると考えられている[84,85]。動物では、OTAの半減期は短く、例えばマウスでは12時間、ブタでは48時間、ラットでは150時間であるが、マカクでは約1400時間の半減期を持つ [85]。
OTAは動物で精巣毒性を示し、食品の汚染が確認されている多くの地域で精巣癌の発生率の増加が示されている[90]。マウスを用いた研究では、妊娠7.5日目にOTAを腹腔内投与すると、哺乳類の精巣の発達に必須の腫瘍抑制遺伝子であり転写因子であるDmrt-1のダウンレギュレーションを引き起こした。
Dmrt-1 のダウンレギュレーションは、マウスの睾丸の生殖細胞腫瘍に関連し、ヒトにおけるそのホモログは、生殖細胞腫瘍への感受性に関与していた[90,92]。EUでは、輸入食品中のOTAの許容限界は、インスタントコーヒーで10.0μg/kg、焙煎コーヒーで5μg/kg、ブドウジュースで2μg/kg、ワインで2μg/kg、穀類加工食品で3μg/kg、未加工の穀類で5μg/kgとなっている[80]。
2.3. トリコテセン類(トリコテセン系マイコトキシン類)
トリコテセン類はトリコテセン系マイコトキシンとも呼ばれ、三環式12,13-epoxytrichothec-9-eneを共通のコア構造とし、構造が類似している200以上のセスキテルペノイド代謝物の多様なグループである。これらは化学的に関連したマイコトキシンで、米、オート麦、ライ麦、大麦、トウモロコシ、小麦、野菜などの食品に一般的に含まれている。
トリコテセン系マイコトキシンは、Fusarium(Fusarium crookwellense、F culmorum、F graminearum、F poaeなど)、Myrothecium、Verticimonosporium、Trichothecium、Trichoderma、Cephalosporium、Stachybotrys、Spicellumの様々な真菌種で生成されている。
最も一般的なトリコテセンはデオキシニバレノール(DON)であり、ボミトキシンとも呼ばれる[93,94]。その他、T-2トキシン、HT-2トキシン、3-および15-アセチルデオキシニバレノール、ジアセトキシシルペノール等がある。
トリコテセンの生物活性を担う最も重要な構造的特徴は、12,13-エポキシ環、トリコテセンの核の適当な位置に存在するアセチル基または水酸基、および側鎖の位置と構造である。C-4とC-15の間のエステル-エーテル結合、または大環状エステルの存在により、トリコテセンマイコトキシンは非大環状と大環状になることがある。
大環状トリコテセンはA型とB型に分類される。A型トリコテセンはC-8位にエステル型または水素型の側鎖を持ち、DAS(Anguidine)、T-2、HT-2(T-2の脱アセチル化代謝物)などが含まれる。A型は毒性が強く、哺乳類ではT-2はdeoxynivalenolの約10倍の毒性がある。
タイプBのトリコテセン系マイコトキシンは、ニバレノールやデオキシニバレノールなど、同じ位置にケトン基を持つ[25,95]。C型トリコテセン系マイコトキシンにはクロトシンが、D型トリコテセン系には大環状化合物が含まれる[96]。
* *
トリコテセン系マイコトキシンは、フザリウム属菌が生産する3種類のマイコトキシン(ゼアラレノン、フモニシン、トリコテセン)のうち主要なグループである[16]。また、化学的多様性が最も高いマイコトキシンの一つである。トリコテセン類は両親媒性(疎水基と親水基の両方を持つ)で、分子量が低い(200から500 Da)ため、皮膚や消化管から容易に吸収される。
細胞内に拡散し、真核生物のリボソームと相互作用することで翻訳を阻害する;これが主な作用機序である [94,97]。トリコテセンマイコトキシンは、DNA、RNA、タンパク質合成の阻害、脂質過酸化、アポトーシス、ミトコンドリア機能の阻害、神経伝達物質の変化、サイトカインの活性化など、いくつかの作用機序を持っている [96,98] 。
* *
トリコテセンへの暴露は脊椎動物のほぼすべての主要なシステムに影響を与える[25]。T-2 をラットに単回投与し、メタボロミクスのプロファイリングにより、中等量と低用量の 2 mg/kg と 0.5 mg/kg of body weight (bw) は代謝、特に尿に変化をもたらし、高用量 (4 mg/kg bw) では胸腺、脾臓、胃、肝臓でさらに代謝の変化をもたらし、また多くの代謝経路の障害と腸の微生物叢の中断をもたらした [98]。

マウスをT-2毒素に暴露した研究では、時間に依存する形で、著しい酸化的損傷、酸化的タンパク質損傷、過酸化脂質の増加が報告され、酸化ストレスが毒性の基礎となる重要なメカニズムであることが、in vivoでは、経皮経路でより顕著な毒性が引き起こされ、皮下経路では毒性が少なかった[99]。
T-2 はトリコテセン系マイコトキシンの中で最も毒性が強く,動物に対する毒性は年齢,投与量,種,投与経路に依存する[100]。活発に細胞分裂する細胞はT-2毒素に対してより脆弱であり、このことは免疫系と消化管がT-2の主な標的器官の一つであることを説明する[98]。
ラットにおける慢性および急性毒性は、脳内のセロトニン、トリプトファン、チロシンの分布に変化をもたらした[101]。ヒトや動物における慢性・急性毒性の症状には、発がん、免疫抑制、神経伝達物質の不均衡、体重減少、成長遅延、口腔内病変、下痢、嘔吐が含まれる[98,100,102]。
DON の免疫機能への影響には、免疫刺激と免疫抑制があり、濃度や暴露時間に大きく依存する [16]。in vivo および in vitro での T-2 の主な代謝産物は HT-2 毒素であり、同様の毒性を持つ脱アセチル化代謝産物で、腸内の多くの微生物によって行われる脱アセチル化反応によって生成することができる [16]。
* *
トリコテセン類への曝露に関連するヒトの腸管毒性アレウキア(ATA)は、1913年に東シベリアで初めて報告され、1932年に西シベリアの多くの地区で再び出現した。病気としてのATAは、発熱、無顆粒球症、壊死性狭心症、歯肉出血、口内出血、鼻出血、下痢、嘔吐、腹痛を呈し、高い死亡率を伴う。
同様の症状を持つ集団発生が、1730年代にニューハンプシャーで先に記録されている[95,97,103]。当初、この大発生は間違って伝染病とみなされたが、罹患者を治療した医療従事者の中に発病者がいなかったことから、この考えは否定された。また、ビタミン類の欠乏が原因であるとする仮説的分析も却下された[103]。穀物の越冬と収穫の遅れがカビの繁殖を促し、マイコトキシンの発生を招いたと考えられている。
2.4. デオキシニバレノール(トリコテセンの一種)
デオキシニバレノールは経済的に最も重要なカビ毒であるが、カビ毒の中で最も毒性が強いというわけではない。トウモロコシ、大麦、オート麦、小麦は、デオキシニバレノールの影響を多く受ける穀物である。圃場で行われた多くの研究では、フザリウム菌核病の強度は DON の蓄積と線形関係にあることが示されている[104]。
相対湿度、水分、温度など、Fusarium head blightの発病に影響を与える要因は、その蓄積にも影響を与える[104]。14%以下の水分含量で貯蔵し、昆虫を制御することは、DONの生成を回避する主な戦略の一つである[105]。
DONは、卵、牛乳、肝臓、腎臓など、動物から得られる食品に含まれることがある。デオキシニバレノールが乳牛からその乳に移行することを示した研究は、全てではないが、ほとんどない。DONに中毒すると、発熱、めまい、頭痛、下痢、嘔吐、吐き気、腹痛が起こる[106]。

フザリウムに汚染された穀物では、損傷した穀物の数が増加するにつれてDON濃度が上昇する。健全な穀粒とフザリウムに汚染された穀粒を5%添加で連続2年以内に0〜100%混合し、それぞれの穀粒から得られた粉を評価した結果、フザリウムに汚染された穀粒の数が増えるほどDON濃度が高くなることが示された[104]。
* *
すべての家畜種の中で、豚は DON の毒性に最も感受性が高い。犬や猫を含む他の種も影響を受け、DON に対する感受性は性別や年齢によって異なる可能性がある[107,108]。DON は 170~350 ℃で安定であり、170 ℃では 30 分後の濃度低下は報告されていない[106]。
DONは水に溶解するため、汚染された麺/パスタを調理する際に、調理に使用する水に溶出するため、濃度は減少するが、汚染された食品を油で揚げた場合には減少しない[106]。動物実験では、低用量のDONに長期間さらされた場合、子供の成長に障害をもたらす可能性があることが示されている[3]。
カシン・ベック病とトリコテセン類との関係をより良く理解することに大きな関心が持たれている。カシンベック病は、慢性の変性性骨関節炎として現れ、中国南西部および東北部のおよそ15の省で250万人が罹患しており、風土病となっている[3]。
その病因は多因子性であると思われ、疫学的研究からの証拠は、セレンの欠乏と穀物のT-2汚染が重要な役割を果たす可能性を指摘している[109]。In vitroでは、T-2は関節軟骨のプロテオグリカンの分解を促進し、軟骨マトリックスの分解を誘発し、マトリックスメタロプロテアーゼのアップレギュレーションを誘発し、軟骨細胞のアポトーシスを引き起こす。ラットを低栄養食とT-2毒素にさらすと、カシンベック病患者で報告された病変と同様の組織学的、X線学的変化が見られた;ネズミでは、毒素は関節の変性変化をもたらした [110,111,112]。
2.5. フモニシン類
フモニシン類は、発がん性や毒性のあるカビ毒の仲間で、スフィンゴ脂質の前駆体であるスフィンガニンと構造的に類似している[79,113]。フモニシン類は、長鎖ポリヒドロキシアミンとプロパノトリカルボン酸のジエステルである[114]。
フモニシン類は、炭化水素とトリカルバリル酸、アミノ基、メチル基からなる長い水酸化鎖を持ち、アミノ基は生物活性に不可欠である[115]。1988年、フモニシン類は南アフリカで発見され、そこで初めて、あらゆる地域でトウモロコシを頻繁に汚染するFusarium moniliforme(現在はFusarium verticillioidesとして知られている)の培養物から単離された。
フモニシン類は、Fusarium nyagamai, F. oxysporum, F. globosum, F. fujikuroi, F. proliferatum など、14 種以上の Fusarium が生産している [19,113,114]。
また、Aspergillus awamoriやA. nigerでもフモニシン類の生合成遺伝子群が報告されており、主にフモニシンB2(FB2)を生産している[114]。フモニシン類は、A、B、C、Pの4つのグループに大別される[15,116]。

現在、少なくとも15種類のフモニシンが知られており、その中で最も量が多く、毒性が強いのはフモニシンB1(FB1)である[117]。フモニシンB3(FB3)も一般的である。FB1、FB2、FB3のみが自然に汚染された食品に含まれている[118]。
フモニシンB3が5-デオキシフモニシンB1であるのに対して、フモニシンB2は10-デオキシフモニシンB1である[118]。Fusarium moniliformeとF. verticillioidesは、ほとんどフモニシンB1を生産するが、ごく少量ながらFB3とFB2も生産している[114]。
トウモロコシおよびトウモロコシ食品とともに、FB1はアスパラガス、ソルガム、ビール、米、大豆、豆類で報告されている[116]。セリアック病の患者は、米とトウモロコシを中心とした食生活のため、フモニシンへの曝露のリスクが高い[114]。
* *
フモニシンは、トウモロコシにおいて最も重要なマイコトキシンであり、特に湿潤で温暖な地域において、汚染のレベルは毎年異なる可能性がある[79,114]。フモニシンは高温で安定性を保ち、そのレベルは150℃以上でのみ減少する。
フモニシン類は、収穫前または保管・乾燥の初期段階において、種子または植物内の真菌が増殖する際にトウモロコシで生成される [79]。トウモロコシの乾燥製粉におけるFB1レベルが最も高いのはふすま画分であり、次いで動物飼料として使用される胚芽画分、そして食品製造用の画分は最も低いレベルである [119]。
フモニシンB1およびB2はpH4で最も安定で、次いでpH10および7であり、175℃で60分後にはpHに関係なく90%の分解があった[119]。トルティーヤチップスを190℃で15分間フライするとフモニシンレベルが67%減少し,コーンマフィンを焼くと175℃で16%減少し,200℃では28%減少した.これらの温度レベルでは、減少はマフィンの表面よりも芯の部分で少なかった[119]。
フモニシン類の生産は、水分活性(aw)が0.95〜0.99で、温度が20℃〜30℃の範囲内で最適となる[114]。フモニシンの生産には、水分活性が重要な役割を果たす。0.85 から 0.86 の aw では,菌はほとんど定量可能な代謝活性を示さず,フモニシンの生産は見られなかった.畏怖の念のわずかな変化がフモニシンの生産に大きな影響を与える。
awが1.0-0.95と5%低下しても、菌の増殖速度に影響はなく、フモニシン量は3倍に減少したが、awが1.0-0.90と10%低下すると、菌の増殖は20倍、フモニシンの生産は300倍に減少した [120]。
* *
フモニシン類の産生を調節することは、菌種によって異なる可能性がある。Aspergillus nigerは低いawでより繁栄し、マイコトキシンの生産は0.985から0.97、25から30℃の温度内でピークに達するが、Fusariumの種は0.99を超えるawと20から25℃の温度を好む [121]。フモニシン類は、サルの動脈硬化、ウマの白質脳軟化症、ブタの肺水腫や肺動脈肥大、ネズミの腎臓がんや肝臓がんと関連があるとされている[113,114,117]。
米国では、1989年に中西部の気候の異常でフモニシン類が高濃度になり、作物からフザリウム・バーチシリオイデスで汚染されたトウモロコシを豚に与えたところ、豚肺水腫が発生した[15]。豚の肺水腫は、スフィンゴ糖脂質の生合成の擾乱を介した急性左心不全の結果であると思われた。
これは、ゴルジ装置や小胞体の障害に加え、心筋細胞のL型カルシウムチャネル阻害により心収縮力が低下し、Ca2+による放出が阻害されることが原因であると仮説的に示唆されている[15]。フモニシン類は、真核生物において重要な調節・構造分子であるスフィンゴ脂質の合成を阻害する[115]。
阻害作用は、FB1の経口摂取の数時間後に容易に発現することができる[118]。その効果は、セラミド合成酵素阻害能力(セラミド合成酵素はスフィンゴシンのリサイクルを制御し、スフィンガニンをアシル化する)により説明することができる。この効果は、複合的なスフィンゴ脂質合成の阻害と、通常細胞内に低レベルで存在するスフィンガニンの細胞内レベルの上昇という2つの結果をもたらし、細胞毒性作用をもたらす[79,115]。
* *
ヒトにおけるフモニシンへの曝露は、食道がんや肝臓がんを引き起こす可能性がある[117]。食道癌との関連は、南アフリカのトランスケイの発生率の高い地域の家庭で栽培されたトウモロコシからフモニシンが検出されたときに記述された[113,122]。
その後、トウモロコシおよびトウモロコシ製品がよく消費される中国、イラン、米国南東部、イタリア北部、アフリカ中南部の人々で食道がんリスクの増加が報告され、中国の一部の地域では暴露が肝臓がんに関連していた[114,118]。動物実験では、神経管欠損症がフモニシンへの暴露によって引き起こされる可能性があることが示された。

このことは、葉酸結合タンパク質や膜の他のタンパク質の機能に影響を与える能力に加えて、フモニシンへの曝露が疑われる、あるいは知られている多くの地域で、ヒトにおける神経管欠損率が増加していることから、神経管欠損がそのフモニシン曝露によって引き起こされる可能性が高まっているが、その根本的原因メカニズムは十分に確立されていない [113、117]。
テキサス州南部において、テキサスとメキシコの国境で行われた研究は、母体血清中のスフィンゴシンの比率を介したスフィンガニン測定を通じて、家庭で作られたトルティーヤからのフモニシン曝露を評価した。スフィンガニン(スフィンゴシン比0.11〜0.35)と調整オッズ神経管欠損症比との間に用量反応関係が報告されたが、最も高い曝露量(スフィンガニン:スフィンゴシンレベル0.35以上)を持つ人々については報告されておらず、またこのグループは参加人数も最も少ないものであった。この知見は、神経管欠損症と母親のフモニシン曝露との間に、おそらく用量反応関係があることを示唆した[113,123]。
* *
フモニシンが食品から母親の母乳に移行し、それに続いて乳児が曝露されることは、重要な検討事項の一つである。タンザニア北部で行われた研究では、授乳中の母親から得られた母乳のサンプルの約44%がフモニシンB1を含み、そのうちの約10%が欧州連合が乳児用食品に設定した200μg/kgの制限値を超えていることが報告されている[124]。
フモニシンB1は、スフィンゴ脂質の代謝を阻害する機能とともに、ミトコンドリアの電子輸送鎖複合体Iを阻害し、活性酸素の発生、脂質の過酸化、酸化ストレスを促進することが報告されている[117]。さらに、フモニシンB1は、アスパラギン酸とシトルリンからアルギニノコハク酸の生成を触媒する尿素サイクル酵素であるアルギニノコハク酸合成酵素を阻害する作用があることが報告されている[125]。
* *
FAO/WHO合同食品添加物専門家委員会は、フモニシンB1、B2、B3の組み合わせまたは単独での1日の最大耐容摂取量を2μg/kg bwとした[113]。国際がん研究機関(IARC)は、フモニシンB1をヒトに対して発がん性がある可能性がある(グループ2B)と分類している[117]。
EUは、フモニシン(フモニシンB1とB2)の総量規制を、人間が直接消費するためのトウモロコシとトウモロコシ製品については1000μg/kgに、トウモロコシから製造されるスナックと朝食シリアルについては800μg/kgに設定している。米国FDAは、フモニシンの総量規制を、人間が直接消費することを意図したトウモロコシとトウモロコシ製品ではそれぞれ2~4mg/kg、ポップコーンに使用されるトウモロコシでは3mg/kgとした[116]。
2.6. 新興フザリウム・マイコトキシン(エニアチン、NX-2 トキシン、ボーベリシン、モニリフォルミン、フサプロリフェリン)
最近の新興マイコトキシンは、穀物、特に穀類や穀類製品などの食品に広く存在するため、大きな課題となっている[126]。新興マイコトキシンは、「日常的に測定されておらず、法律で規制されていないマイコトキシンであるが、その発生を示す証拠は急速に増加している」と定義されている[127]。
食品と飼料におけるボーベリシン(BEA)とエニアチン(ENN)の存在について、欧州食品安全機関(EFSA)は、関連する毒性データが不足しているため、リスク評価を行わないという意見を提示した[128]。フサプロリフェリン(FU)は、二環式セステルペン型マイコトキシンで、Fusarium verticillioides、Fusarium subglutinans、Fusarium proliferatumを含むFusariumの種によって生産されている[129]。
フサプロリフェリンは,ブラインシュリンプの幼生やニワトリの胚に毒性を示した[129]。モニリフォルミン(MON)は、1-hydroxycyclobut-1-ene-3,4 dione で、水溶性の低分子化合物で、Fusarium acuminatum, F. avenaceum, F. arthrosporiodes, F.S. arthrosporiodes, F.S. arthrosporiodes, F.S. acuminatum によって生産することができる。
arthrosporiodes, F. verticillioides, F. chlamydosporum, F. redolens, F. oxysporum, F. beomiforme, F. thapsinum, F. subglutinans, F. sacchari, F. pseudoanthophilum, F. proliferatum, F. napamai, F. nygamai, F. nyamai, F. nyamai, F. nyamai, F. nyamai, F. nyamai, F. nyamai, F. nyamai, F. nygamai, F. napiforme, F. fujikuroi, F. diaminii, F. concentricum, F. bulbicola, F. begoniae, F. anthophilum, F. acutatum, F. tricinctum, F. ramigenum, F. pseudonygamai, F. pseudocircinatum. pseudocircinatum, F. phyllophilum, F. nisikadoi, F. lactis, F. denticulatum の代謝物の一つであり,最近では Penicillium melanoconidium の代謝物の一つであることが示された [129,130]。
* *
構造的には,ボーベリシンは3つのN-methyl-l-とd-A-hydroxy -iso-valeryl-phenylalanyl 残基が交互に配列した環状ヘキサデプシペプチドである[131]。ボーベリシンは、ボーベリア・バシアナという真菌から初めて単離された。
ボーベリア・バシアナは、昆虫に病気を引き起こすことが知られており [131]、フザリウムの種に感染したトウモロコシおよびトウモロコシ製品によく発生する。BEAは、チェコ共和国、イタリア、スペイン、ルーマニアなどのヨーロッパの国々だけでなく、モロッコ、イラン、ルワンダ、タンザニア、日本など世界各地で穀物や穀物製品に感染している[132,133,134,135]。
BEAは殺虫,抗真菌,抗菌作用を持ち,哺乳類の細胞株ではアポトーシス誘導,細胞質カルシウム濃度の上昇,DNAの断片化などの毒性作用を持つことがある[131]。
* *
最近,イネの培養物から新しいトリコテセンであるNX-2毒素が発見された.NX-2 は,C-8 にケト基を持たないが,毒性および構造の点で3-ADON に類似しており,その結果,NX-2 はタイプ A トリコテセンマイコトキシンである [136]。
ENNを産生するフザリウム属菌としては,Fusarium venenatum, F. tricinctum, F. torulosum, F. sporotrichioides, F. scirpi, F. sambucinum, F. poae, F. later, F. oxysporumが示されている.oxysporum, F. lateritium, F. langsethiae, F. kushuense, F. equiseti, F. culmorum, F. compactum, F. merismoides, F. acuminatum, F. arthrosporioides, and F. avenaceum [137]。エニアチンを生産する能力を持つフザリウム属の種は、様々な地域に存在する。
しかし、ENNは穀物だけを汚染するのではなく、コーヒー、木の実、ドライフルーツ、豆、植物油などいくつかの食品を汚染している。食品および飼料から最もよく検出される ENN には、エニアチン A(ENA)、エニアチン B(ENB)、エニアチン A1(ENA1)、およびエニアチン B1(ENB1)が含まれる[138]。

エニアチンがヒトや動物に影響を与えるという兆候はほとんどないが、ENNは細胞輸出阻害を通じて他のフザリウム毒素(特にDON)の影響をより顕著にする役割を担っている可能性がある[139]。食品や飼料に多く含まれ、ヒトや動物に対する潜在的な毒性を持つことから、新興マイコトキシンに対する関心が高まっている[131]。これらの新興マイコトキシンについて、ヒトや動物に対する潜在的な毒性を含めた理解を深めるとともに、食品・飼料中の存在を安全なレベルまで効果的に低減するための研究が必要である。
2.7. ステリグマトシスチン
ステリグマトシスチン(STC)は真菌の二次代謝産物で、A. versicolor(主要なSTC生産者)、A. sydowi、A. quadrilineatus、A. aureolatus、A. amstelodami、A. ruber、A. chevalieriなど様々な種類のAspergillusによって生産されている。
他のカビ種もSTCを生成することができ、ペニシリウム属、エミリセラ属、チエトミウム属、およびビポラリス属のものも含まれる[140]。A. versicolorは0.95awで最適に成長するが、0.8aw以下でも成長することが可能である。
このカビは4℃から40℃の間で生育するが、生育の最適温度は30℃である[140]。ステリグマトシスティンはAFB1の経路の後期代謝化合物であり、AFB1と同様にSTCはキサントンやフラン環を含む[15,141]。

2007年と2006年の研究では、ラトビアの様々な穀物から採取したサンプルを評価し、2006年のサンプルの約14%が0.7未満から83μg/kgのレベルでステリグマトシスティンに陽性であり、2007年のサンプルの35%が1未満から47μg/kgのレベルで陽性であると報告されている[142]。
STCはカビの生えたピーナッツ、コーン、大麦、米、小麦に発生する[140]。様々なパンにアスペルギルス・バーシカラーの芽胞を接種したところ、10日間で約400μg/kgのSTCのレベルが達成された[143]。ヒトの食品や動物飼料とともに、ステリグマトシスティンは、水濡れした壁紙の建材や湿った室内環境のカーペットダストなどの室内環境から検出されることがある[144]。
* *
ステリグマトシスティンは催奇形性、変異原性、発がん性の作用を持つが、AFB1より効力が弱く、ほとんどの動物で肝毒性を引き起こすことができる。STC の発がん性は、投与経路により臓器特異的である。ラットのSTCへの暴露は、経口投与または腹腔内投与で肝細胞癌を、皮膚に塗布すると扁平上皮癌をもたらした[25,140]。
マウスにSTCを短期間投与すると、形質細胞様樹状細胞やTregの数が変化し、免疫機能に影響を及ぼした[145]。STCで汚染された餌(Aspergillus versicolorが産生するSTCを8 mg/kg)を乳牛に与えたところ、STCは血性下痢を誘発し、死亡することも報告されている[140]。STCのヒトへの影響は十分に理解されていない。IARCはSTCをクラス2Bの発がん性物質に位置づけている[144]。
2.8. エルゴットアルカロイド
エルゴアルカロイドは、Clavicipitaceae(NeotyphodiumおよびClavicepsなど)およびTrichocomaceae(PenicilliumおよびAspergillusなど)ファミリーが生産するインドールの誘導体の複雑なファミリーを構成している[146,147]。
四環式エルゴリン環が共通の構造的特徴である。エルゴットアルカロイドは、人間にとって有害であると同時に有益である [147]。エルゴットアルカロイドは、天然および半合成を問わず、いくつかの医薬品に使用されている [146]。
エルゴットアルカロイドの中毒が広まった事例は多く、マサチューセッツ州のセイラム魔女裁判ではエルゴットアルカロイドが原因であると報告されている[147]。1692年、多くの女性ティーンエイジャーが錯乱発作や発作に冒された後、伝統的な医師はその原因を魔女の仕業とした。

しかし、後に記録が評価され、Claviceps purpureaが生産するエルゴットアルカロイドが中毒を引き起こした可能性があることが示された [148]。エルゴットアルカロイドは、いくつかの魔女の告発と裁判にも関与している[147,148,149]。
* *
エルゴ中毒の最初の記録は、アキテーヌ地方で約20,000人が中毒により命を落とした後、西暦944年から945年にかけてフランスで発生し、16世紀にはドイツで多くの発生が記録された。これらの発生過程で、2種類の毒物反応が報告されている。
最初のものは壊疽型とも呼ばれ、通常「聖アンソニーの火」として知られ、フランスでよく発生し、灼熱の痛みを伴うが失血はなく、著しい末梢血管収縮、足、手、四肢の腫れを特徴とした [150]。聖アンソニーの火」という名称は、この病気の患者を治療していた聖アンソニー修道会に由来している。

当時は原因がわからなかったが、修道院での治療や巡礼で病気が治ることが注目された。現在では、この病気はライ麦の摂取によるエルゴットへの曝露が原因であり、巡礼中に食物が変化して曝露しなくなったことが知られている[151,152]。
第二の反応は痙攣型と呼ばれ、ドイツでよく報告された。患者は、激しい下痢、筋肉の痙攣、けいれん、硬直した非常に痛い手足を伴う幻覚やせん妄を呈した[150]。図2に一般的なエルゴットアルカロイドを示す [1,9,151,153]。
図2 エルゴットアルカロイドの化学構造(出典[1,9,151,153]より転載・翻案)
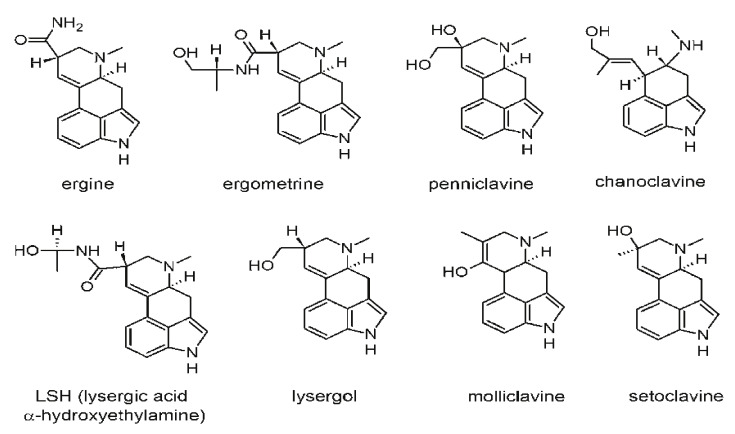
穀物洗浄の近代的な技術により,エルゴ中毒はヒトの病気としてはほとんど消滅したが,鶏,豚,牛,羊など多くの動物にとって依然として脅威である [153]。家畜がエルゴットアルカロイドに暴露されると、四肢壊疽、無月経、運動失調、流産、痙攣を起こす[152,153]。
生物原性アミンと四環式エルゴリン環の構造の類似性から、エルゴットアルカロイドはα-アドレナリン作動性、セロトニン作動性、ドーパミン作動性の受容体に作用する特性を持つ。下垂体D2ドーパミン受容体の活性化を通じて、エルゴットアルカロイドは蹄、尾、耳の欠損とともに血管収縮を引き起こすことがある[153]。エルゴ中毒の壊疽型と痙攣型はいずれも、エルゴットアルカロイドが血管収縮を引き起こす能力に起因するものである [153]。
2.9. ゼアラレノン
ゼアラレノン(ZEA)は、6-(10-hydroxy-6-oxo-trans-l-undecenyl)-β-resorcyclic acid lactone とも呼ばれ、以前は F-2 toxin とも呼ばれ、Fusarium crookwellense, Fusarium cerealis, Fusarium semitectum, Fusarium equiseti, Fusarium graminearum および Fusarium culmorum など、世界中の穀物で汚染が知られている種類のフザリウムにより生成されている [154, 155] 。
トウモロコシは最も汚染された穀物であるが、このマイコトキシンは大豆、米、ライ麦、ソルガム、オート麦、大麦、小麦製品からも見つかっている[156]。構造的にゼアラレノンは17β-エストラジオールに類似しており、エストロゲン受容体と競合的に結合することから、モルモット、ウサギ、ハムスター、ラット、マウス、家畜において生殖管に変化が見られ、生殖機能に障害をもたらすとされている [16,26,156]。ヒトにおいても、ゼアラレノンは低エストロゲン症候群と関連している[156]。

ZEA は収穫前に生成されることが多く、農産物が劣悪な環境で保管されると合成が継続される[155]。ZEA-エストロゲン受容体複合体は核に移動し、ステロイドの反応要素に結合し、多くの遺伝子転写を制御している[154]。ゼアラレノンまたはその代謝化合物は、生合成経路の酵素の発現に関与するプレグナンX受容体を含む転写因子と結合することが知られている[154]。
* *
マウス,モルモット,ラットでは,経口投与では急性毒性は低いが,腹腔内投与では毒性が強くなることが知られている.マウスでは子宮筋腫、下垂体腺腫、肝細胞がん、肝障害、ラットでは慢性進行性血毒、精巣萎縮、白内障、網膜症、腎症などを引き起こす可能性がある[156]。
ゼアラレノンは DNA 付加体を形成し,マウス腹腔内投与では肝臓と腎臓に DNA 付加体が形成されることが,in vitro の研究で明らかになった.家畜の中でも豚はゼアラレノンに対して最も感受性が高く、ZEA曝露による臨床的影響としては、死産、受胎率低下、黄体形成の持続、発情間隔の延長、卵巣萎縮などがある[154]。雄ブタでは、ゼアラレノンは雌性化を誘導し、精子形成の減少、精巣重量の減少、性欲の減少、テストステロンレベルの減少をもたらす [156] 。
* *
子宮内膜組織の検体中の ZEA 濃度を評価したところ、過形成の女性は腺癌の女性よりも濃度が低く、内膜に変化のない女性にはマイコトキシンが検出されなかったことから、ZEA がヒトでの発癌に関与している可能性が示唆されている[157]。
ZEAの特徴として興味深いのは、他のマイコトキシン毒性に対する拮抗作用である。OTAとZEAを併用投与したラットでは、OTAによる腎障害が有意に軽減された[26]。Zearalenone と Deoxynivalenol は同じ菌種によって生産されるため、食品や作物を汚染する可能性がある。
デオキシニバレノールが炎症促進作用を持つのに対し,ゼアラレノンはNF-κB転写因子の活性化を抑制することで抗炎症作用を持つと考えられ,これが拮抗作用の大部分を説明していると思われる[154]。
* *
多くのマイコトキシンは,生産された植物での代謝により,その構造が変化する可能性がある.新たに獲得された物理的・化学的特性のために、試料の分析中にそれらの存在が過小評価されることがある。これらは、マスクド・マイコトキシンと呼ばれる。マスクド・マイコトキシンは、抗体が認識するエピトープの変化、クロマトグラフィーの挙動変化、極性変化による溶媒での抽出障害などにより、存在が過小評価されることがある[158]。α-ゼアラレノール(よりエストロゲン性の高いZEA誘導体)の豊富な存在は、通常推定されず、法律で規制されていないため、その高エストロゲン作用のリスクを過小評価する結果となる [158,159]。
2.10. アルテルナリア毒素(アルテヌエン、テントキシン、テヌアゾン酸、アルタートキシン、オルタナリオールメチルエーテル、オルタナリオール)
Alternariaの種は,土壌,大気,農作物,種子,植物など,いたるところで,またいくつかの生態系で見ることができる[160]。アルテルナリア種はアルテルナリア毒素を生産し、通常保存中に食品を汚染し、テヌアゾン酸(TeA)、アルテトキシン(ATXs)、アルテヌエン(ALT)、テントキシン(TEN)、アルタナリールメチルエーテル(AME)、アルタナリール(AOH)が最も重要な毒素となる [161]。その他のアルテルナリア毒素としては、アルテニュソール(AS)、アルテルセチン(ALS)、ステムフィルトキシン(STE)、アルテイシンまたはアルテルペリレノール(ALTCH)等がある。
毒素を産生するアルテルナリア属の菌には、Alternaria triticina, Alternaria tenuissima, Alternaria solani, Alternaria japonica, Alternaria dauci, Alternaria brassicae, Alternaria alternataなど70種類以上の二次代謝化合物が産生されている [160,162]。
さらに、30種類以上のマイコトキシンが単離され、その化学構造によって様々なクラスに属している[161]。Alternaria 属は、病原性種、内生種、腐生菌種を含み、Alternaria は、人為的環境と自然環境に存在する国際的な真菌である [160]。
Alternaria alternataは、収穫後の果物や野菜に含まれるAlternaria種の中で最も一般的であり、またマイコトキシンを生成する最も重要な種である[162]。ATXがペリレンキノン誘導体のメンバーであるのに対し、ALT、AME、AOHはジベンゾ-α-ピロン誘導体のメンバーである[163]。TeA は植物毒性および抗菌性を持つ四酢酸誘導体のメンバーであり、ヒトの血液障害に加えて、イヌ、ニワトリ、マウスで急性毒性を示す事例がある[164]。
* *
最もよく研究されているアルテルナリア毒素は,TeA,AME,AOHなどである[162]。ほとんどのアルテルナリア毒素は低い急性毒性を示すが,AMEとAOHは,哺乳類と細菌細胞を含むin vitroの毒性研究からの科学的根拠に基づく,遺伝毒性,細胞毒性,発がん性,変異原性作用による毒性がほとんどである.AOHは,ヒトの大腸がん細胞において,AMEよりも遺伝毒性が高いことが示されている[164]。現在、世界的に食品中のアルテルナリア毒素のモニタリングガイドラインや規制値は十分に確立されていない。
EFSAの調査の後、ヒトに対する懸念レベルを評価する目的で、オルタナリア毒素の毒性に関するデータがほとんどないため、毒性学的懸念閾値(TTCアプローチ)がEFSAによって使用されるようになった [162]。
遺伝毒性を持つアルテルナリア毒素(AMEとAOH)については、1日あたり2.5ng/kg体重のTTC値が設定され、非遺伝毒性を持つアルテルナリア毒素(TENとTeA)については、1日あたり1500ng/kg体重のTTC値が設定された;これらの推定暴露は、ヒトに対して懸念を与える可能性がない [162]。
* *
一般的な Alternaria 毒素の化学構造を図 3 に示す [1,7,164,165]。基質組成,pH,aw,温度は,マイコトキシンの生合成,ひいてはアルテルナリア毒素の生合成に影響を与える最も重要な生物・非生物学的パラメータである.特にpHとawは、ほとんどのA. alternata生合成に影響を与える[164]。
赤ワイン、ジュースサンプル、ドライトマトとフレッシュトマト、小麦と小麦製品、ドライフルーツを用いた研究が行われた。ほとんどの研究で注目されているアルテルナリア毒素は、ALT、TeA、TEN、AME、AOHなどである[163]。
アルテルナリア毒素の発生は、イタリア、オランダ、中国、カナダ、アルゼンチン、ドイツを含むいくつかの国で報告されている[1,163,164]。アルテルナリア毒素は、ビール、フルーツジュース、野菜ジュース、ワイン、ピーマン、生鮮・乾燥トマト、小麦粉、ふすま、小麦、ドライフルーツ、穀物製品(例:米、オートフレーク)、ひまわり油、ひまわりの種など多くの食品商品で検出されている [163,165,166]。
図3 一般的なアルテルナリア毒素の化学構造(出典)
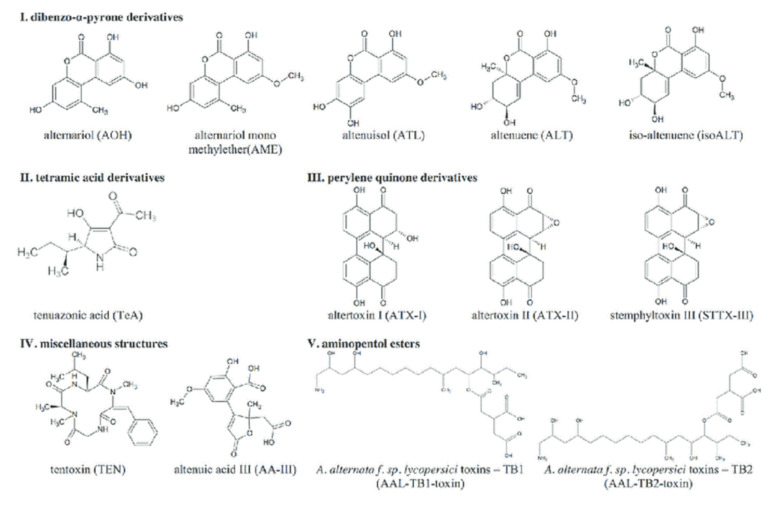
[1,7,164,165] から転載・引用)
アルテルナリアの毒素については、現在もより科学的根拠に基づいた研究が行われている。Alternaria属は世界中に分布する黒カビで,これまでに知られている120種類以上の二次代謝産物のうち,4分の1がマイコトキシンである[167]。アルテルナリア属に属する真菌は、植物だけでなく腐敗した果物や野菜にも広く分布し、低温で増殖するため、冷蔵製品にも影響を与えることが示されている[168]。
アルテルナリア毒素への暴露は、南アフリカと中国の山西省における食道がんと関連していた[168]。アルテルナリアの数種類から少なくとも30の毒性代謝化合物が分離されており、最も重要な代謝物には、ジベンゾピロンの誘導体であるオルタナリオールモノメチルエーテル、オルタナリオール、アルテヌエン、ペリレンの誘導体であるアルテトキシンIII、II、I、テトラミック酸の誘導体のテナゾニックアシッドなどがある [169,170](Alternaria’s Manual of the Alternaria, 2004)。
EFSAは2012年に、アルテルナリアの毒素は公衆衛生に深刻な懸念をもたらすと勧告し、オランダで行われた調査研究は、多くの食品にアルテルナリアの毒素が含まれていると報告している[170]。ドイツで2001年から2010年の間に商業農場から入手された冬に収穫されたばかりの小麦サンプルについて行われた研究では、全てのアルテルナリア・マイコトキシンの中で最も一般的なものはテヌアゾン酸であることが示された[169]。
油糧種子、トマト、野菜は、ほとんどがアルテルナリア種の汚染を受けやすく、アルテルナリア・マイコトキシンは、果汁、オリーブ、リンゴ、小麦にも見出されている[167,170]。動物とヒトの両方において、アルテルナリア・マイコトキシンの暴露は、細胞毒性、発癌性、変異原性、遺伝毒性を有すると報告されている[171]。
2.11. パツリン (PAT)
パツリン(PAT)は、真菌の代謝物で、ポリケチドに分類される有機化合物である。パツリンは、複素環式ラクトン(4-hidroxi-4H-furo [3,2-c]piran-2(6H)-ona) 構造を持ち、分子量は154.12 g/mol、揮発性は低くなる[172,173]。
PAT は,Penicillium expansum (Penicillium leucopus), A. clavatus, Penicillium patulum (Penicillium griseofulvum and Penicillium urticae), Penicillium crustosum など少なくとも60種の真菌によって生産されるが,最も多い生産者は Penicillium expansum である [172]。Penicillium expansumは生成されるパツリンレベルに大きく影響する。
パチュリンは、細胞培養において変異原性、催奇形性、発癌性、免疫毒性、神経毒性などの慢性および急性作用を示した[174]。PATは、動物において神経毒性及び免疫毒性を引き起こすが、ヒトに対する発がん性は信頼できる証拠によって示されていない[172]。
米国、EU及び中国の当局は、フルーツ及びリンゴジュース中のパツリン上限値として50μg/L/kgを設定している[175]。欧州連合は、サイダー、スピリットドリンク、フルーツと再構成されたネクター、およびその他のリンゴ由来の発酵飲料またはリンゴジュースを含む濃縮フルーツジュースの上限値を50μg/kgに設定した。
欧州連合は、成人の直接消費を目的としたリンゴピューレやリンゴコンポートなどの固形リンゴ製品について、25μg/kgの最大許容量を設定した。また、欧州連合は、幼児や児童を対象としたリンゴピューレやリンゴコンポートを含む固形のリンゴ製品およびリンゴジュースの最大レベルを10μg/kgに設定した[176]。
1995年、FAO/WHO合同食品添加物専門家委員会(JECFA)は、パツリンについて1日あたり0.4mg/kg体重の暫定最大耐容1日摂取量(PMTDI)を実施した[172]。パツリンは、世界のいくつかの地域で果物や野菜、特にリンゴとリンゴ製品に見られ、ブドウ、オレンジ、梨などの他の果物やその製品にも散発的に含まれている。パツリンは当初、抗生物質として評価されたが、その後の研究により、出血、潰瘍、嘔吐、吐き気などの人体への毒性があることが明らかになった。米国、中国、欧州連合は、リンゴとリンゴ製品の主要生産国であり続けているため、最も重大なPAT汚染問題を提示している[174]。
2.12. その他の一般的なマイコトキシン
トレモージェニック・マイコトキシンは、痙攣、運動失調、筋肉の震え、混乱を引き起こし、時には死に至ることもあるマイコトキシンの一群である。トレモージェニック・マイコトキシンは、一般に「よろめき症候群」と呼ばれる多くの神経症状を引き起こし、農業・家畜にとっての難題となっている。
トレモージェニック・マイコトキシンは、人間に対しても健康上の懸念をもたらし、発作、震え、精神錯乱、さらには死といった神経症状を示す。臨床症状は、軽度、重度、または生命を脅かす可能性がある [179,180]。

このグループのマイコトキシンには、アスペルギルス・テレウスという真菌が生産するテリレムAとB、ペニシリウム属の真菌種、特にP. crustosumが生産するロックフォーチンCとペニトレムAとEが含まれる[175]。
* *
フサリン類(fusarins A-F)は、ペンタン鎖に2-ピロリドン部分が置換したマイコトキシンの一種である。フザリンは、Fusarium verticillioides (formerly Fusarium moniliforme), Fusarium graminearum (Fusarium venenatum), Fusarium poae, Fusarium sporotrichioides, Fusarium oxysporumなどのFusariumの種によって生産されている [176,181]。
フサリンCは、最も広く研究されているフサリンマイコトキシンの一つであり、食品だけでなく動物飼料にも含まれており、代謝活性化を受けた後は変異原性も有している[181,182,183]。Arthrinium の種が生産するマイコトキシンである 3-ニトロプロピオン酸 (3-NPA) は、コハク酸脱水素酵素 (complex II) を不可逆的に阻害することでミトコンドリアの電子輸送を妨げ、細胞のエネルギー不足を引き起こす [183,184,185]。動物では、3-NPAは末梢神経、脊髄路、海馬および基底核を損傷する[186]。
さらに、3-ニトロプロピオン酸は、1972年から1988年頃に中国13省で発生したとされる「カビ状サトウキビ中毒」と呼ばれる症状に関連していた。これは、貯蔵後2カ月以上経過し、すでにカビが生えているサトウキビを食べたためと考えられている。
症状は、カビが生えたサトウキビを摂取してからおよそ3時間後に急性脳症、その後遅延性ジストニアとして現れ、そのほとんどが若年成人や小児であった。小児では、中毒により不可逆的な全身性ジストニアが発生した。また、急性中毒の後、痙攣、手根骨の痙攣、ジストニア、腹痛、下痢、嘔吐、吐き気などの症状を呈し、昏睡状態に陥り、死に至る場合もあった。
成人の中毒は、ほとんどが消化管の問題で、脳症はまれであった。しかし、このばらつきが、通常子供が消費するサトウキビのレベルが高いことに起因するのか、感受性/脆弱性の違いを反映しているのかは不明である [183,185,186] 。
* *
シクロクロロチンは、Penicillium islandicumが産生する真菌の二次代謝物である。動物では肝毒性を示し、筋芽細胞に対するin vitroの研究では、シクロクロロチンが筋原線維を中断してα-アクチニンの凝集塊とミオシンの島を形成することが示されている [187,188] 。
P. islandicumはまた、ルテオスキリンとして知られる別のマイコトキシンを生成し、これは米に定期的に現れ、マウスの血清トランスアミナーゼの上昇、肝細胞膜の損傷、脂質の過酸化を引き起こすことが示されている [172,189,190]。
また,P. islandicum は rubroskyrin を生成し,ラット肝臓のミトコンドリア呼吸を阻害する [172,189,190] .また,P. islandicumは動物の肝毒素であるrugulosinを生産する[172,189,190]。
* *
Pithomyces chartarum は epidithiopiperazine-2,5-dione 真菌毒素に属する sporidesmin を生産する [173,191]。スポリデスミンは疎水性であるため、細胞膜に容易に取り込まれ、二重層の構造を変化させる [191]。
ヒツジを用いた研究では、スポリジスミンを経口投与すると、多くの臓器の病理学的変化、体重減少、肝毒性、顔の湿疹、光感作を引き起こすことが示された [192]。基本的に、スポリジスミンは牛にも影響を与え、一見無害に見える動物の遺体に高濃度のマイコトキシンを出現させる可能性がある。
スポリジスミンの毒性は累積する傾向があり、個体の脆弱性に基づいて大きく変化する [192]。さらに、スポリデスミンは過酸化水素、ヒドロキシルラジカル、スーパーオキシドラジカルを生成することができる[193]。
3. マイコトキシンの作用機序。
カビ毒の作用機序:重要な側面
カビ毒は,いくつかのメカニズムによって細胞・分子作用を示す.そのような細胞・分子機構の主な種類には、以下のようなものがある。(a) リボソーム結合、(b) タンパク質相互作用、(c) DNA作用、(d) イオノフォア活性、(e) 代謝酵素阻害、(f) ホルモンへの影響、(g) エピジェネティック特性、 (h) RNAポリメラーゼ効果、 (i) 壊死・アポトーシス、 (j) ミトコンドリアの相互作用などである。以下、これらについて簡単に触れる。
- (a) リボソーム結合 トリコテセン毒性は、真核生物のリボソームの60Sサブユニットに結合し、ペプチジルトランスフェラーゼの反応を阻害する能力によって生じる [80]。オクラトキシンAはフェニルアラニン-tRNAリガーゼと競合し、タンパク質の合成を阻害する。アスパルテームとフェニルアラニンはともにOTAと競合することにより、その毒性を低下させる[95,97]。
- (b) タンパク質の相互作用 血漿アルブミンはアフラトキシンと結合する。AFB1がチトクロームP450によって酸化された後、2つのエポキシドが形成され、それらはリジンε-アミノ基と反応してAFB1-アルブミン付加物を形成する[15,194,195]。アフラトキシンは免疫抑制性であり、いくつかの研究において、細胞を介した免疫反応を抑制し、食作用と走化性を損なった。フモニシンB1のほとんどの免疫毒性は、いくつかの科学的実験で示されたように、IL-1β、IFN-γ、およびTNF-αのmRNAおよび/または発現のレベルを変化させる能力の結果であると考えられる[196,197]。ペニトレムは、小脳シナプトソームへのグルタミン酸及びGABA(γ-アミノ酪酸)の取り込みを阻害し、GABA受容体の機能を調節する。パツリンの毒性を発揮する方法の1つは、用量と時間に依存したc-Jun N-terminal kinase、細胞外シグナルを介して制御されるプロテインキナーゼ1および2、およびp38キナーゼのリン酸化増加を引き起こし、細胞死やDNA損傷などの下流効果に寄与することである [197,198]。 口蓋裂」の原因となるセカロン酸Dとして知られるマイコトキシンは、cAMP応答エレメントの結合タンパク質をリン酸化する[198,199]。
- (c) DNAへの影響 核酸とマイコトキシンの相互作用には、可逆的で非共有結合性のものと不可逆的で共有結合性のものの大きく2種類がある[29,200]。DNA と AFB1 の共有結合的かつ不可逆的な相互作用では、N7-グアニン付加物が形成される[29,200]。
- (d) イオントフォア活性 フザリウム属菌が生産するボーベリシンやエニアチンはカリウムに特異的なイオノフォア活性を持ち、ミトコンドリアのマトリックスにカリウムを流入させ、ミトコンドリアを膨潤させる [201]。
- (e) 代謝酵素阻害作用 OTA、シトロビリジン、AFB1 は炭水化物の代謝に影響を与え、ルブラトキシン B とトリコテセン類は脂質の代謝を阻害する [117,125]。フモニシン類の化学構造は、スフィンゴ脂質の骨格であるスフィンガニンおよびスフィンゴシンと高い類似性を有している。その結果、フモニシン類はセラミド合成酵素を競合的に阻害する。フモニシンB1は、アルギニノコハク酸合成酵素を阻害する[125]。
- (f) ホルモンへの影響 ZEAは17β-エストラジオールと構造的に類似しており、エストロゲンの受容体に対するZEAの作用は、ヒトや動物における生殖機能の問題を説明することができる[26,202]。エルゴットアルカロイドの一種であるエルゴバリンは、ドーパミンのアゴニストとして作用することにより、動物のプロラクチン濃度を低下させる[202]。
- (g) エピジェネティックな性質 マイコトキシンの中には、DNAのメチル化レベルを変化させるものがほとんどない [203]。マイコトキシン(ZEA、アフラトキシン、DON)で汚染されたトウモロコシを用いて4週間飼育したマウスでは、卵子のヒストンメチル化およびDNAメチル化が変化した[203]。
- (h) RNA ポリメラーゼの効果 AFB1 は、DNA 依存性のクロマチン結合型 RNA ポリメラーゼに対して阻害作用を持ち、その結果、RNA の合成を阻害する[204,205]。ルテオスキリンやパツリンもRNAポリメラーゼを阻害する[204,205]。
- (i) ネクローシスとアポトーシス ヒトのリンパ球における AFB1 の細胞障害作用には、ネクローシス、カスパーゼ活性化、アポトーシスがあり [206] 、これらはプログラムされた細胞死と不可逆的な細胞障害を引き起こす。ネクローシスによって引き起こされる細胞死は、アポトーシスのシグナル伝達経路をたどらない。
- (j) ミトコンドリアとの相互作用 フモニシン B1 は、ヒト神経芽腫細胞およびラット初代アストロサイトのミトコンドリア複合体 I を妨害し、細胞およびミトコンドリア呼吸の減少、カルシウムシグナルの調節を伴う活性酸素種(ROS)発生の増加をもたらすことが判明した [207,208]。33-NPAは、酵素活性部位に共有結合することで、コハク酸デヒドロゲナーゼを永久的に不活性化する。Acremonium exuviarum由来のAcrebolは、ミトコンドリア複合体IIIを阻害し、結果として呼吸の連鎖を阻害することでATP枯渇を引き起こす[207,209]。
4. カビ毒の予防対策、除染、解毒のアプローチ
Afsah-Hejri, Hajeb, and Ehsani [210]によれば、農産物のマイコトキシン汚染への対処は、世界中の多くの国が直面している重要な課題の一つであり、そのために様々な予防措置がとられている。さらに、これらの研究者は、プレハーベストとポストハーベストの戦術がどのようにマイコトキシンの分解/無毒化を達成することを目的としたかを検討した。
これらの研究者が、オゾンを介してマイコトキシンを分解する物理的、生物的、及び化学的な無害化方法を議論したことを考えると、より広い文脈でそれを見る必要性がある[211]。それにもかかわらず、植物性及び動物性食品中の有害物質は、それぞれの成分とともに、引き続きプレハーベスト及びポストハーベストのプロセスによって影響を受けるであろう [212,213,214,215]。

特に、プレハーベスト戦略は、毒素原性真菌、ひいてはマイコトキシンの発生を回避することを目的としている。しかし、一旦マイコトキシンが生成されると、食品の無毒化はポストハーベストの実践に基づくべきである [216]。以下のサブセクションでは、より広い視野でプレハーベストとポストハーベストの予防策を掘り下げる。
4.1. ハーベスト前予防措置
収穫前予防措置には、適切な灌漑、健康な種子の使用、場合によっては殺菌剤の散布など、適正農業規範(GAP)が関与していることが多い[217]。その他の主要な収穫前対策は、施肥/灌漑の管理、輪作、作物の耐性品種の使用、虫害の回避、越冬の防止、早期収穫、適切な湿度、菌の増殖を抑えマイコトキシンの生成を防ぐための先行収穫の残骸の除去である [218,219] 。収穫前の予防戦略には、好ましい保管方法、適切な環境要因、適正製造基準(GMP)、適正農業規範が含まれる[216]。
適正農業規範には、マイコトキシンの生産を抑制するための遺伝子組み換えの改良、肥料添加の必要性を知るための土壌分析、適切な種床処理、輪作プログラムの実施、雑草の根絶、菌類による感染、虫害を制御するための認可された殺菌剤、除草剤、殺虫剤の使用などがある [220,221]。
* *
完全な曝露回避は不可能と思われるが、ワクチン接種の利用も注目されている。AFM1 の牛乳へのキャリーオーバーを低減する手段として、AFB1 に対する牛のワクチン接種が研究されている [222,223,224,225]。
AFB1 をフロイントアジュバントおよびキャリアタンパク質と結合させた場合、ワクチン接種により抗 AFB1 抗体(典型的には IgG クラス)が得られ、汚染された飼料を食べる動物において長期間にわたって牛乳への AFM1 キャリーオーバーを低減した [222](※1) 。
その後の別の研究では、分娩前の投与がワクチン効果を高めることが示された[225]。弱プロピオン酸、安息香酸、ソルビン酸などの殺菌剤は腐敗を防ぐことができ、同様にレスベラトロール、プロピルパラベン、ブチレートヒドロキシアニソール(BHA)、ブチルヒドロキシトルエン(BHT)などの抗酸化剤の効果によって示されている。
さらに、多くの抗酸化作用が相乗的に作用し、マイコトキシンの生成をさらに防ぐ可能性がある[226,227]。さらに、拮抗菌などの生物学的防除剤の使用は、主食であるブドウ、リンゴ、穀物におけるマイコトキシンの汚染を防止するための重要なプレハーベスト戦略として知られている [228]。
食品加工工場におけるGMPは、HACCP(危害分析重要管理点)と同時作用するようにGAPとともに適用されなければならない[228]。すべての環境要因の中で、湿度と温度は、マイコトキシン生成のためのマイコトキシジェニック真菌種に最も大きな影響を及す。好ましい保管体制に関係するように、保管室/施設の湿気、湿度及び温度は、マイコトキシン生成及びカビの増殖にとって重要な要因である [216]。
4.2. ポストハーベストの予防措置
貯蔵作物は人工生態系の一部であり、化学物質、ガス組成、水の利用可能性、温度などの環境条件の中で相互作用する穀物、害虫、げっ歯類、汚染カビを包み込んでいる [229]。シナモンオイル、クローブオイル、ベイオイルを含むエッセンシャルオイルの使用は、いくつかのマイコトキシンの生産を防ぐことが示されている[226]。
珪藻土、オゾン、ホスフィンなどの殺菌戦略は、害虫駆除のための追加戦術であり、改良大気貯蔵は、貯蔵穀物における昆虫とカビの成長を制御するのに有効であることが示されている [227]。いくつかの種類の農産物に含まれるマイコトキシンの解毒と汚染除去は、世界的に実用的かつ科学的な問題である。
ポストハーベストでは、虫害の防止、加工、輸送、適切な保管、収穫直後の乾燥、適切な取り扱いが不可欠です [217,218,226,227] 。マイコトキシンの蓄積を防ぐために、水分含量が14%以下の環境で作物を乾燥させることが推奨されている[226,230]。
低温プラズマ、放射線処理、保温などの自然的方法と、生物学的薬剤を用いた生物学的方法、吸収、アルコール分解、加水分解、還元、酸化などの化学的方法で、マイコトキシンが除去できることが実証されている[231]。物理的・化学的方法による無害化には多くの限界があり、高価な装置を必要とし、効果がなく時間がかかり、栄養損失が生じる[232,233]。
生物学的方法は、より環境に優しく、より専門的で、より効果的であることが示されている[234,235]。ポストハーベストにおいて、アフラトキシンの無毒化のために化学的、物理的、及び/又は生物学的な方法と技術を用いることは、大きな効果があることが分かっている。
4.2.1. 生物学的戦略
近年、多様な学術的背景を持つ多くの研究者が、マイコトキシンを無毒化するための生物学的薬剤の開発において大きな成果を上げている[236]。飼料や食品中のマイコトキシンを分解するために、真菌や細菌を含む微生物の利用が広く実証されている[237]。
例えば、乳酸菌(LAB)やMicrococcus luteus、Bacillus subtilisなどの細菌種は、最も可能性の高い細菌ペプチドグリカンを介してフモニシンB1およびB2と結合し、BifidobacteriumおよびLactobacillus種などのプロバイオティクスと結合できる [116,238,239]。
Saccharomyces cerevisiae は、Aspergillus parasiticus の芽胞を接種したピーナッツ中の AFB1 のレベルを減少させ、AFB1 との結合に最も有効な新興微生物の 1 つである。
これは、マイコトキシンが酵母の細胞壁に付着するか、マイコトキシンが分解されるために起こったと考えられる [225,240] 。生物学的戦略を用いたマイコトキシンの分解/解毒は、最終生成物および/または毒性中間体をほとんど生成しないため、マイコトキシン制御の代替アプローチとなる。
発酵は、マイコトキシンの除去や低減に有効であることが示されている。しかし、生物学的制御は、一部の食品や飼料に適用できない場合がある[241]。一部の研究者は、マイコトキシンの生物学的無毒化及びその化学構造を変化させる能力は、より注目される価値があることを示している[211]。
これを達成するために使用される生物のいくつかは、Flavobacterium aurantiacum、Nocardia corynebacterioides、Mycobacterium fluoranthenivorans、Lactobacillus rhamnosus、Saccharomyces cerevisiae、Enterococcus faeciumを含む[211]。さらに説明し、[211]と区別するために、発酵と食の多様化、真菌、細菌、酵母について簡単に触れておく。
発酵と食生活の多様化
食品発酵は食品の品質を高めると同時に、消費者にアピールする特定の望ましい特性を提供する。マイコトキシンを殺菌するための比較的費用対効果の高いアプローチである発酵は、マイコトキシンを除去/低減し、食品成分を強化し、食品をより望ましい製品に変えるのに役立つ。
しかし,発酵生成物の毒性およびその代謝物の性質は,食品安全のために慎重なチェックが必要である [228]。その上,マイコトキシンの除去や削減における発酵の有効性の典型的な例として,パツリンがある[241]。

マイコトキシンへの曝露を予防・制御するための主要な戦略の多くは、食事の多様化、ヒトへの曝露回避を目的としたモニタリング・監視プログラム、毒素の生成制御、化学・生物・物理技術を用いた無毒化などである。マイコトキシンへの曝露による疾病を予防するための戦略は、主に予防的なアプローチである [25]。
さらに、食事の多様化は、マイコトキシンへの曝露を制御するための実行可能なアプローチであり、マイコトキシンに対抗しうる栄養素(または食品成分)の摂取を可能にすることに加えて、慢性曝露の影響を改善する可能性がある [242,243]。他の研究者は、中国のある都市で一定期間にわたって食事の多様性を高めると、アフラトキシンへの曝露の低減と肝臓がんの発生の減少がもたらされることを示した[242]。
菌類
菌類を用いた制御もまた、予防戦略の一つである[217]。Aspergillus nigerやA. flavusの非アフラトキシン生産株を含むいくつかの菌種は、AFB1をアフラトキシコールに変換して無毒化する能力を持っている。
Rhizopus oligosporusという真菌をAFB1生産株と一緒に培養すると、AFB1の合成を阻止したり分解を促進することができた [28,244](※1) 。Sphingopyxis 種の組換え酵素はフモニシンを無毒化でき、これらの組換え酵素はフモニシン B1 を HFB1 に加水分解し、後者はその後脱アミノ化される [116]。A. parasiticusとA. flavusの無毒性菌株をピーナッツ、ピスタチオ、綿花、トウモロコシに適用したところ、アフラトキシン汚染の低減に顕著な成功が見られた [221, 228]。
アフラトキシンを生産することができる菌類は、アフラトキシンを分解することもできる。これは、飢餓状態において、菌類は分解する能力を持ち、場合によっては分解産物をエネルギー源として利用するために変換することができるためである。
ペニシリウム、クロノスタキス、トリコデルマ、リゾプス、アスペルギルス種などの一部の真菌は、マイコトキシンを有能かつ効果的に無毒化することができる[221]。アフリカの東部と西部では、非毒性微生物株を用いたトウモロコシのアフラトキシンの生物学的制御は、競合に依存することが判明した。さらに、A. parasiticus と A. flavus の非毒性植菌が作物周辺の土壌に適量入り込み、毒性株と競合する可能性がある [228]。
細菌
Mycobacterium fluoranthenivorans、Nocardia asteroides、Rhodococcus erythropolisなど、土壌中の一部の細菌にもアフラトキシンを分解する能力がある [28,116,238]。一部の細菌種は、食品や飲料に含まれるマイコトキシンと結合することができる。
Flavobacterium aurantiacum B-169 は、アフラトキシンの分解の可能性について試験した1000以上の細菌の中で、溶液からアフラトキシンを不可逆的に除去する能力を持つ唯一の細菌である。Enterococcus faeciumを用いたAFB1の無毒化は、細菌の細胞壁要素に結合することで実現できる。
細菌の細胞壁の多糖類やペプチドグリカンは、微生物の助けを借りてマイコトキシンの結合を引き起こすことが報告されている[245]。さらに,研究の進展と努力の結果,細菌によるDONの無害化も進化した.いくつかのDevosia種で達成されたDONのC3炭素への好気的分配と酸化は、DONの汚染レベルを低下させることを目的とした解決策を提供している[236]。

水溶液では、Lactobacillus reuteriとLactobacillus casei(乳酸菌)がアフラトキシンとの結合に有効であることが示されている。他のin vitro試験では、Lactobacillus rhamnosusとLactobacillus amylovorusが最大60%の効率でAFB1と結合したと報告されており、食品中の汚染物質と結合する能力を有していることがわかる。さらに、Lactobacillus fermentumを用いた全粒ソルガム発酵では、T-2が84%、FB1が98%減少することが報告されている[246]。
* *
酵母 酵母は抗菌特性を持つ化合物を生産し、動物やヒトに有益であることから、競合する酵母の利用は大きな関心を集めている。さらに、いくつかの細菌の拮抗菌や糸状菌とは異なり、酵母は二次代謝産物やアレルゲンを生成しない[247]。
Saccharomyces cerevisiaeは、DONを著しく分解し、細胞内で放出された乳酸脱水素酵素(LDH)のレベル(DONによって刺激された)を低下させるであろう[248]。また、S. cerevisiae の細胞壁を添加することにより、鶏肉飼料中の低い OTA と AFB1 濃度を減少させることができる[249]。
S. cerevisiaeを用いたパツリン低減は、発酵時間と温度を上げると効果的である可能性がある。また、酵母は物理的な吸着によりパツリンを除去することができる。さらに、パツリンは酵母細胞壁のN-H/O-N多糖類およびタンパク質結合と同様に相互作用することができた[241]。また、Kluyveromyces marxianus は OTA、ZEA、AFB1 と結合することが報告されている。
一般に、C. utilis や Yarrowia lipolytica などの酵母を含む細胞膜に結合できるマイコトキシンは、培養中の OTA 濃度を初期レベルの 50%まで低下させると考えられる [250]。
4.2.2. 物理的戦略
物理的加工は、様々な目的のために食品に適用されてきた[251]。選別、患部の除去、等級分け、剥離、マイクロ波加熱、押出、照射、焙煎、煮沸、粉砕、分別、洗浄、乾燥はマイコトキシンの除染によく使われる物理処理である [228,252,253]。ここでは、保管条件、放射線(照射)、マイコトキシン結合剤の使用、保管・洗浄、低温プラズマなどの処理について簡単に触れている。
保管条件
保管条件は、菌類全体の増殖や活性に影響を与えるため、マイコトキシン対策に大きな役割を果たす。高湿度と温度は、真菌の増殖とマイコトキシンの生成を促進する2つの主要な保管要因である。適切な空気湿度、換気、温度管理、包装方法など、管理された保管条件は、真菌の増殖とマイコトキシンの蓄積を抑える[254]。発展途上国では、不適切な保管方法の結果として、作物の損失の約20~50%が報告されている[255]。
放射線(Irradiation)
何種類かの穀物の貯蔵に、放射線のような天然の無害化剤を適用することは、科学文献によく記載されている。放射線には、電離性または非電離性のものがある[256]。放射線は病原体を除去または減少させるが、食品中のマイコトキシンは部分的にしか除去または減少させることができない。
また、放射線は工業的な規模で適用することも可能である [257]。研究では、安全なレベルの約10kGyの照射で、ZEAに感染したトマト、オレンジ、パイナップルの果汁の毒性レベルを低下させることができることが実証された。しかし、より高い放射線量は果汁の品質に影響を与えるであろう[258]。
また、自然感染したトウモロコシに電子ビームを 50kGy 照射し、OTA と ZEN を分解したところ、それぞれ 67.9% と 71.1% の減少が確認された。さらに、米の加工にガンマ線照射を行うと、6 kGy で 95% 以上の AFB1 減少が達成された[254]。
別の研究では、照射時間の重要性が示され、リンゴジュースに最大5分間照射すると、パチュリンレベルが約83%減少することが示された[166]。食品中のマイコトキシンを減少させる照射の能力にもかかわらず、分子反応を引き起こす可能性が高いため、まだ推奨される方法にはなっていない。基本的に、照射を食品に適用する場合、食品医薬品局(FDA)と国際原子力機関(IAEA)の合同委員会によってすでに承認された実験室での特定の標準作業手順に準拠する必要がある[211]。
マイコトキシン結合剤の使用
マイコトキシンに結合する物質は、その吸収を阻害することができる。これは、マイコトキシンに結合することで、腸から血液への侵入が妨げられるために起こる。吸収性物質の例としては、コレステロール、複合難消化性炭水化物、アルミノケイ酸塩、および活性炭を挙げることができる[259]。

マイコトキシン・バインダーの使用は、アフラトキシン分解のための代替的な物理的手法を提供する[260]。ラクトン環の切断は酵素のターゲットであり、この切断はアフラトキシンの毒性レベルを低下させるだろう[260]。
ある研究では、活性炭が自然感染した牛乳とサイダーから、それぞれアフラトキシンとパツリンを除去できることが示された。マイコトキシンレベルの減少にもかかわらず、この研究は、安全性と品質を確保するためにさらなる研究が必要であることを示唆した[257]。
選別と洗浄
選別と洗浄は、自然除染の第一段階の一つである。選別と洗浄は、劣化した製品の数を増加させるリスクを伴わなければ理想的である[216,252]。腐った果物や低品質の穀物を取り除く選別は、果物/果物製品中のパツリンレベルを約99%減少させ [216]、トウモロコシ精製後の総フモニシンBレベルも26%から69%減少させると報告されている[252]。
選別はまた、感染したトウモロコシの FB を 27 から 93%減少させることが報告されている。アフラトキシン汚染の不均一性を考慮すると、損傷した核を分離することで、その汚染レベルを効果的に低下させることができる。紫外線を用いた選別も、穀物中のアフラトキシンを減少させるために利用できる[257]。
低温プラズマ
低温プラズマは、主に気体または減圧下(大気圧以下)での放電によって生成される低温プラズマ(非熱技術とみなすことができる)を使用する。冷温プラズマは,電力を大幅に削減できることに加え,特に,菌類がマイコトキシンを生成するのを不活性化または防止し,マイコトキシンの構造を分解するというプラスの効果を実証している[261]。プラズマは、生物学的な細胞や分子と反応することができるさまざまな化合物を利用することができる。
このような反応から生じる変化は、不活性化プロセス、特に分子および形態レベルで常に進化し、最終的にマイコトキシンを破壊する可能性がある[261]。冷プラズマの使用は有望な抗菌特性を有しており、食品加工におけるその応用は病原性微生物を除去することを目的としている[256,257,262]。
冷プラズマ(低圧下)はまた、典型的なナッツの表面に見られるアフラトキシンの約50%を無毒化する可能性があることが示された[263]。その他、冷温(大気圧)プラズマは、トウモロコシのFB1とAFB1を10分後に約66%有意に減少させた[262]。
5 秒間のプラズマ処理により、DON、NIV、および AFB1 は約 100%分解された。さらに、低温(大気圧)プラズマに8分間暴露すると、約93%のFU、100%のZEA、90%のトリコテセン、93%のアフラトキシンの減少をもたらした[264]。
その他の加工方法(フライ、焼成、皮むき、乾燥など)
食品の加工方法は、食品の特性や組成に顕著な影響を与える [251,265,266,267,268,269,270,271]。加工技術はマイコトキシン濃度を減少させるが、完全に除去することはできない[255]。
軟化は、菌類が顆粒の表面に集まるため、マイコトキシンの汚染レベルを低下させる可能性がある。一方、皮むきは、トウモロコシのアフラトキシンを減少させるのに役立つ可能性がある[256]。粒の表面でZENとDONが多く発生しても、トウモロコシ粉の汚染は少なくなる可能性がある。
さらに、時間と温度の両方が、最終製品(トウモロコシ)のマイコトキシンのレベルに影響を与える可能性もある。マイコトキシンは熱安定性を持っているが、100℃を超える温度でのいくつかの従来の食品調理法(例えば、フライ、ベーキング、ロースト、調理など)は、いくつかのマイコトキシンのレベルを下げる可能性もある。
押出成形を利用すると、加工温度だけでなく顆粒の水分量もアフラトキシンの減少に50~80%影響する[256]。さらに、150〜200℃の温度はアフラトキシンB1レベルを平均79%減少させ、湿度が高い場合にはさらに効果的である可能性がある[272]。
タンザニアでは、ある研究が農村地域の3つの農業生態学的ゾーンの農民を採用してトウモロコシを調査し、高くした台やマットの上でトウモロコシを乾燥させること、変色した穀物、カビや損傷を受けた穀物を除去するための穀物の選別、および穀物の保管中に合成殺虫剤を使用することがフモニシンおよびアフラトキシン汚染を減らすことになり、これらの行動はマイコトキシン汚染を防ぐための優れたポストハーベスト予防戦略として認識されている [273](Phil.Or.jp) 。
4.2.3. 酵素を用いた無毒化
酵素を用いたマイコトキシンの無毒化は、生物学的処理と化学的処理の両方の特徴を併せ持つ。具体的には、マイコトキシンの酵素による無害化には、高い専門性、専門知識、および性能が必要である。生物に対する毒性がないため、温和な条件で発生すると考えることができる。
さらに,酵素は触媒として,マイコトキシンの非化学量論的比率に関与する役割を担っている[231,256]。注目すべきは、アスペルギルスのある種が、フモニシンを自然に無毒化する酵素を産生することだ。病原性微生物に対するキチナーゼや β-1,3- グルカナーゼのような酵素の働きは、微生物の特性によって異なる可能性がある [228]。
キチナーゼやβ-1,3-グルカナーゼの適用により、真菌の増殖だけでなく、果物の腐敗を遅らせることができる。A. flavus, A. niger, Penicillium simplicissimum, and P. nalgiovense complex growthの阻害は、40%と50%の濃度のキチナーゼと50%の濃度のβ-グルカナーゼの散布によってサラミ表面のサンプルで示されている[228]。
キチナーゼとβ-グルカナーゼは、発酵ソーセージ施設における真菌の腐敗を制御するための安全な代替物である可能性がある。微生物ラッカーゼ酵素、カタラーゼ、オキシダーゼ酵素、過酸化マンガンは、アフラトキシンB1の無毒化に役立つ可能性がある[228]。
4.2.4. 化学的戦略
キトサンの利用
キチンから誘導されるキトサンは、抗酸化、抗がん、その他無毒の特性を有する。キトサンの抗菌特性と生体適合性により、キトサンは幅広い用途を持つ興味深いバイオポリマーとなっている[274]。キトサンは、真菌の増殖とそれによるマイコトキシンの生成を制御する能力があることが示された。

具体的には、キトサンはF. graminearumの成長を抑制し、細胞成長、呼吸、病原性、トリコテセンの生合成に関与していた主要遺伝子の転写をダウンレギュレートした。キトサンはまた、菌類の拡散とマイコトキシンの蓄積を減少させ、無毒のキトサンが強力な分子として機能し、従来の殺菌剤に取って代わる可能性を示した [274]。別の研究では、約1%のキトサンと1%のレモン精油を適用することで、マイコトキシンの程度を減少させる効果があることを証明した[275]。
Solís-Cruz ら [276] は、家禽の 3 つの消化器コンパートメントをシミュレートした in vitro 消化器モデルを使用して、アフラトキシン B1、フモニシン B1、オクラトキシン、トリコテセン(T-2)、DON、およびゼラレノンに対するキトサンの吸着容量を 3 つのセルロース性ポリマーと比較して評価した。これらの研究者は、使用した3つのセルロース系ポリマーと比較して、キトサンの吸着能はすべてのマイコトキシンに対してはるかに低い結合活性を得ることを示した。
* *
Abbasi Pirouz ら [277] は、キトサンを用いてパームカーネルケーキ(PKC)中のマイコトキシンの除去を最適化した。具体的には、アフラトキシン(AFB1、AFB2、AFG1、AFG2)、オクラトキシンA(OTA)、ゼアラレノン、フモニシン(FB1、FB2)、トリコテセン類のDON、HT-2、T-2トキシンなどのカビ毒の研究が行われた。
キトサンは最適化された条件下で、AFB1, AFB2, AFG1, AFG2, OTA, ZEA, FB1, FB2に対してそれぞれ 94.35, 45.90, 82.11, 84.29, 90.03, 51.30, 90.53, 90.18% と最大の除去率を達成した。
Zachetti ら [278] は、トウモロコシに存在する 2 種類の主要なフザリウム(F. proliferatum と F. verticillioides)、および小麦の Fusarium head blight を引き起こす主要病原菌である F. graminearum に対して、キトサンと aw を組み合わせた効果をその場増殖とマイコトキシン生産で明らかにし た。
低分子キトサンを介したDONおよびFB産生量の低減は、最低用量(~0.5 mg/g)で70%以上の脱アセチル化が達成された。F. graminearumの生育速度はキトサンの最低用量(~0.5 mg/g)で低下したが、F. verticillioidesおよびF. proliferatumの生育速度はキトサンの最高用量(~2 mg/g)で低下した。
オゾン(O3)
多くのマイコトキシンの分解におけるオゾン利用が報告されている[279,280,281]。オゾン処理は、多くの産業で一般的なプロセスであり、毒性残留物を残さない[282,283]。適用されたオゾンの総量は、O3ガス濃度に暴露時間を掛け、その積をオゾン処理されたサンプルの体積で割ることで求めることができる[284]。
オゾンは、野菜、果物、穀物の殺菌や、マイコトキシンの解毒に適用することができる[281,285]。オゾンガスは、アフラトキシン、特にC8-C9二重結合を持つ構造のアフラトキシンB1およびG1を分解することが示された[286]。
マイコトキシンの構造の違いは、オゾンに対する反応がどのように異なるかを説明する。例えば、アフラトキシンは、フラン環内の高毒性部位を構成しており、それはオゾンが一次オゾニドの生成を通じて破壊しようとするものである[287,288]。
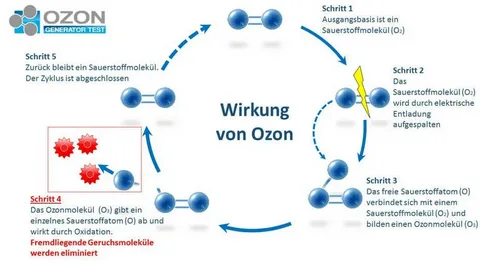
いくつかのマイコトキシンの解毒機構はまだ不明である。にもかかわらず、酸化剤は、マイコトキシン分子内の官能基と反応することができるだろう。その結果、その分子構造を変化させることができ、二重結合が少なく、分子量が大きく、毒性の低い生成物を形成することができる[289]。
* *
オゾンガスの抗真菌性のメカニズムは、真菌の膜に与えるダメージによって説明される[290]。膜の構造は真菌種によって異なる.このため、ある種の真菌は、オゾン処理に対して他の種よりも特異的に耐性を持つ。一方では、水性オゾンは真菌の成長を制御することができ、他方では、ガス状O3はマイコトキシンレベルを減少させるために、より有効である[291,292]。
高水分(MC = 21.9%)の小麦試料において、Wu ら [293] は、高温(40℃)で高い真菌の不活性化率を達成できることを示し、オゾンが高水分の製品と同様に水中で急速に分解することを考慮し、後者はフリーラジカルに分解する速度を加速することができた [211]。最適な条件下でのオゾン処理(55 g ozone per h、6時間)では、DONが29~32%、DON-3-グルコシド(DONの修飾型)が44%減少することが示された。
オゾン処理された小麦から作られたパスタとセモリナのレオロジーと化学的特性に影響を与えることなく、微生物の著しい減少がデュラム小麦で報告された[280]。他の研究者は、トリコテセン系マイコトキシンを分解するための水性オゾンの使用 [294]、赤ピーマンのアフラトキシンB1の無毒化 [295]、さらに乾燥イチジクからアフラトキシンB1を取り除くためのガス状オゾンおよびオゾン水の使用 [296] のように、マイコトキシンを減らすオゾンの能力を示している。
* *
一言で言えば、上記のすべてのトピックを考慮すると、図4に示され、Afsah-Hejri、Hajeb、Ehsani [211]によって報告されたように、一般的な収穫前および収穫後の戦術によって、マイコトキシン防止/無毒化を達成できること、そしてそれらが良い収穫方法と安全輸送につながることが分かる。
図4 カビ毒の防止・無毒化を達成するために適用できるプレハーベストおよびポストハーベスト戦術の模式図と、適切な収穫方法および安全な輸送との関連
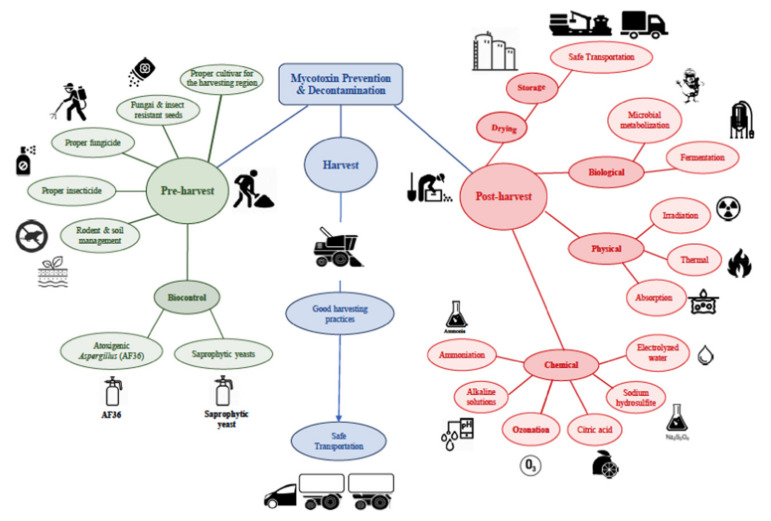
(Repsrinted/Adapted with permission from Afsah-Hejri, Hajeb, & Ehsani [211], 2020, John Wiley & Sons, Inc)
塩基(水酸化物、アンモニア)
アンモニアを用いた種子処理は、フモニシン、アフラトキシン、オクラトキシンなどのいくつかのマイコトキシンを非検出レベル まで減少させることができる一方で、マイコトキシン性菌の増殖を抑制する可能性がある。
水酸化カルシウムとグリセロールの混合液の適用により,マイコトキシンを大幅に無毒化することができた[216]。水酸化カリウムと水酸化ナトリウムは、汚染油中のAFB1分解を達成するために一般的に適用されているにもかかわらず、依然として望ましくない、毒性反応が存在する可能性がある[297]。
Bankole [298] は、エチレンオキシドとギ酸メチルの薫蒸が種子の菌叢といくつかの貯蔵油種子の発芽に及ぼす影響を研究している。この研究者は、エチレンオキサイドとギ酸メチルで種子を燻蒸すると、貯蔵されている落花生とメロンの種子の毒性種を含む真菌の発生率が著しく低下することを実証した。
Kavita と Reddy [299] は、トウモロコシと落花生におけるアフラトキシン B1 の生成、発芽、生存率に対する化学物質の影響について研究した。これらの研究者は、塩化ナトリウム(2.5、5.0、10.0%)、プロピオン酸(1.0、2.5、5.0%)、酢酸(1.0、2.5、5.0%)により、すでにガニーバッグで保管されているA. flavus接種落花生およびトウモロコシのアフラトキシンB1生成を阻害することを示している。また、塩化ナトリウムを除くすべての処理で、種子の発芽と生存率に悪影響を及ぼす可能性があることが明らかになった。
4.2.5. その他の新たな戦略
ナノ粒子(NP)
NP 吸着剤もまた、マイコトキシンを除去するために使用することができる。キトサンでコーティングされた Fe3O4 の NP がパツリンの除染に使用されているように、磁性カーボンナノコンポジットが AFB1 の無害化に使用されている。
さらに、銀のNPは、フザリウムの種とそのマイコトキシンを分解するために使用されている[300]。別の研究では,Lee ら [301] がアップコンバージョン NP(UCNP@TiO2)と呼ばれる新規光触媒ナノ粒子を合成し,DON 分解に使用した.これらの研究者は、90 分後に穀物の製品中の DON が 1 ppm 未満に減少し、120 分間の照明後に DON が完全に分解されることを示した。
UCNP@TiO2の複合材料はグリーンで効率的であり,分解生成物にはほとんど毒性がなかった [301]。さらに、ベントナイト、酸化アルミニウム、活性炭からなるナノコンポジットの混合物から約87%のマイコトキシン除去も報告されている[302]。
植物からの抽出物
いくつかの精油とその生物活性化合物は、抗真菌作用と抗真菌作用のために使用されており、いくつかのマイコトキシン生成を阻害することが示されている[270,303,304]。植物利用は、環境に優しく安全であると考えられているため、化学的処理と比較してマイコトキシンや毒素原性真菌の除去に好まれることが多い。
クローブ油、ウコン油、オイゲノールは、AFB1産生とアスペルギルス種の増殖の両方を抑制することも可能であった。米粒と培地にクローブ全体を適用することで、Penicillium citrinumとAspergillus flavusの成長とそのマイコトキシンを抑制することもできた[305]。
別の研究では、P. nordicum と A. parasiticus の発育と AFG1、OTA、AFB1 産生に対する “Pimentón de la Vera” (スペインのパプリカ燻製)の影響を調査した。ソーセージやフィレなどの肉製品に2〜3%の「ピメントン・デ・ラ・ベラ」を添加すると、オクラトキシンやアフラトキシンの生成だけでなく、発生も抑制できることが示された[306]。

カプサイシンは、Aspergillus carbonariusを介したブドウのOTAの生産を61.5%、Aspergillus Nigriの株を介して28.9-78.1%で阻害することもできる[307]。
その他の新たなグリーン戦略
高圧処理(HPP)、パルス電界(PEF)、および超音波法は、食品中の真菌およびマイコトキシンの制御に役立つ新たなグリーン技術として特定されている [261]。HPPに関しては、マイコトキシンの構造を変化させることができ、その結果、毒性および環境中で増殖する能力の両方を低下させることができる。
温度 45℃、保持時間 20 分でトウモロコシ粒に HPP(圧力 550MPa)を適用した他の研究者は、F. graminearum によるマイコトキシンを大幅に減少させることができることを示した[308]。
その他にも、適度な加熱と組み合わせたHPPは、イチゴピューレ中の2つの耐熱性真菌、Aliivibrio fischeriとTalaromyces macrosporusを不活性化することができた[309]。
* *
PEFは細胞膜の位置を破壊し、内外のバイオフィルムの電位差を利用して膜貫通電圧を形成し、ある閾値に達すると細胞の構造変化が起こり、その後細胞死が起こる[261,310]。PEFは,出力電圧20-65%,パルス幅10-26 ls,pH4-10の条件で,モデル系でアフラトキシンの完全分解を達成することができる[311]。
また、PEF は、可能な限り短時間で、栄養溶液内の F. oxysporum 真菌を殺菌するために、約 99.84% のピーク破壊効果を提供することができ、殺菌効率を達成するためには曝露時間が大きな役割を果たす [312]。
* *
超音波に関しては、低強度(低エネルギー/電力:周波数≧100 kHz、強度1 W/cm2未満)でも高強度(高エネルギー/電力:周波数20~500 kHz、強度≧1 W/cm2)でも、穀物製品を除染することが示されている [261]。
超音波周波数 22-35 kHz、強度 0.3~1.5 W/cm2 は、小麦粒を汚染除去し、それによって真菌含有量を減らし、マイコトキシンの生成を防ぐことが示された[313]。新鮮なイチジクの前処理として、他の処理方法(浸透脱水とK2CO3エマルジョン)を組み合わせた周波数40kHz、出力60Wの超音波処理(30分)は、マイコトキシン性真菌の増殖、ひいてはマイコトキシンの生成を著しく軽減させることができた[314]。
5. 結論と今後の展望
本稿では、動物、食品、ヒト、植物に影響を及ぼすマイコトキシンの種類と毒性、およびそれらの解毒・除去に用いられる戦略について再確認してきた。マイコトキシンの毒性は千差万別であり、動物、食品、ヒト、植物に悪影響を及ぼす可能性がある。
農産物のマイコトキシン汚染への対策は、世界中の多くの国々が直面している重要な課題の1つであり、そのため様々な予防措置がとられてきた。実際、マイコトキシンの汚染除去、制御、および無害化戦略は、プレハーベストおよびポストハーベストの予防対策にまたがるものである。マイコトキシンの汚染除去および無害化のアプローチは、幅広い成果をもたらすことは非常に明白である。
* *
農産物産業に関連するプレハーベストおよびポストハーベストのマイコトキシンの課題を考えると、既存の情報を補完するために、文献の統合やメタ分析から分析/実験的研究まで、さらなる研究を奨励する必要がある。例えば、プレハーベスト・マイコトキシンの影響がポストハーベストの段階で動物および植物製品にどの程度のダメージを与えるかについて、より多くの情報が必要である。
例えば、農産物生産中のマイコトキシン防止策や無害化・除去戦略をどのように最適化できるかを解読するために、さらなる取り組みが必要である。今後の研究では、食品サプライチェーンや動物-食品-人間-植物の生態系全体において、どのような収穫方法や輸送方法がマイコトキシンの毒性をより軽減できるかを評価することができるだろう。全体として、我々は、マイコトキシンの動物-ヒト-食品-植物という側面から、一般公衆衛生に関わる本寄稿が非常に有用であると考えている。
謝辞
著者 K.B., C.O.R.O., M.K. は、Wrocław University of Environmental and Life Sciences, Poland からの財政的支援に感謝する。著者のR.P.F.G.は、ポルトガルのViseu Polytechnic Instituteからの財政的支援に感謝する。
資金提供
本原稿は,2020-2025年度科学技術振興調整費補助金(法第387条第3項に基づく補助金の2%)の交付を受けたものである。高等教育及び科学に関する2018年7月20日の法律第387条(3)、2019年に取得。
利益相反
著者は利益相反を宣言していない。
脚注
出版社からのコメント:MDPIは、出版された地図や機関名における管轄権の主張に関して中立的な立場をとっている。
