コンテンツ
Multifaceted Factors Causing Conflicting Outcomes in Herb-Drug Interactions
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7824553/
オンラインでは2020年12月30日に公開
概要
ハーブと薬物の相互作用(HDI)は,ハーブ製品の併用による代謝酵素やトランスポーターを介した薬物動態(PK)の変化が主要な問題であり,PKの変化が有効性と毒性の交代をもたらす可能性がある。HDIに関する研究は,試験管内試験および生体内試験の前臨床試験や臨床試験で予測されてきた。それにもかかわらず、HDIに関する予測データと臨床的意義との間にはいまだに矛盾があり、HDIに関するさまざまな報告は、生薬や薬物併用療法の使用に関する混乱を解消するどころか、むしろ助長している。ここでは,PKベースのHDIを引き起こす基本的なメカニズムを簡単にレビューし,さらに,投与量や治療期間の影響など,HDI評価の研究デザインや解釈において考慮すべき難しい問題をまとめた。
キーワード:ハーブと薬物の相互作用,薬物動態,用量,治療期間
1. はじめに
漢方薬や栄養補助食品などのハーブ製品の使用が増加しており,ハーブ製品と医薬品との併用も加速している[1]。漢方薬と医薬品の組み合わせでは,漢方薬と医薬品の間で薬理作用が干渉することにより,予期せぬ効果(有効性の喪失や毒性の増大など)が生じることがあり,これを漢方薬-医薬品相互作用(HDI)と定義している[2,3]。すでに多くのHDI事例(セントジョーンズワート、イチョウ、カバなど)が報告されていることから[4,5,6]、HDIはハーブ製品の併用によって引き起こされる薬物動態(PK)の変化と強く関連していることが明らかになっている[2,3,4]。すなわち,生薬による薬物(ワルファリン,インスリン,アスピリン,ジゴキシン,シクロスポリンなど)のPKの変化は,主に代謝酵素やトランスポーターの阻害または誘導を介しており,結果的に薬理作用の変化を引き起こす可能性があるとされている[4,7,8]。加害者であるハーブ製品が薬物のPKに影響を与える代謝酵素やトランスポーターを調節すると、薬物の血漿および/または組織濃度が変化し、その結果、薬理作用や毒性作用に予期せぬ変化が生じることがある[4,9]。
HDコンビネーションにおけるPKベースのHDIを評価するために、様々なアッセイシステム(例えば、試験管内試験、または生体内試験の前臨床試験や臨床試験)が開発されている[3,10,11,12,13]。米国食品医薬品局(FDA)や欧州医薬品庁(EMA)などの規制機関は,HDI研究のガイドラインを提案し,開発中および市販されているPKベースのHDIの評価を推奨している[3,4]。さらに、代謝酵素やトランスポーターを介したHDIの潜在的な作用に関する詳細な情報が求められており、現在、市場承認時にはHDIに関するある程度の知識が得られている[2,5,14]。HDIの背後にあるメカニズムの理解に貢献した科学的知識の蓄積にもかかわらず、ハーブ製品の複雑な性質(例えば、ハーブ製品に含まれる複数の複雑な化学物質)アッセイシステム(例えば、試験管内試験または生体内試験の前臨床試験または臨床例)および試験デザインで考慮される多様な要因(例えば、投与量および治療期間)のため、HDIからの一貫しない予測および/または結果が依然として存在する[3,10,15,16]。さらに、試験デザインを十分に理解せずに、PKベースのHDIを軽率に解釈・判断してしまうと、HDの組み合わせを適切に使用することが難しくなる。
ここでは、HDIに関連する代謝およびトランスポーターを介した経路の概要を紹介し、HDIの予測と結果が相反する原因についてさらに議論する。さらに、HDIの評価システムを設計し、結果を解釈する際の課題や視点についても述べる。
2. HDIの主な原因となる経路 代謝酵素と輸送体を介したHDI
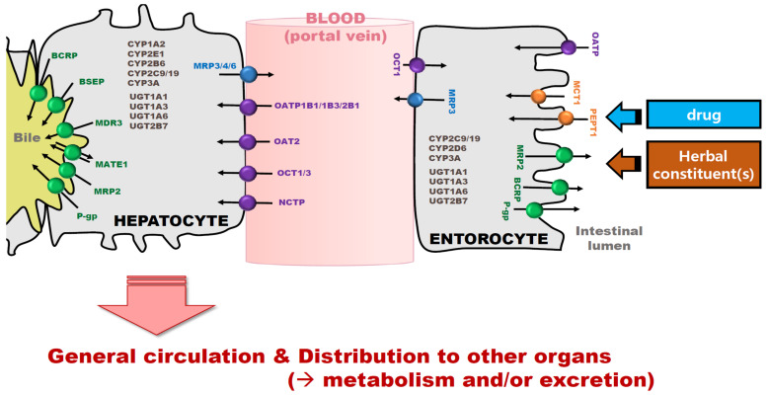
生薬は、体内での吸収・分布・代謝・排泄(ADME)の過程で、医薬品と同じ代謝経路やトランスポーターシステムを利用する(図1)。Tsaiら[4]は,HDI症例の約43%がPKベースの相互作用に関連しており,HDコンビネーションに起因する禁忌症例も発生していると報告している。PKベースの薬物間相互作用(DDI)の評価では、対象となる薬物は、代謝酵素やトランスポーターの基質(被害者側の薬物)または阻害剤や誘導剤(加害者側の薬物)の役割を果たしている[9,17]。DDIにおける併用薬物は,被害者薬物のPKを変化させる可能性があり,被害者薬物と加害者薬物の間のDDIを評価することが推奨されている[9,18,19]。しかし,対象となる生薬は一般的に加害薬物(すなわち阻害剤や誘導剤)と想定されるのに対し,HDIを評価する際には,薬物は代謝酵素やトランスポーターの基質(被害薬物)と考えられることが多い。これは、ほとんどの生薬が多数の化学成分の混合物を含み、時には未知の化合物も含まれていることに由来する[20,21,22]。ハーブ製品に含まれるすべての化学物質の濃度変化を分析してそのPK特性を表すことは容易ではないため、多くのPKベースのHDI評価において、ハーブ製品は主に加害者であると考えられている[1,15,21,22,23]。また、薬物の単独投与による薬理効果はほとんど知られており、生薬を併用することによる薬物の変化を確実に明らかにすることができる。したがって、HDIの評価では通常、HDコンビネーションで使用される薬剤のPKおよびPD(pharmacodynamic)の変化を扱う[3]。
図1 薬物および生薬のトランスポーターおよび代謝酵素を介した体内動態パターン

膜(腸細胞の頂膜、肝細胞の洞膜、腎近位上皮細胞の基底膜など)を介して組織内に入った生薬中の薬物や化学物質は、受動的な拡散やトランスポーターによって制御される。そして、生薬に含まれる薬物や化学物質は、第I相および第II相の代謝酵素による代謝および/またはトランスポーターを介した排泄(例えば、腎排泄または胆汁排泄)によって除去される[24,25,26]。具体的には、重要なPKパラメータであるバイオアベイラビリティーは、腸内取り込みおよび排出トランスポーター、腸内代謝酵素、および肝取り込みによる代謝を含むファーストパス効果の結果として変動する。一方、分布、代謝、排泄の変化は、主にそれぞれの組織における取り込み・排出トランスポーターの調節や代謝酵素の阻害・誘導によって起こる。これらのADME経路は、生薬や医薬品の血漿や組織への曝露の程度を決定し、それによってHDコンビネーションの有効性と毒性を説明する[11,17,27,28]。
PKベースのHDIを引き起こす根本的なメカニズムとして[4,9,29,30]、まず、生薬はトランスポーターや代謝酵素にそれぞれ影響を与える。腸細胞の頂膜に存在する生薬がトランスポーターを阻害すると、トランスポーターを介した薬物の排出が減少し、その結果、薬物の吸収が増加する(例:イチョウ、ミルクシスル)[3,31]。ミルクシスルは、肝臓や腎臓でP-gp阻害剤(P-gp)として作用するハーブ製品であり、薬物の胆汁排泄や腎排泄を変化させ[3,31,32]、その結果、血漿濃度を上昇させて薬物の全身曝露量を増加させることができる[3]。さらに,生薬は代謝酵素を阻害または誘導するため,全身曝露量の変化とともに,併用した薬物の排泄にも影響を与える。特定のトランスポーターや代謝酵素に対するハーブ製品の効果(すなわち,阻害作用と誘導作用)については,賛否両論があることが報告されている[33]。セイヨウオトギリソウ抽出物の慢性的な共同投与は、セイヨウオトギリソウによるCYP 3Aの誘導を介してミダゾラムの血漿濃度を低下させたが、セイヨウオトギリソウ抽出物の単回投与ではCYP 3A4を阻害した[33]。
第二に、ハーブ製品はトランスポーターと代謝酵素に同時に影響を与える。ハーブ製品によって変化したトランスポーターと代謝酵素は、時に相乗効果の可能性を示す[34]。いくつかのハーブ製品(例えば、ニンニク、イチョウ、人参、ブドウジュース)[3,4,31,35]は、P-gp阻害剤とCYP3A阻害剤の両方として機能する。ハーブ製品が腸細胞においてP-gpおよびCYP3Aの両方を阻害することで、経口投与された薬剤の全身曝露量が増加することが報告されている[34]。ミルクアザミは、経口投与されたシクロスポリンAの腸内でのP-gpを介した流出とCYP3Aを介した代謝を阻害し、それによってシクロスポリンAの経口バイオアベイラビリティを向上させた[9,34]。別の例として、ハーブは肝臓のP-gpを阻害し、肝臓から胆汁への薬物流出を減少させる一方で、CYP3A阻害剤として薬物のCYP3Aを介した代謝を減少させ、その結果、肝臓および血漿中の薬物濃度を増加させることができる[35]。ピペリンやカプサイシンなどのフィトケミカルとドキソルビシンを併用すると、ドキソルビシンの胆汁排泄や肝代謝が阻害され、その結果、肝臓や血漿中のドキソルビシン濃度が上昇した[36]。
さらに興味深いことに、生薬は、親薬や代謝物のトランスポーターや代謝酵素を介したPK特性に影響を与える。ロディオラ・ロゼアをロサルタンと併用したところ、CYP2C9とP-gpの阻害により、ロサルタンの血漿中濃度が上昇し、ロサルタンのバイオアベイラビリティが向上した。興味深いことに、ロサルタンの活性代謝物であるEXP-3174の血漿中濃度は、R. roseaのCYP2C9阻害作用によりロサルタンからのEXP-3174の生成が抑制されたにもかかわらず、増加した。これは、R. roseaのCYP2C9を介した代謝に対する阻害作用が、ロサルタンよりもEXP-3174に対して強かったことによると考えられる[37,38]。
腸、肝臓、腎臓がトランスポーターや代謝酵素を発現する主要な臓器として知られていることを考慮すると[17,18]、腸、肝臓、腎臓での生薬による薬物のトランスポーターや代謝酵素を介したPK変化はHDIの評価において主要な焦点となっている。
3. PKベースのHDIの評価と解釈における挑戦的な課題
HDIの評価は、PK相互作用を明らかにすることを目的とした試験管内試験および生体内試験の組み合わせで行われる。これらの研究では、一般的に試験管内試験のスクリーニングに続いて、専用の生体内試験前臨床試験や臨床試験が行われる[15,20]。PKベースのHDIを評価するための方法論は改良されてきており、多数の報告によってHDIが検証されている。しかし、これらのHDI研究の成果は、HDの組み合わせのすべての順列を網羅しているとは限らない。また、生薬の中には、HDIの発生が臨床例で見られるものもある。さらに、文献中のHDIの結果が矛盾しているため、HDIの程度や臨床的意義を予測することは混乱して困難である[15]。そこで我々は、PKベースのHDIを評価・解釈する際の課題を明らかにし、PKベースのHDIを分析するための研究を計画したり、矛盾したHDI評価結果を解釈する際の視点を提案する。HDIの評価結果が多様であることや、HDIの評価結果の解釈が不適切であることの原因として、3つの理由が考えられる。これらの理由は (1) 生薬の複雑な性質、(2) 異なるアッセイシステム(例:試験管内試験および生体内試験)における薬物および/または生薬の曝露の反応、(3) 試験デザインの多様な要因(例:用量、治療期間、投与経路など)[15]。
3.1. 漢方製品の複雑な性質
漢方製品は、単一の抽出物または複数の成分を含む複合抽出物として使用される[39,40]。同じ二名の植物から作られたハーブやハーブエキスに含まれる化学成分は,栽培地域,収穫時期,保存状態,抽出方法などによって異なる可能性がある[41,42,43,44]。これらの理由から,化学組成が類似または同一のハーブエキスやハーブ製剤を調製することは容易ではない。つまり,HDI評価に用いるハーブエキスの品質には研究グループごとに違いがある可能性が高く,同じ二つの植物材料から作られたハーブ製剤を用いてHDI評価を行うと,相反する結果になってしまう可能性がある。生薬製剤の特性に対する混入,誤認,汚染,置換などのその他の変化も起こりうる[40,45]。さらに、ハーブ製品には様々な生理活性化合物が含まれていることから、純粋な活性成分に基づくHDI研究の結果は、ハーブ製品そのもの(すなわちハーブエキス)を調査して得られたHDIの結果と矛盾する可能性がある。例えば,ハーブ製品に含まれる未知の成分は,シトクロムP450(CYP)を調節する可能性があるが,その量やCYPに対する阻害・誘導力を予測することはできない。CYPの調節に対するハーブ製品の総合的な効果のみが検討されている[46]。これらすべての要因が、特にHDコンビネーションで使用されたハーブエキスにおけるHDI観察結果全体の矛盾の原因となっている可能性がある[40,42,47]。したがって、HDIの結果を報告する際には、ハーブ製剤に使用されている植物の二名称や部位、抽出方法、ハーブ製剤の化学組成(例えば、製造ロットが異なる場合の化学的および生物学的反応のフィンガープリント)を提示すべきである[43,44]。
3.2. 異なるアッセイ系への薬物または生薬の曝露による反応
医薬品及び/又は生薬が様々な測定系(例えば、試験管内試験又は生体内試験の前臨床試験及び臨床試験)に曝露されると、一貫性のない反応が生じる可能性がある。薬物相互作用(DDIやHDIなど)の可能性は、主に試験管内試験のアッセイ系(組換えCYP/ウリジン5′-ジホスホ-グルクロン酸転移酵素-グルクロン酸転移酵素(UGTs)ミクロソーム、サイトゾル、S9画分、細胞株、トランスジェニック細胞株、初代または凍結保存された肝細胞など)における代謝の阻害・誘導能力によって評価される[13,48]。試験管内試験のアッセイシステムから得られたデータは,広く行われている生体内試験の前臨床研究,臨床PK,および臨床報告に基づいて,PKに基づく薬物相互作用を引き起こす可能性のあるメカニズムを提供するものである[12,13,15,49]。これらのアッセイシステムは,DDIやHDIなどのほとんどの薬物相互作用試験に適用されている。特に、生薬が代謝経路にのみ影響を与え、この代謝経路が併用薬物の体内動態における主要な特性である場合、試験管内試験代謝研究は、試験管内試験データをヒトに外挿して臨床的なHDIを予測するために重要である[46]。
上述した多くの試験管内試験システムがHDIの予測に効果的に用いられてきたが、試験管内試験アッセイシステムは、PKベースのHDIを引き起こす基本的なメカニズムを説明する上で本質的な欠点を示すことがあり[13,48]、様々な試験管内試験アッセイシステムを用いたHDI評価における挑戦的な問題が懸念される。例えば、代謝的相互作用を評価するために試験管内試験アッセイシステムで広く用いられている肝ミクロソームは、小胞体に局在する酵素のみが含まれており、他の酵素を介した代謝的相互作用は検出できないため、真の生体内試験の状況を表していない[48,50]。生体内のADMEプロセスには、トランスポーターや代謝酵素を介した同時作用が関与しているため、試験管内試験のスクリーニングで1つの代謝酵素やトランスポーターを標的とするだけでは、十分ではなく、また、生体内の現象との関連性もない[9,31,51]。さらに、ジンセノサイドの経口投与は肝CYPに影響を与え、その代謝物は生体内の腸管P-gpにも影響を与える[52,53]。しかし、ジンセノサイドとその代謝物の代謝酵素やトランスポーターを介した相互作用への影響を試験管内試験のアッセイ系で同時に調べることはできない。In vitroのヒトミクロソーム中のCYPに対するジンセノサイドの影響や、In vitroのCaco-2細胞中のリコンビナントCYPとP-gpに対するジンセノサイドの影響がそれぞれ評価されているが[53]、個々のジンセノサイドの生体内試験でのHDI結果に対する定量的な寄与は計算できず、試験管内試験の研究だけでHDIを予測するのは現実的ではないことを意味する。したがって、生薬と薬物の配置を考慮してHDIの結果を評価するためには、生体内試験の前臨床系が必要である(すなわち、生薬による代謝酵素や輸送体の同時調節が薬物の配置に影響する)。生体内試験の前臨床研究は、臨床レベルでのHD組み合わせによる重篤な有害反応の発生を回避するために重要であり、必要とされているが [46] 、特に霊長類とげっ歯類との間の種間変動が原因で、生体内試験の前臨床結果と臨床結果との間に矛盾した結果がいまだに存在している[15] [51,54]。例えば、代謝酵素[55]やP-gp[55,56]腎性有機アニオントランスポーター(OAT)や有機カチオントランスポーター(OCT)[57]などのトランスポーターの種間差が、HDIの矛盾した結果の一因となっている可能性がある[15]。さらに、生体内試験の前臨床試験における投与量や治療期間は、臨床的に推奨される投与法を反映していない場合があり、生体内試験の前臨床試験と臨床データの間の投与法の外挿を考慮する必要がある。
さらに、ハーブエキスに含まれる複数の成分の結果として、異なるアッセイシステム間でHDIの結果が変動する可能性がある[58]。ハーブエキスに含まれる複数の成分は、特定の代謝酵素やトランスポーターと個別に相互作用したり、しなかったりする可能性があり、それが共同投与された薬物のPK変化にも影響を及ぼすことがある。経口投与されたハーブエキスに含まれる未吸収の成分は、共同投与された薬物の肝代謝における生体内試験の相互作用には関与しない[15,59]。しかし,肝細胞や肝ミクロソームを用いた試験管内試験系では,ハーブエキス中のすべての成分,すなわち生体内試験系では吸収されずに肝臓に到達しない成分であっても,薬物と一緒に処理される。したがって、試験管内試験システムと生体内試験システムの間でHDIデータに矛盾が生じる可能性がある。
3.3. 試験デザインの多面的要因(投与経路、投与量、治療期間など
投与経路、投与量、治療期間、プローブ化学物質(基質、阻害剤、誘導剤など)は、HDIが起こるかどうかを決定する重要な因子であり、HDI検査結果に一貫性がない原因となる[15]。したがって、HDI試験の結果を説明する際には、多様な要因を精緻に推定し、考慮する必要がある(図2および表1)。
図2 ハーブと薬物の相互作用(HDI)に影響を与える要因と、薬物動態(PK)の相互作用の潜在的な結果を示す模式図
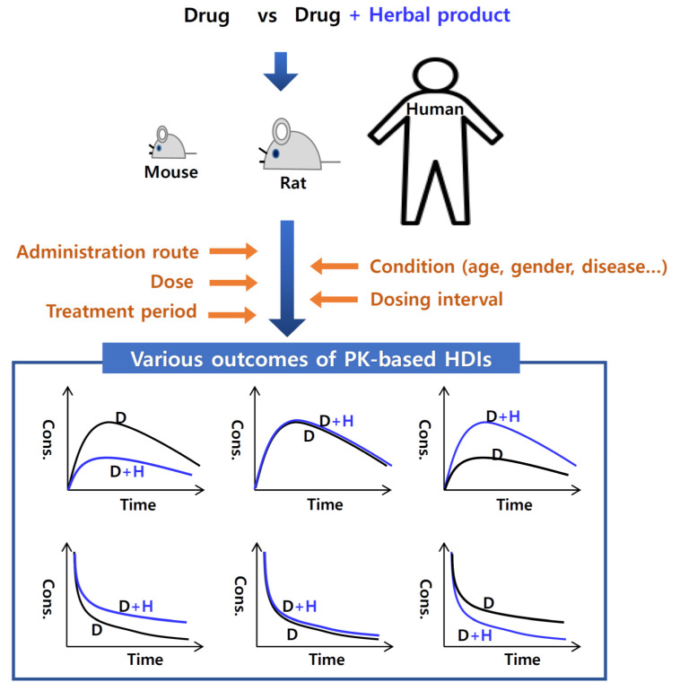
上段の3つのグラフは、ハーブ製品を併用した場合としなかった場合の薬物の経口投与後の血漿濃度-時間曲線を表しており、左は、ハーブ製品を併用した場合に薬物の血漿濃度が低下し、中は、ハーブ製品を併用した場合に薬物の血漿濃度に影響を与えず、右は、ハーブ製品を併用した場合に薬物の血漿濃度が上昇している。また、下の3つのグラフは、ハーブ製品を投与した場合としなかった場合の薬物の静脈内投与後の血漿中濃度-時間曲線であり、左は、ハーブ製品を投与した場合に薬物の血漿中濃度が上昇し、中は、ハーブ製品を投与した場合に薬物の血漿中濃度に影響を与えず、右は、ハーブ製品を投与した場合に薬物の血漿中濃度が低下している。いずれの場合も、ハーブ製品は経口投与される。DとHはそれぞれ医薬品と生薬を示す。
表1 HDI結果に矛盾が生じる要因
| 要因 | ハーブ製品 | HDIの結果 | PK ベースの HDI メカニズム | 参照 |
|---|---|---|---|---|
| 投与経路 | イチョウ葉エキス(経口、経口) | イチョウ葉抽出物は、ラットにニフェジピンを経口投与した場合の PK のみを変化させるが、静脈内投与した場合には変化しない。 | 肝臓ではなく腸での CYP3A の阻害による | [ 61 ] |
| Zingiber オフィシナレルート ジュース (po) | Z. officinaleジュースはシクロスポリンの経口バイオアベイラビリティを低下させるが、静脈内シクロスポリンのPK特性はラットで変化しない | 肝臓ではなく腸での CYP3A と P-gp の阻害による | [ 62 ] | |
| エキナセア プルプレアルート (po) | E. プルプレア根抽出物は、静脈内投与後のミダゾラムの全身クリアランスを減少させたが、ミダゾラムの経口クリアランスはラットで変化しなかった | 腸ではなく肝臓での CYP3A の阻害による | [ 77 ] | |
| 高麗人参の実エキス(po) | 高麗人参の実抽出物は、ニフェジピンまたはシクロスポリンの静脈内投与の PK 特性に影響を与えなかったが、ラットに経口投与した後、両方の薬物の絶対的なバイオアベイラビリティを著しく増加させた | 肝臓ではなく腸での CYP3A の阻害による | [ 77 ] | |
| Schisandra chinensisフルーツ (po) | S. chinensis果実抽出物は、経口投与されたミダゾラムの AUC および Cmax を増加させたが、ラットにおける静脈内投与されたミダゾラムの PK 特性にほとんど変化はなかった | 肝臓ではなく腸のCYP3Aに対する強力な阻害効果による | [ 64 ] | |
| 用量 | アンドログラフィス・パニキュラタ抽出物 (po) | 低用量のアンドログラフィス ヘルバ抽出物はテオフィリンの排出を増加させるが、高用量のサンビロート抽出物はテオフィリンの排出を減少させる | A. パニキュラータ抽出物の低用量処理による CYP1A2 の誘導が、その高用量処理による CYP1A2 の阻害による | [ 72 ] |
| ティノスポラ コーディフォリア水性アルコール抽出物 (po) | ラットにおけるグリベンクラミドのクリアランスとバイオアベイラビリティの増加は、低用量ではなく高用量のT. コーディフォリア水アルコール抽出物であった。 | 低用量ではなく、高用量のT.cordifoliaアクアアルコール抽出物による肝臓の CYP2C9,2D6 および 3A4 の阻害による | [ 73 ] | |
| 治療期間 | S. chinensis果実エキス (po) | S. chinensis果実抽出物の長期治療は、経口投与されたミダゾラムの AUC と Cmax を減少させたが、経口投与されたミダゾラムの AUC と Cmax は、Schisandrae Chinensis Fructus 抽出物の単回治療後に増加した。 | 長期治療での CYP3A の阻害よりも肝臓と腸での CYP3A の誘導が強いため; 単回治療後の肝臓ではなく、腸での CYP3A の阻害が強いため |
[ 72 ] |
| イチョウ葉エキス(po) | 単一の治療イチョウ葉抽出物は血漿中で静脈内投与ジルチアゼム濃度を増加したが、イチョウ葉エキスの長期治療は、血漿中で静脈内投与ジルチアゼム濃度を低減した | イチョウの葉抽出物の単独処理における肝臓のCYP3Aの阻害のため; 長期治療後の肝臓でのCYP3Aの誘導による | [ 68、76 ] | |
| スイカズラエキス (po) | L. japonica抽出物の28 日間の処理は、メトホルミンの耐糖能活性の強化とともに肝臓中のメトホルミン濃度を増加させたが、Lonicera japonica抽出物を1 日および 7 日間処理しても、血漿および肝臓中のメトホルミン濃度および耐糖能は変化しなかったアクティビティ。 | スイカズラ抽出物を 28 日間処理することにより、mate1 を介したメトホルミンの胆汁中排泄が減少したため | [ 29 ] | |
| ドクダミエキス (po) | H. コルダータ抽出物の28 日間の治療は、ラットのグルコース低下効果の強化とともに血漿、肝臓、腎臓中のメトホルミン濃度を増加させたが、Houttuynia cordata の1 日および 7 日間の治療後にメトホルミンの PK および PD に変化はなかったエキス | 腎 oct2 を介したメトホルミンの腎排泄および腎臓におけるメトホルミン濃度の低下による血漿メトホルミン濃度の上昇。メトホルミンの oct1 を介した腎取り込みの増加による耐糖能活性の増強 | [ 30 ] |
まず、ハーブ製品と医薬品の両方の投与経路を考慮する必要がある。臨床例ではほとんどのハーブ製品が経口投与されていることを考えると、特に薬物も経口投与されている場合には、腸管代謝を介した相互作用が重要となる[60]。特に、生薬も医薬品もほとんどの場合経口投与され、腸には豊富な数の代謝酵素やトランスポーターが発現していることから、腸の部位でのHDIも臨床的には重要であり、慎重に検討すべきである[15]。例えば,ラットにおいてイチョウの葉の抽出物を経口投与した場合,ニフェジピンを経口投与した場合にのみPKが変化し,静脈内投与した場合には変化しなかった[61]。Zingiber officinale root juiceの経口投与は、シクロスポリンの経口バイオアベイラビリティを低下させるが、静脈内投与のシクロスポリンのPKは変化しない[62]。この現象は、肝臓と腸の代謝酵素に対するハーブの異なる調節効果によるものと思われる[60,63,64,65]。さらに、Schisandra chinensis果実抽出物は、肝CYP3Aよりも腸CYP3Aに対してより強力な調節作用を有している[64]。
第二に、生薬や医薬品の投与量に応じて、HDIの結果は異なるものとなる[15]。漢方薬は通常、CYPに対して用量依存的な誘導作用[66,67,68]または阻害作用[69,70]を示すが、興味深いことに、CYPに対して二相性の作用を示すこともある。例えば、ハーブ製品の低用量では誘導が起こり、高用量では阻害が起こる[71]。低用量のAndrographis paniculata抽出物で前処理すると、CYP1A2の誘導によりテオフィリンの排泄量が増加し、高用量のA. paniculataではCYP1A2の阻害によりテオフィリンの排泄量が減少することがそれぞれ報告されている[72]。Tinospora cordifolia水性アルコール抽出物とグリベンクラミドを共同投与した場合、低用量(100 mg/kg)ではなく高用量(400 mg/kg)のT. cordifolia水性アルコール抽出物のみが、ラットにおけるCYP 2C9,2D6,3A4を介したクリアランスの減少により、グリベンクラミドの経口バイオアベイラビリティを増加させた[73]。
第三に、治療期間がHDIの発生に影響する可能性がある。ハーブ製品の長期投与は一般的であるため、代謝酵素やトランスポーターに対するハーブ製品の影響は、通常、投与期間に応じて異なって現れる。例えば,S. chinensis果実抽出物の短期投与は阻害作用を示すが,長期投与では肝および腸のCYP3Aに誘導作用を示す[64]。Glycyrrhiza glabra根エキスの単回投与はCYPに影響を与えないが,マウスでは反復投与により肝CYP3Aを誘導し,程度は低いものの2B1および1A2を誘導する[74]。G. bilobaの葉エキスは、通常、ほとんどの併用薬の代謝を阻害する作用を示するが[61,75]、逆に長期の前処理により肝代謝活性を誘導する[68,76]。また、Hanら[29]は、ラットにメトホルミンとLonicera japonica抽出物を単回投与や7日間投与ではなく、28日間同時投与した結果、mate1を介するメトホルミンの胆汁排泄が減少し、肝臓中のメトホルミン濃度が上昇したと報告している。また、28日間の投与でのみ、メトホルミンの耐糖能が向上することも確認された。別の例として、Youら[30]は、メトホルミンとHouttuynia cordata抽出物を28日間共投与したラットにおいて、メトホルミンの血漿中濃度時間曲線下面積(AUC)は、メトホルミンの腎oct2介在性腎排泄の減少により増加し、メトホルミンの腎oct1介在性取り込みの増加により腎臓中のメトホルミン濃度が増加し、グルコース低下作用が増強されたことを報告した。これらの相互作用は、メトホルミンとHouttuynia cordata抽出物の単回および7日間の共投与を受けたラットでは起こらなかった。このように、HDIの評価には適切な処理期間の選択が重要である[15]。
4. 今後の展望と結論
PKベースのHDIを臨床的に評価するための方法は大幅に進歩しているが、HDIの基本的なメカニズムの理解を深めるためには、十分にデザインされた臨床試験が依然として求められている。さらに、それぞれの知見の臨床的な関連性や意味合いを適切に伝えることが重要であり、それによって最終的には、HDの組み合わせを決定する際に、情報に基づいた臨床的な意思決定者を継続的に向上させることができる。さらに、HDIの可能性の評価と臨床的に関連する研究は、HDの組み合わせにおけるリスクを減らし、望ましくない結果を避けるために、継続的に開発・実施されている。HDIの評価方法や解釈を改善するためには、ハーブ製品の複雑な性質、それぞれの試験系(すなわち、試験管内試験または生体内試験の前臨床試験や臨床試験)に存在する異なる固有の特性、試験デザインで考慮される多様な要因を理解することが有用である。
さらに、HDの組み合わせを適切に使用するためには、患者の生理的および病理的な状態(例えば、腸内細菌、基礎疾患、および遺伝的要因)を考慮する必要がある[78,79]。とはいえ、これらの様々な要因を臨床レベルでのHDIの評価に組み込むことは困難である。そこで、HDI研究を生体内試験の前臨床データからヒトに外挿するために、いくつかの試みがなされている。(1)ヒトと全く同じ酵素を発現するようにヒトの遺伝子を導入した遺伝子組み換え動物(ヒト化マウスなど)が登場し、ヒトの状態を忠実に再現していること、(2)試験管内試験や生体内試験の前臨床データを用いて臨床的なHDIのシミュレーションが行われていること、などである。前臨床データからヒトの症例までHDIのシミュレーションが行われていることから、PK-PDモデリングシステムはHDIの結果を予測するための有用なツールとして登場した[80,81]。さらに、薬物と薬物の組み合わせのようなHDの組み合わせにおける相乗効果や拮抗効果の概念を考慮した、HDの組み合わせの最適な投与法が求められている[81,82]。PK-PDモデリングを用いて様々な投与レジメンによるHDIの結果をシミュレーションすることで、適切なHDコンビネーションを選択するための根拠が得られるかもしれない。将来的には、毒性の発生だけでなく、様々な要因による有効性の変化(例えば、相乗効果や拮抗効果)に焦点を当てた広範囲のHDI結果のコンピュータ支援または人工知能ガイドによる予測は、HDI症例の評価と解釈を容易にするのに役立つかもしれない[14,83,84,85]。