コンテンツ
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC7694322/
オンラインでは2020年11月5日に公開
概要
メラトニンは、夜間に松果体や松果体外細胞で産生・分泌されるインドールアミン系ホルモンであり、ヒトの概日リズム(24時間体内時計)の計時や睡眠・覚醒サイクルの調整に重要な役割を果たしている。
しかし、近年、メラトニンが注目されているのは、その強力な親油性抗酸化作用とフリーラジカル消去作用が明らかになったからである。メラトニンは、最も効果的な親油性抗酸化物質であると考えられているビタミンEの2倍の活性を持つことが証明されている。
メラトニンによるメラトニン受容体を介したシグナル伝達は、抗酸化酵素や炎症関連遺伝子の発現を促進する。また、メラトニンは、免疫担当細胞に発現している高親和性受容体を刺激することで、免疫調節作用を発揮する。
ここでは、肥満、心血管疾患、免疫疾患、感染症、がん、神経変性疾患、さらには骨粗鬆症や不妊症など、酸化ストレスや炎症に関連した疾患に対するメラトニン補給の有効性、安全性、副作用について検討した。
キーワード:睡眠覚醒周期の調節、フリーラジカル消去、抗炎症作用、免疫調節、骨量保護、不妊症改善、抗肥満作用、心血管保護、抗腫瘍作用、神経保護
1. はじめに
メラトニンはインドールアミンの一種で、哺乳類では主に夜間に松果体で産生され、視床下部の視交叉上核で調節され、光によって抑制される。しかし,いくつかの研究では,消化管,卵巣,リンパ球,マクロファージ,網膜,皮膚などで,概日周期では制御されない松果体外メラトニンの合成が確認されている[1]。脊椎外のメラトニン生産は、神経内分泌ホルモン反応に重なるパラクラインまたはオートクライン効果を発揮し、主に局所的な抗酸化物質として働くる[1,2]。
メラトニンは、トリプトファンを原料とし、水酸化反応と脱炭酸反応を経てセロトニンに変換される。セロトニンは、アリールアルキルアミン-N-アセチルトランスフェラーゼ(AANAT)とヒドロキシインドール-O-メチルトランスフェラーゼ(HIOMT)の2つの触媒反応によってメラトニンに変換され、中間生成物としてN-アセチルセロトニンが生成される。いくつかの研究では,メラトニン生成酵素であるSNATとASMT,およびSNATの分解を防ぎ,SNATのセロトニンに対する親和性を高めるシャペロンタンパク質14-3-3が存在することから,ミトコンドリアがメラトニンの主要な合成部位であると提唱されている[3](図1)。
図1 メラトニンの生合成と,メラトニン特異的受容体の刺激によって活性化される細胞内シグナル伝達経路。
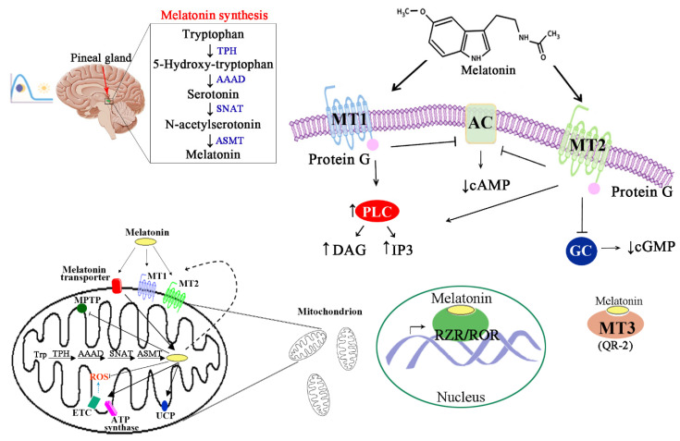
図に示す。(図は、(左上)メラトニン生合成の脳内部位である松果体、メラトニン生合成経路、および光と光周期の変化がメラトニン生合成に及ぼす影響、(左下)ミトコンドリアのメラトニン生合成と局所作用を示している。メラトニンは、ミトコンドリアマトリックス内で合成されるが、特定のトランスポーターを介してミトコンドリア内に入ることもできる。メラトニンは、ミトコンドリア外膜上の特定のMT1およびMT2受容体を、オートクライン的にも活性化し、MPTPおよび活性酸素の産生を抑制し、ETCおよびUCPを刺激する。(図右)メラトニンは、その特定のMT1およびMT2受容体、オーファン核内受容体RZR/RORと相互作用し、さまざまな代謝経路を活性化する。AAADは芳香族L-アミノ酸脱炭酸酵素、ACはアデニル酸シクラーゼ、AFMKはN1-アセチル-N2-ホルミル-S-メトキシキヌラミン(メラトニン代謝物)、ASMTはN-アセチルセロトニンO-メチル基転移酵素。cAMP(環状アデノシン一リン酸)、cGMP(環状グアノシン一リン酸)、DAG(ジアシルグリセロール)、ETC(電子伝達鎖)、GC(グアニル酸シクラーゼ)、IP3(イノシトール三リン酸)。MPTP(ミトコンドリア透過性遷移孔)、MT1-MT3(メラトニン特異的受容体1、2、3)、PLC(ホスホリパーゼC)、QR-2(キノン還元酵素2)、ROS(活性酸素種)、RZR/ROR(レチノイドZ受容体/レチノイド酸受容体関連オーファン受容体)、SNAT(セロトニンN-アセチルトランスフェラーゼ)、TPH(トリプトファン水酸化酵素)、UCP(アンカップリングタンパク質)。
SNAT酵素の不足とトリプトファンの入手困難が、メラトニン合成経路の2つの制限要因となっている。
メラトニンの半減期は20~40分で、分泌されるとすぐに血液や脳脊髄液(CSF)に拡散する。メラトニンには親油性と親水性があるため、細胞膜を介して容易に拡散し、唾液、牛乳、精子、羊水などの他の体液や、メラトニンの一次代謝産物である6-スルファトキシメラトニン(aMT6)として尿中に検出されることもある。体内でのメラトニンの分布は均一ではない。しかし,日中の数pg/mLから夜間の50〜100pg/mLまでのメラトニンの血中濃度の変化は,全身の濃度変化を表していると一般に考えられている[4]。この生理的な濃度範囲は,0.1~0.3 mgのメラトニンを経口投与することで薬理学的に到達する。しかし,生理学的に超えていると考えられる高用量(最大10 mg)についても研究が行われており,毒性作用は報告されていない。さらに、メラトニン製剤の薬物動態特性は様々であり、バイオアベイラビリティに影響を及ぼす可能性がある。
光と光周期の変化は、メラトニン合成の重要な調節因子であり、気温と光周期の季節的変化は、人体のメラトニン生成に大きく影響する[6]。
ここ数十年、概日リズムの指標として、あるいはメラトニンの生理的役割を理解するために、生体液中のメラトニンを測定することへの関心が高まっている。血中のメラトニン濃度の測定は,24時間にわたって複数のサンプルを採取することが困難なために制限されることが多い。そのため,唾液中のメラトニンや尿中のaMT6を測定する非侵襲的な分析技術が開発されている。唾液中のメラトニンは、血漿中のメラトニンに比べて数倍(最大で10倍)低い値を示するが、唾液中のメラトニンを測定することが好ましいとされている。また,メラトニンは濃度が低く,他の類似した内因性化合物と共存しているため,いくつかの制限はあるものの,物理化学的方法(液体クロマトグラフィー(LC),ガス-LC(GLC)-質量分析法,LC-質量分析法など)や免疫学的方法(ラジオイムノアッセイ(RIA),酵素結合免疫吸着法(ELISA)など)など,特異性の高い高感度な方法を確立することが注目されている。特に,血液や唾液中のメラトニンを測定するために最も一般的に使用されているRIAやELISAでは,交差反応や非特異的結合を考慮する必要がある。さらに,体液中のメラトニン濃度が低いことを考えると,LCによるメラトニン濃度の正確な測定には,適切な抽出方法,光や高温,高酸素による酸化からの試料の正しい取り扱いと保存が必要である[4]。
両性具有の分子であるメラトニンは,いったん生成されると,細胞膜を通過して体内のさまざまな部位に到達し,受容体との結合だけでなく,他の分子との直接的な相互作用を通じて,さまざまな生物学的効果や機能を発揮する [6]。
メラトニンは,一般的にGタンパク質と結合している膜関連受容体MT1およびMT2に高い親和性で結合する。MT1またはMT2が活性化されると,アデニル酸シクラーゼ(AC)/環状アデノシン一リン酸(cAMP)/プロテインキナーゼA(PKA)/cAMP応答要素結合タンパク質(CREB)経路が阻害される。それぞれ、グアニル酸シクラーゼ(GC)/環状グアノシン一リン酸(cGMP)/プロテインキナーゼG(PKG)経路、ホスホリパーゼC(PLC)経路が活性化され、イノシトール三リン酸(IP3)と1, 2-ジアシルグリセロール(DAG)が増加する(図1)。また、メラトニンと低親和性で結合するMT3と呼ばれる第3の部位は、細胞質の酵素であるキノンリダクターゼ2(QR2)として特徴づけられている。さらに,メラトニンは,レチノイド関連オーファン受容体(RZRα/ROR, RZRβ/ROR)などの核内受容体と結合する[7](図1)。注目すべきは,ROR受容体が体内時計回路を制御し,概日出力と代謝プロセスの統合に重要な役割を果たしていることである[8]。
MT受容体によって活性化されるシグナル伝達経路は,細胞や組織に大きく依存しており,また,MT受容体とヘテロ二量体複合体を形成するさまざまなタンパク質にも依存している[7]。これらの特徴は、メラトニンの生体内での多様な作用の基礎となっており、主要な代謝プロセスの調節と、さまざまな障害に対する保護の両方の役割を果たしていると考えられる(図2)。
図2 メラトニンの生体内での多様な作用
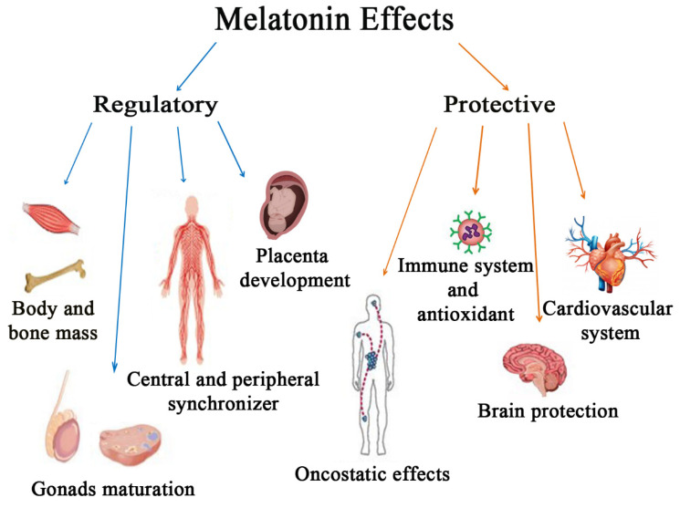
本研究では、睡眠覚醒サイクル、骨代謝、生殖機能の調節におけるメラトニンの役割と、酸化ストレス、異常な免疫活性化や炎症、肥満、心血管障害、がんの発生、神経変性に対する保護作用について検討する。気分障害を改善するメラトニンの能力、身体的パフォーマンスを延長する能力、および骨格筋の脆弱性を制限する能力については、最近徹底的にレビューされているので、ここでは説明しない[9,10]。
2. メラトニンの調節効果
2.1. 睡眠覚醒サイクルの調節
睡眠覚醒リズムは、中枢神経系(CNS)の制御に依存する最も重要な神経生理学的プロセスの1つであり、概日リズムを制御するもの(プロセスC)と睡眠の様々な段階を制御するもの(プロセスS)という、互いに影響し合う2つの基本的な段階によって構成されている。プロセスCは,視床下部前部の視交叉上核(SCN)によって導かれ,急速眼球運動(REM)睡眠,覚醒,その他多くの生理的リズムの概日リズムを制御するペースメーカーであり,覚醒時に増加し,睡眠時に減少するプロセスSと相互に作用する[11]。睡眠覚醒リズムの最も重要な調節因子の一つがメラトニンであり,視床下部や網膜のSCNに存在するMT1およびMT2受容体と相互作用して,睡眠を促進し,覚醒を促す信号を抑制する[12]。メラトニンの分泌は,午前2時から4時の間に最大のピークを迎え,その後,早朝の明るい光にさらされると徐々に減少する。メラトニンの分泌は夜の長さに適応しており、1日の明暗サイクルの調節に関与している。メラトニンの分泌量は、就寝直前の過度の明るさや、ストレスの多い状況、時差ぼけなど、睡眠覚醒サイクルの乱れに影響を受ける。いくつかの研究では、さまざまな電子機器(コンピュータ、スマートフォン、タブレット)のブルーライトがメラトニンの分泌を減少させ、その結果、睡眠時間や睡眠の質も低下させることが示されている[13,14,15,16,17]。20歳の被験者では、夕方にタブレットやスマートフォンを2時間連続使用すると、メラトニンの分泌量が22%減少し、平均年齢に比べて睡眠時間が短く、入眠が困難になる傾向が見られた[18]。
強制的な睡眠不足は、日常生活に悪影響を及ぼし、個人の健康にも影響を与える。睡眠覚醒リズムのずれは、夜勤勤務も含めた交代制勤務でよく見られる。このため、専門家は、日中の疲労を訴え、1日の異なる時間帯に入眠することがより困難になる[19]。現代社会では、シフトワークは労働システムの不可欠な部分となっているが、腫瘍の発生率が高く、睡眠障害だけでなく、心血管障害や胃腸障害など、さまざまな病態と関連していることが示されている[20]。
栄養補助食品の中でも、さまざまな製剤で市販されている合成メラトニンは、米国家庭医学会で不眠症治療の第一選択薬理学的療法とされている[21]。
メラトニンの分泌を改善し、従来の睡眠-覚醒サイクルを維持するためには、夜間労働者は低照度下ではなく明るい条件下で日中に眠るべきであることが示されている。夜勤中の就寝時にメラトニンを投与すると、シフトワーカーの睡眠を改善し、日中の警戒心を高めることができるため、実際の夜勤者が夜間の勤務シフトに適応するための有用な戦略となりうる[22]。
メラトニン分泌の変化は、高齢者に典型的な睡眠効率と継続性の著しい低下と関連している[23]。一部の研究では、老化は実際にはメラトニンの欠乏から生じる症候群であることが示唆されている[24,25]。健康な高齢者では、24時間のメラトニン総生産量は変化しないようであるが、夜間のピーク濃度は低下する[26]。そのため、高齢者にメラトニンを投与することで、睡眠の質、翌日の覚醒度、生活の質が改善される可能性があることが以前に示されている[27]。これに関連して,徐放性メラトニン(サーカディン)が,55歳以上の患者の睡眠の質の低下を特徴とする原発性不眠症の短期治療薬として,欧州医薬品庁から承認されている[28]。
メラトニン分泌の相転移は、時間変更線を越える飛行機の乗客や睡眠相遅延症候群の患者にも起こる。さらに、自閉症スペクトラム障害(ASD)のほとんどの患者では、メラトニンレベルが低いことがわかっている[29]。特に、メラトニン代謝の異常がASDに伴う睡眠障害の原因の1つであることが強調されている[30]。最近,注意欠陥・多動性障害の併存の有無にかかわらず,神経遺伝的障害のあるASDの小児および青年の不眠症治療に対する,小児に適したメラトニン徐放性ミニタブレット(PedPRM)の有効性を評価するため,無作為化プラセボ対照試験(RPCT)が実施された[32]。その結果、PedPRM(2mgまたは5mgを1日1回投与)は、13週間の治療を通じて、総睡眠時間の増加、睡眠潜時の短縮、最長連続睡眠時間の改善を示した。発作への影響は報告されず、傾眠、頭痛、疲労などの軽度の有害事象が記録された。耐性発現の証拠は認められなかった[32]。
いくつかの有望な結果が得られたものの、原発性不眠症および共存性不眠症におけるメラトニンの有効性を評価した文献のデータを最近分析したところ、睡眠潜時および総睡眠時間が統計的に有意に改善したことが明らかになった。しかし、メラトニンの種類、定義、結果の解釈などの測定方法が異なるため、臨床的に意味のある効果についてはまだコンセンサスが得られていない[33]。さらに、研究で使用された用量は0.1~10mgと様々で[21]、短期研究しか行われておらず、16週間の治療を超えたメラトニンの有効性または安全性に関する証拠は提供されていない[34]。
メラトニンの欠乏に伴う概日リズムの乱れと、その結果として生じる睡眠の妨げは、いずれも代謝疾患や心血管疾患、がんのリスク、神経疾患、気分障害と関連している[35]。細胞の代謝と睡眠・覚醒サイクルの制御の関係をより深く理解することは、疾病予防と健康回復のための効果的な戦略を定義するのに役立つだろう[36]。
2.2. 不妊症および生殖におけるメラトニンの役割
抗エストロゲンホルモンとして分類されるメラトニンは、女性と男性の両方の生殖領域に影響を与えることも示されている[37,38]。
メラトニンは、乳腺刺激細胞におけるプロラクチン(PRL)の産生、および性腺刺激細胞における卵胞刺激ホルモン(FSH)と黄体形成ホルモン(LH)の産生を調節する。FSHとLHのレベルが低下することで、思春期に早期に突入するリスクから体を守ることができる[39]。これは,メラトニン受容体の活性化に伴い,cAMP依存性のゴナドトロピン放出ホルモン(GnRH)レベルが低下し,カルシウム流入量が減少することに関連して生じるものである[40]。さらに,メラトニンはp38の活性化を制御し,それが胚の着床に良い影響を与えることから,MT1とMT2は生殖において重要な役割を果たしている[41]。女性では,卵胞細胞でも合成され,排卵や胎盤組織のホメオスタシスに関与している[37]。さらに、メラトニンは、その抗エストロゲン特性の結果として、エストラジオールの産生を阻害することも示されている[42]。
メラトニンは、その抗アポトーシス活性により卵胞細胞死を減少させることで、多嚢胞性卵巣症候群(PCOS)、早発卵巣不全、卵巣炎などの婦人科疾患に好影響を与える[43]。PCOSは、生殖可能な年齢の女性の約20%が罹患する広範な内分泌疾患で、高アンドロゲン血症、肥満、月経不順、無排卵性不妊を特徴とする。メラトニンを6ヵ月間投与したところ,PCOSの女性(n=40)において,アンドロゲンと抗ミュラーリアンホルモンの血清レベルが有意に低下し,FSHレベルが有意に上昇することで,月経周期を回復させることができた[44]。PCOSに罹患した女性ではメラトニンの濃度が高いことがわかっており、これはPCOSで発生する高い活性酸素種(ROS)の量を中和しようとする身体の代償反応であると考えられている[45]。PCOSの女性(n = 56、年齢18〜40歳)にメラトニンを12週間投与した無作為化二重盲検プラセボ対照臨床試験の結果、多毛症およびテストステロンの減少、ならびにマロンジアルデヒドなどの酸化ストレスマーカーの減少が確認された。また,マロンジアルデヒド,高感度C反応性タンパク質(hs-CRP)などの酸化ストレスマーカー,炎症性サイトカインであるインターロイキン-1(IL-1)および腫瘍壊死因子-α(TNF-α)の遺伝子発現が減少し,還元型グルタチオン(GSH)レベルおよび総抗酸化力が上昇したことが報告されている[46]。メラトニンは、黄体化した顆粒膜細胞における誘導性一酸化窒素合成酵素(iNOS)および一酸化窒素(NO)のレベルを著しく低下させ、抗酸化転写因子である核赤血球2関連因子2(Nrf-2)およびその下流の標的であるヘムオキシゲナーゼ-1(HO-1)のmRNAのレベルを増加させる抗炎症および抗酸化作用を介して、卵子の発育能を向上させることが示されている[47]。特に、ミオイノシトールと関連したメラトニンの摂取は、卵子や胚の質、臨床的な妊娠率や着床率を相乗的に改善することが示されている[48,49]。
PCOSの一部の症例では、高インスリン血症を伴うことが観察されている。興味深いことに、メラトニンの投与は、PCOSの女性において、インスリンレベル、インスリン抵抗性指数(HOMA-IR)、コレステロールレベル、ペルオキシソーム増殖因子活性化受容体γ(PPAR-γ)および低密度リポタンパク質受容体(LDLR)の発現に有益な効果を示し、さらに、精神的健康パラメータの改善も観察された[50]。
第II相二重盲検RPCTでは,子宮内膜症の女性(n=40,年齢18~45歳)に8週間のメラトニン投与を行ったところ,日常的な痛み(Δ=-39.8%)と月経困難症(Δ=-38.01%)が有意に軽減され,痛みの軽減とは異なるメカニズムで脳由来神経栄養因子(BDNF)の濃度も低下したことが示された[51]。さらに,生殖年齢の女性から分離した正常および子宮内膜症の子宮内膜上皮細胞を培養した実験的研究(各群n = 6)では,メラトニンがエストラジオールおよびNotchシグナル経路を一度に遮断することで,細胞の増殖,浸潤,移動,および上皮間葉転換マーカーのレベルを低下させることが示された[52]。しかし,高用量のメラトニンは卵胞細胞に対して毒性があり,ゴナドトロピンとPRLの分泌を低下させることで無月経を誘発した[37]。
メラトニンを投与すると、プロスタグランジンやサイトカインの増加が誘導され、その結果、活性酸素レベルが低下する。この活性酸素レベルの上昇は、卵胞の老化が進むことと正の関係がある。その結果、卵母細胞は酸化ストレスから守られる。いくつかの研究では、卵胞前駆体液中のメラトニン濃度が血清中の約3倍であることが示されており[53]、これは妊娠中に起こることと同様である[54]。したがって、妊娠力の低い女性にメラトニンを投与すると、酸化ストレスとエストラジオールの濃度が低下し、どちらも妊娠力の高い女性よりも高くなり、並行して卵子の質と卵胞内の濃度が高まり、結果的に受胎能力と妊娠確率が向上する[55,56,57]。
睡眠-覚醒サイクルが不規則だと、月経の規則性や胚の着床確率に悪影響を及ぼし、結果的に妊娠にも影響を及す[58]。妊娠中はメラトニンの産生量が増加し、胎盤の成長に伴って胎盤メラトニンの量も増加する。しかし、胎児の松果体はメラトニンを産生することができるが、概日作用は母親のメラトニンによって決定され、SCNや松果体の形態的・機能的な発達やその他のリズム体のシステムに重要な役割を果たす[59]。妊婦のメラトニン産生の欠如は、母体の肥満やメタボリックシンドロームのほか、子癇前症、慢性胎盤不全、夜勤などを合併した妊娠でも起こることがわかっている。メラトニンの欠乏は、SCNの発達と概日リズムを乱し、代謝に影響を及ぼすことになる[60]。肥満の母親に概日性メラトニンリズムがないことは、その子孫にも概日性メラトニンリズムがないことと関連している。その代わり、非肥満の母親の子孫は、生後3日目から低いながらも有意な概日性メラトニンリズムを示す[61]。したがって,メラトニンは,母体-胎盤-胎児のインターフェースの重要な調節因子である。このようなデータは、妊娠に関するメラトニンの概日リズムの重要性を示している[62]。
メラトニンは、細胞増殖とエネルギー代謝への影響により、ライディッヒ細胞の内分泌機能とセルトリ細胞のステロイド産生を調節することで、男性の生殖能力も調節する。メラトニンを継続的に投与すると、LHに負のフィードバックを与え、結合型テストステロンの産生を減少させる。一方で、メラトニンの濃度が低すぎると、精巣量の減少を引き起こすことが示されている[63]。
メラトニンを前処理すると、過酸化水素にさらされたヒト精子において、受容体を介した細胞外シグナル調節キナーゼ(ERK)経路の活性化により、抗アポトーシス効果を示した[64]。メラトニンを単独で [65] またはミオイノシトールと組み合わせて [48] 補給することで,男性の精液の質が向上することが示されている。メラトニンを45日間毎日補給すると、尿中および精液中の総抗酸化力が高まり、その結果、精子のDNAに生じる酸化的損傷が減少した[66]。
メラトニンを継続的に投与すると、血管拡張性サイトカインが増加し、勃起不全の細胞反応が改善された[67,68]。in vivoの研究では、メラトニンは、凍結融解により酸化ストレスを受けて壊れやすくなったウサギの精子の運動性、膜の完全性、効力を改善した[69]。さらに,メラトニンは,ミトコンドリア機能不全によって損なわれたヒト精子の侵入能力を回復させることができた[38,70]。
不妊症に対するメラトニンの有効性についてこれまでに報告された知見のほとんどは、動物実験またはサンプル数の少ないヒト研究で得られたものである。したがって、メラトニンの有益な効果は、大規模なプロスペクティブ・ランダム化研究でさらに確認されるべきである。
2.3. メラトニンと骨代謝
夜間のメラトニン生成量の減少は、骨構造の弱体化および骨折のリスクの増加と関連することが示されている。このリスクは通常、ビタミンDとカルシウムによる非薬理学的治療のおかげで軽減される。しかし、前臨床および臨床研究では、メラトニン治療が効果的に骨損失を回復できることが示唆されている[71]。
実験データによると、メラトニンは、マイトジェン活性化プロテインキナーゼキナーゼ1/2(MEK1/2)、ERK1/2、上皮成長因子(EGF)受容体、マトリックスメタロプロテアーゼ(MMP)、クラスリン媒介エンドサイトーシスを含む分子経路を活性化することで、成体間葉系幹細胞(MSC)の分化プロセスに関与している[72]。骨形成は、PPARγの抑制と、MEK/ERK1/2、Runt関連転写因子2(RUNX-2)、オステオカルシン(OCN)、骨形成タンパク質-2(BMP-2)、BMP-4、翼状突起関連統合部位(Wnt)のシグナル伝達経路の活性化を媒介とした骨芽細胞の増殖または分化の増加を含む様々なメカニズムにより、MSCにおいて用量依存的に促進される[73,74,75]。メラトニンは,Wnt/β-カテニン経路を介したヌクレオチド結合ドメインロイシンリッチリピート(NLR)およびピリンドメイン含有受容体3(NLRP3)フラクタソームの活性化を抑制することで,エストロゲン欠乏症に起因する骨粗鬆症および骨形成分化能の低下を改善する[76]。さらに,RANKL(receptor activator of nuclear factor kappa-Β ligand)やオステオプロテジェリンの合成や骨芽細胞からの放出を調節することで,骨芽細胞形成を誘導し,破骨細胞形成を抑制することが示されている[77]。
これらの特徴は、骨移植手術、骨減少症や骨粗鬆症による骨量減少の対策、歯周病の管理などに臨床的に利用されている[78]。高齢の女性は、メラトニンを日常的な薬に加えて栄養補助食品として使用することが有益であり、主薬として使用しないことが報告されている[79]。二重盲検プラセボ対照試験では、45~54歳の女性にメラトニン(3mg、1回あたり)を6ヶ月間毎晩投与したところ、骨細胞のターンオーバーが正常化し、N-telopeptide of Type I Collagenとオステオカルシン(NTX/OC)の比が1:1に向かって経時的に減少する傾向が見られ、身体領域のスコアが改善したが、血管運動、心理社会的、性的なMenopause-Specific Quality of Life-Intervention領域のスコアには影響がなかった。さらに、メラトニンは月経周期を減少させる一方で、プラセボと比較して周期間の日数を有意に増加させた(51.2日対24.1日)[80,81,82,83]。
56~73歳の女性を対象に、メラトニン(1mg、3mg)を1年間毎晩投与した無作為化比較試験では、メラトニンが用量依存的に大腿骨頸部の骨密度(BMD)を増加させることが示された(1mg/日で0.5%、3mg/日で2.3%)。さらに、メラトニン3mg/日投与では、脛骨の海綿体厚が2.2%、脊椎の体積骨密度が3.6%増加したが、他の部位のBMDや骨代謝マーカーには有意な影響はなかった。ただし、24時間尿中カルシウム排泄量は12.2%と有意に減少した[80]。
メラトニンは、マトリックスの分解に関与するMMP-13やa disintegrin and metalloproteinase with thrombospondin motifs 5 (ADAMTS-5)の発現を抑制することで、コラーゲンII、アグリカン、ソックス-9などの細胞外マトリックス(ECM)含量を維持することができる。さらに,メラトニンを投与すると,マイトファジー誘導を介して培養髄核細胞がアポトーシスから保護され,穿刺誘発ラットモデルにおける椎間板変性が改善された[82]。
最近、メラトニンを持続的に放出する複合接着性ハイドロゲルシステム(GelMA-DOPA@MT)が、骨粗鬆症患者のインプラントのゆるみに対処する目的で、骨インプラントの周囲で試験された。メラトニンは、インプラント周囲の骨芽細胞のアポトーシスを減少させ、インプラント周囲の骨量を増加させることができた[83]。
3. メラトニンの保護効果
3.1. 抗酸化および抗炎症剤としてのメラトニン
酸化ストレスは、代謝性疾患、変性疾患、心血管疾患、および癌などの様々な病的状態の共通の特徴である。メラトニンは、ビタミンEよりも強力な抗酸化物質として作用し、細胞内および細胞外の両方で保護的な役割を果たすことが示されている[6]。メラトニンは,代謝中に活性酸素が最も多く生成されるミトコンドリアに豊富に存在し,フリーラジカルによる近隣分子の損傷を効果的に防ぐ。
メラトニンによる活性酸素消去は、直接的および間接的に起こる可能性がある。メラトニンの直接的な作用は、その芳香族インドール環が活性酸素または反応性窒素種(RNS)と反応する緩衝能力に依存している。これらの反応は、カスケード反応メカニズムを介して抗酸化機能を発揮する代謝物の形成につながり、結果的に効果が増幅される [84,85]。例えば,C3でメラトニンがヒドロキシル化されると,ヒドロキシルラジカルを中和する反応によって,環状化合物である環状3-ヒドロキシメラトニン(C3-OHM)が生成される。C3-OHMはその後、尿中に排泄されるため、継続的な消去指標となる [86]。代謝物のN1-アセチル-N2-ホルミル-S-メトキシキヌラミン(AFMK)は,メラトニンによって過酸化水素と一重項酸素が中和された後に生成され,ラジカル種を緩衝し,DNAやタンパク質の損傷,脂質の過酸化を防ぎ,過酸化水素にさらされた細胞の死を軽減することができる。もう一つの代謝物はN1-アセチル-5-メトキシキヌラミン(AMK)で、AFMKのピロリック環が切断されて生成され、in vitroでNOSを用量反応的に阻害して作用する。AFMKとAMKはスカベンジャー活性を示し,生体内の活性酸素暴露の有効なバイオマーカーとなりうるが,AFMKはAMKに比べてスカベンジャー活性が低い[86]。さらに,AMKはNOを消去して安定したニトロソ化生成物を形成し,ミトコンドリアの代謝を調節し,芳香環と相互作用してチロシン残基やトリプトファン残基と付加物を形成し,タンパク質を修飾する2つの代謝物,N1-アセチル-5-メトキシ-3-ニトロキヌラミン(AMNK)と3-アセトアミドメチル-6-メトキシシノリノン(AMMC)は,AMKがRNSを中和する際に形成される[84]。
メラトニンの間接的な抗酸化作用には,メラトニン受容体が関与している。MT1およびMT2受容体の活性化が、内因性の抗酸化酵素の発現および活性を促進することが、in vitroおよびin vivoでのさまざまな研究により明らかになっている。メラトニンはまた、抗酸化酵素を酸化ダメージから保護し、GSHとグルコース-6リン酸デヒドロゲナーゼ(G6PD)の合成を増加させる。G6PDは、ペントースリン酸経路の最初のステップであり、律速段階でもある酵素で、NADPHが生成され、GSHのリサイクルに使用される。
メラトニンはまた、抗酸化酵素をコードする遺伝子のプロモーター領域にある抗酸化応答要素(ARE)に結合するNrf2をエピジェネティックに誘導することで、抗酸化防御力を高めている[87,88]。
メラトニンの有益な効果は,酸化ストレスを伴うさまざまな病態で検証されてきた。In vitroの観察では、低濃度のメラトニン(100 µM)が低密度リポタンパク質(LDL)の酸化を抑制し、アテローム性動脈硬化症の発症を抑制することが示されている[89]。メラトニンの治療効果は、肝硬変症候群の実験モデルでも示されている。Wistar系ラットを用いた研究では、20mg/kgを14日間腹腔内投与したところ、メラトニンによって血管拡張、肺線維症、リポペルオキシド、酸化ストレスが減少し、肺重量/体重比が改善され、PCO2とPO2が変化した[90]。メラトニンの抗酸化作用に関連するその他の潜在的な効果は、アルツハイマー病の実験モデルで示されている(詳細は3.6項参照)。
また、メラトニンの補給は、酸化還元状態の変化に関連する血栓症や溶血性疾患の治療にも有用であると考えられる。スイスのアルビノマウスに50μMのヘミン(ヘモグロビン分解産物)を投与した研究では、メラトニン20mg/kgを3日間投与することで、ヘミンによって誘発される活性酸素と脂質過酸化の量を減少させることができた。また、メラトニンは、GSHのレベルを上げ、循環血小板の数を増やして、鉄が介在するタイプの細胞死である活性酸素によるフェロプトーシスや血小板の活性化を妨いだ。また、炎症性サイトカインであるIL-6、IL-23、TNF-αの量を減少させる一方で、抗炎症性のIL-10の産生を増加させ、ヘミンの効果を逆転させた[91]。
他の多くの研究では、メラトニンは抗炎症分子でもあり[92]、慢性および急性の炎症を抑え[93,94]、炎症性サイトカインおよび抗炎症性サイトカインの発現を調節することで、免疫系の活性化を調整することができることが示されている[95]。
メラトニンは、炎症性サイトカインの発現を活性化する転写因子である核内因子κB(NF-κB)を阻害することで、抗炎症作用を発揮する。メラトニンは,p300ヒストンアセチルトランスフェラーゼ(HAT)活性を阻害することで,p52 NF-κBサブユニットのアセチル化を低下させ,それによってp52の結合を減少させ,リポポリサッカライド(LPS)によって誘導されるiNOSおよびシクロオキシゲナーゼ2(COX-2)の発現を抑制するという仮説が立てられている[96]。最近、in vivoおよびin vitroの解析により、敗血症マウスにおいて、メラトニン投与がサーチュイン1(SIRT1)依存的なNF-κBの脱アセチル化を介してNF-κBの転写活性を阻害することが示された。その結果,NF-κBの阻害は,NLRP3の発現と活性を低下させることで,インフラマソームの活性化を防ぎ,カスパーゼ-1の活性と成熟したIL-1βの産生を抑制することにつながった[97].
また、ザイモサンやカラギーナンで誘発された炎症の実験モデルにおいて、メラトニンは、炎症性サイトカインの標的遺伝子へのNF-κB結合活性の制御に関与するポリ(ADP-リボース)ポリメラーゼ1(PARP-1)の活性化を抑制し[93]、細胞生存率の保護効果をもたらすことが示されている[98]。
さらに、メラトニンは、IL-6、IL-8、COX-2、NOSなどの炎症メディエーターのレベルを低下させることで、慢性炎症性疾患の経過における炎症を抑制し、術後の転帰を著しく改善する。さらに、メラトニンは、ケモカイン、プロスタノイド、ロイコトリエン、接着分子[99,100,101]、CRP[102]など、炎症反応の他のメディエーターの産生を制限する。
原因不明の不妊に悩む若年層および中年層の成人男性を対象に、メラトニン3mgを毎日経口投与したところ、炎症および酸化ストレス関連のマーカーレベルを低下させることができた。実際、ホルモン治療を受けている患者の精巣生検では、COX2、NLRP3、IL-1β、TNFα、およびSOD1とCATの発現レベルが、ホルモン補充を受けていない患者の生検よりも低かった[103]。
最近のメタアナリシスでは、メラトニンの補給は、炎症性バイオマーカー、特に炎症性サイトカインであるTNF-αおよびIL-6を減少させるのに有効であると結論づけられている[104]。全体的に見て、メラトニンが病理学的疾患に関連する炎症および酸化状態に効果をもたらす可能性については、文献に記載されたデータが示唆している。
3.2. メラトニンと肥満
酸化ストレスと慢性炎症状態の組み合わせは、肥満状態を特徴づけることも知られている。肥満は先進国で深刻化している健康問題で、主に座りっぱなしの生活や脂肪分の多い食事などの不健康なライフスタイルが関係している。
肥満の病態生理に関わるメカニズムは複雑である。過剰な肥満は、白色脂肪組織(WAT)の深刻な機能障害を特徴とする状態であり、その内分泌機能の変化も含まれている。肥満と酸化ストレスの関連性は、肥満被験者では正常被験者よりも抗酸化システムのレベルが低いという観察結果から示唆されている[105]。酸化ストレスは、前脂肪細胞から脂肪細胞への分化を促進する。特に、過酸化水素によって引き起こされる酸化ストレスは、脂肪細胞の分化に関与するCCAAT/Enhancer Binding Protein-β (C/EBP-β)やPPARγなどの転写活性化因子を正に制御することで、この分化を決定する[106]。また,肥満は,特に脂肪組織に発現するサイトカインIL-6とTNF-αを介した慢性的な炎症の状態と関連している[107,108]。このような状況において、メラトニンは、その既知の抗酸化特性と代謝調節因子としての作用により、重要な有益な役割を果たしていると考えられる[109]。メラトニンは、すでに述べたように、Nrf2をエピジェネティックに調節することに加えて、NF-κBおよびNLRP3を阻害することで抗炎症作用を発揮することができる[97]。肥満に関連する特性の改善という観点から、松果体ホルモンは、脂肪細胞によるTNF-αおよびIL-6の分泌を減少させ、高密度リポタンパク質(HDL)コレステロールを増加させ、血漿中のトリグリセリド、LDLおよび超低密度リポタンパク質(VLDL)コレステロールのレベルを低下させ、内臓脂肪を減少させることが示されている[109]。最近の研究では、リン酸化ERKの活性化を減少させ、カスパーゼ-3、8、9の活性化を増加させることによって、メラトニンが前脂肪細胞の細胞株のアポトーシス死を誘導する能力が強調されている。メラトニンは,アポトーシス促進タンパク質であるBaxの発現を増加させることに加えて,抗アポトーシスタンパク質であるBcl-2の発現を減少させることも示されている[110]。
肥満による代謝異常の病態生理には、アディポカインの分泌パターンの乱れが重要な役割を果たしており[111]、これは、内臓WATと皮下WATの沈着物間のアディポカイン分泌レベルの違いに関連していると考えられる[112]。アディポカインとは、アディポネクチン、オメンチン-1、レプチン、レジスチンなどのことで、エネルギー生産と消費の調節に関与している。アディポネクチンは、脂質・糖代謝、インスリン感受性、食欲、エネルギー消費の調節に強く関与するホルモンであり、また、抗炎症作用を発揮する[113]。アディポネクチンは、内臓脂肪よりも皮下脂肪で多く産生される[114]。体重とアディポネクチンの間には負の相関関係が見られ、肥満度指数(BMI)とアディポネクチンの間には負の相関関係が見られ、その濃度は肥満患者では減少し、体重減少時には増加する[113]。また、体重過多の患者にメラトニンを補給すると、アディポネクチンの濃度に変化が生じた[115]。メラトニンは、インドールアミンのアディポネクチンシグナル伝達経路への影響、抗酸化・抗炎症作用、ミトコンドリア機能の改善、他のアディポカインレベルの変化など、いくつかの方法でアディポネクチンの分泌に影響を与えていると考えられる[113]。
主に内臓WATで合成されるオメンチン-1は、もう一つのインスリン感作性と抗炎症性のアディポカインで、脂肪細胞におけるインスリン刺激によるグルコース取り込みを改善することがわかっている[116]。オメンチン-1の循環レベルは、肥満で減少し、BMI、インスリン抵抗性およびメタボリックシンドロームと逆相関することが示されている。メラトニンの補給は、低カロリー食を摂取している患者のオメンチン-1の血清レベルを上昇させる。健康な若い女性において、夜間のメラトニン分泌量が多いことは、インスリン抵抗性の有病率が低いことと正の相関があることがわかった[117]。この関係は、メラトニンがアディポネクチンおよびオメンチン-1の分泌に影響を与えることによって、少なくとも部分的には説明できる。
この証拠は、肥満治療および肥満合併症の予防にメラトニンを使用することを強く支持している。さらに、メラトニンの使用は、余分なエネルギーを熱に変えることができる活発な代謝組織である褐色脂肪組織を標的とすることで、肥満を減らすための良いアプローチとなる可能性がある。このため、最近では、メラトニンが褐色脂肪組織の成長と代謝活動を促進する能力を持つことから、ヒトにおける痩身薬として提案されている。
さらに、肥満やメタボリックシンドロームの治療におけるメラトニンの有用性を示す証拠として、メタボリックシンドロームの患者を対象に実施された臨床試験では、2ヶ月間のメラトニン投与(5mg/die)により、脂質異常症、血圧、酸化ストレスに有益な効果が認められた[118]。
肥満の問題は、小児肥満の増加を分析し、子孫の肥満リスクに寄与している可能性のある妊娠中の母親の状態と胎児の子宮内期間に注目することで、効果的に対処できる可能性がある[59]。メラトニンは、このような状況においても重要な役割を果たしている。実際、概日遺伝子ClockとBMAL1(Brain and Muscle ARNT-Like 1)(タンパク質アリル炭化水素受容体核トランスロケーター様タンパク質1(ARNTL)としても知られる)は、メラトニンが概日作用を発揮することによって、ミトコンドリア代謝、昼間のグルコースおよびトリグリセリドレベル、さらには脂質合成、脂肪形成および脂肪組織代謝を調節している[59]。
3.3. メラトニンと心血管疾患
過去20年間で、メラトニンの減少が様々な心血管疾患(CVD)の危険因子であることを示す証拠が増えてきた。夜間のメラトニン濃度が低いと、虚血性心筋障害、高血圧、アテローム性動脈硬化、心不全、薬剤性心筋障害のリスクが高まることが示されている[119,120,121,122]。
メラトニンの投与は,心臓,脳,腎臓,腸,肝臓などの様々な臓器において,虚血/再灌流(I/R)傷害に対して何らかの保護作用を示すが[123],そのメカニズムはまだ十分に解明されていない。単離された心臓または心筋細胞を用いた実験的研究では,メラトニンの前処理または再灌流液への直接添加により,不整脈の発生率が低下することが示された[124]。ラットでは、メラトニンがミトコンドリアの透過性遷移孔の開口部を阻害することで、おそらくカルジオリピンの過酸化を介して、ミトコンドリアのNAD(+)およびシトクロムCの放出を防ぎ、心臓をI/R傷害から保護することが示されている[125]。メラトニンは、SIRT1およびSIRT3のシグナルを活性化することで、I/Rダメージから保護することができる。SIRT1およびSIRT3は、心臓組織に高発現しているが、I/R条件下では著しくダウンレギュレートされるNAD依存性タンパク質脱アセチル化酵素である[126,127]。また、マウスの梗塞心モデルでは、メラトニン投与により、脂肪由来間葉系幹細胞において、FoxO1、p53、NF-κB、Baxなどのアセチル化されたプロアポトーシスタンパク質の発現が減少し、抗アポトーシスタンパク質であるBcl-2の発現が増加した[128]。
メラトニンの低濃度は,高血圧発症の病態生理学的因子を表すことが示されている。肺高血圧症は,肺動脈圧が高いことを特徴とする疾患で,右心室肥大や心不全を引き起こすことが知られている。ラットモデルでは,メラトニンの投与により,右心室の肥大と機能障害が緩和され,間質の線維化と酸化ストレスも減少した[129]。注目すべきは、メラトニンの補給が夜間高血圧、血圧、血小板凝集、循環カテコールアミンを減少させることである[130]。
メラトニンとアンジオテンシン変換酵素阻害剤を投与すると、高血圧、左心室(LV)の肥大と線維化、LVと大動脈の酸化ストレスの増加など、連続光にさらされたラットに起こる病理学的変化を緩和することができた[131]。
急性および慢性心不全(HF)患者では、メラトニンの分泌および循環レベルが低下している[119,132]。新たな研究では、血清メラトニンレベルがHFの有用なマーカーであることが示唆されている。特に、メラトニンの血清レベルは、HFのバイオマーカーとして知られているN-terminal pro-brain natriuretic peptide (NT-pro-BNP)レベルと負の相関を示している[119,133]。
メラトニンの補給は、MAPK経路を調節することにより、アテローム性プラークの数と面積を減少させることが示されており[134]、また、急性心筋梗塞後のミトコンドリア機能障害を回復させ、左心室のリモデリングとアポトーシスを減少させることも示されている[135]。
臨床研究では、メラトニンが心筋梗塞の合併症を軽減し、虚血による心筋損傷や心室肥大を抑制することが示されており、さらに、CVDの外科的および非外科的治療の補助として有益な効果を示している[130]。しかし、ヒトにおけるCVDの治療法としてのメラトニンの有効性に関する強力で明確な証拠はまだ不足しており、無作為化臨床試験ではまだ達成されていない。
3.4. メラトニンの免疫調節作用と抗感染症作用
メラトニンは、感染症、自己免疫、免疫老化などの様々な免疫疾患にも重要な役割を果たしている。注目すべきは、メラトニンの免疫調節機能には季節依存性があることで、メラトニンレベルの季節的変化が、感染症や腫瘍性疾患の発生率の増加に関連する季節依存性の病状に寄与している可能性がある[136]。
メラトニンは、免疫担当細胞に発現したMT2受容体に特異的に作用し、細胞性および体液性の反応、ならびに自然免疫を調節することが示されている[137]。注目すべきは、Tリンパ球、ナチュラルキラー細胞、好酸球、マスト細胞などの免疫細胞がメラトニン受容体を持っているだけでなく、新たな証拠によって、免疫系が外因性メラトニンの1つの供給源であることが明らかになったことである[137]。いくつかの研究によると、このインドールアミンには、さまざまな事象に反応して免疫細胞(マクロファージ、ナチュラルキラー細胞、リンパ球)の分化や移動に影響を与える能力がある。なぜなら、これらの細胞は、メラトニンだけでなく、コルチゾールやケモカインからも影響を受ける概日リズムに従っているからである[138]。メラトニンは,ヒトTヘルパー(Th1)リンパ球を活性化して,IL-2およびIFN-γのin vitro産生を増加させ,末梢血単核細胞(PBMC)によるIL-6産生を増強することができる。さらに,IL-12の産生を増加させることで,ナチュラルキラー細胞(NK)の活性を高める[137]。
さらに、腸内レベルでのトリプトファンとその代謝物は、免疫恒常性と微生物叢全般に有益な作用を及ぼすことが報告されている[137,139]。
メラトニンは、その免疫調節機能とフリーラジカル消去活性および抗炎症特性により、様々な細菌およびウイルス感染症に有効であることも分かっている[140,141]。メラトニンは、院内感染の原因となっている黄色ブドウ球菌、カルバペネム耐性緑膿菌、アシネトバクター・バウマンニに対して、細胞内基質の利用可能性を低下させることで、in vitroの抗菌効果を示した[142]。敗血症、特に敗血症性ショックに対するメラトニンの保護作用に注目した研究もいくつかある [143,144]。
メラトニンはまた、ウイルスによって引き起こされる全身性の炎症を緩和する。メラトニンの有益な効果は、インフルエンザ感染や、ここ数ヶ月で世界を襲ったパンデミックの原因となったSARS-CoV-2ウイルスに対しても仮定されている[145]。実際、すでに述べたように、メラトニンは、老化、心血管疾患、糖尿病に関連する炎症や酸化ストレスを軽減し、コビッド-19病患者の死亡リスクを高める条件をすべて満たする。さらに、メラトニン経路はウイルスと直接相互作用し、インフルエンザやCovid-19感染症にも影響を与えるようである。これらのデータは、ヒトのウイルス誘発性疾患におけるメラトニンの治療効果の可能性を示唆している。この点に関して、メラトニンとビタミンDの組み合わせは、COVID-19感染に対する免疫系および酸化反応を適切に調節・制御できる多くの共通した基礎的メカニズムを持つことを考慮し、相乗効果のある新たな治療法として提案されている[146]。
メラトニンの産生は、感染による炎症性サイトカインの放出によって阻害されるが、これは感染プロセスの制御におけるメラトニンの役割を説明するものと考えられる[147]。さらに、メラトニンの効果の多くは、ミトコンドリアの機能を最適化することで得られる。実際、メラトニンによる概日リズムの調節は、主にBMAL1の誘導によって得られ、その効果は主にミトコンドリアに影響を与える。したがって、ウイルスによるメラトニン経路の阻害は、概日リズム、特にミトコンドリアの代謝に影響を及ぼす可能性がある[147]。メラトニンの補給は、ミトコンドリアの機能を回復させ、サーカディアンリズムを調整するのに有効であると考えられる。
ウイルスが外因性メラトニンとどのように相互作用するかをよりよく理解し、最適な治療用量を決定するためには、今後の研究が必要である。
3.5. メラトニンの抗腫瘍活性
NK細胞やT細胞の減少、TNF-αの増加などを伴う免疫系の異常は、がんに共通して見られる特徴である。このため、従来の放射線療法や化学療法に加えて、治療薬としてのメラトニンに注目が集まっている[148]。いくつかの研究では、矛盾した結果が報告されているものの、メラトニンが腫瘍に対する免疫の開始を媒介することが強調されている。特に、胃がんのマウスモデルを用いた研究では、高濃度のメラトニンがCD4+CD25+細胞として識別されるCD4+リンパ球のサブタイプである制御性Tリンパ球(T-reg)を変化させることができ、腫瘍細胞の免疫系からの逃避に関与することが示された[149]。リンパ球培養を用いた他のin vitro研究では、T-regに対するメラトニンのこのような効果は認められなかった[150]。
メラトニンは、腫瘍細胞に由来するエクソソームの放出を調節することができるという仮説がある。エクソソームは、腫瘍の進行やリンパ球およびNK細胞の変質に関与している[138]。さらに、ある研究では、メラトニンの投与により、トール様受容体(TLR)、特にTLR4、NF-κB、IL-6およびp65の発現が低下することが示されたが[151]、卵巣がんの浸潤性に関与するTLR-7およびTLR-5も同様であった[152]。
メラトニンの静力学的機能は、他の異なる戦略によっても説明される。前立腺がんの研究では、メラトニンは、グルコース輸送体/溶質輸送体ファミリー2A(GLUT/SLC2A)輸送体を介して細胞内に入り、グルコースと競合するというメカニズムにより、ウォーバーグ効果を打ち消すことで、腫瘍の進行を遅らせることができるという仮説が立てられた。その結果、乳酸と解糖が減少し、腫瘍細胞が生存のためのエネルギーを得ることができなくなる[153]。メラトニンはまた、正常または癌の細胞タイプに基づいて作用を区別することにより、アポトーシスを調節する。メラトニンは、正常細胞ではDNA修復酵素を増強することで抗酸化物質として作用し、放射線や化学療法によって誘発される細胞死および毒性を遅らせるが [154]、ほとんどのがん細胞では、内因性の活性酸素産生を刺激するプロオキシダント作用を発揮し、その結果、DNA損傷および細胞死を引き起こす [148]。
アポトーシスは、Bax/Bcl2の比率の増加によって刺激されるが、主要な腫瘍抑制タンパク質であるp53の調節によっても刺激される [155]。さらに、メラトニンは、核内NF-κBなどのさまざまな抗アポトーシスメディエーターを阻害することができるため、Bcl2の増加を妨げるだけでなく、炎症性サイトカインの放出も抑えることができる[156]。
最近では、口腔がんCAL27またはSCC25細胞株にメラトニンを投与すると、予後不良に関連する非コードマイクロRNAのmir-155およびmir-21の発現を抑制できることが報告されている。しかし、長期的な研究でこの問題に深く取り組み、他のmi-RNAも考慮することがまだ必要である[157]。
メラトニンは、様々なレベルで作用することにより、非小細胞肺癌の浸潤性を打ち消すことが観察されている[158]。実際、メラトニンは、微小管およびミクロフィラメントの形成を調節し[159]、有糸分裂およびS期を遅らせることで細胞周期を阻害し[160]、タイトジャンクションの重要なタンパク質であり、そのダウンレギュレーションは通常、転移を促進するオクルディンの発現を増加させ[161]、EGFRの過剰発現を抑制し[162]、Bcl-2のリン酸化を低下させ、Baxを促進する[163]。
メラトニンおよびその代謝物であるAFMKをゲムシタビンと一緒に投与すると、Bax/Bcl-2のバランスを調整することにより、PANC-1膵臓がん細胞にアポトーシスを誘導することができ、化学療法の有益な効果を向上させる有効なツールとなった[164]。
アポトーシス、オートファジー、炎症の調節を通じたメラトニンの潜在的な抗腫瘍活性、および副作用の軽減を通じた化学療法の有益な効果を高める作用を示す実験的研究に加えて、予備的な臨床研究では、消化器系腫瘍の患者において、メラトニンの単独または他の治療薬との併用による有益な効果が報告されている[165]。
さらに、メラトニンは、エストロゲンの合成に影響を与える能力があり、乳房組織にメラトニン受容体が存在することから、エストロゲン受容体(ER)陽性の乳がんの治療薬として臨床研究に採用されており、ER受容体の転写をダウンレギュレートすることでエストロゲン経路の活性化を抑制している[166]。これに関連して,夜に光にさらされるとメラトニンの生成が阻害されるため,シフト制で働く女性は乳がんのリスクが高いとされている。化学療法を受けている乳がんの女性では、睡眠時間に関係なく、血中メラトニンおよびAFMK濃度が健康な女性よりも低かった [167] 。女性看護師を対象とした研究では、尿中のa-MT6濃度が閉経後の女性における乳がんのリスクを予測しているようである。特に、a-MT6の低濃度は乳がんのリスク増加と関連しており、その関連性は腫瘍のメラトニン1受容体サブタイプによって変更されなかった[168]。しかし、これらの臨床研究の結果は、より大規模なプロスペクティブ臨床試験によって確認されなければならない。
3.6. メラトニンと神経変性疾患
メラトニンの代謝物であるAFMK、AMK、3-OHMは、フリーラジカル消去活性を介して脳組織を損傷から保護することが知られている。さらに,AMKはiNOSだけでなく,COX2や神経性NOSも阻害することが知られている[169]。したがって、CNSにおけるメラトニン欠乏に関連するメカニズムや、メラトニン補給による神経保護効果を明らかにするために、多くのモデルシステムが使用されている。
脳内におけるメラトニンの作用の多くは、メラトニンの特異的な受容体の活性化を介して行われる。MT1受容体は下垂体,前脳基底部,SCN,海馬のCA3核,小脳,網膜に多く存在し,MT2受容体は主に海馬に分布し,帯状皮質,錐体層,歯状回,網膜にはほとんど存在しなかった[170]。
メラトニンは、脳梗塞の動物モデルにおいて、脳梗塞の面積を減少させることにより、神経保護効果があることが示された[171,172,173]。注目すべきは、松果体の脳内移植で、宿主の無傷の松果体が存在する場合、おそらくメラトニンの分泌を介して脳梗塞から保護されたことである[174]。
メラトニンが興奮毒性細胞の損傷に対抗できるという証拠が示されている。ラット大脳皮質では、メラトニンがグルタミン酸だけでなく酸性化によって引き起こされるカルシウムの増加を抑制することが示された[175,176]。メラトニンはまた、初代培養神経細胞において、酸性化によって誘発される樹状突起の複雑性、シナプスタンパク質密度、キナーゼ/ホスファターゼの不均衡、タウの過リン酸化、グリコーゲン合成酵素キナーゼ-3β(GSK3β)およびNF-κB経路の活性化、小胞体(ER)ストレスおよびゴルジ装置ストレス、ならびにオートファジー・リソソームシグナルの異常を部分的に回復させるという有益な効果を示した[177]。
多くの観察結果から,加齢に伴う生理的なメラトニンの減少が,アルツハイマー病(AD)やパーキンソン病(PD)などの加齢に伴う神経変性疾患の発症に大きく寄与している可能性が示唆されている。これらの疾患は,タンパク質の凝集体,すなわちADではβアミロイド,PDではアルファシヌクレインの蓄積を特徴とし,これらは基本的な事象であり,特異的な診断マーカーでもある[178]。
ADの動物モデルにおいて,メラトニンは,アミロイドβ(Aβ)によるカルシウムやミトコンドリアのホメオスタシスの変化を制御するだけでなく,Aβの合成やフィブリルの形成を効果的に阻害することで,酸化ストレスや細胞死に対する保護作用を発揮することが示されている。メラトニンは,Aβ前駆体タンパク質(APP)の非アミロイド原性処理を促進し,アミロイド原性処理をダウンレギュレートすることで,Aβペプチドの形成を阻止する[179]。AD患者は、年齢をマッチさせた対照群と比較して、メラトニンレベルが低いことが分かっている。これに関連して、メラトニンは、コリン輸送とコリンアセチルトランスフェラーゼ(ChAT)の両方の活性を刺激し、アセチルコリンエステラーゼ(AChE)の活性を低下させることによって、コリン作動性システムを保護する効果があるという仮説が立てられている[179]。メラトニンは、ミトコンドリアの損傷や(GSK3β)、カスパーゼ-3、Aβ1-42、βセクレターゼ1(BACE1)、リン酸化されたタウの発現を減少させ、プロテインホスファターゼ2A(PP2A)やBcl-2を増加させることで、ADマウスの認知機能を著しく改善する[180]。また,メラトニンは,炎症性サイトカインを減少させ,酸化的損傷を減少させることで,AD発症の重要な要因であるミクログリアの活性化に対しても有効であるとされている[181]。
最近では、メラトニンまたはその誘導体による治療が、タウオパシーに関連するADモデルに有益な効果をもたらし、タンパク質の凝集を抑え、認知機能の低下を防ぐのに有効であることが示されている[181]。実際、外因性に補充されたメラトニンとAFMKは、その抗酸化特性を介して、高リン酸化タウ、ニューロフィラメントタンパク質、マロンジアルデヒドを減少させ、SOD活性を増加させ、タンパク質凝集体の治療のためのオートファジーフラックスを改善し、記憶障害を改善することができた[181,182,183]。
酸化ストレスは、ADの発症に重要な役割を果たしている。AD患者では、Aβの沈着、ミトコンドリアの機能障害、炎症によるフリーラジカルの発生が非常に多い。メラトニンは、ADマウスモデルにおいて、酸化ストレスによる神経細胞の損傷を軽減し、記憶障害を減弱させることが報告されている[184]。APP+/プレセニリン1(PS1)ダブルトランスジェニックマウスにメラトニンを長期投与すると、ミトコンドリアの損傷とマイトファジーが減少し[185]、抗酸化酵素であるSOD1、GPx、CATのmRNAの転写が減少した[186]。さらに、メラトニンの補給は、脳の老化を加速させた動物のCA1海馬ニューロンのミトコンドリア部分の減少を打ち消した。これは、人間の老年期障害に似た表現型である[187]。メラトニンの補給は、海馬のシナプス密度と興奮性シナプスの数を有意に増加させ、抑制性シナプスの数を減少させ、シナプシンIとシナプス後密度タンパク質95の発現を増加させた[188]。しかし、メタアナリシス研究によると、ADまたは認知症患者にメラトニンを補給すると、夜間の総睡眠時間を延長することができたが、認知機能の有意な改善は見られなかった[189,190]。逆に、ADの既存の治療法にメラトニンを追加すると、認知機能が改善した[191]。
MPTP誘発PD動物モデルを用いて、メラトニン注射が海馬と線条体のリポペルオキシドを阻害し、黒質領域の神経細胞死を抑制することが報告されている[192,193]。6-ヒドロキシドーパミン(6-OHDA)誘発PD動物モデルにおいて、メラトニンは黒質におけるミトコンドリア酸化的リン酸化酵素(複合体I)の減少を打ち消し[194]、ヒドロキシルラジカルを消去し、神経細胞体と黒質経路においてGSHと細胞質の抗酸化物質SODおよびCAT活性を増加させることが示された[195,196]。
メラトニンは、パラコート誘発PDモデルマウスにおいて、リポペルオキシデーションとアポトーシスを減少させることにより、運動能力を改善した[197]。また、ロテノン誘発PDモデルラットにおいて、脳の線条体領域のチロシン水酸化酵素をアップレギュレートし、線条体変性を抑制した[198]。
メラトニンは,脳虚血・再灌流マウスにおいて,MT2受容体の活性化を介して内因性神経新生を促進することが報告されている。間葉系幹細胞に対するメラトニンの神経新生効果は、神経発達遺伝子/タンパク質発現のアップレギュレーション、酸化/炎症ストレスの減少を介しており、その結果、血液脳関門(BBB)の完全性が維持されていた[199]。
これらの特徴から,メラトニンは神経変性疾患の予防および治療薬として有望である。しかし、これまでのところ、神経変性疾患の臨床症状に対するメラトニンの役割を評価した研究は限られている。
軽度認知障害(MCI)患者を対象とした二重盲検のRPCTでは、メラトニンの食事摂取(0.15mg/kg、6カ月間)により、プラセボと比較して、篩骨の厚さ(LCT)と海馬の体積が増加し、CSFのT-tau濃度が低下した。特に、MCI患者では、ミニメンタルステート検査(MMSE)スコアの低下、海馬体積の減少、CSFのT-tau濃度の上昇が、LCTの薄さと有意に関連していた[200]。さらに、メラトニンの追加投与(2、5、10mg)は、MCIおよびAD患者において、睡眠の質を改善し、睡眠/覚醒リズムを調整することで有益であることがわかった。しかし、AD患者での効果はあまり顕著ではなかった[201]。
最近の臨床試験では、PD患者にメラトニンを補充(10mg/日、12週間)することで、統一パーキンソン病評価尺度(UPDRS)パートIスコア、ピッツバーグ睡眠品質指数(PSQI)、ベックうつ病目録(BDI)、ベック不安目録(BAI)が有意に低下し、炎症および酸化的特徴とインスリン抵抗性が改善された[202]。別の試験の結果では、メラトニンは、PER1ではなく、時計遺伝子BMAL1の発現をアップレギュレートすることによって、PD患者の睡眠障害を適度に改善することが示された[203]。
神経変性疾患の治療におけるメラトニンの使用に関する前臨床試験と臨床試験の両方で、いくつかの制限を強調する価値がある。特に、メラトニンの有効性は、疾患の進行や投薬を開始した年齢に依存しているようである。さらに、メラトニンが神経新生を回復させたり、アセチルコリンやドーパミンを含む神経伝達経路を調節したりする特性については、さらに深く研究する必要がある。
4. メラトニン治療の安全性と有効性に関する矛盾したデータ
メラトニンの投与が安全であるかどうかについて最終的な結論を出すには、さまざまな要因によって制限される可能性がある。すなわち、二重盲検のRPCT研究が少ないこと、副作用の報告方法が弱いこと、統計的検出力が低くてグループ間の差を検出できないこと、どのような副作用を関連性があると見なさなければならないかが事前に決定されていないことなどが挙げられる。メラトニン投与の安全性という重要な問題を主要評価項目として取り上げた無作為化研究は1件のみであった[204]。しかし、多くの実験的および臨床的研究が、メラトニン単独または付加的な治療法の安全性と有効性の両方に関する有益な情報を提供している。メラトニンを短期および中期的に投与した場合、子供を対象とした臨床研究では、興奮、めまい、頭痛、吐き気、眠気などの軽微な副作用があり、成人を対象とした実験研究では、主観的な眠気、一過性の鎮静、LHおよびGHレベルの統計的に有意ではない減少などが見られた。成人を対象とした臨床試験では、めまい、頭痛、口・腕・脚の感覚異常、軽度の頭痛、しびれ、呼吸困難の悪化、手術患者では精神運動障害、鎮静、見当識障害、健忘、重症患者では軽度の頭痛、眠気の増加、皮疹、高齢者では昼間の眠気 [205]。
神経発達障害のある小児の睡眠障害の治療のためにメラトニンの長期制御放出を行った1件の無作為化二重盲検プラセボ対照クロスオーバー試験では、軽度の副作用、すなわち痙攣(11/51)、風邪/インフルエンザ/感染症(8/51)、胃腸疾患(5/51)、激越(4/51)、不安(2/51)、および頭痛(2/41)が報告された[206]。
最近のシステマティックレビューでは、一次および二次睡眠障害の治療のためにメラトニンの長期連日投与(0.15~12mg、4~29週間)を行った無作為化プラセボ対照試験のデータを報告した37件の研究が調査された。最も頻繁に報告されたメラトニンの有害事象は、日中の眠気(1.66%)、めまい(0.74%)、頭痛(0.74%)、その他の睡眠関連有害事象(0.74%)、低体温(0.62%)であった。重篤な、あるいは臨床的に意義のある有害事象は非常に少なく、激越、動悸、悪夢、気分の落ち込み、疲労、皮膚刺激などがあった。これらの影響のほとんどは、メラトニンを調整しなくても数日以内に自然に解消されるか、治療を中止すると直ちに解消された[207]。
もう1つの難問は、メラトニンの補充が治療上有効かどうかである。いくつかのメタアナリシス研究では、睡眠障害、がんの進行、心臓および脳血管障害、神経障害、および不妊治療に対するメラトニン補充のプラス効果について、証拠がないか、または低~非常に質の低い証拠が見つかっている。メラトニンは、時差ぼけやシフトワーク障害などの二次的な睡眠障害や睡眠制限を伴う睡眠障害の治療に有効であることは証明されておらず、また、不眠症の治療におけるメラトニンの有効性を評価する際のアウトカム指標についてもコンセンサスが得られていない[33,208]。さらに、メラトニンを含む抗酸化物質を補給した後の生存率および/または腫瘍反応という重要な問題を扱った無作為化対照臨床試験のメタアナリシスでは、生存期間の有意な延長、腫瘍成長の減少、またはその両方、さらに対照よりも毒性が少ないという証拠を報告した試験はなかったと結論づけている。しかし、すべての研究は、十分な統計的検出力に欠けていた[209]。さらに、造血器由来のがんに対するメラトニンの抑制効果を確認できず、むしろメラトニンがリンパ腫や白血病の増殖を促進し、リンパ腫細胞のアポトーシスを抑制することを示す知見もあった[210]。また、アルツハイマー病患者において、睡眠、概日リズム、興奮に対するメラトニンの有意な効果は、プラセボと比較して認められなかった。さらに、原発性頭痛、片頭痛、群発性頭痛におけるメラトニンの予防的使用については、十分な科学的証拠が得られていない[201]。最後に、メラトニンを含む抗酸化物質を補った7760人の不妊症の女性を対象とした63の試験をレビューした最近の論文では、不妊症の治療におけるメラトニンの有効性を示すエビデンスは低品質から非常に低品質であると結論づけている[211]。
5. 結論
本レビューでは、いくつかの健康的な特性の基礎となるメラトニンおよびその代謝物の主な生物学的活性をまとめた。メラトニンの欠乏は病気のリスクを高めるマーカーとなるため、体液中のメラトニンとその代謝物のレベルを測定することは、いくつかの病的状態を予防または対策するために補給が必要な被験者を特定するのに役立つ可能性がある。
メラトニンは、そのユニークな抗酸化作用、抗炎症作用、および免疫調節作用により、大きな翻訳の可能性を秘めている。現在のところ、メラトニンは一般的に忍容性と安全性が高いと考えられている。ベンゾジアゼピン、オピオイド、非ステロイド性抗炎症薬、グルココルチコイドなど、重大な合併症や病的状態を引き起こす可能性のある薬剤の短期的および長期的な副作用に比べれば、メラトニン治療のこれまでの軽度の副作用は最小限であると考えられる。最も重要なことは、メラトニン治療には中毒性がないということである[205]。
メラトニン治療は、これまで主に睡眠/覚醒サイクルの変化の治療に有効であることが知られてたが、上述のようにいくつかのメタアナリシス研究で相反する結果が報告されていたとしても、不妊症、骨粗しょう症、酸化/炎症性障害、肥満の治療管理に非常に有用である。さらに、従来の治療法にメラトニンを併用することで、感染症、心血管疾患、がん、神経変性疾患などの治療の効率を高め、従来の薬剤の長期的な副作用を軽減することができる。実際、多くの病態においてメラトニンの臨床効果が確立されていないため、睡眠障害の治療や術前の抗不安薬としての使用を除いて、標準的な治療法をメラトニン治療に置き換えることはできない[205]。
最後になったが、ヒトにおけるメラトニン補充の最適な投与量を決定するには、さらなる調査が必要である。この点で重要な問題は、動物実験を臨床に役立てることの難しさと、最も効果的なメラトニン投与方法を特定することにある。動物実験に基づいた計算では、ヒトへの投与量はランダム化比較試験で採用されたものよりも高いことが示されている[212]。さらに、ヒトの経口および静脈内投与後のメラトニンのバイオアベイラビリティは非常に低く(約15%)、年齢、喫煙、カフェイン摂取、病的状態、特定の薬剤、さらに食物摂取(特にトリプトファンやセロトニンを含む食物の場合)に影響される[213]。さらに、メラトニンは肝臓のチトクロームP-450で代謝されるため、フルボキサミン、カフェイン、経口避妊薬など、同じ酵素と競合する薬剤は、外因性メラトニン投与後にメラトニンの循環レベルを上昇させる可能性がある[214]。
上述の観察結果を考慮すると、長期補給のための最適なメラトニン用量を決定し、代替経路を考慮して補給方法を改善するために多くの努力を払わなければならない。例えば、経鼻、経皮、皮下、および経口経粘膜(舌下、頬側)の経路による投与、または異なる製剤(弾性リポソーム、スプレー、ペースト、ゲル)による投与である。これらの代替経路は痛みを伴わず、肝代謝をバイパスし、メラトニンのバイオアベイラビリティを高める持続的な放出を可能にする[215]。
脳卒中患者におけるメラトニンの有効性;投与量の問題か?システマティックレビュー
www.sciencedirect.com/science/article/abs/pii/S0041008X20300570
本論文は,脳卒中患者におけるメラトニンの治療効果に関するエビデンスを包括的に分析した初めてのシステマティックレビューである。基準を満たし,脳卒中患者におけるメラトニンの治療効果を評価したRCTを6件発見した。さらに,RCTで使用された用量を比較外挿して,ヒトの患者に効果があると思われる用量と相関しているかどうかを検討した。
脳卒中・窒息患者を対象としたメラトニンのRCT研究を含む論文は6件しかなく、いずれもメラトニン治療が安全な治療法であり、良好な結果が得られていることを示すエビデンスが得られた。しかしながら、これらの患者にメラトニンを臨床使用することが効果的であると結論づけるには、十分な証拠がない。動物実験で得られた有効量をヒトに外挿すると、ヒトの投与量はRCTで脳卒中の治療成績に有意な影響を与えるには低すぎる可能性があるため、その後のRCTでの投与量を再検討する必要がある。
動物での効果的な投与量をヒトに外挿すると、25〜100mgという結果になったが、新生児の投与量は10mgであった。動物モデルでは,計算された等価投与量はRCTでの投与量の5倍から15倍の範囲であった。また、成人のヒト等価投与量を算出したところ、RCTでの投与量よりも有意に多かった。
