Vascular Cognitive Impairment and Dementia
www.ncbi.nlm.nih.gov/pmc/articles/PMC6719789/
JACC科学専門家パネル
要旨
加齢に伴う認知機能障害は、現代の公衆衛生上の主要な課題の一つとして浮上している。欧米ではアルツハイマー病が認知症の主な原因とされているが、東アジアでは血管性認知障害が第二の原因とされており、認知機能障害が主な原因となっている可能性がある。さらに、皮質下白質の微小循環に影響を及ぼすものを含む大脳・小脳血管系の変化は、アルツハイマー病を含む他の病態による認知機能障害の臨床発現に重要な役割を果たしている。この科学専門家パネルでは、血管性認知機能障害と認知症の疫学、病理学、神経病理学、神経画像学、および現在の診断と治療のアプローチについて批判的な評価を行う。また、未解決の問題点についても検討し、人間の最も悲惨な状態の一つである認知症の緩和につながる可能性のある新たな基礎研究や臨床研究の道筋を明らかにしている。
キーワード アルツハイマー病、脳血流、認知機能障害、小血管疾患、脳卒中
認知症は、進行性で容赦なく精神能力が低下し、自立した生活がどうしても危うくなることが特徴である。高齢化が主な危険因子であり、世界人口の高齢化と効果的な治療法の欠如により、2018年には世界で5,000万人と推定されている認知症患者の数は、2050年までに3倍に増加し、その費用は4兆ドルに迫ると予測されている(1)。予測される「認知症のパンデミック」は、世界の指導者たちを駆り立て、その壊滅的な社会経済的影響に対処するための国家計画を策定し(2)、治療法の開発を加速させるための研究資金を増加させている(3)。
脳血管の変化は、長い間、加齢に伴う認知機能の低下に関係していることが知られている。アロイス・アルツハイマーは、現在アルツハイマー病と呼ばれている状態を特定したことで最もよく知られているが、高齢者の認知症は脳血管の機能不全に起因するという概念の強力な提案者であった(4)。動脈が硬くなることで脳血管の弛緩能力が低下し、脳の代謝ニーズに合わせて血液の供給を調整する能力が低下し、低灌流、神経細胞死、認知症を引き起こすという考え方であった。この考え方は1970年代に入ってからもずっと続いていたが、脳血流(脳血流)の測定により、認知障害者では脳血管が脳血流を増加させることが実証され(5全域的な血管麻痺と血管不全という支配的な仮説に疑問が投げかけられた。同時期には、脳血管疾患が複数の脳梗塞を介して認知症を引き起こすとする多梗塞性認知症という概念が導入され(6)、グローバル虚血の概念に対するもう一つの論拠となった。多脳梗塞認知症は、脳卒中が予防可能であるならば、脳梗塞による認知障害も予防可能であることを示唆していた。その後、血管性認知症(血管性認知症)という用語は、血管性因子による認知機能の変化の全体像を捉えるには制限的すぎると考えられ、血管性認知障害(血管性認知障害)という用語が提案され(7)、最終的には広く採用されるようになった(8)。血管性認知障害の最も重篤な形態は血管性認知症である。
1990年代にアルツハイマー病の分子病理学の理解が進むにつれて(9)、認知症という用語はアルツハイマー病と同義語になり、血管病理の認知的影響は神経変性病理(アミロイド斑や神経原線維のもつれなど)と比較して見過ごされるようになった。さらに最近では、豊富な疫学的、臨床病理学的、基礎科学的観察により、認知機能障害における血管因子の役割が再評価され(10)、血管機能障害と損傷がアルツハイマー病を含む後期認知症の病態生理の重要な構成要素であることが明らかになってきた(11)。この最新のレビューでは、認知健康における血管因子の役割と、その臨床症状、疫学、病理学、画像相関、神経病理学についての最新の評価を提供する。また、予防と管理の現状、将来の研究と臨床開発のための課題と機会についても検討している(中央図)。
血管性認知障害と認知症
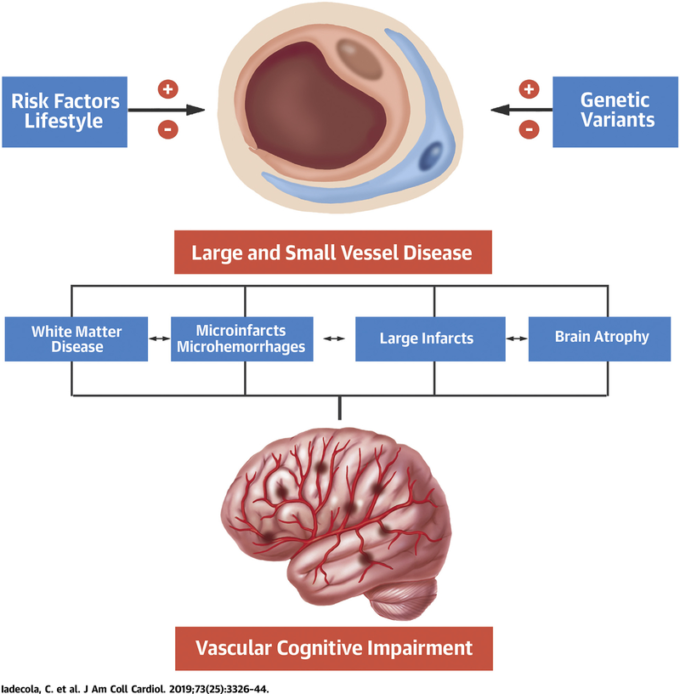
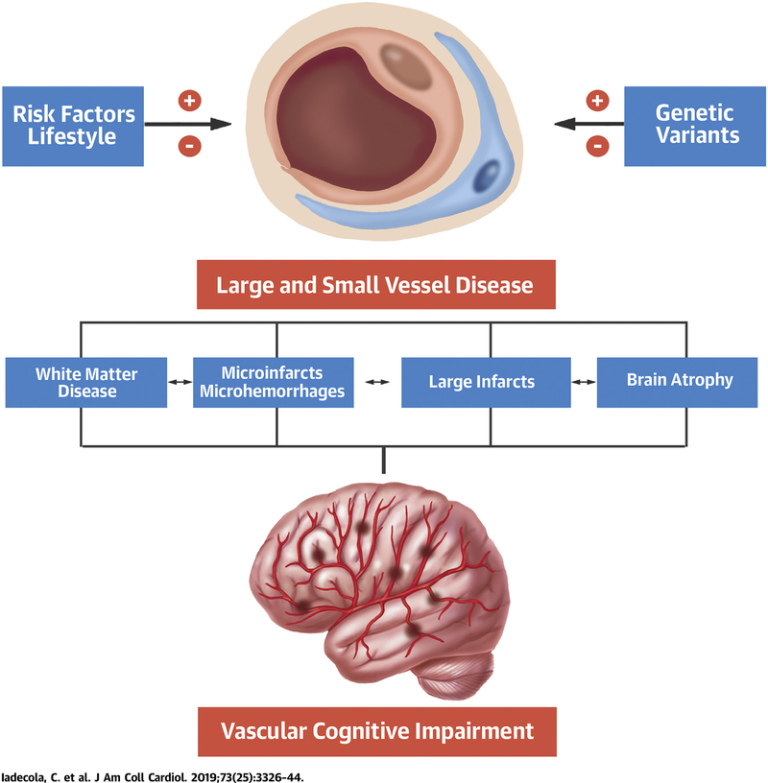
危険因子やライフスタイル、および遺伝的変異は、大脳血管および小脳血管の損傷を促進する(+)か、または回避する(-)かのいずれかであり、その結果、血管性認知障害をもたらす神経病理学的変化につながる。
臨床試験の特徴
認知症とは、日常生活に支障をきたすほど重度の精神能力の低下を指す。最近発表されたVascular Impairment of Cognition Classification Consensus Study(VICCCS)ガイドラインでは、大脳虚血性認知症(血管性認知症)を、少なくとも1つの認知領域において、日常生活の(道具的な)活動を著しく阻害するのに十分な重症度を有する臨床的に有意な欠損と定義している(12)。軽度血管性認知障害または大血管性認知障害(血管性認知症)の第二の要件は、脳血管疾患の画像証拠である(表1)。この新しい定義は、米国心臓協会/米国脳卒中協会(8)および米国神経疾患・脳卒中研究所-カナダ脳卒中ネットワーク(13)のコンセンサス・ステートメントから発展したものであり、大神経認知障害と軽度の神経認知障害を区別するDSM-Vの改訂された用語と一致している。
表1 血管性認知症のためのVICCCSガイドライン
- 臨床検査、神経心理学的検査、画像検査は、米国神経疾患研究所-カナダ脳卒中ネットワークのガイドラインに従うべきである。認知評価の中核となる領域には、実行機能、注意、記憶、言語、および視覚空間機能が含まれるべきである。
- 大脳虚血性心筋梗塞(血管性認知症)の定義:少なくとも1つの認知領域において十分な重症度の臨床的に有意な欠損(欠損は複数の領域に存在する可能性がある)およびIADLs/日常生活動作(ADL))への重度の障害(血管イベントの運動/感覚の後遺症とは無関係)。
- 大脳虚血性心筋梗塞(血管性認知症)と診断された患者は、基礎となる病態に応じて適切に分類される(図1)。
- 「確率」と「可能性」という用語は、利用可能なエビデンスを定義するために使用される。
- MRIは血管性認知障害の臨床診断のための「ゴールドスタンダード」の要件である。コンピュータ断層撮影が唯一の撮影手段である場合は、軽度血管性認知障害または大血管性認知障害(血管性認知症)が適切な診断カテゴリーとなる。
- 脳卒中後認知症とは、脳卒中後6ヵ月以内に開始し、その後も回復しない即時性および/または遅発性の認知機能低下と定義される。
- 診断の対象外:障害やせん妄が最初に認められてから3ヶ月以内の薬物/アルコールの乱用/依存症。
ここにガイドラインの重要な要素を示す。さらなる説明については、本文およびSkrobotら(12)を参照のこと。
日常生活動作(IADL)) = activities of daily living; IADL(IADL)) = instrumental activities of daily living; MRI = magnetic resonance imaging; 血管性認知症 = vascular dementia; 血管性認知障害 = vascular cognitive impairment; VICCCS = Vascular Impairment of Cognition Classification Consensus Study.
分類
VICCCSによると、血管性認知症は大きく4つのサブタイプに分類される。
- 1) 脳卒中後認知症(脳卒中後認知症脳卒中後6ヵ月以内に発現する認知症と定義される、)
- 2)皮質下虚血性血管性認知症(皮質下虚血性血管性認知症)
- 3)多脳梗塞(皮質)性認知症
- 4)混合型認知症(図1)
である(12)。慣例では、混合病態(例えば、血管性認知症とアルツハイマー病)の証拠がある患者は、推定される認知症の優勢な原因(例えば、血管性認知症-アルツハイマー病またはアルツハイマー病-血管性認知症)を特定するために、さらにラベルが付けられている(図1)。血管性認知症または軽度の血管性認知障害と診断するためには、新しいVICCCSガイドラインでは、一般的に磁気共鳴画像(MRI)と主要な診断サブタイプのいずれかに該当する血管病変の証拠が必要とされている(表1)。
図1 血管性認知障害の分類
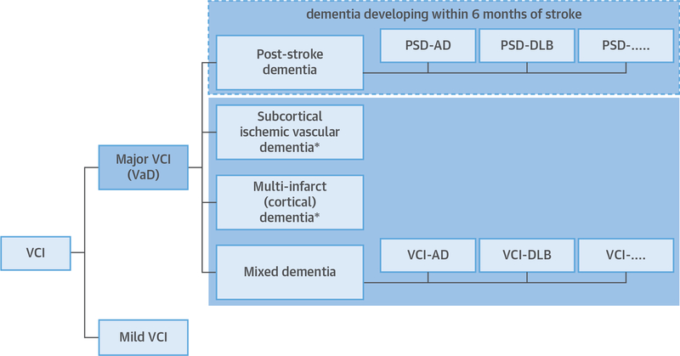
大血管性認知障害(血管性認知障害)の診断分類(大血管性認知障害=血管性認知症[血管性認知症])。脳卒中後の認知機能低下の6ヵ月間の時間的根拠(破線のボックス)は、脳卒中後認知症(脳卒中後認知症)を他の血管性認知症と区別する。*アルツハイマー病やレビー小体型認知症(DLB)のように、認知症の非血管性原因として確立された併存疾患を有する患者は混合型認知症に分類される。軽度の血管性認知障害とは、少なくとも1つの認知領域に障害があり、日常生活の器楽活動や日常生活活動に軽度から無障害(血管性イベントの運動・感覚の後遺症とは無関係)であることを意味する。Skrobotら(12)のデータ。
影響を受ける認知領域および臨床的評価
軽度の血管性認知障害および血管性認知症における認知障害のプロファイルおよび時間的進展は可変的である。認知機能の低下は、徐々に、段階的に、または両方の組み合わせで進行する。現在の診断基準では、アルツハイマー病のより特徴的な記憶障害の存在はもはや必要ない(12,13)。血管性脳病変を有する患者の共通の所見は、実行機能と処理速度の障害である。遂行機能は、開始、計画、意思決定、仮説生成、認知的柔軟性、判断のための多くのプロセスで構成されている。血管性認知障害患者のもう一つの一般的な所見は、単語リストや視覚的内容の想起の遅れである(14)。
臨床では、認知評価には、次の5つのコアドメイン、すなわち、実行機能、注意、記憶、言語、および視覚空間機能が含まれるべきである(12)。学習、社会的認知、神経精神医学などの他の領域に関する情報は、認知症候群の定義に役立つかもしれないが、血管性認知症の診断には必要ない。5つのコアドメインは、国立神経疾患研究所および脳卒中-カナダ脳卒中ネットワーク血管性認知障害調和基準によって提案された「60分」および「30分」プロトコルによってカバーされている(13)。これらのプロトコルは広く使用され、VICCCSガイドライン(12)によってサポートされている。
特定の設定では、詳細な認知検査は、例えば、重度のうつ病、重度の認知症、または急性の脳卒中の患者など、実行可能でも意味のあるものでもない。このような状況下では、有効なスクリーニング装置による短時間の認知検査が、最初の概要と今後の調査のための参考となる。その後、臨床的に適切であれば、詳細な検査は通常3~6ヶ月間延期することができる。血管疾患患者の認知スクリーニングに適した装置は、モントリオール認知評価(MoCA)であり、約10分で実施できる1ページ30点のテストである。MoCAは、上記のコアドメインのすべての項目を含み、多言語で利用可能であり、脳卒中を含む複数の設定で検証されている(15)。脳卒中後の急性期のMoCAスコアが低いと、認知機能障害を含むいくつかの有害な長期転帰が予測されるため、脳卒中患者におけるMoCAの日常的な使用を支持している(16)。しかし、脳卒中直後の認知検査には、スクリーニング機器であっても障壁がある(17)。入院中の脳卒中患者の最大20%がせん妄を発症する。せん妄とは、注意力の低下、意識障害、または思考の乱れを特徴とする状態であり、短期間に発症し、1日のうちに変動する(18)。せん妄の評価ツールには、せん妄評価尺度と錯乱評価法がある(18)。血管性認知障害におけるもう一つの診断上の問題は、認知検査に支障をきたすため、失語症である。しかし、失語症の原因となった血管イベントの前に正常な認知機能の証拠が文書化されていれば、「可能性のある血管性認知障害」と診断することができる。付随する前の認知状態の評価には、Informant Questionnaire for Cognitive Decline in the Elderly(19)とアルツハイマー病8 Screening Interview(20)があり、これは情報提供者が記入すべきものである。
血管性認知症の神経画像検査では、以下の主要評価項目を評価すべきである(12,13)。1)全身萎縮、脳室の大きさ、内側側頭葉萎縮の推定を含む脳萎縮;2)半定量的尺度を用いた白質増強(白質肥大);3)梗塞(数、大きさ、大[1cm超]および小[3~10mm]の梗塞について層別に分けた大きさ、場所);および4)出血(数、大きさ、大[1cm超]および小[1cm未満]の出血について層別に分けた大きさ、場所)(画像化のセクションも参照のこと)。白質肥大および梗塞の容積測定値などの追加測定値を追加することもできるが、臨床診断には必要ない。
遺伝性血管性認知症
脳小血管疾患(脳小血管病)に関連した遺伝性認知症の家族の発見は、血管性認知症、特に皮質下虚血性血管性認知症の理解を進めてきた。特に、NOTCH3遺伝子の変異によって引き起こされる遺伝性脳小血管病である皮質下梗塞および白質脳症を伴う脳常染色体優性動脈障害(CADA皮質下虚血性L)の患者を対象とした研究では、純粋な皮質下虚血性血管性認知症の認知プロファイルが明らかにされている(21)。無気力(皮質下虚血性血管性認知症の臨床的に関連する症状)の認知メカニズム(22血管性認知障害の神経画像学的相関(Dichgans and Leys [23]および以下のテキストでレビュー疾患修飾因子と回復力因子の役割(24および薬理学的介入への治療反応(25)。
疫学
認知症は加齢との関連性が強く、若年者では遺伝的疾患との関連性が高い。先進国では、認知症の発生率と有病率は75歳までから指数関数的に上昇する(1)。しかし、教育、生活環境、医療の向上などにより、過去数十年の間に全原因性認知症の年齢別有病率と発生率は低下している(26)。認知症を伴わない軽度認知障害(MCI)の有病率も年齢に強く関連しており、若年者では認知症よりも認知症の方が多く、高齢者では認知症が比例して高くなる(27)。
血管性認知症は一般的に白人の後期認知症原因の第2位とされているが、東アジアでは最も多いとされており、他の民族のデータは少ない(28,29)。しかし、認知症のサブタイプに関する最近の疫学的データは、分類の難しさもあってほとんどない。神経変性疾患と脳血管障害が混在しているのが一般的で、実際、認知症で死亡する高齢者(75歳以上)の大多数に見られる(30)(神経病理の項も参照)。現代の人口ベースの推定値が不足しているため、血管性認知症の有病率の経時変化に関するデータはほとんどない。しかし、英国では女性よりも男性の方が認知症の有病率や発生率が低下していることから、認知症への血管の寄与度が特に低下していることが示唆されている。血管性認知障害の有病率は不明であるが、認知症への進行や死亡率の危険因子である(31)。
脳卒中後の認知症
全体では、約10人に1人が脳卒中の前に認知症を発症し、10人に1人が初発脳卒中後の最初の1年間に新たな認知症を発症するが、その後のリスクは低い(32)。発症前の認知症の有病率は重症脳卒中(NIHSS>10)では20%程度であるのに対し、TIAでは5%程度であり、発症後1年以内に新たに認知症を発症するのは重症脳卒中(NIHSS>10)の3分の1以上であるのに対し、軽症脳卒中(NIHSS<3)では8%程度、TIAでは5%程度である(33)。背景となる集団の割合と比較すると、認知症は重度の脳卒中では~25年、軽度の脳卒中では~4年、TIAでは~2年前に進行する(33)。
MCIのリスクは、脳卒中(34)とTIA(35)の後にも増加し、脳卒中前と比較して認知機能の低下率が加速し、アフリカ系アメリカ人、男性、心筋塞栓性脳卒中または大動脈性脳卒中後のグローバル認知機能の急性低下が大きい(36,37)。一過性の認知障害(TIA/軽度脳卒中の30%まで)(38)または率直なせん妄(入院脳卒中の25%まで)(18)が発生することがあるが、多くの患者はイベント後に改善する。個々の患者の認知的軌跡は不均一で予測が困難であるが、特にベースラインの認知力が低い高齢の患者では、初期の改善に続いて長期的な認知力の低下がみられることから、このような一過性の変化が認知の脆弱性や認知予備能の欠如のマーカーである可能性が示唆されている(38)。
リスク因子
認知症の危険因子は脳卒中の危険因子と重複しており、これら2つの疾患の疫学的関係からも示唆されているように、共通の感受性という概念を支持している(33)(図2)。全原因性認知症の圧倒的な危険因子は年齢の上昇である(26,28,29,33)。他の修正不可能な危険因子には女性の性があるが、血管性認知症との関係は最近のデータでは少なくとも脳卒中後には関連性がないことが示唆されており、あまりはっきりしていない(33)。遺伝的因子も役割を果たしているかもしれないが、のような稀な障害を除けば、特定のリスク遺伝子はほとんど知られていない(39)。アポリポ蛋白E4は、特に女性におけるアルツハイマー病の強い危険因子であるが、血管性認知症や脳卒中後認知症との関係はあまり明確ではなく、さらなる研究が必要である(39)。
図2 認知症の危険因子
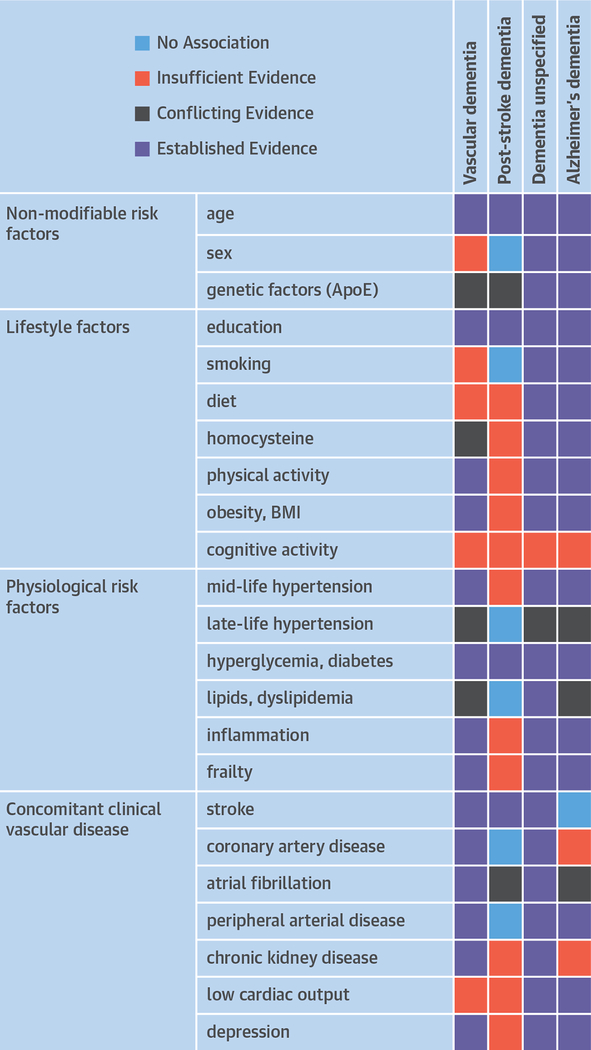
血管性認知症、脳卒中後認知症、病因不明の認知症(不特定認知症アルツハイマー型認知症の危険因子。Dichgans and Leys(23)およびPendleburyら(134)に由来するデータ。最近の遺伝学的および疫学的証拠は、アルツハイマー病が脳卒中の危険因子であることを示唆していることに留意されたい(135)。
修正可能な危険因子は、保護因子と認知症のリスクを高める因子に分けることができる(40)。保護因子には、高学歴/IQ、職業、社会的ネットワーク、認知活動や身体活動などの認知予備能(加齢や疾病関連の変化に対する回復力)を高めるマーカーが含まれる(41)。地中海式食生活は認知機能低下のリスクを減少させることが示唆されているが、血管性認知症に特化したデータは不足している(8)。
中年期の過緊張と糖尿病を血管性認知症とアルツハイマー型認知症の両方に関連付ける強い証拠があるが、多くの研究では混合病態の症例が含まれている可能性がある(8,40)。実際、糖尿病は主に脳血管病理の負担を増加させるようであるが、アルツハイマー病の頻度は増加しないようである(42)。後期高血圧と認知症との関係は不明であり、糖尿病とは対照的に、少なくとも5年追跡までは脳卒中後認知症とは無関係のようである(33)。中年期のコレステロールや肥満と晩期の認知症との関連については、いくつかのエビデンスがある(8,40)。喫煙は認知機能低下のリスク増加と関連しているが、喫煙と特に血管性認知症との関連は不明である(8,40)。晩期うつ病は特に血管性認知症の危険因子であり、基礎となる血管病理があるかもしれない(43)。
症候性、無症候性を問わず、脳血管疾患は血管性認知症の強力な危険因子である。脳卒中後の認知症リスクは、年齢、脳卒中病変の負荷・部位(重症度、脳卒中の既往・再発、失語症脳の感受性・保存状態の前兆マーカー(教育レベル、前兆依存、白内障の重症度ベースラインの認知スコア、糖尿病(32,33,44)などが影響している。したがって、TIA後の認知症のリスクは、他の感受性/予備能のマーカーがない場合には低い(33)。出血性脳卒中は、同程度の重症度の脳卒中では虚血性脳卒中よりも認知症リスクがわずかに高くなる可能性がある(33)。血管性認知症の他の仮定され、修正可能な危険因子には、全身性炎症が含まれている(45)。
病態生物学
脳血管細胞は脳細胞と密接に関連しており、その相互作用は、健康時と疾患時の両方において、脳の発達、維持、機能に重要な役割を果たしている。神経血管単位の概念は、脳細胞と血管系のユニークな関係、それらの機能的相互作用、および傷害に対する協調的反応を強調している(図3)(11)。ここでは、神経血管の構造、機能、および病態生物学の主要な側面を簡単にレビューする。
図3 血管性認知障害における神経血管障害の病理学的研究
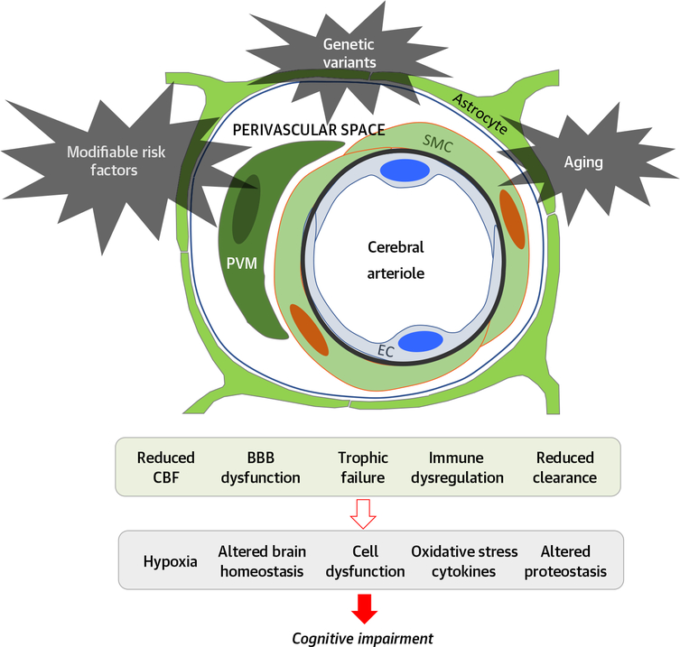
修正可能な危険因子(高血圧、生活習慣因子など遺伝的因子(ApoEなど加齢などにより、神経血管ユニットの主要な機能が損なわれ、認知機能障害の基礎となる脳機能に変化が生じる。神経血管ユニットは、血流調節だけでなく、脳の健康維持に不可欠な他の重要な機能にも関与していることに注目してほしい。BBB=血液脳関門、脳血流=脳血流、EC=内皮細胞、PVM=血管周囲マクロファージ、SMC=平滑筋細胞。
脳血管ネットワークの解剖
脳は “外で “血管ネットワークによって供給されている。脳の表面を走っている大脳動脈から発生したもので、小脳動脈は高度に吻合性のネットワークを形成し、脳実質(貫通動脈)に潜る。脳の基底部では、貫通血管はウィリス環と近位枝から直接発生し、基底核に供給するために上昇する。貫通血管は、毛細血管や毛細血管とは異なり、側副枝が少ないため、単一の血管の閉塞でも小規模な虚血性病変(ラクナ梗塞)を引き起こすのに十分である(46)。また、灌流圧が低いと予測される長い貫通動脈から供給される深部皮質下白質(WM)は、血行動態不全に対して特に脆弱であると考えられている(11)。
貫通血管は、頭蓋骨を出る髄膜リンパに接続された排水経路として機能する可能性のある血管周囲空間(Virchow-Robin空間)に囲まれている(47)。血管周囲空間は、血管周囲マクロファージ、線維芽細胞、および他の細胞を含むいくつかの細胞型を収容する(48,49)。動脈が毛細血管に変化すると、血管とグリアの基底膜が合流して血管周囲空間が消失する。
毛細血管では、内皮表面の3分の1がペリサイトで覆われており、両方の細胞型が毛細血管周囲の約3分の2を覆うアストロサイトエンドフィートに包まれている(50)。毛細血管は血液脳関門(BBB)の主要部位であり、以下のような特徴がある。1)隣接する内皮細胞を封鎖する緊密な接合部、2)内皮小胞輸送の低率(経細胞化および3)血液と脳の間の分子交換を調節する双方向性分子トランスポーターの膨大なレパートリー(51)。
脳血流とその制御
脳血流は、脳細胞の刻々と変化する要求を満たし、毎日の血圧変動に対処するために絶妙に制御されている。内皮細胞は、主に強力な血管拡張剤である一酸化窒素(NO)などの血管作動性分子を放出することにより、血管運動緊張の主要な調節因子である(52)。
脳血流自己調節とは、血管内圧が低下したり上昇したりしたときに、動脈と動脈穴がそれぞれ拡張または収縮し、全身血圧(通常は60~150mmHg)の範囲で脳血流を比較的一定に維持する能力のことである(53)。平滑筋細胞が膜貫通圧の上昇に反応して収縮する性質(筋原性緊張)は、このメカニズムに大きな役割を果たしている(53)。
機能性充血は、脳血流の送達を脳のエネルギー必要量と一致させ、代謝性の老廃物を排出することで、脳の代謝恒常性を維持する役割を果たしている。脳にはエネルギー備蓄がないため、神経活動によって誘発されるエネルギー需要の増加は、血流を介した酸素とグルコースの送達を増加させることによって満たされる(11)。機能性充血の細胞および分子基盤は完全には解明されていないが、脳血管樹のあらゆるレベルでのニューロン、グリアおよび血管細胞間の精巧なシグナル伝達機構が関与している(11)。
血管性認知障害の根底にある病理学的メカニズム
慢性的な低灌流は、長い間、血管性認知障害の病因に関与してきた。この仮説を支持して、慢性的な脳血流の低下は、げっ歯類においてWM傷害、ラクナ梗塞、出血、脳萎縮、記憶障害を引き起こすことが示されており、そのうちのいくつかはApoE4によって悪化している(54,55)。ヒトでは、散発性および遺伝性脳小血管病の両方で、大脳、灰白質、およびWM血流の低下を伴う脳低灌流がいくつかの横断的研究で報告されている。しかし、脳血流の低下が原因因子なのか、代謝需要の低下を反映したものなのか、神経血管機能の他の側面も関与しているのかは不明である(図3)。実際、縦断的な研究では、正常に見えるWMにおけるベースラインでの脳血流の低下が新たなWM高輝度の発生に先行するかどうかについて、相反する結果が示されている(56)。さらに、脳血流の低下と白質肥大との関連は、年齢や認知症診断を考慮した場合には弱くなる(56)。
血管性認知症と脳小血管病の2大危険因子である高血圧と加齢が血管壁構造と脳血流調節に大きな影響を与えることが実験的研究で十分に証明されている(57,58)。最近のBOLDや動脈スピンラベリングMRIを用いたヒトの研究では、脳小血管病患者では脳血管反応性が変化しているという説得力のある証拠が得られた(59,60)。さらに、血管性認知症患者を対象とした最近の死後試験では、内皮依存性の動脈拡張がWM貫通動脈で有意に減少していることが示された(61)。しかし、変化した微小血管血行動態機能障害と組織損傷との因果関係はまだ確立されていない。
大頭蓋内動脈の高い脈動性と脳小血管病との関係を支持するエビデンスが増えている(62)。加齢と高血圧は動脈壁の弾力性の喪失と血管硬化に関連している(63)が、これらの因子が脳の機能障害と損傷にどのように寄与しているのかはまだ明らかにされていない。脳血流の減少、流体力学的ストレスによる微小血管損傷、およびアミロイドβ沈着の増加をもたらす自己調節の喪失が、潜在的なメカニズムとして提案されている(64)。
BBBは、フィブリノーゲンなどの神経毒性を持つ可能性のある血漿成分や血球の脳内への侵入を制限する(65,66)。高血圧または老化のいくつかの動物モデルは、BBB透過性の増加、神経細胞の喪失、およびWMの変性と関連している(58)。慢性的な低灌流はBBBリークを促進する可能性があり(55)、BBB透過性は、アルツハイマー病(68)と同様に、脳小血管病および血管性認知症(67)を有するヒトにおいても増加する可能性がある。脳小血管病の特徴である血管周囲空間の拡大は、体液クリアランスの機能不全を反映していると提案されており、脳に有害な老廃物の蓄積をさらに引き起こす可能性がある(69) (図3)。
細胞および細胞機構
主要な血管危険因子は内皮機能障害および損傷を引き起こし、その結果、神経血管機能障害、BBB透過性の増加、および微小血管血栓症を引き起こす可能性がある。内皮機能障害の主な結果は、NOバイオアベイラビリティの低下である(70)。例えば、活性酸素種(ROS)は、NOをスカベンジするか、または重要な補酵素を不活性化することによってNO合成を抑制する(10)。一方、Rhoキナーゼによる内皮NO合成酵素のリン酸化阻害は、内皮NOを抑制し、認知障害をもたらす(11,71)。アンジオテンシンII受容体1型を介したNOX2含有NADPHオキシダーゼによって産生される活性酸素は、慢性高血圧モデルにおける内皮機能障害と認知機能障害に関与している(72)。このモデルでは、活性酸素の主要な細胞源は最近、血管周囲マクロファージに局在している(72)。機能不全の内皮細胞もまた、オリゴデンドログリアの分化を阻害する有毒因子を分泌し、それゆえにWMの完全性に不可欠な骨髄化を損なうことがある(56)。さらに、内皮細胞は加齢に伴い、プロテオミクス上の有害な変化を受ける可能性がある。例えば、主要なスフィンゴ脂質代謝酵素である脳内皮細胞由来の酸スフィンゴミエリン酵素のアップレギュレーションは、カベオラが介在するトランスサイトーシスを増加させることにより、加齢に伴うBBBの破壊に寄与している(73)。
平滑筋細胞の変性に加えて、最近では、周皮細胞の喪失または機能不全が脳病変の主要な寄与因子である可能性が高いと考えられている。いくつかの研究では、げっ歯類、サル、およびヒトでは加齢とともに周皮細胞の被覆率が低下することが示唆されている(74)。しかし、血管性認知症における末梢細胞の完全性に関する信頼できる情報は不足している。周皮細胞の喪失は、初期のBBB破壊、機能性充血の減少、脳の低灌流、低酸素と関連しており、最終的には顕著なWM損傷、神経細胞の喪失、および認知障害につながる(75)。
細胞外マトリックス(ECM)を構成するタンパク質とECMに関連するタンパク質の集合体である微小血管マトリソームもまた、新たな原因の一つである。遺伝学的研究により、脳小血管病のほとんどの単発型はマトリソーム蛋白質をコードする遺伝子の突然変異によって引き起こされることが明らかになった(76)。さらに、血管ECMの病理学的変化、すなわちメタロプロテアーゼ-3の組織阻害剤の異常上昇は、CADA皮質下虚血性Lのマウスモデルにおける脳血管機能障害の基礎となるチャネルパチー様の欠陥と関連している(77)。血管周囲細胞は、まだ未解明ではあるが、ECMの変化を引き起こす魅力的な候補である。
神経病理学
血管性認知症の神経病理学は異質で複雑である。最も広く認識されている神経病理学的基質には、梗塞、出血、および全身性低酸素性虚血性脳損傷が含まれる。軸索喪失の有無にかかわらず脱髄を含むWM損傷もまた、血管性認知症の人によく見られるが、特異的ではなく、神経変性性痴呆、例えばアルツハイマー病などの文脈でも起こりうる。同様に、皮質萎縮および海馬硬化症は、局所性およびびまん性低酸素脳損傷の両方に関連している可能性があるが、これもまた、血管性認知症に特異的ではなく、神経変性疾患にも見られる。血管組織傷害の病因には、全身性、心臓性、および最も一般的な一次脳血管病因が含まれる。後者には、脳小血管病と大血管疾患の両方が含まれ、これらはいずれも加齢脳に非常によく見られ、血管性認知症とアルツハイマー病の両方を含む認知症に大きく寄与している(78)。
SMALL VESSEL DISEASE(小血管疾患)
脳小血管病は、小梗塞、微小梗塞、微小出血、動脈硬化、頭蓋内アテローム性動脈硬化症、脳アミロイド血管症などの様々な病理学的所見を含む包括的な用語である(図4)。血管周囲空間の拡大とWMの蒼白も脳小血管病の共通の重要な病理学的特徴である。脳小血管病は加齢に伴い脳に多くみられる。高齢者(90歳)の約50%に梗塞がみられ、これらの梗塞の大部分は小さな総梗塞または微小梗塞である(以下のテキストを参照)(79,80)。他の年齢に関連した病態(例えば、アルツハイマー病やレビー小体[81,82])とは異なり、梗塞は高齢者群で増加し続ける(82)。ほとんどの人では、これらの小さな梗塞は生涯に診断されない(79)。動脈硬化、頭蓋内アテローム性動脈硬化症、および脳アミロイド血管症のすべてが、ラクナ梗塞、微小梗塞、および出血などの両方の小梗塞の確率を増加させる(83,84)。興味深いことに、動脈硬化と脳アミロイド血管症は、梗塞と出血をコントロールした後でも、高齢者の認知症のオッズを増加させる(78)。このことは、梗塞を伴わない組織損傷の程度が認知機能障害と関連していることを示唆している。この組織損傷の一部は、画像研究で指摘されたWMの破壊と皮質萎縮の形であるかもしれない(画像のセクションを参照)。神経病理学と画像研究の両方で見られる血管周囲空間の拡大もまた、脳小血管病の証拠となり、加齢、過緊張、脳血管疾患、認知機能障害と関連している(69)。
図4 血管性認知障害の神経病理
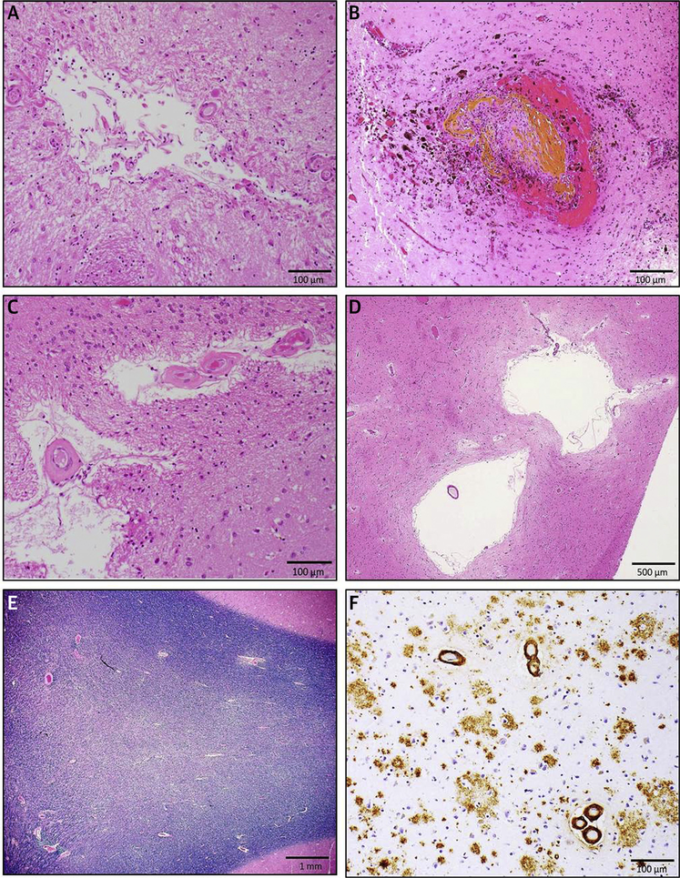
小血管疾患の病態。(A)ヘマトキシリン・エオシン染色による前尾状核の慢性微視的梗塞;(B)ヘマトキシリン・エオシン染色による側頭葉の損傷した皮質血管周囲の微小出血;(C)ヘマトキシリン・エオシン染色による大脳基底核の動脈硬化症;(D)ヘマトキシリン・エオシン染色による後水辺部の白質蒼白;(E)ヘマトキシリン・エオシン染色による後水辺部の白質蒼白 (D) ヘマトキシリン・エオシン染色による血管周囲空間の拡大;(E) Luxol fast blueおよびヘマトキシリン染色による後水辺領域の白質蒼白;(F) 前頭前野中層におけるアミロイド血管症およびアルツハイマー病病理(抗βアミロイド抗体4G8を用いた免疫組織化学)。
小型およびミクロスコピック・インファクタ
血管性認知症やその他の認知症症候群、特に高齢者の認知症において、微小・微小梗塞が重要な役割を果たしていることがますます明らかになってきている(79,85)。顕微鏡的梗塞とは、病理学的検査では見られないが顕微鏡的に見られる梗塞のことであり、巨視的梗塞や肉眼で見られる梗塞は肉眼で見られる。この定義は、3mm未満の梗塞を顕微鏡的なものとみなすイメージング研究とは大きく異なる。いくつかの研究では、複数の皮質小梗塞および微小梗塞が認知機能に大きな影響を与えることが示唆されている(85,86)が、皮質下ラクナ梗塞も認知機能障害に関連していることが示されている(87)。病理の発現には、梗塞の数、大きさ、位置、他の共存する病理、臨床的回復力が重要な因子であるため、病理学的な観点からは、脳小血管病の病理の特定のコンステレーションが血管性、混合性、アルツハイマー型認知症をもたらすかどうかを判断することは困難である。
大型梗塞
大型または嚢胞性の梗塞(通常、最大寸法が10~15mmを超える)は、しばしば大血管の頭蓋内または頭蓋外のアテローム性動脈硬化症や心臓病と関連している。認知症の発生には、梗塞の大きさと位置の両方が重要である。もちろん、大きな梗塞は臨床的に脳卒中として認識されることが多く、脳卒中後認知症の危険性がある。脳卒中後認知症は臨床的には血管性認知症、混合型認知症、またはアルツハイマー病として認められることがある。純粋な “血管性認知症 “と診断されるには、認知されていないアルツハイマー病や他の神経変性疾患を有することが多いため、剖検による確認が必要である。
マイクロブリードおよび他の血行不良
脳アミロイド血管症が血管アミロイドを伴わない小葉出血や脳小血管病と関連していることはよく知られているが、例えば高血圧症では基底核出血を伴うことがある。しかし、これらの大出血は、脳アミロイド血管症でしばしばみられる、焦点性くも膜下出血に起因する小出血、微小出血、皮質表在性サイデローシスに比べて頻度が低い。微小出血や表在性サイデローシスは病理標本上に見られるが、これらの病変を総合的に検出するには画像検査の方が優れている。複数の研究で、微小出血は脳小血管病の他の証拠と関連しており、認知障害のある人に多く見られ、認知機能の低下を予測する可能性があることが示されている(88,89)。数、位置、大きさ、および共存する病理学的疾患は認知障害の可能性を高める可能性がある。
神経遺伝学的病理学を伴うオーバーラップ
血管性認知症は高齢の認知症患者の約10%にみられるが、より一般的には、脳血管疾患と虚血性傷害がアルツハイマー病や、パーキンソン病やレビー小体を伴う認知症にみられるレビー小体や、筋萎縮性側索硬化症や前頭側頭型認知症に関与するDNA-RNA結合タンパク質であるTDP-43などの他の神経変性病態と共存している(80,90)。実際、いくつかの大規模な病理学的研究では、混合型または多病因型の認知症が加齢に伴う認知症の中で最も一般的なタイプであることが示されている(80,90)。さらに、これらの研究では、血管病理が認知症の約3分の1を占めていることが示されている(30)。また、どのレベルのアルツハイマー病病理学においても、巨視的梗塞、微小梗塞、動脈硬化、動脈硬化、および/または脳アミロイド血管症を有することは、それぞれ認知症症候群を呈する可能性を高めることが研究で示されている(78)。神経変性疾患との相加効果に加えて、特定の血管疾患の病態が神経変性疾患を促進することを示唆する研究もある。例えば、一部の研究ではあるが、すべての研究ではないが、脳アテローム性動脈硬化が加齢に伴う脳内アミロイド沈着の増加と関連していることが示されている(91,92)。さらに最近では、いくつかの研究で、動脈硬化と加齢に伴うTDP-43病理との関連が示されている(93,94)。逆に、アルツハイマー病病理を持つ人では、灌流の減少、血液脳関門の変化、およびペリサイトを含む神経血管ユニットの変化がよく認識されている(11,51,68)。
イメージング
血管性認知障害の診断と管理には神経画像診断が非常に重要である。大規模な梗塞、広範な脳幹細胞の変化、または高度な萎縮はコンピュータ断層撮影で可視化できるが、MRIは脳小血管病に関連する脳の変化を可視化し、定量化するのに適している(95)ので、この画像モダリティを用いた所見について詳しく述べる。
脳小血管病における白と灰色の物質の画像異常。
MRI上での小血管の直接撮像は、特に日常的に使用されている磁場強度では困難である。7-T以上の超高磁場MRIは小血管の構造と機能を特徴づける可能性を秘めているが(96,97)、MRIで捉えられる神経画像のほとんどは小血管の病理学的な変化に由来すると考えられている実質細胞の変化である。STRIVE(STandards for ReportIng Vascular changes on nEuroimaging)イニシアチブでは、脳小血管病に関連する病変の広範なスペクトルとコンセンサス用語の詳細な概要が提供されている(95)。
最も一般的な皮質下の画像所見は白質肥大と血管性と推定される裂孔である(図5)。脳小血管病の出血性症状には、微小出血、大規模な頭蓋内出血、焦点性くも膜下出血、皮質表在性サイデローシスなどがある。後者は脳アミロイド血管症と密接に関連しており、予後関連性がある(98)。
図5 血管性認知障害の神経イメージング
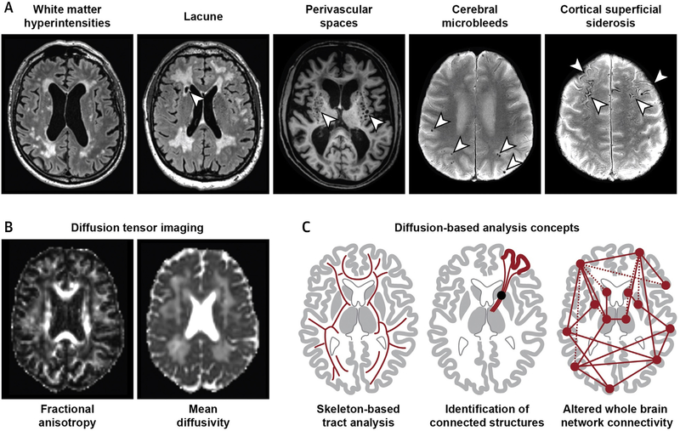
A)小血管疾患(脳小血管病)における従来の磁気共鳴画像上の信号変化(可視病変)。矢印は各脳スキャンの上部に記載されている病理を示している。B)拡散テンソル画像は、脳小血管病患者の脳内の水の拡散性の増加を示している。C)拡散イメージングは、局所的およびグローバルなアプローチを含む様々な戦略を使用して解析することができる。
神経病理学のセクションで説明したように、血管周囲空間の拡大と脳の萎縮もまた、脳小血管病の重要な画像診断の特徴として認識されている。白質と灰白質の両方で体積減少が認められ、脳小血管病は皮質下だけでなく皮質疾患であることを強調している(99)。逆に、脳小血管病における脳萎縮の存在は、脳の体積減少が主に神経変性疾患の特徴であるため、脳小血管病のイメージングマーカーが特異的ではないことを示している。現在のところ、血管障害と神経変性疾患を確実に区別できる特異的な画像診断法や分子イメージングマーカー(PETリガンドなど)は存在しない。
脳小血管病の重症化と進行を定量化する
脳小血管病画像異常の定量的な測定は、横断的および縦断的研究だけでなく、臨床試験で疾患の負担と進行のマーカーとして提案されている。しかし、脳小血管病の定量化は困難である。視覚的評価は評価者間の信頼性が低く、白質肥大の体積測定は時間がかかり、臨床的障害との関連性は弱い(100)。
脳組織内の水分子の動きを定量化する拡散イメージングは、脳小血管病の負担と進行の完全自動評価に向けて大きな進歩を遂げている。脳小血管病患者では、従来のMRIスキャンでは正常に見える脳領域でも水の移動度が増加しており、この変化を定量化するために拡散テンソルイメージングが使用されるようになってきている(図5)。細胞外水分量の増加とWM繊維構造の変化が関与していると考えられている(101)。これらの変化は疾患特異的なものではないかもしれないが、拡散指標は有益なリスクマーカーであることが証明されている。病変や脳体積などの従来のマーカーと比較して、臨床的な障害や脳小血管病の進行との関連性がより強いことが示されている(102)。スケルトンベース解析(図5)やヒストグラム解析などの高度な後処理技術により、完全に自動化された方法で信頼性の高い定量化が可能となっている(103)。
急性心筋梗塞後の二次神経発生
最近の研究では、皮質下病変の遠隔効果に注目が集まっている。大脳皮質下病変の程度と皮質の厚さとの間に関連性があることが横断的研究で示されている(104)。プロスペクティブな研究では、皮質下病変の発生は、特に拡散トラクトグラフィによって同定された皮質の接続領域において皮質の菲薄化と関連していた(図5)(105)。これらの研究は、二次的な神経変性が脳小血管病における皮質萎縮の原因となっていることを明らかにし、将来の介入のターゲットとなる可能性を示唆している(106)。
コネクティビティとネットワークの萎縮
神経イメージングにより、血管性認知障害は脳ネットワーク障害である可能性があることが生体内試験で証明されている。安静時機能MRIによる脳小血管病の機能的接続性の評価は再現性が低いために困難であるが(107拡散イメージング、全脳トラクトグラフィ、ネットワーク構築を用いて構造的接続性を確実に決定することができる(図5)。グラフ理論解析により構造的ネットワークの特性を定量化することができ、最近の解析では、ネットワーク構造の変化が脳小血管病の神経画像病変と認知障害との関連性を合理的に説明できることが示されている(108)。特に、脳ネットワーク内の高度に相互接続された領域の集合であるリッチクラブの異常な組織化が認知障害に寄与していることが明らかになった(109)。二次性神経変性についても指摘されているように、これらの観察から、脳小血管病や血管性認知障害の局所的な病変からより広範な変化に注目が移ってきている(99)。
ここから先は、「マネジメント」のページである。
マネジメント
血管リスク因子をコントロールするための介入が認知症や認知機能低下のリスクを低下させるという無作為化比較試験(RCT)からのエビデンスは限られている(23,40,110,111)。SYST-EUR(Systolic Hypertension in Europe)試験では、血圧(BP)を8.3/3.8mmHg下げると認知症リスクがわずかに低下することが示された(112)。他の様々な試験では、認知症リスクや認知機能に対する血圧低下の有益な効果は示されていない(40,111)。しかし、最近発表されたSPRINT(Systolic Blood Pressure Intervention Trial)MIND試験では、心血管疾患のリスクが高いが糖尿病はなく、脳卒中の既往歴もない成人において、目標値140mmHg未満と比較して120mmHg未満に集中的にBPを下げることで、MCIとMCIまたは認知症の複合エンドポイントの両方のリスクが低下することが明らかになった(113)。興味深いことに、集中的なBP低下は、さらに脳MRI上の白質肥大の小さな増加と関連していた(113)。PROGRESS(Perindopril Protection Against Recurrent Stroke Study)では、脳血管疾患患者への積極的な治療は認知機能低下のリスクを19%低下させた(114)。しかし、脳卒中予防の二次試験では、BPの低下が認知症の発症リスクを低下させるというエビデンスはない(115)。同様に、高血糖症や糖尿病の治療が認知症や認知機能低下のリスクを低下させるというエビデンスはない(42)。しかし、複数の標的臓器に対する血糖コントロールの有益性は、リスク因子コントロールを推奨するために十分に文書化されている。Heart Protection StudyとPROSPER(PROspective Study of Pravastatin in the Elderly at Risk)試験では、スタチン治療は認知症の発症率と認知機能の低下に影響を与えなかった(116,117)。しかし、重要なことは、これらの試験ではいずれも認知機能を主要エンドポイントとしていなかったことである。さらに、多くの試験では認知症リスクの低い被験者を採用しており、治療期間が短く、フォローアップ期間が短く、脱落者が多く、脱落者の差によるバイアスの可能性がある(40)。
観察研究では、認知症予防のターゲットとして生活習慣因子が示唆されている。FABS(Fitness for the Aging Brain Study)では、主観的記憶障害のある成人を対象に6ヶ月間の身体活動プログラムを実施したところ、フォローアップ期間中(時間枠:18ヶ月)に認知力の中程度の改善が見られた(118)。対照的に、LIFE(Lifestyle Interventions and Independence for Elders)研究では、24ヶ月間の中程度の強度の身体活動プログラムを実施しても、座位の高い高齢者の健康教育プログラムと比較して、グローバルまたは領域別の認知機能の改善は見られなかった(119)。同様に、軽度から中等度の認知症患者を対象に実施されたDAPA(Dementia and Physical Activity)試験では、中等度から高強度の有酸素運動と筋力運動のトレーニングプログラムが認知機能の低下に有益な効果をもたらさないことが示された(120)。
また、観察データからは、禁煙が血管性認知症を含む認知症リスクを低下させることが示唆されている(121)。しかし、禁煙やもう一つの修飾可能な生活習慣因子である体重減少(40,111)が認知機能低下に及ぼす影響を検討した介入研究はない。教育レベルの低さは認知症リスクと関連しているが、教育や構造化された認知介入が疾患の進行に有益な効果をもたらすというエビデンスはない(23,40)。
PREDIMED (Prevención con Dieta Mediterránea)試験では、4年間の追跡調査の結果、認知機能が正常な高齢者ボランティアの認知機能にオリーブオイルやナッツ類を加えた地中海式食事の有益な効果が認められた(122)。しかし、この研究は、方法論の問題から結果の妥当性に疑問が生じたため、後に撤回され、再発表された(123)。地中海食の遵守はFINGER(Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability)の一部でもあり、この研究では被験者を多成分介入(血管リスクモニタリング、運動、栄養アドバイス、認知トレーニング)または一般的な健康アドバイスに無作為に割り付けた。介入群の患者では、認知機能スコアに中程度の改善がみられた(124)。しかし、他の2つの試験では、認知機能に対するマルチドメイン介入の有益性は示されていない(125,126)。また、記憶障害を訴える高齢者の認知機能低下に対する3つの多価不飽和脂肪酸補給の有益な効果は認められなかった(126)。
心房細動(AF)患者において、経口抗凝固療法は認知機能を温存する可能性がある。スウェーデンの病院で心房細動と診断された心房細動患者440,106人の登録データをレトロスペクティブに分析したところ、ベースラインでの経口抗凝固療法は認知症発症リスクを29%低下させることが明らかになった。観察期間の少なくとも80%以上の治療を受けていた患者は、経口抗凝固薬を服用していなかった患者に比べて認知症リスクが48%低かった(127)。この観察は、脳卒中予防の戦略が認知症予防にも有効であるという一般的な考え方を支持するものである。
前述のデータを考慮して、米国心臓協会/米国脳卒中協会は、最適な脳の健康を維持するためにLife’s simple 7(禁煙、目標レベルの身体活動、現在のガイドラインに沿った健康的な食事、体格指数<25kg/m2,血圧<120/80mmHg、総コレステロール<200mg/dl、空腹時血糖<100mg/dl)で健康状態をチェックすることを推奨しており(111危険因子管理に関する具体的な推奨事項を提供している(8,111)。
対症療法
血管性認知症の対症療法の戦略には、コリンエステラーゼ阻害薬(ガランタミン、ドネペジル、リバスチグミンN-メチルD-アスパラギン酸拮抗薬メマンチン、および各種漢方薬の処方が含まれる(25,128-130)。RCTでは、コリンエステラーゼ阻害薬とメマンチンの両方とも認知にわずかな効果を示した。しかし、ドネペジルを除いては、Clinician’ Global Impression of Change尺度、行動・機能尺度において有益な効果は認められず、血管性認知症におけるコリンエステラーゼ阻害薬とメマンチンの使用には疑問が残る結果となった(128)。それにもかかわらず、いくつかの専門家の声明やガイドラインでは、血管性認知症における認知機能の強化のためにドネペジルを検討することを推奨している(8)。血管性認知症における治療計画は、行動的・心理的症状、患者や介護者への支援、自立の最大化などの併存疾患にさらに取り組むべきである(23)。
疾患の進行をモニタリングするためのマーカー
血管性認知症/血管性認知障害の予防および治療試験は、補助的な転帰指標として機能し、認知機能低下の他の原因から血管性認知障害を区別するのに役立つ生物学的マーカーへの関心に火をつけてきた。提案されているマーカーには、脳MRI上の白質肥大の定量的および半定量的な測定値(95,131)、脳血管病変の負荷の複合スコア(132)、拡散テンソル画像から得られる指標(103)などがある。血管性認知障害に特異的な循環または脳脊髄液マーカーがない場合、バイオ流体の評価は疾患のモニタリングや診断のためには限られた価値しかないが、PET画像の場合と同様に、認知症の他の原因を除外するのに役立つかもしれない。
結論と今後の方向性
前節で検討したエビデンスは、脳の健康維持における神経血管機能の重要な役割と、加齢に伴う認知症への血管原因の重要な寄与を強調している。認知機能障害の血管性原因に対する関心の高まりは、いくつかの進歩をもたらした。臨床と画像診断の両方の基準に基づいた血管性認知障害と血管性認知症の新しい分類基準が開発され、認知機能障害を評価するためのより実用的なツールが導入された。また、血管性認知障害と血管性認知症の病理学的研究も進み、認知機能障害を誘発する脳微小血管系、特にWMに集中している病原因子について、よりニュアンスのある理解が得られてきている。これまでの神経病理学的研究では、これまであまり知られていなかった血管性認知障害や血管性認知症の原因となる脳病変の多様性や、神経変性疾患との共存が明らかにされていたが、脳イメージングの進歩により、これらの病変を生体内試験で検出し、脳の構造や機能に及ぼす影響を評価し、定量化することができるようになった。
これらの進歩にもかかわらず、いくつかの知識のギャップが残っている。
- 血管因子による認知機能障害の疫学は、他の認知症に比べて十分に理解されていない。ほとんどの研究は特定されていない認知症に焦点を当てており、血管性認知障害や血管性認知症の発生率や有病率に関する情報は不完全である。血管性認知障害の新しい分類システムが実際にどのように機能するのか、また血管性認知障害の疫学研究、特に集団レベルでの研究で使用できるのかどうかはまだ定義されていない。さらに、個々の患者の認知症リスクを予測するためのリスクモデルやスコアを開発することも重要である。この点では、新しい画像診断ツールの使用がリスク予測の助けになるかもしれない。
- 新しい診断法や治療法を開発するためには、血管性認知障害や血管性認知症の病態をより深く理解することが必要である。そのためには、新たなメカニズムの解明、バイオマーカーの開発、治療法の検証を行うために、ヒトの疾患をよりよく再現した動物モデルが必要である。ほとんどの研究では、脳血流の低下が認知に及ぼす影響に焦点が当てられている。しかし、神経血管機能の他の側面、特に内皮機能とプロテオスタシス(図3)の認知効果については、より深く研究する必要がある。
- また、早期診断や疾患進行のモニタリングのための信頼性の高いバイオマーカーの必要性も急務である。全身のBBB機能障害は疾患の初期マーカーとなる可能性があるが(59交絡因子の可能性を避けるために十分な規模の縦断的研究が必要であり、脳損傷に対するBBB漏出の寄与をよりよく理解し、バイオマーカーとしての役割を明確にする必要がある。
- 血管性認知障害と血管性認知症の管理は限られた進展しかなく、疾患を改善する治療法はない。アルツハイマー病の治療法開発における豊富な研究とは対照的に、血管性認知障害/血管性認知症における創薬努力は限られている。動物モデルで同定された病原性経路に基づいて「薬物化可能な」ターゲットを同定するためには、基礎科学者のコミュニティを巻き込んだ精力的な努力が必要である。そして、これらのターゲットを治療法に変換して臨床試験に供する必要がある。血管性認知障害とアルツハイマー病の病態が頻繁に重なり合っていることを考えると、そのような努力は確かに必要である。
- 危険因子のコントロールが疾患の臨床経過に影響を与えるという証拠は十分ではない。必要とされるのは、より長い治療とフォローアップを伴う十分なパワーのある予防試験である。1)認知試験の方法論的課題を考慮し、2)脳画像検査などの代替エンドポイントを伴う。このような試験は実現可能であるが、かなりのリソースが必要である。
- 神経病理学のセクションで強調されているように、高齢者の認知機能障害の多くは複数の病理学に起因するものであり、そのうち血管性のものは現在のところ治療可能で予防可能な唯一のものである。さらに、認知症と脳卒中は同じ危険因子を共有しており、脳卒中は認知症発症の可能性を倍増させる。実際、脳卒中の発症率の低下は、認知症の発症率の低下と同時に関連している(疫学の項を参照)。
- 疾患を改善する治療法がない場合、脳血管疾患を予防し、脳の健康を促進する対策は、世界の高齢化人口に影響を与える最も厄介な疾患の一つである急速に拡大する負担を抑えるために、現在利用可能な唯一の実行可能な選択肢である。
ハイライト
- 加齢に伴う認知症は世界的に驚くほど増加しており、2050年までに1億5000万人が発症すると推定されている。
- 脳血管の変化は認知症の主な原因であるが、アルツハイマー病の原因でもある。
- 病態生物学、予防、診断に関する新たな知見が出てきているが、治療法はまだない。
- 血管の健康を維持し、脳機能を維持することは、認知症の公衆衛生上の影響を緩和する可能性がある。
略語と略語
- AD アルツハイマー病
- ADL日常生活動作
- BBB血液脳関門
- CAA脳アミロイド血管症
- CBF脳血流
- ECM細胞外マトリックス
- エムシーアイ
- MoCA モントリオール認知評価
- NO一酸化窒素
- PSD脳卒中後認知症
- SIVaD 大脳皮質下虚血性血管性認知症
- 血管性認知症
- 血管性認知障害
- WMH 白質肥大