コンテンツ
pubmed.ncbi.nlm.nih.gov/21698487/
ジェラルド・M・マッジョーラ
オンライン公開:2011年6月23日
要旨
ドラッグディスカバリー研究において、還元主義は健在である。その伝統の中で、私たちは生物系をより小さく、より小さく研究するための実験手法や計算手法を継続的に改善していた。
- しかし、これまでの研究では、その成果は大きく改善されてきたとはいえ、私たちの努力はあまりにも狭い範囲に集中しすぎているのではなかろうか?
- 仮にこれらの手法からすべての誤差を取り除くことができたとしたら、効果的な医薬品を設計するための生体システムを十分に理解することができるではなかろうか。
- 現在、ほとんどの創薬研究は単一のターゲットに焦点を当てている。このプロセスを複数のターゲットに拡大すべきではないではなかろうか?
- このような方向での最近の取り組みは、ポリファーマコロジーという新たな分野につながっている。これは正しい方向に進んでいるように見えるが、どの程度のポリファーマコロジーで十分なのだろうか?
- ポリファーマコロジーの基礎となるプロセスの複雑さが増すにつれ、それらのプロセスとその相互関係を理解することができるようになるのではなかろうか?
- この課題を達成するためには、物理学や化学の研究ではあまり馴染みのない「新しい」数学が必要なのではなかろうか?
本論文では、これらの疑問のいくつかを取り上げ、創薬の難問に対する答えではなく、問題点や疑問に焦点を当てていく。
キーワード
生物学的還元主義 創発的性質 ヒエラルキー 薬物
序論
現代の生物学や薬物研究では、還元主義が健在である。その伝統の中で、私たちは生物学的システムのより小さな側面を研究するための実験方法や計算方法を絶えず改善していた。これは、長年にわたって科学を支配してきた還元主義的アプローチの究極の成功の象徴かもしれないが、その成功には代償がある。皮肉なことに、分子の構成要素の詳細が明らかになればなるほど、それらの構成要素に関連するメカニズムはより混乱する。私たちの努力は、あまりにも狭い範囲に集中しすぎているのではなかろうか?仮に、これらの方法からすべての誤差を取り除くことができたとしたら、生物学的システムを十分に理解して、より効果的な薬剤を設計することができるだろうか。答えはノーである可能性が高いと思われる。
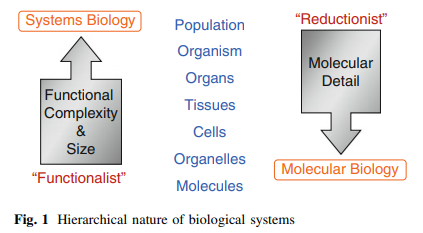
生物システムは、図1の青字で示したような階層構造を持っている。図の「還元主義」側では、分子生物学、細胞生物学、構造生物学の能力が飛躍的に向上したことで、機能が不明なタンパク質の構造を解くことができるようになった[1]。どのようにしても、我々は階層を下に移動すると、これらのエンティティが機能する内の生物学的論理環境の多くは”編集”されている。
このような詳細な構造の知識は、創薬プロセスを一新したが、それには代償があった。例えば、難解な創薬標的を代表するタンパク質は、様々な安定な細胞型で発現していたり、場合によっては無細胞系で発現していたりする。これらの環境が、標的が通常機能する生物学的環境を代表するものであるかどうかは、多くの場合、問題である。それにもかかわらず、システムが比較的単純であることから、多くのハイスループットスクリーニング(HTS)法が生まれており、広範囲の化合物のコレクションと相まって、科学者は生物学的に活性な化合物のために化学空間の広範囲の領域を採掘することができるようになっている。このブルートフォースアプローチは、活性化合物の同定には効果的であるが、真に新しい化学物質や医薬品の数を大幅に増やすことはできなかった。実際、1988年から 2004年までの間、承認された新規分子実体(NME)の数は20数個と比較的一定しており、非NMEや再利用医薬品の約半分の数にとどまっている。一方、研究費は1,000万ドルから4,000万ドル程度に急増している[2] 。
図1の機能主義側では、生物学的階層が上がるにつれて、機能が「再導入」され、システムの大きさと複雑さが増大する傾向にある。これは、システムを構成するすべての要素が一般的には知られていない、あるいは完全に理解されていないために、場合によっては研究が困難な場合もあるが、より現実的な状態を表している。しかし、これは機能主義的アプローチをボトムアップから適用しなければならないことを意味するものではない。複雑なシステムは、構成要素の機能を記述した理論的枠組み(すなわち理論)が存在しない限り、個々の構成要素の知識だけでは推論できない創発的な性質を示すため(後述)このようなアプローチは一般的には不可能である[3]2 。
現在、より高い階層の生物学的システムの研究が注目されていることから、古典的な薬理学、すなわち、生物学的現象を研究するために必要な知識や技術が再注目されているようである[4]。
- この推定値はPhRMA(Pharmaceutical Research and Manufacturers of America)によるものであることに注意してほしい。米国国立科学財団(National Science Foundation)の推計では、変化率はPhRMAの推計の半分強となっている。すべての推定値はコンスタントドルであり、インフレを除いたものである。
- ここでは、熱力学系に適用可能な例を紹介する。統計力学の理論的枠組みは、個々の分子のミクロな変数からマクロな変数(エンタルピー、自由エネルギー、圧力など)の値を決定するための手段(理論)を提供する。
この分野は数年前から衰退の一途をたどっていた [5] 。さらに、生物学、薬理学、医学をよりシステム的な視点から見ることで、長年の薬物研究を支配してきた古典的な1ターゲット1薬剤モデル(詳細は後述)を超えた薬物療法の新たな可能性が開けてくる[6, 7]。
この論文では、生物学的システムを研究するための化学的・物理的手法の開発と応用がもたらす課題について述べているのではない。むしろ、これらのシステムの性質に関連した問題と、なぜ医薬品研究に対する従来のアプローチが新薬の数を減少させる結果となったのかに関心を持っている。また、その結果として、生物学的・薬物研究における計算手法の役割の変化、新しいアプローチを提供するために計算手法がどのように役立つか、そしてなぜ計算手法が将来の研究に不可欠な役割を果たすのかについても言及している。
生物学的還元主義
基本的に還元主義的アプローチは、生物学的システムをその構成部分に分解して、その構成部分に よって引き起こされる生物学を理解しようとするものである[8]。科学の哲学者たちは、密接に関連しているとはいえ、生物学的還元主義には3つの異なるタイプがあると定義している [9] 。
生物学的還元主義に関する議論は長年続いており、化学や物理学の基礎となる法則が生物学を説明するのに十分かどうかに焦点が当てられていた。生物学的還元主義に対する最も率直で雄弁な批判者の一人であるマイケル・ポラニは、次のように簡潔に述べている [10]。
このような観察は、初期の段階では、生物学に対するバイタリスティックな見方、すなわち、化学や物理学では理解できない ある種の「生命力」が、生物システムの形成、繁殖、持続可能性に関与していることを暗示していたが、 後に述べるように、生物学を理解するためには、このような仮定は必要ない。
生物系を構成要素に分解するという還元主義的なアプローチが、生物系の化学的・物理的な基礎を説明する上で有効であったことには疑いの余地はない。しかし、現在では多くの生物学者が、生物系は非常に複雑であり、創発的なプロパティーを持っているため、このアプローチは限界に達していることを認識している[8](図参照)。ポラニー[10]([3]参照)が述べた「オルガナイジング原理」(または生物学の理論)の概念こそが、生物系の構成要素とそこから生じる性質との関係を特徴づけ、理解するための手段を提供しているのである(詳細は後述)。
創発的性質
創発的な特性を持つシステムの機能は、個々の部分を研究しても説明できないし、予測することさえできない。例えば、時計を考えてみよう。完全に解体された時計から部品の集合体を提示され、その機能を知らされなかった場合、時計を再構築するのは難しいであろう。創発的な性質のより劇的な例を図 2 に示す。図の左は色のついたレゴの山、右はアンディ・キャロルがレゴで作ったバベッジ差分エンジンの模型で、関数f(x) = ax2 ? bx ? c for x = 0, 1, 2, 3, …,nを3桁の精度で評価している[11]。左の矢印は還元主義の方向を示し、右の矢印は関数主義の方向を示す。明らかに、バベッジ差分エンジンを分解するのは比較的簡単な作業である。しかし、バベッジ差分エンジンをその構成部分から再構築することは、その目的とする機能についての知識がない限り、簡単な作業ではないし、そうであっても非常に難しいかもしれない。
このことから、アナログシステムという概念が浮かび上がってく。図3はバベッジ差分エンジンの他の実装を示している。これらは同じ機能を持っているので、図2に示したものと類似している。時計の例に戻ると、見た目は全く異なるが、時間を伝える時計の類似体はいくつか考えられる。後述するように、アナログシステムの概念は、生物学における退化系の概念と似ている。
最後の例は関数推定である。よく知られているように、多くの数学的関数は、基底関数と呼ばれる他の関数の線形の組み合わせで表すことができる。これらの関数の集合は,以下の式に示されるように,それぞれ他の関数とは形が異なる.この例は、上記の考察で指摘した2つの点を表している。第一に、基底関数のセットは、どのような関数が推定されるべきかを知らない限り、効果がない。第二に、異なる基底関数の集合は、例えば上述のバベッジ差分エンジンのアナログ表現に似ていると考えることができる。これらの例は、類似した方法で動作するシステムは、それらが構築される正確な方法で類似している必要はないという事実を示している。
これまでの議論をまとめると (1) 同じ機能を表現する方法はたくさんある、(2) 与えられた機能は、あるレベルでその構成部分に分解(”縮小”)される可能性がある、(3) 理論や機能原理が知られていない限り、一般的にはその逆のプロセスは不可能である、ということである。
自然の法則
図2 個々のレゴからバベッジ差分エンジンを構築した場合の創発的な特性(計算能力)を示す図 [9]
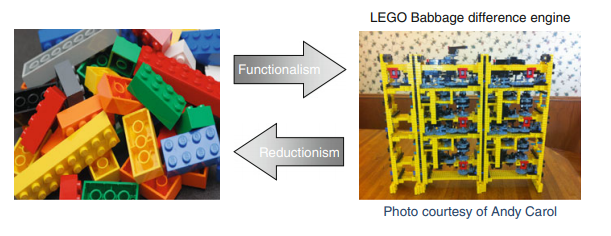
図3 バベッジ差分エンジンの他の実現方法

図4 a
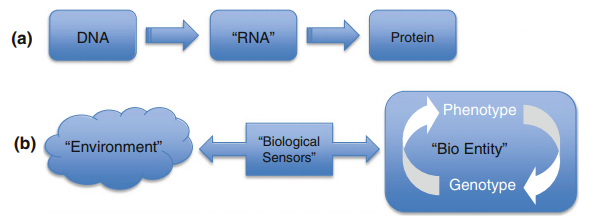
「分子生物学の中心的ドグマ」に代表される直線的な関係、すなわち、遺伝情報の流れは、DNA ? RNA (いくつかの形態) ? b 「環境」とその中に存在する「生物学的実体」(器官、器官、細胞、…)との間のより現実的な関係を示している。様々な”生物学的センサー”が相互作用を媒介している。全体的な生物学的システムは、重要な非線形挙動とフィードバック制御を持つ、非常に複雑でオープンなシステムである。12]からの引用
生物学には、それに匹敵するほど単純な法則は存在しない。「生物学の法則」が存在するとしても、それは本質的に複雑なものである。例えば、分子生物学の中心的なドグマである DNA ? RNA ? タンパク質という分子生物学の中心的なドグマは、「生物学的現実」とは一致しない。図4は、この点をより詳細に示している。図の(a)の部分から、DNA、RNA、タンパク質の間の直線的な関係が極端に単純化されすぎていることがわかる。(b)は、生物系の遺伝子型と表現型の関係について、より現実的なモデルを示している。示されているように、細胞の、より一般的には生物の表現型はゲノムおよびエピジェネティックな現象の影響を受けており、後者は環境を感知してシステムが実行できる機能に影響を与えることができる様々な生物学的センサーとリンクしている[12]。このように、細胞や生物のゲノムに関する知識だけでは、存在の初期段階から、発生から成熟、そして最終的には死に至るまでの生物学を理解するには、明らかに不十分である。実際には、その完全なプロテオームまたはその多くの可能な”-ome’s”のいずれかを知っていても、まだ不十分である[13-15]。必要とされるものは、最低限、細胞や生物の分子、高分子、および超分子コンポーネントの相互関係を描いた階層的なフレームワーク内の様々なomicsコンポーネントのすべてを統合し、より多くのシステム指向のビューである。これは、有名な生物数学者ニコラスRashevsky [16]による以前の引用を展開している。
これまで見てきたように、個々の細胞の集合体としての生命の理論を構築する目的で、生物学的現象の数学的モデルで使用されている物理的な原理を直接適用しても、実りあるものにはなりそうにない。私たちは、関係するさまざまな物理現象を結びつけ、生物と有機世界の全体としての生物学的一体性を表現する原理を探さなければならない。
上で述べた生物学的システムのより詳細な説明は、正しい方向への一歩ではあるが、完全な理解に不可欠な要素がいくつか省略されている。したがって、このようなシステムを完全に詳細に扱うことは、控えめに言っても困難な挑戦である。幸いなことに、すべてのケースでそうすることが必要なわけではないし、おそらく望ましいことでさえある。むしろ、調査したい現象に関連した階層的なレベルで発生するプロセスを記述するために、十分に詳細なモデル [17] を開発することが課題となる。状況に応じて、これらのレベルで構築されたモデルは、完全に分子的な用語で記述する必要はない。むしろ、「ブラックボックス」または「グレーボックス」形式 [18] を用いて開発することができ、各ボックスは、適切な入力セットによって活性化され、適切な出力セットを提供する特定の生物学的機能(または機能)をシミュレートする。
なぜ生物学的システムは研究が難しいのではなかろうか?
生物系の研究が難しいのは、次のような理由があるからである。
- (1)構成要素の数や種類、それらをつなぐ相互作用の種類や強さ、それらが組み込まれた階層構造(上図参照)などが複雑であること、
- (2)創発性を有すること、
- (3)冗長性や縮退性を示すこと、
- (4)サブシステムのモジュール性を示すこと、
- (5)開放的で安定な非平衡系であること、
- (6)顕著な非線形挙動を示すこと、
などである。
これらの特徴の多くはよく知られており、いくつかはすでに言及されている。しかし、縮退性の概念は冗長性の概念とは全く異なり、一般的にはあまり知られていない[19]。生物学的システムにおける冗長性とは、あるサブシステムが不活性化しても、他のサブシステムが必要な機能を実行できるように、同じサブシステムの複数のコピーを指す。一方、縮退性とは、複数の異なるサブシステムが同じ機能を効果的に実行できる状態を指す。これは先に述べたように、アナログシステムの概念と密接に関係している。実際、生物学的システムに縮退性があるということは、私たちの知らないサブシステムが存在しても、私たちが認識しているサブシステムと類似の機能を発揮できる可能性があるということを意味している。したがって、ノックアウト法、ノックイン法、条件付き突然変異法 [20] を用いて遺伝子機能を直接改変したり、siRNAや関連する方法 [21] を用いて遺伝子機能を改変したりしても、必ずしも期待通りの結果が得られるとは限らない。このことは、場合によっては、システム生物学における効果的なモデルの開発に深刻な課題となることがある。
生体システムを理解するためには何が必要か?生化学者でありシステム生物学者でもある Leroy Hood [22] によれば、以下のように述べている。
複雑な生物学的システムを真に理解するためには、これらの階層のそれぞれからグローバルなデータセットを収集し、それらを統合することで、システムを首尾一貫した形で理解する必要がある。
このようなアプローチで必要とされる膨大な量のデータを得るためには、生物学に対する高度に機械化されたハイスル ープットなアプローチの必要性を示唆している。適切なアッセイ法の開発には大きな進展があったが、このようなアプローチの有用性を低下させる重大な要因が存在する。それは、イニシャルコストや継続的なコストが高いこと、データを中心としたもので、 仮説に基づいたアプローチではないこと(参考文献[15])そして私が「ここにはどこかにポニーがいるに違いない」と 呼んでいるものが暗黙のうちに使われていることなどである4 。
驚くことではないが、ハイスループット、データ駆動型の研究には、生物学の産業化、ひいてはアッ プライン・サイエンスへの移行という隠れたコストが存在する。このような傾向があまりにも長く続くと、効果的な研究環境を確保するために必要な要件に反し、研究の生産性に長期的な影 響を及ぼすことになる。また、このような大規模な研究からどれだけ生物学を理解できるかという点でも、いくつかの問題がある。
- 生物学は今や「データが豊富な」科学となっている [13, 15, 23]。データが多いことは良いことなのか悪いことなのか?
- 実験が行われている環境は、モデル化されている生物系の実際の環境を正確に表しているのだろうか?
- 収集されたデータのほとんどは時間に依存しないものであるが、時間依存効果(複数のタイムス ケール、イベントシーケンス、閾値効果など)はどの程度重要であるか?
- 真の細胞濃度はかなり低い傾向にあるが、どのようにして適切にモデル化できるのではなかろうか?
- また、細胞、小器官、器官、生物の微小環境は非常に不均質であるが、これをどのようにモデル化するのか?変数の数が多いので、偶然の相関関係は実質的な問題なのか?
- このような大規模で、ノイズが多く、おそらく疎なデータセットの中で、パターンを見つけることができるのではなかろうか?
- このような大規模で複雑なシステムをモデル化するのに十分な精度のデータを得ることができるのではなかろうか?
結果を理解できるだろうか?これらの要因をすべて考慮する必要があるかどうかにかかわらず、生物学的システムやサブシステムの複雑で計算可能な拡張可能なモデルを開発して扱う能力が、今後の生物学的研究や薬物研究の進歩にとって最も重要であることは明らかである。生物学的システムやサブシステムの効果的なモデルを開発するための潜在的な障害をすべて考慮すると、それにもかかわらず、かなりの最近の活動が行われている[24, 34]。
4 この話には多くのバージョンがあるが、基本的には以下のようになる。6歳の双子の男の子の両親は、彼らが極端な個性を 発達していることを心配している。一人は完全な悲観主義者で、もう一人は完全な楽観主義者であるように見える。そこで両親は彼らを精神科医に連れて行く。まず、精神科医は悲観主義者を治療する。彼は彼の精神を持ち上げるためにおもちゃのすべての種類で満たされた部屋に彼を取るが、代わりに喜んでいるのではなく、少年は泣き始めた。彼が泣いていた理由を尋ねられると、少年は 「ぼくはおもちゃで遊ぶなら、ぼくはたぶんそれらを壊すと思う」と答える。精神科医はその後、馬の糞で満たされた部屋に彼を取ることによって、彼の見通しを減衰させようと、彼の弟を治療する。彼の兄弟とは異なり、少年は完全に喜んでおり、彼の素手で糞尿を掘り始める。驚いた精神科医は少年に何をしているのかと尋ねると、少年は「この部屋には馬の糞がいっぱいあるから、どこかにポニーがいるに違いない」と答えた。
図5 Yildirimら[26]の研究から引用した薬物標的(DT)ネットワーク
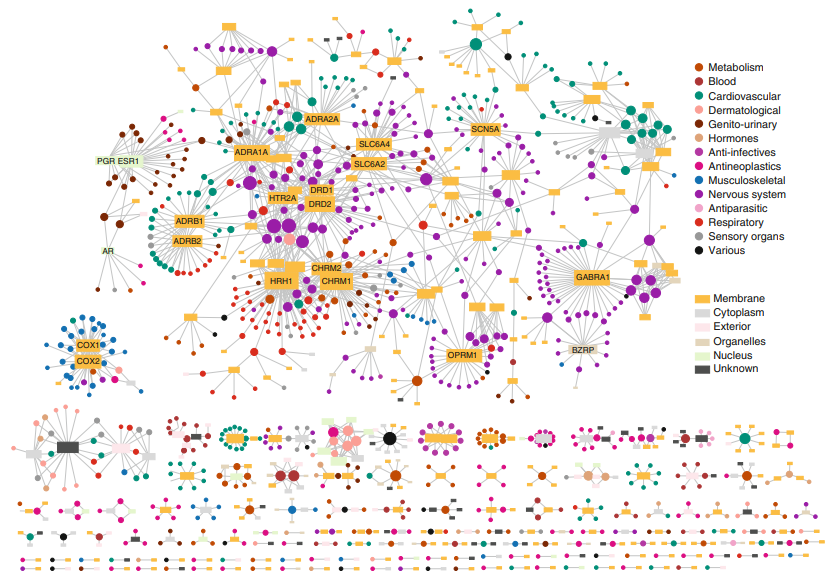
このネットワーク(二部グラフ)は、FDA承認薬と既知の標的タンパク質との関連付けから構築されている。リンクは、薬剤のノード(解剖学的治療化学分類に応じて色づけされた円で塗りつぶされている)と、その既知の標的タンパク質のそれぞれ(Gene Ontologyデータベースから得られた細胞成分に応じて色づけされた長方形で塗りつぶされている)との間に描かれている。各薬剤(タンパク質)ノードの大きさは、それが相互作用する数のターゲット(薬剤)に比例する。許可を得て転載
重要な点は、計算モデルと実験モデルはどちらも本質的に不完全であるということである。このことは、生物系の計算モデルに関してはよく理解されているが、実験モデルを扱う場合には必ずしもそうではない。例えば、多くの研究でよく知られているように、マウスは生きたシステムであり、ヒトと同等の機能をいくつか持っているにもかかわらず、マウスは必ずしも上位種のモデルに適しているとは限らない[25]。したがって、細胞や臓器、動物全体を対象とした実験が実験室で行われているからといって、コンピュータ上で行われているこれらのシステムの数理モデルに基づいた実験よりも、必ずしも関連性が高いと考えるべきではない。
新薬はどこにあるのか?
序文[2]で述べたように、1988年から 2004年までに承認されたNMEの数は約20と比較的一定しており、これは同期間に開発された非NME薬や再利用薬の数の半分に相当する。それにもかかわらず、研究費は1,000万ドルから4,000万ドルへと急増している。何が問題なのか?多くの分析がなされているが、現在の医薬品研究を支配している還元主義的なアプローチが一役買っていることは明らかである。では、どうすればよいのではなかろうか?図1に示すように、創薬研究は、より多くの生物学を薬学研究に投入することで、よりシステム生物学的なアプローチに移行していく必要がある。そして、これは実際に起こっていることである。例えば、医薬品と標的タンパク質(および遺伝子)との間の多くの関係を特徴づけるネットワークモデルが数多く開発されている[26-31]。これらのネットワークは、長年知られているように、ほとんどの薬物が複数の標的と物理的に相互作用していることを明確に示している。図5は、そのようなネットワークの一例を示している。
さらに、今日のコンピュータの能力の向上により、様々な生物学的プロセスをシミュレートするように設計された様々な洗練されたモデルを開発することが可能になった[4, 32]。また、より信頼性の高い動物モデルやより効果的なバイオマーカーの開発と相まって、「クラスシカル」な薬理学が再登場している[33]。臨床研究の重要性も高まっている[34]。
これらすべてが、図6に示されているような新たなパラダイムシフトをさらに促進するものである。旧来の単剤・単標的モデルは、やむを得ずとはいえ、単剤・単標的モデルや多剤・単標的モデルに基づく新しいモデルへと移行しつつある。オミックス技術の増加と、それに対応する生物学的ネットワークやシステム生物学への関心の高まりが、この変化を促している。とはいえ、単一薬物、単一標的のパラダイムは、複数の標的を攻撃する乱雑な「ダーティドラッグ」よりも、高い特異性をもって単一の標的を攻撃する薬物の方が望ましいという考えに基づいており、現在の研究努力はいまだに支配的である[35]。しかし、「標的外効果」に対する意識の高まり[36]により、この考え方は変わりつつあり、かつてダーティドラッグと呼ばれていたものが、現在では多機能ドラッグと呼ばれるようになってきている。このような薬剤は、精神薬理学をはじめとする多くの治療領域で応用が広がり、多剤併用が増加している[37]。より広い視野では、ポリファーマコロジーという有望な新しい分野が、単一または複数の薬剤が複数の標的と相互作用する実際の事例をより体系的に記録し始めており[27, 29]、これはさらに合理的なドラッグデザインの分野にまで拡大されている[28]。
「新しい」生物学における計算手法の役割とは何ではなかろうか?
物理学では理論的手法と計算機的手法が長い歴史を持っているが、化学や生物学ではそうではない。しかし、状況は変化しつつあり、ここ10年の間に計算化学と生物学の論文が大量に発表されている。このような論文数の増加傾向は、一向に衰える気配がないが、その原因はそれだけではないにせよ、いくつかの要因が考えられる。(1) デスクトップでも利用可能なコンピュータの能力が驚異的に向上したこと、(2) 多様化する化学・生物学的実験によって生成される膨大な量のデータを扱う必要があること、(3) データ内の関係性を発見して解明する必要があること、そして最終的には(4) データを説明する化学・生物学的モデルを構築する必要があること、である。
コンピュータの能力の向上により、数年前には想像もできなかった規模の計算が可能になったが、それだけでは十分ではない。数学者のジョン・キャスティの言葉を借りれば、「生物学を完全に理解するためには、従来の物理学や化学で用いられてきた数学に加えて、新たな数学が必要である」 (38)。数学者、コンピュータ科学者、統計学者、エンジニア、さらには社会学者までもがこの要請に応え、階層のあらゆるレ ベルで生物学的システムを研究するための豊富なフレームワークを提供していた。これらの手法には、グラフ、ハイパーグラフ、ネットワーク(確率的なものを含む)多様なパターン認識と機械学習の手法、連続的、離散的、確率的な生物学的シミュレーション、計算的意思決定理論などが含まれている。
これらの手法の影響は劇的であるが、多くの課題が残されている。その中でも特に重要なのは、生物学的システムのサイズと複雑さ、そしてその結果として生じる詳細な情報の量に関連する問題である。ファジィ集合理論とファジィ論理の父として知られる Lofti Zadeh の言葉を借りるならば、「情報量が増えれば増えるほど、それを効果的に扱うことができる詳細さのレベルは低下する」ということになる。
タンパク質のダイナミクスのシミュレーションからの適切な類推が思い浮かぶ。分子の詳細さのレベルが維持されている場合、つまり水素原子を含むすべての原子が明示的に説明されている場合、観察される最も一般的な運動は、ハイドロゲンの比較的高速で生物学的に興味のない運動に関連したものである。シミュレーションを非常に長い時間にわたって行わない限り、より興味深い大規模なコンフォーマル変化は観測されない。この問題は、単純な「ボールとバネ」モデルを用いてタンパク質の構造的特徴を単純化することで解決されていた。このようなモデルは、多くの生化学的プロセスのメカニズムに関連する比較的ゆっくりとした構造変化を特徴づけることに成功していた。
さらに、生物学的システムが生成することができる膨大な量の詳細情報によって生じる問題に加えて、ほとんどの生物学的実験で収集された情報が程度の差こそあれ、不正確で不確実なものであるという事実から、さらに大きな問題が生じる可能性がある。そのため、このような情報を扱うことができる追加の数学的手法が必要とされている。ソフトコンピューティング手法は、この目標を達成するための潜在的な手段を提供している[39]。Lofti Zadeh [40, 41]を再び言い換える。
ソフトコンピューティングは、不確実性と不正確性のある環境で推論し、学習する人間の心の驚くべき能力に匹敵する、計算に対する新たなアプローチである。
ソフトコンピューティングに関連する手法には、ファジィ集合理論とファジィ論理 [42, 43]、ニューラルネットワーク [44]、確率的推論 [45]、遺伝的アルゴリズムと進化的アルゴリズム [46]、信念ネットワーク [47]、大まかな集合理論 [48]、およびグラニュラーコンピューティング [49] などがある。これらの手法のいくつかはここ10年ほどの間に飛躍的な成長を遂げていたが、ニューラルネットワークと遺伝的/進化的アルゴリズムを除いて、生物学的問題に実質的な方法で適用されたものはほとんどない。したがって、ファジィ数学や粗集合理論に関連するような他の方法論のいくつかを生物学的問題に適用する時期が来ているのである。
まとめと結論
生物学的還元主義の概念は、長年にわたって私たちの役に立っていたが、その代償が明らかになりつつある。過去数十年の間に細胞生物学者、化学生物学者、構造生物学者によって発見された優雅な詳細は、この方向への努力に拍車をかけていたが、生物システムの全体的な機能的側面にもっと注意を払う必要があることが明らかになりつつある。生命システムを構成要素に分解するのは簡単であるが、複雑で創発的な性質を持っているため、再構成されたシステムが何を達成しようとしているのかをある程度理解していないと、再構成することは困難である。しかし、研究対象となるシステムの理論的枠組みが存在すれば、ボトムアップ的なアプローチはある程度可能である[3]。
関連する問題は、生物学的システムを支配するすべての法則が物理学や化学の法則に含まれているのか、それとも生物学的システムに特有の法則が存在するのかということである。このような法則は、かつてはバイタリズムの概念、すなわち、生物学的システムの根底にある原理は、純粋に物理化学的システムを支配するものを超えているという概念と結びついていた。これは、生物学的システムは自然のシステムであり、したがって、自然科学を支配する法則によって支配されるべきであるという考え方と矛盾しているように思われる。
例えば、分子生物学の中心的なドグマ(図4a)を考えてみよう。DNA ? RNA} ? タンパク質である。物理学や化学の法則は、これらすべての分子の構造や相互作用を理解するための基礎を提供してくれるが、これらの法則だけでは、これらの分子がセントラル・ドグマに関連して実行する機能、すなわち、DNAの特定の塩基配列から対応するタンパク質の特定のアミノ酸配列への情報の伝達を説明することはできない。しかし、セントラル・ドグマは、生物学的現実よりもさらに単純なものであり、遺伝子型や表現型の要因が、一連の「生物学的センサー」(図4b)を通じて、システムが存在する「環境」と相互に結びつく、より複雑な関係のセットを必要としている。
薬物が投与される生物学的システムにどのような影響を与え、その影響を受けているかを把握するためには、生物学的システムの階層的な性質と、その構成要素間の多くの複雑な相互作用を考慮に入れた、よりシステム指向のアプローチが必要であることは明らかである。これは、現代の実験的生物学的研究や臨床研究で使用されている数多くの方法と密接に連携して、計算生物学のツール(例えば、細胞シミュレーション)を使用して初めて達成できるものである。
なぜなら、これらのシステム、特に哺乳類や霊長類のシステムは複雑であり、人間の頭ではこれらのシステムの多くの特徴を把握することができないからである。生物学的経路の漫画の中の情報でさえ、役に立つとはいえ、完全に把握するには複雑すぎることがある。さらに、時間依存性のあるプロセスや閾値効果、不均一な環境要因など、研究対象の生物学的機能を理解する上で重要な情報は、通常は無視されている。
この点で、生物学的システムは、意味のある結果を得るためには、小さな相互作用が非常に多く、適切に説明しなければならないため、研究が特に困難である。単純で、ほとんど些細な例として、タンパク質の三次構造の予測がある。折りたたみには支配的な相互作用が存在しないため、各項の小さな誤差が積み重なって大きな誤差になる可能性があるため、多くの小さな相互作用を確実に正確に説明しなければならない。特に、タンパク質の構造を構成する要素間の多くの相互作用を正確に説明しなければならず、また、タンパク質が存在する生物学的環境から生じる微小環境要因も考慮する必要があることを考えると、このような正確さを得ることは実際には困難である。
実験技術や計算技術を強化することは重要だが、単一の方法では生体システムを確実に理解することはできない。創薬研究の「銀の弾丸」に相当するもの、すなわち、創薬と開発のプロセスで直面しなければならない多くの障害を克服できるほど強力な結果が得られる単一の方法を見つけるために、何百万ドルもの投資が行われていた。コンビナトリアルケミストリーの導入にまつわる誇大広告を思い出してほしい。過去20年間に誇大宣伝された技術の例は他にもたくさんあり、実現できない非現実的な期待につながり、最終的にはその技術のさらなる使用への抵抗となっている。このサイクルは今日も繰り返されている。Bezdek [50] は、図 7 に示すように、彼が言うところの「テクノロジー・サイクル」をうまく概念化している。最初は、新しい技術は一般的に、「誇大広告のピーク」に達するまでの間に、「内なる幸福感」を 呼び起こすものである。しかし、どのような新技術であっても、基本的にはその誇大広告に応えることができないため、必然的に「未熟な技術に対する過剰反応」が起こり、それが「皮肉の深み」へと必然的に陥るのである。ゆっくりと”現実の漸近表”に近づくにつれて”真のユーザーベネフィット”が現れ始める。
最終的には、生物システムの理解は、計算と実験の両方の方法を含む全体的なアプローチから得られることになる。私たちは今、生物学研究全般、特に創薬の分野でエキサイティングな新しい段階に入っており、生物学的システムをより根本的に理解するために必要な多くのツールを手に入れている。しかし、システム生物学的アプローチへのパラダイムシフトを完全に達成するには、どのくらいの時間がかかるのではなかろうか。
