コンテンツ
www.ncbi.nlm.nih.gov/pmc/articles/PMC7399198/
Front Cell Infect Microbiol. 2020; 10: 359.
オンライン公開 2020 Jul 28.
カイユー・チャン、1シン・リー、1チェン・ユー、1ヤン・ワン1,2,2,※1
要旨
バイオフィルムは、生物学的または非生物学的表面に付着し、自己産生された細胞外マトリックスに囲まれた微生物の共同体である。バイオフィルム内の細胞は、プランクトン細胞とは異なる固有の特性を有している。抗菌剤に対するバイオフィルム耐性は、ますます注目されている。
医療器具や組織に付着したバイオフィルムは、抗生物質による治療がうまくいかない主な原因であり、多くの慢性感染症を引き起こすことが知られている。バイオフィルムの根絶は、非常に困難な課題である。多くの研究者がバイオフィルムに関連する感染症に取り組んでおり、いくつかの新しい戦略が開発され、有効かつ有望であることが確認されている。しかしながら、これらの戦略の将来性を評価するためには、より多くの前臨床試験や適切にデザインされた多施設共同臨床試験が決定的に必要である。
ここでは、バイオフィルムの薬剤耐性の基礎となるメカニズムに関する情報をレビューし、微生物バイオフィルムに対する代替療法と有望な戦略に関する最近の進展について議論する。また、これらの戦略の長所と短所についても詳しくまとめている。
キーワード:バイオフィルム,抗生物質耐性,抗菌ペプチド,ナノテクノロジー,併用療法
はじめに
ほとんどの微生物は、周囲の環境に適応し、宿主の免疫反応や抗菌処理に対して活性を維持するために、いくつかのタイプの生存メカニズムを発達させている。バイオフィルムは、生物的または非生物的表面に付着し、細胞外高分子物質(EPS)からなるマトリックスに囲まれた微生物群である(図1A)(Fulaz et al.、2019)。
微生物バイオフィルム群内の微生物の代謝活性、遺伝的適応、コミュニケーションは変化する(Singh et al.、2017)。バイオフィルムは様々な感染症に存在し、ヒトの疾患において重要な役割を果たすことが実証されている。バイオフィルムは、薬剤や宿主の免疫反応に対する物理的な障壁として機能し、抗菌剤治療に対する耐性をもたらす。
バイオフィルムは明らかに感染症根絶の可能性を低下させ、従来の適切な治療後の再発の原因となる。バイオフィルム関連感染症の発症は、重篤な症状だけでなく、死亡率も増加させる(Tascini et al.、2018)。微生物のバイオフィルムを除去する戦略に焦点を当てた研究が増えていることを考えると、感染症におけるバイオフィルムの役割をより深く理解し、発表された文献に報告されている最新の有望な抗バイオフィルム戦略を慎重に評価する時期に来ていると言えるだろう。
ここでは、バイオフィルム薬剤耐性のメカニズムに関する情報と、微生物バイオフィルムに対する代替療法と有望な戦略に関する最近の進歩について概説する。また、これらの戦略の長所と短所についても詳しくまとめている。
図1 バイオフィルム形成の模式図
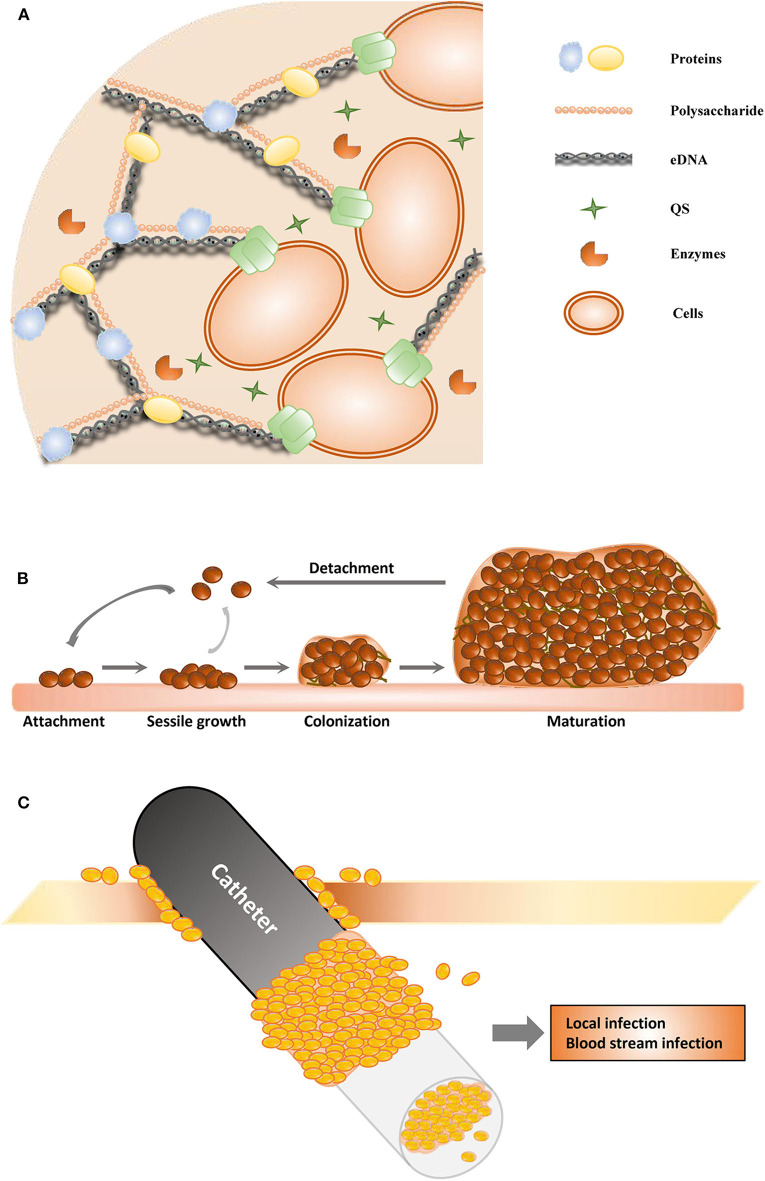
(A)細胞外高分子物質の構造。(B)バイオフィルムの段階。
(C)カテーテル関連バイオフィルム
バイオフィルムと感染症におけるその役割
バイオフィルムの形成
バイオフィルムは一部の病原性微生物の重要な病原因子であり、一部のバイオフィルム感染症は根絶がほぼ不可能と思われる(Zarnowskiら、2014)。ほとんどの細菌および真菌、例えば、緑膿菌(Olivaresら、2020)、表皮ブドウ球菌(Sabaté Brescóら、2017)、カンジダ・アルビカンス(Tuiら、2016)、アシネトバクター・バウマニ(Ezeら、2018)、ヘリコバクター・ピロリ(Yonezawaら、, 2015)、Staphylococcus aureus(Moormeier and Bayles, 2017)、Listeria monocytogenes(Barbosa et al., 2013)、Vibrio cholerae(Bridges and Bassler, 2019)、およびSalmonella Enterica(Fàbrega et al., 2014)は、バイオフィルムを形成する可能性がある。これらの微生物はすべて同様の方法でバイオフィルムを形成し、多くの共通の特徴を有している(Koo et al., 2017; Moormeier and Bayles, 2017; Cavalheiro and Teixeira, 2018)。
バイオフィルムは最も重要な健康上の脅威の1つであり、難治性院内感染症の約80%を引き起こしている(Jamal et al.)バイオフィルム関連感染症は、医療機器関連バイオフィルム感染症と組織関連バイオフィルム感染症に分けられる(Römlingら、2014年)。
この2種類のバイオフィルム関連感染症の詳細については、次節で説明する。ほとんどの病原性微生物は、尿道カテーテル、歯科矯正器具、ペースメーカー、心臓血管弁、コンタクトレンズ、乳房インプラントなどの医療機器に関連する感染症に関連している(Percivalら、2015b)。
バイオフィルムの成熟過程は複雑であり、様々な過酷な環境での生存のために時に特徴的である(O’Toole et al.、2000)。一般に、成熟したバイオフィルムは、様々な生物学的または非生物学的表面に付着した微生物の集団またはコミュニティとみなすことができる。
バイオフィルムは、単一または複数の微生物種から構成されることができる。生物学的表面とは、食品表面、家庭内や公共の場の表面などであり、これらの生物学的表面は感染の温床となり得る(Lappin-Scott and Bass, 2001)。
微生物は、栄養や抗生物質処理などの特定の環境圧力により、バイオフィルム形成を開始する。細胞は、疎水性相互作用を介して、あるいはカテーテルやインプラントを取り囲む宿主マトリックスタンパク質のような特定の方法で表面タンパク質に結合することによって、表面に付着する。
バイオフィルムの形成には、主に3つの段階がある(図1B)。第1段階(接着段階)では、細胞が表面に付着し、第2段階(無柄成長段階)では、これらの細胞の集合体がマイクロコロニーを形成する。付着段階と無柄成長段階は可逆的であり、細胞は緩く群がることができるが、剥離してプランクトン状態に戻ることができる(Kumar et al.)。
そして、付着した細胞は、細胞外DNA(eDNA)、タンパク質、多糖類を含むEPSを分泌し(図1A)、第3ステージでバイオフィルムを形成するように発達する。この段階は不可逆的である。バイオフィルム形成の第3段階では、細胞は厚く安定した複雑な生体分子層内に付着している(Roy et al.、2018)。完全に成熟したバイオフィルムは、3次元の塔状構造のように見え、中の細胞にシェルターを提供する。
バイオフィルムが完全に発達した後、その分散または分解は、能動的および機械的なプロセスの両方を介して行われる。これらのプロセスは、第4段階(分散段階)で発生する。バイオフィルム内の細胞は、細胞-細胞-接着マトリックス成分だけでなく、フェノール可溶性モジュリン、プロテアーゼ、ヌクレアーゼ、レギュレーターなどの破壊因子も分泌する(Graf et al.、2019)。
これらの破壊因子は、バイオフィルムの剥離を促進することもできる。剥離の過程で、バイオフィルムは個々の細胞を脱落させ、断片を血流や周辺組織に流し、多くの急性および慢性感染症に関連する(Davies, 2003)。
* *
バイオフィルム内の微生物の組織は、構成する細胞に、独立して増殖する個々の細胞や液体培地中の浮遊性集団では区別できないいくつかの特性を付与する。さらに、これらの活動の多くは、EPS内の混合種機能集団の形成に関連し、他のものは、構成細胞の代謝を制御するバイオフィルム内の物理化学的勾配の形成に関連するものである。
バイオフィルムは、プランクトン細胞、表面に付着した細胞、成熟したバイオフィルムの中で、生物学的サイクルの中で最も安定した状態であり、特に困難な状況においてその状態を維持する。このバイオフィルムは、栄養分が豊富なときには成長を続けるが、栄養分が不足するとプランクトン型に移行する。
異なる微生物のバイオフィルムは、バイオフィルムの発達段階が似ており、保護カバーとして同様の役割を示す、例えば、P. aeruginosa (Olivares et al., 2020), S. epidermidis (Sabaté Brescó et al., 2017), and C. albicans (Tsui et al., 2016) biofilmsがそうである。
微生物が自由生活モードとバイオフィルム成長モードの間で切り替わるとき、微生物の合成および代謝特性は変化し得る(Bell, 2001)。バイオフィルム内では、異なる表現型と遺伝子型を持つ細胞が、個々の代謝経路、ストレス応答、および他の異なる生物学的特性を共発現する。
一部の細胞は、バイオフィルム群内での成長を感知した後、細胞外多糖やオルガネラの産生、さらには細胞の形態を変化させる。バイオフィルム内の集団は複雑で、化学的、生理的、遺伝的な不均質性を示している(Stewart and Franklin, 2008)。
ほとんどの研究は、単一の微生物によって形成されるバイオフィルムに焦点を当てているが、口腔内の複数種バイオフィルムのように、複数の微生物種がバイオフィルム内に存在することもある(Kolenbrander et al.)。
バイオフィルム内の複数の微生物種の間では、細胞外マトリックスを介した細胞間の直接接触なしに、DNAの移動と遺伝子の組み換えが起こる。抗生物質耐性遺伝子は、このような方法で伝達される可能性がある(Kolenbrander et al.、2010)。
クオラムセンシング(QS)は、複数の生理的・生化学的機能を制御する細胞間コミュニケーションプロセスである。初期の研究では、QSが緑膿菌のバイオフィルムの形成制御に関与していることが示された(Davies et al.)QSシグナル分子は低分子であり、アシルホモセリンラクトン(AHL)、オートインデューサーペプチド、オートインデューサー-2、シス不飽和脂肪酸(DSFファミリーシグナル)など幅広い化学クラスに属している構造をしている。AHLの産生は1998年にバイオフィルムで初めて観察され(Sticklerら、1998)、その1年後、緑膿菌のバイオフィルムに関するいくつかの研究により、QSがバイオフィルムの発達に関与していることが確認された(Hassettら、1999)。その後、QSはグラム陽性菌のバイオフィルム形成にも重要な役割を果たすことが明らかになった(Wucら、2019)。
現在では、QSが多くの細菌や真菌のバイオフィルム形成を制御・促進し、抗生物質耐性や病原性因子の産生を引き起こすことはよく知られている(Madhani, 2011; Hong et al.)。QSが遺伝子レベルの制御と集団レベルのダイナミクスに必要であり、バイオフィルムの形成に重要な役割を果たすことは広く認められている。
微生物はQSを利用して集団密度を調節し、代謝生産を最適化する(Wuc et al.)QSは、マトリックス化合物の合成またはマトリックスの分解を協調的に阻害することにより、バイオフィルム共同体の成熟だけでなく、分解も制御する(Solano et al.、2014)。
バイオフィルムの形成と発達に対するQSの重要な効果によれば、多くの研究が、これらの自己誘導物質の産生を標的とする、またはそれらの受容体を遮断することによってバイオフィルムを阻害することを試みている。QS阻害剤は、有望な抗バイオフィルム剤とみなされている(Whiteleyら、2017)。
医療機器関連バイオフィルム感染症
医療の向上に伴い、医療機器(コンタクトレンズ、歯列矯正用補綴物、気管内チューブ、中心静脈カテーテル、ニードルレスコネクター、子宮内装置、心臓血管弁、ペースメーカー、腹膜透析カテーテル、導尿カテーテル、人工関節、乳房インプラントなど)は広く使用されており、臨床業務において治療に不可欠となってきている。
時に、医療機器の使用は合併症をも伴い、最も多い二次的合併症は、医療機器上のバイオフィルムから剥離した微生物による感染であり、その一例がカテーテル関連バイオフィルム(図1C)である(Donlan, 2001)。尿道カテーテル関連バイオフィルムは1985年に観察され、バイオフィルムの抗生物質耐性が報告された(Nickelら、1985)。
カテーテル関連尿路感染症は非常によく見られる感染症であり、この感染症に着目した研究が多く行われている。長期カテーテル留置患者のカテーテル内表面に存在するバイオフィルム中の微生物は、抗生物質治療から保護され、慢性感染を引き起こす(Delcaru et al.、2016)。
尿道カテーテル上のバイオフィルム形成は、主に2つのルートのいずれかで起こることが指摘されている。カテーテル挿入時に直接接種することでカテーテル外表面に微生物がコロニーを形成する場合と、周囲の粘膜鞘を経由して移動することでコロニーを形成する場合である。
関連する微生物の多くは消化管からやってきて、会陰部にコロニーを作る(Delcaru et al.、2016)。尿道カテーテル関連バイオフィルムの多くは、特に女性患者において、微生物の管腔外侵入により発生する(Delcaru et al.)。
閉鎖的な排液システムを維持しなかったり、回収バッグが汚染されたりして、微生物が腔内ルートでカテーテルに侵入し、バイオフィルムを形成することもある(Nickel and Costerton, 1992)。血流感染によって微生物が尿路に入り、カテーテル関連バイオフィルムを形成することもあるが、尿路感染が敗血症の主因となることの方が多い。
* *
その後の研究では、他のカテーテル関連バイオフィルムや移植材料関連バイオフィルムが広く研究され、コンタクトレンズ、歯列補綴物、気管内チューブ、ニードルレスコネクター、中心静脈カテーテル、子宮内装置、心臓血管弁、ペースメーカー、人工関節、乳房インプラントなどに関連するバイオフィルムが研究されている(Zahran et al, 2015; Sampaio et al., 2016; Gominet et al., 2017; Okuda et al., 2018; Stewart and Bjarnsholt, 2020; Walker et al., 2020)がある。
バイオフィルムの存在は、慢性腹膜透析カテーテルの感染またはコロニー形成に伴い、腹膜炎の再発または持続の重要な病原因子であると考えられている(Sampaio et al.、2016年)。カテーテル関連血流感染は、重大な関連罹患率を伴う院内感染の重要な原因である(Bouza et al.、2015)。
カテーテル上のバイオフィルム形成は、手術中および/またはカテーテル挿入中の汚染微生物に由来する可能性がある。これらのバイオフィルムは、カテーテルの外表面に形成される。S. epidermidis、S. aureus、およびC. albicansは皮膚によく見られる微生物であり、したがって、これらはカテーテル関連のバイオフィルム感染症の最も重要な病原原因である(Septimus and Schweizer、2016年)。
さらに、カテーテル内腔のバイオフィルムは菌血症に由来することもある。プランクトン細胞と比較して、バイオフィルム内の細胞は、通常かなりの宿主反応を引き起こす炎症性因子の産生が少ない。多くの微生物が気管内チューブに定着し、バイオフィルムを形成することができる。
気管内チューブ内のバイオフィルムは、集中治療室における最も一般的な感染症の1つであり、主要な死因である人工呼吸器関連肺炎に関連している(Orhan-Sungur and Akça, 2006; Fernández-Barat and Torres, 2016)。
人工関節、ペースメーカー、心臓弁、コンタクトレンズ、乳房インプラントなどの長期医療用インプラントにおけるバイオフィルム形成が、術後の大きな合併症を引き起こすことを示す証拠が増えてきている。感染症は、インプラント周囲の炎症や組織破壊を引き起こし、時には生命を脅かすこともある。バイオフィルムの除去が困難なため、多くの患者でインプラントの交換を検討する必要がある(Arciolaら、2018年)。
* *
医療機器に関連するバイオフィルムは、院内感染の最も重要な感染源である。重要な日和見病原体の間で行われたバイオフィルムに関する研究のほとんどは、包括的なものである。バイオフィルムは、S. epidermidis(Sabaté Brescó et al., 2017)およびS. aureus(Moormeier and Bayles, 2017)によって最もよく形成され、他の院内日和見微生物、例えば、P. aeruginosa(Nickel et al., 1985; Hassett et al, 1999; Bell, 2001)、大腸菌(Koseoglu et al., 2006)、Klebsiella pneumoniae(Stahlhut et al., 2012)、A. baumannii(Eze et al., 2018)、C. albicans(Chandra et al., 2001)などの院内日和見微生物も医療機器関連バイオフィルムを形成し得る。これらの病原体の多くは多剤耐性であり、これらのバイオフィルムの治療は非常に困難である。
組織付着型バイオフィルム感染症
微生物は、生体表面に付着し、宿主の異なる組織、例えば、表皮細胞(Paranjpye and Strom, 2005)や歯(Black et al, 2004)にバイオフィルムを形成したり、組織内、例えば、粘膜の粘液中(Cellini et al, 2008)や慢性創傷内部(Akiyama et al, 1996)に存在することもある。
歯肉溝や歯面に形成されるバイオフィルムは、歯肉炎や歯周炎の発症の主要因とされており、ポリミクスの相乗効果やディスバイオシスが関与している可能性が指摘されている。持続的な炎症と慢性的な感染症には、がんのリスク上昇が関連している(Groeger and Meyle, 2019)。
口腔マイクロバイオームには、ウイルス、原生動物、古細菌、真菌、細菌など、750種類に上る微生物が認められている。ストレプトコッカスやアクチノマイセスなど、複数の種による口腔内バイオフィルム形成は非常に一般的である。歯面バイオフィルムはう蝕の原因となり、歯周障害は歯肉の下や歯肉に沿ったバイオフィルムによって誘発される(Mosaddadら、2019年)。
複数の消化器感染症がバイオフィルム形成によって引き起こされることが確認されている。ヘリコバクター・ピロリによるヒト胃粘膜のバイオフィルム形成は、内視鏡的に指示された生検において、走査型電子顕微鏡で観察されている(Caron et al.、2006年)。
H. pylori感染症は、バイオフィルム形成のため、根絶することは困難である。サルモネラはヒトの胆石上にバイオフィルムを形成することができ、胆汁はサルモネラのバイオフィルム形成を著しく促進させる。胆石上のサルモネラのバイオフィルムは慢性的な感染源となる可能性があり、胆嚢癌の発症リスクの高さと関連している(Prouty et al.、2002年)。
大腸菌(Conway and Cohen, 2015)、V. cholerae(Silva and Benitez, 2016)、S. enterica(Azriel et al., 2015)などの複数種の微生物は、宿主腸内にバイオフィルムを形成することができる。女性生殖器の正常な細菌叢には、熱心に付着する細菌と緩く組織付着する細菌の両方のバイオフィルム集団が含まれている(Davies, 2003)。下痢性疾患の治療や予防に用いられ、腸を健康に保つのに役立つ生きた細菌や酵母であるプロバイオティクスも、バイオフィルムを形成することがある(SlíŽová et al.、2015)。
一方、常在菌/プロバイオティクス型株の効率的なバイオフィルム形成は、宿主を病原体から守り、腸炎の発症や重症化を抑制するという優位性をもたらすことが示されている(Olson et al.)
抗菌剤に対するバイオフィルム耐性のメカニズム
バイオフィルムの成長様式は、多くの殺生物剤や抗生物質に対する保護を提供するため、バイオフィルムは制御が難しく、最終的に根絶することは困難である。バイオフィルムから再浮遊した微生物はプランクトン細胞よりも明らかに耐性が高く、バイオフィルム内の細胞はバイオフィルムから再浮遊した細胞よりも耐性が高いことが指摘されている。
バイオフィルム細胞は、少なくともプランクトン細胞よりも数百倍(最大1,000倍)抗菌剤に対する耐性が高い(Royら、2018)。バイオフィルムは、シェルターや物理的な障壁として機能することで、乾燥、化学的摂動、他の細菌による侵入、免疫細胞による殺傷から細胞を保護する(Yan and Bassler, 2019)。
* *
バイオフィルム細胞が抗生物質に対する耐性向上を作り出すメカニズムは複数あり、これらのメカニズムはプランクトン細胞におけるものとは異なる(図2)。バイオフィルムへの抗生物質の浸透阻害が当初は原因であると提唱された(Dunne, 1993)。
しかし、シプロフロキサシンやフルコナゾールなど一部の抗菌剤のバイオフィルム内への浸透性は低下しない(Anderlら、2000)。マトリックスのメッシュサイズは、抗菌剤分子のサイズよりもはるかに大きいことが、現在ではよく知られている(Yan et al.、2018)。バイオフィルムへの抗菌剤の浸透は、バイオフィルムの厚さ、バイオフィルム内での薬剤の反応性と拡散、バイオフィルムの収着、薬剤の投与濃度に依存する(Stewart, 2015)。
エクソポリサッカライドマトリックスの生成は、C. albicansバイオフィルムにおけるフルコナゾールなどのいくつかの抗生物質の活性を低下させる(Nett et al, eDNAは、陽イオンが制限された状態を作り出し、リポ多糖(LPS)の修飾を誘発し、アミノグリコシドなどの抗生物質の取り込みを阻害することによって、抗生物質活性を低下させることができる(Mulcahy et al.
図2 抗菌薬治療に耐性を持つバイオフィルムのメカニズム
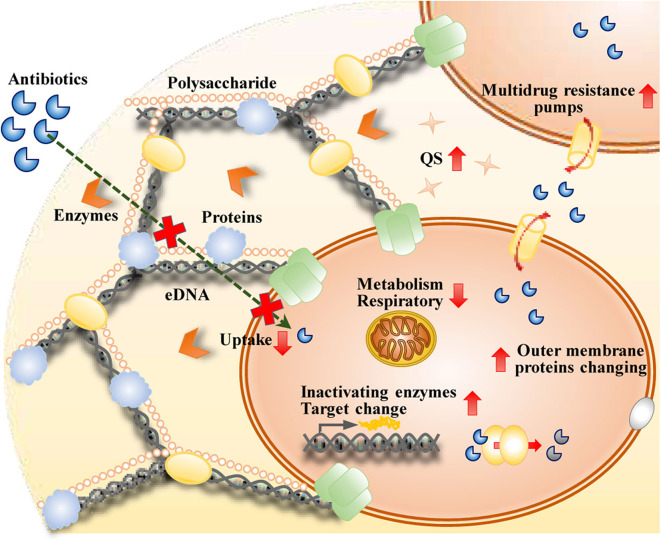
バイオフィルム内の細胞の状態が、抗菌薬に対する感受性と関連することは広く認められている。バイオフィルム内の高浸透圧条件、高酸素濃度、高金属イオン濃度、低pHレベルは、いくつかの遺伝子の発現に関与し、バイオフィルム細胞の表現型の一部を決定することが確認されている(Prigent-Combaret et al.、1999)。
バイオフィルム内では、酸素濃度が表面で高く、底面や中心部で低くなっている(Costerton et al.)したがって、バイオフィルムの表面には代謝活性の高い細胞が存在し、中心部には代謝活性が低く増殖が遅い細胞が存在する。
代謝活性の高い細胞は、環境の変化を感知し、抗菌ストレスの存在に積極的に対応することができる。しかし、バイオフィルム内の細胞の大半は休眠状態で定常期にあり、これらの細胞は代謝が不活発で、増殖していないことを意味する。バイオフィルム内の定常期にある細胞は、増殖や呼吸を行わず、抗菌薬に対する耐性が高い(Stewart, 2015)。栄養環境の変化やバイオフィルム内の増殖阻害は、バイオフィルム内の薬剤耐性の上昇につながる。
* *
バイオフィルムには内在的な耐性機構が存在するが、後天的な機構と適応的な機構の相乗効果がバイオフィルム内の抗生物質耐性に寄与していることが多くの研究で示されている(Taylor et al.、2014)。バイオフィルム内の遺伝的適応は、細胞が周囲の環境に適応するのを助け、抗生物質耐性を高める。
バイオフィルム内の細胞の外膜タンパク質の変化は、多剤耐性遺伝子の発現を介して抗生物質耐性に寄与する。一部の抗生物質は、バイオフィルム内の細胞の耐性関連酵素の発現を誘導することができる。例えば、高度なイミペネム耐性は、緑膿菌のバイオフィルムにおいてイミペネムによって誘導されるβ-ラクタマーゼの発現の増加に関連している。
Piperacillinもまた、バイオフィルムにおいてβ-ラクタマーゼの発現を誘導することができるが、β-ラクタマーゼ発現の増加はイミペネムレベルほど高くはない。β-ラクタマーゼ発現量の増加とバイオフィルム増殖様式の他の保護特性との組み合わせが、慢性感染症におけるバイオフィルムの持続性の主な理由である(Coquet et al.、1998)。
バイオフィルムにおける多剤排出ポンプの活性の変化は、薬剤耐性に寄与する。バイオフィルム内の細胞の活性化されたエフラックスポンプが最も注目されている(Kean et al.、2018)。バイオフィルム群集の定常状態における有力な細胞集団であるパーシスター細胞は、微生物亜集団の休眠細胞であり、遺伝的なものではなく表現型の多剤耐性変異体である(Keren et al.,2011)。
バイオフィルム細胞の抗生物質耐性のもう一つのメカニズムは、水平移動による多剤耐性遺伝子の獲得であり、これがバイオフィルム内の細胞の進化に寄与している(Mah, 2012)。QSは、このバイオフィルム内の細胞間の水平移動に本質的な影響を与える(Zhuら、2019)。
バイオフィルムは、バイオフィルム内の微生物が経験する可能性のあるこれらの環境変化に反応するよう誘導する一般的なストレス反応として、これらのメカニズムを発達させたことを示す証拠がある(Mah, 2012)。バイオフィルムと戦うためには、これらの機構を標的とした新しい戦略を開発する必要がある。
微生物バイオフィルムに対する戦略
バイオフィルムに関連する感染症やその治療の課題は、人々の健康に対する大きな脅威とみなされているため、近年、この問題に対処するための戦略が開発されている(図3)。
図3 バイオフィルムに対する戦略
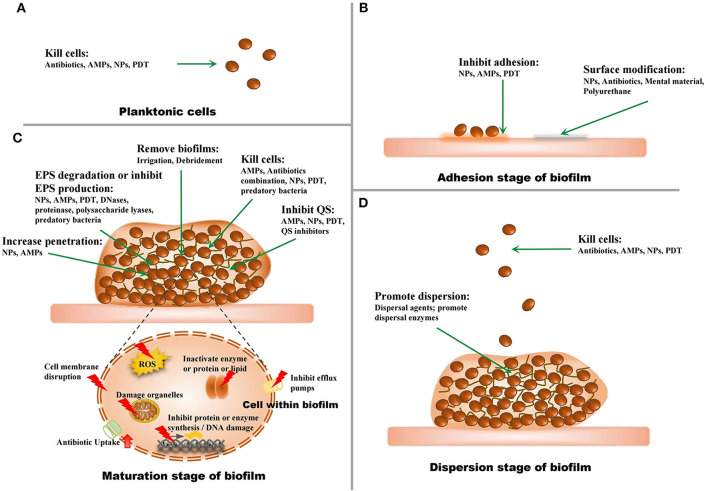
(A) 浮遊性微生物に対する戦略。(B)バイオフィルムの付着段階に対する戦略。(C)バイオフィルムの成熟段階に対する戦略。
(D) バイオフィルムの分散段階における戦略
従来の抗生物質併用療法
バイオフィルム内の細胞は抗生物質の最小発育阻止濃度(MIC)がはるかに高く,局所投与により高濃度の抗生物質を供給することができる(Olivares et al.)バイオフィルムに対する新しい抗生物質や治療法の選択肢は限られており、新規の抗バイオフィルム候補を見つけるための新しい戦略の開発が必要である。バイオフィルムは抗生物質治療に対して耐性があるため、バイオフィルムの根絶を試みるために、異なる薬との併用療法が検討された。
最初の試みとして、1987年に大腸菌のバイオフィルムを抗生物質のアムジノシリンとセファマンドールの組み合わせで治療した(Prosser et al.)研究者は、相乗効果によってバイオフィルムを除去するために様々な組み合わせ方式を試し続け、逐次/代替療法や高用量局所治療も試みている(Akturk et al.、2019)。
ほとんどの研究は、大腸菌、緑膿菌、黄色ブドウ球菌、コアグラーゼ陰性ブドウ球菌、C.アルビカンスなど、院内感染を引き起こす一般的な多剤耐性病原体に焦点を当てている(Cai et al., 2009; Pettit et al., 2009; Sarkar et al., 2014; Wang Y. et al., 2014; Ahmed et al., 2019)。
多くの研究により、伝統的な抗生物質の相乗作用がin vitroだけでなくin vivoでも確認されている(Cai et al., 2009; Pettit et al., 2009)。併用療法を行う際には、抗生物質の感受性、標的、浸透性、バイオフィルムでのPK/PDなど、複数の要因を考慮する必要がある(Cernohorsk and Votava, 2008; Dales et al., 2009; Rose and Poppens, 2009)。
臨床例では、多くの抗生物質併用療法のスキームが使用されている(Dales et al.)また、サリチル酸ナトリウムとN-アセチルシステインのように、抗生物質と他の種類の薬の相乗効果も確認されている(Polonioら、2001年;Belfieldら、2017年)。
これらの医薬品には、抗炎症試薬、免疫調節試薬、細胞外マトリックスを分解してバイオフィルムを根絶するために用いられる医薬品が含まれる(Bernal-Mercado et al.、2020年)。しかし、バイオフィルムは、抗生物質の副作用により投与量が制限されるため、徹底的に除去することは困難である(Ciofu et al.、2017)。その結果、新しい薬剤や技術開発にかなりの注目が集まっているが、最も有望な代替案は、新しい薬剤と従来の抗生物質の組み合わせに基づく必要がまだある。
バイオフィルムを物理的に除去するためのイリゲーションとデブライドメント
歯科用ウォータージェットを用いた灌流は、in vivoおよびin vitroの両方でバイオフィルムの除去に有効であると報告されている(Gorur et al, 2009; Kato et al, 2012)。適切な抗菌性皮膚処理により、細菌数の減少および創傷バイオフィルムの形成が可能である(Paulson, 2005)。
口腔、創傷、人工関節のバイオフィルム関連感染に対しては、ウォータージェットによる潅流やデブリードメントに続いて積極的な抗菌薬治療が広く行われているが、これらの治療後にバイオフィルムが表面に広がり、表面上の細菌の残存を引き起こすこともわかっている(Urish et al.)人工関節のバイオフィルム関連感染症の治療は複雑とされ、病原体や感染発症期間によって選択肢が異なり、明瞭である(Aboltins et al.、2014)。
グルコン酸クロルヘキシジンスクラブなどの適切な洗浄剤の中には、コロニー数の減少やバイオフィルムの除去に有用であると報告されているものもある(Schwechter et al.)低強度の断続的超音波照射によるマイクロバブルの破裂(Agarwalら、2014)やキャビテーションジェット(Yamadaら、2017)などの新技術が、これらの従来の治療法と組み合わされているものもある。これらの新規の方法は有望であるが、その有効性はまだ臨床で示されていない。
表面改質
医療機器に関連するバイオフィルム感染の脅威が高まっている。バイオフィルムの形成には、微生物が表面に付着することが重要であり、いったん医療器具の表面にバイオフィルムが形成されると、その除去は非常に困難になる。そのため、バイオフィルムを除去するための主要な戦略として、医療機器の表面を改質することに多くの研究がなされてきた。
バイオフィルムの形成に対抗するために、医療用人工関節のコーティングが広く開発されている。金属材料には抗感染作用があることが分かっており、カテーテルのコーティングにも使用されている。尿道カテーテル、腹膜カテーテル、血管カテーテル、骨折固定装置など、様々なカテーテルやその他の医療機器に使用される銀または銀-銅多層コーティングは、バイオフィルムの成長を防ぐ(Bechertら、1999)。
表面改質のための現在の予防的アプローチは、主に物理的な前処理または抗菌剤もしくは接着力を低下させる薬剤による表面のコーティングによって機能する。1995年、スルファジアジン銀とクロルヘキシジンでコーティングされた中心静脈カテーテルが豚に移植され、無毒性範囲であることが示された(Greenfeldら、1995年)。
その後、リファンピシン、ミノサイクリン、ゲンタマイシンがバイオフィルム表面の改質の研究に用いられた(Spencer, 1999; Cho et al., 2001)。市販のコーティングカテーテルは、クロルヘキシジン、ミノサイクリン、リファンピン、スルファジアジン銀などの広域抗生物質でコーティングされており、これらのカテーテルは、いくつかのガイドラインで支持された推奨に従って、特に集中治療室での臨床研究で広く使用されてきた(Dwyer, 2008)。
抗菌カテーテルは、菌血症がある場合でも転帰を改善することが実証されている(Jamal et al.)ハイドロゲルは、医療機器のコーティングに使用されており、官能基密度、生体適合性、潤滑性が良好なため、バイオフィルム対策に有効であることが示されている(Norris et al.、2005)。
ポリウレタンは生分解性ポリマーとして開発され、制御された用量の抗生物質を送達することができた。防汚ポリウレタンは、抗バイオフィルム活性を有すると推定されており、医療用インプラントのコーティング材料として利用できるかもしれない(Tunney and Gorman, 2002)。ナノテクノロジーは、バイオフィルムと戦うための表面改質に使用されており、この新しい技術に関する詳細な情報は、次のセクションで説明される。
ナノテクノロジー
ナノテクノロジーは、確立された科学技術である。ナノマテリアル(NM)は、1~100 nmのナノメートルスケールの範囲に少なくとも一つの次元を持ち、いくつかの特殊な物理的および化学的特性を有している。ナノ材料は、様々な医療診断や治療分野で開発されている。
脂質(Routら、2017)、ポリマー(Landisら、2017)、金属NM(Besinisら、2014)など、様々なNMが生み出されてきた。金属NMは、その無毒性と本質的な不活性のため、コア材料となっている(Burygin et al.、2009)。
ナノテクノロジーは、微生物を直接殺したり抑制したりするだけでなく、抗バイオフィルム活性を持つ抗生物質や他の薬剤を運ぶことで、バイオフィルム対策に様々な役割を果たすことができる(Li et al.、2019)。また、NMはサイズが小さいため、送達キャリアとして活用することもできる。
ナノツールを用いれば、従来の抗生物質やその他の新規抗菌剤がバイオフィルム障壁を通過し、さらにバイオフィルム内に浸透し、バイオフィルム内の細胞を殺すことができる(Galdiero et al.、2019年)。主なナノキャリアの種類には、分子複合体(タンパク質ナノ複合体やシクロデキストリンナノ複合体など)、ポリマー系ナノカプセル[デンドリマー、コアシェルナノカプセル、リガンド装飾ナノ粒子(NP)など]、無機ナノキャリア(金属NPなど)、脂質系ナノ粒子(リポソームや固体脂質NPなど)などがある。
多くの種類のNMの中でも、NPは特に注目されている(Sambhy et al.、2006)。担体として、NPは薬物の溶解度と安定性を高め(Dingら、2018)、標的部位での薬物の生体適合性を高めることができる(Buryginら、2009)。送達された薬物の放出は、塩濃度、pH、光、温度などのさまざまな刺激によって制御することができる(Paasonen et al, 2007)。
* *
これらの新しいNP、特に金属NPは、既存の抗生物質の抗菌効果を増強し、独自の殺菌活性を提示す。金属NPは金属イオンを放出し、様々な経路で細胞成分と相互作用してバイオフィルムと戦うことができる(Paasonen et al.、2007)。
NPsの主な抗バイオフィルム機構は以下の通りである。(1) NPsは微生物の細胞壁に直接接触し、細胞壁や細胞膜を損傷することができる。このNPの抗菌作用は、グラム陰性菌、グラム陽性菌、真菌で確認されている(Grigor’eva et al.2013; Monteiro et al.2013)。
(2) NPsは微生物の表面付着を防ぎ、バイオフィルムの形成を抑制することができる。NPは、バイオフィルムを根絶または抑制し、細胞の近傍への抗菌剤の輸送を増加させる有望な技術である。あるいは、NPはマトリックス分散剤を運ぶことも可能である。
バイオフィルム内の浸透は、ほとんどがNPsのサイズによって制御される(Habashら、2014年;Dingら、2018年)。(3) NPは宿主の免疫反応を制御して病原性バイオフィルムの形成を抑制することができ、NPは抗炎症作用を有するが(Shi et al., 2019)、酸化亜鉛NPなど一部のNPは自然免疫反応を損なうことも明らかにされている(Lin et al., 2014)。
(4) 銀NP(Paosen et al., 2019)などのNPは、微生物細胞との相互作用により触媒として作用し、活性酸素種(ROS)を生成することがある。(5)金属イオンまたはNPは、容易に微生物細胞に侵入し、(例えば、DNAおよび/またはタンパク質との相互作用を介して)細胞内構造を損傷することができる(Gordonら、2010;Grigor’evaら、2013)。
NPは、エフラックスポンプ阻害剤として作用することができ、この活性は、抗菌剤の抗菌効果を回復させ、それによって抗菌剤に対する耐性を低減することに寄与する可能性がある(Ding et al.、2018)。QSがバイオフィルム形成に重要な役割を果たし、QS阻害剤が有望な抗バイオフィルム代替物質と考えられていることを述べた。NPがQS阻害剤として作用し、バイオフィルム形成を阻害することが確認されている(Masurkar et al, 2012; Radzig et al, 2013)。
(6) NPをキャリアとして用いることで、薬剤のフリーローディングと比較して、カプセル化された抗菌薬の治療指数や薬物動態プロファイルを改善することにより、バイオフィルム由来の浮遊性細胞やバイオフィルムに対する低用量の抗菌性を向上させることが可能である。NPは、これらの抗菌薬の毒性および副作用を低減することができる(Dingら、2018;Fulazら、2019)。銀NPはその抗菌特性について広く研究されており、銀NPの抗バイオフィルム活性を表1にまとめた。
表1 銀APの抗バイオフィルム活性と応用例
| 病原体 | 効果 | 参考文献 |
|---|---|---|
| 緑膿菌 | バイオフィルム形成の抑制 | Sambhyら,2006; Besinisら,2014 |
| 表皮ブドウ球菌 | 不活性化酵素 | Gordon et al.,2010 |
| 緑膿菌、大腸菌、黄色ブドウ球菌 | 細胞壁合成阻害、タンパク質合成阻害、核酸合成阻害、QS | Masurkar et al.,2012; Radzig et al.,2013 |
| Salmonella typhimurium、黄色ブドウ球菌 | 細胞壁への付着、細胞膜へのダメージ、DNAへの結合 | グリゴール・エヴァほか,2013 |
| カンジダ・アルビカンス | 細胞壁合成の抑制 | モンテイロほか,2013 |
| 緑膿菌 | 抗生物質との併用療法で、バイオフィルム内への浸透性を高める。
|
ハバシュら、2014年 |
| 緑膿菌 | キャリアとして薬物の排出に影響を与える。
|
ディンら、2018 |
| A. baumannii、大腸菌、黄色ブドウ球菌、カンジダ・アルビカンス | 細胞膜の破壊、活性酸素の発生、細胞外マトリックスの溶解 | パオセンら、2019年 |
| 黄色ブドウ球菌、緑膿菌 | 宿主免疫応答の調節 | シら、2019年 |
これらの利点を総合すると、ナノテクノロジーは、従来の抗生物質とは異なるナノシステムのユニークなメカニズムにより、バイオフィルムに対抗するための抗菌ナノシステムを開発する多くの有望な機会を提供することが示唆される。これまでに数多くの材料が製造され、臨床試験で使用され、そのうちのいくつかは承認されている。
これらの臨床的に承認されたNPの中には、脂質系、ポリマー系、タンパク質系のNPがある(Wolfram et al.、2015)。ほとんどの研究者は、NPは人体組織に対して安全であると述べているが、特定のカテゴリーのNPは細胞毒性作用を有すると報告されている(Zhaoら、2008年)。NPsの毒性試験は限られており、NPsのリスク評価のためのさらなる長期的な研究が必要である。
抗菌性ペプチド
抗菌ペプチド(AMP)は、自然界に広く分布する一連の化合物であり、ウイルス、細菌、原虫、真菌に対する幅広い抗菌活性で最もよく知られている。天然のAMPは、脊椎動物、無脊椎動物、植物、バクテリアなど、さまざまな種類の生きた生物から抽出される。
また、AMPは、化学合成によっても製造することができる。従来の抗生物質と比較して、天然および合成のAMPは、抗生物質耐性の発達を誘発することなく、幅広い抗菌の役割を果たすことができる。バイオフィルムに影響を与えることができるAMPはごくわずかであり、ヒトカテリシジンペプチドLL-37のようにMIC以下の抗バイオフィルム活性を示すものもある(Chennupatiら、 2009;Kai-Larsenら、 2010)。
LL-37は、抗プランクトン細胞活性は非常に弱いが、抗バイオフィルム活性ははるかに高い(Overhageら、2008年)。バイオフィルムに対するAMPの効果の基礎となるメカニズムには、(1)孔形成および/または膜破壊による膜関連活性(Sochackiら、2011;Wang G.ら、2014;Chenら、2019);(2)細菌の細胞質への侵入および細胞壁、酵素またはタンパク質合成の抑制(Pinheiroら、, 2018)、(3)細胞外マトリックスの分解または不安定化(Dean et al., 2011)、(4)バイオフィルム形成の初期段階における細胞付着の防止および既存細胞の分散促進(Overhage et al.)一部のAMPは、微生物のQSを阻害することにより、バイオフィルム形成を防止または抑制することができる(Overhageら、2008年)。
AMPのバイオフィルムへの浸透は、その抗バイオフィルム活性に不可欠である。AMPは、宿主の免疫反応を調節することによって、抗バイオフィルムの役割を果たすことができる(Solら、2013;Chenら、2019)。ほとんどのAMPは、膜構造の違いから、原核細胞のみに毒性があり、宿主細胞には毒性がないとされている(Ko et al.、2019)。
しかし、いくつかの研究では、透過性、電位、流動性、表面電荷、疎水性、安定性などのいくつかの要因が、宿主膜に対するAMPの効果に影響を与える可能性が示唆されている(Hoskin and Ramamoorthy, 2008)。
一部のAMPは宿主細胞膜と静電的に相互作用することができ、その抗腫瘍活性から一部の抗がん研究に使用されている(Zhou et al.、2018)。天然AMPは安定性が悪く、炎症促進作用を有することが多いが、合成AMPはAMPのこれらの欠点を克服するように設計されている。
しかし、天然AMP(Scottら、2002)と比較して、合成AMPは、プロテアーゼの切断部位を変更することによってより良い不安定性を示し、毒性を下げ、抗菌活性を改善し、生産コストを下げる(Haismaら、2014;Pfalzgraffら、2018)。その潜在的な毒性および低い安定性は、抗バイオフィルム感染症の臨床治療におけるAMPの使用を制限する(Chennupatiら、2009)。
AMPの有望な利点を考慮すると、AMPに基づくさまざまな組み合わせ戦略が評価されている。ナノテクノロジーによってNPと組み合わせたAMPは、バイオフィルムの障壁を貫通することができ、低用量のAMPを使用して、その欠点と潜在的な毒性を克服することができる(Almaaytahら、2017年)。
* *
明らかな抗菌活性を有するいくつかのAMPは、ヒトの細胞から分泌される。いくつかの薬剤は、微生物感染に対して宿主細胞がAMPを分泌するように誘導することができ、いくつかの薬剤は宿主細胞によって分泌されるAMPとの相乗効果を示す(Sechet et al.,2018)。
また、一部のAMPは、抗生物質の取り込み促進を介して従来の抗生物質と組み合わせた相乗効果を示す(Shurko et al.、2018)。LL-37およびLL-37由来ペプチドの抗バイオフィルム活性を表2に列挙する。
表2 LL-37およびLL-37由来ペプチドの抗バイオフィルム活性を示す
| 病原体 | 効果 | in vitroまたはin vivo | 参考文献 |
|---|---|---|---|
| 緑膿菌 | 細胞の付着力を低下させ、曳糸運動を刺激し、QSに影響を与える。 | インビトロ | Overhage et al.,2008 |
| 緑膿菌 | プロ炎症および繊毛毒性効果を有するバイオフィルムの根絶と細菌数の減少 | インビボ | Chennupatiら,2009 |
| 緑膿菌 | 細胞の付着やバイオフィルム形成の抑制、細胞外マトリックスの分解 | インビボ | Dean et al.,2011 |
| 大腸菌 | 細胞の付着、バイオフィルムの形成を減少させる。 | インビトロ | Kai-Larsenら,2010 |
| 大腸菌 | 膜に結合し、細胞壁の生合成を妨害する | インビトロ | Sochacki et al. |
| アグリガティバクター・アクチノマイセテムコミタンス | 宿主の免疫反応を制御する | インビトロ | ソルら、2013 |
| 黄色ブドウ球菌 | 細菌膜を破壊し、DNAを結合する。 | インビボ | Wang G. et al.,2014 |
| 黄色ブドウ球菌 | 細菌を死滅させ、バイオフィルム形成を抑制する。 | インビトロ | ハイスマら、2014 |
| 黄色ブドウ球菌 | 他の抗生物質との併用による相乗効果 | インビトロ | シュルコら、2018年 |
| ミュータンスれんさきゅうきん | 細胞膜の破壊、バイオフィルム形成の抑制、炎症の抑制 | インビトロ | チェンら、2019年 |
ほぼすべての細菌群が産生するバクテリオシンの中には、コリシンやマイクロシンのように抗菌活性を示すものがある。大腸菌が生産するコリシンや、緑膿菌など様々なグラム陰性菌が生産するコリシン様バクテリオシンは、生産菌と近縁の菌を殺す(Brown et al.、2012)。
コリシンは、ヌクレアーゼ機能を分解したり、細胞壁合成を阻害する酵素型コリシンと、細胞質膜を脱分極する孔形成型コリシンに分けられる。これらの作用機序はいずれも細胞死を引き起こす可能性がある(Rendueles et al.、2014)。
また、コリシンおよびコリシン様バクテリオシンは、バイオフィルム状態で増殖する標的株を死滅させる効果が高い(Brown et al.、2012)。腸内細菌(主に大腸菌)が分泌するマイクロシンも、近縁種に対して強力な抗菌活性を発揮する。
それらは、細菌膜に孔を形成し、アスパルチルtRNA合成酵素を阻害し、DNAジャイレースGyrBを阻害し、DNA損傷をもたらすことによって作用する(Baquero et al.)緑膿菌のバイオフィルムに対抗するためにマイクロシンを使用し、プランクトン細胞および成熟バイオフィルム細胞に対するマイクロシンの殺傷活性が証明された(Hwang et al.、2019)。
これらのバクテリオシンの利用は、バイオフィルム治療の新たな戦略となる可能性がある。しかし、これらの化合物は、真核生物宿主細胞との相互作用を伴う機能を持ち、ある程度の宿主DNA損傷を誘発する可能性もあり(Baqueroら、2019)、これらの作用は、抗バイオフィルム治療への応用を制限する可能性がある。
* *
これらは、宿主固有の免疫系を制御することで感染症と戦う新規戦略となり得るものであり、これらの治療法は同時に、炎症反応による有害なリスクを回避できるかもしれない。
光線力学的療法
光線力学療法(PDT)は、多くの疾患の治療に用いられており、光増感剤または光増感剤の後に特定の波長の光を照射して治療する。PDTは、in vitroでバイオフィルム内の細胞膜を効果的に損傷させることにより、広範囲の微生物によって形成されたバイオフィルムを阻害する抗菌戦略として使用された(Woodら、1999年)。
その後、抗菌剤PDTは、強い酸化力と高い反応性を持つ細胞傷害性活性酸素を生成することにより、細菌の脂質酸化を速やかに起こして微生物を非特異的に攻撃することがわかった(Qi et al.,2019)。また、PDTの抗バイオフィルム活性は、微生物の表面付着能力の阻害、バイオフィルム構造の破壊、一部の小器官の損傷、病原性因子分泌の誘導、排出能力およびQSの阻害と関連していることが分かっている(Arciolaら、2011; Liら、2017; Tanら、2018; Hendianiら、2019; Mahdizade-Ariら、2019)。
PDTの抗バイオフィルム研究のほとんどは、歯垢関連疾患および慢性創傷感染にこの技術を使用している(Zaninら、2005;Dilsizら、2013;Mahmoudiら、2019);しかしながら、いくつかの研究は、人工呼吸器関連肺炎および慢性鼻副鼻腔炎におけるバイオフィルム関連感染と戦うためにPDTを使用している(KrespiとKizhner、2011;Geraldeら、2017)。
光増感剤の大部分は水に難溶性で疎水性であるが、NMの適用により、この制限が克服されるかもしれない(Qi et al.、2019)。PDTはナノテクノロジーの時代に出現し、これらの組み合わせ戦略は良好な効果を持つことが示されている(Khan et al.、2012)。
NMは、フラーレンなどの光安定性とROSの生成を高めるために光増感剤の役割を果たすことができ、NMは、金やシリカ系NPなどの安定性、分散性、親水性を高めるために光増感剤のナノキャリアとしても機能する(Qi et al.、2019年)。
プロトコルと光源の継続的な開発のため、PDTは長期的な臨床試験で使用されてきた。ほとんどの試験では、PDTがバイオフィルムの抗菌療法になる可能性があることが証明され、PDTの副作用は観察されなかった(Lopes et al, 2014; Alwaeli et al, 2015; Percival et al, 2015a; Tahmassebi et al, 2015)。有望な結果にもかかわらず、含まれる研究の数が限られているため、これらの研究からの結論は慎重に検討されるべきである。
バイオフィルムから細胞外多糖類物質を分散させる酵素
バイオフィルムのEPSは、様々な抗菌剤や自然免疫反応からバイオフィルム内の細胞を守っている。バイオフィルムを排除する戦略として、eDNA、細胞外多糖類、およびタンパク質を標的とする酵素が検討されている(Kaplan et al.、2018)。
DNase Iは、in vitroおよびin vivoでeDNAを分解するのに有効であることが確認され(Zhaoら、2018)、バイオフィルムを損ない、微生物の接着を減らし、既存のバイオフィルム、特に初期段階のバイオフィルムの分散を誘導するために使用されている。
DNase Iは、C. albicans (Martins et al., 2012), S. enterica (Wang H. et al., 2014), Campylobacter jejuni (Brown et al., 2015), S. aureus (Waryah et al., 2017) and Burkholderia pseudomallei (Pakkulnan et al., 2019) biofilmなどの複数のバイオフィルムに対抗するのに使用されている。
部分的に脱N-アセチル化されたポリ-β-d-(1,6)-N-アセチル-グルコサミン(dPNAG)からなるエクソポリサッカライドは、グラム陽性およびグラム陰性細菌バイオフィルムEPSの主要構造要素である。口腔病原体Aggregatibacter actinomycetemcomitans由来の新しいβ-N-アセチルグルコサミニダーゼであるDispersin Bは、dPNAGを切断し、有望な抗バイオフィルム剤として機能する(Kaplanら、2018年;Wangら、2019年)。
Dispersin Bは多層コーティングの成分の1つとして使用され、高い安定性で高い抗バイオフィルム効率を示した(Pavlukhina et al.)その他、プロテイナーゼKやリゾチームなど多くの酵素が、有望な抗バイオフィルム活性を有することが証明されている(Eladawy et al.、2020)。これらのバイオフィルム分散酵素は、抗菌剤と組み合わせて投与すると、より優れた抗菌活性を示す(Darouicheら、2009年;Rodríguez-Lópezら、2017年;Kimら、2019年;Eladawyら、2020年)。
研究者はまた、抗菌バイオフィルム活性を向上させ、良好な結果を得るために、異なる酵素の組み合わせ(Karygianniら、2020)または分散誘導酵素をナノテクノロジーなどの他の新技術と組み合わせる(Patelら、2019;Tasiaら、2020)ことを試みている。したがって、従来の抗菌剤または他の新規の抗バイオフィルム治療剤と組み合わせた酵素処理は、殺菌効果とバイオフィルムの分散性の両方を目的としたバイオフィルム関連感染症に対する別の効果的な治療戦略を我々に提供するものである。
捕食性細菌
Bdellovibrio and like organisms(BALOs)は、Klebsiella、Escherichia、Acinetobacter、Salmonella、Pseudomonas、Aeromonas、Vibrio、Shigella、およびYersinia種などの多くのグラム陰性細菌を標的にして捕食する能力を有する小さな細菌グループである(Dashiffら、2011; Duncanら、2019; Bratanisら、2020)。
これらの生物の捕食行動は非常に複雑で、様々な獲物が特異的に認識されて殺され、捕食者はすべての資源が枯渇するまで獲物の細菌内で生活し複製する(Lambertら、2009)。それぞれの捕食細菌は、独自の餌生物スペクトルを持つ。
最もよく研究されている捕食性細菌であるBdellovibrio bacteriovorusが、大腸菌やPseudomonas fluorescensのバイオフィルムだけでなく、浮遊菌も攻撃できることが2005年に初めて報告された(Kadouri and O’Toole, 2005)。
BALOは、バイオフィルムの形成を阻害し、餌となる細菌の既存のバイオフィルムを減少させることができる。グラム陽性細菌バイオフィルムは、B. bacteriovorusの細胞内トランスクリプトーム反応を誘発し、いくつかのプロテアーゼ、ヒドロラーゼ、およびヌクレアーゼの分泌をもたらし、これはグラム陽性細菌バイオフィルムに対するBALOの分解効果に関連する(Im et al, 2018; Bratanis et al., 2020)。
in vivo動物モデルでは、捕食性細菌はげっ歯類に非毒性および非免疫原性であることが示されており(Russo et al., 2015)、in vitro捕食性細菌は数種のヒト細胞株に対して非病原性および非毒性である(Gupta et al., 2016)。
捕食性細菌には、体内の天然微生物叢に悪影響を及ぼす可能性や、餌となる細菌の不完全な捕食といった限界があるにもかかわらず(Shatzkesら、2017)、これらの細菌は依然として「生きた抗生物質」とみなされており、研究者はこれらの細菌が従来の抗生物質の代わりとなることを願っている。
結論
バイオフィルムに関連する感染症は、臨床サービスにおける深刻な懸念事項として残っている。現在の抗生物質治療に対するバイオフィルムの高い耐性は、この分野の大きな課題であると思われる。バイオフィルムの根絶は、医療であれ産業であれ、驚くほど困難である。抗生物質による治療だけでは、微生物のバイオフィルムを根絶できないことが多い。
バイオフィルム耐性のメカニズムの深い理解に伴い、近年、AMPやナノテクノロジーなど多くの開発が行われ、有効かつ有望であることが確認されている。これらの戦略の中には、複数のターゲットに対して抗バイオフィルム活性を有するものがある。これらの有望な薬剤を抗生物質と組み合わせることで、将来的にはバイオフィルムの根絶が可能になるかもしれない。
しかしながら,バイオフィルム感染症に対する安全で効果的,かつ実用的で経済的な戦略を開発するためには,十分にデザインされた臨床試験を含め,この分野においてさらなる慎重な取り組みが必要である.
利益相反
著者らは,本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
脚注
資金提供 本研究は、中国国家自然科学基金(81801972)および吉林大学ベスネ計画(2018B37)、吉林大学第一病院からの中国国家自然科学基金の栽培資金(2020-ZL-01)により支援されたものである。
