Contents
- 要旨
- はじめに
- 治療における抗プリオン剤
- 1. 化合物
- 2-アミノチアゾール (2-AMT)
- ベンゾオキサゾール誘導体
- カルバゾール誘導体
- 環状テトラピロール
- ジアゾ染料
- ジフェニルメタン誘導体
- ジフェニルピラゾール誘導体(DPP)
- ジメチルスルホキシド(DMSO)
- エタノールアミン
- インドール-3-グリオキシルアミド
- リチウム
- フェノチアジン誘導体(メチレンブルー)
- 硫酸化ポリアニオン
- 2. リパーポーズド医薬品
- セレコキシブ
- クロルプロマジン(CPZ)
- エファビレンツ(EFV)
- フルピルチン(FLU)
- グアナベンツ(GA)
- グリメピリド
- イマチニブ
- キナクリン(QC)
- ラドチニブ
- シンバスタチン
- 抗生物質
- 3. 天然化合物
- バイカレイン
- 胆汁酸
- カンナビジオール(CBD)
- カルノシン酸(CA)
- クルクミン
- エピガロカテキンガレート(EGCG)
- ジンセノサイド-RG3
- ヒノキチオール
- メラトニン
- ポリダチン
- レスベラトロール
- スペルミン
- トレハロース
- 4. 免疫療法
- 5. 臨床試験
- 結論と今後の展望
- 著者の貢献
- ディスクロージャー・ステートメント
- 追加情報
Prion therapeutics: Lessons from the past

pubmed.ncbi.nlm.nih.gov/36515657
265-294ページ|受理:2022年07月09日, 受理:2022年11月02日, オンライン公開:2022年12月14日
要旨
プリオン病は、プリオンタンパク質によって引き起こされる、ヒトおよびその他の動物における人獣共通感染性の神経変性疾患(NDD)である。中枢神経系(CNS)において、可溶性細胞性プリオンタンパク質(PrPC)がスクレイピーアイソフォーム(PrPSc)に異常なフォールディングと凝集を起こすことにより、脳障害やその他の神経症状が引き起こされる。PrPCから PrPScへの変換を阻止する、PrPScの除去を増加させる、PrPCを安定化させるなど、さまざまな治療アプローチが検討されており、有機化合物から抗体まで、さまざまな化合物が使用されている。さらに、セルピン阻害剤を用いた非PrP標的薬剤戦略も議論されている。試験管内で数多くの抗プリオン活性の足場がスクリーニングされたにもかかわらず、生体内で有効であったものはわずかであり、残念ながら臨床試験で有効であると証明されたものはほとんどなかった。最近、プリオン蛋白モノクローナル抗体PRN100がCJD患者を対象とした最初のヒト臨床試験で有望な結果が発表された。この包括的な総説では、プリオン病の歴史を再吟味し、様々な抗プリオン薬、その構造、作用機序、毒性について論じた。プリオン病に対する将来の治療法を開発するためには、病因の解明が不可欠である。既存の治療法の結果に基づき、毒性が軽減され、生物学的利用能が向上した新しい抗プリオン薬が同定/合成/設計され、おそらくプリオン病の治療に有効であろう。
キーワード
プリオン治療薬 過去からの教訓 2022t.co/jUXfZ86fCs
この包括的な総説では、プリオン病の歴史を再吟味し、様々な抗プリオン薬、その構造、作用機序、毒性について論じた。
(以下LLMによる要約)— Alzhacker (@Alzhacker) April 19, 2024
はじめに
プリオン病(伝達性海綿状脳症:TSE)は、まれで致命的な人獣共通感染症の神経変性疾患(NDD)であり、ヒト(クロイツフェルト・ヤコブ病:CJD、変異型CJD、致死性家族性不眠症:FFI、Gerstmann-Straussler-Scheinker症候群:GSS、クル)、動物(牛海綿状脳症:BSE、慢性消耗性疾患:CWD、スクレイピー、ネコ海綿状脳症:FSE、伝達性ミンク脳症:TME、哺乳類海綿状脳症:USE):USE)である。
PrPCは32 kDaのグリコホスファチジルイノシトール(GPI)アンカー型糖タンパク質で、多くの組織に発現し、神経組織に多く存在する[引用1]。プリオン病の分子病態には、ミスフォールディングしたプリオンタンパク質(PrPSc)の集合が含まれる[引用2]。正常なPrP(PrPC)は、単量体、αヘリカル、可溶性、プロテアーゼ感受性タンパク質として存在する[引用3]。一方、スクレイピーアイソフォーム(PrPSc)は、多量体でβシートに富み[引用4]、不溶性でプロテアーゼ耐性[引用5,引用6]、感染性である[引用7]。中枢神経系(CNS)において異常なタンパク質の凝集が進行すると、正常な脳の構造(脳組織に海綿状の穴が形成される)に影響を及ぼし、機能(認知、記憶、運動)が低下する。
中枢神経系がプリオン病理の主要な標的であるにもかかわらず、多くのプリオン病は、大脳以外の部位(すなわち、二次リンパ器官、血液、筋肉)でのプリオンの複製によって補完される[Citation8]。PrPCは、末梢神経系(PNS)を介して脳へ輸送される責任分子である。しかし、神経細胞プリオンのPNSからCNSへの、あるいはその逆の輸送機構は十分に理解されていない。ドミノ仮説」(プリオンの伝播は神経細胞上で起こる)[引用9]と「路面電車仮説」[引用10]であり、神経終末がPrPScを取り込んでCNSに戻すというものである。
プリオン病は、後天性(汚染された食物や医療行為による)、散発性(原因不明)、遺伝性(PrP遺伝子:PRNPの変異による)のものがある。PrPの切断型変異は、遅発性の感覚神経障害および自律神経障害を特徴とするPrP全身性アミロイドーシスをもたらす。この疾患の症状は、トランスサイレチン(TTR)遺伝子の変異に起因する自律神経優性NDD、家族性アミロイドポリニューロパチー(FAP)に匹敵する[引用文献11]。この2つの疾患は、病歴の長さによって臨床的に区別することができ、FAPはPrP全身性アミロイドーシスに比べて急速に進行する[引用12]。
年間100万人あたり約1~2人がプリオン病に罹患しており[引用13]、そのうち85~90%の症例が散発性CJD(sCJD)である[引用14]。CJD患者の主な共通臨床症状には、迅速かつ進行性の認知機能低下、平衡感覚障害、協調運動障害、視覚障害、行動変化などがある。これらの症状の一部はADやHDと類似しているが、CJD患者では脳組織がスポンジのように見えるのが特徴である。中国や他の欧米諸国におけるsCJD患者の平均生存期間と生存率は7.1ヵ月で、発症から1年以内の死亡率は78.5%である[引用15]。一方、日本では生存期間が17.4ヵ月と最も長く、死亡率は46%である[引用16]。CJDの診断検査は以下の通りである;脳波検査における周期性同期放電(PSD)または周期性鋭波複合体(PSWC)の検出[引用17-19]、脳脊髄液(CSF)分析[引用20](CSFのリアルタイムクエーキング誘発変換(RT-QuIC)アッセイおよび鼻腔ブラッシングを含む) [引用21,引用22]、頭蓋磁気共鳴画像法(MRI)[引用23]、生検による脳組織中のプリオンの免疫組織化学的検査である。
プリオン病を治療するための有望な標的について、数多くの報告がなされている。細胞療法、免疫療法、薬物療法、化学物質からタンパク質に至る化合物など、様々な研究方法論から膨大な量の文献が入手可能である。PrPScを不安定化し、感染を抑える化合物も同定されている。それらの多くはin vitroで有望な結果を示したが、いくつかのin vivo研究は臨床試験に成功しなかった。その結果、残念ながらプリオン病に対する決定的な治療法は存在せず、病気に伴う症状を和らげる薬だけが使用されている。例えば、精神症状には抗うつ薬や鎮静薬が処方され、ミオクローヌスにはクロナゼパムやバルプロ酸ナトリウムが、CJD患者の認知症にはドネペジル、ガランタミン、リバスチグミン、メマンチンが使用されている[引用24,引用25]。最近、プリオン蛋白モノクローナル抗体(PRN100)がCJD患者を対象とした臨床試験で有望な結果を示した[引用14]。
本総説は、様々なクラスの抗プリオン薬、作用機序、およびこの分野のさらなる研究に役立つであろう他の重要な側面について、最新の包括的な展望を提供した。
治療における抗プリオン剤
PrPCドメインの核磁気共鳴(NMR)とX線結晶構造解析から、C末端(アミノ酸残基128-231)では小さなβシート含量とαヘリカル構造が明らかになった[引用26]が、N末端領域(アミノ酸残基23-127)では適切なフォールディングが欠如しており[引用27]、オクタペプチド反復(OR)(残基60-91)で構成され、それぞれの反復はヒスチジンとトリプトファンを持ち、最大4つの銅(Cu II)を配位する。5番目の銅結合部位は、非OR領域(His 92とHis111)にある[Citation28,Citation29]。113-120残基の間には回文モチーフ(AGAAAAGA)が存在し、これがプリオンの変換に関与していると考えられている[引用30]。回文モチーフが非OR領域に近いことは、Cu(II)結合とプリオン転換との関連を示している[引用31]。Giachinらは、酸性条件下ではPrPCが銅を1つのHisで配位して変換しやすくなるというモデルを提唱し、非OR領域がプリオン変換の重要な制御因子であることを示唆している[引用32]。最近の研究では、生物物理学的手法を用いて、Cu(II)が非OR領域に結合すると、コンフォメーションがコンパクトになり、その結果、この領域の構造可塑性に影響を与えることが示された。さらに、銅の座標幾何学は以下のように同定された:PrPCと PrPScは、それぞれタイプI(閉鎖型)とタイプ2(開放型)であった[Citation33]。
プリオン病の病因において、PrPScは基質としてのPrPCの存在下で、その変化したコンフォメーションを播種することによって増殖する[引用34]。このように、PrPCオリゴマーは基質として作用する以外に、神経毒性の伝達物質でもある[引用35]。したがって、PrPCから PrPCオリゴマーまたはPrPScへの変換を制限できる抗プリオン剤は、治療上重要であろう。これらの相互作用または重合阻害は、PrPCおよび/またはPrPScに結合することによって達成することができる。細胞膜は、PrPCから PrPScへの変換の主要な部位であるので[引用36,引用37
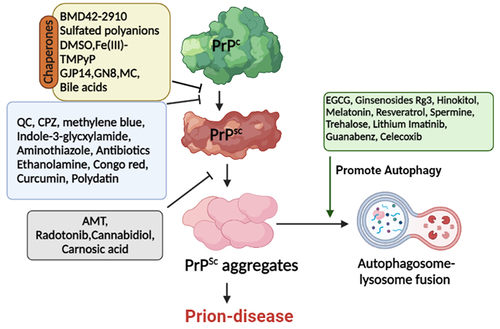
PrPCの再分布は、抗プリオン薬のもう一つの重要な標的である。さらに、PrPCの発現を抑制し、他の経路を標的とすることで、疾患に関連した神経毒性を軽減することも検討されている。すなわち、PrPCの特異的構造安定化、PrPCの非特異的安定化、PrPScの蓄積防止、PrPScと PrPC以外の分子との相互作用による増殖防止である[引用38]。その他のアプローチには、オートファジーの制御や、PrPScの細胞内輸送とPrPCの安定化をそれぞれ補助するシャペロンの使用が含まれる。いくつかの抗プリオン薬の作用機序を示す。
図1. プリオンタンパク質を標的とするいくつかの抗プリオン薬の模式図。PrPC、PrPSc、およびPrPCから PrPScへの変換が、これらの抗プリオン薬の主な標的である。シャペロンはPrPCと直接相互作用し、PrPCを安定化させ、PrPScへの変換を阻止/減少させる。別の化合物群は、オートファジーを促進することにより、毒性凝集体を除去する。略語PrPC: 正常プリオンタンパク質;PrPSc: スクレイピープリオンタンパク質;EGCG: エピガロカテキン-3-ガレート;AMT: アミノチアゾール;CPZ: クロルプロマジン;DMSO:ジメチルスルホキシド;QC:キナクリン。(Biorender.comにより調製)。
1. 化合物
このセクションでは、抗プリオン研究に用いられる様々な重要な足場について述べてきた。これらの化合物のプリオンタンパク質への結合に関する情報、および合成誘導体の構造活性相関(SAR)についても言及した。1はこのセクションで取り上げた様々な側面を要約したものである。
表1. 化学ベースの抗プリオン化合物
| コンパウンド | クラス | 構造 | 投与方法 ルート |
ターゲット | MOA | 毒性/BB浸透性 | ステータス | レフ |
|---|---|---|---|---|---|---|---|---|
| アンレ138b | ジフェニルピラゾール誘導体 |  |
経口 | プロトコル実装適合性宣言 | PrPScのオリゴマー化を阻害する | 1日300mgまで安全 | PD患者を対象としたフェーズ1b試験進行中 | [79-83] |
| BMD42-2910 | ベンゾオキサゾール誘導体 |  |
i.c. | プロトコル実装適合性宣言 | シャペロン PrPScの蓄積を抑える |
マウスで100 mg/Kg/日まで無毒性 | インビボ | [45,46] |
| コンゴーレッド | ジアゾ染料 |  |
皮下、i.p. | PrPC/PrPSc | PrPScの生成をブロックする | 毒性 BBB透過性が悪い PrPCへの非特異的結合 |
In vitro, In vivo(初期) | [59-72] |
| シクロデキストラン | 硫酸化ポリアニオン |  |
プロトコル実装適合性宣言 | シャペロン PrPScのオリゴマー化を阻害する |
非毒性作用 (1日あたり5 mg/kg BW) |
インビトロ | [129,130] | |
| デキストラン硫酸塩 | 硫酸化ポリアニオン |  |
プロトコル実装適合性宣言 | PrPScの膜への付着とその伝播を阻害する。 | NA | in vitro, in vivo(early),ex-vivo | [123-127] | |
| ジメチルスルホキシド | アプロティック溶剤 |  |
経口 | プロトコル実装適合性宣言 | シャペロン; PrPScの蓄積を抑える |
ハムスターで0.25 g/日まで無毒性 | インビボ | [84-88] |
| エタノールアミン | 有機低分子 |  |
PrPScの蓄積を抑える | インビトロ | [89-92] | |||
| 鉄(III)-TMPyP | 環状テトラピロール |  |
i.p. | プロトコル実装適合性宣言 | シャペロン;PrPCの安定化 PrPScのオリゴマー化抑制 |
BBB透過性が悪い 血漿タンパク質との非特異的相互作用 |
in vitro, in vivo | [49-58] |
| GJP14 | カルバゾール誘導体 |  |
プロトコル実装適合性宣言 | シャペロン、PrPSc蓄積阻害剤 | インビトロ | [47,48] | ||
| ジーエヌエイト | ジフェニルメタン誘導体 |  |
皮下 | プロトコル実装適合性宣言 | シャペロン PrPScの生成をブロック |
無毒性 BBB透過性 |
臨床試験の準備 | [46,47,73-76] |
| IND24 IND81 IND125 |
2-アミノチアゾール |  |
経口 | PrPSc | PrPScの形成を抑制する | 無毒性 BBB透過性 |
薬剤耐性の発現によるin vivoでの失敗 | [39-44] |
| インドール-3-グリオキシルアミド | インドール-3-グリオキシルアミド誘導体 |  |
PrPC/PrPSc | PrPScの蓄積を抑制する | ゼブラフィッシュに毒性なし | インビトロ | [97-99] | |
| リチウム & (Li-NP03) |
マイクロエマルジョン | 直腸粘膜周囲 | PrPSc | オートファジー PrPScの減少 |
in vitro; in vivo | [100-106] | ||
| MC | GN8誘導体 |  |
i.p. | シャペロン PrPScの生成をブロック |
動物モデルでは30mg/kgまで毒性なし | in vitro; in vivo; ex-vivo | [66] | |
| メチレンブルー | フェノチアジン誘導体 |  |
プロトコル実装適合性宣言 | PrPScの生成をブロックする | 安全性 <2 mg/kg BBB透過 血漿タンパク質との非特異的相互作用 |
インビトロ | [107,108] | |
| ペントサン ポリサルフェート |
硫酸化ポリアニオン |  |
i.v. i.p. 皮下 経口 |
プロトコル実装適合性宣言 | シャペロン PrpCの安定化 PrPC発現のダウンレギュレーション PrPCの内在化と後期エンドソームおよび/またはリソソームへの再分布を促進する。 |
広い用量範囲(11-110μg/kg/日)で良好な忍容性 6ヵ月間 BBB透過性が悪い |
臨床試験では効果なし | [110-122] |
略語:i.v.:血管内;i.p.:腹腔内;i.c.:頭蓋内
2-アミノチアゾール (2-AMT)
2-AMTは、抗プリオン活性を有する小分子の一種である。当初、2-AMTはPrPCの発現には影響を及ぼさないが、PrPScの形成/除去には影響を及ぼすと提唱されていた[引用39,引用40]。改良された2-AMT類似体は、動物モデルでの経口投与により、スクレイピー感染神経芽腫細胞(ScN2a-cl3)において有効な抗プリオン活性(EC50 81 nM)を示した。また、血液脳関門(BBB)を容易に通過する能力を示し、脳内で治療定常濃度に容易に到達した[Citation41]。2-AMT誘導体、IND24およびIND81は、スクレイピー感染マウスまたはCWDプリオンモデルの寿命をかなり延長した。しかしながら、マウスは、やがて進行した神経機能障害を示し、これらの2-AMTの有効性の限界を示した[引用42]。別の2-AMT誘導体であるIND125は、マウスの大脳におけるPrPScの蓄積とアストロサイトグリオーシスの両方を防ぐことができるが、進行性の中枢神経系機能障害は防ぐことができなかった。 in vitroでのプロファイル、生物学的利用能、マウスにおける生存時間の延長は良好であったにもかかわらず、2-AMTは他の動物実験では失敗した。さらに、IND24とAnle138bとの併用療法は、感染期間の延長において単独療法よりも有意な効果を示さず、プリオン病の治療における併用療法アプローチの不可能性を提唱した[引用44]。
ベンゾオキサゾール誘導体
BMD42-2910は、最近発見された抗プリオン剤であり、マウスモデルにおいて毒性効果を示すことなく、in vitroで低いEC50を示した[引用45,引用46]。この化合物は、プリオン感染マウスの脳内のPrPScを有意に減少させ、生存期間を延長した。分子ドッキング実験により、4つのアミノ酸残基、すなわちAsn159、Gln160、Lys194、およびGlu196において、PrPCとBMD42-2910の結合相互作用が予測された[引用46]。これらの結果は、BMD42-2910が有望な新規抗プリオン化合物であることを示しており、臨床試験を念頭に置いてさらに研究を進める必要がある。
カルバゾール誘導体
GJP14または[2,3,4,9-テトラヒドロ-9-[2-ヒドロキシ-3-(1-ピペリジニル)プロピル]-6-メチル-1 H-カルバゾール-1-オン]は、GT+FK細胞[マウス適応GSS剤(福岡-1株)に持続感染したマウス神経細胞(GT1-7)]による細胞アッセイにおいてPrPScの蓄積を阻害した(IC50 8.54 µM)。[引用47]。この化合物をリード化合物として、様々な誘導体を合成し、抗プリオン活性をスクリーニングした。その結果、N-プロピル基の3位にアミノ基、2位にヒドロキシ基を有する三環式芳香環が抗プリオン活性を示すことが明らかとなった。その結果、N-ortho-fluorobenzyl類似体(IC501.11μM)が親化合物の約8倍強い抗プリオン活性を示すことが判明した[Citation47]。GJP14の結合特性は、表面プラズモン共鳴(SPR)とNMR分光法によって解明され、PrPCのC末端ドメインにリガンド結合ポケットがあることが示された[引用48]。しかしながら、プリオン感染モデルにおけるGJP14のin vivo研究の報告は保留されている。
環状テトラピロール
環状テトラピロールは、金属イオンを有する平面芳香環構造であり、異なる化学的性質の周辺置換基によって定義される。ポルフィリン(重水素ポルフィリンIX 2,4-ビス-(エチレングリコール)鉄(III) (DPG2-Fe3+)、メソテトラ(2-N-メチルピリジル)ポルフィン鉄(III) (TMPP-Fe3+)、テトラ(4-N,N,N-トリメチルアニリニウム)ポルフィン(Fe-TAP)、テトラ(4-スルホナトフェニル)ポルフィン(Fe-TSP)、ヘミン)およびフタロシアニンがこのグループに属する。テトラピロールは、in vitroで PrPScのオリゴマー化を阻害し[引用49]、invivoで生存時間を増加させることが報告されている[引用50-52]。SPRは、環状テトラピロールがPrPCまたはPrPScと直接相互作用することを明らかにし[引用53]、PrPCはPrPのN末端を介して積み重なり、相互関係することによってPrPCに結合する[引用54,引用55]。NMR研究により、プリオンの複製阻害(EC501.6μM)[引用56]および細胞ベースのアッセイにおけるPrPC媒介毒性[引用57]の原因となるFe(III)-TMPyP(KD4.52μM)の結合部位として、ヒトPrPのヘリックス3のC末端およびループ(残基160-180の間)の残基が同定された。Fe(III)-TMPyPの結合は、熱力学的にも速度論的にも、折り畳まれたPrPのコンフォメーションを安定化するようであった[引用58]。テトラピロールは、in vitroと細胞ベースのアッセイにおいて、PrPCの最も強力な薬理学的シャペロンであることが証明されたが、残念なことに、ポルフィリンの治療能力は、バイオアベイラビリティの低さと血漿タンパク質との非特異的相互作用のために、臨床試験で承認されなかった[引用58]。
ジアゾ染料
コンゴーレッド(CR)は、組織学的研究に使用される従来のジアゾ染料であり、βシートコンフォメーションに富むフィブリルタンパク質に結合親和性を有する[引用59,引用60]。CR は抗プリオン活性を有し、PrPC の細胞内レベルを変化させ、PrPSc を安定化させ、PrPCのさらなる変換を防ぐことにより、PrPScの形成を阻害する[引用61][引用62-65]。SPRは、KD値1.6 µMのヒト組換えPrPに対するCR結合を示した[引用66]。他のいくつかの関連色素(シリウスレッドおよび他のスルホン化色素)も、invitroで PrPScの生成を阻害することが報告されている[引用67]。しかし、CR は、in vitroで強い抗プリオン活性を示すにもかかわらず、(CR の異化の際にベンジジン誘導体が放出されるため)潜在的な毒性があると考えられており、高い非特異的結合[引用68,引用69] を伴い、in vivoでのバイオアベイラビリティは低い [引用38]。コア部分のスルホン酸をカルボン酸に置き換えることで)バイオアベイラビリティを向上させ、(ベンジジンに置き換えることで)毒性を低下させるために、一連の CR の類似体が合成され、抗プリオン活性についてスクリーニングされた[引用70]。CR の異なる類似体は、ナノモル領域でPrPScの凝集を阻害した。最も活性の高い化合物 2a は、スクレイピーマウス脳細胞(SMB)[引用71]およびスクレイピー感染ハムスター[引用72]におけるPrPScの形成を潜在的に阻害した(EC50 25-50 nM)。しかしながら、PrPCとの相互作用に関する決定的な報告はない。
ジフェニルメタン誘導体
インシリコベースの薬剤スクリーニングから、ジフェニルメタン誘導体であるGN8は、シャペロンとして作用することでPrPCのコンフォメーションを安定化させ、マウスの神経細胞株においてPrPScレベルをかなり低下させ(IC50~1.35μM)、TSE感染マウスの生存期間を延長させることが明らかになった(皮下注射)[Citation73]。SPRにより、GN8とPrPCとの明確な結合が確認された。結合に関与する残基のほとんどは、C末端ドメイン、すなわちS2-Aループ、Bヘリックス、またはB-Cループに位置している。A-S2ループとB-Cループのインターカレーションは、PrPCのコンフォメーションを安定化するために重要であるようだ。GN8は遠く離れたAsp159とGlu196(PrPCでは36アミノ酸離れている)を水素結合で結びつけ、そのためにさらなる構造変化が阻害されている。PrPC-GN8複合体の自由エネルギー(∆∆H = 6.7 kcal/mol)は、PrPC単独の自由エネルギーよりもかなり低く、その結果、遷移状態が形成される可能性が減少し、PrPCのコンフォメーションが安定化した[引用73]。その後、さらにGN8誘導体が合成され、TSE感染マウス神経細胞における抗プリオン活性が分析された。SARでは、ベンジル位に置換基を持つ誘導体の方が抗プリオン活性が高い(IC500.51-0.83 μM)ことが示された[Citation47,Citation74]。11C標識化合物から得られた陽電子放射断層撮影(PET)画像により、GN8誘導体がBBBを通過して脳内に入ることが立証された[引用48]。さらに、GN8の非臨床安全性評価では、抗プリオン活性に十分な投与量において、重篤な副作用は認められなかった[引用75]。より活性の高いシャペロンを求めて、研究者たちはGN8を医療用シャペロン(MC:N,N‘-([シクロヘキシルメチレン]ジ-4,1-フェニレン)ビス(2-[1-ピロリジニル]アセトアミド))に改良した。MCがPrPCに結合すると、結合部位(アミノ酸残基186-196)の揺らぎが減少し、ヘリックスAの他の領域(アミノ酸残基144-154)の不安定性が増加した。さらに、PrPScのオリゴマー化を阻害し、感染細胞内での除去を促進した。興味深いことに、MCは様々な株(Fukuoka-1、22 L、RML)および宿主(マウス、サル)で有効性を示し、薬剤耐性の生成を阻止した[引用76]。プリオン病においてMCが示した有望な結果を受け、科学者たちはプリオン病のヒト臨床試験に向けて取り組んでいる。
ジフェニルピラゾール誘導体(DPP)
ジフェニルピラゾール類似体は、in vitroでPrPScのオリゴマー化を強力に阻害する。DPP-1と名付けられた最も効率的な阻害剤は、SMB細胞とScN2a細胞でそれぞれ0.6μMと1.2μMのIC50値を示した[引用77]。SAR研究では、SMB細胞ではメチル基が活性を向上させる重要なモチーフとして記録されたが、ScN2a細胞ではそうではなかった。ScN2a細胞では、DPP-1はPrPCの発現にもプロテアソーム活性にも影響を与えず、無細胞アッセイでも効果を示さなかった。それにもかかわらず、in vitroでも in vivoでも毒性は報告されておらず、マウスの臨床的発症を遅らせた[引用77]。
Anle138b、3-(1,3-ベンゾジオキソール-5-イル)-5-(3-ブロモフェニル)-1 H-ピラゾールは、無細胞タンパク質ミスフォールディング環状増幅法(PMCA)と異なるPrPSc株に感染したマウスにおいて、PrPScの形成を阻害した(EC50vCJDで7.1 μM、マウスRMLで7.3 μM)。驚くべきことに、Anle138は後期プリオン感染においても生存期間を延長した[引用79]。刺激的なことに、Anle138bはα-シヌクレインの凝集も阻害し、パーキンソン病(PD)の病態生理学において治療的役割を果たす可能性がある[引用80]。したがって、Anle138bは、他のタンパク質ミスフォールディング疾患に対する有望な新規リード化合物となりうる。Anle138bの作用機序を全原子分子動力学法を用いて解明したところ、Anle138bはそのピラゾール部分を介して未組織タンパク質と相互作用し、ペプチド間相互作用と自発的なβシート形成を阻害した。これらの相互作用は、分子内の水素結合を減少させ、アロステリック誘導からリモデリングするのに役立った。しかしながら、別の類似体であるAnle234bは、この研究では凝集に影響を与えなかった[引用81]。Anle138bが、経口投与が可能な無毒性の有望なリード化合物であることは間違いない。しかし、Anle138bは病気の進行を遅らせるだけであり、病気を修飾するものではないので、治療薬ではない。健康な男女を対象としたAnle138bの安全性、忍容性、薬物動態を評価するファースト・イン・ヒト試験」がフェーズ1をクリアした[引用82]。この試験の結果、薬物の半減期は12時間であり、血漿中濃度は有効性に必要な濃度を大幅に上回ることが示された。300mg/日までの用量は安全であると考えられている。同社(MODAG GmbH)は、Anle138bによるPDを対象としたフェーズ1b試験を開始した[Citation81]。この試験では、150mgとそれ以上の1日投与量の幸福度、受容性、薬物動態が評価される。この試験は今年中に完了する予定である[引用83]。
ジメチルスルホキシド(DMSO)
DMSOは実験室で頻繁に使用される非プロトン性溶媒である。DMSOは中間体βシートの形成を阻害することができるため、多くの末梢性アミロイド性疾患の治療に用いられてきた[Citation84,Citation85]。DMSOの投与は、プリオン感染ハムスターの生存期間を有意に延長し、感染動物の脳におけるPrPScの蓄積を減少させたが、これは後に尿中に検出された[引用86]。DMSOは、あらかじめ形成されたPrPSc凝集体を可溶化することはできないが、プリオン感染膜を洗浄剤で抽出する際に生じるPrPSc蓄積をうまく抑えることができ[引用87]、化学的シャペロンとしての役割を示唆している[引用88]。
エタノールアミン
エタノールアミンは新しく発見された抗プリオン化合物であり、プリオンに感染したN2aC24L1-3細胞のPrPScレベルを用量依存的に効果的に減少させた。同じ研究で、エタノールアミン経口投与はRMLプリオン感染マウスに有効であることが証明された[引用89]。エタノールアミンはPrPCの細胞内局在に影響を与えず、in vitroでの PrPCから PrPScへの変換を妨げなかった。エタノールアミンは、細胞膜の重要な脂質成分であるホスファチジルエタノールアミン生合成に必要であり[引用90]、その結果、PrPCから PrPScへの変換が促進された[引用91]。対照的に、別の研究ではホスファチジルエタノールアミンがPrPCから PrPScへの変換を阻害した[引用92]。したがって、プリオン病におけるエタノールアミンの役割を確認するためには、さらに多くの研究を行う必要がある[引用89]。
インドール-3-グリオキシルアミド
インドール-3-グリオキシルアミドの足場は医薬品として重要であり、アトピー性皮膚炎[引用文献93]、HIV[引用文献94]、いくつかの癌[引用文献95]、急性冠症候群[引用文献96]の治療に使用されている。一連のインドール-3-グリオキシルアミドが合成され、SMB細胞における抗プリオン活性が評価され、最も強力な2つの化合物、1(EC501.5μM)と2(EC506.4μM)が抗プリオン剤として同定された。しかし、インドール-3-グリオキシルアミドは40μMまでPrPCと直接相互作用しなかったことは興味深い[引用97]。
SAR研究により、一級芳香族アミンから誘導され、パラ置換基を有するグリオキシルアミドが、SMB細胞株アッセイにおいて最適な効力を発揮するための重要な要件であることが明らかになった。これらの結果に基づいて、N-1が無置換のインドール-3-グリオキシルアミドがより高い活性を示し、抗プリオン活性のためにはC-2に置換基がないことが必要である。最も有効な化合物はp-アミノ置換基を有していた:p-ピペリジノ>p-NMe 2>p-モルホリノ>p-ピロリル>p-1 H-ピラゾリルで、IC50はナノモル範囲であった(それぞれ72 nM >26 nM >9 nM >6 > 1 nM)[引用97,引用98]。さらに、C-6での置換(R3=6-Me、6-CNまたは6-NO2)は、未置換の親と比較して、安定性の向上、低毒性、およびより良好なEC50値をもたらした[引用99]。しかし、プリオン感染モデルでのin vivo研究の報告はない。
リチウム
リチウムは銀白色のアルカリ金属で、NDDにおける神経保護活性の可能性がある[引用100,引用101]。さらに、抗プリオン剤としてのリチウムの役割は、プリオン感染細胞培養で評価されており、リチウムはオートファジー機構を通じてPrPSc凝集を減少させた[引用102]。Liは、プリオンに誘導された神経変性に関与する重要な酵素であるグリコーゲン合成酵素キナーゼ3(GSK-3)の活性化を阻害することが報告されている[引用103]。Songら[引用104,引用105]は、Liが生存関連タンパク質(RE1 Silencing Transcription Factor:RESTおよびWingless関連統合部位:Wnt)、活性酸素種(ROS)を減少させ、シナプスを修復する。しかし、Liの治療域は狭く(血漿中濃度0.5-1.2mEq/L)、上記濃度を超えると毒性を示す[Citation105]。プリオン感染マウスにLiマイクロエマルジョン(NP03)を幅広い用量(40μg/kg/day~16mg/kg/day)で投与すると、最低用量でも感染動物の生存期間が延長し、PrPScレベルがわずかに低下した[引用106]。神経病理学の改善におけるNP03-Liマイクロエマルジョンの有望な結果は、Li単独と比較して、病気の後期段階においてさえ、プリオンマウスモデルで顕著であり、プリオン病の慢性治療における使用の可能性を示唆している。
フェノチアジン誘導体(メチレンブルー)
フェノチアジン誘導体であるメチレンブルー(MB)は、ヒト、ウシ、ネズミの組換えPrPを用いた研究において、PrPCに結合し、オリゴマー化速度に影響を与える可能性がある[引用107]。NMRの結果、MBはヘリックス1-3のAsn146, 156;Tyr160;Lys188; Thr191, 194, 195;Val192,Gln215残基に結合できることが示された。しかしながら、他のタンパク質に対するMBの非特異的結合は、その使用を制限する可能性がある[引用108]。
硫酸化ポリアニオン
ペントサンポリサルフェート (PPS)は、キナクリンに次いでプリオン病における重要な薬剤の一つである。ポリアニオン性化合物はN末端のHisと相互作用し、平面芳香族化合物はπスタックを形成してTrp側鎖内にインターカレートする[引用55,引用109]。この結合は、PrPC発現のダウンレギュレーション[引用110]あるいはPrPCの内在化[引用111]に関与している。等温滴定熱量測定(ITC)は、PPSがPrP上に2つの結合部位を持ち、複数のPrP分子に結合してリフォールディングを遅延させることができることを示した。力スペクトロスコピーの測定から、PPSはシャペロンとして、PrPのネイティブPrPと他の不完全に折り畳まれた中間体の両方を安定化することが明らかになった[引用112]。PPSはまた、細胞培養において、プリオンの増殖を阻害し[引用113]、プリオン感染マウスにおいて予防的・治療的に生存期間を延長することにより、抗プリオンの可能性を示した[引用114,引用115]。PPSは、内因性グリコサミノグリカン(GAG)によるPrPCと PrPScの結合に競合的に影響を与えるか[引用113]、ヘパリン模倣化合物のように細胞表面でPrPScを断片化する[引用116]のではないかと推測された。ニワトリPrPCを過剰発現するマウス神経芽細胞において、PPSは、100μg/mlでPrPCレベルを減少させることに加えて、PrPCの内在化を促進し、後期エンドソームおよび/またはリソソームへの再分布を促進することができる[引用111]。逆に、PPSは、10μg/mlまでのPrPCの細胞内分布に影響を与えることなく、N2a-3細胞(マウス神経芽腫細胞株Neuro 2aのサブクローン)においてPrPScレベルを速やかに減少させた[引用118]。PPS処理はまた、CWD感染シカ細胞モデルにおいて、RML感染N2a細胞で報告されたのと同様の効果で、PrPSc凝集を阻害した[引用119]。PPSはvCJD被験者の生存期間を延長したが、臨床的利益は報告されていない[引用120]。PPSのBBB透過性の悪さは、脳室内投与によって改善される可能性がある[Citation115,Citation121]が、残念ながら治療群と未治療群の病理学的変化には大きな変化はなかった[Citation122]。
デキストラン硫酸 (DS)は、PrPCの変換を阻害することにより、強力な抗プリオン活性を示しながら最小限の細胞毒性を示した[引用123]。N2a-58細胞では、DSはPrPScの膜への付着とその増殖を特異的に阻害した[引用124]。また、DSの投与は、マウス[Citation125,Citation126]およびハムスター[Citation127]において、感染後2時間以内の発症を遅らせたが、その後は効果がなくなった[Citation125]。
シクロデキストランは、食品産業において様々な目的の添加物として使用されている[引用128]。β-形態のシクロデキストリンは、スクレイピーに感染した神経芽腫細胞からPrPScを除去するのに、α-形態(IC50 750μM)よりも効率的(IC50 75μM)であることが判明した。SARは、抗プリオン活性がシクロデキストリンのサイズに依存することを発見した。シクロデキストリン中のグルコピラノース単位の構造的配向は疎水性空洞を形成し、疎水性部分を包み込むことができる[引用129]。シクロデキストリンの抗プリオン活性は、PrPCの適切なフォールディングを補助するシャペロン機能により、硫酸化によって増強される可能性があり、その陰イオン特性によるものではない[引用130]。
2. リパーポーズド医薬品
医薬品もまた化合物であるにもかかわらず、それらは別の見出しで論じられる。このセクションでは、米国食品医薬品局(US-FDA)の承認を得ている薬剤について述べる。これらの薬剤は、許容できる薬物動態と安全性プロファイルを有し、他の様々な疾患の治療薬としてすでに市販されている。これらの薬剤はプリオン病に対する有効性を検討するために再利用されている)。
表2. 抗プリオン化合物として再利用された薬剤
| 名称 | クラス | 構造 | 投与方法 ルート |
戦略 | MOA | BBB透過性/毒性 | ステータス | レフ |
|---|---|---|---|---|---|---|---|---|
| セレコキシブ及びその誘導体 (AR-12, AR-14) |
非ステロイド性抗炎症薬; COX-2阻害剤 |
 |
i.p. | オートファジー | PrPScによるミクログリアの活性化と炎症をブロックする; PrPScの蓄積を抑える |
BBB透過性 非毒性 |
in vivo,in vitro | [133-136] |
| クロルプロマジン | フェノチアジン誘導体; 抗精神病薬 |  |
経口 | プロトコル実装適合性宣言 | PrPSc濃度をゆっくりと低下させる; PrPScの細胞内分布と代謝を変化させる。 |
BBB透過性 | in vitro, in vivo | [53,138-144] |
| エファビレンツ | 非ヌクレオシド系逆転写酵素阻害薬; 抗HIV薬 |
 |
経口 | Cyp46A1活性化因子 | PrPScの形成を抑える | BBB透過性 | in vitro, in vivo | [145] |
| フルピルティン | トリアミノピリジン; 非オピオイド鎮痛薬 |  |
経口 | 神経保護作用; Bcl 2アップレギュレーション |
PrPScを減少させ、PrP断片によって誘導される神経毒性およびアポトーシス細胞死から保護する。 | BBB透過性 忍容性 |
CJD患者:二重盲検試験:認知機能の改善、疾患の進行には影響なし | [146-154] |
| グリメピリド | スルホニルウレア誘導体; 抗糖尿病薬 |  |
(GPI)ホスホリパーゼC | PrPCの発現を低下させる;PrPScレベルを低下させる; 抗炎症作用 |
BBB能力が低い | インビトロ | [161-165] | |
| グアナベンツ | α2-ARアゴニスト;降圧薬 |  |
オーラル i.p. |
プロトコル実装適合性宣言 | PrPScのクリアランスを促進する | BBB透過性 毒性がない | in vivo、in vitro、ex vivo | [156-159] |
| イマチニブ | チロシンキナーゼ阻害剤; 抗がん剤 |  |
i.p. | オートファジー | PrPScのリソソームクリアランス | BBB能力が低い | in vivo,in vitro | [166-170] |
| キナクリン | アクリジン誘導体; 抗マラリア薬 |  |
経口 | プロトコル実装適合性宣言 | PrPScの形成を抑制する | BBB透過性 300mg/日まで無毒性 |
CJD患者を対象とした第II相試験の失敗 | [53,139,140,171-180] |
| ラドチニブ | チロシンキナーゼ阻害剤; 抗がん剤 |  |
NA | PrPScの蓄積を抑える | BBB透過性 1g/kgまでの無毒性 | in vivo, 特許出願中 | [184,185] | |
| シンバスタチン | HMG-CoA阻害薬;コレステロール低下薬 |  |
経口 | タンパク質のプレニル化を阻害;抗炎症; 抗酸化物質 |
PrPScレベルを下げる | BBB透過性 | インビボ | [186-194] |
| テトラサイクリン ドキシサイクリン アムホテリシンB |
抗生物質 |  |
経口 | プロトコル実装適合性宣言 | PrPScレベルを下げる | BBB透過性 安全(テトラサイクリンとドキシサイクリン) AmB:毒性の問題 |
in vitro, in vivo ドキシサイクリン第II相CJD:CJD末期には効果なし |
[196-209] |
セレコキシブ
セレコキシブは、シクロキシゲナーゼ(COX-2)を阻害する薬としてFDAに承認されている非ステロイド性抗炎症薬(NSAID)である[引用131]。また、PrPScが誘発するミクログリアの活性化を阻害し、プロスタグランジン(PGE2)と一酸化窒素(NO)を放出することができる[引用132]。一方、ケトプロフェン(COX-1阻害剤)は、ミクログリアの活性化およびPrPScによって引き起こされる関連反応を阻害することができなかったことから、PrPScによって誘発される炎症がプリオンの進行に関与していることが示唆された[引用132]。抗がん剤のセレコキシブ誘導体AR-12(OSU-03012)は、進行または再発の固形がんやリンパ腫患者を対象とした臨床試験の第I相で、FDAによって承認された治験薬(IND)として評価された[引用133]。Abdurahmanらは、AR-12とその誘導体、AR-14の効果を神経細胞と非神経細胞培養モデルで評価し、抗プリオン特性を明らかにした[引用134]。AR-12は、プリオンに感染したScN2aおよびScMEF細胞においてPrPScの有意な減少を示した。長期投与は、高感度RT-QuIC分析において、投与を中止した場合でもPrPScを消失させた。AR-12とAR-14の両方が細胞のオートファジーを誘導し、感染を根絶することが示唆されている[引用134]。特筆すべきは、AR-12がBBBをうまく通過できることであり[引用135]、これは抗プリオン薬にとって不可欠な要件である。オートファジーは自然な細胞の分解・再処理経路であり、細胞質から機能不全に陥った成分が小胞に詰められ、分解のためにリソソームに送られる。したがって、オートファジーの流れを促進することによって、PrPScのリソソーム分解も促進され、プリオン病に対する治療法を提供することができる[引用136]。
クロルプロマジン(CPZ)
フェノチアジン誘導体であるCPZは、米国FDA認可の抗精神病薬であり[引用137]、BBBを通過することができる。CPZは、薬理学的シャペロンとして作用することによりヒト組換えPrPに結合し、PrPScの形成を阻害した(EC503 μM)[引用138]。しかし、その相互作用は、キナクリン(抗マラリア薬)よりも弱い[Citation53,Citation139,Citation140]。残念なことに、CPZはタンパク質のミスフォールディング環状増幅(PMCA)アッセイでは結果を示すことができず[引用141]、細胞アッセイではPrPScの蓄積を阻害することができなかった[引用142]。CPZが後期エンドソーム/リソソームにおけるPrPScの再配置を誘導する可能性が示唆された[引用143]。CPZの活性は、400 nMでPrPScの形成を完全に阻害するキナクリンよりも10倍低いことが判明した[引用45]。CPZの投与は、プリオンに脳内感染したマウスの潜伏期間を延長し、罹患率をいくらか低下させた[引用144]。
エファビレンツ(EFV)
EFVは、ヒト免疫不全ウイルス(HIV)を治療するための経口非ヌクレオシド系逆転写酵素阻害薬(NNRTI)として米国で承認されている。重要なことに、EFVは、プリオン病におけるチトクロームP450ファミリー46サブファミリーAメンバー1(CYP46A1)レベルを有意に低下させながら、BBBを効果的に通過することができた[Citation145]。したがって、CYP46A1活性化剤であるEFVは、プリオンに感染した神経細胞やマウスに使用することができ、PrPCに影響を与えることなく、PrPScの増殖をかなり緩和することができる[引用145]。したがって、EFVはプリオン病において有効な薬剤であることが証明されるかもしれない。
フルピルチン(FLU)
トリアミノピリジン系鎮痛薬であるフルーは、有名で、忍容性が高く、非麻薬性鎮痛薬であり、筋弛緩作用もある。米国FDAの承認は得ていないが、欧州では許可されている[引用147]。以前の研究で、FLUはPrPCに結合することなくN-メチル-D-アスパラギン酸受容体(NMDAR)の拮抗薬として作用する可能性が示されたが[引用148]、神経細胞上のNMDARと相互作用し、NMDAR依存性の神経細胞の興奮性および興奮毒性を調節することができる[引用149]。PrPScが細胞表面のPrPCに結合すると、シグナル伝達カスケードが開始され、α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸受容体(AMPAR)とNMDARの活性化、カルシウムイオンの流入、ミクログリアの神経炎症の重要な調節因子であるp38マイトジェン活性化プロテインキナーゼ(MAPK)の刺激につながる可能性がある。最終的には、樹状突起スパインの分解につながるアクチン細胞骨格が破壊され、興奮性神経伝達が低下する[引用150]。
FLUは、invitroにおけるPrP断片化やアミロイドβ誘導によって誘発される神経毒性から神経細胞を保護した[引用151]。CJD患者を対象とした二重盲検試験[引用152]では、FLU投与により認知機能が改善したことが明らかにされ、BBBを通過するFLUの能力が支持された[引用153]。しかし、同試験においてFLUは病気の進行や生存期間に影響を与えることはできなかった。FLUの神経保護作用は、抗酸化作用(グルタチオンレベルの維持)、グルタミン酸を介した興奮毒性に対する防御作用、アポトーシス経路における役割(抗アポトーシスB細胞リンパ腫2タンパク質:Bcl-2の増加)などによると考えられる[引用154]。
グアナベンツ(GA)
GA:α2-アドレナリン受容体(α2-AR)作動薬[引用155]は、FDAの認可を受けた降圧薬であり、長い間使用されている。抗プリオン特性を用いたスクリーニング研究において、GAは酵母とヒツジの両方のプリオンに対してin vivoで PrPScのクリアランスを刺激した。GAはPrPの変換には直接関与せず、代わりにリボソームのタンパク質折り畳み活性(PFAR)を変化させる[引用156]。さらに、GAは毒性がなく、BBBを容易に通過することができる[引用157,引用158]。プリオン病の治療においてGAの副作用(降圧作用)を克服するためには、α2-ARアゴニスト活性を除去することが不可欠である。そこで、SARに基づいて、ベンジル部分とグアニジン上の塩素の位置の変更を行った。その結果、α2-ARアゴニスト活性とは無関係に、GAと比較して強い抗プリオン活性(IC502.8 ± 1.3 μM;1.1 ± 0.5 μM、12.5 ± 2.7 μM、それぞれ6、7、GA)を有する誘導体6および7が得られた。GAと同様に、これらの誘導体もPFARを阻害することにより抗プリオン効果を示した[引用159]。したがって、これら2つのGA誘導体は、次のin vivoおよび臨床研究にとって価値があると思われる。
グリメピリド
グリメピリドはスルホニルウレア誘導体であり、2型糖尿病の治療薬として米国FDAに承認されている[引用160]。プリオンに感染した神経細胞(ScN2a、SMB、ScGT1細胞)に対するグリメピリドの効果を調べた。その結果、グリメピリドは内因性のグリコシルホスファチジルイノシトール(GPI)-ホスホリパーゼCを活性化することにより、PrPCの発現とPrPScの形成を低下させ、神経細胞表面のPrPC発現を減少させることが示された。さらに、グリメピリドはプリオン由来のペプチドPrP82-146に対しても神経保護効果を示した[引用161]。このペプチドは、細胞質ホスホリパーゼA2(cPLA2)の活性化とプロスタグランジンE2(PGE2)の産生を誘導することが知られており、プリオン病における神経細胞傷害と関連している[引用162,引用163]。さらに、グリメピリドはマクロファージにおけるCD14(cluster of differentiation 14)や他の炎症性サイトカインの発現を低下させることにより、抗炎症活性を発揮した[引用164]。動物データから、グリメピリドは胎盤を通過することが示されているが、そのBBB透過性は低い[引用165]。
イマチニブ
イマチニブは、経口化学療法薬として米国FDAに承認されたチロシンキナーゼ阻害薬である。イマチニブはオートファジーを誘導し[引用166,引用167]、プリオン感染ScN2a細胞およびスクレイピー感染マウス脾臓におけるPrPScのリソソームクリアランスを促進することができる[引用166,引用168]。しかし、腹腔内投与(i.p.)または脳室内投与(i.c.)による中枢神経系でのクリアランスには、そのような効果は認められなかった。
キナクリン(QC)
QCはアクリジン誘導体であり、細胞ベースのアッセイにおいてPrPScの形成を効果的に阻害した(EC500.3μM)[引用171]。米国FDAは、BBBを通過する能力を持つ抗マラリア薬であるQCの再利用を承認している[引用172][引用173]。NMR分光法によって観察されたように、QCはヒト組換えPrP球状ドメインのヘリックス3のTyr226、Gln227(アミノ酸残基121-230)、Tyr225に結合することができ[引用174]、薬理学的シャペロンとして作用する[引用140]。QCはin vitroでの PrPScのクリアランスにも関与している[引用175]。しかしながら、ScGT1細胞(慢性的にスクレイピーに感染したネズミの神経細胞)では効果がなく、長期間の治療が必要であることが示唆された[引用172]。QCの細胞毒性は、細胞アッセイにおいて2μM以上であり[Citation45,Citation171]、PrPScの形成を阻止する至適濃度は〜4μMであった[Citation172]。QCとシンバスタチンまたはデシプラミンとの併用療法は、QC単独よりも効果的であることが判明した[引用176]。
SARに基づく研究では、(S)-QCは(R)-エナンチオマーと比較して優れた抗プリオン活性を示すことが示された[引用171]。別の研究では、抗プリオン活性を高めるためには、三環式骨格の7位の窒素と脂肪族側鎖が重要であることが示されている[引用138]。三環式骨格の9位の環窒素からジメチルアミノプロピル側鎖を持つ化合物(プロマジン、クロルプロマジン、アセプロマジン)は、より優れた結合活性を示した(EC505μM)。一方、ジメチルアミノ-2-メチルプロピル側鎖を持つプロメタジンは、比較的活性が低かった(EC50≈8μM)[引用138]。QCの有望なin vitro抗プリオン活性にもかかわらず、in vivoでは有益な効果は観察されなかった[引用172,引用177]。さらに、CJD患者を対象とした第2相臨床試験でQCが評価された際にも好ましい結果は観察されず、むしろ肝機能障害を引き起こした[引用177-180]。継続的なQC治療によるもう一つの結果は、薬剤耐性プリオンの形成であった。これらの薬剤耐性プリオンの一過性の蓄積が、生体内におけるQCの無効性の原因かもしれない[引用39]。
ラドチニブ
ラドチニブは経口のチロシンキナーゼ阻害薬であり、慢性骨髄性白血病(CML-CP)の治療薬として韓国FDAから承認されている[引用181]。また、PD患者の治療薬としても考えられている[引用182]。ラドチニブはイマチニブと構造的に類似しており、前臨床試験でイマチニブと比較して優れた抗がん作用を示し[引用183]、第I相試験では1g/日まで毒性を示さなかった[引用184]。ラドチニブ(100mg/Kg p.o.)は、プリオン感染ハムスターモデルにおいて、脳内のPrPSc沈着を減少させ、治療群の生存期間を延長させるという有望な結果を示している[引用185]。作用機序に関するその他の詳細はまだ得られていない。
シンバスタチン
膜コレステロールは、PrPCから PrPScへの変換において重要な役割を担っていることから[引用186,引用187]、コレステロール阻害剤の抗プリオン活性が検討されてきた。シンバスタチンはコレステロール低下薬として米国FDAに承認されている。シンバスタチンの投与(1mg/Kg)は、プリオン病の進行を有意に遅らせ、プリオン感染マウスの生存期間を延長した[引用188]。スタチンは上流のメバロン酸/イソプレノイド経路を阻害することにより、タンパク質のファルネシル化とゲラニル化の両方を阻害することがすでに知られていることから、シンバスタチンはタンパク質のプレニル化を通じてプリオン感染に有益な効果を発揮する可能性が提唱された[引用190]。イソプレノイド合成とタンパク質のプレニル化を阻害することで、invivoでのAβの蓄積を減少させることができることが、説得力のあるデータによって示唆されており[引用191]、スタチンによる神経保護を促進するための、より戦略的なメカニズムであろう[引用192,引用193]。さらに、抗炎症作用と抗酸化作用は、プリオン病の治療にプラスの相乗効果をもたらすであろう[引用186,引用194]。
抗生物質
プロテイナーゼK消化に対する耐性は、PrPScの重要な特徴である[引用27]。研究により、プリオンが抗生物質にさらされると、酵素消化を受けやすくなり、プリオン感染の減少を伴うことが明らかになった[引用195]。その結果、抗生物質は、抗生物質としての活性とは別に、脳を衰弱させる病気に対する抗生物質としても見直されている。
テトラサイクリンはよく特性化された安全な抗生物質であり、米国FDAの認可を受けている。テトラサイクリンは、in vitro[引用文献196,引用文献197]およびex vivo条件下でプリオン感染から細胞を保護した。プリオンに感染した脳ホモジネートをテトラサイクリンでプレインキュベートすると、臨床症状の発現が遅延し、動物の生存期間が延長した。フォルローニ(Forloni)らは、テトラサイクリンがプリオン病の強力な治療薬であり、線維形成を標的とし、神経細胞の減少とアストロサイトの増殖を阻止することを実証した[引用文献195]。NMR分光法は、テトラサイクリンが構造変化の鍵となるアミノ酸(残基100-126)と相互作用することを明らかにした[引用196]。ドッキングと分子シミュレーションは、テトラサイクリンがPrPのヘリックス-2のThr(190-193)の官能基と強く相互作用することを示唆した[引用198]。テトラサイクリンはまた、抗酸化、抗炎症、抗アポトーシスのメカニズムを通じて、間接的な神経保護効果を示すかもしれない[引用199]。同様の分子であるアントラサイクリン系のイドドソルビシンは、ネズミのモデルにおいて、プリオン感染を減少させるPrPに対する親和性を有することが報告されている[引用200,引用201]。ドキシサイクリンは第2世代のテトラサイクリン系抗生物質で、BBB透過性と安全性プロファイルがより優れており[引用202]、in vitroで PrPScレベルを低下させ、プリオン感染動物の生存期間を延長させたことが報告されている[引用203]。しかしながら、CJDに関する無作為化二重盲検プラセボ対照第2相臨床試験では、ドキシサイクリン(100mg/日)は、CJDの後期に有意な影響を及ぼすことなく、良好な忍容性を示した[引用199,引用204]。
アムホテリシンB(AmB)は、米国FDAが承認したポリエン系抗生物質であり、抗プリオン活性も示したが[引用205]、その毒性のために使用は制限されている。その結果、AmBの誘導体(カルボキシル基をメチルに置き換えたもの)が抗プリオン活性について試験され、AmBと比較して毒性は低いものの、同等の効力があることが判明した[Citation206,Citation207]。一方、AmBの別の誘導体であるMS-8209は、PrPScに対する直接的な効果を示すことができなかった[引用208]。最近、アミノグリコシドG418(Geneticin)が、PrPのレベルや局在に影響を与えることなく、プリオン感染の初期段階に関与するde novoプロセスを阻害することが報告された[引用209]。
3. 天然化合物
いくつかの天然ポリフェノールは、抗炎症作用、抗酸化作用、神経保護作用、自己貪食促進作用があることがすでに報告されている[引用210]。ポリフェノールは、β-アミロイドやα-シヌクレインのような様々な病理学的タンパク質の凝集を阻害した[引用211,引用212]。これは、異常なコンフォメーション変化を阻害することによってβシートと直接相互作用することによって[引用213,引用214]、あるいはタンパク質凝集の金属イオン相互作用を傾けることによって[引用215,引用216]。植物由来の天然化合物とは別に、胆汁酸、ホルモン、二糖類のような抗プリオンの可能性を持つ他の天然化合物についても議論されている)。
表3. 抗プリオン剤としての天然化合物
| 名称 | クラス | ソース | 構造 | 投与方法 ルート |
戦略 | MOA | 毒性/BBB | ステータス | レフ |
|---|---|---|---|---|---|---|---|---|---|
| バイカレイン | フラボノイド | オウゴン |  |
経口 | 神経保護 | 活性酸素を減らす; JNKリン酸化を抑制する |
インビトロ in vivo |
[217-220] | |
| カンナビジオール | カンナビノイド | カンナビス・サティバ |  |
決め手に欠ける | PrPScレベルを下げる | BBBを通過可能 無毒性 |
インビトロ | [224] | |
| カルノシン酸/カルノソール | カテコール | ローズマリー |  |
PrPSc | PrPSc凝集体のde novo生成を抑える | BBBを超えることができる | インビトロ | [226-228] | |
| クルクミン | クルクミノイド | クルクマ・ロンガ |  |
経口 | プロトコル実装適合性宣言 | PrPC-PrPSc変換を防ぐ | BBBを通過可能 無毒性 |
in vitro インビボ |
[229-234] |
| エピガロカテキンガレート | カテキン | 緑茶 |  |
オートファジー | PrPSCの細胞内輸送 | インビトロ | [235-239] | ||
| ジンセノサイドRg3 | サポニン | 蒸し人参 |  |
オートファジー | PrPScの毒性を抑える | インビトロ | [240-242] | ||
| ヒノキチオール | トロポロン誘導体 | クプレッソス属 |  |
オートファジー | PrPScの毒性を抑える | インビトロ | [243-246] | ||
| メラトニン | 神経内分泌ホルモン | 松果体 |  |
オートファジー | PrPScの毒性を抑える | インビトロ in vivo |
[249-254] | ||
| ポリダチン | レスベラトロール配糖体 | イタドリ |  |
プロトコル実装適合性宣言 | PrPC-PrPSc変換を防ぐ | インビトロ インシリコ |
[257-259] | ||
| レスベラトロール | スティルベノイド | ブドウ/ベリー |  |
オートファジー | PrPScレベルを下げる | インビトロ | [261,262] | ||
| スペルミン | ポリアミン | 真核細胞 |  |
オートファジー | PrPScの毒性を減少させる 活性酸素を減少させる |
インビトロ | [266] | ||
| タウロソデオキシコール酸 およびウルソデオキシコール酸 |
胆汁酸 | 胆汁 |   |
PrPC; ケミカルシャペロン |
PrPC-PrPSc変換を抑える | BBBを通過可能 無毒性 |
インビトロ in vivo |
[221-223] | |
| トレハロース | 二糖類 | 菌類、植物、無脊椎動物 |  |
経口 | オートファジー | PrPScの蓄積を抑える | インビトロ in vivo |
[268-271] |
バイカレイン
バイカレインは、ミント科のハーブScutellaria lateriflora(ブルースカルキャップ)から得られるフラボノイドであり、神経保護に有効であることが知られている[引用217]。これは、c-Jun N-末端キナーゼ(JNK)経路におけるリン酸化を阻害することによって活性酸素誘導性の細胞死を調節することにより、in vitroのSH-SY5Y細胞およびSK-N-SH細胞において神経保護メカニズムを発揮し、PrPScの蓄積を減少させることが報告されている[引用218][引用219]。さらに、S. lateriflora(水抽出物)の経口投与は、プリオン感染マウスの培養時間を増加させた。バイカレイン水和物とバイカレインは、プリオンの増殖と残存フィブリルの除去に対して、ほぼ同じ抑制効果を持つことが観察された[引用220]。
胆汁酸
胆汁酸、タウルソデオキシコール酸(TUDCA)およびウルソデオキシコール酸(UDCA)は、in vitro、ex vivo、およびin vivoにおいて、ScN2a細胞におけるPrPCから PrPScへの変換を阻止することにより、神経喪失を減少させ、プリオン動物モデルにおける雄マウスの生存率を増加させる[引用221]ことにより、神経保護作用を示し、化学的シャペロンと呼ばれている[引用222]。有望な結果に加えて、これらの胆汁酸は比較的毒性がなく、BBBを通過することができ、経口で生物学的に利用可能である。さらに、TUDCAはすでに原発性胆汁性肝硬変の治療薬としてFDAに承認されている[引用223]。
カンナビジオール(CBD)
カンナビス植物由来の非精神活性化合物であるCBDは、プリオンに感染したヒツジやマウスにおけるPrPScの大脳蓄積を抑制することが報告されている[引用224]。残念ながら、構造的に関連する2つのカンナビノイド類似体、Δ9-テトラヒドロカンナビノール(THC)とエンドカンナビノイドのアラキドノイルグリシン(AG)は効果がないことが証明された。CBDはPrPScの細胞内輸送に影響を与えず、既存のPrPSc凝集体を破壊しなかったからである。CBDはPrPScレベルを低下させる他のメカニズムによって神経保護を示す可能性が示唆された。CBDは、長期のCBD治療による薬物耐性を伴わずにBBBを通過することができるため、有望な抗プリオン薬の候補となる可能性がある[引用224]。
カルノシン酸(CA)
ローズマリー(Rosmarinus officinalis)から単離されたカテコールであるCAは、抗酸化作用、抗炎症作用、神経保護作用の可能性が報告されている[引用225]。CAとその代謝物であるカルノソール(CS)は、N2a22LとN2a58細胞において、PrPSc凝集体のde novo生成を減少させ、すでに形成されたPrPScクラスターの除去を促進することにより、強力な抗酸化活性と抗プリオン活性を発揮することが示されている[引用226]。さらに、CAは経口投与後にBBBを通過することができ[引用227]、これはLight-BBB計算予測によっても確認された[引用228]。したがって、PrPScの直接的な阻害と抗酸化作用は、プリオン病だけでなく、タンパク質のミスフォールディングを伴う他の疾患においても、特異的な治療的意義を持つ可能性がある。現在、いくつかのin vivo研究が進行中である。
クルクミン
クルクミンは、1,7-ビス(4-ヒドロキシ-3-メトキシフェニル)-1,6-ヘプタジエン-3,5-ジオンであり、ウコン(Curcuma longa)の根茎から得られる黄色色素である。クルクミンは、無細胞でのPrPCから PrPScへの変換を部分的に阻害し、スクレイピーに感染した神経芽腫細胞におけるPrPScの蓄積を防ぐことから、抗プリオン化合物として示唆されている(IC50~10 nM)[引用229]。しかし、in vivo研究では、クルクミンの食餌投与は、ハムスターにおけるスクレイピーの発症に実質的な影響を及ぼさないことが明らかになった[引用229]。マウスモデルでは、クルクミンはBBBを通過し、脳内のβアミロイド凝集体に結合することができた[引用230]。血漿タンパク質は、脳へのクルクミン輸送のキャリアとして示唆されている[引用231]。研究者たちは、円偏光二色性(CD)を用いてPrP上のクルクミン結合部位を同定し、αヘリックス中間体への結合がβシートへの構造変換を阻害することを観察した[引用232]。無細胞系において、クルクミンはマウスプリオンタンパク質のフィブリル形成を有意に減少させた。さらに、プリオンアミロイド線維とクルクミンとの共インキュベーションは、オートファジーの機能不全から細胞を保護し、マウス神経芽細胞腫細胞における活性酸素のレベルも低下させた[引用233]。クルクミンの構造はコンゴーレッドと類似しているため、両化合物はα-ヘリックス中間体への結合を競合すると思われた。興味深いことに、コンゴレッドとは異なり、クルクミンは無毒性である。しかし、水不溶性(0.6μg/mL未満)[引用234]と生物学的利用能の低さがその限界であり、臨床試験における制約となった。したがって、クルクミンを他の薬物と組み合わせて、効果的な薬物送達を行うことが、その治療応用の鍵となる可能性がある。
エピガロカテキンガレート(EGCG)
緑茶抽出物のEGCGは、NDDを治療するための潜在的な治療化合物として使用される可能性がある。一次神経細胞において、EGCGは、Bax阻害、チトクロームCの転位、クラスIIIヒストン脱アセチル化酵素の活性化、およびサーチュリン-1(sirt-1)誘導によるオートファジーの活性化によって、プリオン感染に対する神経保護を示した[引用235]。プリオン病におけるsirt-1の関与は、主要な神経保護機構としてのミトコンドリアの恒常性の維持を示唆した[引用236]。sirt-1の過剰発現の有益な効果は、すでに様々なNDDSで観察されている[引用237-239]。さらに、EGCGはPrPCのリソソームへの内在化と分解を促進する。
ジンセノサイド-RG3
蒸した高麗人参のサポニンであるジンセノサイドRg3は、オートファジーの機能を促進することにより、神経原性の可能性を持つことが知られている[引用240][引用241]。ジンセノサイドRg3を用いた研究では、オートファジー活性を促進することにより、一次ニューロンおよびSK-KSH細胞をプリオンペプチド(106-126)の誘導神経毒性から保護した[引用242]。プリオン誘導毒性からジンセノサイドRG3によってオートファジー機能が増強されるメカニズムはまだ解明されていない。
ヒノキチオール
ヒノキチオール(β-thujaplicin)は、2-ヒドロキシ-4-イソプロピルシクロヘプタ-2,4,6-トリエン-1-オンとして化学的に知られており、神経保護薬理学的特性を有するヒノキ由来のトロポロン誘導体である[引用243,引用244]。Moonら[引用245]は、ヒノキチオールが、オートファジーの機能強化を通じて、PrP106-126誘発神経毒性から神経細胞を保護できることを観察した。電子顕微鏡観察では、ヒノキチオールが神経細胞におけるオートファジー液胞の形成を促進することが明らかにされ、その結果、低酸素誘導因子-1α(HIF-1α)経路を介したオートファジー誘導が、PrP誘導毒性に対する主要な神経保護機構であることが提唱された[引用246]。
メラトニン
松果体によって産生される神経内分泌ホルモンであるメラトニンは、強力な抗酸化分子であり[引用247]、様々な神経変性疾患と関連している[引用248]。メラトニンによって誘導されたオートファジーは、ミトコンドリア機能を調節することにより、プリオン感染細胞において神経保護活性を示した[引用249,引用250]。メラトニンによる前処理は、ミトコンドリアの分裂経路におけるダイナミン関連タンパク質1(DRP1)[引用251]および融合経路における視神経萎縮1(OPA1)と相互作用することにより、PrP106-126の毒性からミトコンドリアの形態を保護/調節することにより、in vitroにおいてミトコンドリアを介するアポトーシスを阻害した[引用252,引用253]。しかし、動物実験で低用量と高用量のメラトニンを投与した研究では、プリオンの活性を刺激したり抑制したりするという、論争の的となる結果が示された[引用254]。
ポリダチン
イタドリ(Polygonum cuspidatum)の根から得られるポリダチン(3,4′,5-トリヒドロキシスチルベン-3-β-D-グルコシド)は、レスベラトロールの天然前駆体である[引用255]。ポリダチンは、様々な医薬的特性[引用256]の他に、アミロイド形成を阻害する[引用257,引用258]。最近の生物物理学的研究において、ポリダチンはPrPCに結合し、PrPScへの変換を阻害することにより、in vitroおよびin silicoで抗プリオン活性を明らかにした[引用259]。分子動力学シミュレーションを用いた詳細な構造解析により、ポリダチンはβ2-α2ループ、α3-ヘリックス、N末端アミロイド形成領域における好ましくない構造転移を消失させることでオリゴマー化を抑制し、αヘリカルおよびランダムコイル形成を促進することで、プリオンの凝集と発症を阻害することが説明された[引用259]。
レスベラトロール
レスベラトロールは、抗酸化作用、抗がん作用、神経保護作用を持つポリフェノールで、ブドウやベリー類など様々な果実に含まれている[引用260]。レスベラトロールは、プリオンに感染したSMB-S15細胞において、PrPScの蓄積を用量依存的に減少させることが報告されている(EC500.61 μM)。さらに、レスベラトロールを1週間投与すると、マウスのプリオン感染性が有意に低下したことから[引用261]、抗プリオン薬としての可能性が示された。また、レスベラトロールは、脳内のsirt-1(プリオンタンパク質に誘導された神経細胞死を制御する)レベルを低下させることにより、PrPScを除去できることが報告されている[引用262]。構造的には、レスベラトロールはπ-πスタッキングによってTyr128と相互作用し、PrPCを安定化させ[引用263]、凝集を防いだ。プリオンの神経毒性に対するレスベラトロールのもう一つの神経保護能は、レスベラトロールを介したオートファジーのシグナルの増強である[引用264]。
スペルミン
生物学的に活性なポリアミンであるスペルミンは、細胞の成長と分化に必須である。不安定な微小管や非定型的なタンパク質の折り畳みの影響は神経変性過程に影響を及ぼす可能性があるため、スペルミンは微小管の安定化のために微小管アセチル化タンパク質(チューブリンα1B/1C、チューブリンβ4B、チューブリンβ5)の発現を増加させるようである。アセチル化された微小管は、オートファゴソームをリソソームへ輸送するのに不可欠な役割を果たしている[引用265]。微小管との親和性実験を用いて、Tubb6はスペルミンとの結合パートナーとして同定され、細胞内でPrPScのオートファジー分解を促進した[引用266]。
トレハロース
トレハロースは、2つのα-グルコースユニット間にα, α-1,1-グルコシド結合を有する非還元性二糖であり、脊椎動物を除くほぼ全ての生物に存在し、様々な種類のストレス条件に対する細胞防御機能を有する[引用267]。トレハロースは、哺乳類ラパマイシン標的(mTOR)非依存性経路におけるオートファジーを活性化することによって、α-シヌクレインのようなタンパク質凝集体を除去することができる[引用268]。Aguibら[引用269]は、トレハロース処理によるプリオン感染培養細胞でのオートファジー誘導とPrPScの同時減少を報告した。マウスモデル(プリオンに腹腔内感染)では、トレハロースの経口投与は、動物の生存に影響を与えることなく、PrPScの蓄積をわずかに減少させた。CNSにおけるトレハロースレベルは、限られたBBB横断から望ましい効果を示すには十分高くないことが示唆される[引用269]。トレハロースはまた、PrPScの細胞内局在を修飾することによって、誘導された酸化ストレスからプリオン感染細胞を保護することができる[引用270]。トレハロースの神経保護作用は、直接的または間接的なメカニズム、あるいは腸内細菌叢の関与によって発揮されると推測されている[引用271]。
4. 免疫療法
免疫療法には、能動的(ワクチンによる)免疫と受動的(抗体による)免疫の両方がある。プリオンエピトープを適切に同定することは、強い特異性と副作用の少ない治療を開発するために不可欠である[引用272]。プリオン感染動物モデルを用いた免疫療法の研究から、さまざまな有望な結果が報告されている。
小さなプリオン断片による免疫は、PrPScを減少させるために抗PrPC免疫を刺激することによって、主要組織適合性複合体クラスII(MHC II)の溝にはまることができる[引用273]。しかしながら、免疫系は自己抗原に対して寛容であるため、免疫によって得られた抗体は頻繁に効果を発揮するわけではなかった[引用274]。
上述したように、PrPCの安定化はPrPCから PrPScへの変換を阻害するために非常に重要であるため、PrPCを標的とする治療法はプリオン病における神経保護効果に限界がある。しかし、PrPScと PrPCの構造の違いから、PrPScも免疫系に抗原として認識され、免疫反応を引き起こすことがある。この種の免疫応答は、プリオン感染マウスの終末期において報告されている[引用275]。PrPSc特異的抗体反応を開発するために、PrPSc上の排他的エピトープが探索され、チロシン-チロシン-アルギニン(YYR)反復モチーフ、βシート1中のチロシン-メチオニン-ロイシン(YML)モチーフ、およびβシート2とαヘリックス2をつなぐ剛性ループ(RL)が同定された[引用276]。これらのエピトープを用いて多価PrPSc特異的ワクチンが調製され、免疫原性と安全性が分析された[引用277]。YYRに基づくワクチンの有望な結果は、プリオンに感染したシカを用いた研究で報告されている[引用278]。意外なことに、同じワクチンは132MM遺伝子型のヘラジカでは発病を増加させ、132ML遺伝子型のヘラジカでは効果がなかったが、その理由は明らかではなかった[引用279]。
PrPC-抗体の結合はPrPCから PrPScへの変換を阻害することができるため、様々な抗体を用いた研究が盛んに行われている。
POM1とPOM6は、球状ドメイン(GD)に結合するモノクローナル抗体(mAbs)であり、POM1は神経毒性を引き起こすのに対し、POM6は神経保護作用を示すという異なる生物学的反応を示す。しかしながら、POM1の毒性はプリオンの複製とは無関係であることが観察された[引用280]。POM1のPrPC結合とその結果生じる毒性との関連を調べると、「H-latch」(GDのHis140と Arg208の間の分子内水素結合)形成が毒性の初期レポーターとして同定された。従って、H-ラッチ形成を阻止する抗体を設計すれば、プリオン感染による有害な影響から身を守ることができるであろう[引用281]。
シミュレーションの結果、POM1/PrP界面はPOM6/PrPに比べて安定であり、抗体の結合によってGDの柔軟性が大きく向上することが明らかになった(β1-α1ループを除く)。いくつかの抗PrP抗体によって提起された毒性の懸念に対処するために、二重特異性抗体scPOM-biが分子プリオンツイザーとして設計された。この抗体は、POM1とPOM2の相補性を決定する領域から構成されており、GDとフレキシブルテール(FT)を同時に標的として、強力な神経保護をもたらし、抗プリオン免疫療法を開発する有望な戦略として使用されるかもしれない[引用283]。
PrPの異なる領域にある複数のエピトープを認識する強力な抗体は、異なる有効性でその阻害メカニズムを明らかにした[引用284]。モノクローナル抗体(mAbs)は、4つのエピトープ(オクタレピート領域、残基90-110、ヘリックス-1の残基145-160、およびC末端の残基210-220)を介して、プリオン感染細胞におけるPrPCの変換を有意に制限した[引用285-288][引用289]。さらに、90-110または145-160の領域に対するmAbsは、腹腔内プリオン感染後にin vivo抗プリオン活性を示したが、これらのmAbsはBBBにアクセスできないため、脳内感染の場合には示さなかった。
抗PrP抗体はプリオン感染マウスモデルでも評価された。8B4(残基34-52を認識)および8H4(残基175-185を認識)抗体は、8F9(残基205-233を認識)と比較して、PrPCおよびPrPScに対する親和性が高いため、プリオン感染を減少させるのに効果的であった[引用290]。また、6D11の短期腹腔内投与は、プリオン感染マウスの生存期間を延長した[引用291]。PrPCと PrPScは、6D11によって細胞表面から隔離され、複合体(PrPC/6D11とPrPSc/6D11)を形成し、分解するためにリソソームに輸送されることが決定された[引用292]。最も効率的な抗体はICSM 18(残基146-59を認識)とICSM 35(残基91-110を認識)と同定され、マウスの生存期間をかなり延長させたが、残念ながら感染の後期や脳内経路で感染させた場合には効果がないことが判明した[引用293]。
抗体治療における最近の重要な進歩は、プリオン感染マウスの生存率を増加させたヒト化抗PrPCモノクローナル抗体(IgG4κアイソタイプ;PRN100)の開発と臨床効果である[引用293]。PRN100は、ヒトPrPに対して開発されたマウスモノクローナル抗体の結合性とPrPCを安定化させる特性を評価し、MRC(Medical Research Council)プリオンユニット、ユニバーシティ・カレッジ・ロンドン(UCL)の研究者により開発された[引用294]。最近の臨床研究では、6人のCJD患者が死亡またはプログラムから離脱するまで、PRN100を2週間ごとに静脈内投与された。静脈内投与により、PRN100は目標とするCSF薬物濃度(50 nM)に達することができ、さらに、8ヵ月間副作用なく良好な忍容性を示した[引用14]。このような有望な結果を受け、PRN100は第II相臨床試験に向けて評価される予定である。
5. 臨床試験
Anle138bの臨床試験は2020年、68人の健康な男女を対象に実施され、安全性、忍容性、薬物動態の第1相評価に合格した[引用82]。有害事象は軽度であると考えられ、患者はこの試験中に完全に回復した。将来的には、Anle138bの完全な安全性プロファイルにアクセスするために、より長く、より大規模な評価が実施される可能性がある。Anle138bは当初、多系統萎縮症治療のために開始され、以前はαシヌクレインの凝集を阻害していたため、PD患者48人を対象としたフェーズ1b試験が2020年に開始された[引用81,引用83]。この試験では、Anle138bを1日量150mg以上、7日間経口投与したPD患者を対象に、髄液検査や運動機能の改善などを評価し、2022年に終了する予定である。
QCは抗マラリア薬として利用されており[引用173]、再利用抗がん剤としても承認されている[引用172]。再生不良性貧血はQCの最も有害な副作用であり、これは高用量で表示されるよりも低い割合(0.003%)の患者に起こる[引用295]。QCに関する最近の臨床試験では、300mgの用量で十分な忍容性が報告されているが、CJD患者の生存率の改善は観察されていない[引用177-180]。QCは1日量300mgで忍容性が認められたが、この嗜好臨床試験ではプリオン病に影響を与えなかった[引用177]。QCを2ヵ月間経口投与しても、sCJD患者の生存期間は延長しなかった[引用178]。否定的な結果にもかかわらず、CJDに対するこれまでの臨床試験は、まれで、進行が速く、致死的な神経細胞疾患において、適切なランダム化比較試験を実施できることを示していた。
ヒトにおけるPPSの安全性や有効性は証明されていない。Boneらは、PPSが110μg/kg/日の用量で6ヵ月間まで耐容性があることを示した[引用120]。2つの研究から、PPSは散発性、異所性、遺伝性、vCJD患者に投与され、脳内の異常プリオン蛋白の減少により、自然歴プリオン患者よりも平均生存期間が延長した[引用296]。しかし、他の研究では、PPSによる治療は臨床的改善を達成しなかったので[引用121]、プリオン病に対するPPSの有効性を明らかにするためには、さらなる研究が必要である。
FLUは欧州とアジア諸国で許可されていたが[引用147]、その後2018年3月に欧州市場から撤退した。CJD治療薬の最初の無作為化研究であるFLUは、生存期間の延長における有効性を明らかにしなかったが、認知機能の悪化を遅らせる可能性があった[引用152]。認知機能の改善に関するFLUの肯定的な結果は、他の神経変性疾患における治療効果を示唆する可能性がある。
少数のCJD患者を対象とした研究では、疾患の初期段階におけるドキシサイクリンの治療がわずかに良好な効果を示したが[引用204]、無作為化試験では有意な効果は認められなかった[引用199]。PRNP遺伝子のAsp178Asn変異を有するFFI患者に対するドキシサイクリンの試験が進行中である[引用297]。
結論と今後の展望
様々なクラスの化合物が、invitroおよびin vivoで抗プリオン活性について評価されてきた。異なる足場は、PrPCとの直接的または間接的な相互作用、PrPScの安定化、PrPScの蓄積の減少、あるいは他の神経保護メカニズムによって抗プリオン特性を示した。その結果、コレステロール生合成を阻害する薬剤やラフト膜を撹乱する薬剤は、表面のPrPCを再分布し、PrPScの蓄積を減少させたり、クリアランスを増加させたりすることができる。
PrpCや PrPScを標的とする様々な戦略とは別に、プリオン病を治療する効果的なアプローチとして、PrPを標的としない新しい薬剤戦略が登場した[引用298]。SerpinA3/SerpinA3nのアップレギュレーションは、セリンプロテアーゼ阻害剤として、プリオン病を含むNDDと関連しており、プリオンタンパク質の凝集体を除去するプロテアーゼ活性を阻害する。この考えに基づき、低分子のセルピン阻害剤(ARN1468)が設計され、スクレイピーに感染したScN2a RMLおよびScN2a 22 L細胞株におけるプリオン負荷を効果的に減少させた。残念なことに、この化合物の生物学的利用能が低いため、in vivoでの研究は制限されていた[引用298]。バイオアベイラビリティを向上させたARN1468の類似体は、プリオン病の治療において有望な戦略となり得る。
真核生物の細胞内タンパク質を分解する重要な機能を持つユビキチン・プロテアソーム系(UPS)は、タンパク質凝集体のクリアランスに深く関わっているようである。ある種の神経変性疾患では、この活性が低下し、ミスフォールドしたタンパク質の有毒な凝集体の蓄積につながっている[引用300]。従って、ユビキチンの増加[引用301]、特異的関連遺伝子の過剰発現[引用302]、あるいはp38マイトジェン活性化プロテインキナーゼ(MAPK)経路の阻害によってUPS活性を増強することも、UPS活性化による治療の有力な候補となりうる[引用303]。
シャペロンは細胞内タンパク質の再フォールディングに重要な役割を果たし、それによってプロテオスタシスを維持している。しかし、プロテオスタシス能力は加齢とともに低下し、その結果、NDDの発現が促進される。さらに、医薬品のシャペロンは通常半減期が短いため、高濃度に維持することでタンパク質のミスフォールディングを防ぎ、タンパク質凝集体の毒性を軽減することができる。一方、疎水性シャペロンは毒性が低く、治療目的により適している[Citation222]。文献はまた、プリオン病におけるオートファジーの重要な機能を示唆しており、感染した脳内のオートファゴソームがタンパク質の凝集体を分解している証拠が多い[引用136]。しかし、可能性のある化合物によってオートファゴソームの活性を高めても、オートファジーの誘導/増強によってプリオン感染を根絶するには不十分かもしれない。多くの天然化合物やチロシンキナーゼ阻害剤は、プリオンの病態を改善する上で、このメカニズムを通じて働く可能性がある。異常なタンパク質の凝集により、プリオン病では酸化ストレスの劇的な増大と抗酸化防御の喪失が観察されている。従って、酸化ストレスを軽減する化合物は、プリオン病に伴う神経毒性と神経炎症を軽減する上でも有益であると考えられる。
最近、CJD患者におけるモノクローナル抗体(PRN100)の有望な結果は、新しい抗プリオン薬への道を開き、他のNDDの治療にも役立つだろう。サクセスストーリーはこれだけにとどまらず、MCとGN8という有望な分子もプリオン病に対するヒト臨床試験の準備が整い、Anle138bはPD患者を対象としたフェーズ1bに入った。
先に述べたように、キナクリン、ペントサン・ポリサルフェート、フルピルチン、ドキシサイクリンはCJD患者を対象とした臨床試験で失敗した。試験されたほとんどの分子が無効であったのは、BBBを通過できなかったか、毒性があったか、あるいは薬剤耐性プリオンが一過性に蓄積したかのいずれかであった。従って、背景から学ぶことは非常に重要である。何がすでに研究されていたのか、薬剤の作用機序はどうなっているのか、臨床試験はなぜ失敗したのかを理解することで、プリオン病をより深く理解し、より効果的な治療法の正しい方向性を見出すことができるだろう。最後に、プリオン病に関与する複数の経路を標的とすることで、相乗効果が得られるかもしれない。
著者の貢献
コンセプト立案、K.H.S.、N.S.、S.S.A.A.、執筆-原案作成、N.S.、執筆-校閲・編集、K.H.S.、N.S.、S.S.A.A.、資金獲得、S.S.A.A. 著者全員が最終原稿を読み、同意した。
ディスクロージャー・ステートメント
利益相反の可能性は報告されていない。
追加情報
資金調達
本研究は、韓国政府による韓国国立研究財団(2021R1A2C1093218)および韓国国立保健研究院(National Institute of Health, Korea 2022E210100)の助成を受けた。
