Contents

The Role of Selenium in Pathologies: An Updated Review
pubmed.ncbi.nlm.nih.gov/35204134
オンライン公開:2022年1月27日.
PMCID: PMC8868242
PMID: 35204134
要旨
セレンは多くの生物学的機能に必要な必須微量元素である。セレン、より詳細にはアミノ酸のセレノシステインは、活性酸素種(ROS)濃度の調節からホルモンの生合成に至るまで、多種多様な必須生物学的機能に関与する少なくとも25種類のヒトセレノタンパク質に存在する。これらのプロセスはまた、がん、糖尿病、アルツハイマー病、精神障害、心血管障害、不妊症、炎症、感染症(SARS-CoV-2を含む)など、いくつかの疾患の予防や臨床転帰の調節に中心的な役割を果たしている。過去数年にわたり、セレンとこのような病態との関係に焦点を当てた研究が数多く報告されている。一般に、十分なセレンの栄養状態、場合によってはセレンの補充は、予後の改善やいくつかの疾患の発症リスクの低減に関係している。一方、栄養レベルを超えると有害な影響を及ぼす可能性がある。本総説では、これらのテーマに焦点を当てた最近の研究結果を、特に過去10年間に達成された進歩に重点を置いて要約し、議論する。
キーワード
セレン、抗酸化物質、エブセレン、GPx、TrxR、炎症、がん、COVID-19、不妊、ジェンダー医学
1. はじめに
ヒトの健康に対するセレンの効果は、異なるセレン含有化合物の特異的効果もいくつか報告されているが、主にセレンタンパク質の生物学的役割に関連している。グルタチオンペルオキシダーゼ(GPx)とチオレドキシン還元酵素(TrxR)は、いくつかの病態の発症と進行の主な原因である酸化ストレスからの保護に関与している[1,2,3]。
真核生物の核内セレノタンパク質は、酸化ストレスからゲノムを守る働きをする。その中で、セレノは核にのみ存在することが知られている唯一のセレンタンパク質である。健康寿命の低下は、グルタチオンペルオキシダーゼ、チオレドキシンレダクターゼ、チオレドキシン様(Rdx)ファミリーに属するいくつかのセレンタンパク質の発現低下と関連している可能性があり、これらは食事性セレン欠乏の可能性に特に敏感である。上記のセレノタンパク質は、酸化還元維持とタンパク質の品質を総合的に制御している。[4]。
セレンタンパク質の中には、GPx1欠損マウスにおけるインスリン感受性の亢進や、TrxR1欠損肝がん細胞や肺がん細胞におけるがん抵抗性の亢進など、特定の状況において逆説的に悪影響を及ぼすものも報告されている。セレンを含むGPx1、GPx2、GPx3、GPx4は、酸化ストレスからの保護、炎症の抑制、酸化剤による細胞死の抑制に関与している。GPx1とGPx4は、主にH2O2や脂質ヒドロペルオキシドによるホスファターゼの不活性化を防ぐことにより、リン酸化カスケードを阻害する。GPx2は腸細胞の再生とアポトーシスのバランスを制御し、腸における炎症誘発性発がんを抑制する。しかし、GPx2は確立した癌の成長を促進する。GPx3の欠乏は、おそらくトロンボキサン生合成経路の阻害を介して、血小板凝集を促進する。GPx3もまた腫瘍抑制因子と考えられている。GPx4は細胞質、核、ミトコンドリアの3つの異なる形態で発現している。細胞質型はインターロイキン-1が駆動するNF-κBの阻害やロイコトリエンの生合成に関与している。また、複合脂質のヒドロペルオキシ基を還元し、リポキシゲナーゼを沈黙させることから、フェロプターシスの重要な制御因子でもある。GPx4の核型はクロマチンの圧縮に寄与し、ミトコンドリア型は精子のミトコンドリア鞘の形成に関与するため、男性の生殖機能に重要な役割を果たしている。個々のGPxの発現とGPxに依存した制御現象は、特にヒトの健康との関連において、さらに調査する価値がある[4]。
セレンはホルミシス化学物質として提案されており、高用量では毒性を示すが、非常に低用量では有益な特性を持つ、ホルミシス二相性用量反応を持つ化合物である。セレンのセレンタンパク質への取り込みは、栄養レベルでプラトーに達し、残りのセレンは、メチオニンに代わる有機セレノメチオニン(SeMet)の形でセレン含有タンパク質に非特異的に取り込まれ、最終的に酸化ストレスを引き起こす可能性がある。無機セレンの亜セレン酸塩とセレン酸塩は、セレンタンパク質の発現が飽和した後、体外に排泄される。遊離SeMetやセレノールのような低分子量のセレン種は、ヒトのセレンプール全体のごく一部であり、そのレベルはセレン欠乏から過剰までの条件下で非常に安定している。これらの非タンパク質形態のセレンは、体内のセレン状態が低下するにつれて、総セレンプールに対してますます大きくなる[5]。
セレノタンパク質は、ニトロソ化ストレス応答においても中心的な役割を担っている: GPxとTrxRは、2つの主要なRNSであるニトロソチオールとペルオキシナイトライトを代謝する。[6]。セレノプロテインT(SELENOT)は小胞体常在タンパク質で、小胞体の恒常性維持に重要な役割を果たし、タンパク質のミスフォールディングや凝集を防ぐ上で極めて重要である。トランスジェニック細胞や動物モデルでSELENOTの発現が低下すると、活性酸素や窒素種の濃度が上昇する。その結果、ミスフォールディングや凝集したタンパク質が蓄積し、いくつかの神経変性、心血管、代謝、免疫疾患を引き起こす。[7]。さらに、セレノタンパク質は、Ca2+シグナル伝達、精子形成、脳活動など、極めて重要な生物学的機能に影響を及ぼす[1,2,3]。脳におけるSELENOT遺伝子のノックアウトは、マウスの行動に影響を与える解剖学的変化を引き起こし、脳の発達と機能に極めて重要な役割を果たしていることを示唆している。[8]。
セレンは、主にセレノシステインという形で生物学に利用される。セレノシステインは、セレノール官能基(SeH)を持つ真のタンパク質生成アミノ酸であり、セレノタンパク質に挿入される。セレノシステインはまた、ギ酸デヒドロゲナーゼのモリブドプテリングアニンジヌクレオチド補因子、[NiFeSe]ヒドロゲナーゼのニッケル、鉄-鉄クラスターの鉄のリガンドとしても使われる。生体分子で使用されるセレンの他の化学形を図1に示す。

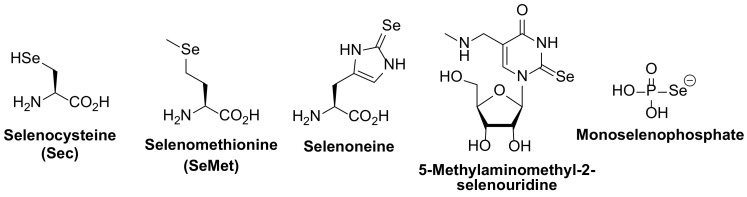
図1 生体分子に含まれるセレンのさまざまな化学形態の例
ReichとHondalは、「Why nature chose selenium」と題した最近の総説で、セレンと硫黄の化学的性質について包括的な比較分析を行っている。セレン化合物とその硫黄化類似体は、酸化状態や官能基の種類など、物理的・化学的性質は類似しているが、セレンタンパク質のユニークな生化学を説明する重要な違いがある。
セレノシステインの生合成は「コストがかかる」「効率が悪い」と言われているが、[9]、タンパク質に取り込まれることで、システインが苦手とする必須化学機能を生体系で実現することができる。グルタチオンペルオキシダーゼ(GPx)[4,10]、ヨードチロニン脱ヨードイナーゼ[11]、チオレドキシン還元酵素(TrxR)[12]などの哺乳類セレンタンパク質の酵素活性は、セレノシステイン残基のセレノール部分の反応性に依存している[13]。
例えば、GPxの速い反応性を説明する2段階のメカニズムは、酵素活性部位に存在するSec残基のセレノール部分の酸性と求核性に基づいている。SecのSeH基のプロトンは、すべてのGPxの酵素ポケットに高度に保存され、プロトン受容体の役割を果たすトリプトファン残基に移動する。このプロトン移動反応により、セレン酸アニオンの求核性が中性のセレノールに対して増強された、エネルギーの高い双性イオン型になる[14]。
最近研究されたセレンと硫化水素との相互作用の可能性は、生化学的メカニズムの調節においてセレンが果たす役割の複雑さをさらに際立たせている。硫化水素(H2S)は、細胞内シグナル伝達、細胞生体エネルギー、細胞増殖、細胞分化の制御に関与する「ガス伝達物質」と呼ばれる代謝活性ガス分子の小グループに属する。H2Sは、低濃度ではミトコンドリア機能を刺激し、高濃度ではミトコンドリア呼吸複合体IV(シトクロムCオキシダーゼ)の活性を抑制することがよく知られている[15,16]。いくつかの研究では、H2Sが脳、胃粘膜、肝虚血再灌流障害、血管内皮における活性酸素による酸化ストレス誘発性障害を緩和する役割を持つことが報告されている[17]。哺乳類の3つの主要なH2S生成酵素は、シスタチオニン-リアーゼ(CSE)、シスタチオニン-β-シンターゼ(CBS)、3-メルカプトピルビン酸硫酸転移酵素(3-MST)である[15]。
動物モデルの肝臓と腸において、セレン欠乏食は、対照群に対する試験群のH2S、CSE、CBS、3-MSTレベルの上昇[18,19]と低下[20]に関連している。セレン欠乏に由来するH2Sの増加は、ミトコンドリアを介するアポトーシスが損なわれている可能性のある原因として注目されている[19]。H2S不足は、代わりに炎症因子TNF-α、NF-κB、COX-2、PTGESのレベル上昇と関連していた。[20]。これらのデータは、適切なセレン状態に依存する異なるメカニズムが存在することを示唆しており、その両方がH2Sの適切な細胞産生に関与し、細胞の酸化還元ホメオスタシスとシグナル伝達経路に影響を及ぼしている。
最近、セレンと共有結合する高度に保存されたタンパク質であるSBP1が、第4のH2S産生因子として同定された[15,21]。SBP1は、タンパク質分解、細胞分化、酸化還元調節など、いくつかの基本的な生理学的機能において重要な役割を担っていることがすでに強調されており、ヒトの健康状態や疾病状態にとって重要である可能性がある[21]。SBP1はメタンチオールオキシダーゼ(MTO)として働き、腸内細菌由来の有機硫黄化合物であるメタンチオールをH2S、H2O2、ホルムアルデヒドに変換する。[16,21,22]。この発見は、H2Sとセレン(その作用がセレンに依存する分子の形でも)の間の生物学的相互作用という仮説をさらに支持するものであり、最近関心が高まっている。大腸がん、胃がん、上咽頭がん、肺がん、腎臓がん、前立腺がんなど、臨床転帰の悪いさまざまながん種で、SBP1レベルが低いことが多く、卵巣がんは唯一の例外である[16,21]。H2Sは試験管内試験および生体内試験で前立腺がん細胞の生存を阻害することがすでに証明されているので、H2Sレベルの低下、ひいてはそれに対応するH2Sを介したシグナル伝達の低下は、SBP1活性の低下と関連している。この結果、AMPK(細胞内エネルギーセンサー)が阻害され、酸化的リン酸化と腫瘍の増殖と進行に必要なビルディングブロックの生合成が刺激される。[16]。SBP1はまた、H2Sが関与する複数の細胞シグナル伝達過程を介して、前駆脂肪細胞から脂肪細胞への分化にも関与していることが判明した。[15,22]。SBP1のサイレンシングは、細胞内のH2S、CBS、CSE、3-MSTレベルを低下させ、脂肪細胞の分化を有意に抑制した[15]。食事性セレンに由来する還元型セレン(HSe-およびH2Se)は、H2Sといくつかの特徴を共有している。このため、H2Seは、一酸化窒素、一酸化炭素、硫化水素と並ぶ第4の内因性ガス伝達物質として提唱されている。内因性に生成されたH2Seは、酸化還元酵素機能を持つ多くのセレノタンパク質に間接的に取り込まれる。H2Seを投与すると、ミトコンドリアのシトクロムCオキシダーゼが一過性に阻害されることが証明された[23,24]。
CSE由来のH2Sは、心機能の維持に重要な役割を果たしている。セレノシステインリアーゼ(SCLY)はシスタチオニンリアーゼのホモログであり、H2Sのセレン同族体であるH2Seを生成することが同定されている。ラット心筋細胞H9C2において、H2SがSCLY/H2Seシグナルを誘導し、生物学的に利用可能なSe含量を増加させることが観察され、その結果、グルタチオンペルオキシダーゼやチオレドキシン還元酵素を含むセレンタンパク質の発現と活性が上昇し、次いで活性酸素レベルが低下し、細胞が肥大化した。H2Sレベルが高くなると(ストレス状態の場合のように)SelPレベルも上昇し、特に酸化ストレス防御のために高レベルのセレンを必要とする組織において、生体全体へのセレンの分布が良くなる。[25]。最後に、H2SとSeO32-の相互作用には、活性酸素の消去、酸化還元状態の調節、血圧への影響、DNAとの反応など、注目すべき生物学的効果がいくつかあると報告されている。また、例えば酸化ストレスや癌の状態において、セレンの有益な作用と毒性作用に関する対照的な結果が報告されていることも説明できるかもしれない。このような理由から、亜セレン酸を用いた生物学的実験や、栄養サプリメントとして、あるいは臨床的に使用する際には、H2S/SeO32-相互作用を考慮する必要がある[26]。
十分なセレン摂取は、がん、自己免疫疾患、不妊症、重篤な疾患における死亡リスクを低減する可能性があるが、一部の病態は特定のセレノタンパク質遺伝子型に起因している。[27]。この文脈では、正しいセレン摂取を確保するために、有機または無機セレンのサプリメントを使用することが一般的な戦略である。サプリメントの形で古典的または新規のセレン含有分子を使用するだけでなく、果物、野菜、作物のセレンによるバイオフォーティフィケーションも、世界的または地域的なガイドラインに従って、一般人口に十分なセレン摂取量を確保するための貴重な戦略である可能性がある。食品中のセレン濃度は、土壌中の利用可能な形態の栄養素の存在に依存し、その栄養素は植物や草食動物によって蓄積される。植物バイオフォーティフィケーション戦略は、主に植物の自然な代謝経路を利用するもので、葉面散布や土壌散布、水耕栽培、共生根圏微生物による土壌添加など、さまざまな農業技術によって達成できる。穀類、野菜、マイクログリーン、果樹で、驚くべき結果が得られている。ヨウ素などの他の微量元素と組み合わせることで、セレン含有量と一般的な栄養特性が向上した機能性野菜食品が得られる可能性がある。[28,29,30,31,32]。
さらに、家畜の飼料に有機セレン、特にセレノメチオニンを与えることは、家禽、子牛、豚の肉における一般的なセレン含有量を増加させるのに効果的であることが証明された[31]。有機セレンを牛に給与すると、牛乳中のセレン含量も増加した。一方、無機セレンの効果は限定的であった。[33]。
しかし、セレン補給がヒトの生体に有益な効果ではなく、無効または有毒な効果をもたらす可能性については、最近議論されている[34,35,36]。VincetiとJablonskaは、DNAのエピジェネティックな制御や腸内細菌叢に深刻な影響を及ぼす、酸化還元ホメオスタシスにとって特に安全でない可能性のあるセレンの過剰摂取の影響がまだ未調査であることに警告を発している。このため、セレンに関するWHOのRDAの改訂が提案されている。[34]。
他の必須微量栄養素と同様に、セレンはその濃度の関数として反対の生物学的機能を果たす。セレンの推奨一日摂取量(RDA)は55μg/日であり、耐容上限摂取量(UL)はセレノーシスを有害作用とみなして400μg/日である[37]。これは一般的に、超栄養量のセレンを使用した場合に観察される、確立された酸化促進作用に関連している。しかし、このようなプロオキシダント特性は、新規治療ツールの開発に利用できる可能性もある(後述)。
これらすべての問題を考慮しながらも、ヒトの健康に対するセレンの複数のポジティブな役割についての一般的な合意があり、セレンの状態と有益な効果の間の一般的なU字型の非線形関係が示唆されている。全体的に、ベースライン時のセレン濃度が低い被験者は、サプリメントから恩恵を受ける可能性があり、逆に、十分なまたは高いステータスを持つ被験者は、悪影響を受ける可能性がある[38]。このような背景から、セレンを含む低分子の研究も注目されている。実際、広範な有機セレン化合物が顕著な生物学的特性を有することが実証されている。例えば、ベンゾセレナゾール誘導体であるエブセレンは、セレン含有低分子化合物の中で最もよく研究された化合物であり、幅広い生物学的機能を示した。セレン含有合成低分子は、抗がん剤や抗生物質としても潜在的な役割を果たすことが証明された。[39]。エブセレンは、特に原核細胞においてTrxRの阻害剤であり、活性酸素に対抗する中心的な役割を果たすため、活性酸素種(ROS)の細胞内上昇を引き起こす。また、多くのセレン含有分子は、ビブリオ・コレラ、ブルクホルデリア・シュードマレイ、結核菌など、さまざまな病原性細菌に対して顕著な炭酸脱水酵素阻害活性を示した[40]。過去数年にわたり、有機化学者、医薬化学者、生物学者の間で、合成または半合成セレン含有誘導体の合成と研究が着実に関心を集めている。[41,42,43,44,45,46,47,48,49]。
ここでは、セレンと最も重要な現代病との関係について、これらのトピックに関する研究のマイルストーンを考慮しながら、特に最新の結果に重点を置いて、主な文献結果を報告する。
2. 癌
セレンによるがんの化学予防に関する大きな関心は、1960年代後半にまでさかのぼる。1966年、ShambergerとRudolphは、誘導マウス皮膚腫瘍モデルにおいて、セレン化ナトリウム(Na2Se)が腫瘍形成を大幅に減少させることを示した[50]。セレンの抗がん作用もまた、米国におけるがん死亡率と血中および飼料作物中のセレン含量の間に存在する逆相関に基づいて経験的に推測された。[51,52]。
1970年以降、数多くの疫学的セレン補給研究と臨床試験が、セレン摂取量の低さとがんの発生率の高さを結びつける「セレン-がん仮説」を支持した。1996年にClarkとCombsが主導した1312人の患者を対象とした研究は、この研究分野の頂点とみなされ、多施設共同二重盲検無作為化プラセボ対照がん予防試験において、セレン化酵母の形で200μg/日のセレンを補給することで、結腸がん、前立腺がん、肺がんが有意に減少することを示した。セレンの補給はまた、10年間にわたるがん総死亡率を有意に減少させることが示された。[53]。
最初の研究以来、がん患者は診断前の血清セレン濃度が対照群よりも低いことが示されている; セレン治療は、動物モデルで腫瘍の収量を減少させた。[54]。
セレンは、主にグルタチオンペルオキシダーゼ(GPx)、チオレドキシン還元酵素(TrxR)、セレノプロテインP(SelP、SePまたはSELENOP)などのセレノプロテインを介して、正しい酸化還元ホメオスタシスとエラーのないタンパク質フォールディングを維持することにより、化学療法予防効果を発揮する。その他の機能には、遺伝子発現の調節、代謝の酸化還元およびホルモン調節、DNA修復および細胞シグナル伝達経路における役割が含まれる。セレノタンパク質は様々な重要なレベルで作用する:タンパク質-チオールの酸化還元修飾、重要なタンパク質におけるメチオニン擬態を介して、細胞増殖を阻害し、アポトーシスを刺激し、細胞周期をG1期に止めて転移を抑える(図2)[56,57,58]。GPX、TXNRD1、SELENOF、SELENOPなど、酸化還元ホメオスタシスの維持に直接的または間接的に関連するセレノプロテインは、がんの発生と進行に関与する複数のシグナル伝達経路に影響を与えるようだ。セレンが減少すると、上記のセレノタンパク質の合成に影響を与えることによって、これらの経路のバランスが崩れ、大腸がん(CRC)の場合のように、腫瘍の発生や進行につながる可能性がある。さらに、いくつかのセレンタンパク質(GPX-1、GPX-2、SELENOP、TXNRD1)に影響を及ぼす一塩基多型が、CRCの発症や進行をサポートする可能性があるという強い証拠がある[59]。
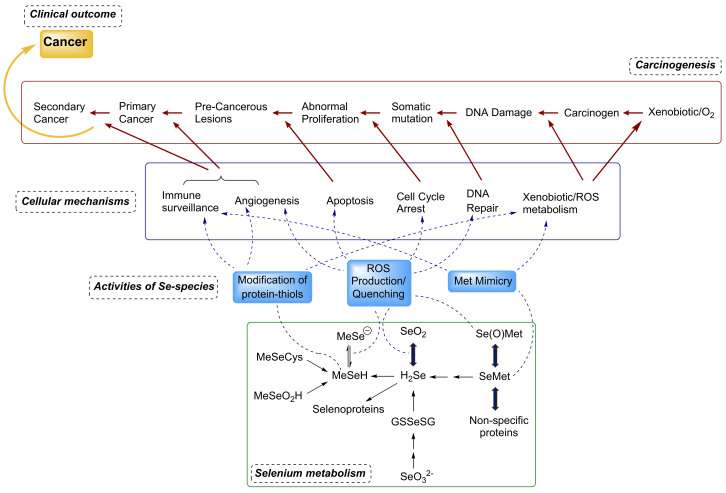
図2 がん関連経路に対するセレンの多段階作用 [56]。
SELENOHは細胞周期進行の重要な制御因子であり、その発現はセレンの状態に大きく依存する。SELENOH KO 試験管内試験および生体内試験(ヒト大腸がん細胞)は、予想外に増殖と遊走を増加させ、腫瘍の進行を抑制し、大腸がん細胞を制御不能な増殖から保護するSELENOHの役割を強調している。[60]。
がん細胞におけるTrxR2の過剰発現は、しばしば腫瘍の発生と進行、およびアポトーシス抵抗性の重要な因子として指摘されてきた。TrxR2を阻害すると、Trx2活性の障害を介してミトコンドリア内の活性酸素種濃度が上昇し、シクロフィリンDのような多くのアポトーシス促進因子が放出される。
セレノプロテイン以外にも、さまざまな代謝物がさまざまな段階で腫瘍予防に作用する。無機または有機セレン化合物から体内で生成されるメチルセレノールは、そのような代謝産物の中で最も重要なものの一つであることは間違いない。[55,56]。活性セレン代謝物には以下のものがある: (i) 酸化された無機塩(亜セレン酸塩、セレン酸塩)の還元的代謝産物であるセレノジグルタチオン(GS-Se-SG)、(ii) セレン化メチオニン類似体であり、食品中のセレンの主な形態であるセレノメチオニン(SeMet); (iii)セレン化水素(H2Se)は、還元経路とセレンアミノ酸の異化の共通中間体である。(iv)CH3SeH(メチルセレノール)、(CH3)3Se+(トリメチルセレノニウム)、CH3SeCys(メチルセレノ-シエテイン)、CH3SeO2H(メチルセレニン酸)などのセレンのメチル化代謝物。このような代謝産物は、基礎的および中間的なレベルで、セレンの抗発癌作用に影響を与える様々な役割を担っている(図2)。例えば、GSSeSGはアポトーシスを促進し、AP-1(activator protein 1)転写因子のDNA結合を阻害し、細胞増殖を抑制することが報告されている。メチル化セレン誘導体は、乳がん、肝がん、神経芽腫細胞においてアポトーシスを誘導する[56]。活性化した内皮細胞の新生血管新生を阻害する役割の可能性も報告されている。実際、メチルセレノールの前駆体は、がん細胞における血管内皮マトリックスメタロプロテアーゼ-2と成長因子の発現を阻害することが示されている。[56,58]。
高栄養量以上では、酸化還元ホメオスタシスの維持をめぐるさまざまなメカニズムが作用する。例えば、セレノレートはスーパーオキシドを産生することでがん細胞を死滅させ、がん細胞を回復不可能な酸化状態に追い込み、アポトーシスへと導く。生物学におけるセレンの一般的な形態である亜セレン酸とメタネセレニン酸は、どちらも酵素のチオール基を酸化し、がん細胞をアポトーシスへと導くことができる。[62]。一般的に、セレン化合物はプロオキシダントとして作用することで細胞毒性作用を発揮し、腫瘍細胞の酸化還元ホメオスタシスを変化させる。このような背景から、多くの新規有機セレン化合物が最近合成され、潜在的な化学療法剤として試験されている。[63]。
一般的にこのような化合物は、カスパーゼ、ミトコンドリアの機能障害/シグナル伝達、小胞体ストレス、活性酸素の産生と酸化損傷、DNAの分解/断片化、細胞骨格の損傷などを媒介として、がん細胞にアポトーシスを誘導することで作用する。場合によっては、オートファジーの誘導は複数のキナーゼの特異的阻害によって引き起こされることも示されている。観察されるメカニズムは、癌の種類や分子の性質の違いによって異なる。[64]。例えば、ある種の前立腺がん細胞株では、メチルセレニン酸(MSA)が、プロテインキナーゼC(PKC)の抗アポトーシス性アイソザイム(εおよびα)の触媒ドメインに近いいくつかのチオール部位と選択的に反応し、それらを不活性化して細胞をアポトーシスに導くことが実証されている。これは、低濃度のMSAが細胞死を誘導する一方で、高濃度のMSAがプロアポトーシスPKCアイソザイム(δとζ)とカスパーゼ-3を不活性化し、腫瘍細胞をアポトーシス抵抗性にするという二相性の効果である。[65]。
注目すべきは、遺伝、ジェンダー、および修正可能な行動が、発癌に対するセレノプロテインの対立遺伝子変異の影響を修飾することである。特に、遺伝的要因と食事からのセレン摂取量との相互作用は、SelP、SelF(セレノプロテインF)、GPx4、GPx1といった極めて重要なセレノプロテインの代謝を介して、がんのリスクと転帰を決定するのに有効であるようである[66]。多型の中には、進行性の前立腺がん、乳がん、大腸がんの増加と関連しているものもある。[55]。
従って、セレン欠乏症の人や特定のセレノタンパク質の対立遺伝子変異を持つ人は、がんリスクの増加を示す。一方、GPx2は、がんのごく初期段階や、炎症状態によって発がんが引き起こされる場合には予防的に作用するようだが、がん細胞がすでに発がんしている場合には、GPx2は細胞増殖と腫瘍の成長をサポートし、転移性浮遊細胞の生存率を高めるようだ。[67]。
がんリスク低減におけるセレンの有効性を調べるため、ヒトを対象としたランダム化比較試験が長年にわたって実施されてきたが、相反する結果が示されている。[54,68]。最初の研究では、セレンを濃縮した食卓塩の投与が原発性肝がんに有効であることが証明され、[69,70]、セレンを含む多剤併用サプリメントは食道がん。[71,72]、口腔前がん病変 [73,74]、非黒色腫皮膚がん。[53,75]、前立腺がん。[76,77]に有効であった。
その後の研究では、Rayman [2]や他の著者 [1]がそれぞれ2012年と2014年までのこのテーマに関する主な結果について包括的な考察を行ったように、対照的なエビデンスが示された。より最近の研究では、318人の患者を対象とした症例対照研究 [78]において、血漿中のセレン濃度が低いと前立腺がんのリスクが4~5倍上昇することが強調された。しかしながら、この結果は、以前に実施されたSelenium and vitamin E Cancer prevention Trial(SELECT)研究 [75,79,80]や、2020年に実施されたランダム化比較試験のレビュー [81]の結果とは対照的である。一部の著者は、異なる結果が、検討された特定のがん種、セレンの形態、試験参加者の初期血漿セレン濃度による一次的なものである可能性を示唆している。[82]。異なるがん種について異なる地理的地域で実施された37の研究の2018年のレビューでは、セレンの補充はがんに対する予防効果があるかもしれないが、特定の腫瘍によって効果が異なることが一貫して確認された[82]。さらに最近では、481人の男性にセレン化酵母の形で200μg/日のセレンを6カ月間補充した。セレンと前立腺特異抗原(PSA)値が、補充前と補充後の血清で測定された。全体として、PSAの変化と補充によるセレンレベルの変化との間に有意な相関はなく、血清PSAを通して測定された前立腺の安定性に対する、人口統計学的、ライフスタイル、遺伝的および食事因子と補充セレンの相互作用を示した。このことは、前立腺の健康のためには、継続的な単回用量のセレンサプリメントに依存するのではなく、個人に合わせた規模で血清セレン濃度を最適化することの重要性を強調するものである。[83]。
Evansらは、栄養学的に関連する主な形態のセレンの臨床的効力と、がん患者における薬物動態学的(PK)プロファイルおよび薬力学的(PD)効果の関係を評価する可能性を評価した。亜セレン酸ナトリウム(SS)、セメチルセレノシステイン(MSC)、セレノ-L-メチオニン(SLM)が、慢性リンパ性白血病(CLL)と固形悪性腫瘍の2つのコホート(12人)で比較された。[84]。以前の臨床試験では、3つのSe化合物とも忍容性が高く、遺伝子毒性もないことが証明された。[85]。24人の患者に、SS、MSC、SLMのいずれかの方法で400μgのセレンを無作為に8週間経口投与した。著者によると、このコホートで検討された用量は、有効なセレン血漿中濃度を達成するには低すぎ、有意なPD効果を引き出すには不十分であった。前臨床データに基づき、著者らは、薬物動態学的マーカーに有意な変化をもたらすには、栄養学的血漿中濃度以上の用量まで増量する必要があるかもしれないと仮定している。これは、セレン化合物を抗がん剤と併用投与した場合に、悪性細胞に対する治療相乗効果と健常組織の細胞保護効果をもたらすかもしれない。患者に対するより大きな効果と、がん治療のための各セレン化合物のPK-PD関係におけるより良い洞察を得ることを目的として、より高用量の後続コホートに関する次の研究が、より高栄養量のセレンのPKとPDを評価するために計画されている[84]。
セレンの至適投与量と生理的状態は、がん予防に利用できる抗酸化活性に対応している。一方、セレンのプロオキシダント特性もまた、がん治療のための潜在的な治療手段を開発するために利用することができる。様々な有機および無機形態のセレンの中でも、セレン含有ナノ粒子は、その興味深い特性(すなわち、他のセレン含有種に比べて毒性が低く、標的性が向上している)により、大きな関心を集めている。化学療法から診断、抗がん剤送達に至るまで、がんにおけるSeナノ粒子の応用の可能性に焦点を当てた研究がいくつか報告されている。[86]。
Vincetiらは最近、栄養レベルを超える有機セレンへの曝露が、がんリスクの上昇に関係する可能性があると結論づけた。[87]。Verniaら [88] は、Seを含むいくつかの微量元素の食事からの摂取が大腸がんにもたらす潜在的な有益性を強調した。一方、超栄養的なセレンの補給は、大腸がん(CRC)に対する有害な影響と関連している。セレン補給の臨床試験の大部分を占めるセレン欠乏症の患者は、栄養セレン欠乏症の患者やSELENOP SNPsを有する患者と同様に、セレン補給の恩恵を受けない可能性がある。[89]。
18の症例対照研究を対象としたごく最近のメタアナリシスでは、ヒト組織中のセレン濃度と乳がんリスクとの関係が調査され、負の相関が強調されている。[90]。この関連で、肥満患者の乳がんに焦点を当てた同様の研究 [91] では、肥満被験者の脂肪組織におけるセレノプロテインレベルの低下が、がんに進展する可能性のある炎症状態をもたらすことが示された。
甲状腺がんに関しては、ごく最近の研究 [92]によると、セレン濃度が低いことが素因なのか結果なのかが不明であるため、セレンと甲状腺がんとの関連性に結論は出ていない。これは、甲状腺がんにおけるセレン補給の有意性が低いか、あるいは有意な効果がないこと、したがって因果関係を確立することが不可能であることをすでに強調していた以前の研究 [93,94]の結果と一致している。
ごく最近、HeLa細胞(HPV18 DNAを含むヒト子宮頸がん細胞株)およびHeLa細胞移植、MCA(3-メチルコラントレン)曝露、ヒトパピローマウイルス(HPV)曝露によって誘発された子宮頸がんモデルマウスを用いた実験的研究もいくつか報告された。特に、HPV暴露による細胞性子宮頸がんモデルは、生体内試験での発がんプロセスを最も確実に模倣しているようだ。その結果、セレンナノ粒子(Se-NP)のHPVおよび化学発がん物質に対する抗がん作用が強調された。Se-NPは、がん細胞に対する特定の薬剤の標的性を高め、低用量での効果を増大させた。最も重要なことは、Se-NPが非がん細胞に対して無毒であることが示されたことである[95]。実際、腫瘍と正常組織では、酸化代謝に決定的な違いがある。このことは、腫瘍細胞では酸化促進剤として、健常細胞では抗酸化剤として同時に作用するセレン含有誘導体など、新規の低分子治療薬のターゲットとなる可能性がある[58]。実際、がん治療にセレンやセレン含有分子を用いる可能性が最近出てきた。この文脈では、がんの予防におけるセレンの利用(抗酸化作用に依存)とは異なり、セレンの治療作用は主にその抗酸化活性を中心としている。例えば、上皮性卵巣がん、卵管がん、腹膜がんなどの婦人科がん患者45人のコホートでは、カルボプラチン/パクリタキセル化学療法に加えて、セレンをセレニアス酸の形で投与した。最大5000μgの投与で安全性と忍容性が確認され、化学療法剤として通常使用される細胞毒性薬との相乗的相互作用が示唆された[96]。
十分なセレン摂取は、グルタチオンペルオキシダーゼやチオレドキシンレダクターゼなどの抗酸化タンパク質の生合成に必要である。セレンが欠乏している場合、サプリメントを摂取することで、細胞の酸化還元状態の調節に関与するセレン依存性タンパク質や酵素の発現を改善することができる。一方、多くの研究が、栄養レベルを超えるセレンの使用が、有意な毒性を伴わずにポジティブな効果をもたらすことを強調している。このような条件下では、抗酸化タンパク質の発現は、推奨される食事からのセレン摂取量ではそれらの酵素が体内で飽和してしまうため、RDAで投与された被験者のレベルに関しては増強されない。したがって、セレンに関連する抗酸化系の調節は、がん治療における高用量セレンの潜在的な有益性を説明することはできない。この点で、セレンの抗酸化活性が重要な役割を果たすと考えられている。実際、細胞の酸化ストレス状態に応じて、酸化還元活性を持つセレン化合物が主要タンパク質の酸化を触媒し、DNA損傷を促進してアポトーシスを誘発することが提唱されている。[97]。例えば、セレンを触媒とするタンパク質のチオール部位の酸化や、グルタチオン(GSH)のシステイン残基の酸化は、分子内のジスルフィド結合につながる。チオール官能基はセレンとも反応し、セレノトリスルフィド(ジチアセランまたはセレン(II)ジチオレート、RSSeSR)やセレニルスルフィド(RSSeR)を形成する[98,99]。酵素の触媒ドメインのシステイン残基が関与する場合、これらの反応はシグナル伝達分子を不活性化する可能性がある。例えば、NF-κBやAP-1のシステイン残基のセレン促進酸化は、標的DNAに対するそのような転写因子の結合親和性を低下させる[98,100]。同様に、カスパーゼ-3、サイクリン依存性キナーゼ2(CdK2)、プロテインキナーゼC、c-Jun N末端キナーゼ(JNK)などの酸化還元依存性シグナル伝達分子を含む多くのタンパク質のチオール官能基も、セレンを介した酸化を受けることが示されており、細胞の生存とアポトーシスを制御するシグナル伝達経路を破壊する可能性がある[98,101,102,103,104]。
形質転換された細胞は、高い酸化障害によって特徴付けられ、その結果、スーパーオキシドアニオンと過酸化水素のレベルが上昇する。このような条件下では、セレンの酸化促進特性は、がん治療のための新たな治療手段を開発する魅力的な機会を提供するかもしれない。さらに、亜セレン酸、二酸化セレン、ジセレニドなどのセレン含有化合物は、スーパーオキシドジスムターゼ(SOD)によって容易に過酸化水素(H2O2)に変換されるスーパーオキシドアニオンの内因性生成に関与している。反応性の高いヒドロキシルラジカル(HO-)と二酸化窒素ラジカル(NO2-)は、Fe2+の存在下で過酸化水素からフェントン反応によって、またヒドロキシルラジカルと一酸化窒素(NO-)との反応によって、それぞれ生成することができる[98,105]。(i) レンを触媒とするタンパク質や酵素のチオール部位の酸化、(ii)グルタチオン(GSH)との反応によるセレンの枯渇、(iii)スーパーオキシドアニオンの生成とH2O2、HO-、NO2-などの高反応性種の生成。
最適な食事レベルのセレンは、抗酸化セレノタンパク質の適切な合成を介して、セレン依存的な酸化還元ホメオスタシスの維持を確実にし、特にがん、心血管障害、神経変性疾患、不妊症を含む多くの疾患の発症予防に関与しているようだ。一方、セレンの過剰供給は毒性を引き起こし、内分泌系障害、精神障害、癌のリスクを高める可能性があるが、[106]、超栄養量のセレン含有化合物は、癌細胞に対する抗酸化作用とアポトーシス促進作用があるため、化学療法剤として使用することができる。[86,107]。
したがって、がんにおけるセレンとセレン含有化合物の役割は、予防と治療の両方である可能性がある。例えば、キトサンオリゴ糖(COS)とセレンの無毒性共役分子であるCOS-Seは、最近、がん予防の機能性食品成分として大きな可能性を示した。COS-Seは、試験管内試験でヒト胃がん細胞SGC-7901の増殖と転移を抑制し、正常線維芽細胞L-929には無毒性であった。この分子を補充すると、CD34タンパク質、血管内皮増殖因子、マトリックスメタロプロテアーゼ-9のレベルを低下させることにより、胃腺癌の増殖を有意に抑制することができた。さらに、COS-Se投与は貪食作用を効果的に上昇させ、抗炎症性サイトカインの分泌を増加させた。さらなる実験により、COS-Seはマウスモデルにおいて免疫増強作用を示すことが示された[108]。
新規のセレノ誘導体医薬品は、成人の原発性脳腫瘍の中で最も侵攻性の高い膠芽腫に対する代替的な治療戦略としても使用できる可能性がある。[109]。上述したすべてのプロセスと代謝の個人差との相互作用を理解し、セレン濃度とがんリスクとの関係を確認し、セレン摂取量の増加による利益を決定するためには、さらなる研究が必要である。特に、腫瘍の病期の違いや、性別、年齢、ベースライン時のセレンなどの患者の特徴を考慮する必要がある。[67]。
3. 炎症状態
炎症性疾患では、特にペルオキシダーゼ活性が高い場合、最適なレベルのセレンタンパク質が臨床的に有益である可能性がある。実際、活性酸素と窒素種(ROSとRNS)による酸化ストレスは、炎症が根底にあるさまざまな疾病を引き起こす。炎症は健康な細胞を障害し、がん、動脈硬化、糖尿病、自己免疫疾患、関節リウマチ、膵炎、喘息、神経変性疾患などの臨床症状を引き起こす。
セレンの抗炎症作用の根底にある複数の機序とそれらの相互関係は、Kaushalらによって包括的に論じられている[110]。文献には、活性酸素に対するセレノタンパク質の潜在的役割や、細胞の酸化還元状態とシクロオキシゲナー ゼ(COX)およびリポキシゲナーゼ(LOX)の活性化との関係に焦点を当てたデータが報告されている。これらの酵素は、プロスタグランジン(PG)、トロンボキサン(TX)、プロスタサイクリン(PGI2)、ロイコトリエン(LT)、酸化脂肪酸などの脂質メディエーターの産生に関与しており、ストレス、フリーラジカル、感染に反応して組織や免疫細胞から放出される炎症のバイオマーカーとしてよく知られている。このような分子はまた、極めて重要な代謝シグナル伝達経路の微調整や、炎症性マクロファージM1から抗炎症性マクロファージM2への転換にも関与している(図3)。
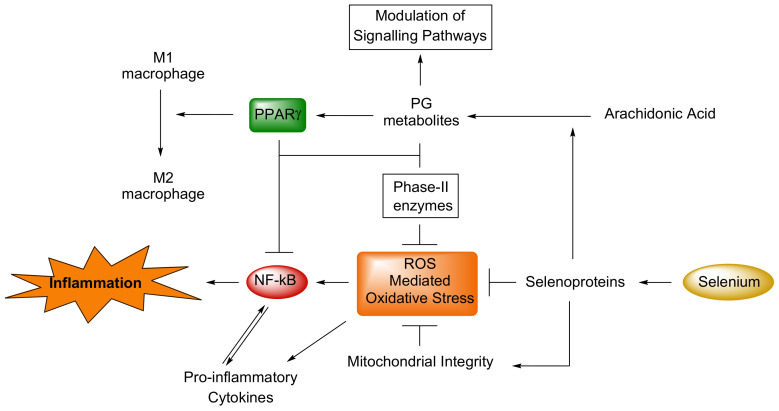
図3 炎症の代謝経路に対するセレンの作用 [110].
セレンの欠乏は、「免疫と炎症反応の中心的メディエーター」である活性化B細胞の核因子κ-軽鎖エンハンサー(NF-κB)を制御することにより、間接的にミトジェン活性化プロテインキナーゼ(MAPK)経路とシクロオキシゲナーゼ-2(COX-2)を介してCOXとLOXの発現を制御するGPx活性の低下を引き起こす可能性がある。セレンを含む多くの天然由来のサプリメントや栄養素は、低グレードの炎症を調節し、[110]、このようなメディエーターを抑制することで抗炎症メカニズムをサポートする可能性がある。
炎症のもうひとつの一般的なバイオマーカーであるC反応性タンパク質(CRP)の血漿中濃度が高いことは、血清セレン濃度の低下と関連している。[111]。セレン濃度が低いと、さらに全身性炎症反応症候群(SIRS)や敗血症に至るまで活性酸素やRNSの産生が増加し、広範な組織損傷や臓器不全を引き起こす可能性がある。[110,112]。セレンの補給は、このような状況下での死亡率を減少させた。[113]。酸化還元バランスの乱れは、実に多くの疾患の発生と発症に密接に関係している。このような観点から、抗酸化物質を用いた治療法は魅力的な選択肢と考えられる。一方、細胞のシグナル伝達経路は、生理的な活性酸素レベルに厳密に依存している。したがって、正確な酸化還元戦略が必要であり、適切な試験や個別化された治療戦略、栄養補給プロトコルを設定するために、種、時間、場所、レベル、標的の文脈で酸化還元状態を考慮すべきである[114]。
COX-2活性を選択的に阻害するよく知られた非ステロイド性抗炎症薬であるセレコキシブ(図4)のセレン誘導体が開発され、大腸がん予防のための臨床試験が行われている。[115]。これらの新規分子は、発がんの前段階である炎症過程に作用するため、抗炎症作用と化学療法による予防作用を併せ持つ。特筆すべきは、このような分子は極めて低用量で使用できるため、典型的な副作用を抑えることができることである。[116]。
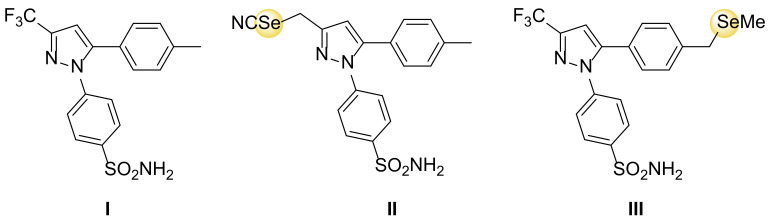
図4 セレコキシブ(I)、セレノコキシブ-2(II)、セレノコキシブ-3(III)の構造。
最近の疫学研究では、炎症性腸疾患(IBD)患者におけるセレン欠乏が、クローン病や潰瘍性大腸炎の重症度上昇と関連していることが報告されている。[38,117]。IBDは多因子性の病因を持ち、症状も異なるが、腸の慢性炎症状態という点で共通している。IBD患者の腸管細胞では4種類のGPxアイソフォームが高発現していることから、転写因子Nrf2を介した、炎症過程で免疫細胞が産生する高レベルのフリーラジカルを減少させるための代償機構が示唆される。十分な量のセレンがあれば、Nrf2は核内に入り、抗酸化/電気泳動応答性エレメント(ARE/EpRE)領域に結合して、GPxやTrxRを含む抗酸化遺伝子の発現を高めることができる。これらのセレノタンパク質は酸化ストレスに対抗し、炎症シグナル伝達経路を減衰させ、抗炎症性M2マクロファージ集団を増加させ、患者の寛解期延長を助ける。[117]。食餌性セレンとセレノプロテインは、このような疾患に関連する特定の経路を調節することが観察されている。具体的には、アセレンとセレノプロテインが欠乏すると、WNT経路(発癌に関与)が活性化され、炎症性サイトカインの産生が調節される。このようなことが起こる正確なメカニズムは、さらに研究され、明らかにされるべきである[89]。
関節リウマチ患者における炎症の影響を調節するGPxの役割の可能性については、ごく最近、臨床および前臨床研究のレビューで検討された。このような研究において、著者らは、セレン欠乏が自己免疫性炎症性疾患の原因なのか結果なのかは明らかではないと結論づけた。[118]。平均的な超栄養セレン摂取量の地域から選ばれた中国人コホートを対象としたごく最近の研究では、関節リウマチ患者群と健常対照群から血液サンプルが採取された。一般的に、セレン濃度が高い患者は症状が軽く、C反応性タンパク質、IL-6、RANKLのレベルが低かった。試験管内でのさらなる試験の結果、著者らは、セレンの高摂取が活性酸素調節を介してRANKL発現を調節する可能性があると結論づけた。[119]。全体として、これらの栄養素を摂取することによっても、適切な酸化還元ホメオスタシスを維持することは、炎症性疾患の予防や緩和にも役立つようだ。セレンを十分に摂取することで、セレン酵素を含む抗酸化経路が正しく機能するようになるかもしれない。
4. 心血管疾患
酸化ストレスは、いくつかの心血管疾患(心血管疾患)の発症と進行に寄与する内皮細胞機能を損なう。シクロオキシゲナーゼ(COXs)は、血管収縮作用や血管拡張作用を持つ5種類のプロスタノイドを産生する主要な酵素である。酸化ストレスが増加した条件下では、COXsの発現と活性の変化が血管の緊張に影響を及ぼし、心血管系疾患のリスクが増加する。近年、一般的な心血管疾患に対する酸化ストレス、COX-2、プロスタノイドを標的とした新規薬剤が評価されている。動物モデルの実験では、セレンが酸化ストレスとCOX活性を低下させ、糖尿病性心肥大におけるロイコトリエン経路をダウンレギュレートすることが実証されている。[120]。
一酸化窒素(NO)は、最も強力な内因性血管拡張物質である。また、平滑筋細胞の増殖や遊走、白血球の内皮への接着、血小板の凝集を抑制する作用もあるため、内皮機能にとってその正しい代謝は極めて重要である。[121]。血管の恒常性は、活性酸素種(ROS)の発生とNO産生との間の平衡によって維持されており、[122]、構成的な内皮一酸化窒素合成酵素(eNOS)と血管NAD(P)H酸化酵素に依存している。この微妙なバランスは、cGPxやTrxRsのようなセレノタンパク質の作用を介し、セレンによって調節されることが示されているスーパーオキシドアニオン/硝酸バランスに影響される。これらは、(NOとスーパーオキシドイオンの比を不均衡にする)活性酸素種の消去や、(eNOSや血管オキシダーゼなどの)重要な酵素の酸化的不活性化の防止など、さまざまなレベルで作用する。例えば、TrxRsの過剰発現は、遺伝子組換えブタ肺動脈内皮細胞におけるeNOSの不活性化を防いだが、遺伝子組換えによって誘導されたcGPx欠損は、NOSの阻害を通じて生物学的利用可能なNOの枯渇を引き起こした。[121]。
最近、制御タンパク質であるカベオリン-1が、カルモジュリンによるeNOSのカルシウム依存性活性化とアロステリックに競合することによって、eNOSを不活性化することが観察された。これはNO産生を減少させることによって一酸化窒素のバイオアベイラビリティを低下させ、内皮機能障害を引き起こす。カベオリン-1の高発現レベルは、高濃度の亜セレン酸の投与と関連していた。興味深いことに、生理的濃度の亜セレン酸は、カベオリン-1のmRNA発現を減少させる。[122]。
マクロファージなどの誘導性一酸化窒素合成酵素(iNOS)を持つ細胞では、異なる証拠が示されている。[121]。セレン欠乏RAW 264.7(マウスマクロファージ細胞株)では、酸化還元感受性転写因子NF-κBのアップレギュレーションを介したiNOSの発現亢進が観察された。その結果、NOの産生が亢進し、酸化ストレスの増加に起因する炎症に関連した状態が記録された。[123]。ブタの脳でも同様に、セレンの欠乏はiNOS/NF-κB経路を活性化し、炎症性サイトカインの発現をアップレギュレートし、炎症性病変を引き起こした。[124]。セレンを含むサプリメントは、サイトカインによって誘発されるNF-κBとiNOSのアップレギュレーションをブロックするのに有効であることが証明され、動物モデルの視床下部と海馬におけるストレス関連のNO炎症レベルを減少させた。[125]。ニワトリのセレン飼料サプリメントは、NF-κB/iNOS経路を介したNOの産生を介して、カドミウム由来または水銀由来の炎症に関連する心臓傷害、脾臓リンパ球、および脾臓組織損傷を緩和した。[126,127]。
NO合成に対するセレンの調節作用については、無機セレンまたは有機セレンに由来するiNOSの発現に対するGPxの阻害作用が関与するメカニズムが提唱されている。[123,128]。
したがって、セレンの十分な摂取は、非感染性心血管疾患に対する潜在的な予防効果を発揮する可能性がある。心血管系疾患におけるセレンの役割に焦点を当てた最近の研究の概要を表S1にまとめた(補足資料参照)。セレンはすでに、IL-15依存性の上皮障害と炎症に関連した合併症を阻止するために、心血管系疾患の治療手段として推奨されている。[110]。しかし、観察データや臨床試験に基づくいくつかの疫学研究は、セレニウムと心血管の健康との関係を明らかにすることを目的としていたが、決定的な回答は得られなかった[1]。一般的な合意では、結論の出ない結果は、ベースラインのセレンレベルの違い、他の共同サプリメント抗酸化物質の影響、異なるプロトコル(サプリメント戦略と使用されたセレン種)に起因するとされている[129,130,131,132,133]。
セレン欠乏が心血管疾患(感染症を伴わない)に果たす役割に注目した実験から、セレン摂取量の低下と心血管疾患の関連性は、酸化ストレスの増加とその結果によるものである可能性が示されている。[129]。早くも80年前から、セレン摂取量の低さは、急速に進行する心筋症と関連しており、広範な線維化と変性変化をもたらし、今日では「ケシャン病」と名付けられている。この心筋炎の発症はコクサッキーウイルスによって引き起こされることが知られており、その病原性はセレン欠乏とGPx1保護活性の低下という条件下で増大する。[2]。実際、酸化還元活性を持つセレノプロテインGPxとTrxRは、冠動脈や心不全の主な危険因子である酸化ストレスや脂質の酸化的修飾を防止または調節し、炎症を抑え、血小板の凝集を抑制し、血管反応性を正しく維持することによって、心臓血管系を保護している[2,134](図5)。
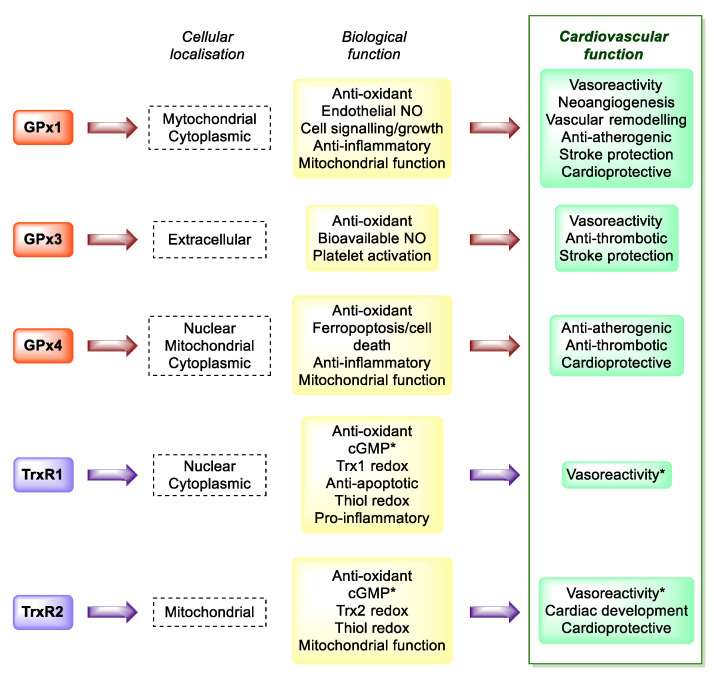
図5 GPxとTrxRと心血管系の健康との関係。* TrxR1とTrxR2の両方がこの機能に寄与しているかどうかは不明である[134]。
セレンの補給は、GPxsとTrxRsの機能の増加を通じて、心臓虚血再灌流後の酸化的損傷の軽減に効果的であることが証明されている[135]。このように、セレンのサプリメントは、ヒトを対象とした研究で示唆されているように、全般的な酸化還元ホメオスタシスを維持し、心血管疾患とそれに伴う死亡のリスクを軽減するのに役立つ可能性がある。関与するセレノタンパク質の具体的な作用機序をより明確にするために、さらなる研究が必要である。
セレンタンパク質TrxR1は、コエンザイムQ10(ユビキノン、CoQ10)を活性型ユビキノールに還元するのに必要であり、セレンが欠乏すると、細胞が最適濃度のCoQ10を得ることができなくなる可能性がある。コエンザイムQ10は、ミトコンドリアの呼吸鎖における中心的な電子キャリアであり、また強力な抗酸化物質でもあり、主に脂質の過酸化に対して作用する。心筋症患者や虚血性心疾患患者ではCoQ10濃度が低く、その補充によって心機能と内皮機能が向上することが、さまざまなメタアナリシスによって示されている。さらに、CoQ10濃度は心血管死リスクの予後指標となることが明らかにされた。[136]。443人の高齢者を対象に、セレンと補酵素CoQ10のサプリメントを4年間投与する二重盲検プラセボ対照前向き研究が実施された。10年間の追跡調査の結果、心血管死亡率の低下、心機能の改善、バイオマーカーNT-proBNPの血漿中濃度の低下が示された。[136,137]。興味深いことに、セレン濃度が低い患者ほど死亡率が高かった。セレン補給による心臓保護効果は、セレン濃度が低い被験者で観察されたが、セレン欠乏症のない患者はセレン補給の影響を受けなかった。[138]。
以前に報告された肯定的な臨床効果に関する説明は、後に、線維症の状態の低下 [139] および/またはプラセボと比較したサプリメント摂取被験者におけるインスリン様成長因子-1(IGF-1)およびインスリン様成長因子-1結合タンパク質(IGFBP-1)の濃度上昇に基づいて提案された。この文脈では、IGF-1が有意な抗炎症作用と抗酸化作用を有することが報告されている。[140]。セレン補給の保護作用は追跡調査期間中も持続し、12年後も観察された。[141]。さらに、同じ母集団から得られた219人の被験者からなるサブグループを対象としたごく最近の研究では、サプリメント介入の結果、特にベースライン時のセレン濃度が低い患者において、フルクトサミン濃度が有意に低下したことが強調されている。注目すべきことに、フルクトサミンは糖尿病患者における血糖コントロールの長期的なマーカーであり、心血管リスクのマーカーでもある。[142]。
48カ月にわたる無作為化二重盲検プラセボ対照試験において、213人の被験者にセレン酵母(200μg/日)とCoQ10(200mg/日)またはプラセボが投与された。ベースライン時と試験終了時にD-ダイマーが測定された。D-ダイマーは線溶の産物であり、内皮機能障害、血栓塞栓症、炎症のバイオマーカーとして用いられ、虚血イベントにおける心血管系死亡率と関連している。このコホートの対象者は全員、ベースライン時のセレン濃度が低かった(平均67μg/L、SD 16.8)。ベースライン時のDダイマー値が中央値を超えていた被験者では、サプリメントによる有意な効果が認められ、プラセボ群と比較して心血管系死亡率が低下した。[143]。
このように、セレンとCoQ10の併用補充は、Dダイマーの上昇を防ぐことによって心血管系死亡率を低下させるようであった。したがって、上記の研究結果は、心血管障害に対するセレンとCoQ10の相乗作用を示唆しているが、セレンの補充は、ベースライン時のセレン濃度が低い患者においてのみ、有益な介入戦略として考慮される。
甲状腺機能低下症の場合、循環リポ蛋白に変化が生じ、アテローム性因子が増加する。DIO1の十分な活性は、脂質代謝のホメオスタシスにとって重要であるようだ。[1]。血中または足の爪のセレン濃度を測定した25の観察研究(14の前向きコホート研究、11の症例対照研究)と、セレンサプリメントに関する6つの無作為化試験のメタアナリシス [144] では、総セレン濃度と冠動脈性心疾患(CHD)リスクとの間に、統計的に有意な中程度の逆相関があることがすでに判明していた。セレン濃度が低い人は、特にセレン摂取量の少ない集団において、CHDリスクが高いことが判明した。セレン濃度が高いほど、特に食事からのセレン摂取量が少ない人では、CHDの発症率が低いことがわかった。一方、すでに十分なセレン摂取量がある被験者では、過剰摂取が心血管障害を引き起こす可能性があった。
2017年に行われたランダム化比較試験のレビューとメタアナリシスでは、CHD死亡率、血中脂質プロファイル、血清C反応性蛋白(CRP)、GPxレベルに対するセレン補給の効果が評価された。この研究では、合計43,998人の参加者を対象とした16のプラセボ対照二重盲検試験が検討された。セレンの補充は血清CRPを減少させ、GPxレベルを増加させたことから、CHDを悪化させる酸化ストレスと炎症を減少させる効果があることが示唆された。しかし、セレンの補充は、血中脂質プロファイルの改善や死亡率の低下には十分ではなかった。[145]。
血中脂質プロファイルに対するセレンの効果に関しては、この関連性の根底にあるメカニズムはまだ部分的に不明である。[146]。
セレンは脂質過酸化とリポ蛋白代謝に重要な役割を果たすと考えられるが、この話題についてはさらに研究が必要である。[133]。
フランスの多施設共同試験SU.VI.MAXの初期データでは、セレンの補充による虚血性心血管疾患発症率への有意な影響は示されなかった。興味深いことに、男性ではトリグリセリド値の上昇とHDL-コレステロール値の低下がみられたが、女性ではみられなかった。[146,147,148]。同じコホートを対象とした5年間の追跡調査における介入後の研究では、総コレステロールと非HDLコレステロールの血漿中濃度がプラセボ群と比較して低いことが示された。[149]。
英国のPRECISEコホートを対象としたランダム化試験では、低用量および中用量のセレンを補充すると、総コレステロールおよび非HDL血漿コレステロールが有意に低下することが示された。一方、高用量のセレン補給はHDLコレステロールを増加させ、総コレステロール/HDLコレステロール比は、セレン投与量の増加とともに漸減した。[150]。同様に、血液透析(HD)を受けている60人の糖尿病患者を2つのサブグループに無作為に割り付け、1日あたり200μgのセレンまたはデンプンプラセボを投与した。24週間後、セレン投与群はプラセボ群と比較して、血清インスリン値、インスリン抵抗性、総コレステロール値、LDL-コレステロール値、C反応性タンパク質の有意な減少を示した。さらに、インスリン感受性、HDL-コレステロール、総グルタチオンについては有意な増加が観察された。全体として、セレンの補給は、HD糖尿病患者の一般的な代謝状態を改善した。[151]。
心不全患者2516人を対象としたBIOSTAT-CHF観察研究では、セレン欠乏(血漿中70μg/L未満)と死亡または入院、運動耐容能の低下、QOLの低下との間に強い関連が示された。[131]。
一方、894人の被験者を含む無作為のKardiovize都市コホートに関する横断的分析では、セレン摂取量(複合食事抗酸化指数内で考慮)と頸動脈内膜中膜厚(cIMT)との間に有意な関連は認められなかった。セレン濃度は、ウエスト/ヒップ比(WHR)、体脂肪量(BFM)、総コレステロール/HDL比などの他の心血管危険因子とは負の相関を示し、HDL-コレステロールとは正の相関を示した。興味深いことに、このような関連は女性においてより有意であった。しかしながら、全体的な結果に対するさまざまな食事性抗酸化物質の具体的な寄与を評価することは困難であったことを述べておく価値がある。[152]。
2903人の参加者を対象としたNHANES研究では、血清セレン濃度が高い人ほど一般死亡率および心血管疾患死亡率が低かった。最も予防効果が高かったのは、心血管リスクが低い被験者であった。さらに、血清セレンは両ジェンダーにおいて総死亡率と有意に関連していたが、心血管疾患死亡率との関係は女性においてのみ有意であった。[130]。
入院中の慢性心不全(CHF)患者32人では、健常対照群と比較して血清セレン濃度が低かった。さらに、セレン濃度は左室容積および肺動脈圧と有意な逆相関を示した。[153]。
ごく最近の症例対照研究では、血漿セレン濃度と脳卒中初発リスクとの関連性が検討された。ベースラインの血漿セレン濃度と脳卒中リスクとの間には、男性では非線形な負の相関が認められたが、女性では認められなかった[154]。同様に、ごく最近の研究では、セレンを含む微量元素と大動脈弁硬化症(AVSc)との関係が調査された。AVScとは、長期にわたる炎症過程の後期結果であるとされる大動脈弁の肥厚と石灰化のことである。患者群の血清セレン濃度は健常対照群と比較して低かった。[155]。これは、セレンを含むいくつかの微量元素が通常提供する活性酸素やRNSからの保護と一致しているようだ。
上記のような肯定的な結果が報告されているにもかかわらず、いくつかの観察研究では、セレン濃度と心臓病や心臓死のリスクとの間に統計的に有意な関係を見出すことができなかった。驚くべきことに、セレン濃度の上昇と心血管疾患の世界的なリスク上昇との関連も認められた。[2,132,156]。この文脈において、16の観察研究と16の無作為対照試験の最近のメタアナリシスでは、検討されたコホートにおいて、心血管イベントに対するセレン補給の有意な効果は示されなかった。しかし、セレン濃度と心血管疾患リスクとの間に逆U字型の相関がある可能性が示唆された。[157]。これらの知見は、2012年の包括的レビュー [2] から得られた結果と一致している。現在までに報告されている研究の一般的な結論は、ある血漿濃度を超えてセレンを補給しても、それ以上の利点は得られないというものである。したがって、これらの結果は一般的に、特にすでに食品から十分なセレンを摂取している健康な人において、心臓病の予防にセレンのサプリメントを使用することを支持するものではない。実際、上述したように、過剰なセレンは、直接的なチオール酸化や間接的な活性酸素種の発生を介して、酸化還元状態に悪影響を及ぼす可能性がある。食品やサプリメントからのセレンの心血管健康への寄与、特にセレン欠乏症の被験者に対する寄与をよりよく理解するためには、さらに具体的な臨床試験が必要である。
5. 甲状腺疾患
甲状腺のセレン濃度は、体内のどの臓器よりも高い。セレンはヨウ素とともに甲状腺ホルモンの合成と代謝に重要な役割を果たしている。血清セレン濃度と甲状腺容積、甲状腺腫のリスク、甲状腺組織損傷のリスクとの間には、軽度のヨード欠乏症者において逆相関が認められた。しかし、これらの結果は女性においてのみ統計的に有意であった。
ある研究で、SECIS結合蛋白質2(SBP2)遺伝子のミスセンス変異が甲状腺機能のいくつかの問題の原因であることが同定された。これらの機能異常はセレンの補充では解決できず、ヨードチロニン脱ヨードイナーゼ2(DIO2)の活性低下、ヨードチロニン脱ヨードイナーゼ1(DIO1)およびヨードチロニン脱ヨードイナーゼ3(DIO3)の発現不足が原因であると考えられる[158,159]。
他の内分泌疾患では、ヨードチロニン脱ヨウ素化酵素(DIO)レベルの変化は、食事によるセレンの摂取不足が原因である可能性がある。例えば、セレンとヨウ素の摂取不足が重なると、風土病である粘液水腫性クレチン症の原因となるようだ。[160]。さらに、中程度のセレン欠乏は自己免疫性甲状腺炎と関連している可能性がある。ヨウ素は十分だがセレンが少ない集団は、橋本病自己免疫性甲状腺炎(AIT)を含む甲状腺疾患の有病率が高くなりやすい。過去数年間のいくつかの介入研究では、セレノメチオニン、亜セレン酸塩、セレン化酵母の形でセレンを補充したAITまたはグレーブ病患者において、甲状腺ペルオキシダーゼ抗体(TPOAb)が変動的に減少することが証明されている[110,161]。最近Wintherらによってレビューされたように、疲労の軽減や炎症性サイトカインの減少など、他の有益な効果が得られた例もある。[161]。同様に、Zuoらは、甲状腺疾患患者におけるセレン補給の明らかに有益な効果を報告した17の試験の結果を分析し、FT3、FT4、TPOAbのレベルを低下させた。[162]。AITの71人の小児と青年に、有機L-セレノメチオニンを毎日200μgの高用量またはプラセボを6カ月間投与した。Seの補充は、プラセボ群と比較してSe群で抗Tgを減少させるようだ。甲状腺容積に有意差は認められなかった[163]。15~78歳の被験者102人のコホートを3カ月間、亜セレン酸ナトリウム200μg/日、ビタミンC 500mg/日、プラセボの3群に無作為に割り付けた。甲状腺刺激ホルモン(TSH)、TPO-Ab、抗サイログロブリン抗体(Tg-Ab)、セレン濃度が、治療前と試験終了時に測定された。注目すべきことに、TPO-Ab濃度はセレンとビタミンCを投与した群では低下したが、プラセボ群では低下しなかった。これらの所見は、セレンがビタミンCより優れているとは証明されなかったとしても、AITにおけるセレンの有益な抗酸化作用の仮説を支持するものである。[164]。橋本甲状腺炎で低ビタミンD状態の女性47人を含むグループで、半数に1日200μgのセレノメチオニンサプリメントとビタミンD(1日4000IU)を12カ月間投与した。もう一方のグループにはセレンは投与せず、ビタミンDのみを投与した。この2つの研究グループは、年齢、体重、甲状腺抗体価、サイロトロピン値、遊離甲状腺ホルモン値がよく一致していた。甲状腺ペルオキシダーゼ抗体とサイログロブリン抗体の血清力価、サイロトロピン、遊離甲状腺ホルモン、25-ヒドロキシビタミンDの循環レベルを分析した結果、甲状腺自己免疫に対する外因性ビタミンD補充効果は、セレンとビタミンDの併用療法が橋本病甲状腺炎に有効である可能性を示している。一方、潜在性甲状腺機能低下症に関しては、42人の患者が二重盲検臨床試験に参加し、毎日200μgのセレンを投与する群とプラセボを投与する群に無作為に割り付けられた。8週間の治療後、血清抗TPO AbとTSH値に有意な影響は認められなかった。[166]。
バセドウ病(GD)の一般的な甲状腺外症状はバセドウ病眼窩症であり、これは活性化Tリンパ球が甲状腺組織だけでなく眼窩組織や眼外筋肉にも作用する結果である。メキシコシティの眼科紹介センターで、対照無作為試験が行われた。患者は2群に無作為に割り付けられ、プラセボまたはセレンサプリメント(200μg/日)を6カ月間投与された。治療前の値は、群間で統計的に有意な差は認められなかった。治療終了時、サプリメント投与群ではCASスコア(目に関連する7つの炎症徴候からなる)に統計学的有意差が認められたが、プラセボ投与群ではどの変数にも差は認められなかった[167]。
甲状腺機能低下症は、妊娠中や出産後によくみられる症状であり、母体や新生児に悪影響を及ぼす可能性がある。この観点から、甲状腺機能低下症および潜在性甲状腺機能低下症の妊婦を対象とした、さまざまなセレノメチオニン補充ランダム化対照試験が比較された。[168]。セレンの補充は、中等度から高度の分娩後甲状腺炎の発生率を減少させるのに有効であることが証明された。微量栄養素の欠乏は妊娠中によく起こり、胎児の正しい成長を損なう可能性がある。1931人の妊婦を対象としたごく最近のプロスペクティブコホート研究で、妊娠中の母親のセレン状態は甲状腺機能と非線形に関連し、甲状腺機能低下は低出生体重と関連するようであることが示された。[169]。
このシナリオでは、セレンのサプリメントが一般集団と妊婦の両方で甲状腺疾患 [68,161]の予防や治療を効果的にサポートできるかどうかをよりよく理解するために、さらなる研究が必要である。
6. 生殖能力および生殖
セレンの欠乏は、家畜、実験動物、ヒトにおいて雄の生殖能力の障害を引き起こす。当初から、中程度のセレン欠乏では精子の運動性と形態(頭部と尾部の切断まで)が損なわれるが、重度の欠乏では精子形成が完全に阻害されることが明らかになっている。[170,171,172]。放射性標識75Seを用いた先駆的研究により、セレンは精巣や精巣上体でいくつかのタンパク質に蓄積されることがすでに示されていた[173,174]。近年、高解像度の蛍光X線顕微鏡(XFM)により、精巣と精子におけるセレンの供給と利用について、より高感度な特性評価が可能になった。誘導結合プラズマ質量分析法(ICP-MS)または原子吸光分析法(AAS)による生体試料の定量分析の結果からも、男性の生殖能力に関与するセレン含有種に関する重要な情報が得られた[172]。
主な精巣セレンタンパク質はグルタチオンペルオキシダーゼ4(GPx4)で、精子のケラチン様ミトコンドリア被膜に約50%存在し、精子では非常に活性だが、成熟精子では不活性化される。[172,175]。精子は抗酸化システムが限られているため、高レベルの活性酸素種(ROS)に対して特に敏感である。精子中の高レベルの活性酸素は、脂質、タンパク質、DNAの酸化を引き起こす。酸化ストレスは精子の質の低下や男性不妊症と関連している。いくつかの動物モデルにおいて、GPxsファミリーのセレノプロテインは、精子とそのDNAを酸化的損傷から保護するのに有効であることが証明された。このことは、男性不妊症の治療戦略を改善するための重要なポイントである。[176]。酸化還元ホメオスタシスと男性不妊の維持との関係は、長い間確立されてきた。生理的レベルでは、活性酸素は精子の機能と受精に不可欠であり、ステロイド生成から精子による卵子受精に至る極めて重要な過程に関与している。病的な条件下では、活性酸素の異常産生が起こり、男性の生殖機能を損なうことがある。体内の抗酸化システムは、主に酸化還元ホモダイナミクスの維持を保証するが、体内の活性が十分でない場合には、食事から得られる外因性抗酸化物質が重要な役割を果たす。一方、無秩序なサプリメントは、生殖機能の基本である上記のプロセスを阻害する可能性がある。したがって、男性の生殖能力を正しく保証するための主な課題は、酸化物質と抗酸化物質のバランスをとることによって、活性酸素を適切な生理的濃度に維持することである[177]。
GPx4はリン脂質ヒドロペルオキシドとH2O2を還元することが判明しており、[1,178]、これらは精子濃縮の基本であるプロタミン硫酸化に関与している。一方、リン脂質ヒドロペルオキシドとH2O2は、精子の構造と運動性に悪影響を及ぼす酸化ストレスの一因でもある。このように、GPx4は、成熟中の酸化的損傷から精子細胞を保護するという、男性の生殖能力にとって極めて重要な役割を担っている。[172]。GSHや他のチオール還元剤で還元すると、GPx4は活性型に戻る。ミトコンドリア型GPx4の他に、細胞質型(cGPx4)[172]と核型(nGPx4)の2つの型が同定されている[179]。当初は、これらの形態のうち特に1つが、雄の生殖におけるセレンの役割に関与しているかどうかは不明であった。特定の研究 [180,181]により、ミトコンドリアアイソフォームのみが男性の生殖に重要であることが示唆された。73人の男性を対象とした遺伝学的研究では、不妊症男性の約10%、乏精子症の男性の約35%でGPx4の発現が低下しており、精子の運動性と精子濃度が有意に低下していることが示された[182]。別の研究 [183] では、75人の不妊男性から採取した精子サンプル中のGPx4濃度が、対照群と比べて有意に低いことが示された。これは精子の生存率、形態学的完全性、前進運動性とも相関していた。
SBP2遺伝子にヘテロ接合体変異が同定され、精巣におけるSBP2の発現が低下し、精子形成が停止して完全な無精子症に至ることが明らかになった[172]。さらなる研究により、肝臓から分泌されるSelP(哺乳類で唯一、セレノシステインを2つ以上持つセレンタンパク質)が、精巣にとって不可欠なセレン供給源であることも示された[172]。注目すべきことに、トランスジェニックSelP欠損マウスは雄性不妊症であった。[184]。
精巣特異的なもう一つのセレノプロテインは、チオレドキシン-グルタチオン還元酵素(TGRまたはTRxR3)であり、精子の成熟過程でジスルフィド結合の異性化に関与することが示唆され、その結果、男性の生殖能力に直接影響することが示唆された。[185]。
さらに、セレノプロテインV(SelV)はネズミにおいて精巣特異的な発現を示し、特に精細管に存在することがわかった。精子形成における正確な機能はまだ解明されていないが、チオレドキシン様フォールドと保存されたCxxUモチーフを含むその構造に関するデータから、酸化還元機能の可能性が考えられる。ごく最近、SelVは小胞体ストレスやプロオキシダントによる酸化傷害に対して保護的であることが示された。これらの理由から、精子に対する保護的な抗酸化物質の役割を仮定することは妥当かもしれない[186]。
Salas-Huetosら[187]による最近の研究では、セレン摂取量の少ない不妊症の男性にセレンを補充したところ、精子の運動性、精液量、総精子数および濃度、精子形態などの精子品質パラメータが有意に増加し、受精の可能性が高まったと結論づけている。これは、上記のセレノプロテインの機能が、適切なセレン摂取量で改善された結果かもしれない。
Tellez Rojoらは、245人の男性(10歳から18歳)を対象に、セレンの摂取量と思春期の発達との相関関係を分析した。この研究では、セレンの摂取量がRDAを下回ると、思春期の発達が遅くなることが強調された[188]。
とはいえ、異なる証拠も出てきている。Hawkesらの介入研究では、42人の男性に高セレン酵母サプリメントを48週間摂取させたが、精子の質パラメーターには肯定的にも否定的にも影響は見られなかった[189]。著者らは、自己調節機構がセレンレベルの変動から精巣を保護している可能性を示唆した。171人の参加者(乏精子症および無精子症の男性を含む)を対象としたMOXI多施設無作為化臨床試験では、l-セレノメチオニンを含む多抗酸化製剤を一部に投与した。投与後、精子濃度は対照群に比べて上昇したが、精子の形態や運動性、生体内試験妊娠率には統計学的に有意な差は認められなかった。この研究によると、抗酸化剤の併用は精液パラメーターを改善しなかったが、著者らは、このテーマをよりよく解明するために、より大規模な試験を行うべきであると示唆した[190]。最近、Cannarellaらは、慢性自己免疫性甲状腺炎患者が男性不妊症と関連している場合、特にセレンが欠乏している場合、セレンが非ホルモン治療戦略の可能性があることを示唆した。彼らの研究では、男性不妊症の20人の男性に、市販のサプリメントを介してl-セレノメチオニンとして83μgのセレンを6カ月間毎日投与した。投与終了時には、精子濃度と精子運動性の増加、全般的な形態の改善、精液白血球濃度の低下、およびDNA断片化を伴う精子の割合が、投与前のデータと比較して観察された[191]。
さらに、このトピックに関する研究の数が少ないことを考慮すると、セレンのサプリメントが精子のパラメーターだけでなく、受胎の成功にも影響を与えるかどうかを判断するために、より大規模な集団を対象とした無作為対照試験を実施すべきである。
女性の生殖能力に対するセレンの効果については、2012年にRaymanがレビューしている。[2]。しかし、マウスモデルに関するごく最近の知見 [192] では、動物に無機または有機セレンを投与すると、SelKとSelM mRNAの卵巣レベルが上昇することが示された。さらに、卵母細胞からの胚盤胞の産生は、セレン欠乏群に対してセレン補給群で有意に高かった。ヒトの卵母細胞や胚において、過剰な活性酸素や不十分な抗酸化物質による酸化ストレスは、生殖の成功に有害な影響を及ぼす可能性がある[193]。
潜因性早発卵巣不全(OPOI)に罹患した70人の不妊女性コホートにおいて、セレン200μg/日とビタミンE 400IUを12カ月間補充する介入が行われた。OPOI患者は血漿中のセレン濃度が低く、活性酸素が増加していることが特徴であり、これは原始卵胞にダメージを与え、抗ミュラーホルモン(AMH)レベルを低下させる病態を悪化させる可能性がある。この介入終了時には、副作用なしに、抗ミュラーホルモン、肛門卵胞数、平均卵巣容積の増加が記録された。[194]。
報告された結果は、GPx1やGPx3を含む抗酸化酵素が、女性の生殖系において保護的な役割を果たすと考えられていることと一致しているようである[193,194]。サプリメントによって正しいセレン濃度を回復させることで、セレノタンパク質の正しい生理的活性が達成され、女性の不妊症が改善される。
したがって、これらの新しい結果にもとづいて、セレンが不妊に及ぼす影響は、確実にさらに研究されるべき研究分野である。
7. 骨と骨格の健康
ヒトでは、血清セレン濃度の低下は、骨疾患の高いリスクを伴う骨回転率の上昇と骨密度の低下の両方と関連している。従って、セレンは骨の健康に不可欠な栄養素であり、その役割は、酸化ストレスから骨を保護し、骨細胞の増殖と分化を制御する、酸化還元細胞バランスを維持する特定のセレノプロテインの作用に関連していると考えられる。適切な食事からのセレン摂取は、骨粗鬆症の発症を予防する役割を持つ可能性がある。
セレノタンパク質の変異と血漿中の低セレン濃度は、カシン・ベック障害や閉経後骨粗鬆症などの骨格疾患に典型的にみられる。セレン濃度は、大腿骨および転子部位の骨量と正の相関があり、セレンの十分な摂取は、股関節脆弱性骨折のリスクと逆相関がある。[195]。しかし、この点に関しては、骨折は骨粗鬆症とは異なる原因によるものかもしれないので、セレン濃度に関連する股関節骨折ではなく、骨密度(BMD)を評価する方が適切であろうという著者もいる。さらに、これらの患者では、喫煙状況、飲酒状況、身体活動レベル、栄養補助食品、糖尿病、高血圧、食物繊維摂取、カルシウム摂取を一緒に考慮すべきである。なぜなら、これらはすべて、骨の健康に直接影響する酸化ストレスの予防因子または危険因子だからである[196]。
最近の横断研究では、成人の集団において、長期的な栄養状態を反映する信頼性の高い指標である毛髪セレン値と腰椎および大腿骨のBMD値との相関が分析された。毛髪セレン濃度が低い人は、BMDが有意に低く、骨粗鬆症の発症リスクが高いことが示された。この研究から、毛髪セレン濃度の測定は、骨減少症または骨粗鬆症の患者に対して、最も適切な食事療法戦略を評価するために、簡単かつ迅速に使用できる戦略である可能性が示唆された。[197]。
この関連で、骨減少症または骨粗鬆症のトルコ人閉経後女性におけるセレン血清濃度と腰椎BMDとの関連性が、先行研究ですでに強調されている。[198]。さらに、血清セレン濃度の一般的な低値と骨粗鬆症との正の関連が指摘された。セレン濃度が低い人は、大腿骨頸部および腰椎のBMD値も低かった。[199]。最近の研究では、健康な加齢ヨーロッパ人男性において、血漿中のセレノプロテインおよびセレン濃度とBMD値が比較された。興味深いことに、セレノプロテインとセレン濃度は、甲状腺機能とは無関係に、BMD値と正の相関を示した。
食事からのセレン摂取量と骨粗鬆症の有病率との間に負の相関関係が、中国の一般的な中高年集団においても見出された。BMDは、コンパクトなデジタルRAシステムで指骨で検出され、そのエビデンスは男性にも女性にもおよび、用量反応傾向を示した。[196]。
一方、セレン摂取量の増加は、測定時のカルシウム摂取量にもよるが、閉経後女性被験者のBMDに悪影響を及ぼす可能性があることを観察した著者もいる[201]。
ごく最近、骨減少症または骨粗鬆症の閉経後女性120人を対象に、無作為二重盲検プラセボ対照試験 [202]が実施された。その半数に200μg/日の亜セレン酸が投与された。骨折リスクに関連する骨代謝マーカーである尿中I型コラーゲンN末端架橋テロペプチド(NTx)が測定され、血清セレンおよびセレノプロテインレベルも評価された。骨格の健康維持におけるセレンのメカニズムについては、セレンの活性酸素を減少させる役割と、骨吸収を促進する破骨細胞に対する造影機能の可能性が検討された。介入終了時、血清セレンとセレノプロテインPはベースラインより増加したが、NTxは変化しなかった。しかし、著者らは、骨格の抗酸化機能はサプリメントによって実際に改善されるかもしれないが、NTxは不適切なマーカーかもしれないと考えた。
すでに示唆されているように[197]、セレンは骨格維持に極めて重要な役割を果たし、骨微小環境における抗酸化防御特性を有している。セレンタンパク質は、主にセレンの必須輸送体であり、骨吸収破骨細胞と骨形成骨芽細胞の両方に発現している。
セレンとセレノプロテインの濃度が低いと、細胞内の活性酸素濃度が上昇し、異なるメカニズムで骨髄間質細胞の骨芽細胞分化を阻害し、骨粗鬆症の発症に関与する。さらに、セレンは細胞周期の進行と細胞増殖に重要であり、セレンの欠乏はG2細胞周期の停止をもたらす。さらに、インターロイキン-6(IL-6)や他のサイトカインが骨粗鬆症の発症に重要な役割を果たしていると考えられている。セレンは、IL-6とサイトカインの活性を抑制する作用を発揮することにより、疾患の発症と進行を遅らせることができる。最後に、セレンの欠乏は血中の甲状腺ホルモン濃度を上昇させ、骨量減少と骨粗鬆症の発生を加速させるため、この元素は間接的に骨格の健康にも関係している。[197]。
8. HIV
セレンは、ウイルス発現の阻害、およびHIV陽性患者におけるAIDSの進行遅延に関与している[203,204]。HIV/AIDSは世界的に主要な健康上の優先事項であり、効率的な抗レトロウイルス療法の開発により、HIVとともに生きる人々の数が増加した。しかし、栄養素の不足は、セレン摂取量に直接依存する免疫系を弱めることにより、抗レトロウイルス療法の効果を妨げる可能性がある。これは、免疫機能におけるセレンの役割だけでなく、ウイルス発現を調節する活性にも関係している可能性がある。さらに、前述のように、セレンは、慢性感染とその治療の両方に関連する酸化的損傷からの保護に関与している[205]。いくつかの研究で、HIV感染は一般的に活性酸素の増加 [205,206]と関連しており、その結果、セレンを含む主要な抗酸化栄養素が減少することが強調されている。[205,207,208]。
抗レトロウイルス薬は、特にヒト大動脈内皮細胞 [209,210,211]における酸化ストレスおよび損傷の増加と関連しており、その副作用としてアテローム性動脈硬化症および冠動脈性心疾患の長期的発症を引き起こす可能性がある。[205]。したがって、セレンを含む抗酸化物質の補給は、治療の副作用に対する治療の重要な部分であると考えられる。
HIVに感染した小児や成人では、セレン欠乏は進行した免疫不全 [205]、疾患の進行、死亡率と関連している。[212,213,214]。セレン欠乏状態におけるHIV関連死亡率の高さは、HIV感染患者において十分なセレン状態を維持することの重要性を示している。[213,215,216,217]。セレンが免疫系に及ぼす有益な効果は、動物実験やヒトでのサプリメント投与試験で証明されている。[205,218]。セレンの状態は、サイトカインの発現、インターロイキン2の産生、貪食性好中球とマクロファージが抗原を破壊する能力を調節し、HIV疾患の進行に影響を与える。
上述したように、抗酸化システムが正しく機能するかどうかもセレンに依存しており、セレンは腫瘍壊死因子α(TNF-α)の産生にも影響を与える。血漿中のセレン濃度は、HIV陽性患者におけるTNF II型受容体と逆相関していた[205]。HIV陽性患者におけるセレンの補充は、病気の進行、罹患率、死亡率のバイオマーカーに効果を示し、[205]、ウイルスの複製を減少させ、潜伏HIV感染Tリンパ球のグルタチオンペルオキシダーゼ活性を増加させた。[219,220]。さらに、通常HIV感染後に低下するマクロファージにおけるグルタチオンペルオキシダーゼ活性とチオレドキシン還元酵素1活性が、セレンの補充によって改善した。[221]。これは、グルタチオンおよびチオレドキシン系の活性と関連していると推測された。実際、セレンの補給は、HIV患者(セレンが欠乏していることが多く、その結果セレン酵素も欠乏している)におけるGPx1とTrxR1の発現を改善し、またHIVの転写と複製を阻害した。これはおそらく、酸化ストレスレベルが低下し、HIV感染において極めて重要な役割を持つNF-κB(Nuclear factor kappa-light-chain-enhancer of activated B cell)や炎症性サイトカインの発現が減少したためであろう[205,221]。
セレンの状態とHIVの進行に関するいくつかの研究では、血漿/血清セレン濃度または赤血球GPx1活性の低下、およびCD4+リンパ球数の減少と、HIVの進行および死亡率の増加との直接的な関連が観察された。HIV患者における十分なセレン濃度は、免疫防御を高め、全身状態を改善し、日和見感染症による入院を減らす可能性がある[1]。このような背景から、いくつかのランダム化比較試験では、HIV患者におけるセレン補給の有益性が強調され、入院が有意に減少した。[2]。
高活性抗レトロウイルス療法(HAART)患者300人を対象とした24カ月二重盲検プラセボ対照無作為化臨床試験において、CD4糖蛋白低下率、ウイルス抑制、罹患率に対するセレンの効果が評価された。1日200μgのセレンを投与された被験者では、CD4の減少率が43.8%減少し、免疫系に全体的な効果が認められた[222]。これに関して、別の無作為化二重盲検臨床試験では、878人のHIV感染HAART成人被験者が参加した。1日200μgのセレン+ビタミンのサプリメントは、プラセボ群に対してCD4数の減少を有意に減少させ、AIDS関連合併症の臨床症状や死亡のリスクは軽微であった。
これらの結果は、たとえマルチビタミンと一緒に投与したとしても、免疫系の維持におけるセレンの重要な役割を確認するものである[223]。HIV感染妊婦を対象とした特定の試験では、CD4+細胞数の改善 [217]も早産の減少 [224]も認められていない。しかしこれは、対象とした患者のベースラインの栄養状態が不良であるためかもしれない。
9. COVID-19
コロナウイルス疾患COVID-19を引き起こす新型コロナウイルスSevere Acute Respiratory Syndrome-coronavirus-2(SARS-CoV-2)は、世界的大流行と深刻な公衆衛生危機を引き起こす危険なコロナウイルスである。実際、COVID-19に関連する世界的大流行の深刻さは、より限定された地域に限られていた2003年の過去の急性呼吸器症候群コロナウイルス(SARS-CoV-1またはSARS-CoV)や2012年の中東呼吸器症候群コロナウイルス(MERS-CoV)を凌駕している[225,226]。本稿執筆時点で、SARS-CoV-2は2億9,300万人以上の感染を引き起こし、540万人以上の死亡の原因となっている。[227]。
最近、特異的なワクチンが開発されたにもかかわらず、COVID-19が人の健康と経済にもたらす世界的な脅威は、特にオリジナルのウイルス株に新たな変異体が拡散していることを考慮すると、依然として続いている。感染リスクを低減し、病原性の発達を抑制し、免疫系を強化し、回復を支援するための、迅速で信頼性が高く安全な対策が必要である。セレンは、主に特定のセレノタンパク質を媒介とする複雑な免疫調節作用など、幅広い保護機能を持つことから、これらの問題のほとんどに関連する役割を果たす可能性がある。[228,229]。
多くの研究が、セレン欠乏がRNAウイルス感染に対する宿主の感受性を高め、死亡にまで至るより重篤な疾患転帰を引き起こす可能性があることを記録している。[229,230]。
SARS-CoV-2と微量元素との関係に関するごく最近の文献を分析したところ、セレンとCOVID-19との関連性を示す直接的な証拠が得られた。十分なセレンの摂取は、ウイルス感染に対する抵抗力、免疫機能の向上、感染発症を促進する炎症の抑制に不可欠である。観察研究では、COVID-19のようなRNAウイルス感染に対する宿主の抵抗力を高めるには、感染初期に栄養補助食品を投与することが重要であることが示されている。実際、セレンの欠乏はRNAウイルスの突然変異、複製、病原性をサポートする。セレンは新型コロナウイルス感染症において、宿主の抗酸化力を回復させ、アポトーシスを減少させ、SARS-CoV-2による内皮細胞障害や血小板凝集への影響を減少させるなど、幅広い多面的効果を持つ。低セレン状態は、重篤なCOVID-19関連症候群を発症する危険性のある患者、特に炎症性サイトカインの高レベルに特に影響を受けやすい脆弱な肥満患者や高齢患者に共通する指標である。このようにセレンは、COVID-19に対する世界的な対応において、ゲームチェンジャーとなる可能性がある。[228,229]。
SARS-CoV-2ウイルスが肺細胞に侵入すると、細胞構造を悪用して代謝や生理学的プロセスを阻害する。このような活動から酸化ストレス反応が生じ、宿主細胞からのビリオンの出芽はさらに細胞膜を破壊し、細胞溶解、活性酸素産生の亢進、炎症シグナル伝達経路の活性化を引き起こす。COVID-19における酸化ストレスのレベルは、疾患自体の重症度(組織損傷の拡大と炎症亢進)と関連づけることができる。セレン種の酸化還元活性、特にメチル-セレノール、ジメチル-セレニドなどの低分子セレン化合物(ヒトの体内ではセレン多量摂取によりほとんど達成される)、セレンナノ粒子、その他のセレン含有分子は、ウイルスの複製と転写を阻害することにより、ウイルスのライフサイクルを停止させることができる。特に、これらのプロセスは、宿主内でのウイルス成熟を可能にする主なSARS-CoV-2プロテアーゼである3C様プロテアーゼ(3CLpro)またはMpro(正式にはC30エンドペプチダーゼとして知られている)によるものである。エブセレン(図6)は、触媒ダイアドのCys145残基のスルフヒドリル基と共有結合することにより、Mpro活性を直接阻害することが示された[228,230]。
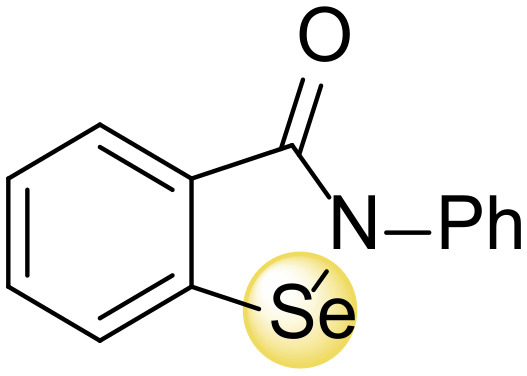
図6 エブセレンの構造
パパイン様プロテアーゼ(PLpro)は、SARS-CoV-2が宿主の抗ウイルス自然免疫応答に拮抗するために用いるもう一つの酵素である。エブセレンは、触媒トリアッドのCys112残基のスルフヒドリル基と共有結合することで、PLproを高度に阻害することが発見された。[228]。
セレン保護作用のメカニズムには、ウイルス誘発性サイトカイン放出症候群に対する抵抗性の増加も関与している可能性を示唆する著者もいる。セレノタンパク質と酸化還元活性セレン種(エブセレンや関連するGPx模倣物質など)の両方が、ウイルスが誘発する酸化ストレス、異常炎症反応、免疫システム不全を遅らせ、SARS-CoV-2感染の予後を改善することに関与している可能性がある。
抗酸化セレノ誘導体の投与は、COVID-19感染の発症を抑制したり、臨床経過を改善したりする上で極めて重要である可能性がある[228,230]。適切な栄養補給を伴う栄養介入は、特に発展途上国などの脆弱な集団や高リスク地域において、COVID-19の予防または共助となる可能性がある[225]。
COVID-19患者におけるセレン欠乏と死亡リスクとの関連が強調されている。Moghaddamらは、ドイツの病院で39人のCOVID-19患者を対象に横断研究を行った。研究者らは、生存しているCOVID-19患者では、生存していないCOVID-19患者に比べて、血漿中のセレン濃度が有意に高いことを発見した[231]。さらに、中国人のCOVID-19患者の治癒率と地域的なセレンの状態との間に、有意な正の線形相関が認められた。[228]。
前述のように、セレンはCOVID-19の疾患侵襲性と良好な回復に関与しているようだ。したがって、最も重篤な症例やセレン欠乏患者には、サプリメントの投与が考えられる。因果関係のメカニズムはまだ不明だが、予備的な観察研究では、COVID-19患者におけるセレンの状態分析が、たとえ因果関係のメカニズムが不明であっても、有用な診断情報を提供する可能性があることも明らかになった。セレンとSARS-CoV-2疾患との関係を明らかにし、セレン補給による可能な予防法または補助療法を定義するために、介入研究を設定すべきである[231]。
Hellerらは、COVID-19における生存の信頼できる指標として、セレノプロテインPと亜鉛を含む複合バイオマーカーを提案し、セレンおよび/または亜鉛の個別化された補充が回復をサポートする可能性を示唆した[232]。COVID-19に関連した炎症は、グルタチオンペルオキシダーゼ、チオレドキシンレダクターゼ、小胞体(ER)ストレスの制御に関与するもの、SARS-CoV-2感染細胞におけるインターロイキン-6(IL-6)の発現を含む、多くのセレノプロテインの発現低下に関連している。このことは、一般的にセレンの状態が低い肥満患者においてさらに強調され、食事によるセレンの補給が呼吸器症状や炎症性臨床症状の緩和に役立つ可能性がある。[233]。
セレンはまた、NF-κB阻害剤としての役割も果たし、その結果、免疫調節と抗炎症作用がもたらされる。[229]。サイトカインの放出はCOVID-19に悪影響を及ぼし、特に高齢者では、セレン欠乏は循環炎症性サイトカインの増加と相関している。一方、セレンが十分であれば、感染症や炎症モデルにおけるサイトカインの過剰な活性化を防ぐことができる。場合によっては、高用量のセレンが適応免疫の増加と自然免疫系による炎症性サイトカインの放出の抑制に寄与したこともある。[228]。
十二分なセレン摂取量/状態と高い治癒率との関連性が強調されている。1日1mgのセレン(亜セレン酸の形)が、敗血症や重症患者への適用にすでに使用されている。以上のことを考慮すると、セレンの使用は、できればランダム化比較試験で臨床的に検証されるべきであることが、予備的な結果から示唆されている。[228]。
亜セレン酸4価陽イオン(Se4+)は2価陽イオン(Se2+)に還元され、酸化剤として作用する。この酸化能力は、抗ウイルス性に重要な意味を持つ。亜セレン酸はウイルスのタンパク質ジスルフィドイソメラーゼ(PDI)の活性部位にあるスルフヒドリル基と素早く反応し、図7に示す反応に従ってこの酵素を酸化し不活性化する。このようにして、ウイルスの疎水性スパイクは細胞膜タンパク質のジスルフィド基と交換反応を行うことができなくなり、その結果、ウイルスは健康な細胞質に侵入できなくなる[234,235]。
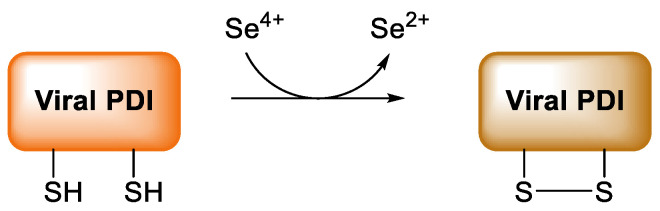
図7 Se(IV)が促進するウイルス蛋白質ジスルフィドイソメラーゼ(PDI)のチオール機能の酸化。
これらの結果に基づいて、エボラ出血熱、ポリオ、インフルエンザなどの他の感染症ですでに示唆されているメカニズムに従って、安価で入手しやすい亜セレン酸ナトリウムが、コロナウイルスを含むウイルス感染症を予防する潜在的な薬剤になりうると推測することは妥当であると思われる[235]。COVID-19の急性感染期が典型的な症例ではわずか数週間であることを考慮すると、毒性リスクを伴わずに中等度から重度の症状の患者に利益をもたらすために、このような短期間の同じ超栄養セレン投与を考慮することは妥当であろう。この戦略の全体的な可能性は予備的な提案であり、できれば大規模コホートでのランダム化比較試験で、臨床的に検証する必要がある。[228,230]。
10. 認知機能の低下とアルツハイマー病
血清セレン濃度は加齢とともに低下し、低セレン濃度は加齢に伴う脳機能の低下と関連する可能性があるが、これは抗酸化活性の低下によるものと考えられる。[236,237]。このような背景から、中国農村部の一部の地域など、土壌中のセレン含有量が低い地域での研究では、食事中のセレン濃度が低いほど認知機能が低下することが実証されている。[238]。
Kesse-Guyotらは、フランスのSU.VI.MAX.研究の45~60歳の4447人の参加者のデータを分析した。彼らは、アスコルビン酸、ビタミンE、β-カロチン、セレン、亜鉛を含む抗酸化サプリメントを約8年間投与したところ、エピソード記憶と意味流暢性テストのスコアが高くなったことを報告した。しかし、一般的に観察された効果に対するセレンの独立した寄与は決定できない。[239]。同様に、InCHIANTIコホート研究では、65歳以上の1012人が参加し、協調運動能力が評価された。セレン濃度の低下は、神経学的検査の成績低下と有意に関連していた。60~70歳の1166人を対象としたフランスのEVAコホートでは、ベースラインの血漿セレン濃度が低い参加者において、4年間で認知機能低下のリスクが有意に増加した。[237]。約288マイクログラムのセレンを含むブラジルナッツを1日1個、6カ月間摂取することにより、食事から体内のセレン濃度を適正に戻すと、患者の認知能力が改善した。[241]。
十分なセレンステータスを持つ2016人の参加者を含む横断研究は、高齢者におけるセレンステータスと認知能力との関連における性差の最初の証拠を提供した。特に、血中セレン濃度と認知能力との間には、男性では正の相関が認められたが、女性では認められなかった[242]。
アルツハイマー病(AD)は1906年に初めて報告され、長年の研究にもかかわらず、この疾患の病因はまだ十分に解明されていない。この疾患は、自発的にオリゴマー型に凝集する細胞外アミロイド斑の生成と、大型錐体ニューロン内のタンパク質タウの凝集体から形成される細胞内神経原線維もつれの存在によって特徴づけられる。[243]。現在のアルツハイマー病の治療法は、認知機能の維持に軽度の効果しかない。初期の研究では、さまざまな形態のセレンがこの疾患の予防や治療に有効である可能性が示唆されている。セレンは、単独で、またはビタミンEと組み合わせて、主にその抗酸化特性から、アルツハイマー病の治療または予防のために提案されている。[243]。脳内のセレン濃度は他の臓器ほど高くないが、セレンの摂取量が少ない条件下では、セレンはこの臓器に優先的に保持され、適切な脳機能に不可欠である。[244]。酸素利用率が高く、酸化しやすい金属が豊富なため、脳はいくつかのセレノプロテインとセレノ化合物を含む抗酸化メカニズムに特に依存している。[243,245]。この点に関して、セレノ-L-メチオニンは、細胞培養やげっ歯類モデルにおいて、酸化ストレスから保護し、βアミロイドによる毒性から保護することが実証された。[243]。亜セレン酸ナトリウムはγセクレターゼ活性を低下させることによりアミロイド産生を阻害することができ、セレン酸ナトリウムは神経原線維もつれ形成を減少させることができる。[243,246,247]。
アルツハイマー病では、タンパク質、脂質、核酸の酸化的損傷が、アミロイド斑の領域や神経原線維のもつれを持つ細胞で特に関連している。[248]。特にGPx1、GPx4、TrxR1は、過酸化物、フリーラジカル、酸化生体分子の還元に相乗的に働く。さらに、Gpx1は神経調節因子として作用し、神経変性疾患や神経精神疾患(ADだけでなく、PD、統合失調症、双極性障害も含む)に影響を及ぼす可能性があることが、ごく最近Sharmaらによって議論された[249]。SelP、SelW、ERに常駐するセレノタンパク質K、T、M(SelK、SelT、SelM)といった他のセレノタンパク質も、脳において極めて重要な役割を果たすことが示唆されている。[250]。脳内のセレノタンパク質は、グルタチオンまたはチオレドキシンを基質とする抗酸化物質として働く可能性がある。参考文献 [243] 最近の研究では、神経細胞へのセレン供給、抗酸化活性、細胞骨格形成、酸化還元活性金属(銅と鉄)のキレート化、ミスフォールディングタンパク質(アミロイドβとタウタンパク質)との相互作用におけるSelPの役割に焦点が当てられている。さらに、シグナル伝達に関連するグリア活性化や脳内コレステロール代謝への関与の可能性も考えられている。これらのトピックを明らかにするためには、今後の動物モデルやヒトベースの研究が必要である。[251]。SelPがアルツハイマー病に関与する正確なメカニズムについては、さらに調査し、議論する必要がある。SelPのノックアウトは、アミロイドペプチドによる神経毒性を増加させることがすでに示されている。[252]。さらに、長期記憶の神経細胞メカニズムに関連するシグナル伝達分子としてのセレノプロテインPの役割を示す証拠もある。[243]。このように、アミロイド斑や神経原線維のもつれの形成や記憶経路におけるSelPの潜在的役割が仮説として立てられている。この点から、SelPはADに関連した酸化ストレスに対する保護剤として働く可能性がある。[243,253]。アルツハイマー病患者の組織に関する死後研究では、通常加齢脳で増加するSelPが、アミロイドβ斑、神経原線維、脳脊髄液で特に顕著な増加を示したことが強調されている[253,254]。いくつかの研究によると、SelPは脳への輸送機能を発揮し、ApoER2 [255,256,257]などの特異的な受容体を介して標的化される。初期の研究では、SelPがAβと高リン酸化タウの凝集と毒性を防ぎ、Cu、Fe、Hgなどの脳の酸化還元活性金属とも相互作用することが示された。SelPは抗酸化酵素活性とシグナル伝達機能を示し、酸化還元ストレス反応を仲介する抗酸化セレノタンパク質の合成のために、神経細胞とグリア細胞にセレンを供給する。[251]。
現在の知識レベルでは、セレンの状態とセレノプロテイン濃度がすでに十分である集団にセレンを補給する根拠はない。すでに十分なセレンステータスを持つ集団にセレンを補充しても、影響や毒性の症状すら観察されなかった[251]。
今後の研究では、一般集団における認知機能の低下や、おそらくADの予防におけるセレン補給の潜在的な効果を明らかにするために、ベースライン時の参加者のセレン濃度を慎重に考慮する必要がある。さらに、セレノタンパク質は、シナプスレベルでのER-Ca2+フラックスとバランスの調節、および未修正のフォールディングタンパク質の分解に関与している可能性がある[250]。
間接的に脳を酸化ストレスから保護するセレンの金属キレート作用に関連して、試験管内試験モデルにおける最近の研究では、Aβ凝集プロセスに焦点が当てられている。キトサンで安定化されたセレンナノ粒子(Ch-SeNPs)は、金属によって誘導されたAβ凝集を阻害し、Aβ線維の有意な解離能を示し、その長さと幅を減少させた。[258]。
小胞体におけるタンパク質の適切なフォールディングは、その本来の機能にとって不可欠であり、このプロセスにおけるエラーは、小胞体関連タンパク質分解(ERAD)システムを介して修正する必要がある。初期の研究から、アルツハイマー病における小胞体ストレスの重要な役割がすでに示唆されており、アルツハイマー病患者の脳に特異的なマーカーが存在することが示されている。[243,259]。ERストレスは、細胞外アミロイドβの存在によって引き起こされ、神経原線維のもつれの形成を促進する可能性がある。[260]。このような背景から、セレノプロテインS(SelS、VIMP、またはSEPS1)はERADにおいて重要な役割を担っており、したがって神経原線維のもつれ形成において予防的な役割を果たす可能性がある。[261]。一方、カルシウムが神経細胞のシグナル伝達、生存、細胞死において重要な役割を担っていることを考えると、カルシウム調節の喪失はアルツハイマー病の病態の重要な一部である可能性がある。[262,263]。小胞体からのカルシウムフラックスの制御に関与するセレノタンパク質の数は増えており、例えばセレノタンパク質Mは、以前に報告されたように、ニューロンにおける小胞体カルシウムシグナル伝達を変化させ、酸化ストレスからニューロンを保護する。[264]。さらに、セレノプロテインN(SelNまたはSEPN1)の発現は、カルシウム感受性リアノジンER受容体を介したカルシウムシグナル伝達を変化させる。[243]。セレノプロテインTはまた、ニューロペプチドであるポリアデニル酸シクラーゼ活性化ポリペプチド(PACAP)に反応して、神経内分泌細胞の小胞体沈着物からのカルシウム放出を変化させることができる。このように、セレノタンパク質ファミリーは、小胞体カルシウムの調節と恒常性維持に重要な役割を担っているようだ。[265]。
ADにおけるセレンの潜在的重要性にもかかわらず、AD患者のセレン濃度に関する研究は、生活環境や食事状態の困難さやばらつきのため、非常に限られている。これが、現在得られている結果が矛盾し、一貫性がない主な理由であろう。[266]。最近行われた14の研究のシステマティックレビューとメタアナリシス [267] では、AD患者の脳におけるセレン濃度が有意に低下しており、記憶プロセスに極めて重要な役割を果たす側頭部と海馬領域で最も低い値を示した。これらの領域におけるセレン濃度の低下は、前述のセレノタンパク質の適切な発現と活性を損なうことによっても、ADの病態生理に重要な役割を果たしている可能性がある。
マウスモデル研究は、ADにおけるセレンサプリメントの有益な役割に関する最初の証拠を提供した。このようなサプリメントは、正しいセレンレベルとセレン酵素活性を維持する上で重要な役割を果たし、症状の進行を遅らせることができると考えられている。エブセレンは、アルツハイマー病誘発マウスモデルにおいて、記憶障害、海馬の酸化ストレス、アポトーシス、細胞増殖を改善した。[268]。セレノメチオニンは、ADマウスのシナプスの構造的・機能的可塑性を回復させた。[269]。セレンを主成分とするサプリメントは、神経変性に対して有効であることが証明された。例えば、エブセレンは酸化ストレスを調節し、Aβとp-tauを減少させ、ADモデルのシナプス後密度を改善することが示された。さらに、エブセレンを投与したトランスジェニックADマウスは、空間および記憶テストにおいて改善した結果を示した。[268,270]。
通常、AD患者は血漿中のセレン濃度が健常人よりも有意に低い。これは、上述のメカニズムを通じて、疾患の発症に関連している可能性がある。重回帰分析の結果、パン、バター、コーヒー、チーズ、魚の缶詰を含む栄養パターンの頻繁な摂取は、アルツハイマー病患者の血清中のセレン濃度の上昇と関連している可能性が示された。セレンを含む食事性抗酸化物質の十分な摂取は、予防因子である可能性がある。[271]。
臨床病期の異なる40人のアルツハイマー病患者と40人の健常対照者を対象としたごく最近の研究では、AD患者の爪と毛髪のサンプルに高いセレン濃度が認められた。著者らは、爪と毛髪のセレノメチオニン濃度が高いことは、脳内のセレノシステイン濃度が低いことに対応しており、したがって、活性型セレンの障害の結果として神経変性が説明されるという仮説を立てた。[266]。Vincetiらによると、過去の症例対照研究は、末梢のセレン曝露に関するデータ(例えば、足の爪、毛髪、血清または血漿レベル)を考慮しており、脳脊髄液のような中枢神経系の指標を考慮していないため、AD病因におけるセレン曝露の役割について信頼性の高い評価を行うことはできない[272]。この点に関して、Vincetiらは最近、脳脊髄液(CSF)の分析に焦点を当てた研究を行った。この研究の結果、ADリスクはCSF中の無機セレン種およびセレノプロテインPに結合した有機型と逆相関することが示された。一方、いくつかの先行研究では、AD患者群と対照群との間で、髄液中および血清中のセレン濃度に有意差は認められなかった。[273,274,275]。Cardosoらは、40人のアルツハイマー病患者を対象としたパイロット研究において、血清および脳脊髄液(CSF)中のセレンおよびセレノプロテインレベルを調べた。[276]。患者は、プラセボ群、栄養群(セレン酸ナトリウム0.32mg、3回/日)、超栄養群(10mg、3回/日)に無作為に割り付けられた。24週間の治療後、血清および髄液中のセレン濃度が測定され、認知アウトカムと比較された。高用量または超栄養量でのセレン酸ナトリウムの補給は、中枢神経系へのセレンの取り込みを増加させ、髄液中のセレンの上昇を伴い、ミニメンタルステータス検査(MMSE)スコアの微妙だが有意な改善に対応した。セレン代謝には個人差があることを考慮しなければならないが、長期的なサプリメント摂取による健康な高齢者の死亡率の増加も考慮しなければならない。また、55~100歳のアルツハイマー病患者にプロバイオティクス(L.アシドフィルス菌、B.ビフィダム菌、B.ロンガム菌)とセレン(200mg/日)を12週間共同摂取させたところ、プラセボ群と比較して認知機能といくつかの代謝プロファイルが改善した。[277]。
アルツハイマー病におけるセレンの役割に焦点を当てた最近の研究の総合的な概要は、表S2に報告されている(補足資料参照)。
11. パーキンソン病
パーキンソン病(PD)は、黒質の色素ドパミン作動性ニューロンの消失と、「レビー小体」と呼ばれる神経細胞内タンパク質の封入体が同時に存在することを特徴とする神経変性疾患である。ドパミン作動性ニューロンは、主に加齢に伴う鉄イオンの蓄積により、酸化ストレスに対して特に脆弱である。酸化ストレスは、細胞レベルで神経変性の発症と進行の主要な一因とされている。[278,279,280,281,282]。
実際、酸化ストレスは細胞内小器官、特にミトコンドリアを損傷し、神経細胞のエネルギー代謝を損ない、その結果、神経伝達と神経新生を阻害する。ミトコンドリアの機能障害は、アポトーシス、カルシウム放出、ミトコンドリア伝染性移行孔(mtPTP)の開口などを引き起こし、特定のドーパミン作動性ニューロンを含むニューロンの死につながる。さらに、ドーパミン代謝の不均衡が活性酸素の産生を助長する。食餌性抗酸化物質は、活性酸素と相互作用することにより、酸化的連鎖反応の終結に重要な役割を果たす。[282]。この点から、十分な抗酸化栄養状態を維持することは、PDの予防や進行を遅らせるための戦略であると考えられる。
セレンの生物学的機能は、活性部位にセレノシステイン残基を持つセレノタンパク質を介して発揮される。セレンは特に脳組織に取り込まれ、そこで様々な機能を果たすが、その中でも最も重要なものの一つが抗酸化機能である。セレンの欠乏は、PDを含む酸化ストレスに関連する疾患の危険因子となりうる。[283]。しかし、このような前提にもかかわらず、セレンとパーキンソン病の病態生理との因果関係を述べることは困難である。実際、運動系の一般的な障害は、全体的な栄養不良状態と関連している。したがって、このような障害はセレンだけでなく、疾患の進行に影響を及ぼす可能性のある他の微量元素の欠乏とも関連している。[240,284]。動物モデルを用いた最近の多くの研究から、セレン欠乏がドーパミン作動性ニューロンの酸化ストレスに対する脆弱性を高めることが示唆されている。特に、パーキンソン病神経毒にさらされる前に、亜セレン酸セレンに基づく準備治療を行うと、線条領域のドーパミン枯渇が用量依存的に減少することが観察された。[285]。
一方、56件の症例対照研究を対象としたごく最近の系統的レビューとメタアナリシスでは、パーキンソン病患者の血清または血漿中のセレン濃度は対照群と同程度であり、さらに脳脊髄液(CSF)濃度はパーキンソン病患者でかなり高いことが強調されている。[286]。これらの所見は、後にZhangらによって行われた11の研究のメタアナリシスでも確認された。[287]。
Adaniらによると、中枢神経系におけるセレンの過剰曝露は、保護因子というよりもむしろPD発症の原因である可能性さえある。セレンの人体に対する複数の有益な特性(抗酸化活性、Ca2+チャネルの調節、神経新生の調節)にもかかわらず、特に過剰暴露の場合には、ドーパミン受容体のmRNA発現の変化を介して直接神経変性につながる可能性のある、いくつかの悪影響も及ぼす可能性がある。[286]。
ADの場合について前述したように(前掲書)、パーキンソン病患者のセレン濃度について、血液や血漿のデータの代わりに髄液サンプルのデータを使用することは、より信頼性の高い研究を行うために、近年、さまざまな著者によって実際に支持されている。[286,287,288]。パーキンソン病患者の髄液中に存在する異なるセレン種を決定する試みが、Maassらによって行われた。[289]。75人のパーキンソン病患者と68人の年齢をマッチさせた対照者が登録され、8つの異なるセレン種が髄液サンプルから検出された。セレノプロテインP、ヒト血清アルブミン結合セレン(Se-HSA)、セレノメチオニン(Se-Met)、未同定のセレン化合物(U2)のみが、有意な定量値を示した。症例と対照の間に有意差は認められなかった。この研究によると、PD病態の発症におけるセレンの神経毒性は、以前考えられていたほど関係ないかもしれない(表S3、補足資料)。
さらに興味深い点は、腸-脳軸に関連していることである。腸内細菌配列が決定された細菌の21.5%がセレノプロテインを発現している[288]。ヒトのマイクロバイオームの変化がPDの危険因子であることが証明されている。[290]。したがって、腸-脳軸はパーキンソン病の病因に強く関与している可能性があり、さらなる研究が必要である。
12. 統合失調症、不安とうつ病
統合失調症は、小児期、青年期、成人期に発症する重篤な精神神経疾患である。平坦な感情、緊張病、注意・記憶障害、幻覚など、陽性、陰性、認知症状が異質に混在するのが特徴である。この病態は複数の環境的、遺伝的危険因子の影響を受けている。いくつかの研究で、統合失調症の病態生理に関連すると思われる神経系の損傷が酸化ストレスと関連している可能性が強調されている。[291]。実際、活性酸素は、脂質過酸化、タンパク質のカルボキシル化、DNA鎖切断によって神経細胞を損傷し、いくつかの神経伝達系を制御する細胞シグナル伝達カスケードを変化させ、その結果、ドーパミン作動性、グルタミン酸作動性、GABA作動性の神経伝達が変化する。グルタチオンペルオキシダーゼ、チオレドキシンレダクターゼ、ヨードチロニンデヨージナーゼが酸化ストレスに対する防御機構に決定的に関与していることを考えると、これらのセレンタンパク質の生合成や機能の低下は、統合失調症の病因に関与している可能性がある。[292]。
精神分裂病患者におけるグルタチオン(GSH)レベルの低下は1934年に初めて指摘され、[293]、その後のいくつかの研究でGSHレベルの低下と精神分裂病との相関が報告されている。[294,295]。また、精神分裂病とGSH合成障害との関連を示す遺伝学的証拠も示されている。[296]。抗精神病薬による治療を受けている統合失調症患者群では、GPx活性が著しく低下していることが報告されている。[292,297]。さらに、慢性統合失調症患者集団において、血中GPx活性と脳萎縮の構造的評価との間に逆相関が観察されており、酸化還元調節異常と神経変性との潜在的な関連性が示唆されている。また、ミトコンドリアのセレノ蛋白質であるチオレドキシン還元酵素2(TrxR2)の機能変化が統合失調症に関与している可能性が示唆されている。[292]。
興味深いことに、米国では、食物連鎖中のセレン濃度が低い州で統合失調症の発症率が高いことが報告されている。[292]。さらに、セレン輸送障害は、陰性症状を特徴とする統合失調症のサブタイプの危険因子であるという仮説が以前に立てられた。このことは、統合失調症患者における血小板や赤血球のGPx活性の低下からも支持されている。[292]。また、いくつかの研究では、ドーパミン作動性シグナルが食事からのセレン摂取量と関連していることが強調されており、統合失調症との間接的な関係の可能性が示唆されている。実際、食事性セレン欠乏は線条体における高カリウム誘発ドーパミン放出を上昇・延長させ、黒質、前頭前皮質、海馬におけるドーパミンのターンオーバー率を上昇させる。[292]。さらに、ラットモデルにおけるセレン欠乏は、黒質ニューロンにおけるチロシン水酸化酵素とドーパミントランスポーターmRNAの両方をアップレギュレートし、それに伴ってドーパミンの合成と取り込みが増加する。[298]。
逆に、食事性セレン補給は、GPx1の酵素活性と連関したプロセスで過酸化物を生成するドーパミン異化酵素モノアミンオキシダーゼ(MAO)の活性を低下させる。[292,299]。これらの知見を総合すると、食事性セレンはドーパミンのターンオーバーと代謝を調節し、統合失調症の病態に深く影響する可能性が示唆される。
最近、ベースラインの血清セレン濃度が低い21人の統合失調症患者を対象とした研究で、セレン補給の効果が強調された。患者には市販のサプリメントを介して、セレン濃縮酵母の形で1日60μgのセレンが投与された。治療3カ月後、血清セレン濃度は上昇し、患者は食欲増進と記憶力の改善を示した[300]。
2020年、Maらは、中国において、セレンを含むいくつかの必須元素と統合失調症リスクとの間に存在する潜在的関連性を調査した症例対照研究(症例99、対照99)を報告した。[291]。Liら [300]が得た結果と一致して、血清中のセレン濃度の低下は、統合失調症のリスクおよび疾患の重症度と有意に関連していた。著者らによると、セレノタンパク質による酸化ストレスの生理的抑制は、神経保護的な役割を果たしている可能性がある。[291]。さらに、ドーパミン経路におけるセレンの役割も指摘された。同じ研究で著者らは、血清セレン濃度が、グルコース代謝(空腹時血糖)、脂質代謝(トリグリセリド、総コレステロール)、肝機能(アスパラギン酸トランスアミナーゼ、アラニントランスアミナーゼ、アルブミン、総タンパク質)、腎機能(血中尿素窒素、クレアチニン、尿酸)、血球数(赤血球、白血球、血小板、ヘモグロビン)のいくつかの代謝バイオマーカーの血清レベルと正の相関があることも強調した。これらのマーカーは統合失調症患者では健常対照群と比較して有意に変化しており、統合失調症患者における大規模な代謝障害との相関の可能性を示唆している。[291]。
一方、合計1784人が参加した10の研究の2020年のレビューとメタアナリシスでは、統合失調症患者と健常対照者の血中セレン濃度が比較されている。その結果、統合失調症と血中セレン濃度との間に有意な関連は認められなかった[301]。
近年、いくつかの研究で、セレンの摂取量や血漿中濃度がうつ病 [302,303,304,305]や不安症 [306]と逆相関する可能性も示されている。この関連性は、甲状腺機能とは無関係に、甲状腺結節性甲状腺腫の患者でも示された。[306]。このような背景から、横断研究で高セレン濃度を含む「雑食」栄養パターンを投与したところ、うつ病、心理的苦痛、不安から有意に保護された。[307]。
13. 2型糖尿病
- 2 型糖尿病(2型糖尿病)は、インスリン分泌不全および/またはインスリン抵抗性を特徴とする。現在、セレンと2型糖尿病の関係は、部分的にしか解明されておらず、主に論争が続いている。初期の症例対照研究や前向き研究の中には、体内のセレン濃度が高いほど糖尿病有病率が低下し、高血糖リスクが低下するとの関連性を示したものがある。しかし、他の研究では、インスリン代謝に対するセレンの無関係な効果が示唆されている。例えば、400人の被験者が、200μg/日のセレンまたはプラセボを投与された無作為プラセボ対照試験に参加した。2.9年間の介入後、セレンはプラセボ群と比較して、インスリン感受性またはβ細胞機能(HOMA2-%βまたはHOMA2-%Sから推定)に影響を及ぼさなかった[308]。一方、さまざまなコホートにおいて、血清セレン濃度が高いことは、糖尿病有病率の増加、空腹時血糖値の上昇、またはまったく効果がないことと相関している。最初の研究の結果は、2012年にRaymanによってレビューされているため、このレビューでは対象としていない[2]。その後のシステマティック・レビューやメタアナリシス [309,310,311] では、セレンへの曝露と2型糖尿病のリスク/有病率の増加との間に一貫した正の相関が認められるという点で一致している。2型糖尿病におけるセレンの役割に焦点を当てた最近の研究の総合的な概要は、表S4に報告されている(補足資料参照)。
Dubeyらは、微量ミネラルと糖尿病の関係についての複合的な解析にセレンを含めている。著者らは、異なる研究間で一貫性のない結果を強調し、さらなる調査の必要性を主張している[312]。最新の疫学的および介入試験は、セレンの高摂取量と2型糖尿病リスクの増加との関連に注目した。[313]。
655人の被験者のコホートにおいて、血清セレン状態が肥満や2型糖尿病と相関していることが示唆されたが、これはおそらくシグナル伝達経路への影響によるものであろう。[314]。Liaoらは、US National Health and Nutrition Examination Survey (NHANES)の2903人のデータを分析し、2型糖尿病患者は健常者に比べてセレン濃度が高いことを明らかにした。特筆すべきは、リスクの関連性が特に若い女性で高かったことである。[315]。同様に、Moli-sani研究コホート(21,335人)のイタリアの成人の大規模集団では、最近、食事からのセレン摂取量の多さが糖尿病による入院リスクの増加と関連していた。[316]。私たちの考えでは、上述した一見矛盾した知見のいくつかは、ベースラインのセレン摂取量に応じて、セレノプロテイン濃度と2型糖尿病リスクとの間にU字型の関連があると考えれば説明できるかもしれない。デンマークのPRECISEコホートの60歳から74歳の491人のボランティアを対象とした最近の研究結果 [317]によって、セレンの状態とサプリメントの摂取が糖代謝にU字型に関連するという仮説が補強された。彼らは、セレン濃縮酵母またはプラセボ酵母の形で、100,200または300μgセレン/日の治療に無作為に割り付けられた。HbA1cは、ベースライン時、6カ月後、2年間のセレン補給後に測定された。試験終了時、HbA1cはすべての治療群で有意に減少していた。プラセボと比較すると、最も低用量レベルのセレン補充群(100μg/日)では、6カ月後にHbA1cのわずかな有益な変化が観察された。2型糖尿病を予防しながら、糖代謝への潜在的な悪影響を最小限に抑えるためのセレンの最適な摂取量と状態を明らかにするために、さらなる研究が必要である。[317]。
セレンとインスリン抵抗性/糖尿病との相関の根底にある生化学的メカニズムは、はっきりとは解明されていない。セレノタンパク質は、酸化ストレスの調節だけでなく、インスリンシグナルに作用してその役割を発揮する可能性がある。[309,310]。グルコースおよび脂質代謝関連疾患に対するセレノタンパク質の役割を調べるため、特定のセレノタンパク質の発現を遺伝的に変化させた動物モデルを含む多くの研究が行われてきた。
セレノタンパク質の欠乏と高レベルの両方が糖尿病の発症を促進する可能性がある。さまざまなセレノタンパク質がグルコースホメオスタシスの調節に関与しているが、そのメカニズムはまだ完全には解明されていない。SELENOTは血糖ホメオスタシスだけでなく、内分泌膵臓の構造的完全性の維持にも関与している。マウスの膵β細胞でSelTをKOすると、インスリンの合成や放出が変化するために耐糖能が低下し、ノックアウトマウスでは野生型マウスに比べて膵島の形態が変化し、サイズが小さくなった[8]。トランスジェニックマウスにおけるGPx1のノックアウトと過剰発現の両方が糖尿病を誘発する可能性がある。このセレノプロテインの適切な発現と活性は、酸化還元バランスとグルコースおよび脂質代謝を制御するために極めて重要である。GPx1が欠損すると、過剰な活性酸素が蓄積し、重要な転写因子の遺伝子発現やタンパク質産生が阻害され、膵島β細胞量の低下、インスリン合成の低下、インスリン分泌の低下を引き起こし、1型糖尿病の表現型となる。一方、ある種の組織では、インスリンシグナル伝達経路に関与するタンパク質リン酸化酵素を制御するために、生理的レベルの活性酸素が必須である。そのような組織では、GPx1の発現が生理的レベルより高くなることにより、細胞内活性酸素が制御不能に減少し、インスリンシグナル伝達が脱感作される可能性がある。
インスリンの受容体への結合は、H2O2が関与する穏やかな制御酸化バーストを誘導するカスケードを開始する。GPx1は、過酸化水素を除去することにより、この経路を阻害する可能性がある。[319]。GPx1を過剰発現させたマウスではインスリン抵抗性と高インスリン血症がみられたが、ノックアウトモデルではインスリン感受性が改善した。[318,320,321]。ヒトでは、赤血球GPx1活性の上昇に関連して妊婦ですでに観察されたインスリン抵抗性 [320]や、世界的な遺伝的セレノタンパク質欠損患者におけるインスリン感受性の亢進 [322]から確認された。
一方、過剰な酸化ストレスは、膵β細胞の正しい機能を損なう可能性があり、この場合、GPxのような抗酸化セレノ蛋白質が保護的な役割を果たす可能性がある。このように、全体的なインスリン調節には微調整が必要である。他のセレンタンパク質もグルコース代謝に関与している。[317]。
SelPは代わりに、膵β細胞におけるインスリン合成の正の調節因子であるアデノシン一リン酸活性化プロテインキナーゼ(AMPK)を不活性化することによって、インスリンシグナルを阻害する。[1]。臨床研究では、SelP濃度が高いほど、インスリン抵抗性や2型糖尿病、糖化A1Cヘモグロビン、空腹時血糖と関連することが示されている。[323]。
この文脈において、精製ヒトセレノプロテインPを腹腔内注射したC57BL/6Jマウスは、耐糖能異常とインスリン抵抗性を示した。この研究結果は、セレノプロテインPが肝臓と骨格筋におけるインスリンシグナル伝達を障害し、生体内試験で耐糖能を誘導することを示唆している[324]。上記[323]のように、血清SelPレベルも健常人と比較して2型糖尿病患者で上昇していることを考慮すると、この研究は、分泌タンパク質SelPがインスリン抵抗性関連疾患の治療のための新たな治療戦略を開発するための標的となり得ることを示唆している。
14. セレン関連健康のためのジェンダー医学的アプローチ?
セレノタンパク質をコードする25のヒト遺伝子のうち、Y染色体またはX染色体上に存在するものはないが、女性と男性ではセレン代謝のいくつかの面で違いがある。セレンタンパク質とセレン結合タンパク質の活性は、どちらも性特異的に制御されている。SelPとApoER2は男性の精巣に多く発現しているが、女性の卵巣と子宮にはほとんど存在しないか、存在しない。この顕著な差は、男性と女性におけるセレンの保持と利用の差に重要かもしれない。現在のところ、入手可能な一般的データでは、男性の方がセレン供給量の急性変化に対する反応性が高く、より速い速度論と強い振幅で反応することが強調されている。また、過剰なセレン摂取から生じる毒性に対しても、男性の方が敏感であるようだ。[325]。これらの理由から、観察研究と介入研究の結果を分析する際には、ベースラインのセレン状態や参照集団とともに、性的二型を常に考慮すべきである。
例えば、がんリスクに関しては、最初の研究ですでに、予防効果が男女で異なり、特に肺がん、大腸がん、胃がんについては男性でより顕著であることが示されている。[326,327,328,329]。さらに最近では、膀胱がんについても異なる相関が認められ、そのリスクは、女性では体内のセレン濃度と逆相関するが、男性ではそうではないようである[325,330,331]。大腸がんに関しては、セレン補給による男性または女性の最善の保護について、異なる研究が正反対の結論を示している。[332,333]。さらに、敗血症における不妊症と死亡率は、主に女性よりも男性で観察されると主張されてきた。実際、男性の生殖系は女性よりもセレンに厳密に依存しており、敗血症患者へのセレン補充に関する試験では、女性の割合が少なかった。
甲状腺炎、特に橋本甲状腺炎(HT)におけるセレン依存性の健康影響は、甲状腺容積、甲状腺腫、甲状腺結節とセレンの状態との関連と同様に、女性でのみ報告されている[334,335,336,337]。心血管疾患については、現在のところ相反する結果となっている。いくつかの研究では、特に男性において、心臓と冠動脈の健康に対するセレンの補給の有益性が証明されているが、主要な副作用(すなわち、糖尿病リスクの増加)も男性特有のようだ。他の研究者は、女性においてより肯定的な効果を見出したり、性差を認めなかったりしている。これらのことから、セレン代謝とセレンの健康効果は、女性と男性で異なる可能性があり、男女間で一般化すべきではない。[27,146,325,338]。
ここでは、セレン代謝、セレンタンパク質の発現、健康と疾患に対する医学的セレン効果に関して、男性と女性ではかなり異なるが、ほとんどの場合、ジェンダーを差別要因として考慮しなかった最近の結果をレビューした。セレンタンパク質発現の制御は、組織特異的、年齢関連的であるだけでなく、性特異的でもあるようだ。[27]。異なる組織におけるセレンタンパク質のmRNAとセレンタンパク質のレベルは、主に翻訳的側面の制御によって制御される、セレンの状態に応じて特異的な発現パターンを持つ男女間で変化する[339,340]。さらに、動物モデルを用いた多くの研究により、性ホルモンはセレン代謝とセレンタンパク質の制御にも影響を及ぼすことが強調されている。[341]。したがって、セレンの栄養状態、健康状態または疾患状態と、男性または女性のジェンダーとの関係を解明することを目的とした今後の研究では、「ジェンダー医学」[342,343]の概念を考慮した革新的なアプローチも考慮すべきである。
15. 結論
セレンは、多くの生物学的に必須な機能に関与する重要な微量元素である。主に食事(サプリメントを含む)から摂取され、セレノシステインの形でセレノタンパク質に取り込まれる。セレノシステインのセレノール部分のユニークな特徴により、セレノプロテインは硫黄化類似体に対して、多種多様な異なる生物学的機能を達成することができる。セレノタンパク質は、ホルモンの生合成から酸化ストレスの調節まで、実に様々なプロセスに関与している。セレノタンパク質を介した生化学的メカニズムは、がん、糖尿病、ウイルス感染(SARS-CoV-2やHIVを含む)、精神・神経疾患など、数多くの重要な疾患の予防、発症、臨床転帰においても中心的な役割を果たしている。
このような病態の予防と調節におけるセレンの役割を明らかにするために、いくつかの研究が行われてきた。ここでは、主に過去10年間の研究に焦点を当てて、これらの研究をレビューした。報告されたデータによると、体内のセレン状態と上記の病態の良好な予後との間には、一般的に正の関係が観察されている。さらに、(食事やサプリメントからの)セレンの十分な摂取は、特に甲状腺機能、生殖能力、骨格の健康、炎症性疾患、いくつかの精神障害に関連する様々な疾患の予防に大きく関わっている。また、ベースラインの血清セレン状態が最適であることは、重症のCOVID-19を発症するリスクが高い患者にとって好ましい予後因子であることが示唆されている。また、予備的な補充試験によって、セレンは私たちが現在も直面しているSARS-CoV-2パンデミックに対する治療戦略となりうることが示された。セレン含有低分子化合物であるエブセレンは、顕著なMpro阻害作用を示した。
ハウスキーピング・セレンタンパク質とストレス関連セレンタンパク質の両方が、上記の状態に関与しており、それらの発現は、人体のさまざまな細胞やシステムにおけるセレン濃度に応じて細かく調節されている。したがって、セレノタンパク質の生物学的機能(すなわち、抗酸化機能と免疫機能)を適切にサポートするには、体内のセレン濃度を適切に維持することが不可欠である。とはいえ、血漿中のセレン濃度が一定以上であれば、セレンを補う必要はない。
動物モデルにおける遺伝子操作によって達成されるいくつかのセレノタンパク質の過剰発現は、その機能のメカニズムを研究するための有用なツールである。しかし、上述したように、通常の生理学的レベルよりも高いセレン酵素の発現は、栄養レベル以上のセレンを慢性的に摂取した結果として、身体のいくつかの領域で起こる可能性があり、否定的な結果をもたらす。ベースラインですでに最適な状態にある患者におけるセレンへの栄養を超えた曝露と、いくつかの病態を発症するリスクの増加との間の潜在的な関連性が示唆されている。例えば、いくつかのがん、T2糖尿病、アルツハイマー病、パーキンソン病、心血管疾患でも、同様の挙動が観察されている。
短期間、あるいはベースライン時にセレンが著しく不足している場合、あるいは病態によって抗酸化物質が大量に枯渇し、病気の経過を悪化させるような患者には、栄養レベル以上のセレンの補充が有効である。例えば、いくつかの炎症性疾患や感染性疾患では、このようなことが示唆されている。
このような考察から、セレンの状態と病気の発症との関係はU字型であると考えられる。超栄養摂取に由来する循環セレン濃度が過剰になると、SEBP1を介したH2O2の過剰産生が起こり、ミトコンドリア反応が阻害され、その結果、細胞のアポトーシスが起こる可能性がある。[13,19]。一方、体内のセレン含量が高いと、組織特異的なセレノタンパク質の発現が調節されなくなり、抗酸化酵素のレベルが生理的なものよりも高くなる可能性がある。このようにして、活性酸素-特にH2O2-の「過剰消光」が起こり、活性酸素に依存するいくつかの極めて重要な細胞内シグナル伝達経路、例えばインスリン分泌が阻害されるという直接的な結果をもたらすかもしれない。[321,344,345,346]。過酸化水素とスーパーオキシドは、細胞内シグナル伝達経路にとって重要な化学種である。これらは、NADPHオキシダーゼやミトコンドリア電子輸送連鎖複合体を含む40以上の酵素によって、制御されたメカニズムで産生される。生理的レベル(ナノモル濃度範囲)では、H2O2は代謝調節とストレスに対する細胞適応に関与する。一酸化窒素や硫化水素などの他の活性種と同様の働きをする。酸化還元シグナル伝達に不可欠な生理的酸化状態は、まさに酸化的ストレスと呼ばれている。タンパク質の特異的酸化、反応パターンの変化、生体分子の損傷につながる活性種の超生理学的濃度(すなわち、およそ100nM以上のH2O2)は、酸化的苦痛と呼ばれる状態を示す。セレノタンパク質は、酸化還元ホメオスタシスの維持にも重要に関わっている。[347]。
セレン欠乏は、GPXやTRxRを含むがこれらに限定されない、特にセレン摂取により厳密に依存するセレノタンパク質の一般的な合成の減少に対応することができる。このことは、体内の酸化ストレスの増大とその結果(炎症や酸化還元ホメオスタシスの変化など)だけでなく、タンパク質の折り畳みと分解の誤り、タンパク質機能の低下、厳密にセレンに依存する組織へのセレン輸送の障害、カルシウムシグナル伝達経路での相互作用などにも対応し、健康状態や疾病に関連した深刻な結果をもたらす。
セレン摂取量が少ないと、セレン濃度はGPxとSelPの最適発現レベルを下回る。これらのセレンタンパク質の発現は、食事からのセレン摂取量に依存すると報告されている。いくつかの研究では、セレンの補給(栄養レベル以上)がセレン濃度レベルを高めるのに有効であると報告している。サプリメントで達成される血清セレン濃度は、セレノタンパク質の最大化/飽和発現につながるであろう[118,138]。セレノタンパク質の発現増強における高セレン食レベル(またはセレンサプリメント)の役割は、文献によく記載されている[135,187]。他のいくつかの研究では、セレン補給が、そして一般的に、高セレン摂取(60-80 µg/日を超える)が、いくつかのセレノタンパク質の最大レベルでのアップレギュレーションにどのように関係しているかについて記述している。セレン補給によって誘発されるセレンタンパク質のアップレギュレーションは、元素の栄養欠乏の逆転、またはセレンの酸化促進作用に対する代償反応のいずれかに起因するプロセスを通じて起こる可能性があり、両方のメカニズムが作用する可能性がある[316]。セレンは、それ自体で、あるいはセレンタンパク質の過剰発現を通じて、糖尿病発症に潜在的な悪影響を及ぼす可能性がある[309,314,316]。慢性疾患の発症に対するセレノタンパク質の潜在的な有害作用は、遺伝子操作 [34,318,320,321,344]または精製ヒトセレノプロテインPの注射 [324]によってセレノタンパク質レベルが増加した動物モデルを含む研究でも実証されている。
このような背景から、最適なレベルのセレノプロテインを確保することは、酸化還元ホメオスタシスの維持に重要な役割を果たしている。Jablonska and Vinceti [34]によると、基本的な生物学的証拠は、セレノタンパク質の最適な活性/発現の正確な意味を定義すべきである。したがって、セレノタンパク質の活性/発現が、セレン補給によって増加し、最大でないという理由だけで、最適でないと正しく定義できるかどうかを評価することが重要である。GPxとSelPのレベルを最大化するためにセレンを補充するアプローチは、批判的に分析・評価されるべきである。このようなアプローチは、これらのセレノタンパク質のレベルが最大値を下回ると、セレン欠乏症に関連し、ヒトの健康保護に不適切な可能性があるという仮説に依存している。
栄養効果に加え、セレンが誘発する酸化還元反応セレンタンパク質のアップレギュレーションは、セレンの抗酸化活性の結果である可能性もある。したがって、酸化ストレッサーの存在下で適応的な代償反応を引き起こす能力を提供するためには、セレノプロテインは通常の条件下で最大化すべきではない。一方、実験室での研究から、セレンが誘導するセレノプロテイン活性は、少なくとも部分的には、セレン過剰に対する適応反応であり、その毒性に対する適応反応である可能性が示唆されている。
しかし、セレノタンパク質は、わずかに栄養量を超えたセレンによる治療の効果の一部を説明するかもしれないが、栄養量を超えた高用量のセレンサプリメントが使用される場合には、セレンのプロオキシダント特性に関連する他のメカニズムも合理的に起こる。このようなメカニズムは、新たな治療手段の開発にも利用できる。
これらの点をすべて解明し、定量的なパラメーターを提供するためには、さらなる研究が必要である。セレンが健康に及ぼす影響については、男女で異なる結果がしばしば報告されている。このため、今後の研究では、実験デザインとデータ分析の両方で性差を考慮すべきである。
これらすべての考察に基づき、すべてのセレンタンパク質の生物学的機能を深く理解し、サプリメントや医薬品候補としてセレンを含む低分子を開発することは、セレン化学、生化学、生物学の分野における今後のさらなる課題である。
