コンテンツ
COVID-19 mRNA Vaccines: Lessons Learned from the Registrational Trials and Global Vaccination Campaign

M. ナサニエル・ミード– ステファニー・セネフ–ラス・ウォルフィンガー–ジェシカ・ローズ–クリス・デンヘリンク–スティーブ・キルシュ–ピーター・A・マッカロー
発行:2024年1月24日
DOI:10.7759/cureus.52876
査読付き
引用者:Mead M, Seneff S, Wolfinger R, et al. (January 24, 2024) COVID-19 mRNA Vaccines:登録試験と世界的なワクチン接種キャンペーンから得られた教訓。Cureus 16(1): e52876.
要旨
COVID-19ワクチン接種とその健康および死亡率への影響に関する私たちの理解は、最初のワクチン展開以来大きく発展してきた。当初のランダム化第3相試験の報告書は、COVID-19 mRNAワクチンがCOVID-19症状を大幅に軽減できると結論付けている。その間に、これらの重要な臨床試験の方法、実施、報告に問題が生じた。ファイザー社の試験データの再解析により、ワクチン群における重篤な有害事象(SAE)の統計学的に有意な増加が確認された。緊急時使用許可(EUA)後も、死亡、がん、心疾患、さまざまな自己免疫疾患、血液疾患、生殖器疾患、神経疾患など、多数のSAEが確認された。さらに、これらの製品は、以前に確立された科学的基準に従って、適切な安全性および毒性学的試験を受けたことがなかった。このナラティブ・レビューで扱われている他の主要なトピックの中には、ヒトに対する重大な危害の公表された分析、品質管理上の問題点および製法に関連した不純物、有害事象(AE)の根底にあるメカニズム、ワクチン無効性の免疫学的根拠、および登録試験データに基づく死亡率の傾向に関するものがある。現在までのエビデンスによって立証されたリスクとベネフィットのアンバランスは、さらなるブースター注射を禁忌とし、適切な安全性と毒性学的研究が実施されるまで、少なくともmRNAワクチンを小児期の予防接種プログラムから除外すべきことを示唆している。連邦政府機関によるCOVID-19 mRNAワクチンの集団包括的な承認は、関連するすべての登録データの誠実な評価と、リスク対ベネフィットの適切な検討による裏付けがなかった。広範囲に及ぶ、十分に文書化されたSAEと、許容できないほど高い危険対効果比を考慮すると、私たちは各国政府に対し、因果関係、残存DNA、異常タンパク質産生に関連するすべての関連質問に回答が出るまで、改変mRNA製剤の世界的モラトリアムを支持するよう強く求める。
序論と背景
新型コロナウイルス感染症(COVID-19)mRNAワクチン接種と死亡率への影響に関する私たちの理解は、2020年12月の最初のワクチン展開以来、大きく発展してきた。初期の調査では、これらの生物学的製剤が重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)感染を予防する可能性が示された。Pfizer-BioNTech社(米国ニューヨーク州、ドイツ・マインツ市)とモデルナ社(米国マサチューセッツ州)がスポンサーとなった最初のランダム化比較試験に基づき、研究者らは、症候性COVID-19の95%相対リスク(RR)減少が注目に値すると結論づけた[1,2]。この2つの試験で得られた知見が重複していたことから、米国食品医薬品局(FDA)は2020年12月11日、緊急使用許可(EUA)のもとでCOVID-19 mRNAワクチンの使用を許可し、その後、早期の盲検化解除と試験の中止が決定された[3]。
この記録は、1967年にメルク社(米国ニュージャージー州)が世界初のおたふくかぜワクチンを開発した際に樹立したものである[4]。ファイザーのワクチン(BNT162b2)は7カ月で完了した。これまでの第3相臨床試験の期間は平均10年であった[5]。保健省は、ワクチンの安全性評価には10~15年が通常のタイムフレームであると述べている[6]。COVID-19ワクチンでは、FDAが通常従う数多くの安全性試験と毒性学プロトコルが回避されたため、以前に確立された科学的基準に見合った方法で安全性が評価されることはなかった[7,8]。mRNA製剤の生体内分布や反復投与による潜在的毒性(複数回のワクチン接種を模倣するため)の前臨床研究は、加速された臨床試験を可能にするために回避された[9]。おそらく迅速承認プロセスによって回避された最も重要な臨床試験基準は、ワクチン対プラセボ群における可能性のある長期的なワクチン関連副作用(AE)を同定するために通常推奨される最低6~12カ月の観察期間であった[9]。
ワクチンの臨床評価には、がんや自己免疫疾患などのAEの発現をモニタリングするための十分な時間を確保するために、10~15年という既定の時間枠が必要であると考えられた[10,11]。迅速性を期すため、ファイザー社とモデルナ社の治験コーディネーターは、重篤なAEや死亡率の懸念よりも、COVID-19の症候性リスク軽減を優先した。振り返ってみると、これは重大な失策であった。歴史的な証言によれば、莫大なプレッシャーのもとでワクチンが早々と市場に投入されたにもかかわらず、後日、障害を引き起こす、あるいは致命的な有害事象が明らかになった例がある。例えば、1955年のポリオワクチンの汚染、1976年のインフルエンザワクチン接種者に観察されたギラン・バレー症候群の例 2009年のナルコレプシーと特定のインフルエンザワクチンとの関連などがある[12-14]。このような背景から、COVID-19 mRNAワクチンが通常の安全性試験プロセスを回避したことについて、多くの医学・公衆衛生の専門家が懸念を表明したことは驚くべきことではない。
政治的・金銭的インセンティブが、EUAに至る科学的評価プロセスを弱体化させる上で重要な役割を果たした可能性がある。Lalaniたちは、米国政府が認可のかなり前に行った大規模な投資を記録している[18]。パンデミック以前から、米国国立衛生研究所はmRNAワクチン技術に1億1600万ドル(35%)を投資し、Biomedical Advanced Research and Development Authority(BARDA)は1億4800万ドル(44%)を投資し、国防総省(DOD)はmRNAワクチン開発に7200万ドル(21%)を拠出していた。BARDAと国防総省は、モデルナのmRNAワクチンの共同開発においても緊密に協力し、180億ドル以上を拠出した。これには、臨床試験やモデルナ社の製造能力拡大のための直接的な財政支援とともに、何億回分ものmRNAワクチンの事前購入が含まれていた。「ワープ・スピード作戦」を通じてこれらの製品の開発に提供された公的資金は、過去のどの公的イニシアティブの投資も上回るものであった[19]。パンデミックが始まると、292億ドル(その92%は米国の公的資金による)がCOVID-19 mRNA製品の購入に充てられ、さらに22億ドル(7%)が臨床試験の支援に回され、1億800万ドル(1%未満)が製造と基礎研究に割り当てられた[18]。このように税金が大量に使われることは、パンデミックの間ずっと続いた:BARDAは2021年だけでさらに400億ドルを費やした。
これほど多くの投与量を事前に購入するために米国の税金を使うということは、EUAプロセスの前に、米国連邦機関が登録試験の成功に強く偏っていたことを示唆している。さらに、このような広範な既得権益が、登録試験を早期に中止する決定に影響を与えたと推測するのは妥当である。盲検化解除は、試験の「プラセボ対照」要素を実質的に無効化し、対照群を排除することで、mRNAワクチンの安全性プロファイルや潜在的な重篤事象(SAE)を客観的に評価する能力を損なうものだった。このように、早期承認は、こうした新規製品の提供に対する政府の献身的な姿勢を示す一方で、リスク・ベネフィットの問題に関して多くの専門家に懸念を抱かせ、mRNA接種の潜在的な長期的有害性を知る機会を事実上なくしてしまった。解決策を迅速に提供しなければならないという政治的圧力が、科学的評価プロセスの徹底性と完全性を損なう一方で、mRNA技術に関連する潜在的リスクに関する科学的懸念を軽視し、難解にした可能性がある。
不十分な安全性試験に関する懸念は、通常の規制当局の承認基準や慣行を超えて広がっている。本稿では「ワクチン」および「ワクチン接種」という用語を使用するが、COVID-19 mRNA産物は正確には遺伝子治療産物(GTP)とも呼ばれる。欧州の規制では、ワクチンに抗原を含めることが義務付けられているが、これらの免疫原性タンパク質はmRNAワクチンに内在するものではない。GTPワクチンプラットフォームは、実験的がん治療として30年以上研究されており、遺伝子治療とmRNAワクチン接種という用語はしばしば同じ意味で使われている。これは、mRNA産物の特異的な作用機序によるものである。合成mRNA鎖は、保護的な脂質ナノ粒子(LNP)ビヒクルに封入され、細胞内で特定のタンパク質に翻訳され、その後、特定の疾患に対する免疫系を刺激する。もう一つの正確なラベルはプロドラッグであろう。なぜなら、これらの製品は、標的タンパク質を製造するためにレシピエントの体を刺激するからである[24]。迅速な承認プロセスの時点では特別な規制がなかったため、規制当局はすぐに製品を「適合」させ、「ワクチン」の定義を一般化して製品に対応させ、ウイルス性疾患に対して初めてEUAを承認した。しかし、これらの製品をワクチンとして規制し、GTPとして規制監督から除外する根拠は、科学的にも倫理的にも正当性を欠いている[21]。(注:このレビューを通して、ワクチンや予防接種という用語は、注射、接種、生物学的製剤、または単に製剤と同じ意味で使用する)
GTPはワクチンとして再分類されているため、その構成成分の安全性はまだ十分に評価されていない。主な懸念は、一言で言えば、COVID-19 mRNA産物が体細胞を、オフスイッチのない(すなわち、そのような増殖を停止または調節する内蔵のメカニズムのない)ウイルスタンパク質工場に変えてしまう可能性があり、スパイクプロテイン(Sタンパク質)が長期間生成され、慢性的な全身性の炎症と免疫機能障害を引き起こすことである[25,26]。このSタンパク質は、コロナウイルスとワクチンの共通項であり、感染と接種の両方によって生じるAEが頻繁に重複することの説明に役立つ[25]。ワクチンによって誘導されるSタンパク質は、そのウイルス性蛋白質よりも免疫原性が高いが、抗体産生の増加は、より重篤な免疫病理やその他の副作用とも関連している。ファイザーとモデルナのmRNA製品には、2つの修飾コドンを持つmRNAが含まれており、その結果、S-タンパク質は前駆状態で安定化される。このヌクレオシドで修飾されたメッセンジャーRNA技術は、合成mRNAの体内での持続性を延長することを目的としている。Sタンパク質が血流にのって全身に拡散すると、感受性の高い人において多様なAEの一因となる可能性がある[25]。
このナラティブレビューでは、登録された臨床試験を再検討し、これらの臨床試験やその他の関連試験から得られたAEの解析をレビューする。過去数年間、ワクチン企業によって設定された一般的なシナリオに異議を唱えた医療専門家や研究科学者に対する広範な検閲が行われたため、ほとんどの暴露はごく最近になって明るみに出たものである[29,30]。まず、EUAをもたらした2つの無作為化二重盲検プラセボ対照試験に焦点を当て、その後、オリジナルの試験を頻繁に参照しながら、mRNA接種の様々な有害な影響について深く掘り下げていく。パンデミック後の緊急事態が一段落した状況では、このような探索的なナラティブ・レビューは、COVID-19 mRNAワクチン接種に関する一般大衆の十分な根拠のある安全性への懸念の科学的根拠を再評価する上で重要な役割を果たすことができる。
レビュー
登録試験の再検討
パンデミックの初期に、米国の公衆衛生当局は、第3相試験でCOVID-19 mRNAワクチンが「安全かつ有効」であることを証明すると約束した。ワクチン製造業者9社は、規制当局の審査を早急に求めないことを誓約する前例のない共同声明を発表した[32]。この2つの確約は、すでにパンデミック疲れに苦しんでいる人々に伝えられたものであり、その多くは、ワクチン接種プログラムの開始を担当した同じ機関が課した、封鎖、マスク着用、社会的距離の取り方、その他の制限に起因するものであった。美辞麗句とは裏腹に、SARS-CoV-2の感染、入院、死亡の減少を証明した大規模な無作為二重盲検プラセボ対照試験はない。
重要なことは、EUAにつながった重要な臨床試験のデザインは、mRNA接種が重症化や早死を予防できるかどうかを決定することを意図したものではなかったということである[31]。これは主に、これらの結果を評価するための統計的検出力が不十分であったためである[33]。(検出力の計算は、主要アウトカムであるCOVID-19症状の軽減のみに基づいていた)。この限界は、18~55歳の若く健康な試験参加者を採用したことと、介入群で報告された臨床感染症例数が比較的少なく、ファイザーでは8例、モデルナでは11例のみであったことに起因する[1,2]。ファイザー社の試験では重症のCOVID-19が1例しか報告されていないのに対し、モデルナ社の試験では1例も報告されておらず、同社は重症化に対する100%の有効性を宣言している[34]。モデルナはまた、プラセボ群におけるCOVID-19による死亡を1例報告している[2]。このように、2つの試験の間で、73,000人以上の試験参加者のうちCOVID-19に起因する死亡は1人だけであった[1,2]。
試験結果の発表後、ファイザー社は試験を4カ月延長した。試験参加者は20週目までに盲検化が解除され、プラセボ・ボランティアがmRNAワクチン接種を受けることになった。ファイザー社が発表したmRNA製剤の有効性は、22,000人のプラセボ接種者のうち162人がCOVID-19に罹患したことに基づいており、これに対してワクチン接種者は22,000人中わずか8人であった。COVID-19に罹患した162人のプラセボ患者のうち、この病気で死亡した者は一人もいなかった[35]。COVID-19の罹患率と死亡率に関して意味のある、実際的な、あるいは広範な結論を出すには、この数字は少なすぎる[36]。
さらに、170例のポリメラーゼ連鎖反応(PCR)で確認された症例数は、別の知見から注意をそらしている:試験中に確認された症例のはるかに多くが、「COVID-19の疑い」というカテゴリーに分類され、そこでは、症候性COVID-19を示したが、PCR検査が陽性ではなかったのである[37]。(注:これらの試験で使用されたPCR検査は、SARS-CoV-2を検出するために広く受け入れられているものであり、コロナウイルスを正確に検出するための性能と信頼性の一定の基準を満たしている。)合計3,410例のCOVID-19疑い未確認症例が同定され、疑い例と確定例の間には20倍の差があった。このような症例はワクチン接種群で1,594例、プラセボ群で1,816例であった。確定症例と疑い症例の両方を考慮すると、症状発現に対するワクチンの有効性はわずか19%に低下し、規制当局の認可に必要なRR減少基準値50%をはるかに下回る[37]。短期間のワクチン反応原性(真の感染ではなく)を考慮し、ワクチン接種後7日以内に発症した症例を除外しても、有効性はわずか29%である。疑われる症例の中に偽陰性があれば、有効性はさらに低下する傾向にある。このように、確定例と疑い例の両方を考慮すると、ワクチンの有効性は公式発表の95%よりも劇的に低かったようだ。
同様に、試験でカウントされた「症例」は、中等症から重症の感染症ではなく、軽度の感染症のPCR陽性患者であったことを強調することが重要である。したがって、咳やその他の軽度の呼吸器症状は主要評価項目として適格であった[38,39]。この試験の結論は、プラセボ群で記録されたこのようなCOVID-19の「症例」がわずか100例であったことに基づいている[31]。試験がこの時点に達すれば、有効性が宣言され、プラセボ群の参加者に有効なワクチンが提供されると予想されていた。ファイザー社の盲検化段階は2カ月で終了し、モデルナ社の盲検化段階は3カ月で終了し、盲検ランダム化追跡期間は事実上終了し、リスク・ベネフィット評価は大幅に制限された。
試験で重症化を評価する能力がなかったことは、実世界の状況、すなわちCOVID-19の重症化、入院、感染による死亡の可能性が常に非常に低いことを反映している。年齢で層別化すると、2021年の感染致死率(IFR)は年齢勾配を示し、10年ごとに約3~4倍に増加し、小児と青年では0.0003%(ほぼゼロ)と低く始まり、60~69歳では0.5%に増加した[40]。高齢者(70歳以上)においても、IFRは併存疾患や治療法によって1~5%の幅がある。基本原則として、全死因死亡率(ACM)は年齢とともに増加する傾向がある。COVID-19の場合、併存疾患の存在は死亡率に対する年齢の影響を大きく修正する[41]。若い世代(40歳未満)では、2020年以降のSARS-CoV-2感染の重症度と致死率は、インフルエンザと同程度である。2020年に死亡率超過を示した国でさえ、小児の死亡率は極めて低かった。2020年に180万人の子どもたちが自由に登校できるようになったスウェーデンでは、2021年夏までに子どもたちのCOVID-19による死亡はゼロであった。
ランダム化比較試験は、(バイアスを最小化するため)医薬品の安全性と有効性を検証するためのゴールドスタンダードと考えられているが、限られた範囲の試験では、さまざまな層の人々に関する真の安全性と有効性の問題が容易に不明瞭になる可能性がある。この場合、試験は主要なサブグループ、特に小児、妊婦、虚弱高齢者、免疫不全者、さらにがん、自己免疫疾患、その他の慢性炎症状態の患者を除外した[45]。設立時の臨床試験では合併症のある患者はリクルートされなかったが、展開時のワクチン接種者ではこれらの基礎疾患が実際に存在した。このようなよく知られた安全性や合併症リスクの懸念を評価するよりも、COVID-19患者や、その何年も前にSARS-CoVに感染した免疫動物モデルで見られたような、炎症性肺障害の可能性に焦点が絞られた[46]。COVID-19ワクチンに関連した重篤で生命を脅かす事象が何百万件も医学文献に記録され続けていることから、私たちは今、このような狭い安全性の焦点の愚かさを認識し始めている[47-51]。
全死亡率(全死因死亡率)について、重要な試験は何を明らかにしたのだろうか?ファイザーとモデルナのACMを注意深く分析した結果、Bennらは合計61人の死亡(ワクチン31人、プラセボ30人)を認め、ワクチン接種者とプラセボを比較した死亡率RRは1.03(0.63-1.71)であった[52]。これらの所見は、「有意差なし」またはこれらのmRNAワクチンが死亡率を減少させることを示す金本位的な証拠はないと解釈できる。試験群間で死亡率に有意差がないことは注目に値する。このような状況では、真の死亡率への影響は未知のままであり、この事実だけでも意味がある。というのも、死亡率減少の良好な臨床試験エビデンスがあるワクチンを接種する方が、生存率改善の説得力のあるエビデンスがないワクチンを接種するよりも望ましいからである[53]。同様に、ファイザー社の試験データのその後の分析では、無作為化試験の最初の20週間の期間中、死亡率はワクチン接種群とプラセボ群の間で同等であったと結論している[54]。mRNAワクチン接種が総死亡率の減少につながらなかったという事実は、注射が本当にCOVID-19に特異的に起因する死亡を回避していたとしても、そのような減少はSAEのような他の原因に起因する死亡率の増加によって相殺される可能性があることを示唆している。
ファイザーの6カ月間の試験でさえ、全死因死亡率の減少を示すことはできなかった[35]。実際、FDAに提出された市販後データの再分析では、逆の効果が示唆されている。この試験の延長部分には4カ月間の非盲検期間があり、ほとんどのプラセボ参加者がワクチン接種群に移行した。この段階で、当初のワクチン群の3例とワクチン接種を選択したプラセボ群の2例を含む5例の死亡例が追加された[35]。これらの5人の死亡を「ワクチン接種を受けた」死亡として含めると、総死亡数はワクチン群で20人、プラセボ群で14人となり、死亡数が43%増加したことになる(数が少ないため統計的に有意ではない)。しかし、FDAの文書では、合計38人の死亡が報告され、ワクチン群で21人、プラセボ群で17人であり、BNT162b2の一次シリーズ2回投与を受けた人の全死因死亡が23.5%増加したことになる[55,56]。このことは、mRNAワクチン接種後に死亡した2人のプラセボ参加者が2回カウントされたことを示唆している(すなわち、両方の死亡が試験の各群でカウントされた)。しかし、5人の余分な死亡を適切に考慮するには、各群で過ごした人月に基づいて解析を調整すべきである。この方法を適用すると、総死亡数はBNT162b2群で21例、プラセボ群で16例の計36例となった。相対ACMリスクを計算すると、ワクチン群の死亡率は0.105%(20,030人中21人死亡)、プラセボ群の死亡率は0.0799%(20,030人中16人死亡)であった。RR式は1.3125(95%CI 0.6851-2.5144、p=0.41)という値を示し、プラセボ群と比較してBNT162b2群のACMリスクが31%高いことを示した。この推定値は保守的であると考えられるが、これはプラセボ群全員が非盲検試験期間中にワクチン接種を選択したことを想定していないためだ。
ファイザーとモデルナの登録試験についても、Bennらは、ワクチン群における心血管死(RR=1.45; 95%CI 0.67-3.13)の有意ではない45%の増加を報告している[52]。この結果は、若年層と高齢層の両方におけるCOVID-19ワクチンに関連した心血管系の病理に関する多くの報告と一致していた[57-63]。試験から得られた死亡率の推定値はいずれも統計的に有意ではなかった。それにもかかわらず、ACMと心血管系死亡の両方が増加傾向にあることは問題である。もしファイザー社の試験が早期に中止されなかったとすれば、そして死亡率が最初の6カ月で観察されたように両群で同じであると仮定すれば、ACMの差は約2.8年(34カ月)で統計的有意性の標準的な閾値(p<0.05)に達するであろう。p値は2.5年で0.065,2.75年で0.053である(付録1参照)。これらの計算は、Masterjohn[64]によって独自に確認された。
絶対リスクと「接種必要数(NNV)」
登録試験の欠点としてしばしば見落とされがちなのは、最終報告書がRRにのみ焦点を当て、絶対的リスク減少を省略していることである。後者の指標は、サンプルサイズによってスケーリングされるため、前者の相対的指標よりも薬剤の臨床的有用性をよりよく示すものである[65]。RRはワクチン群とプラセボ群におけるCOVID-19の症状発現率の比であり、ファイザー社の製品であるBNT162b2とモデルナ社の製品であるmRNA-1273ではそれぞれ95%と94.5%と報告されている[1,2]。絶対リスクとは、ある結果(この場合、臨床的な感染症状)が起こる確率のことで、母集団全体に対するその結果を経験した人の数に基づく。これは通常、調査集団で発生した事象の数をその集団の人数で割ったものとして計算される。報告バイアスを回避し、ワクチンの有効性についてより包括的な視点を提供するためには、両方のタイプのリスク推定が必要である[65]。絶対リスク統計の省略は、ワクチンの臨床的有益性の過大評価につながる[66]。95%RRの数値とは対照的に、BNT162b2とmRNA-1273の絶対リスク減少率は、それぞれ0.7%と1.1%であった[67]。これらの推定値は、最終的にFDAのVaccines and Related Biological Products Advisory Committee(VRBPAC)によるEUAの承認を可能にした、一般に入手可能なデータから導き出されたものである[68]。しかし、VRBPACが検討したデータには絶対的リスク低減指標が含まれていなかったため、医薬品の誤った使用を避けるためには両方のアプローチが重要であるとするFDAのガイドラインから逸脱していた[69]。ここでも、絶対リスクを示さず、代わりにRRのみに固執することは、一般的にワクチンの有益性を過大評価する結果となる。絶対リスク統計は、AE 率などの安全性指標を評価・比較する際にも有用である。
COVID-19のmRNAワクチン接種による絶対リスク減少が約1%であることは、COVID-19の軽度から中等度の症例を1例予防するためには、相当数の人に注射する必要があることを意味する。具体的には、COVID-19の1症例を予防するためのNNVは、BNT162b2注射では142人(範囲122-170)、mRNA-1273注射では88人(範囲76-104)となる[65]。これらの数値は年齢とともに、また変異型によって増加する[70]。NNVは、実世界の影響を評価するための解釈可能で顕著な指標であり、ワクチン接種から得られる潜在的な利益を評価することを可能にする。比較的健康な集団(合併症が少ない)であれば、NNVが高いリスク・ベネフィット・プロファイルは容易に過剰な害を指摘することができる。
COVID-19 mRNA製剤に関連するすべての潜在的リスクを慎重に検討することが不可欠である。万が一、COVID-19 mRNA製剤の使用に関連した重大な害が発生した場合、NNVによってもたらされる「報酬」の再評価が必要となる。例えば、NNVを119、IFRを0.23%(いずれも保守的な推定値)と仮定すると、COVID-19に関連した死亡を1人予防するためには、約52,000回のワクチン接種が必要となる。したがって、BNT162b2注射剤については、寛大に見積もっても10万コースの生物学的製剤ごとに2人の命がCOVID-19から救われることになる。臨床試験の不正行為とデータ整合性の問題の証拠(次のセクションを参照)を考慮すると、この推定値は「上限」であり、したがって真の利益はもっと低い可能性が高い。潜在的な有害性については、30%の偽陽性報告と中程度の過少報告係数21を仮定すると、BNT162b2の10万回投与あたり27人の死亡リスクが計算される。従って、これらの合理的で保守的な仮定を適用すると、COVID-19 mRNAワクチンの推定される害は、利益を大きく上回る。
被害の過小報告とデータの完全性の問題
SAEを含む重篤な有害事象の過少報告は、もう一つの重要な懸念事項だが、一般にはあまり注目されないことが多い。特に、日常生活や生活の質を著しく損なう重篤な有害事象は、ランダム化試験、特に企業がスポンサーとなった試験において、普遍的に過小報告されている[71]。このような有害事象は、SARS-CoV-2に感染したmRNAワクチン接種者に最も多く見られる可能性がある。原則的に、ランダム化試験のシステマティックレビューは信頼できるエビデンス源として役立つが、重篤な有害性の報告は必ずと言っていいほど薬剤試験報告から欠落している[72]。このような報告の少なさは、ワクチン試験の文脈では例外的に明らかであるように思われる[73-75]。COVID-19ワクチン試験の場合、報告不足は状況的なものであり、参加者はファイザー社の試験の非盲検相で盲検化が解除され、プラセボ受領者はEUAのわずか数週間以内にワクチンを提供された。早期の盲検解除は、ワクチンに関連する後発または診断された害を特定するのに十分な時間がないまま行われた[15]。ファイザー社の試験で死亡した人の中にCOVID-19が主な原因とされた人がいなかったこと、比較的健康な集団のIFRが非常に低かったことを考えると、これは必要なことだったのだろうか[40]。
Classenは、試験コーディネーターがAEモニタリングに行き当たりばったりのアプローチを採用したため、これらの生物学的製剤が健康転帰に及ぼす潜在的な有害影響は、通常認識されているよりも大きかったと指摘している[49]。治験責任医師は、COVID-19の事象を優先的に記録する一方で、免疫後約7日間、「要請された」AEについて前向きに患者を追跡した。「要請されない」AEは、その後30~60日間報告された。試験参加者の中には、教育水準の低い人や高齢者(認知障害がある可能性がある)がいた[49]。このような人が重篤なAEを適切に認識し報告できるかどうかは疑問である。さらに、当初の臨床試験報告書には、30~60日の報告期間を超えて発生した、致死的なものを含む重篤な非感染性事象に関するデータは含まれていなかった[49]。対照的に、COVID-19の感染症は接種時から継続的にモニタリングされていた(情報バイアスの一種)。ファイザーとヤンセンの両社は、AEの記録に寛大であり、「勧誘された」事象の記録は、試験集団全体の20%未満に相当する安全性コホートに限定された。これらの知見は、製薬企業がスポンサーとなった試験で報告される。AE は、一般的に5%程度のごく一部であることを示した先行研究と一致している[76]。
さらに悪いことに、一般市民は登録試験の生データにアクセスすることが許されなかったため、科学界によるAEの独立した検証が妨げられた(これらは後に、予防接種が広く配布された後に明らかになった)[77]。このような秘密主義によって、産業界は、潜在的な危害の重大な過小評価とともに、遺伝子注射の利益に関する誇張され歪曲された見積もりをより容易に提示することができた可能性がある。
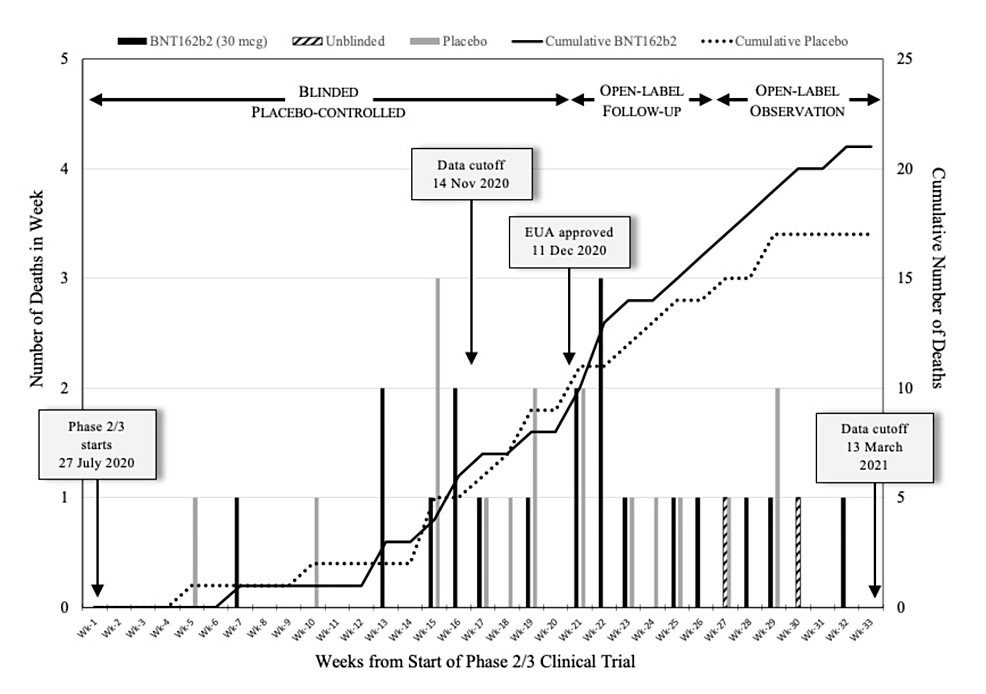
ファイザー社の6カ月間の臨床試験データの最近のフォレンジック分析により、臨床試験における多くの死亡が、FDAが審査し、ワクチンを承認するための小冊子を作成するために使用されたカットオフ日以降に発生していることが明らかになった。ファイザー社の当初のEUA申請書には、データカットオフ日である2020年11月14日までの試験結果のみが記載されていた。しかし、死亡やその他のSAEは、mRNAワクチンを承認する決定的なVRBPAC会議の前であっても、その後も発生し続けた。7カ国以上の153の臨床試験施設にまたがるファイザー・BioNTech臨床試験CA4591001の最初の33週間の間に、合計38人の被験者が亡くなった。38人の被験者はファイザー・BioNTechの6カ月間中間報告[35]に記載されている。これらの事象は、2020年7月27日に始まり2021年3月13日に終了した33週間の期間内に時系列的に発生した。このデータを視覚的に表現するために、Michelsらは週ごとの被験者死亡数を棒グラフにした(図1)。本試験のBNT162b2(ワクチン接種群)とプラセボ群の被験者死亡数が別々に描かれている。このグラフには、各週末に測定された各群の累積死亡数を示すプロットも含まれている。実線の棒グラフはBNT162b2の注射を受けた被験者を表し、灰色の棒グラフはプラセボを受けた被験者を表し、ハッチングを施した棒グラフは、当初プラセボを受けたが、盲検化が解除され、その後BNT162b2を投与された被験者を表す。さらに、著者らは、各試験群における死亡の累積数を表示した直線グラフを掲載した。実線はBNT162b2投与群、点線はプラセボ群である[54]。
図1:ファイザー社の試験における33週間の週間死亡率の分析
このMichelsら[54]によるファイザー試験の表現は、2020年7月27日から2021年3月13日までの週ごとの被験者死亡数を示している。実線の棒グラフはBNT162b2投与群、灰色の棒グラフはプラセボ群、ハッチングを施した棒グラフは、後にBNT162b2を投与された盲検化されていないプラセボ群である。実線はBNT162b2群、点線はプラセボ群の累積死亡数を示す。
画像出典Michels et al, 2023[54]; CC BY-NC-ND 4.0 Deed (Attribution-NonCommercial-NoDerivs 4.0 International)の下、著者らの許可を得て掲載。
注目すべきは、後にBNT162b2を投与された盲検化されていないプラセボ投与者は、この分析ではBNT162b2「ワクチン群」に組み入れられていることである[54]。背景を説明するために、登録試験は3つの期間に分けることができる。1つ目は「盲検プラセボ対照期間」で、2020年7月27日から2020年12月10日までである。第2段階は「非盲検フォローアップ期間」で、2020年12月11日から2021年1月24日までである。最後の期間は「非盲検観察期間」で、2021年1月25日から2021年5月13日までである[35,78]。プラセボ被験者の最初の死亡は5週目に記録され、BNT162b2被験者の最初の死亡は7週目に発生した。
試験開始後12週間は死亡例が非常に少なかったが、これは新規被験者の登録が続いていたためと思われる。両群の累積死亡数を示したプロットは、20週目頃まではほぼ一致しており、その後は乖離している(図1)。第20週以降、プラセボ群の死亡率は減少し、最終的には第30週までに安定した。対照的に、BNT162b2群の死亡数は一定の割合で増加し続けた。プラセボ群におけるこの死亡率の減少は、12月11日以降に開始された盲検化解除およびワクチン接種プロセスにより、試験中に残っていたワクチン未接種のプラセボ被験者の数が減少した結果であると考えられる。全体の死亡数は少なかったものの、mRNAワクチンを接種した被験者の死亡率が上昇し続けていたことを知っていれば、一般市民のワクチンに対する認識ははるかに低かったと思われる[54]。Michelsら[54]の図1のデータは、ファイザーの6カ月中間報告[35]から直接入手したものである。さらに、Michelsら[54]は、報告された死亡数を2019年の米国データ[79]に基づく年齢層別推定数と比較し、ファイザー社が報告した38人の死亡数は、米国集団で予想される死亡数の約17%であると判断した。
憂慮すべきことに、ファイザー社の6カ月間中間報告書から、Michelsらは、BNT162b2ワクチンを接種した被験者において、ワクチン製造業者が報告していない心血管イベントによる死亡数が大幅に増加している証拠を発見した[54]。、研究者らは、公開された査読付き解析のために、2020年11月14日以前に被験者の死亡日を明確に通知した少数の重要な被験者に関する報告書にアクセスすることができた[54]。プロトコルC4591001では、死亡または入院を含むSAEを24時間以内に直ちに報告することが義務付けられており、このガイドラインは試験実施施設のスタッフが遵守していたと思われる。それにもかかわらず、ファイザー社は、ファイザー社が管理している被験者の症例報告書に死亡が記録された日付を使用した。Michelsらの調査では、被験者の症例報告書に記載された死亡日の報告の遅れが、試験全体にわたって一貫したパターンであることが明らかになった[54]。これらの遅延は、2020年11月14日以前に死亡したワクチン接種被験者で最も大きかった。ファイザー社がEUA申請に実際の死亡日を使用していれば、さらに2人のワクチン接種対象者がEUA申請に含まれていたはずだ。ワクチン接種を受けた被験者の死亡のすべて(4人中4人)とプラセボの死亡の半分(4人中2人)が心臓に関連していたため、この不一致は極めて重要であった。法医学的分析により、ワクチン接種群では死亡例の75%、プラセボ群では死亡例の33.3%が心臓に関連していたことが明らかになった[54]。心臓SAEを経験した14人の被験者のうち、11人はBNT162b2ワクチンを接種した人であり、3人はプラセボのみの試験群の人であり、3.7倍の増加であった(OR 3.7, 95%CI 1.02-13.2, p = 0.03)[54]。Thomasらによるオリジナルの臨床試験論文もファイザー社の臨床安全性要約報告書も、この重要な安全性シグナルを認めず、コメントもしていないことは注目に値する[35,78]。
今にして思えば、ファイザー社の臨床試験において、ワクチン接種を受けた被験者の心臓死がワクチン未接種の被験者の2倍に比例して多いという、これまで公表されていなかった観察結果が、FDAの再評価を促した可能性が高く、特に、2020年12月10日までに17人の死亡が発生し、その後蓄積されたデータを考慮すると、そうであった可能性が高い[54]。これらの患者の死亡を症例報告ファイルに記録するのが遅れたことと、実際の死亡日が省略されたことが相まって、EUA承認プロセスの重要な段階で死亡が事実上隠蔽され、心臓のSAEシグナルが隠蔽された[54]。要するに、さまざまな報告の遅れや省略が、もしVRBPACでオープンに議論され、検討されていれば、承認プロセスが長引いたかもしれない。不適切な報告とVRBPACによる不十分な精査が、最終的にファイザー社が試験結果を操作し、心臓死のシグナルを不明瞭にすることを可能にしたのかもしれない。最近の生体内試験動物実験では、「単離された心筋細胞では、mRNA-1273とBNT162b2の両方が、病態生理学的に心筋症に相関する特異的な機能障害を誘導する」ことが証明されている[80]。原理的には、LNP-mRNAの生体内分布から心筋細胞を除外することはできず、すべての新しいmRNA産物は、心筋症や心停止など、生命を脅かす心臓の問題を引き起こす可能性がある。
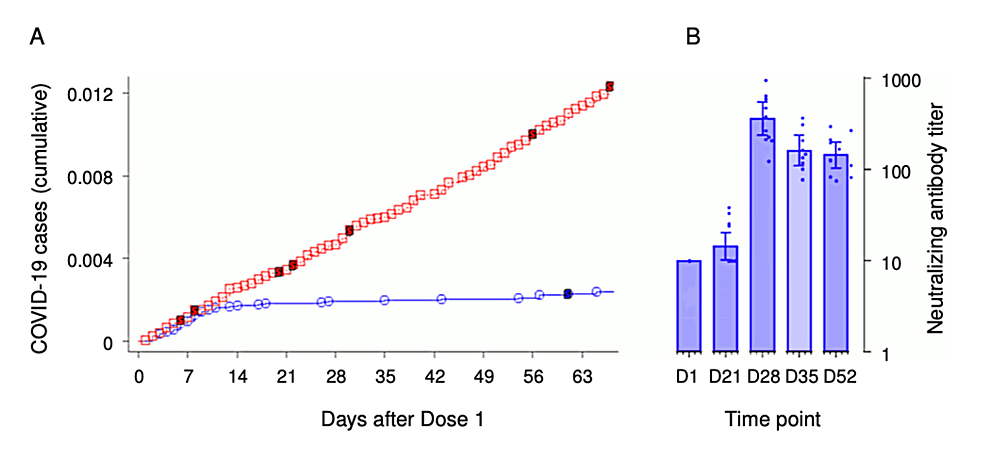
このようなSAE報告の漏れだけでなく、試験結果の公式報告にも問題があった。ファイザー社がEUA申請のために提出した臨床試験データから、mRNAワクチン群とプラセボ群のCOVID-19発症率を比較した際に不可解な傾向が明らかになった。プラセボ群では新たな症例が発生し続けたが、BNT162b2群の感染率は突然停止し、12日目に突然、均一な免疫が発現したことを示唆している。このような免疫応答は、現実的には集団の中でより緩やかに登録される傾向があることを考えると、12日目でのこのような突然の完全な応答は生物学的妥当性に反する。さらに、ファイザー社は、1回のみの投与を受けた人のデータを提供していない。Palmerら[82]によって翻案された同じ試験報告書[83]の図2は、最初の注射の日(D1)とその後の様々な日の中和抗体価を示しており、mRNA接種後のSARS-CoV-2に対する中和抗体の漸増を示している。このことは、迅速で完全な臨床免疫という概念と矛盾する。1回目の接種後21日目には、中和抗体はわずかに上昇し、ほとんどの人が2回目の接種を受けたであろう28日目にピークに達した。このような臨床データと抗体データの不一致は、12日目に突然免疫を示すグラフに疑問を投げかけ、その妥当性に疑念を抱かせるものである。図2は、ファイザー社の試験データに関する欧州医薬品庁(EMA)の評価報告書から引用した2つのグラフである[83]。
図2:COVID-19症例および体液性免疫反応(抗体価)の報告におけるファイザー社の不正を示す図表
これは、BNT162b2注射後12日目以降の異常なパターンを示している。プラセボ群では感染者が出続けたが、BNT162b2群では感染率が急激に低下し、予期せぬ即時免疫を示唆した。
画像出典Palmer M, et al., 2023[82]; Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License (CC BY-NC-SA 4.0)の下で複製。データは欧州医薬品庁(EMA)の報告書から抽出し、図9(A)および図7(B)を参照した[83]。
ファイザー社が発表した有害事象の6カ月中間報告(C4591001)で、総死亡者数が38人であることが明らかになった[35]ときは、パンデミックの中で44,060人の参加者を対象とした臨床試験としては、予想外に少ない数字に思われた。調査のため、Michelsらは、参加国間で比較可能であると仮定し、2020年の米国の死亡率に基づいて予想死亡者数を推定した[54]。米国内の132の治験施設と80%の被験者を対象として、彼らは2020年7月27日から2021年3月13日の間に222人の死亡が発生するはずであったと推定した。ほとんどの試験施設で死亡数が予測より少なかったが、これはおそらく、試験期間中に395人のユニークな被験者を含むかなりの割合の「追跡不能」被験者(無作為化された被験者の4.2%)に起因している。ごくわずかな損失を記録した施設がある一方で、その施設の被験者の最大5%という相当な数値を示した施設もあった[54]。これらの数字は、死亡者数が全体的に少ないように見える一因であると思われ、これらの個人の所在を確認する努力を増やすべきであった。追跡観察期間中に400人近い研究参加者の所在がわからなくなったことで、結果の妥当性と一般化可能性が大幅に損なわれた可能性がある。データの欠落は推定値に偏りを生じさせ、無効な結論につながる可能性がある。その結果、ワクチンの有効性が歪められ、SAE(死亡を含む)が過小評価され、mRNA製剤の安全性プロファイルが誤って表示される可能性がある。要するに、参加者の減少を最小限に抑えることができなかったファイザーの失敗は、6カ月間の研究の結論の正確性と信頼性を著しく損なった。
Gulbrandsenらによるレトロスペクティブ解析によると、ファイザー社の試験データでは、ワクチン群とプラセボ群の両方において、死亡率と注射後の経過時間との間に有意な関連が認められた[84]。最初の80日間に記録された死亡数はごくわずかであったが、注射後100日目あたりから死亡率の有意な増加が観察され、偶然とは考えられないパターンが示された。驚くほど不規則な傾向は、本試験における心臓のSAEにおいても明らかだ。最初の140日間は常にリスクに曝されることが予想されるにもかかわらず、全心臓イベントの半数近くが注射後50日以内に発現した。奇妙なことに、プラセボ群とワクチン群の両方で、最初の注射から100日目前後に心臓SAEが劇的に急増し、死亡率の上昇と一致した。試験に参加する前の主な病歴を調べたところ、さらに別の異常な傾向が明らかになった。9つの既往症はすべて、プラセボ群の参加者に多く見られた。さらに、死亡した参加者の年齢も両群間で顕著に異なっていた。これらの観察されたパターンがランダムに起こるとは考えにくい。これらの異常な傾向と一致する唯一のもっともらしい説明は、ワクチン接種者のSAE記録が変更され、発生後にプラセボ群に移されたことである[84]。
これらの懸念は、ピボタル試験における標準以下の研究慣行と不十分なデータ管理に関する暴露によってさらに悪化している。ファイザー社のピボタル試験への患者登録を担当した委託研究機関の元従業員による内部告発報告書は、データの完全性と試験参加者の安全性に関して重大な疑問を投げかけている[85]。記録された試験実施上の問題の中には、プロトコルの逸脱を報告しなかったこと、ワクチンの不適切な保管、実験用検体の誤ったラベル付け、AEを経験した患者のタイムリーなフォローアップの欠如があり、おそらく過少報告につながった。規制当局の監督に関しては、FDAはファイザーの臨床試験に関与した153施設のうち9施設しか査察していない[86]。
最後に、参加者の盲検化が試験の初期に行われ、異なる試験実施施設間で広範に行われた可能性がある。参加者は治験実施計画書と同意書の両方で、潜在的なAEに関する明確な情報を提示されなかった[87]。同意書の一部は誤解を招きやすく、理論上または「書類上」で約束されたことが現実に起こる可能性が低いことをボランティアが認識していれば、そうでなければ起こらなかったかもしれない参加を引き出すことを単に意図したものであった[87]。その結果、参加者は真にインフォームド・コンセントを受けていなかった。ワクチン接種によって引き起こされる可能性が最も高い潜在的な傷害やAEは、決して公言されていなかった。
このようなインフォームド・コンセントの欠如は、EUA後の実臨床にも引き継がれた。例えば、妊娠中のCOVID-19ワクチン投与の安全性を主張する際に、ファイザー社の試験で妊婦が除外されていることを公にしなかったことは、CDCの最も重大な過失の一つであることは間違いない[1]。ニュルンベルク綱領は、第二次世界大戦後、自発的なインフォームド・コンセントに対する患者の権利を確立した[88]。米国の裁判所は、インフォームド・コンセントを患者の自律のための基本的権利として一貫して支持している[89]。インフォームド・コンセントの手順では、頻繁に観察されるリスク、まれにしか起こらないリスク、SAEのリスクとは別の、有効性の欠如や免疫力の低下という、より明白なリスクを明確に区別しなければならない。臨床試験であれ、自由な実生活の場であれ、インフォームド・コンセントは、遺伝子ワクチンの接種に関連する潜在的リスクを明確に理解させるために不可欠である。パンデミックを通じて、医療従事者は患者に明確なリスク・ベネフィット情報を提供する義務があった。しかし実際には、インフォームド・コンセントは存在せず、情報シートは白紙であり[90]、ワクチン接種者は潜在的なリスクについて事前に知らされることはなかった。
移り変わる物語、保護の幻想
一般に、ワクチンの有効性には感染を阻止するか、大幅に制限する能力が不可欠であると考えられている。それにもかかわらず、ファイザー社とモデルナ社による登録試験は、この問題に対処するようにはデザインされていなかった。試験のエンドポイントはCOVID-19に関連した症状の軽減であった[1,2]が、その後CDCによってCOVID-19製品は感染を止めると一般市民に伝えられたにもかかわらず[91]。さらに、無症候性感染は極めて極小であることが示された[92]。2021年以降、科学界はCOVID-19 mRNA製品が感染も伝播も防げないことを知っている[93]。ワクチン産業がスポンサーとなった専門家でさえ、2021年の感染減少は最大61%であったと認めている[94]。オミクロン亜種は、ブースター投与後に感染を30~50%減少させることができる[95-97]。この効果は漸増的で一過性のものであり、オミクロン感染に対する防御効果は数ヵ月しか持続しない[93]。注射後のSARS-CoV-2に対する抗体価は高いが、mRNAを投与された患者では、自然感染者と比べて抗体価の低下が早い。COVID-19ワクチン接種者における疾患の重症度の低下が、二次感染を引き起こすリスクに及ぼす影響については、対照臨床試験で体系的に調査されたことはない[93]。
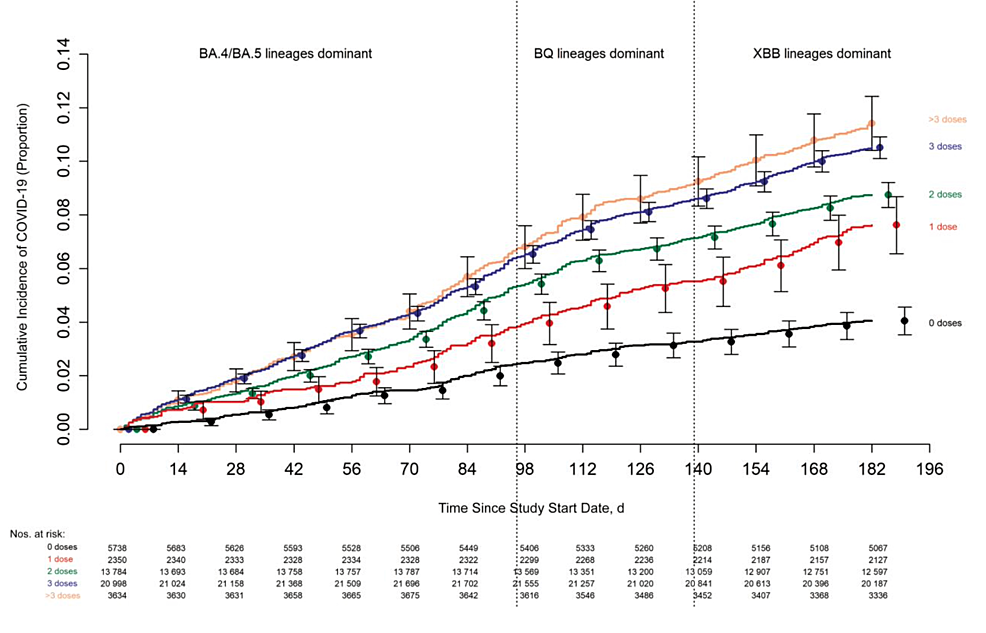
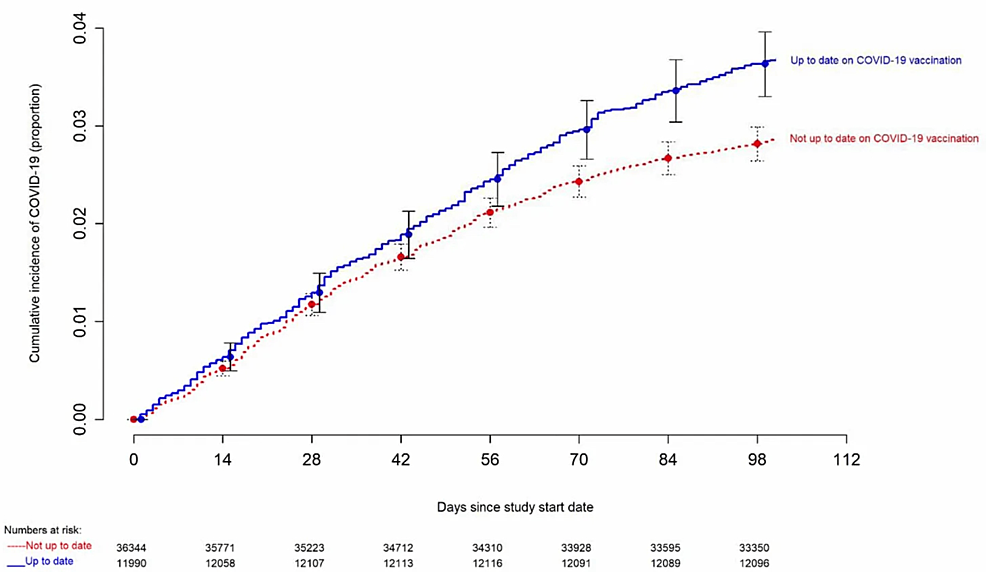
COVID-19に対するCOVID-19 mRNAワクチンの防御能の失敗を示す最良の証拠は、二価のmRNAブースターが利用可能になった後、クリーブランド・クリニック・ヘルス・システム(CCHS)内の従業員を対象とした2つの大規模コホート研究から得られている[99,100]。最初の研究(n=51,017)では、26週間の観察期間中に4,424人(8.7%)にCOVID-19が発生した[99]。蔓延している3つのオミクロン亜型による感染の予防という点では、ワクチンの有効性はそれぞれ29%、20%、有意ではない4%であった[99]。XBB系統が優勢な場合には、予防効果は得られなかった。注目すべきことに、「ブレークスルー」感染のリスクは、先にワクチンを接種した人の方が有意に高く、接種回数が多いほどCOVID-19のリスクは高くなった[100]。2番目のCCHSコホート研究(n= 48,344)では、CDCの定義による「最新でない」成人のCOVID-19の発症率は、ワクチン接種が「最新である」成人よりも23%低かった[100]。これらの知見は、ブースター接種後にオミクロン感染に対する予防効果が急速に低下することを示す複数の実世界研究によってさらに補強されている[101]。実験室で確認されたオミクロン感染と症候性疾患に対するワクチン効果は、1回目のワクチン接種とブースター接種から3カ月以内に急速に低下する[97]。
図3–4は、これら2つのクリーブランド・クリニックの研究から得られた驚くべき所見を示している。図3は先行研究の結果で、研究参加者のCOVID-19の累積罹患率を以前に受けたmRNAワクチンの投与回数で層別化したものである。0日目は2022年9月12日で、CCHS職員に二価ワクチンが最初に提供された日である。症例発生率は、mRNAワクチンの頻度が高くなるにつれて明らかに増加していた[99]。図4は、CDCが定義したワクチン接種状況に関して、「最新」と「最新でない」におけるCOVID-19の累積罹患率を比較したSimon-Makuchハザードプロットである。ゼロ日目は2023年1月29日で、オハイオ州でオミクロン変異株のXBB系統が優勢になった日である。両図ともx軸に点推定値と95%CIを示している[100]。
図3:mRNAワクチン接種の増加に伴いCOVID-19症例が増加していることを示すクリーブランド・クリニックの研究結果
クリーブランド・クリニックの研究で、過去に受けたmRNAワクチンの投与回数に基づく参加者のCOVID-19発症率が示された。この研究では、COVID-19 mRNAワクチンの接種回数の増加に伴い、症例発生率が上昇していることが示されている。
画像出典Shrestha et al, 2023[99]; Open Government Licence v3.0(www.nationalarchives.gov.uk/doc/open-government-licence/version/3/)に基づきライセンスされた、公共部門の情報を含むオープンアクセス論文。
図4:クリーブランド・クリニックの研究では、mRNAワクチン接種が最も「最新」の被験者でCOVID-19症例が増加している
Clevelandクリニックの研究で、CDCが定義したワクチン接種状況に基づき、「最新接種者」と「非最新接種者」のCOVID-19累積罹患率を比較したもの。プロットにはX軸に沿った点推定値と95%信頼区間が含まれている。
画像出典:Shrestha et al, 2023[100]; Open access, licensed under CC BY 4.0 Deed (Attribution 4.0 International)
COVID-19の有効性プロファイルが疑問視されている現在、ワクチン企業はCOVID-19ワクチン接種の継続を正当化するために2つのシナリオを採用している。一つ目は、COVID-19 mRNA製剤は感染をブロックしないかもしれないが、それでも重症化、入院、死亡を防ぐというものである。もうひとつは、mRNA接種に伴う防御は、自然感染と組み合わせた場合、自然感染(したがって自然免疫)単独よりも優れているというものである。
最初の物語は、感染に対する防御と重症化に対する防御という2つの防御の間に直感に反する二項対立を仮定し、両者の独立性を暗示しているように思われる。この二項対立を象徴するように、2022年のイスラエルの研究報告では、「確認された感染に対する防御は短命であったが、重症化に対する防御は研究期間中衰えなかった」と述べられている[102]。しかし、感染に対する防御が急速に低下した後も、重症化や死亡率に対する防御がそのまま維持されていると主張するのは妥当だろうか?この問題に対処するため、オフィールらは臨床試験、イスラエルでの大規模観察研究、現代の統計ダッシュボードから得られた著名なデータを綿密に分析した[103]。著者らは、「追跡期間が短く、時には恣意的であったり不均一であったりすること、除外基準やCOVID-19検査レベルが不均一であること、選択バイアス、結果の選択的報告など、複数の方法論的・代表的制約がある」ことを指摘した。しかし、最も重要なことは、文書化された死亡と重症化の条件付き確率(すなわち、ウイルス感染者における重症化と死亡例の割合)は、様々な臨床的および観察的有効性研究の治療群と対照群の間で差がなかったことである」[103]。著者らは、2回目のCOVID-19 mRNAブースターを受けることで重症化や死亡を効果的に予防できるという主張を立証する有効な証拠はないと結論づけた[103]。
2つ目の別の説は、ハイブリッド免疫、すなわち自然感染とブースターによる複合防御という現象に焦点を当てたものである。SARS-CoV-2感染に最近暴露された人では、COVID-19ワクチン誘発免疫は、より強固な抗体応答を生じさせ、生成される抗体のスペクトルを広げるため、自然免疫を上回ると考えられている[104]。このような強固で広範な体液性応答は、感染またはワクチン接種のみによって達成されるレベルの5-10倍高いレベルのメモリーB細胞の産生を伴う[105]。現在までに、先進国では全員ではないにしても、ほとんどの人がSARS-CoV-2に感染している。ハイブリッド免疫によって追加的な防御が得られることを知らされれば、感染歴があることを認識している一般人は、継続的なブースターを受け入れる傾向が強まるかもしれない。とはいえ、オミクロンの重症度が比較的低いことを考えると、追加的な抗体産生は本当に必要なのだろうか?また、抗体産生の増加による潜在的リスクも考慮する必要がある。オミクロンの亜型は常に変異しているため、現在のワクチンで生成される抗体の多くは非中和性である。非中和抗体が過剰に産生される可能性は、ワクチン関連亢進症(VAED)という現象につながる可能性がある。現在までのところ、動物モデルではCOVID-19ワクチン接種における軽度のVAEDの報告が数件あるだけで、ヒトで記録された症例はない[107]。しかし、ブースターが繰り返されると、VAEDは最終的にmRNAワクチン接種の長期的な安全性に影響を与える可能性がある。
ハイブリッド免疫の文脈で、最も深刻な免疫学的落とし穴は、Sタンパクの産生がすでに全身的に増加しているCOVID-19 mRNAワクチン後に起こるSARS-CoV-2感染に関するものである。当初は、事前のワクチン接種が感染の重症度を軽減し、COVID-19の重症化リスクを下げると考えられていた。ワクチン接種後の免疫系は、一連のワクチン接種を終えてから数週間以内であれば、その後の感染に対してより強く反応するようになる。しかし、上記の非中和抗体の過剰産生や重症化に対する不十分な防御とともに、自然免疫応答が回避されることにより、逆のシナリオが展開されることもある[108]。COVID-19ワクチン接種は、I型インターフェロンシグナル伝達の重大な障害と、タンパク質合成の調節制御の障害およびがん監視の障害を介して、自然免疫抑制を引き起こすことが知られている[26]。非中和抗体が過剰に産生されると、ウイルスではなく宿主組織と交差反応し、分子模倣によって炎症性自己免疫反応を誘発することにより、自己免疫反応のリスクが高まる可能性がある[109-111]。これらのメカニズムは、癌、心血管系疾患、その他慢性炎症性病因を持つ多くの疾患を含む自己免疫性炎症性病態のリスクを総体的に高める可能性がある[112,113]。(有害事象の機序に関する考察については、「AEの基礎となる機序」の項を参照されたい)。
この時点まで、SAEを検討する際、私たちは主にファイザー社のmRNA製剤BNT162b2に関連する影響に焦点を当て、6カ月間の臨床試験データと2022年8月に発表された393ページの機密文書から、約160万件のAEを明らかにした[114]。ハイブリッド免疫の文脈では、モデルナの製品であるmRNA-1273は、BNT162b2と比較して、実質的に強力な免疫応答を生成し、症候性感染と重篤なCOVID-19の転帰の割合が低いことに注意することが重要である[115]。mRNA-1273は、臨床試験、調査ベースの研究、政府主催のサーベイランス研究によると、BNT162b2と比較してSAEのリスクが有意に高いことを示している[1,2,116-120]。このことは、一方ではオミクロン感染に対する防御の向上、他方ではワクチン誘発性SAEの大幅なリスクという、好ましくないトレードオフを示している。
約500万人の成人を対象とした最近の研究では、注射後21日以内にSARS-CoV-2に感染した人は、同時感染のないワクチン接種者(OR=5.23,95%CI 1.11-24.64)と比較して、虚血性脳卒中のリスクが8倍(OR=8.00,95%CI 4.18-15.31)、出血性脳卒中のリスクが5倍(OR=5.23,95%CI 1.11-24.64)増加した[121]。このリスクはmRNA-1273の注射を受けた患者で最も高かった。このように、SARS-CoV-2感染とワクチン接種の時期が近かったことは、虚血性脳卒中および出血性脳卒中の早期発症と強い関連をもたらした[121]。繰り返しになるが、ハイブリッド免疫のアプローチでは、潜在的な害が利益を大きく上回る可能性がある。
自然免疫にはこのようなリスクはなく、オミクロン亜種の軽度の病原性に対しては十分すぎるほどだ。現在では、自然免疫によってCOVID-19の重症化に対する強固で持続性のある高レベルの防御が得られるという多くの証拠が示されている[122-126]。SARS-CoV-2感染の既往歴がある30,000人以上の医療従事者を対象とした英国(UK)の大規模研究では、再感染のリスクが84%減少し、防御期間の中央値は7カ月であった[125]。イスラエルで行われた大規模な観察研究では、ワクチン未接種の既感染者は、ワクチン接種者に比べてウイルスに感染する可能性が6~13倍低かった[122]。同じ医療システム内の32,000人のうち、ワクチン接種者はワクチン未接種者と比較して、症候性COVID-19の発症リスクが27倍、入院リスクが8倍高かった[122]。
COVID-19から回復した後、体内には長寿命の記憶免疫細胞が存在し、これは新たな感染に応答する永続的な能力を示しており、何年も持続する可能性がある[127]。オミクロンによる自然感染が繰り返されることにより、抗体の訓練とT細胞記憶の誘導が行われ、将来の感染症の軽減が増強されることを示唆する証拠が増えつつある[128,129]。最近のコホート研究では、SARS-CoV-2の再感染に対して、過去に感染を経験した小児が最低18カ月間、長期にわたる防御を示した[130]。このような5歳から11歳の小児は、研究期間中、防御力の低下を示さなかったが、12歳から18歳の小児は、時間の経過とともに、防御力の軽度ながら測定可能な低下を経験した[130]。特にこれらの若い世代にとっては、自然免疫は十分すぎるほど有効であり、もちろんmRNA接種よりもはるかに安全である。
ヒトに対する重大な有害性の分析
ここで、登録試験で報告されたAEとSAEについて、EUA後に規制当局や医薬品安全性監視調査で明らかになったデータも含めて、既知のことをレビューする。2014年の時点で、SahinたちはmRNAワクチン技術の潜在的な危険性を警告しており、特にコード化された抗原が複数の疾患リスクを有していないか調査する必要があると警告していた[131]。調査によると、COVID-19ワクチンの接種を受ける子供に関して親が表明する主な懸念は、ワクチンの有効性ではなく、むしろ潜在的なAEであることが示されている[132,133]。米国の親を対象とした調査では、mRNAワクチンの前例のない開発スピード(および、その意味するところとして、迅速な承認プロセス)に対する懸念が、有害な副作用に対する懸念よりも上位にランクされている[133]。リスクは、COVID-19ワクチンの接種回数や頻度によって異なる可能性がある。2回目以降の投与ではAEが少ないという報告もある一方[134]、発生率が高くなるという報告もある[116]。Sultana らは、モデルナワクチンの2 回目投与後のAE 発生頻度が高いものの、両 mRNA 製剤の2 回目投与後のAE 発生傾向は異なることを報告している[135]。
これらの製品の有害な影響に関する最も説得力のある発見は、死亡例を含むより重篤な転帰に主眼を置いた臨床試験データの包括的な再解析からもたらされた。Fraimanらは、厳密な方法論を適用し、ファイザー社とモデルナ社の臨床試験の中間データセットを徹底的に調査・分析した。SAEは、死亡、生命を脅かす状態、入院または既存の入院の延長、持続的または重大な障害/能力障害、先天異常/出生異常、医学的判断に基づく医学的に重大な事象のいずれかにつながった事象と定義された。ワクチンに関連したSAEのリスクは、世界保健機関(WHO)が採用したブライトン共同研究(Brighton Collaboration)の基準[136]によって特定された一般的なSAEと特別な関心のあるAE(AESI)に分けられた。
ファイザーとモデルナの両試験を合わせると、ワクチン接種者10万人当たり約125件のSAEが発生しており、これはワクチン接種者800人に1人の割合に相当する[50]。試験では最も虚弱な人を参加者として避けたため、集団への展開ではSAEの割合がさらに高くなると予想される。驚くべきことに、ファイザー社の試験では、ワクチン群におけるSAEのリスクがプラセボ群に比べて36%高く、そのリスク差はワクチン接種者1万人あたり18.0(95%CI 1.2-34.9)、リスク比は1.36(95%CI 1.02-1.83)であった。これらの所見は、2つの重要な臨床試験で報告されたSAEは「治療群間でバランスがとれていた」というFDAの当初の主張とは対照的である[15,50]。この矛盾は、FDAが参加者個人のデータのみに注目していたにもかかわらず、それらの個人の多くが複数のSAEを経験していたという事実によって部分的に説明されるかもしれない。Fraimanらは、個人を分析する代わりに、複数の同時事象を考慮するために、SAEの合計に焦点を当てた[50]。SAEを総合的に見ると、ワクチン群のリスクはFDAが以前に決定したものよりも大幅に上昇していた。
Fraimanのチームはリスク・ベネフィット評価において、ワクチン群における重篤なAESIの過剰リスクとプラセボ群におけるCOVID-19による入院リスクを比較検討した[50]。この分析は、ワクチン会社のスポンサーからの公表報告とFDAの発表に基づいている。驚くべきことに、Fraimanらによると、COVID-19の入院リスクと比較して、ファイザーの試験では重篤なAESIのリスクが4倍高く(それぞれ、参加者1万人あたり10.1件のAESI対2.3件の入院)、一方、モデルナの試験では2倍以上高かった(それぞれ、参加者1万人あたり15.1件のAESI対6.4件の入院)[50]。これらの所見は、EUA時代に当初推定されたよりもはるかに強いワクチン関連有害性の程度を示している。これらの結果を考慮すると、他のワクチンの公式SAE発生率は100万人当たり1-2人である[137]。ファイザー社の試験データに基づくFraimanらの推定(100万人当たり1,250件のSAE)は、この基準を少なくとも600倍上回っている。
米国と欧州の2 つの大規模な医薬品安全性報告システムの解析により、COVID-19 ワクチン接種後に約 160 万人から報告された。780 万件を超える。AEが明らかになった[47]。18~64歳の個人と比較すると、高齢者ほど死亡、入院、生命を脅かす反応の頻度が高く、RR推定値は1.49(99%CI 1.44~1.55)から8.61(99%CI 8.02~9.23)であった。両mRNAワクチンに関連する心筋梗塞、肺塞栓症、心肺停止、脳梗塞、脳出血のシグナルが同定された。これらのシグナルは、虚血性脳卒中とともに、大規模な不釣り合い分析によって確認された[48]。独立したリスク-ベネフィット解析では、BNT162b2は、予防された重症COVID-19症例数よりも25倍多くのSAEを発生させた[51]。このような不均等なリスク・ベネフィットの計算は、2021年だけで、COVID-19 mRNAワクチン接種による米国の死亡者総数が289,789人(95%CI 229,319-344,319人)と推定したSkidmore調査の結果を補強するものである[138]。医師と調査研究の専門家が調査の検証に協力し、サンプル(米国コネチカット州に本拠を置く世界最大のファーストパーティデータプラットフォームであるDynata社により取得)は米国人口を代表すると判断された[138]。
最後に、剖検研究から、重大な有害性の証拠が追加された。完全な独立判定を伴う包括的系統的レビューでは、剖検所見の74%(325例中240例)がCOVID-19 mRNA製剤によるものと判定された[139]。注射から死亡までの平均時間は14.3日であり、死亡例の大部分は心血管系が唯一の致命的な臓器系の損傷であった。これらの所見は、mRNAワクチンによって誘発された心筋炎(28人が死亡し、そのすべてが注射に起因していた)に関する、より最近の裁決付き剖検レビュー[140]や、独立した裁決の利点がなかったmRNAワクチン接種者の以前の剖検研究[141]によっても補強されている。複数の剖検研究に基づき、故アルネ・ブルクハルトが率いるドイツの病理学者は、免疫組織病理学的染色により、血管壁や脳組織におけるワクチンmRNA産生Sタンパクの存在を記録している[142,143]。これらの所見は、神経系、消化器系、肝系、腎系、血液系、免疫系、および生殖系に影響を及ぼすCOVID-19ワクチン誘発毒性について広く文書化されていることの説明に役立つ[25,144,145]。死後検査は、mRNA接種の潜在的SAEを同定するために極めて重要である。しかし、診療所や病院はCOVID-19ワクチンの流通に大きな既得権益を有しているため、剖検を抑制し、剖検報告を延期するという一般的な行政慣行は、包括的なリスク評価を弱体化させ、安全性に関する一般大衆の誤解を永続させ、公衆衛生政策立案を弱体化させるだけである[145]。
品質管理の問題および工程(プロセス)に関連する不純物
SARS-CoV-2ワクチンに使用されたmRNA技術の新規性を考慮すると、長期安全性モニタリングプロトコルとともに、定期的な製造検査と品質保証を確立し、必要な腫瘍原性、遺伝毒性、神経毒性、免疫毒性、生殖毒性試験を実施することが賢明である。これらの遺伝子ベースあるいはGTP製品にふさわしい安全性および毒性試験が実施されたことがないという事実は問題である。
死亡する個体がいる一方で死亡しない個体がいる理由を説明する上で重要な問題は、ワクチンの種類とバッチのばらつきである。mRNA技術特有の不安定性により、バッチによってはインタクトなmRNAが極端に少ない場合がある[146]。一部のバッチは二本鎖RNA(dsRNA)で汚染されており、ファイザーとモデルナの両製品についてEMAが記録している[147,148]。dsRNAは心筋炎などの免疫炎症反応を引き起こす可能性が高い[149]。
品質管理は、バッチのばらつきや製法に関連する不純物の議論の中心だが、現実的には、個々のバイアルについてそのような管理を評価することは不可能である。2021年に発表された論文で、Yuらは、副反応のばらつきは、汚染物質と取り扱い履歴の両方のばらつきに起因する、異なるバッチ間、あるいは個々のバイアル間の品質差によって引き起こされる可能性があるという仮説を立てた[150]。極端な低温での維持管理は必ずしも現実的ではないかもしれず、不適切な取り扱い(例えば、コールドチェーンの破断)がもたらす結果については、十分に特徴付けられていない。
バッチばらつきの問題は、mRNAワクチンにDNAが混入しているという最近の知見によって、さらに複雑になっている[151]。McKernanらは、2価のファイザーとモデルナのmRNA製剤の複数のバイアルの分析で、「1価、2価のワクチンの両方に高レベルのDNA混入」を発見し、それはRNA1ミリグラムあたり330ナノグラムのDNAという「EMAの制限値よりも桁違いに高い」ものであった[152]。DNA処理に関連した不純物もFDAの安全基準(10ng/回)を超えていた。
この主張を反証しようと、バックホーツと彼のゲノミクス研究チームは、ファイザー社のmRNAバイアルの2つのバッチを検査し、mRNAワクチン製造の鋳型として使用されていたプラスミドDNAベクターの混入を確認した[8,153]。サウスカロライナ州の上院公聴会で、バックホーツは、バイアル瓶あたり2000億個のDNA断片という、相当量のプラスミドDNAの塩基配列を一貫して決定したと報告した[153]。
驚くべき、潜在的に憂慮すべき発見は、ファイザーワクチンのサンプルにシミアンウイルス40(SV40)プロモーターが存在したことであり、モデルナワクチンのサンプルには顕著に存在しなかった[151]。2023年10月、規制当局であるカナダ保健省は、mRNAワクチンサンプルにこの遺伝子配列が存在することを確認した[154]。SV40は、もともと汚染されたポリオワクチンから1960年に分離された発がん性DNAウイルスで、実験動物にリンパ腫、脳腫瘍、その他の悪性腫瘍を誘発する[155]。がん患者から得られた免疫学的データから、がん患者の血清は健常人と比較してSV40に対する抗体の有病率が高いことが示されている[156]。1,793人のがん患者からの多様なデータのプーリングに基づくメタアナリシスでは、脳腫瘍、骨がん、非ホジキンリンパ腫、悪性中皮腫との関連においてSV40の有意な過剰リスクが同定された[157]。しかしながら、SV40に汚染されたポリオワクチンの配布後に癌の流行がなかったことから示唆されるように、SV40への暴露だけでヒトに悪性腫瘍が発生することはあり得ないようだ。より可能性の高いシナリオは、確立された発癌物質であるアスベストとの共発癌の可能性を明らかにした実験室研究が示すように、SV40が腫瘍の発生と進行における補因子として機能することである[158]。
SV40プロモーターは、DNAプラスミドを用いた遺伝子治療において、エンハンサーとして使用される可能性がある。骨格筋細胞への体細胞遺伝子導入に関する2001年の研究では、SV40エンハンサーをDNAプラスミドに組み込むことで、外因性遺伝子の発現レベルを20倍高めることができることが示された[159]。プロセスに関連した不純物の影響に関する洞察に満ちた論説によると、DNA断片を脂質粒子にパッケージングすることで、DNA断片がヒトゲノムに組み込まれる可能性が高まるという[160]。
登録試験で使用されたバイアルにはなかったが、一般に配布されたバッチから採取されたすべての試験済みBioNTechバイアルにSV40プロモーターが確認されている。2023年12月6日、フロリダ州の外科医Joseph LadapoがFDAとCDCに、安全性評価とmRNAワクチン製品の1用量あたり数十億のDNA断片の発見について質問した[161,162]。その1週間後、FDAは、遺伝毒性試験(DNA統合のリスクを評価するには不十分である)を引用し、SV40プロモーター/エンハンサーとSV40タンパク質の区別をあいまいにし、これらの要素を互換性があるものとして誤って扱うことによって、文書で回答した[162]。FDAは 2007年にFDA自身が強調したリスクに対処するためのDNA統合評価を実施した証拠を今のところ示していないため、LadapoはすべてのCOVID-19 mRNAワクチンの使用を完全に停止するよう求めた[161,162]。mRNAワクチンの開発者であるロバート・マローン博士は、Brownstone Instituteの論文の中で、FDAが汚染DNAの潜在的リスクを評価しようとしないことを強く批判した[163]。
世界保健会議が主催する国際的な専門家諮問委員会が発表した共同声明には、次のような内容が含まれていた:「モデルナとファイザーの両方のバイアルには、完全に未申告の遺伝子配列が複数存在し、SV40の配列はファイザーのバイアルにのみ見られる。しかし、人口のかなりの部分でSV40が潜伏感染している場合、モデルナのレシピエントにも同じSV40リスクが生じる可能性がある。染色体への組み込みがない場合でも、DNAプラスミドはSタンパク質毒素やその他の有害な蛋白質のmRNAを長期間、予測できない期間生成する可能性がある。外来DNAのヒトゲノムへの統合は、既存の自然な遺伝子配列を破壊する。規制当局による正式で透明性のある評価が行われていないため、専門家たちはまた、これらの製品の完全なリスクは開示されておらず、完全に理解されていないため、インフォームド・コンセントを提供することは現状では不可能であると指摘している。
なぜこのような危険で大規模な汚染が公衆衛生当局の監視の目を逃れたのか、また製造者はこの問題を認識していたのか?登録試験で使用されたCOVID-19 mRNA製品には、製法に関連した不純物が含まれていなかったことは重要である。これらの臨床試験で使用されたほぼすべての用量は、プロセス1と呼ばれる方法で製造された「臨床バッチ」に由来する[1]。しかし、世界的な流通のための承認後の緊急供給措置として、細菌プラスミドDNAを利用したプロセス2として知られる大量生産にはるかに適した方法が考案された[165]。プロセス2の変更には、RNA転写に使用するDNAテンプレートの変更、精製段階の変更、LNPの製造工程の変更が含まれる[165]。
注目すべきは、プロセス2を用いて製造されたバッチは、mRNAの完全性が著しく低下していたことである[146,166]。プロトコルの修正によると、プロセス2を用いて製造されたファイザー製品の各バッチは、16~55歳の約250人の参加者に投与され、その後、無作為に選ばれたプロセス1バッチの250人のレシピエントに対して免疫原性と安全性の比較分析が行われた[165]。本稿執筆時点では、プロセス1とプロセス2の安全性と反応原性を比較した解析結果は公表されていない。
もう一つの懸念は、RNA分子のウリジンを全てN1-メチルシュードウリジンに置き換えることによる生物学的影響の可能性である。この戦略は、mRNA治療薬の一部としてタンパク質の発現を高める有用な方法とみなされている[167]。この技術革新を欠いたCureVac mRNAワクチン(CureVac N.V.、ドイツ、テュービンゲン)は、ファイザーやモデルナの製剤よりも効果が低かったため、これもブレイクスルー技術革新と考えられた[168]。有効性が向上したのは、このような改変が分解プロセスを遅らせ、mRNAをより長く持続させるからであろう。N1-メチルシュードウリジンは天然の分子だが、通常は配列中のウリジンのごく一部にウリジンの代用として存在するだけだ。N1-メチルシュードウリジンを大量に細胞に導入することで、細胞自身の新しいmRNA分子の合成にどのような影響があるのか、まだ解明されていない[169]。
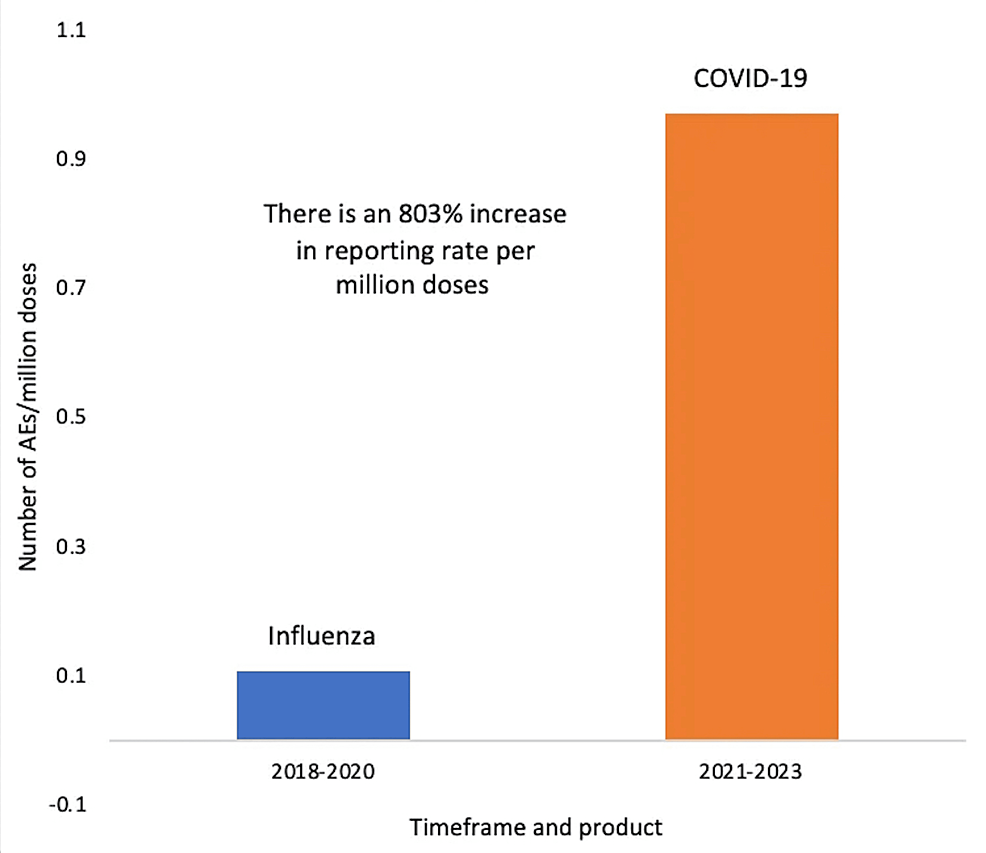
驚くべき発見として、Mulroneyらは、mRNAワクチンが、mRNAコードから1ヌクレオチドだけフレームシフトした場合に合成されるタンパク質に対する抗体をマウスに誘導することを観察した。これは、Sタンパク質だけでチャレンジした細胞や、DNAベースのワクチンであるAstra-Zenecaワクチン(AstraZeneca plc, Cambridge, United Kingdom)を接種したマウスでは見られなかった[170]。このような意図しないオフターゲットタンパク質は、Mulroneyらの言葉を借りれば、「有害である可能性が非常に大きい」ワクチン有害事象報告システム(VAERS)のMedDRAコード「自己免疫疾患」の照会に基づくと、2018年から2020年までのインフルエンザワクチン投与と2021年から2023年までのCOVID-19ワクチン接種を比較した場合、投与100万回当たりの自己免疫疾患が803%増加していた(図5)[173]。これは巨大な安全性シグナルを意味する。この技術に関するこのような根本的な疑問や懸念は、製品が何億人もの人々に提供される前に解決されるべきであった[174]。
図5:COVID-19 mRNA(2021~2023)の100万回接種あたりの自己免疫疾患のVAERS報告数とインフルエンザ(2018~2020)接種数の比較
MedDRAコード「自己免疫疾患」を用いたVAERSクエリー(https://vaers.hhs.gov/)に基づき、2018年から2020年に投与されたインフルエンザワクチンと2021年から2023年に投与されたCOVID-19 mRNAワクチンを比較した場合、投与100万回あたりの報告率が803%増加した。注目すべきは、自己免疫疾患の既往歴のある人を除外した報告である。
画像出典:ジェシカ・ローズ(共著)、[173]
AEの根底にあるメカニズム
COVID-19ワクチンの様々なAEを説明する可能性のある生物学的メカニズムに関する完全な考察は、本稿の範囲を超えている。そのため、これらの論文[26,175-181]を参照されたい。分子模倣、抗原交差反応性、病原性プライミング、ウイルス再活性化、免疫疲弊、および免疫機能障害に関連する他の要因のメカニズムはすべて、ワクチンによる悪性疾患や自己免疫疾患の発症の生物学的妥当性を補強するものである[26, 182-185]。SARS-CoV-2ワクチンもmRNAワクチンも、慢性炎症、血栓形成、プリオン関連調節障害、内皮炎関連組織障害など、多くの病態生理学的影響とともに免疫機能障害を引き起こす可能性がある[180]。
mRNAワクチンは、ウイルス感染に対する反応とは全く異なる独自の免疫活性化メカニズムを提供する。これらの機序は、遺伝子ベースの製品のAEプロファイルを説明するのに役立つ。Sタンパク質そのものは、ウイルスが産生する最も毒性の高い蛋白質であることは間違いない[180]。mRNA-LNPが多様な組織に分布することで、複数の細胞種にまたがる細胞表面でのSタンパク質の発現が促進される[186]。その結果、標的組織はT細胞を介した攻撃とそれに続く破壊を受けやすくなる[109-111]。特に傷つきやすいのは、心筋や神経細胞などの組織で[80,144]、どちらも修復や再生能力が限られているのが特徴である。さらに、血管組織は全身に広く標的化され、攻撃されている[180]。
ワクチンに含まれるその他の成分は、複雑で、十分に理解されておらず、予測不可能なAEの一因となっている。これらの成分には、脂質ナノ粒子、特にイオン化可能なカチオン性脂質、ポリエチレングリコール(PEG)、および最近独立した研究者によって検出されたDNAプラスミド (前節で議論)などの様々なプロセス関連不純物が含まれる[151,186]。イオン化可能なカチオン性脂質は有毒であることが知られており、プロアポトーシスおよびプロ炎症カスケードを誘導する[187]。しかし、それらはワクチンの必須成分であり、mRNAから豊富なSタンパク質をより多量に合成するのをサポートする。
30年以上前、研究者たちは、合成カチオン性脂質ナノ粒子が両親媒性の凝集体を形成し、細胞膜を破壊し、炎症反応を誘発し、免疫機能を抑制するという、通常とは異なる可能性に気づいていた[188]。実際、明白な感染がない場合の免疫活性化を説明できる、免疫機能に関する新たな理論への関心が高まっている。米国国立アレルギー・感染症研究所のマツィンガーと彼女の免疫遺伝学研究チームによるブレイクスルー研究は、免疫応答は主に、異物ではなく危険なものから身を守る必要性によって駆動されるという概念の先駆者である[189]。
COVID-19 mRNAワクチンの主要アジュバント成分の一つであるPEGは、ワクチン誘発アナフィラキシーショックの主要因であると考えられており、これは感受性の高い人における潜在的な即時型SAEとして確立されている[190]。ナノ粒子にPEGを結合させると免疫原性が高まり、補体の活性化とそれに続く急性で生命を脅かす反応を引き起こす[191]。さらに、PEGとワクチンで生成されたSタンパク質との結合は、COVID-19ワクチン接種後1週間以内に発生する突然発症する下垂体障害(下垂体卒中、急性下垂体炎への移行)の一因となる可能性がある[192,193]。Taiebらは、これらのワクチン成分が、ワクチン誘発性血栓性血小板減少症(VITT)に関連した全身性の炎症反応および循環障害を誘発し、下垂体出血または梗塞を引き起こす可能性があると仮定している[192]。下垂体卒中の症状には、頭痛、めまい、発熱、および筋肉痛(すべて一般的なワクチンの副反応)が含まれるため、著者らは、ワクチン接種後の下垂体障害の実際の発生率は、一般的に記録されているよりもはるかに高いのではないかと疑っている。台湾の研究では、ワクチン接種後のめまい/立ちくらみの発生率は、ファイザー社のBNT162b2と比較して、モデルナ社のmRNA-1273を投与された患者でかなり高いようであり、めまい/立ちくらみの発現までの期間の中央値はそれぞれ12日と6日であった[194]。
Sタンパク質の顕著な毒性作用について記述した文献は多数あり、その数は増え続けている。ワクチン接種後30日間も持続することが懸念されている[195]。S-タンパク質は、NF-κBシグナル伝達経路の活性化を通じて、急性の炎症反応を引き起こす[196]。Sタンパク質は内皮細胞の老化を誘導することが示されており、これが血管に関連する様々なAEの一因となっている可能性が高い[197]。最も懸念されるのは、アミロイド生成の可能性であり、これは神経症状の広範なスペクトルに重要な役割を果たしている可能性がある[198]。
COVID-19 mRNAのワクチン接種後、特に若年成人では、多くの研究で心筋炎や不整脈のリスクが増加し、場合によっては突然死に至ることが判明している[57,60,140,149,199-202]。Sタンパクは、ワクチン接種後に心筋炎を発症した若年成人では循環中に持続するが、心筋炎を発症しなかったワクチン接種者では持続しない[202]。ワクチンのmRNAは、剖検時のヒトの心臓から30日まで分離された[195]。ラット心筋細胞に対するファイザーとモデルナのmRNA ワクチンの直接的な心毒性は、注射後 48 時間で証明されている[80]。COVID-19ワクチン心筋炎で入院した若年者の生検では、Sタンパクと活発な炎症が観察された。Cadegianiは、アドレナリンの急増が、臨床的または潜在性心筋炎で心停止を起こした若年者の心停止を引き起こす主要な誘発因子であると提唱している[204]。さらなる心毒性機序として、アンジオテンシン変換酵素2(ACE2)受容体がSタンパク質に結合した後、その発現がダウンレギュレーションされることが考えられる。これにより、ACEの発現が阻害されなくなり、アンジオテンシン-2レベルが上昇し、炎症が起こり、最終的にはアポトーシスに至る可能性がある[201]。上昇したアンジオテンシン-2は、炎症と酸化ストレスを引き起こし、心筋症の進行の主な要因である[205]。
ブースター注射を繰り返した後に現れる一般的な免疫抑制は、もう一つの大きな懸念となる。T細胞疲弊とは、CD8+ T細胞がサイトカイン産生と細胞傷害能を徐々に失っていく免疫学的状態を指す[206]。このような機能不全は、慢性感染症、癌、自己免疫疾患などの病態で起こることが知られている[207,208]。COVID-19のmRNAワクチンを3回と4回接種した後、研究者たちは、IgG4へのクラススイッチに関連した、Sタンパク質に対するT細胞応答の減少を観察した[209]。IgG4は感染を防御しないだけでなく、他のIgGを積極的にブロックしてその作用を抑制し、免疫抑制を引き起こす。注目すべきことに、SARS-CoV-2に対するT細胞応答の低下は、3回目と4回目の接種の1カ月後に観察された[211]。COVID-19のmRNAを複数回接種した後のこのようなT細胞の疲弊は、ブースターの回数を増やすとCOVID-19の感染率が上昇するという研究結果を説明するのに役立つ可能性がある[99,100]。
Loackerらは、2回目のmRNAワクチンの2日後に測定した免疫細胞表面上のプログラム死リガンド1(PD-L1)の発現が有意に増加することを示した[212]。PD-L1が癌細胞上のPD-1に結合すると、T細胞が癌細胞を排除する能力が制限され、腫瘍の免疫回避が促進される[213]。免疫細胞上のPD-L1レベルの上昇は、がん患者を好ましくない転帰に導く可能性があり、PD-L1抑制を標的とする治療法(抗PD1遮断療法)は、実行可能な治療選択肢として注目を集めている[214]。様々なリンパ腫の急速な進行は、COVID-19 mRNAワクチン接種と関連しており[215-218]、PD-L1の上昇がこの文脈で役割を果たしている可能性がある。
COVID-19ワクチンの発がん性や腫瘍増悪性に関連する他の因子が、集中的な研究の焦点となっている。AnguesとBustosによる最近の総説では、COVID-19ワクチンが生物学的機序を活性化すると仮定され、その機序によって、既存の巨視的病変を加速させたり、休眠状態の微小転移巣を目覚めさせたりして、癌の進行を助長する微小環境が形成される可能性があることが検討されている[219]。これらのメカニズムは、主にSタンパク質とLNPの炎症促進作用、I型インターフェロンを生成する身体の能力の障害、ワクチン内のmRNAの構造変化によって引き起こされる細胞のマイクロRNAの制御障害に関連している[219]。さらに、COVID-19 mRNAワクチンは、インターロイキン-17(IL-17)濃度の上昇とTh17のアップレギュレーションを引き起こし、Th1-Th2免疫を混乱させ、がん患者の慢性炎症状態をエスカレートさせ、腫瘍の成長と進行をさらに増幅させる[220-222]。
ワクチン無効の免疫学的根拠
COVID-19 mRNAワクチン接種の生物医学的目的は、基本的に2つある:(1) SARS-CoV-2による感染に対して身体の免疫防御を活用すること、(2) 重症化とその結果のリスクを軽減すること。mRNA産物の筋肉内注射後、Sタンパク質をコードするmRNAはLNPを介してヒト細胞に送達され、Sタンパク質および/またはコロナウイルスの表面に存在する抗原に似た関連抗原を生成する[25]。これらの抗原はその後、記憶T細胞やB細胞の産生を刺激し、後者はウイルスの特異的エピトープに結合する抗体を産生する。その結果、ワクチン接種を受けた人がSARS-CoV-2に遭遇した場合、その免疫系は短期的に強力な適応免疫反応を起こし、理論的には感染の重症度を軽減する。このCOVID-19症状の軽減は、これらの生物学的製剤が意図する臨床的効果を示すものである。
しかし、上記の説明は、COVID-19ワクチン接種による全身的効果と肺粘膜免疫による自然な防御との間に免疫学的断絶があることを意味している。SARS-CoV-2は主に空気感染するウイルスで、上気道から人体に侵入する。そのため、免疫系と病原体との最初の遭遇は通常鼻腔と扁桃で起こり、最初の暴露からわずか4日以内に唾液、鼻汁、涙、その他の分泌物中に分泌型IgA抗体が産生される[223]。その後、ウイルスは上気道にうまく閉じこめられ、無症状の感染か、咳やくしゃみなどの軽い症状をもたらす[223]。分泌性IgAと粘膜領域の活性化された組織常在T細胞が組み合わさることで、感染を制限し病気の症状を抑えるだけでなく、感染を完全に食い止めることができる[224]。さらに、SARS-CoV(SARS-CoV-2の前身と推定される)の研究によると、最初の呼吸器感染に伴う細胞性免疫は、検出可能な液性成分がなくても、最長17年間持続する可能性がある[225]。H1N1インフルエンザウイルスへの曝露に同意したヒト被験者を対象とした研究では、既存の粘膜IgAが全身性IgGよりも重症化に対する防御に優れており[226]、高い循環IgG力価が強固な防御と相関しない可能性が示唆されている。肺粘膜は一連の自然免疫因子(補体、プロテアーゼ、ラクトフェリン、抗菌ペプチドなど)を産生し、分泌抗体(sIgAおよびsIgM)と同期して、外来微生物や粒子の侵入を制限する[227]。感染時には、好中球が主に反応し、IL-8とエラスターゼを放出し、循環中のナチュラルキラー細胞、単球、好酸球の動員を促進する[227]。
このような免疫学的背景を考慮すると、SARS-CoV-2や他の呼吸器ウイルスに対する自然な粘膜免疫は、COVID-19ワクチン接種によって惹起される全身性免疫応答と比較して、通常、より包括的で長期にわたる防御をもたらすと推測するのが妥当である。SARS-CoV-2感染が粘膜免疫応答と全身性免疫応答の両方を誘導するのに対し、現在投与されているCOVID-19 mRNAワクチンは粘膜免疫の誘導という点では効果がない[227,228]。ワクチンによって誘導される免疫の利点は、前述したSAEのリスクと相殺される。このようなリスクは、重症化や早死にすることなくSARS-CoV-2を排除する能力を持っている大多数である集団全体に関わるものであり、強調しすぎることはない。
連邦政府関係者は、COVID-19 mRNAワクチンが「安全で効果的」であると述べた際、しばしば「感染に対して95%の効果がある」と付け加えた。それにもかかわらず、その後の研究で、予防効果は短期間で、わずか数ヵ月で免疫力が低下することが示された[229,230]。この効果の減退は、ブースター接種を繰り返すほど顕著になる[231]。この現象には論理的な説明がある。第一に、ウイルスの進化により、SARS-CoV-2の亜種は常に変異しており、中和抗体の標的であるSタンパク質に多数の変異が生じている。これらの変異は、ほとんどが受容体結合ドメイン(RBD)の近傍に集中しており、新たなエスケープ変異体(すなわち、中和抗体を回避する変異体)を生み出す絶え間ない機会を生み出し、その結果、その後のワクチン接種における免疫回避を可能にしている。第二に、エスケープ変異体上の新規抗原との対決は、「原抗原原罪」、すなわち、先行する株への曝露が原因で新規抗原や病原体に対して有効でない可能性のある交差反応性抗体の産生と関連している[232,233]。交差中和が起こることはまれだが、S-タンパク質への抗体の結合における交差反応性は、SARS-CoV-2感染では一般的である[234]。さらに、他の研究では、季節性コロナウイルスとSARS-CoV-2の間にある程度の交差反応性があることが示されている[235]。
免疫系が既存のSARS-CoV-2亜型に同調するようになると、現在流行している亜型に対する抗体応答が徐々に狭まる。この刷り込み現象は、自然感染とCOVID-19ワクチン接種の両方で実証されている[236]。2021年のパイロット研究では、SARS-CoV-2未感染者では、BNT162b2の各投与後に体液性応答が強力に増加したのに対し、既感染者では、mRNAワクチンの1回目には強い体液性応答を示したが、2回目には反応が鈍くなったことが明らかになった[237]。免疫刷り込みは、2価のCOVID-19ワクチンの予期せぬ有効性の低下の根本的な要因であることも同定された。
COVID-19ワクチン失敗の免疫学的根拠の少なくとも一部は次のように要約できる。SARS-CoV-2のS-タンパク質はACE2レセプターに結合し、強い選択的免疫圧によってS遺伝子が変異し、ウイルス逃避機構を発達させるというシナリオを作り出す。SARS-CoV-2ワクチンの大半は、最初の武漢株のSタンパク質配列を使って設計されているため、これらのエスケープ変異体は、これらのワクチンによって引き起こされる免疫反応を効果的に回避することができる。このため、オリジナルのS-タンパク質配列を利用したmRNA産物によるその後のすべての注射の有効性が低下する[236,239,240]。COVID-19のmRNAを定期的に接種することは、ウイルスの生態系に悪影響を与え、免疫逃避変異体(すなわち、突然変異によって選択圧を逃れた変異体)の継続的な出現を促し、最終的にワクチンを効かなくする可能性がある。このような収穫の逓減は、本稿で前述したクリーブランド・クリニックの研究で観察された[99,100]。さらに、継続的なブースターは免疫機能不全を引き起こす可能性が高く、それによって抗ウイルスや微生物防御が低下し、自己免疫疾患や癌の進行が促進される。
SARS-CoV-2では、ウイルスの自然進化とワクチンによる免疫系への選択圧の両方によって遺伝的変化が進行していることから、今後数年間は、新たな変異型に対処するためにCOVID-19 mRNAワクチンの接種を頻繁に行う必要があると考えられる。しかし、上述の免疫刷り込みは、強固な防御を達成する能力を制限する可能性があり、集団規模のワクチン接種であってもウイルス感染を促進する可能性がある[239]。以前の亜種に対してワクチン接種を受けた個体におけるSARS-CoV-2の新型または新興亜種による免疫回避は、抗体の交差反応性と免疫刷り込みにより、いつまでも続くであろう。
皮肉なことに、mRNAワクチンには新たな変異型の出現を永続させる能力があるため、一般の人々の間にも、新たな予防接種が必要だという認識が広まる傾向がある。その結果、ワクチンとエスケープの変種サイクルが際限なく繰り返されることになり、この問題に対処するためにとられた行動(ワクチン接種の増加)が、かえって有効性を失わせるというフィードバックループが生じる。ウイルスのSタンパク質の変異は抗体応答に対する抵抗性を提供し、この淘汰過程が新たな優勢変異体が出現するという大きな現象の根底にある[241-243]。大量mRNA接種は、ワクチン誘導免疫をうまく回避する、感染力の強い免疫回避型SARSコロナウイルス変異型の自然淘汰を引き起こし、これらの変異型の流行の劇的な上昇につながる[108]。
要約すると、優性変異体の大規模な出現は、集団ワクチン接種キャンペーンによって及ぼされた選択圧に対する適応的反応であり、この反応は免疫抑制個体でさらに高まった[244]。重要なことは、免疫逃避変異体は主にワクチン接種を受けた個体で発生しており、ワクチン未接種個体では発生していないことである[245,246][241,242]。ワクチンによって誘発される免疫機能不全の根底にあるメカニズム(前節を参照)が、さらに無効性を助長している。COVID-19 mRNAワクチンの無効性に関与する主な因子を図6にまとめた[247]。
図6:COVID-19 mRNAワクチンの無効性の要因
COVID-19ワクチンは、SARS-CoV-2の突然変異を誘発し、新たな免疫エスケープ変異体につながることによって、部分的に効力を失う可能性があり、その結果、最終的にその後のコロナウイルス感染に対するワクチン関連防御を制限することになる。定期的なCOVID-19 mRNAワクチンは、免疫機能障害(主に自然免疫の破壊による)に関連する多様なメカニズムを誘発する可能性があり、その結果、がん、感染症、自己免疫疾患のリスクが高まる。
画像出典:Majumder and Razzaque, 2022[247]、著者らの許可を得て引用。
考察
このレビューでは、入手可能なデータと公表された研究を直接評価した上で、別のシナリオを検討する。そうすることで、透明性、信頼性、情報に基づいた意思決定を促進し、COVID-19ワクチンの安全性に関する公衆の正当な疑問が解決されるようにすることを意図している。このアプローチは、安全性をめぐる継続的な議論に貢献するだけでなく、今後の公衆衛生戦略の改善に道を開くものでもある。COVID-19が主に免疫抑制者、高齢者、複数の合併症を持つ人々を苦しめてきたのに対し、COVID-19の予防接種は、虚弱な高齢者(最も脆弱なサブグループ)だけでなく、若くて比較的健康な人々など、あらゆる年齢の人々に悪影響を及ぼす可能性がある。COVID-19のmRNAワクチン接種とその後のSARS-CoV-2感染との相互作用の結果、SAEがより頻発する可能性を考慮する場合、2022年初頭から優勢となっているオミクロン亜型感染は軽度の経過をたどり、必ず致死的ではないことを念頭に置くことが重要である[248]。さらに、感染症がその性質上、不随意かつ偶発的なものであるのに対し、mRNAワクチンは、生命を脅かす可能性のある反響を伴う選択である。
ワクチンやその他の介入策の有効性を評価する上で、無作為化プラセボ対照臨床試験が極めて重要な役割を果たすことは、医学界や公衆衛生界で長い間認識されてきた。2021年1月に発表されたCOVID-19ワクチン評価のための次のステップに関するWHOアドホック専門家グループによる報告書[249]では、十分に設計された対照試験の価値が強調されている。観察された結果の信頼性を確保するためには、特に改変RNA-LNP製剤のような新規の実験的薬剤の場合、様々な基準を満たした被験者を介入群またはプラセボ群に無作為に割り当てる細心のプロセスが必要である。無作為化は、比較のためのベースラインを確立するだけでなく、結果におけるいかなる差異も介入そのものに起因することを容易にする。プラセボ対照は、介入の効果について誤った結論を出す可能性を最小限にする。安全性のシグナルを検出するツールとしては非常に貴重だが、VAERSやイエローカードのような全国的な健康監視データベースは、対照試験によって設定された厳格な基準を満たしておらず、医療および公衆衛生介入を評価するためにこのアプローチが必要であることをさらに強調している。
振り返ってみると、EUAにつながった登録試験から明らかになった最も懸念すべきことは、95%の有効性が明らかに誇張されていたことではなく、比較的健康な参加者グループであっても、ワクチンがSAEや早期死亡の重大なリスクを伴うことがこれらの試験で示されたことであった。ファイザー社による拡大試験の知見に基づくと、私たちの人年推計では、ワクチン接種者における総死亡率は31%増加し、明らかに誤った方向への傾向となった。さらに、Fraimanらの解析では、Pfizer試験のワクチン群でSAE(死亡や多くの生命を脅かす状態を含む)のリスクが36%有意に高いことが示された[50]。Michelsらの解析では、ファイザー試験でBNT162b2注射を受けた被験者の心血管系のSAEがプラセボに比べて4倍近く増加していることが判明したが、この事実は2020年12月のロールアウト時には一般に報告されなかった[54]。これらの重大な懸念にもかかわらず、モデルナ製剤はファイザー製剤と比較して、さらに頻度の高いAEを示している[116-120,135]。両mRNA製剤は、虚血性脳卒中、脳出血、急性冠症候群、および生命予後を低下させることが知られているその他の疾患のリスク増加と関連していた。
このような背景から、特にNNVの高さ(COVID-19による1人の死亡を予防するのに必要な接種回数は約52,000回)を考慮すると、FDAがわずか20週間の観察期間後にCOVID-19 mRNAワクチンを「安全かつ有効」と宣言し、世界中に配布することを決定した根拠は、せいぜい疑わしいとしか思えない。実際、COVID-19 mRNAワクチンは、Fraiman研究によって800人に1人のSAEが発見された後、市場から撤退したと予想される。1976年の豚インフルエンザワクチンは、約10万人に1人の割合でギラン・バレー症候群と関連したため、製造中止となった[250]。ロタウイルスワクチンのロタシールドは、接種者10,000人に1人か2人に腸重積症がみられたという報告を受けて中止された[251]。mRNAワクチンの場合、FraimanのチームはFDAとEMAの双方に予備的知見を報告した。Fraimanのチームは、FDAとEMAの双方に予備的知見を報告し、両機関の指導者はチームと面談し、分析結果を修正するフィードバックを提供した[50]。それにもかかわらず、規制当局はその後、一般大衆に警告を発し、注射へのアクセスを制限するような行動をとらなかった。
これと同様に、Michelsらによる法医学的分析では、FDA、CDC、NIHが新医薬品の開発と安全性/有効性評価で使用する手法に重大な欠陥があることが露呈した[54]。著者らは、「米国FDAおよび他の国際的規制機関によるBNT162b2 mRNAワクチンの承認決定は、このワクチンがCOVID-19パンデミックを制御する『安全かつ有効な』手段であるという基準を満たすことを証明することを意図した、偏りのない、徹底した、透明性のある証拠の評価に基づく情報に基づいた決定ではなかった」と結論づけた[54]。ファイザー社には、FDAの意思決定プロセスに影響を与える可能性のある新情報を積極的に開示する倫理的責任があった。そうしなかったことは事実誤認を招いた。逆に、VRBPAC会議の参加者全員が、2020年11月14日からの臨床試験の死亡率データが古くなっていることを認識していたはずだと期待するのは妥当である。驚くべきことに、VRBPACのメンバーは、EUAデータのカットオフ日(2020年11月14日)から会議の日(2020年12月10日)までの間に発生したAEに関する最新情報について質問しなかった[54]。
EMAが要求し、2022年8月に公開された393ページの機密文書[114]によると、ファイザーはその時点で、ほぼすべての臓器系をカバーする約160万件のAEを文書化していた[114, 252,253]。このうち3分の1が重篤であった。多くの所見の中には、3,711件の腫瘍、264分類の血管障害(合計73,542件)、100,000件を超える血液およびリンパ系障害、127,000件の心臓障害(心筋炎および心膜炎に加えて270分類の心臓障害を含む)、77,000件の精神障害(精神病、うつ病、自殺および自殺行動を含む)、および数百分類の神経障害(合計696,508件)が含まれ、その多くは非常にまれであると考えられており、重大な危険性を明確に示している。これらの推定値は、2021年11月8日付の「規制措置の根拠概要」と題されたFDAの公式文書と顕著な対照をなしており、その中で審査委員会はファイザーとバイオエヌテックの製品を承認することを決議した[56]。この報告書の「リスク・ベネフィット評価」セクション全体は、たった一文で構成されている:「本書で提示され議論されたコミナティの安全性と有効性を支持するために提出されたデータ、およびCOVID-19の重大性を考慮すると、審査委員会はコミナティのリスクとベネフィットのバランスが良好であり、16歳以上の個人への使用を承認することを支持することに同意する」[56]。
過剰死亡率に関する国際的な分析によると、COVID-19ワクチン接種が大規模で深刻な結果をもたらした可能性がある。AarstadとKvitasteinは、2021年から2022年にかけてのヨーロッパ全域での集団予防接種に関する慎重な研究の中で、2021年のヨーロッパ全域でのCOVID-19ワクチン接種率と、その後の2022年までの毎月の過剰死亡率との間の相互作用の可能性を分析した[254]。著者らは、31カ国を網羅する十分にキュレーションされたデータセットを用いて、人口加重分析を適用し、以下のことを明らかにした:(a) 2022年の最初の9カ月間のACMの増加は、2021年のワクチン接種分布の増加と正の相関があり、(b) 021年のワクチン接種率の各パーセントポイント増加は、2022年の月次死亡率の0.105%増加(95%CI 0.075-0.134)と関連していた。Rancourtらによる広範な複数国の生態学的分析では、COVID-19ワクチン接種によって1,700万人の過剰死亡がもたらされ、世界のワクチン投与による致死率(vDFR)は0.1257±0.0035%、つまり約0.1%と推定された[251]。Rancourtの180ページに及ぶ報告書は、COVID-19ワクチン接種が多くの国で全死因死亡率のピークと同期していたことを示している[255,256]。
ほとんどの被接種者は、COVID-19による入院や死亡のリスクは極めて低いが、COVID-19 mRNAワクチン接種後のSAEのリスクは比較的高い(800回の注射ごとに1回のSAE)[50]。この不穏な二項対立は、小児期の予防接種プログラムにおいて最も顕著だが、実際には40歳未満のすべての年齢でIFRはほぼゼロである。Pezzulloらの計算では、IFRの中央値は0-19歳で0.0003%、20-29歳で0.002%、30-39歳で0.011%であった[40]。先に述べたように、パンデミック中に死亡率が過剰となった国々でも、小児の死亡率は極めて低く[43]、スウェーデンで起こったように、小児の自由登校を許可した結果、この低年齢層のCOVID-19による死亡はゼロであった[44]。このように小児に対するリスクが非常に低いことを考えると、これらの年齢層に実験的なワクチンを投与する方針を否定せざるを得ない。当時主流であった)オミクロン亜種BA.5に対して、二価のmRNAワクチンは8匹のマウスで試験されただけで、ヒトで試験されたことはなかった[257]。この認可を受けて、VRBPACのメンバーである著名なワクチン学者ポール・オフィットは、「数ヵ月後には消滅してしまうかもしれない株のmRNAを含むワクチンを接種することで、健康な若者の有症状感染をすべて予防しようとするのはやめるべきだ」と書いている[237]。入手可能な最良の証拠に基づくと、こうしたmRNA接種の潜在的リスクは、若い世代にとっては常に利益を上回っている[258,259]。このような若い年齢層では、リンパ腫[215-218]や心臓障害[57-63]などの因子が、害と見返りを比較する上で重要である。心臓のリスクに関して、潜在的な心筋障害を注意深く評価したプロスペクティブ研究によると、歩行可能な若年者が心筋炎を発症するリスクは、BNT162b2またはmRNA-1273のいずれについても、2回目または3回目の注射後に約2.5%(レシピエント10万人当たり2500人)であることが判明している[260,261]。COVID-19 mRNAワクチン後の思春期の10代の心筋炎リスク2.2%は、同じ年齢層のSARS-CoV-2感染に関連するリスク(0.06%)の約37倍である[260,262]。これらの推定値を考慮すると、この年齢層にワクチンを接種する正当な理由はない。
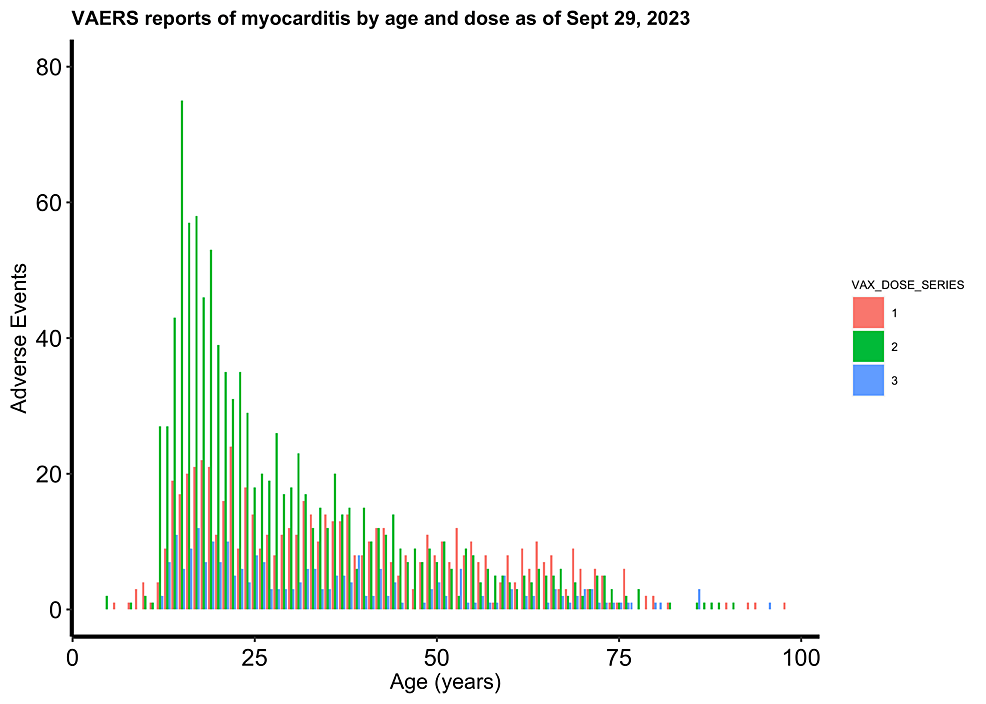
図7は、2023年9月29日現在のVAERS国内データにおける心筋炎報告に基づくグラフであり、この事態の深刻さを示している。すべての心筋炎報告が年齢と投与量(投与量1(ピンク)、投与量2(緑)、投与量3(青)に従ってプロットされている。投与2回目以降、15歳男性の心筋炎症例は5倍に増加した。年齢に関係なく、心筋炎症例は投与2回目以降に多く、これは心筋炎とCOVID-19 mRNA接種との因果関係を示唆している。このグラフに描かれたデータは、心血管系イベントとCOVID-19ワクチン接種との間に統計的に有意な関連があることを示すVAERSデータの最近の不均衡分析によってさらに補強されている[263]。
図7:2023年9月29日現在のVAERS国内データにおける心筋炎報告(年齢・投与量別プロット図
投与量1:ピンク、投与量2:緑、投与量3:青
15歳男性で2回目のCOVID-19接種後に心筋炎症例が5倍に増加したというデータがあり、全体的に2回目の接種がより多くの心筋炎症例に関連していた[263]。
VAERS:ワクチン有害事象報告システム;COVID-19:新型コロナウイルス感染症
画像出典:ジェシカ・ローズ(共著)。
若年層への悪影響は、米国の生命保険会社による2021年後半の臨時報告書にも反映されている。団体生命保険の調査データによると、2021年の第3四半期と第4四半期に、米国の一般人口の死亡率は32%上昇したのに対し、団体生命保険では40%上昇した(8%の差)[264]。団体生命保険契約者は、よく働き、若く、一般的に健康な成人であり、2016年のアクチュアリー会(SOA)の分析に基づくと、以前は米国人口の約3分の1の割合で死亡していた[264]。したがって、2021年に団体生命コホートで観察された死亡率は、これまでの傾向の逆転を意味する。Group Lifeのデータにおける過剰死亡は、2017年から2019年のベースラインのGroup Lifeのデータにおける平均死亡率を季節性で調整し、CDCのデータと組み合わせて比較することによって決定された。米国の2回目のワクチン接種が始まった第2四半期から第3四半期にかけて、SOAの分析では、25~34歳では36%、35~44歳では50%、45~54歳では52%の超過死亡率の増加が示された[264]。これらの数値は、25~54歳の年齢層における超過死亡率の巨大かつ前例のない増加を示しており、その平均増加率は46%であった(ただし、パーセンテージを平均化すると、特定の年齢コホートに対する影響の深刻さが覆い隠される傾向がある)[264]。
上述したように、これらの成人はより若く、より健康であったので、COVID-19が死亡率に実質的な影響を与えたと示唆するのは非論理的である。実際、Group Lifeの最新の報告書によると、各年齢群の過剰死亡率は「非COVID-19」死亡にのみ適用されており、COVID-19に直接起因する過剰死亡率はなかった[264]。重要なことは、25~54歳の年齢層における過剰死亡率の急増は、2021年の夏から秋にかけて軍人と病院関係者の間で米国のワクチン接種が義務化されたこととも時間的に関連していたことである[265]。2021年3月から2022年2月にかけて、40歳未満のアメリカ人の超過死亡は約61,000人で、これはベトナム戦争で失われたすべてのアメリカ軍人の命に匹敵する[266]。この悲劇は、アメリカの主要なニュースメディアでは一切報道されなかった。
こうしたワクチンによる心臓リスクの健康への影響は、2021年以降、表舞台に現れている。それ以前は、欧州のプロスポーツ選手の試合中の心停止は年平均29件であったが、35歳の現役選手を対象としたワクチン接種プログラム開始後の心停止発生率を年率換算すると、その数は年283件と約10倍に増加している[267]。選手の3分の2は蘇生されなかった[267]。最近の研究では、ワクチンの種類、接種回数、基礎疾患にかかわらず、COVID-19ワクチン接種後7日以内に発生する突然死には遺伝的基盤(SCN5A変異体)が存在する可能性が示唆されている[268]。COVID-19ワクチンを接種する前に遺伝的危険因子(例えば、MTHFR多型)を特定することで、静脈血栓塞栓症やその他のワクチンに関連した血管傷害のリスクに、より効果的に対処することができる[269,270]。
世界保健評議会は、広範なDNA汚染の問題もあり、これらの新規製品の即時モラトリアムを要求している[164]。予防的に、私たちは、COVID-19ワクチンを小児期の予防接種スケジュールから直ちに削除し、ブースターを中止するとともに、安全性評価と創設時の試験データに関するワクチン産業と規制当局の不正行為を全面的に調査するよう勧告することに同意する。COVID-19によって死亡するリスクはゼロに近いが(IFR、0.0003%)、入手可能な最善のプロスペクティブ・データに基づき、永久的な心臓障害のリスクが2.2%であることが確立されている子どもに、実験的なワクチンを投与することは、非倫理的で非良心的である。そうでなくても健康な若い人たちには、ワクチン接種後、発作、がん、自己免疫疾患、その他多数の生命を奪うような状態に陥るリスクもある。
この悲劇に関連するもう一つの側面は、平均余命の減少という知られざる物語である。多くの先進国では、平均寿命を縮める主な原因(喫煙、肥満、オピオイドの過剰摂取、殺人、自殺、乳幼児死亡)が、集団規模での早死の主な原因となっている[271]。とはいえ、COVID-19ワクチン接種に関連するいくつかのリスクが、長期的には早死ににつながる可能性があることも明らかだ。貧しい人々の間では、未治療の細菌性肺炎が平均余命を縮める主な原因であり、COVID-19ワクチン接種によってさらに悪化する可能性がある[272]。COVID-19ワクチン接種に関連した脳卒中や心筋炎は、最初の発症から数年後に早死にする可能性がある。脳卒中患者の縦断的研究によると、脳卒中発症後28日未満での死亡リスクは28%であり、1年後には41%、5年後には60%に増加した。未診断の心臓疾患や血液凝固障害は、無症状のまま何年も続くことがある。複数の剖検研究から、突然の心停止や突然死など、注射後の心臓への重篤な障害が、すべてCOVID-19 mRNAワクチンに関連しているという明確な証拠が得られている[140]。しかし、思春期の男性では、心筋炎は外見上の臨床症状は軽いものの、重度の心筋線維化(瘢痕化)を引き起こし、心筋に永久的な損傷を与えることがある[274,275]。このような損傷は、最終的にはうっ血性心不全を引き起こし、何年も経ってから死に至ることもある[276]。登録試験は、このような長期にわたる危険性を検出するには不十分であり、そのほとんどは、2年半の追跡観察と10億回以上のmRNAワクチンの後に初めて明らかになった。
また、この議論には、「Long-COVID」として知られる医学的に難治性の現象も重要である。SARS-CoV-2感染の急性期の後、疲労、ブレインフォグ、筋肉痛、呼吸困難、四肢のしびれ、胸や喉の不快感などの症状が長期間持続する人がいる。これは、自律神経失調症、脳炎、慢性疲労症候群、免疫機能障害、心血管および血液凝固異常、および複数の臓器系への影響を包含する多因子、多系統の状態である急性COVID-19後症候群(PACS)として知られるようになった[277]。PACSの特定のタイプは、症状の現れ方に基づいて定義することができる[278,279]。感染とmRNA接種(Sタンパク)の共通項があるため、COVID-19ワクチン接種により、PACSと多くの特徴を共有する長期症状が生じることは驚くにはあたらない[280,281]。この症状は、ワクチンにより生成されたSタンパクに対する免疫の過剰反応[282]によって誘発される可能性があり、注射後少なくとも6カ月間持続することが示されている[283]。ワクチン関連S-蛋白質はPACS患者でも見つかっている[284,285]。Diexerらは、PACS症例の70%がCOVID-19の完全なワクチン接種を受けた人で発生していることを観察し、注射がほとんどの症例でPACSを悪化させる可能性があることを示している[286]。PACSのリスクが最も低かったグループは、オミクロンに初感染したワクチン未接種者であった。このように、一般に信じられていることやメディアのメッセージに反して、ワクチン接種者はワクチン未接種者に比べてCOVID-19の長期的な転帰がより重篤になる可能性がある。COVID-19ワクチン接種後症候群(PCVS)、急性COVID-19ワクチン接種後症候群(ACVS)、および急性COVID-19ワクチン接種後症候群(PACVS)という、PACSに非常によく似た病態を含む、mRNA接種に関連したいくつかの新しい症候群が紹介されている[287]。国際疾病分類(ICD)の診断コードの次期バージョンには、「COVID-19ワクチン接種後の状態、特定不能」専用の新しいコードを組み込むことが提案されている[287]。
上記で述べたCOVID-19ワクチン接種後の複雑な状況に対処することに加え、継続的な反復接種がもたらす他の影響についても注意深く検討することが、私たちの生命倫理上の急務である。すなわち、(1) ウイルスの進化と耐性を最終的に加速させる外在的な選択的圧力とともに、さまざまな免疫抑制効果による注射後の収穫の減少、(2) SAE、特に主に自己免疫疾患、神経疾患、悪性疾患、心血管系疾患に起因する甚大な苦痛と早死にである。早死やその他のSAEのリスクとともに、ブースター投与を繰り返すことによるウイルスの進化と耐性への潜在的な免疫学的影響の両方を考慮することは、mRNA COVID-19ワクチン接種の包括的なリスク・ベネフィット評価にとって極めて重要であり、十分な情報に基づいた公衆衛生上の決定を保証するものである。
この叙述的レビューで紹介された研究に基づけば、世界的なCOVID-19ワクチン接種キャンペーンは重大な医療過誤とみなされるべきである。医療過誤は個人と公共の安全に対する重大な脅威であり、長い間、主要な死因を構成してきた[288-290]。誤った政治的・規制的決定が最高レベルでなされ、金銭的インセンティブに大きく影響された可能性がある。政府機関は、実験的な遺伝子ワクチンの集団的な配布を許可するのではなく、すべての合理的な治療選択肢を検討し、医療製薬業界からの圧力をそらすべきだった。もしFDAが、ファイザー試験のワクチン群でその後確認された心臓のSAE(死亡を含む)が4倍近く増加していることを認識していたなら[54]、2020年12月にEUAが成立していたかどうかは疑わしい。COVID-19ワクチンの長期安全性プロファイルの詳細な調査が今、緊急に必要とされている。このレビューで議論された多くの驚くべき事実にもかかわらず、ほとんどの先進国は、対象者全員に対するCOVID-19 mRNAブースターの継続的な採用を提唱し続けている。米国の連邦政府機関は、コロナウイルスによる重篤な疾病や死亡を減少させるワクチンの安全性を依然として強調しているが、そのような主張を裏付ける無作為化二重盲検プラセボ対照試験がないにもかかわらずである。これは、エビデンスに基づく科学的思考と公衆衛生政策との間の不可解な断絶を反映している。
結論
COVID-19 mRNA製剤の安全性を慎重かつ客観的に評価することは、倫理基準を守り、エビデンスに基づいた意思決定を行う上で極めて重要である。登録試験とEUAのその後に関する私たちの叙述的レビューは、これらの遺伝子ワクチンがいかにして市場に参入することができたかについて、エビデンスに基づいた洞察を提供するものである。2つの重要な臨床試験において、安全性は、ワクチンまたはGTP(これらの製品のより正確な分類)のいずれについても、以前に確立された科学的基準に見合った方法で評価されたことはなかった。多くの重要な試験結果は、誤情報されるか、発表された報告書から完全に省略された。通常の安全性試験プロトコルと毒性学的要件は、FDAとワクチン製造業者によって回避され、両試験の早期終了は、適切な試験評価のための時間枠が不十分であったため、潜在的なSAEの偏りのない評価を妨げた。試験を急いだことによる深刻な生物学的影響が明らかになったのはEUAの後であり、多数の心血管系、神経系、生殖系、血液系、悪性、自己免疫系のSAEが同定され、査読付き医学文献に発表された。さらに、プロセス1で製造され臨床試験で評価されたCOVID-19 mRNAワクチンは、最終的に世界中に配布された製品とは異なっていた。これまで規制当局が製造工程に関連する不純物(SV40など)を公表してこなかったため、mRNAワクチン製造工程の安全性と品質管理監督に関する懸念がさらに高まっている。
2021年初頭から、過剰死亡、心筋梗塞、脳卒中、その他のSAEは、COVID-19 mRNAワクチン接種のせいではなく、COVID-19のせいであるとしばしば誤って認識されてきた。SAEのCOVID-19への誤認は、mRNAワクチンの後にSARS-CoV-2亜型に感染すると副作用が増幅されることが原因であることが多い。mRNA製剤による傷害は、PACSと重篤なCOVID-19急性疾患の両方に重なり、しばしばワクチンの病因的寄与を不明瞭にしている。複数回のブースター注射は免疫機能不全を引き起こし、その結果、逆説的に連続接種によりCOVID-19感染に対する感受性を高めることになるようだ。50歳未満の成人の大部分にとって、mRNAブースターの有益性は、その潜在的な障害や生命を脅かす害よりもはるかに大きい。高齢者に対する潜在的な害も同様に過大であるように思われる。十分に文書化されたSAEと容認しがたい害対利益の比率を考慮すると、私たちは各国政府に対し、因果関係、残存DNA、異常タンパク質産生に関するすべての関連する疑問が解明されるまで、これらの改変mRNA製品の世界的なモラトリアムを支持し、実施するよう強く求める。