Contents
pubmed.ncbi.nlm.nih.gov/3003799/
SV40 Promoters and Their Regulation
注:古い論文からのOCR、文字起こしのため誤字、誤訳が多いと考えてください。
要旨
シミアンウイルス40(SV40)はパポウイルスグループの小型がん原性ウイルスで、動物や細胞培養の非許容性げっ歯類細胞を腫瘍化する(総説は1参照)。このウイルスは「寛容な」サルの腎臓細胞で増殖サイクルを行う。ウイルスは5243塩基対(bp)の小さな二本鎖環状DNAゲノムを持ち、その塩基配列は完全に知られている(2,3)。ウイルスゲノムは4つの細胞ヒストンH2A、H2B、H3、H4と複合体化し、感染細胞内でミニクロモソームの形で現れる(4)。ウイルスゲノム中の5〜6個の遺伝子は、細胞内のRNAポリメラーゼIIによって転写される(5, 6)。SV40転写産物の転写後プロセシングは細胞性RNAのそれと類似しており、「キャッピング」、ポリアデニル化、スプライシング、内部メチル化が含まれる(7-11)。SV40はまた、真核生物系における遺伝子発現の基本的なメカニズムのいくつかを理解するためのモデルとしても役立ってきた。
* 現職: 現住所:Division of Molecular Biology and Biophysics, School of Basic Life Sciences, University of Missouri-Kansas City, Kansas City, Missouri 64110.
t 米国エネルギー省との契約DE-AC05- 840R21400の下、Martin Marietta Energy Systems, Inc.により運営されている。
はじめに
許容細胞におけるSV40の溶菌サイクルは、2つの時間的に制御された段階で発現される(I)。「初期」遺伝子発現は感染後まもなく始まり、Tとt(「大きなT」と「小さなt」)と呼ばれる2つの腫瘍抗原を生じる。これらのタンパク質の合成は、溶菌サイクルを通して制御された様式で継続する。「後期」遺伝子の高レベルの発現は、一般に感染後約12〜16時間のウイルスDNA複製の開始まで遅れ、「大きなT」の合成はウイルスDNA複製に必要である。後期段階に豊富に存在する後期領域mRNAは、子孫ビリオンを形成するのに使われるウイルスカプシドタンパク質VP1、VP2、VP3を産生するのに必要である(12)。ウイルスカプシドタンパク質に加えて、「アグノプロテイン」と呼ばれるマイナーなタンパク質も後期に産生される(73, 14)。初期遺伝子産物の一つであるラージTはオリジン領域と相互作用し、初期転写の自己制御、DNA複製の開始、後期転写の刺激など、SV40の発生サイクルにおいて制御的役割を果たす(75-22)。初期および後期遺伝子の時間的制御により、まずウイルス感染とDNA複製の確立に必要な遺伝子の発生的発現が可能になり、次に新しく合成されたウイルスDNAをカプセル化するのに必要な構造タンパク質の合成が可能になる。
SV40に関するデータを含むパポバウイルスの総説が数年前に出版された(7, 23, 24)。それ以来、我々は制御領域の一般的な構造の理解、プロモーターエレメントの同定、およびこれらのプロモーターからの転写制御におけるそれらの役割の理解に向けて、大きな進歩を遂げた。この論文の目的は、SV40の複雑な制御領域に関する我々の理解の現状を記録することである。これは他の多くの真核生物系で働く制御機構のモデルとして役立つであろう。
I. SV40の制御領域
SV40の制御領域(図1)は長さ420bpで、ヌクレオチド位置5171と346の間に位置するHindlll-Hpall断片に含まれている(25)。このDNAは、感染の初期と後期で分岐して転写される2組の遺伝子のコード配列の間に位置している。感染細胞内のこの領域の大部分は一般にヌクレオソームがない(26)。この領域には、完全な27bpの回文、17bpの(A + T)リッチ配列、3コピーの(G + C)リッチ21bpリピート、そして最も上流のセグメントには2コピーの72bpリピートが連続して存在する(2, 3)。コア”複製起点(ori)を含むセグメントは、短いセグメントで両側を挟まれた27bpの回文構造が特徴である(16,27,28)。初期および後期mRNAの5’末端に相当する配列がこの領域内にあり、初期および後期転写のプロモーターもこの領域内にある(29,30)。この領域内には、ラージTに対する3つの密接な間隔を置いた結合部位(I、II、III)が同定されており、ウイルスDNA複製の開始と遺伝子発現の制御に関与していると考えられている(15-22)。
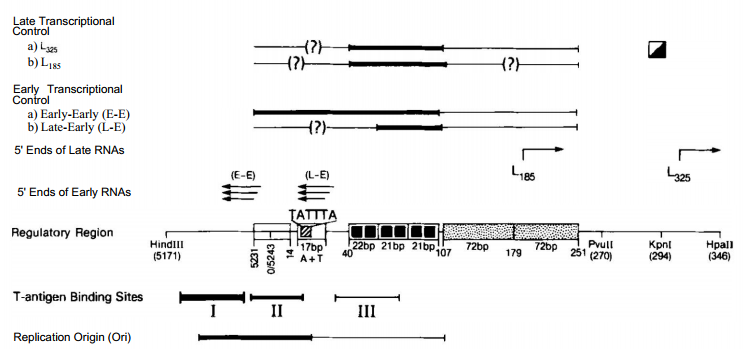
図1. SV40ゲノムの制御領域(ヌクレオチド位置5171と346の間のHindlll-Hpall断片)。この領域の構成要素は、27bpの回文(5231位から14位)、TATAボックスを含む17bpの(A + T)-ricb領域(E233)、(G + C)-リッチモチーフを2つ含む1つの不完全な21bpリピートと2つの完全な21bpリピート(□)、2つの72bpリピート(D)である。感染初期(E-E)と感染後期(L-E)の初期RNAの5’末端(3本の矢印)と、185位(Li85)と325位(L325)から始まる2つの主要な後期RNA(右の1本の矢印)をマークした。DNA複製に関与する領域、あるいは初期プロモーターと後期プロモーターの効率制御に関与する領域は太線と細線で示した。境界線はおおよそのもので、主な不確定要素には疑問符(?) (3)はL325 RNAの開始効率を制御するTATA-box様領域を示す。3つのT-抗原結合部位(I、II、III)のおおよその境界がマークされており、太字の度合いはその領域への結合親和性を反映している。
SV40初期プロモーターはプロトタイプのRNAポリメラーゼIIプロモーターであり、その組織と制御は後期プロモーターよりもよく理解されている(31-39)。一方、後期プロモーターは、後期プロモーター全体を含むDNAセグメントにはプロトタイプのプロモーター様エレメントを持っていない(40-45)。SV40の制御領域は、どちらの方向にも連結されており、他の異種遺伝子を駆動することができる(21,46)。最近、この性質を利用して、一過性の生体内試験アッセイで容易にアッセイできるマーカー遺伝子と融合させることにより、この領域内の異なるプロモーターエレメントの突然変異解析が行われるようになった。ラージTは精製され、オリジン領域に結合し、生体内試験で初期転写を制御することがわかっている(15, 31, 47-49)。これらの実験的観察により、いくつかの共通要素を持つ2つの異なるクラスのプロモーターの制御に関する研究が容易になった。
A. 初期プロモーターの組織
SV40初期プロモーターは少なくとも3つの空間的に異なる要素を含んでいる: (1) エンハンサー配列を構成する2つの72bpの繰り返し;
(2) それぞれが2つの(G + C)リッチモチーフを含む3つの21bpの繰り返し;および(3) TATAボックスまたはGoldberg-Hognessボックス。各要素の機能的意義については後述する。
1. 「エンハンサー」配列
エンハンサーの定義は、RNA開始部位に対する位置や方向とは無関係に、多様な遺伝子の転写を増強することができる、シス作用を持つDNAの短い伸長である。これはSV40において、107位と251位の間に位置する2つの72bpの繰り返しからなる144bpのセグメントとして最初に同定された(34,35)。2つのリピートのうち1コピーだけを欠失させてもその活性は失われないが、両方を欠失させると一過性アッセイで測定される初期転写が劇的に減少する(34,35)。RNA開始部位から数kb離れた様々な位置に、72bpのリピートをどちらかの方向に再挿入すると、転写はほぼ回復する(50, 51)。このエレメントはまた、同じプラスミド中に少なくとも1つの72-bp配列が存在すると、異なる細胞遺伝子の転写レベルを増加させる(52-55)。初期の試験管内試験実験では、生体内試験で観察されるエンハンサー配列の効果を再現することはできなかった。その後、このエレメントは、少なくとも部分的には、試験管内試験で同種および異種のプロモーター上で機能することが証明された(56-58)。
SV40の2つの72bp配列のうち1つで初期転写の完全な増強には十分であるため、なぜこのエレメントが重複しているのかは理解されていない。他のいくつかのウイルスのエンハンサー領域にも繰り返しがあることから、このエレメントの機能には配列の重複が重要なのかもしれない。SV40エンハンサーは無傷のユニットとして最も効率的に機能しているように見えるが、微細構造のマッピングから、配列の一部がより重要な役割を担っている可能性が示されている(32, 35, 59)。
SV40以外にも、エンハンサー配列はポリオーマウイルス(60-62)、JCウイルス(63)、ウシ乳頭腫ウイルス(64)、アデノウイルス(65,66)、BKウイルス(67)などの他のウイルス系にも存在し、またRNAウイルスやレトロウイルスの長期反復配列(LTR)内にも存在する(68,69)。[全てのエンハンサーに関する包括的な総説は、最近のシンポジウムに掲載されている(70)。例えば、SV40の72bpのセグメントをモロニーマウス肉腫ウイルスの72/73bpのリピートで置き換えると、生存可能なウイルスが生成される(68)。エンハンサー配列は多くの細胞遺伝子、例えば免疫グロブリン重鎖遺伝子(71-73)、マウスやヒトのゲノムライブラリー(67)にも存在し、時にはイントロン内にも存在する(71, 73)。SV40のエンハンサーと他のDNAおよびRNA腫瘍ウイルスのエンハンサーとの間の配列相同性を比較することにより、以下の「コンセンサス」エンハンサー配列が導き出された(59): (g)tggaaa/ttt(g). この配列だけではエンハンサー活性には不十分であるが、制御因子と相互作用するコアとして機能する可能性がある。
現在、いくつかのモデルが提案されているが、エンハンサー機能の分子基盤についてはほとんどわかっていない。このエレメントは位置や方向とは無関係に機能するので、厳密な定義ではプロモーターエレメントではない。このエレメントはRNAポリメラーゼIIのための双方向性進入部位を提供するかもしれないし(50, 60, 74)、クロマチン構造を制御することによってプロモーターを活性化するかもしれない(32, 75)。後者の考えは、72-bpの繰り返し配列が様々なヌクレアーゼに対して感受性が高く(76, 77)、ヌクレオソームが存在しないという観察から支持される(26) 。最後に、エンハンサー配列は、RNAポリメラーゼIIによって認識されるDNA構造のための微小環境を作り出すかもしれない。最近、SV40のDNAが負のスーパーコイルを形成しており、転写エンハンサー配列内にZ-DNAセグメントが存在し、それが転写活性化に関係している可能性があることが示された(78)。
興味深いことに、異なるエンハンサーの機能的活性は、宿主(69)や導入される組織(72, 73, 79, 80)によって異なる。この宿主および組織依存性は、エンハンサーの一次配列の機能か、エンハンサーエレメントを認識する特異的な細胞性因子、あるいはその両方が関与している可能性がある。最近の研究では、エンハンサー機能に必要な細胞因子の存在が証明されている(81)。
2. UpstreAm (G + C)-riChモチーフ
np40と103の間に、GGGCGGRR(Rはプリン)という構造の(G 4-C)リッチモチーフを2つずつ含む21bpのリピートが3つある。この配列のCリッチ鎖は早期mRNAの極性に存在し、Gリッチ鎖は後期mRNAの極性に存在する。このエレメントは、感染初期の主要なRNA開始部位から約50bp上流に位置する。
感染初期の主要なRNA開始部位から約50bp上流に位置するこのエレメントは、初期プロモーターの2番目の重要なエレメントを構成している(31-33,37, G. C. Das, 未発表)。しかし、この領域に含まれる様々な配列の研究により、結論は一貫していない。欠失変異体の研究から、初期プロモーターの最大機能にはGGGCGG-リピートのうち少なくとも2つが必要であり、6つのうちどの2つでも等しく有効であると結論された(81a)。これらの結果は、SV40初期プロモーター活性が、6つの(G 4-C)リッチモチーフのうち4つを欠失させると少なくとも3-4倍減少することが見出された、別の変異体セットとアッセイ法を用いて得られた結果とは異なっている(37, G. C. Das, 未発表)。さらに、(G + C)リッチモチーフの点変異体を用いた研究では、これらのリピートのいずれかに1つのC T転移があるだけで、生体内試験で21bpのリピート領域のプロモーター機能を損なうのに十分であることが示された。しかしながら、この効果は試験管内試験では再現されない(37, 57)。
この(G-I-C)リッチエレメントのもう一つの興味深い特徴は、72bpリピートと同様に双方向に機能できることである(37, 43, 57)。完全なSV40起源領域の初期プロモーター活性は、21-hpリピートの向きが逆になると、2分の1にしか低下しない(37, 57)。このエレメントが初期プロモーターの重要な部分であることを直接的に証明したのは、SV40プロモーター特異的因子Splの同定と精製であり、この因子はこの領域に特異的に結合し、再構成試験管内試験系で初期転写に必要である(82, 83)。
TATAボックスの上流に位置するDNA配列は、様々なウイルスや細胞のプロモーターで解析されている(84)。明らかな配列相同性は見られないが、これらの領域はG-C対に非常に富んでいるようである。この領域は細菌プロモーターの認識配列(-35bp領域)に相当すると考えられている(85, 85a)。RNAポリメラーゼによるこの領域の認識が、Splのような因子によって媒介されるかどうかは、まだ決定されていない。この領域にこのような因子が結合すると、SV40クロマチンが活性型コンフォメーションに変換され、両方の方向で転写を開始できるようになるかもしれない。このような鋳型の構造変化は、DNase Iの過敏部位を作ることによって認識される(85a)。
このユニットの双方向性は、後述するように、後期転写への関与にも必要なようである。21bpの繰り返し領域が後期転写に及ぼす影響は、開始点からの距離が長くなるにつれて著しく減少するが、220bpの距離ではまだ検出可能である(57)。また、SV40の21-bp反復領域は、生体内試験でも試験管内試験でも、異種TATAボックスエレメントからの転写を活性化できることも注目に値する(86, R. Hen and N. Miyamoto, unpublished)。このように、21bp反復領域はエンハンサーエレメントと3つの特徴を共有している:双方向性、離れた場所での作用、異種プロモーターの刺激である(37, 43, 57, 86, 87)。
3. TATAボックスまたはGoLDBerG-HoGnessボックス
SV40初期プロモーターの3番目のエレメントは、16位と21位の間にあるTATA配列またはGoldberg-Hognessボックス、TATA(A/T)A(T/A)である。他のTATAボックスとは異なり、このエレメントは17bpの(A+T)リッチ領域に埋め込まれている。このエレメントは、SV40初期プロモーターだけでなく、他の多くの真核生物プロモーターにおいても、RNA開始部位から約25-35ヌクレオチド上流に位置している。このエレメントは次のように機能する。(1) 生体内試験でも試験管内試験でもRNAの5’末端を固定する1つのエレメントとして機能する。この配列を欠失させると、RNA合成の開始部位が不均一になり、TATAボックスより下流の配列を欠失させると、TATA配列から約25ヌクレオチド下流に位置する新しい開始部位が生じる(35, 36, 81 a, 88, 89)。(2)SV40のTATAボックス内の点変異が転写レベルを劇的に低下させるように、転写効率を制御している(90)。同様の転写阻害は、オバルブミン、コンアルブミン、絹フィブロインのTATAボックス、アデノウイルスの主要後期プロモーターでも観察された(92-94)。しかしながら、このような転写レベルの低下は、必ずしも新しい転写開始部位を作り出すわけではない。これらは、転写機構がおそらくTATAボックス領域と相互作用していることを明確に示している。HeLa細胞に存在するある因子がTATAボックス領域と相互作用し、試験管内試験での転写開始に必須であることから、この命題は正当であると思われる(95)。
TATAボックスを含む欠失変異体の解析から、多くの場合、TATAボックスは生体内試験や試験管内試験での転写効率を制御していないという結論が導き出された(32, 43, 51)。欠失変異体に関する観察は、かなり慎重に解釈されるべきである。なぜなら、大きな欠失は、TATAボックスと一緒に他の制御配列を除去するだけでなく、他の配列を一緒にする可能性もあるからである。このような新たな結合は、異なる制御的役割を持つ他の機能的要素を作り出すかもしれない。TATAボックスの役割に関しては、TATAボックス内の点変異や微小欠失で得られたデータの方がより有意義であると我々は考えている。したがって、TATAボックスは、少なくとも部分的には細菌プロモーターの”Pribnow “ボックスと同様の機能を果たしているが、後者はRNA開始部位にやや近い位置にある。
試験管内試験と生体内試験の結果を比較すると、文献に見られるもう一つの矛盾が観察される。SV40初期プロモーターを含むほとんどのプロモーターにおいて、TATAボックス近傍のDNA配列の変化は試験管内試験での転写に顕著な影響を及ぼすが(96-100)、生体内試験での効率を制御する重要な配列はさらに上流に位置している(35,36,101-103)。これらの矛盾は、以下の考察によって説明できる。試験管内試験系では鋳型は抽出液中に存在するタンパク質と核タンパク質複合体を形成する可能性があるが(104)、認識過程ではおそらく一次DNA配列の方がより支配的な役割を果たしている。しかし、生体内試験では、一過性のアッセイでも長期のアッセイでも、鋳型DNAは全細胞抽出液中で転写されるDNAよりも整然とした核タンパク質構造をとっている。プラスミドpBR322に含まれるSV40起源領域は、トランスフェクション直後のCOS細胞でヌクレオソーム構造をとるが、これはBSC-1細胞感染後期に調製されたSV40クロマチンのそれと類似しており、同様のDNase I過敏部位が存在することから判断できる(105)。後期タンパク質はこの領域のクロマチン構造を変化させない(105)。
原核生物系では、”Pribnow box”(-10bp領域)や”-35bp領域”のような必須プロモーターエレメントは、RNA開始部位から50bp上流に位置している。突然変異解析によると、大腸菌RNAポリメラーゼはこれら2つの領域に同時に接触しており(85)、スペーサーの長さ17bpは、遺伝子発現効率を最大にするための「コンセンサス」長に非常によく適合している(106)。真核生物のTATAボックスは原核生物のPribnowボックスと構造的に非常に似ており、RNA開始部位からやや上流に位置している。一方、6つの(G + C)リッチ配列は、RNAポリメラーゼIIおよび/または他の因子の認識配列として働く可能性があり、細菌プロモーターの-35bp領域に類似していると考えられている(32, 33)。従って、TATAボックスと(G + C)-リッチ配列の間の領域は、原核生物のプロモーターになぞらえて「スペーサー」と呼ばれるかもしれない。RNAポリメラーゼIIとこの領域との相互作用の分子的詳細については、まだよくわかっていない。突然変異解析から、38位から41位までのTATAボックスと(G + C)リッチ領域の間の狭い領域が、生体内試験および試験管内試験における初期プロモーターの重要なドメインであるようだ(107)。この領域の欠失変異体や挿入変異体の解析から、RNAポリメラーゼIIや他の転写因子がTATAボックスと(G + C)リッチ領域と同時に相互作用することが示された(107)。さらにこの研究は、原核生物系で観察されるように、これら2つのドメイン間に最適な間隔が必要であることを示唆しているが、これは生体内試験でのみ正確に反映される(107)。
4. EARLYプロモーターのオーバーラッピング
溶菌感染の後期には、初期転写に使われる開始部位に変化が見られる(108)。ウイルスDNA複製が始まる前に、転写産物は5’末端がオリジン領域(ori)の27-bpインバーテッドリピートから5231-14位の下流にマッピングされて現れる。5’末端の位置は、約25bp上流のTATAシグナルによって決定される。ウイルスDNA複製の開始後、下流RNAの産生は減少し、5’末端がTATAボックスから約20bp上流に位置する新しい初期領域RNAのセットが出現し、感染後期に優勢な種となる(39, 108)。これらのRNAがタンパク質に翻訳されるかどうか、あるいはウイルス増殖の生物学的制御において特別な役割を果たすかどうかは不明である。この発見は、初期プロモーターが以前予想されていたよりも複雑であること、そして2つの重複したプロモーターから構成されている可能性を示している。1つは感染のごく初期に作動する初期-初期(E-E)プロモーターで、もう1つは感染の後期に作動する後期-初期(L-E)プロモーターである。
最近、突然変異解析によってこの2つのプロモーターを分離する試みがなされている(38, 90)。E-Eプロモーターのエレメントは、TATAボックス、6つの(G 4-C)リッチモチーフすべて、および72bpのエンハンサーと思われるが、L-Eプロモーターのエレメントは最後の4つの(G -I- C)リッチモチーフと72bpのエンハンサーのみである(38, 90)。L-EプロモーターのTATAボックス様配列はまだ同定されていない。ある研究では、L-Eプロモーターからの転写は、72bpのリピートがなくても影響を受けなかった(39)。E-EとL-E RNAの合成は、DNAの複製がなくても開始できる(38, 90)。DNA複製とE-Eプロモーターからの転写を減少させるTATAボックスの変異は、L-Eプロモーターでの転写を劇的に増加させる(38, 90)。しかしながら、他の研究では、L-Eプロモーターからの転写を増強させるには、DNA複製または増幅が必須であることを示している(39)。両プロモーターの機能における個々の(G + C)リッチモチーフの役割は、まだ明らかにされていない。
L-E RNAの生理学的機能と2つの初期プロモーターの制御は解明されていない。上流部位からの転写はoriを介して進行するので、上流プロモーターがウイルスDNA複製の活性化に関与している可能性がある。oriでDNAらせんを開いてDNAプライマーゼによる開始を可能にするか、oriでL-E RNAを切断してRNAプライマーとして機能させるかのいずれかである(39,109,110)。このRNAには、T抗原コード配列の開始部位より上流にオープンフレームがある(39)。この付加的な読み枠は23アミノ酸のタンパク質をコードしている可能性があるが、まだ同定されていない。この小さなタンパク質は、感染後期に必要とされる機能を提供するかもしれない。最近、SV40 16S後期RNAのリーダーセグメント内にコードされる同様のタンパク質(”agnoprotein”)が同定された(14)。
B. 後期プロモーターの組織
SV40後期プロモーターは、その活性化のために異なったシグナルと異なった機構を用いている。後期遺伝子の時間的発現だけでなく、後期転写の効率調節にも関与すると思われる制御エレメントは、まだ定義されていない。SV40後期転写は約220bpの領域にわたっていくつかの部位で開始されるが、主要なものは325番目の部位である。185位の第二の部位は生体内試験では非効率的であるが、HeLa細胞抽出液では試験管内試験で重要な開始部位である(30, 41)。一連の欠失変異体を用いた突然変異解析から、2つの重複したプロモーターが存在し、それらは順に初期プロモーターと重複していることが示された(32, 43,45; G. C. Das, 未発表)。
185位(Liss)で開始する後期RNAのプロモーターは、開始部位から100bp上流のDNA配列を必要とし、これには21bpのリピートが含まれる(32, 45)。この領域は初期プロモーターのプロモーター特異的因子Splが結合する領域でもある(83)。325で転写を開始する主要な後期プロモーターについては、このプロモーターからの転写効率を制御する2つのドメインが同定されている(41-45)。これらのドメインの一つは、RNA開始部位の約25bp上流に位置する11bpのDNA配列GGTACCTAACCである(41)。これは代用TATAボックスのように働き、同等の役割を果たしているようである(41)。41遺伝子の解析から得られたTATAボックスの「コンセンサス」配列はTATATAATAである。29、-28、-27、-26、-24の位置(5’末端のTは-29の位置)で配列特異性が高く保存されている(88)。5’開始点から-29と-28の位置にある代用TATAボックスに1塩基の変化を導入すると、試験管内試験での転写レベルは野生型の半分にまで低下する(111)。この配列をSV40初期遺伝子を駆動するのと同じ配列に段階的に変化させると、転写が段階的に促進される(111)。
試験管内試験で作動するL325プロモーターのもう一つの重要なドメインは、(G + C)リッチセグメント内部の遥か上流に位置している(42, 43, 45, 57)。L325転写の完全発現には、6つの(G-I-C)リッチモチーフのうち3つが必要である。さらに(G -I- C)-リッチモチーフを欠失させると、プロモーター活性は急激に低下する。6つの(G 4- C)リッチモフィットを含む領域は、E-E、L-E、L325、およびプロモーターの両方の必須部分を構成している(38, 39, 42-45, 57; G. C. Das, 未発表)。この領域の効果は、開始点からの距離が長くなるにつれて著しく減少する(86, 87)。たった21bpの領域が、E-E、L-E、後期オーバーラッププロモーターで共有されるのは、非常に複雑であるように思われる。この疑問に答えるには、この(G + C)リッチセグメントの突然変異解析が必要である。
試験管内試験における後期遺伝子の転写には、主要な開始部位から250bp以上にわたる配列が必要である(42, 43, 45, 57)が、初期遺伝子がプロモーター活性のために開始部位から上流に約100bpしか必要としないのとは異なる(31-39)。初期プロモーターと後期プロモーターがこのように異なる配列を要求する理由は分かっていないが、これらの違いがSV40転写の時間的制御に関与している可能性がある。初期プロモーターからの生体内試験イニシエーションで重要な役割を果たすエンハンサー配列が、後期プロモーターからの効率的イニシエーションではそれほど重要でないかどうかは、まだ証明されていない。しかしながら、このエンハンサーはL325からの転写を約2-3倍刺激することが報告されている(44, 57)。
II. ラージT抗原のDNA結合特性
SV40の2つの初期遺伝子産物のうち、「スモールT」の溶解サイクルにおける役割は分かっていない。もう一つの「ラージT」抗原は、ウイルス複製の開始、初期転写の自己制御、後期転写の刺激などのプロセスで重要な役割を演じている(15-22)。ラージTは分子量96,000のリンタンパク質で、関連するATPアーゼ活性を持つ(112)。しかし、その生化学的特性の中でも、配列特異的なDNA結合活性に強い関心が寄せられている。Tのこの特性は、制御タンパク質としての作用機序の可能性を直ちに示唆しているからである。
結合研究のために、TはSV40感染サル細胞(溶菌T)(113-117)、SV40形質転換ヒト細胞(SV80)(118,119)、アデノとSV40のハイブリッドウイルス(Ad2 + D2)(D2)(15,117)、またはハイブリッドウイルスAd-SVR6(T)(120)で感染させたHeLa細胞など、様々なソースから精製されてきた。初期の結合実験のほとんどは、アミノ末端が約10%のAd2タンパク質、カルボキシ末端が90%の真正T抗原からなるハイブリッドD2Tタンパク質を用いて行われた(121)。DNase 「フットプリンティング」、フィルター結合、メチル化保護アッセイにより、D2タンパク質はSV40 DNA上の120-140 bpの領域にわたってI、II、IIIと名付けられた3つの密接に間隔を置いた部位に結合することが示された(15)(図1)。この領域はDNA複製の起点と、SV40の初期プロモーターと後期プロモーターの全てではないにせよ、一部にまたがっている。別の研究で、このタンパク質の付加的結合部位が、部位IとTのAUGコドンの間に位置している(117)。真正のTを用いた結合研究では、部位Iと部位IIの存在は証明されているが、部位IIIは検出されていない。これはおそらく試験管内試験アッセイで使用したTの量が限られていたためであろう(122)。
これらの部位に対するTの結合親和性は、部位I>>部位II>部位IIIの順に増加する(15)。初期の実験では、相互作用の協同的性質が支持されていたが(15,117)、最近では、異なる結合部位を順次欠失させた変異体を用いた研究に基づいて疑問視されている(123)。多くの点で類似しているが、D2タンパク質の結合は野生型Tの結合よりもNaCl濃度に敏感である(124)。真正T抗原のサイトII結合は、ウイルス複製起点の27bpの回文配列にまたがり、IIAとIIBの2つのサブサイトに細分することができ、IIAはサイトIIの初期部分である。IIAのTに対する親和性はIIBのそれよりも大きく、複製開始配列の主要部分(サイトII)へのTの結合は、少なくとも2つの相互作用の産物であることを示している(122)。
SV40ラージTとSV40ゲノムの結合部位IおよびIIとの間の必須ヌクレオチド接触は、試験管内試験のメチル化およびエチル化干渉実験から推測されている(123)。各結合部位には、らせんの約4回転を隔てた2つのグアニン接触クラスターがあり、4つのG接触クラスターはすべてDNA二重鎖の限られた領域に局在している。Gクラスターのうち3つは二重らせんの一方の面からアクセス可能であり、第4の接触グループはサイトIの初期側に位置し、他の3つに対して約30°回転している。これらの認識部位の配列はコンセンサスファミリーG/TGGGCに対応しているが、これらのペンタヌクレオチドブロックのすべてが必須接触点を含んでいるわけではない(123-125)。部位IIIとの結合の分子的な詳細はまだよくわかっていないが、この部位が初期プロモーターの重要な21bpの繰り返し領域と重なっていることは知られている(15,117)。
タンパク質-DNA複合体の電子顕微鏡観察から、ラージTの4量体がそれぞれの部位に結合していることが示唆されるが、溶液中では精製されたD2タンパク質は単量体から12量体まで様々な凝集体で存在する(126)。Tが結合してもDNAのらせんピッチは変化しない(127)。TのDNA結合特性がその様々な物理的状態に依存しているのか、あるいは古いT抗原と新しいT抗原の間に生化学的あるいは構造的な違いがあるのかは分かっていない。ある研究においてのみ、新しく合成されたT分子は古いT分子よりもSV40起源領域に対する親和性が高いことが示されており、また異なる程度にリン酸化されたT分子はDNAとの親和性が変化することが示されている(128)。
III. 転写の制御
A. 初期転写の制御
t抗原とT抗原をコードするSV40の初期遺伝子は、ウイルスDNA複製の開始前に転写される。Tは96時間まで指数関数的に合成され続け、細胞核に蓄積される(129, 130)。この遺伝子の温度感受性変異体(tsA変異体)は、非許容温度でDNA合成の開始に機能しない熱不安定性Tを産生し、DNA合成における正の役割を示す(129, 130)。一方、制限条件下でtsA変異体に感染した細胞では、野生型ウイルスに感染した場合よりも、このタンパク質の合成速度が速い(130)。このことは、Tが初期遺伝子の転写、すなわちそれ自身の合成を制御していることを強く示している。Tによる自己制御を確認する他の研究によると、tsA変異体は許容温度下でも初期RNAを過剰に産生し、その影響は非許容温度への移行で大きく拡大する(19, 131)。自動調節機能の喪失は、RNA合成の開始の阻害というレベルである。
In vivoでの突然変異解析から、Tに対する親和性が最も高い部位Iへの結合が、Tを介した自己制御に十分ではないにしても必要であることが示された(132)。自己調節におけるTの役割は、初期転写の抑制によって試験管内試験で直接証明されている(47-49)。一つは結合部位IIを33bpの細菌DNA断片で置換した変異体を用いた試験管内試験での観察であり、もう一つは部位Iと部位IIの欠失変異体を用いた生体内試験での観察であり、これらの部位が自己調節に関与していることが明確に示された(49)。以前は、Tに対する親和性が最も低い結合部位IIIは、初期の転写には関与していないのではないかと考えられていた。なぜなら、この部位の欠失はウイルスの正常な発育に影響を及ぼさなかったからである(132)。この部位の塩基置換による変異解析から、この部位もおそらくTをこの領域に結合させることによって、自己制御の役割を果たしていることが示された(107)。
以下の証拠は、Tによる制御が鎖の伸長や終結の間ではなく、転写の開始のレベルで起こることを示している。(1) T結合部位を下流に挿入した異種プロモーターからの試験管内試験転写はTによって阻害されない(31)。(2)結合部位IIIは、RNAポリメラーゼII(DNA指向性RNAポリメラーゼ、EC2.7.7.6)の認識配列として機能すると思われる初期プロモーターの重要な部分と重なっている。従って、T抗原とRNAポリメラーゼIIは同じ部位を競合し、その結果、転写開始が阻害される可能性がある(107)。
(3)T抗原が結合すると、この領域の安定性が増し、転写開始前の二重らせんの局所的な融解に不利になる可能性がある(31)。正確なメカニズムはともかく、初期転写を最大限に抑制するためには、3つの部位全てへの結合が必要であるようだ(49, 107, 132)。
Xリプレッサーによる抑制のメカニズムには、DNA結合に関してRNAポリメラーゼと直接競合する部位へのリプレッサー分子の協調的結合が含まれる(133)。しかし、転写を阻害するためには、どちらかの部位を占めれば十分である。初期の研究では、これらの部位へのTの結合は協力的であるとされていたが、最近の研究では逆のことが示唆されている(15, 117, 123)。SV40プロモーターにRNAポリメラーゼが結合する部位はまだマッピングされておらず、結合が何らかの因子によって媒介されているかどうかはまだ明らかにされていない。少なくとも1つのプロモーター特異的因子であるSplは、T結合部位IIIの一部でもある(G + C)リッチな21bpリピートに結合する(83)。最近の研究によると、転写装置はTATAボックスと結合部位IIIの(G + C)リッチ領域と同時に接触する可能性がある(107)。Tが結合部位をめぐってSplと競合するのか、ポリメラーゼIIと競合するのかはわかっていない。
T抗原による初期転写の制御にはもう一つのレベルがあるかもしれない。感染後期には、初期RNA転写産物(L-E RNA)の合成に新しい開始部位が使われる。これらはE-E RNA転写産物から約40bp上流にあり、T結合部位IIとIIIの接合部にあるものもある(39,90,108)。以前は、この切り替えはTがIとIIの部位に結合することによって行われると考えられていた(90, 108)。最近のある研究によると、これはTの存在による直接的な結果ではなく、DNA複製がこのearly-tolateスイッチに必須であることが示されている。従って、TはDNA複製における役割から間接的に関与しているに過ぎない(39)。L-E RNAが完全にタンパク質に翻訳される鋳型として使われるのか、あるいは先に述べたような他の生理的機能を果たすのかはわかっていない(セクションI,A,4)。
E-EプロモーターとL-Eプロモーターの関係や、SV40の発生サイクルにおいてT抗原がこの2つをどのように制御しているかは分かっていない。これら2つの重複するプロモーターからの転写は、ウイルス感染の2つの段階、すなわちウイルスDNA複製の開始前と開始後に起こる事象と協調していることは明らかである。ウイルス機能への影響に加え、TはリボソームRNA、ヒストン、DNA代謝に関与する酵素の合成など、様々な宿主細胞の代謝機能を誘導する。おそらく、E-Eプロモーターの高効率は、ウイルスDNA複製の開始に十分なTを供給するだけでなく、宿主細胞をウイルス増殖に適した代謝状態に導くためにも必要なのであろう。E-EプロモーターからL-Eプロモーターへの転写ギアシフトは、ウイルス増殖の2つの異なる段階において、T産生速度を適切なレベルに調整するために機能しているのかもしれない。
B. 後期転写の制御
後期領域の転写の増加はDNA複製の開始後に始まり、3つのカプシドタンパク質VP1、VP2、VP3を作るために非常に急速に上昇する(12)。このプロモーターの制御は、初期プロモーターに比べてあまり理解されていない。後期遺伝子の制御については、相互に排他的ではないが、2つの異なったモデルが考えられる。一つはリプレッサーによる負の制御であり、もう一つはTによる正の制御である。前者では、ビリオン中のウイルスDNAに結合したタンパク質リプレッサーが、初期転写とDNA複製によってリプレッサーのない鋳型ができるまで、後期RNA鎖の開始や伸長を阻害する可能性がある(134)。後者の場合、Tは後期転写を活性化する上で、直接的な役割か、DNA複製における役割のために間接的な役割を果たす(134)。
tsA変異体を用いた遺伝子解析から、Tが後期転写に必要であることが示された。ある研究では、tsA58ウイルスまたはそのDNAを制限温度で感染させると、2種類の初期RNAが相当量合成されたが、後期RNAは合成されなかった。一方、野生型ウイルスまたはそのDNAを感染させた細胞では、感染後7.5時間でもかなりの量の後期mRNAが合成された。これらの結果は、Tが後期転写に積極的な役割を果たしていることを示している(134)。
感染後期に後期RNAが蓄積する要因の一つは、ウイルスゲノムの増幅によるもので、このプロセスにはTが深く関与している。Tはまた、ウイルスDNAの複製とは無関係に、後期プロモーター活性を直接的に大きく刺激することができる(21, 22)。様々な実験的アプローチによって、この結論が導き出された。一つは、SV40の起源の欠損変異体を使うか、DNA合成阻害剤を使うかによって、ゲノムの増幅を阻止したものである。もう一方では、COS、C2、C6、Cllなどの異なる細胞株から得られた正常または変化したTが、後期遺伝子発現に制御的影響を及ぼすようにした。どちらの実験も、後期転写を数倍活性化するTの直接的な役割を実証している(21, 22)。TのDNA結合特性が後期転写に関与している可能性はあるが(21, 22)、DNA複製の開始には必要ではない。
T抗原は、転写ユニットを積極的に活性化することによって、すなわち、T抗原がない場合には反応しない後期プロモーターにRNAポリメラーゼを誘導することによって、後期転写を刺激するのかもしれない。In vivoでの競合実験は、後期転写の活性化のために鋳型DNAがTと直接相互作用することをさらに示唆している。SV40の後期領域からの様々な競合フラグメントを用いると、後期遺伝子発現の誘導が示される(J. BradyとG. Khoury、私信)。このことは、細胞転写因子がSV40後期転写を負に制御している可能性を示唆している(22)。もしそうなら、Tの積極的な役割は、鋳型と相互作用することによってこの抑制因子を除去することかもしれない。
IV. 結論
SV40の2つのプロモーターは、他の多くの真核生物のプロモーターと類似しており、その組織と制御を理解することは、真核生物の分子生物学にとって非常に重要である。初期の遺伝子産物の一つであるT抗原が精製され、試験管内試験でその転写制御を研究することが可能になった。このDNA結合タンパク質は、真核細胞に存在する他の多くのタンパク質の典型であると考えられている。このタンパク質は特定のDNA配列を認識し、異なる組織、あるいは生物の異なる発生段階において、どのRNAが作られるべきかを決定するのに役立っている。T抗原による転写の制御を徹底的に理解することで、DNA結合タンパク質がどのように遺伝子発現を制御するのかが明らかになると考えている。
