Contents
pubmed.ncbi.nlm.nih.gov/38390323
オンライン公開2024年2月8日。
PMCID: PMC10883065
PMID:38390323
要旨
mRNA-LNPワクチンは、欧米諸国で最も広く使用されているSARS-CoV-2ワクチンの基礎となったため、COVID-19パンデミックの際に大きな注目を集めた。初期の臨床試験データから、これらのワクチンはすべての層に対して安全で有効であると考えられていた。しかし、最新のデータでは、これらのワクチンの安全性と有効性について重大な懸念が示されている。ここでは、現在までに確認されている安全性と有効性に関する懸念について概説する。また、これらのワクチンの使用に関連して観察された有害事象の潜在的な機序と、このワクチン機序のアプローチを変更することで軽減できるかどうかについても議論する。
キーワード:mRNAワクチン、有害事象、副作用、クオバディス、抑制
mRNA-LNP COVID-19ワクチンの標準成分と非標準成分
新しい治療法や予防法の展開を承認する規制当局は、製品の厳格な純度基準を求めている。しかし、新しいmRNAワクチン・プラットフォームは、製造中の不純物に関して、新規で未検証の、これまで規制されていなかった側面を提供する。mRNAワクチンは、目的のタンパク質をコードするmRNAと、直径約100nmのナノ粒子を形成する様々な脂質の混合物とが複合化し、保護されたものである(1)。mRNAは、鋳型となる大腸菌由来のDNAプラスミドからRNAポリメラーゼを用いて試験管内試験で合成される。理想的には、mRNAの精製段階でプラスミドやその他の成分は除去される(2)。しかしながら、複数のシークエンシングアッセイを用いた最近のプレプリントスタディーでは、モデルナとファイザーの二価mRNAワクチンのDNA混入レベルが、欧州医薬品庁(EMA)と米国食品医薬品局(FDA)の設定レベルを超えていることが報告されている(3)。汚染されたプラスミドDNA断片がヒトの健康に影響を及ぼすかどうかは、まだ定義されていない。製造過程で形成される可能性のある低レベルの二本鎖RNA(dsRNA)は、自然免疫センサーを活性化し、炎症を誘発する可能性があり(4)、ファイザーとモデルナのmRNAワクチンについても報告されている(5,6)。ファイザー社のCOVID-19ワクチンにも、生理学的に適切なレベルのdsRNAが含まれていることが実験的に確認されており、このワクチンによってマウスで誘導される適応免疫応答は、dsRNAセンサーであるMDA5タンパク質に部分的に依存していることが示されている(7)。
HPLCを用いたヌクレオシド修飾とdsRNAの除去は、当初Karikóらによって導入された。これは、修飾されていないmRNAの特徴である自然免疫センサーの活性化と、mRNAからのタンパク質翻訳を制限するI型インターフェロンのような炎症性サイトカインの産生を回避するためであった(4,8,9)。mRNA技術は当初、治療用タンパク質の代替や送達を目的としていたため、生体内での半減期が長いことは望ましいことであった(10)。それにもかかわらず、ヌクレオシド修飾は、mRNAベースのワクチンのヒトへの使用を可能にするブレイクスルー発見として注目された(11)。mRNA-LNPプラットフォームにおける炎症性成分の重要性は、高度に精製されたmRNA(検出可能なdsRNAなし)と、炎症を誘発するイオン化可能脂質を含まない脂質ナノ粒子(LNP)を組み合わせた場合、生体内試験で自然免疫反応や適応免疫反応を誘導できないのに対し、タンパク質やmRNAと混合されたイオン化可能脂質を含むLNPは、同様の適応免疫反応を支持するという事実によって強調されている(12,13)。mRNA-LNPワクチン(7)に含まれるdsRNAは、LNPの高い炎症性(12,14)と相まって、免疫感受性の観点からヌクレオシド修飾の必要性を本質的に排除している可能性がある。従って、mRNAを免疫応答を誘導するワクチンに変化させる重要な要素は、当初mRNAの不活性キャリア/送達ビヒクルであると考えられていた炎症性LNP(10)であり、ヌクレオシド修飾ではない。
保管、輸送、臨床での取り扱い以外に、ワクチンのロット間で汚染物質のレベルが異なることが、ファイザー社製mRNAワクチンのロットによって異なるレベルの有害事象が誘発されるというデンマークで最近発見された結果を説明するかもしれない。あるロットではほとんど副作用がなかったが、他のロットでは中程度または非常に高い有害事象(疑われるすべての副作用、重篤な死亡例、関連した死亡例)が発生した(15)。これらの知見を一般化できるかどうかを明確にするためには、同じロットのワクチンが異なる国や人口統計でどのような挙動を示したかを調べることが重要であろう。汚染物質がこのプラットフォームの炎症性と有害事象の誘発に寄与している可能性は高いが、mRNA-LNPワクチンのLNPのイオン化可能な脂質成分は炎症性が高く(12)、すでに上述したように、このプラットフォームの反応原性と免疫原性の鍵を握っている(12,13)。従って、仮に、異なるロットが異なるレベルの有害事象を引き起こした別の説明として、mRNA-LNPの量、あるいはmRNAとLNPの比率がロット間で異なっていた可能性がある(16)。異なる可能性を評価するためには、異なるロットのワクチンによって引き起こされた適応免疫反応のレベルを決定すること、また、適切に保存されたワクチンの残りがあれば、それらを不純物や治療薬のレベルについて検査することが不可欠であろう。まとめると、これらの知見は、この新規ワクチンクラスの純度基準と許容限度を厳格に評価する必要性を強調するものである。
mRNA-LNPプラットフォームに関する仮定について
mRNA-LNPワクチンに関して、様々な専門家や関係者が、いくつかの仮定に基づいた公式見解を発表している。最も公にされたものの一つは、ワクチンmRNAはDNAに逆転写されないので、ヒトゲノムに挿入される危険性はない、というものであった(17-20)。ヒトゲノムへの新たなDNA挿入が生殖系の幹細胞レベルで起これば、深刻な懸念となる。真核細胞における情報の流れは、DNAからRNA、そしてタンパク質へと一方向に流れるという、フランシス・クリックの分子生物学のセントラル・ドグマ(21)を修正したものがしばしば引用される。真核細胞における情報の流れは、一般的にはDNA→RNA→タンパク質だが、特殊な例では、RNAがDNAに逆転写されることがある。このプロセスは逆転写酵素によって媒介される。逆転写酵素はレトロウイルスと自然に結びついている酵素である。しかし、ヒト細胞を含む真核細胞は、テロメアとレトロトランスポゾンを複製するために逆転写に似たプロセスを用いる(22–25)。ファイザーのmRNA-LNPワクチンでは、ワクチンmRNAが不死化ヒト肝細胞株でDNAに逆転写されることが実験的に示されている。mRNA-LNPワクチンへの暴露は、LINE-1レトロトランスポゾンの全体的な発現レベルの上昇と核への局在化とも相関していた(26)。ワクチンのmRNAの配列の特徴は、LINE-1を使ったレトロポジションに必要な既知の条件をすべて満たしていることが提唱されている(25)。これらが生体内試験で関連性があるかどうかはまだ不明である(27)。スパイクプロテインの核への局在は以前に報告されている(28,29)。スパイクプロテインの核局在を明らかにした研究を支持するものとして、最近のプレプリント研究で、SARS-CoV-2のスパイクプロテインは他のSARSウイルスとは異なり、核局在シグナル(NLS)を持っていることが報告された。このNLSはスパイクプロテインの核への輸送を可能にし、スパイクプロテインはスパイクmRNAも核にシャトルするようである(30)。ある研究では、SARS-CoV-2 RNAが逆転写され、培養ヒト細胞のゲノムに組み込まれることが示された。この過程はLINE-1エレメントが介在している可能性があり、患者由来の組織で発現することができる。著者らは、これらの知見は、ウイルスが排除された後でもPCR検査でSARS-CoV-2が陽性となる患者がいることの説明にもなると提唱している(31)。しかし、これらの結果は再現性がなく(32,33)、頻度も少なく、恣意的であると批判されている(34)。私たちの知る限り、SARS-CoV-2スパイクプロテインの全長融合前固定型をコードするCOVID-19 mRNAワクチンを用いた同様の研究は行われていないが、スパイクプロテイン/mRNAの核への輸送は同等であると予想される。mRNAは核内に入り、そこでDNAに逆転写される可能性があるため、ゲノムに組み込まれる可能性が高まる。さらに、mRNA-LNPは全身に拡散し、精巣と卵巣の両方に蓄積することができ(5、6)、女性の月経周期を変化させることが報告されている(35、36)。したがって、生殖器の幹細胞に到達している可能性がある。これらの知見は、こうしたデータや懸念を真摯に受け止め、それに対処するための具体的な実験を行う必要性を強調している(25)。
ワクチンmRNAのもう一つのよく宣伝される特徴として、mRNAは生体内で数時間から数日で分解されるため、正常な細胞生物学を破壊する可能性がさらに制限されるというものがある(17–20)。この仮定は、未修飾のmRNAは一般的に生体内での半減期が短いことから生まれたと思われる(37)。しかし、mRNA-LNPへの曝露後、異なる時点で採取されたヒトリンパ節生検では、最大8週間までワクチンmRNAとスパイクプロテインの検出可能なレベルが認められた(38)。循環しているワクチンmRNAとスパイクプロテインは、ワクチン接種後数週間から数ヶ月の血漿中に検出されている(39–42)。最近の死後調査でも、ほとんどの被験者の被爆後30日目のリンパ節からワクチンmRNAが検出され、心臓組織からはあまり検出されなかったが、肝臓と脾臓からは検出された(43)。このように、mRNAのさまざまな修飾(5’および3’の修飾、ユニークなヌクレオチドの使用など)が、ヒト体内での生体内試験半減期にどのような影響を及ぼすかについては、具体的な研究が行われていないため、これらのことを考慮すると、私たちの理解が限られていることを認める必要がある。
COVID-19ワクチンのmRNAには、生来の反応原性を低下させるために修飾リボヌクレオチドが一般的に組み込まれている(8)。しかし残念なことに、mRNAの翻訳忠実度に対するその効果は最近まで明らかにされていなかった。N1-メチルシュードウリジンをmRNAに組み込むと、試験管内試験で+1リボソームフレームシフトが起こり、BNT162b2ワクチンのmRNA翻訳による+1フレームシフト産物に対するマウスとヒトの細胞性免疫がワクチン接種後に生じた(44)。アデノウイルスベースのChAdOx1 nCoV-19ワクチンでは検出できなかったので、フレームシフト産物の存在とそれに関連する適応免疫応答は、このプラットフォームに特異的であった(44)。フレームシフト産物が内在性のタンパク質配列と重なり、自己免疫応答の発現に寄与するかどうかは、まだ検討されていない。
全体として、このセクションは、科学において仮定し、外挿し、既存のパラダイムを未検証の新しいプラットフォームに適用する際の危険性を強調している。この新しいワクチンの展開に関する上記の問題は、このプラットフォーム特有のものであるため、将来ヒトに使用するためには、よりよく対処しなければならない。
mRNA-LNPワクチンの安全性と有効性は?
mRNA-LNP COVID-19ワクチンは、臨床試験データの初期分析に基づき、人口統計学的に安全かつ有効であると考えられた(45,46)。しかし、最近の査読を受けた研究、継続的に増加している様々な症例報告、一般に公開されている有害事象データベースは、これらの製品の安全性と有効性に疑問を投げかけている。
安全性
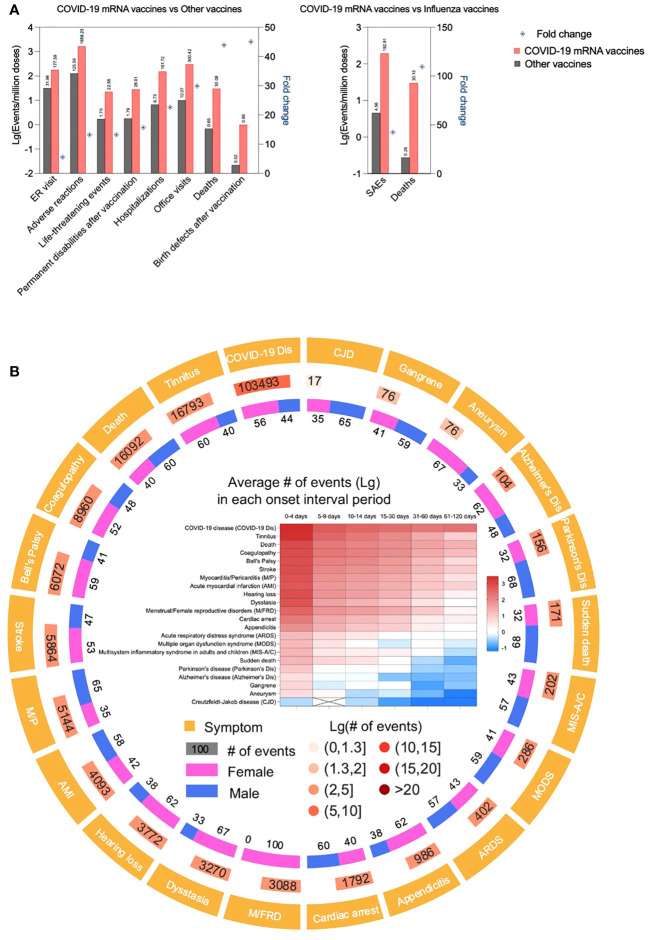
臨床試験の専門家であるDoshi博士が主導したファイザー社とモデルナ社の臨床試験データの慎重な分析と再分析により、ファイザー社とモデルナ社のCOVID-19ワクチンの両方で、特に注目すべき重篤な有害事象(SAE)の過剰リスクが明らかになった。mRNAワクチンを接種した患者では、SAEのリスクが16%高かったのである(47,48)。これは、ドイツの保健大臣が最近認めた10,000件に1件程度の重篤で永続的な損傷事象と一致している(49)。CICP(Countermeasures Injury Compensation Program)のデータによると、これまでに申請されたCICPの請求総数13,406件のうち、12,854件がCOVID-19対策の請求であり、そのうち9,682件がCOVID-19ワクチンによる傷害/死亡を訴えている(50)。骨髄(51-55)、肝臓(56-58)、皮膚(59–64)、心臓血管系(65–77)、筋骨格系(76,78,79)、内分泌系(80-84)、神経系(66,84– 87)などの重篤な炎症性/自己免疫性事象を含むが、これらに限定されず、時には致死的であった症例報告は着実に増加している。しかし、これらの報告数だけではSAEの発生率を判断することは困難である(88)。症例報告データを補足するために、疾病管理予防センター(CDC)とFDAが共同管理しているワクチン有害事象報告システム(VAERS)の公開データを限定的に分析した(89)。VAERSによれば、すべての死亡報告および関心のある重篤な事象が調査されている(89)。この解析は、文献に報告されているこれらの治療薬の多様な副作用を反映したものであり、発生率に関する情報を提供する可能性がある(図1)。COVID-19以外のすべてのワクチンを合計したものと比較すると、mRNA-LNPベースのCOVID-19ワクチンの投与100万回当たりの有害事象発生率ははるかに高い(図1A )。死亡やSAEもまた、注射後すぐに発生することが多く(図1B )、単なる偶然の出来事ではなく、ワクチンの結果である可能性が高い。とはいえ、VAERS報告を見ただけでは因果関係を立証できないことを強調しておく必要がある。mRNA-LNPワクチンとSAEとの因果関係は、主に若い男性に発症した心周囲炎と心筋炎に関してのみ、規制当局によって公式に認められている(90)。ほとんどの症候性患者は若い男性かもしれないが、最近の生体内試験生理学的検査、例えば心臓のグルコース取り込みでは、性別や人口統計に関係なく、無症候性ワクチン接種患者で40%の増加が見られ(91)、潜在的にもっと広い範囲での影響を示唆している。これらの所見は死後調査でも支持されており、その一部では剖検によって心臓の炎症とワクチンRNAの存在が明らかになった(43)。若年層における心臓発作や死亡の増加(92,93)がこれらのワクチンと関連しているかどうかはまだわからない。
図1 COVID-19 mRNAワクチンは他のワクチンと比較して有害事象の発生率が高い。(A).CDC VAERSとNational Vaccine Injury Compensation Program (NVICP)から得られたデータを棒グラフにLg(events/million doses)として示した。COVID-19 mRNAワクチンは2020年12月から2023年9月まで、その他のワクチンは2006年1月から2021年12月までのデータである。変化倍率は、COVID-19 mRNAワクチンと他のワクチンまたはインフルエンザワクチンのLg(イベント/100万投与)比として計算した(B)。COVID-19 mRNAワクチンに関連して懸念される有害事象。CDC VAERSから得られたデータを解析し、懸念される有害事象(AESI、CDCが定義した特別な関心のある有害事象を含む)を症状とその事象数、男女比、各症状の発症間隔として表示した。
有効性
感染を予防し、ウイルスの拡散を抑えるというこれらの治療薬の有効性は、初期の報告から大きく損なわれており(94)、現在では、その有効性は主に、罹患しやすい人々の病気の重症度と死亡を減少させる可能性があるという程度に限られている(95)。免疫系の過剰反応による過剰な炎症(サイトカインストーム)は、重症COVID-19患者の主要な病理学的特徴の一つである(96)。従って、仮にmRNA-LNPワクチンへの暴露が全身の炎症反応の抑制につながるのであれば、ワクチン接種がデルタ型やオミクロン型の重症化を抑制した理由を説明できるかもしれない。この仮説を支持するものとして、Netea博士のグループは、ワクチン接種を受けた個体において、二次的なウイルス刺激に対する免疫細胞の転写反応性が減弱し、I型インターフェロン応答が低下したことを報告している(97)。一方、私たちのグループは、このプラットフォームを用いたマウスにおいて、適応免疫応答の阻害と自然免疫体力の変化を報告している(99)。これらのワクチンによって誘導される免疫寛容環境は、mRNAワクチンの過去接種回数の増加とCOVID-19に感染するリスクの高さとの間に相関関係があることを発見した最近の研究によってさらに支持されている(100–102)。従って、これらのデータは、疾患の重症度と死亡を減少させるこれらのワクチンの有効性が、これまで発見されていなかった免疫抑制特性にある可能性を示唆している。これらの知見は、新規プラットフォームが予期せぬ結果をもたらす可能性を抑えるために、厳密な前臨床試験の必要性をさらに強調している。
mRNA-LNPに関連する有害事象-炎症性と抑制性の両方
mRNA-LNPプラットフォームで報告されたSAEは非常に多様である。SAEはmRNA-LNPワクチン構成成分の組み合わせによって引き起こされる可能性が高く(103)、またスパイクプロテイン自体の直接的な毒性や生物学的作用によって引き起こされる可能性もある(104–108)。ここでは、免疫系が介在すると考えられるSAEに焦点を当てる。SAEは、免疫学的観点から、炎症性カテゴリーとアレルギー性/抑制性カテゴリーに分けられる。炎症性の副作用には、急性反応原性(発熱、頭痛、疲労、筋肉痛や関節痛、悪寒など)(45,46)、炎症性/自己免疫性、抗PEGを介したCARPA(109)、その他自然免疫系や適応免疫系の活性化を伴う関連事象がある。アレルギー性の副作用、すなわち免疫抑制は、水痘・帯状疱疹ウイルス(VZV)(110、111)やC型肝炎ウイルス(112)のようなウイルスがCOVID-19 mRNAワクチン注射後に再発するウイルス再活性化として現れる。さらに、感染症に対する感受性(100、101、113)や、がん免疫サーベイランスの障害(114–117)のリスクを高める可能性があることも報告されている。あるプラットフォームは、どのようにして免疫反応を活性化し、また抑制することができるのだろうか?
炎症反応
上述したように、この治療薬の炎症性は、LNPのイオン化可能な脂質成分に関連しており(12)、事実上、dsRNA(7)のような潜在的な炎症性汚染物質によってさらに強調される可能性がある。発熱、頭痛、疲労、筋肉痛、関節痛、悪寒など、これらの治療薬で観察される急性の反応原性反応は、曝露時にIL-1β、IL-6、GM-CSF、I型インターフェロン(7,12)などの様々な自然炎症性サイトカインが大量に放出されることによって引き起こされると考えられる。この治療薬によって誘導されるこの炎症環境は、mRNA-LNPがLPS(118)のような他の炎症剤と相加的な効果を持つことから、既存の自己免疫疾患の再燃をサポートする可能性がある。mRNA-LNPは全身に拡散し(6,10,41,42)、LNPはどのような細胞型にもmRNAを送達し、その翻訳を可能にするので、抗原特異的な適応免疫応答によって攻撃される可能性のある非APCにおける関心タンパク質の標的外翻訳を考えることは妥当である(103)。従って、COVIDアーム、心筋周囲炎、脳、肝臓、骨髄などに影響を及ぼす炎症反応など、このプラットフォームで報告されたSAEのいくつかは、全身の免疫系によるスパイクプロテインまたはフレームシフトタンパク質発現細胞の破壊が原因かもしれない。
耐性反応
オミクロン感染に対する予防効果は、ブースター接種後1カ月を経過するまでに徐々に低下し、7カ月目以降は、一次接種のみの人に比べてブースター接種者の感染率が高いという観察結果がある(119)、や、COVID-19の罹患率は予防注射の回数とともに増加し(100–102)、免疫反応性は低下し(97)、ウイルスは再活性化し(110,112)、がん患者は再発したり、新たながんが発生したりする(114–117,120)ことから、mRNA-LNPプラットフォームに暴露されると、人々や特定の人々が半免疫不全/免疫抑制状態になることを示しているようだ。これと同様に、マウスの研究では、mRNA-LNPやLNPに一度だけさらされただけでも、適応免疫応答が阻害され、自然免疫の体力が遺伝的に変化することが示されている(99)。1回だけの暴露で、その後のインフルエンザ感染に対する感受性は低下したが、マウスは全身性酵母感染に対する抵抗性が著しく低下した。敗血症(121)、院内感染(113、122)、ある種の真菌感染症(123–126)の発生率の増加が、mRNA-LNPプラットフォームやCOVID-19への膨大な曝露、あるいはその他のパンデミック関連対策と関係があるかどうかは、まだ解明されていない。
LNPのイオン化可能脂質は合成で、生体内での半減期は20-30日と推定されている(5)。従って、これらのワクチンに暴露されると、早期に高レベルの炎症が起こり、その後、長期間にわたって低レベルの慢性炎症が続く可能性がある。慢性炎症は免疫系の非応答性やアネルギーにつながる可能性があり(127)、このため、このプラットフォームに関連して報告されたウイルスの再活性化や感染症感受性の上昇の一因となる可能性がある。さらに、上記で示したように、予想に反して、スパイクmRNAはmRNAワクチン接種後数ヶ月間無傷のままであり、スパイクプロテインの長期発現が可能であることを示唆する証拠がある。これは、数ヶ月間持続する胚中心の存在と相関する。抗原による継続的な刺激は、異常なT細胞およびB細胞応答を引き起こす可能性がある。連続的な抗原暴露は、最近mRNAワクチンを3回接種した人の約半数で観察されたIgG4へのアイソタイプ転換を促進するかもしれないが、アデノウイルスワクチンでは観察されなかった(128,129)。SARS-CoV-2の自然感染に事前に暴露されると、mRNAワクチンによるIgG4スイッチの誘導が阻止されたことから(130)、免疫系の最初のプライミングが、その後の体液性免疫に影響を与え、決定することが示された。IgG4は一般に抗炎症性であり、オプソニン化、補体固定化、抗体依存性細胞毒性をあまり促進しないことが知られている。しかし、自己免疫疾患である尋常性天疱瘡や重症筋無力症の一部では病原性を示すこともある(131)。IgG4関連疾患は、癌全体のリスクも高いようである(132)。IgG4産生B細胞の誘導は、多量のIL-10産生を特徴とするT濾胞ヘルパー(Tfh)細胞のサブセットからの助力に依存している(133)。これらのIL-10産生Tfh細胞は、持続的抗原刺激の存在下で産生され、最初に慢性ウイルス感染で同定され(133)、後にIgG4関連ヒト疾患にも存在することが示された(134)。mRNA-LNPプラットフォームがこのユニークなタイプのTfh細胞を誘導するかどうか、またmRNA-LNPプラットフォームで観察されたIgG4アイソタイプへのスイッチングの生体内試験での関連性は、まだ決定されていない(135)。
私たちの研究室では最近、免疫抑制を補完するもう一つの潜在的な機序を提唱した(99)。T細胞の活性化とエフェクター細胞への分化は、樹状細胞(DC)などの抗原提示細胞(APC)から受け取る3つのシグナルに依存していると考えられている。第一のシグナルはペプチド-MHCの形で、第二のシグナルは膜結合性の共刺激で、第三のシグナルは可溶性サイトカインの形である。もしT細胞が最初のシグナルより先に3番目のシグナルを受けると、これをout-of-sequence stimulationと呼び、T細胞を死に至らせるか、あるいはアネルギー性で無反応にする(136,137)。mRNA-LNPあるいはLNPに暴露されると、out-of-sequence刺激を誘導することが知られているI型インターフェロン(7)を含む炎症性サイトカイン(12)が急速に放出され、mRNAがタンパク質に翻訳されてDCに提示される前に、T細胞を含む適応免疫細胞が炎症環境にさらされる可能性が高い。従って、抗原提示と炎症が一致する旧来のワクチンとは異なり、mRNA-LNPプラットフォームの潜在的欠陥の一つは、適応免疫細胞をアウトオブシーケンス刺激にさらすことである。mRNA-LNPプラットフォームで非連続性刺激が存在するかもしれないという実験的証拠を得るために、私たちはナイーブな先天性Eα特異的CD4 T細胞をWT B6マウスに移植し、マウスをmRNA-LNPあるいはLNPあるいはPBSに暴露した。2週間後、一部のマウスは無処置とし、他のマウスにはEα抗原を免疫し、移植したT細胞の増殖を誘発した。4日後、皮膚から排出されたリンパ節を分析したところ、mRNA-LNPまたはLNPに暴露された動物では、免疫状態にかかわらず、養子移入されたT細胞数がおよそ10倍減少していた(99)。従って、これらのデータは、LNPが作り出す炎症環境がナイーブT細胞に有害であることを示唆している。別の実験では、mRNA-LNPとLNPとIFNα、あるいは炎症やインフルエンザ感染を誘導する因子が、養子移入されたナイーブCD4 T細胞の生存に及ぼす影響を比較した。mRNA-LNPとLNPと同様に、マウスをI型インターフェロン(IFNαとポリ(I:C)(I型インターフェロン分泌の引き金となる)で処理すると、T細胞前駆体数の減少が見られた(図2)。高用量のLPSは中間的な表現型をもたらしたが、致死量以下のインフルエンザ暴露は、養子移入されたCD4 T細胞に有意な影響を与えなかった(図2 )。OT-II CD4 T細胞も同様の反応を示したので、この影響はTEα細胞に限ったものではなかった(データは示さず)。内因性T細胞が同様の影響を受けるかどうかは、まだ明らかにされていない。注目すべきは、直接排出される臓器、皮膚から排出されるリンパ節、そして離れた脾臓でも同様の傾向が見られたことから、観察された変化は全身的なものである可能性が高いことである。これらのデータは、mRNA-LNPまたはLNPへの暴露が、適応免疫応答の全身的な阻害につながるという私たちの以前の知見と一致している(99)。インフルエンザへの曝露を除く全ての治療で、移植されたナイーブT細胞数は有意に減少した。インフルエンザウイルスに暴露されたマウスは著しく体重が減少した(データは示さず)。LPS暴露もまた、その程度は低いものの、ナイーブT細胞数を減少させた。この場合の効果が、I型インターフェロン以外のサイトカインによるものなのか、間接的なI型インターフェロンの誘導によるものなのか、あるいは私たちが用いた高用量のLPSに限定されたものなのかは、まだ明らかにされていない。全体として、これらのデータは、mRNA-LNPプラットフォームによるI型インターフェロンを介した配列外刺激の可能性を支持するものである。しかしながら、阻害のメカニズムの詳細を明らかにし、これらのデータがヒトに適用可能かどうかを決定するためには、さらなる研究が必要であろう。
図2 mRNA-LNPおよび他のIFN産生試薬への暴露は、配列外刺激を誘発する可能性がある。実験デザインマウスにTEα細胞を尾静脈から養子移入した。2週間後、排出リンパ節と非排出リンパ節、脾臓を採取し、フローサイトメトリーでTEα細胞を検出した。各治療条件下での異なる臓器からのTEα細胞(CD4+CD90.1+、生CD3+集団からゲーティング)を示す代表的フロープロット、および対応する要約棒グラフ(下)。データは少なくとも2つの独立した実験からプールした。各ドットは1匹のマウスを表す。TEα細胞の相対レベルはPBS群で正規化した。PBS群と治療群間の比較は、一元配置分散分析(One-way ANOVA)検定によって行った。
mRNA-LNPの現状は?
mRNA-LNPプラットフォームでは、いくつかの重篤な副作用が報告されており、ヒトの健康を守るためには、さらなる使用の前に注意深く調査し、対処すべきである。イオン化可能な脂質を生分解性にし、生体内での半減期を短くすることで、適応免疫応答に有害な慢性炎症の存在を解決あるいは制限できる可能性があると考えている。同様に、mRNAの半減期も、T細胞やB細胞の慢性的抗原刺激を防ぐために注意深く調整されるべきである。LNPのイオン化可能な脂質成分が、LPS(138,139)と同様に、複数回の曝露によって自然寛容を促進するかどうかについては、明らかにされなければならない。ワクチン、特に潜在的な新型をターゲットとしたブースターショットを設計する際には、抗原の用量、既存の抗体、元の抗原性罪(140)がどのように結果に影響するかについての基礎免疫学を考慮すべきである。抗原がmRNAから翻訳され、APCの表面に提示される準備が整った後にのみ炎症を誘発するような「インテリジェント」なデザインを用いれば、mRNA-LNPプラットフォームによる配列外の刺激を減らすことができる。現在のLNPの製剤は、特定の臓器に他の臓器よりも多く集積させるが、この性質はRNAカーゴに関係なく持続する。したがって、自己免疫反応を誘発し、自己細胞を殺す可能性を減らすためには、mRNA-LNPをDCに標的化し、抗原の発現をAPCだけに限定すべきである(103)。特定の非標準ヌクレオチドの使用によるフレームシフト産物の生成は、提案されているように改善されるべきである(44)。mRNAの安全性に関する人々の懸念を払拭するために、mRNAの生体内試験での半減期と、DNAへの生体内試験での転写とゲノム挿入の可能性の有無について、NHPとヒトで研究を行うべきである。最後に、現実のデータから品質管理における潜在的な深刻なギャップが明らかになった以上、独立した保健当局による製薬会社に対するより厳格な監視が望ましく、遅滞なく実施されるべきである。
脳梗塞
パンデミック対策とこの新しいワクチン・プラットフォームの採用をめぐっては、いくつかの根本的な疑問が残っている。撤回や検閲を主張するよりも(141)、開かれた対話を促進し、あらゆる観点を考慮し、論理と推論を駆使して将来の備えを強化することが重要である。上記のような懸念や他の場所での議論(142、143)にもかかわらず、救われた命を引き合いに出して、この措置は正当であると主張する人もいるだろうが、裏付けとなるデータの頑健性には重要な疑問がある。数学的モデリング(144)に頼った推計には、特に入力データの質に関する精査が必要である。例えば、公式の死者数統計に依存し、ウイルス感染致死率(IFR:感染した場合に死亡する可能性)の人口統計学的なばらつきを考慮していないため、報告された数値の正確性について疑問が生じる。なぜ公式統計にはCOVID-19で死亡した人とCOVID-19に感染して死亡した人の両方が含まれているのか?なぜCDCは成人集団のインフルエンザによる入院と死亡を推定し、正確な数字は出せないが(145)、COVID-19については正確な数字を出すことができると主張しているのか?IFRデータ(146,147)は公式の死亡者数を支持しているのか?
パンデミック(世界的大流行)の最中に、感染やウイルスの拡散を最小限に防ぐワクチン(94)を前例のない大量接種を行ったことは、重大な反省を促すもの:それは健全な戦略だったのか?集団免疫は現実的な期待だったのか?この戦略は不注意にもウイルスの変異を加速させたのか、脆弱な集団に的を絞った方が良い結果をもたらしたのか?(148-156)従来の方法ではなく、mRNA-LNPプラットフォームを選択するという決定には、その利点(生産速度、更新の容易さ)と限界(特許、生産上の制約、手頃な価格、未知の短期および長期の副作用)の両方を考慮した精査が必要である。なぜ変異率の高い単一のウイルスタンパク質に注目するのか?ワクチンの更新が容易であることは、亜種との闘いに不可欠だったのか?抗原の投与量、繰り返されるブースター、既存の抗体、抗原原罪などが、パンデミックの間、免疫系にどのような影響を与えるかについて、免疫学の基礎知識がほとんど無視されたのはなぜか?
科学的知識が共有される中、特定の年齢層には予防接種を勧めず(157)、学校は開校し続け、COVID-19に感染した子供が死亡しなかったと報告した(158,159)スウェーデンのような国々が下した判断の相違は、様々な視点からの理解を深める必要性を強調している。スウェーデンと同様のモデルを提唱し、弱者保護を強調した「グレートバリントン宣言」(160)を検閲したのはなぜか。(161)このような問い合わせのリストは、これらの問題の微妙な複雑さを浮き彫りにし、徹底的な検証を促している。
前進
ワクチン接種のためらいや社会的信頼の低下に対処するための抜本的な対策を提唱する影響力のある科学者が、検閲や脅迫を通じて学問の自由を損なう可能性があることを中心に、数多くの議論がなされてきた。しかし、パンデミックの間、反対意見を封殺するような行為は、確かな実験データよりもむしろ仮定に依存することが多い政策決定と相まって、不注意にも科学と社会的信頼の両方を損なった可能性がある。信頼を回復するためには、科学的探求の基本原則に立ち返ることが極めて重要である。科学者は自らの訓練を受け入れ、出典の如何にかかわらず、あらゆる主張に疑問を呈することに専念すべきである。このアプローチは、集団思考や群集心理を防ぐものである。利用可能なすべてのデータを、利害の対立に影響されることなく、批判的思考と理性的判断を用いて厳密に分析することは、バランスの取れた視点を形成するために不可欠である。社会との透明で誠実なコミュニケーションも同様に重要である。生物学には不確実性がつきものであることを認識した上で、私たちの代表者は、既知のことと不確実なことの両方を伝えるべきである。科学は本質的にダイナミックなものであり、新たな知識の出現とともに常に進化し続けるものである。生物学に絶対的なものは何一つなく、知識を追求するためには、絶えず疑問と探求が必要であることを強調することが肝要である。これらの原則を守ることで、私たちは科学的プロセスと、その成長と洗練の能力に対する信頼を新たに育むことができる。
謝辞
Sidney Kimmel Cancer CenterのFlow Cytometryおよび実験動物施設には、本実験の実施に際して専門家の助力をもらった。原稿を批判的に読んでくれたミズーリ大学のAdam G. Schrum博士、トーマス・ジェファーソン大学のTim Manser博士、および匿名を選んだ他の同僚に感謝したい。
資金調達
著者は、本論文の研究、執筆、および/または発表のために金銭的支援を受けたことを表明する。BIはNational Institute of Allergy and Infectious Diseases(www.niaid.nih.gov)のR01AI146420およびR01AI146101、ならびに研究機関のスタートアップ資金の支援を受けている。トーマス・ジェファーソン大学シドニー・キンメルがんセンターのフローサイトメトリーおよび実験動物施設は、米国国立がん研究所(www.cancer.gov)P30CA056036の支援を受けている。
利益相反
著者らは、本研究が、潜在的な利益相反と解釈されうる商業的または金銭的関係がない状態で実施されたことを宣言する。
著者は投稿時にFrontiers誌の編集委員であることを表明した。このことは、査読プロセスおよび最終決定には影響しない。