Contents
Prolonged adaptive immune activation in COVID-19:implications for maintenance of long-term immunity?
pubmed.ncbi.nlm.nih.gov/33104057/
コメントプレスプレビュー
現在進行中の観察的臨床研究では、COVID-19パンデミック時のSARS-CoV-2に対するヒト免疫応答を理解することが優先されている。最近のいくつかの研究では、早期および長期にわたる適応免疫系の活性化に伴う免疫異常が細胞の疲弊をもたらすことが示唆されている。
JCIの本号では、Filesらは、入院患者と重症度の低い非入院患者のCOVID-19の最初の2ヶ月間の細胞免疫表現型を比較した。著者らはフローサイトメトリーを用いて、循環する末梢血単核球を分析した。
両患者群とも、感染後2ヵ月間はB細胞とT細胞の表現型は、感染後2ヵ月間を通じて活性化と細胞の枯渇に一致していた。さらに、非入院患者コホートからの追跡調査では、活性化マーカーと細胞の消耗が時間の経過とともに増加していることが示された。
これらの所見は、COVID-19で観察された適応免疫系の変化の持続性を示しており、SARS-CoV-2に対する免疫の維持を形作る長期的な影響を示唆している。
要旨
現在進行中の観察的臨床研究では、COVID-19 パンデミック時の SARS-CoV-2 に対するヒト免疫反応を理解することが優先されている。最近のいくつかの研究では、早期および長期化した適応免疫系の活性化に伴う免疫異常が細胞の疲弊をもたらす可能性があることが示唆されている。
JCIの本号では、Filesらは、入院患者と重症度の低い非入院患者のCOVID-19の最初の2ヶ月間の細胞免疫表現型を比較した。著者らはフローサイトメトリーを用いて、循環する末梢血単核球を分析した。両患者群とも、感染後2ヵ月間はB細胞とT細胞の表現型は、感染後2ヵ月間を通じて活性化と細胞の枯渇に一致していた。
さらに、非入院患者コホートからの追跡調査では、活性化マーカーと細胞の消耗が時間の経過とともに増加していることが示された。これらの知見は、COVID-19で観察された適応免疫系の変化の持続性を示しており、SARS-CoV-2に対する免疫の維持を形作る長期的な影響を示唆している。
序論
2019年後半に出現し、その後世界的に拡散し、過去100年で最も致命的なウイルスパンデミックの1つを引き起こしたβ型コロナウイルスの影響が世界に氾濫している。SARS-CoV-2ウイルスによって引き起こされたCOVID-19に起因する世界的な死亡者数は、現在、1956-1958年のインフルエンザパンデミックに起因する死亡者数のいくつかの推定値と一致しており、推定世界的な死亡者数では1918-1920年のインフルエンザパンデミックとHIV/AIDSパンデミックを追うのみとなっている。SARS-CoV-2感染に対するヒトの免疫反応については、過去10ヶ月の間に多くのことが明らかになっているが、これらの反応が時間の経過とともにどのように変化していくのかについてはまだ明らかになっていない。COVID-19に起因する死亡者数は、世界的な広がりが続くか、効果的なワクチンが広く普及するまでは増加し続けると考えられるため、免疫反応に関する情報はパンデミックの管理に最も重要な情報となっている。
インフルエンザ感染症(1)、呼吸器同期ウイルス感染症(2)、エボラ感染症(3)を含む他のウイルス感染症に対するヒトの免疫反応を理解することは、ワクチンの設計に役立っている。現在進行中の臨床研究は、現在進行中のCOVID-19ワクチンの大規模臨床試験の評価を待ち望んでいるため、SARS-CoV-2感染に対する自然免疫反応の詳細を提供するにとどまっている。COVID-19ワクチン試験の参加者が獲得した免疫反応の経時変化を含めた解釈のために、これらの研究の重要性を強調することはできない。この情報は、既存のCOVID-19ワクチンや治療法を改良する上で重要な鍵となるであろう。SARS-CoV-2に対する自然免疫反応のさらなる理解は、ワクチンが標的とすることができる保護の相関関係を発見し、最終的にワクチンの再接種が必要となった場合の投与間隔を確立するのに役立つ。
免疫活性化の長期化
初期の報告では、ICUに入院した患者のリンパ球数の減少、好中球数の増加、炎症性サイトカインの増加などにより、ウイルスに対する免疫反応がある程度損なわれる可能性が示唆されていた(4)。しかし、急性感染後数日から数週間の間に起こる正確な変化については、最近になって明らかになっていた(5-7)。JCIの本号では、Filesら(5)が、入院を必要とするCOVID-19患者のコホートと重症度の低い非入院患者のコホートにおいて、感染後最初の2ヶ月間の末梢血単核球の細胞性免疫表現型を比較することで、この分野の知見を前進させている。著者らは、これらの最近発表された他の研究で得られた知見を、非入院患者から得られたフォローアップサンプルにおける免疫応答の時間的変化を調べることでさらに精緻化している(5)。
著者らの主な知見には、CD69,Ox40,HLA-DR、CD154,CD38のアップレギュレーションを含む、入院患者と非入院患者のCD4+およびCD8+ T細胞活性化の顕著な増加が含まれている。COVID-19患者の活性化CD4+およびCD8+ T細胞の増加は、より重症度の高い状況で報告されている(6, 8)。しかし、Filesら(5)は、これらの活性化マーカーの多くが、症状発症から30〜45日後に非入院患者で増加することを示している。さらに、HLA-DR、Ox40,およびTim3は、非入院患者からのCD4+ T細胞上で時間の経過とともに増加し、HLA-DR、TIGIT、およびPD-L1は、リピートサンプリングでCD8+ T細胞の表面上のCD27およびCD28の有意な減少に耐えながら増加した。PD1,HLA-DRおよびTIGITを含むいくつかの表面マーカーの発現レベルは、このコホートではCD4+およびCD8+ T細胞の両方で年齢と有意な正の相関を示し、CD28の表面発現はCD4+およびCD8+ T細胞の両方で年齢と有意な負の相関を示した。これらの所見は、T細胞の枯渇の増加という、加齢に伴う慢性ウイルス感染後のT細胞の量的枯渇や機能の抑制と定義される、確立された相関関係と一致しており、ワクチンに対する免疫応答の理解の指針となる可能性がある。著者らはまた、B細胞表面マーカーも評価し、COVID-19の入院患者と非入院患者でCD69,CD27,PD-1が増加しており、B細胞活性化の増加を示唆していることを明らかにした。さらに、ICUに入院した患者とICUレベルのケアを必要としない患者に分けて検討したところ、CD4+T細胞、CD8+T細胞、B細胞活性化の増加の多くの成分はICU群で顕著であったが、HLA-DRはICUに入院した患者ではB細胞の表面発現が低いことが明らかになった。
著者らが指摘しているように、この研究の1つの限界は、個々の被験者におけるウイルス血症の程度や持続時間を正確に測定できないことである。Lucasらは最近、重症患者は中等症患者と比較して鼻咽頭ウイルス負荷の上昇が長期化することを示している(7)。さらに、他の研究者は、高齢のCOVID-19被験者におけるウイルス脱落の長期化を報告しており(9)、いくつかの報告では、患者の小さなサブグループで30日以上の鼻咽頭ウイルスRNA脱落が報告されている(10)。しかし、症状発症後15日以上経過したこれらの陽性ウイルスRNA検査に関連したウイルスの感染性は疑問視されている(11)。それにもかかわらず、SARS-CoV-2ウイルスからの抗原が、ヒト宿主内で潜伏に入らない他の一般的なヒトウイルスと比較して、特に高齢者およびより重度のCOVID-19を有する個人において、より長く残存する可能性があることは確かに明らかである。
Filesら(5)による所見は、COVID-19患者における抗原への曝露が長期化している可能性が高いものの設定において、必ずしも予想外のものではない。さらに、より重症化した患者における活性化の増加に関連した変化は、より高いウイルス負荷、したがって、抗原へのより深い曝露を持つ個人で予想される変化とよく相関していた。それにもかかわらず、免疫系への長期的な影響は確かに重要である。抗原への曝露の増加は、細胞の疲弊の増加をもたらす。
将来の治療やワクチンへの影響
COVID-19患者における細胞免疫の早期枯渇がT細胞およびB細胞応答を制限する可能性があることを理解することは、以前に感染した患者の免疫応答を考慮する上で、その後の新たな感染性ウイルスの再チャレンジに非常に大きな影響を与える。感染したヒト患者における抗体応答は、90%以上の感染者が血清陽性を示している(12)が、抗原特異的T細胞応答は、その後の感染でウイルスに再曝露した際に、その量や質が制限される可能性がある。実際、いくつかのグループでは、SARS-CoV-2に感染した一部の患者では、抗原特異的CD4+ T細胞応答がしっかりしているにもかかわらず、抗原特異的CD8+ T細胞の誘導が限られていることがすでに報告されている(13)。
現在試験段階にあるCOVID-19ワクチンの多くは、T細胞およびB細胞応答を誘導するために開発されたベクターを使用している。これらのワクチンでT細胞応答を誘導することができれば、最終的には、ワクチンを接種したにもかかわらず感染してしまった人の重篤な疾患からの保護が改善される可能性がある。さらに、自然感染が大量の抗ウイルスCD8+ T細胞の誘導に失敗した場合、そのような応答を誘導するワクチン候補の受領は、すでに感染しており、実質的な中和抗体価を持っている人であっても、重篤な疾患からの重要な保護を提供する可能性がある。抗ウイルスT細胞量の増加は、高齢者や免疫抑制剤を服用している人、その他T細胞応答を生成する能力が低下しているグループでは、将来SARS-CoV-2に感染した場合に予後が悪くなるリスクが高くなる可能性があるため、より重要であると考えられる。
残念ながら、パンデミックの初期段階では、適切な炎症性反応(正常なHLA-DR発現、IL-6上昇)(14)およびその後の免疫抑制を考慮するよりも、とらえどころのないサイトカインストームに焦点が当てられてきた。継続中のデータは、免疫抑制(HLA-DRの低下、CD279(PD-1)発現の増加を伴うT細胞応答の低下)くすぶり続ける低レベルの炎症、および患者における二次感染症の発症の明確な生物学的証拠を理解することの重要性を再確認している(14-16)。Filesら(5)が再報告したように、この免疫抑制の効果は45日まで持続するため、インターロイキン-7やOx40の投与などの免疫回復療法を支持する強い議論となるが、一方で大規模使用のための有効なワクチンを開発することも可能である(16, 17)。インターロイキン-7は、COVID-19患者においてリンパ減少を改善し、TNF-αおよびIFN-γ産生を増加させることが十分に確立されている(16,17)。多能性を修飾する治療法(IL-7など)は、適切なワクチンまたは中和ポリクローナル抗体の組み合わせと組み合わせて、病気の重症度を軽減し、入院患者および非入院患者を二次感染症に罹患しやすくする一時的な免疫活性化および抑制を最小限に抑えることができる(18)。免疫抑制を標的としたアプローチは、関連するワクチンが開発される際に不可欠である。
結論
COVID-19は、将来のワクチンキャンペーンの成功が何らかの形で制限されている場合には、近い将来、そしておそらく将来にわたって、循環するヒト病原体として存続することは間違いないだろう。SARS-CoV-2感染に対するヒトの自然免疫反応を説明するための観察研究を早期に実施してきた研究者によって得られた知見は、現在進行中の診断検査や潜在的な治療法の開発に有益であることが証明されるだろう。これらの知見は、ウイルスの侵入や複製を無力化するだけでなく、持続的な適応免疫抑制を逆転させる免疫修飾療法をさらに洗練させるために必要とされている。
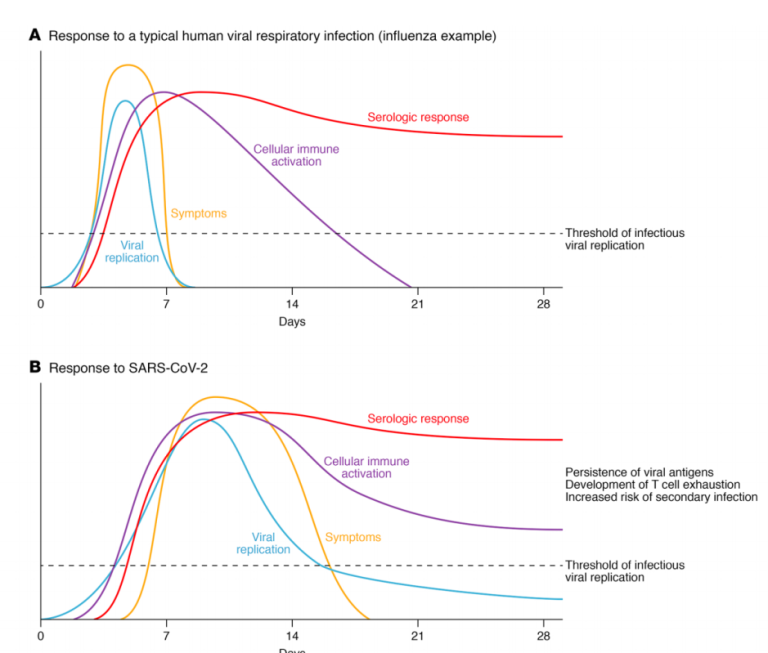
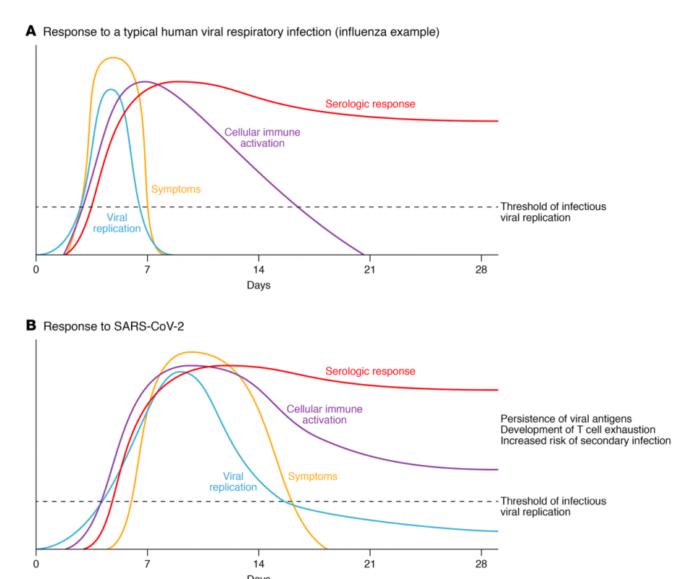
図1. ヒトのウイルス性呼吸器感染症に対する反応
A. 典型的なインフルエンザ感染症では、症状およびウイルス複製は数日以内にピークを迎え、最初の1週間後に消失する;血清学的反応は最初の2週間以内にピークを迎え、高値を維持する。特筆すべきは、インフルエンザでは、細胞免疫活性化は1週目にピークを迎え、3週目までに消失することである。
B. 対照的に、SARS-CoV-2感染では、ウイルスクリアランスにもかかわらず、細胞性免疫系は活性化されたままである。ウイルス抗原の持続、T細胞の消耗、二次感染のリスクの増加が、SARS-CoV-2感染症を他のウイルス性呼吸器感染症とは異なるものにしている。