
I-RECOVER POST-VACCINE TREATMENT PROTOCOL
covid19criticalcare.com/protocol/i-recover-post-vaccine-treatment/
更新:推奨される治療法の順番を変更した。マスト細胞活性化の治療法、迷走神経刺激、ARCマイクロカレント装置を追加した。
目次
- 推奨される治療法の要約
- 免責事項
- 貢献者
- 定義
- 疫学
- 病因
- COVIDワクチンによる合併症/傷害
- 治療アプローチ
- ベースライン検査
- ワクチン接種後の抗凝固療法とワクチンで傷害を受けた3つの臨床表現型
- ワクチン接種後の表現型における抗凝固療法の暫定的アプローチ
- 第一選択療法
- 間欠的毎日絶食または定期的毎日絶食
- イベルメクチン(IVM)
- 適度な身体活動
- L-アルギニンとビタミンC
- 低用量ナルトレキソン(LDN)
- ナットウキナーゼ
- マスト細胞活性化の治療
- 日光と光生物調節(PBM)
- メラトニン
- ブロメライン
- ニゲラサティバ
- レスベラトロールまたは複合フラボノイド
- プロバイオティクス/プレバイオティクス
- 迷走神経刺激およびニコチン作動薬
- 補助療法/セカンドライン療法
- 高気圧酸素療法
- 三重抗凝固療法
- ビタミンD
- マグネシウム
- オメガ3脂肪酸
- N-アセチルシステイン(NAC)
- シルデナフィル
- スペルミジン
- ARCマイクロカレント装置
- メチレンブルー
- 非侵襲的脳刺激(NIBS)
- ビタミンC静注
- 行動修正、リラクゼーション療法、マインドフルネス療法
- サードライン治療
- 低磁場機械刺激
- ミトコンドリアエネルギー最適化薬
- 低用量コルチコステロイド
- その他の治療法
- プラズマフェレーシス
- 免疫グロブリン(IVIG)静注療法
- バルプロ酸
- 誘発高熱療法および寒冷水治療法
- ペントキシフィリン(PTX)
- マラビロク
- スルフォラファン(ブロッコリースプラウト粉末)
- タンポポ
- 免疫抑制療法
- ホモシステイン値が高い患者
- 疾患特異的治療補助薬
- 小繊維神経障害(SFN)/自律神経障害
- 全般的な神経症状/ブレインフォグ/疲労/視覚症状
- うつ病
- DIC上昇のある患者および血栓症のエビデンスのある患者
- ワクチン誘発性心筋炎/心膜炎
- ヘルペスウイルス再活性化症候群
- 耳鳴り
- 味覚障害および嗅覚障害
- ベル麻痺/顔面知覚麻痺/視覚障害
- 脱毛症(抜け毛)
- 参考文献
推奨される治療法のまとめ
- 第一選択療法
- 補助/セカンドライン治療
- 第三選択療法
- 1日1回の間欠的絶食または1日1回の定期的絶食
- 高気圧酸素療法
- 低振幅機械刺激療法(LMMSまたは全身振動療法)
- イベルメクチン(0.2~0.3mg/kg/日)
- トリプル抗凝固療法
- 「ミトコンドリアエネルギーオプティマイザー」
- 適度な身体活動
- ビタミンD(1日4000~5000単位)およびビタミンK2(1日100mcg)
- 低用量コルチコステロイド:プレドニゾン1日10~15mgを3週間投与する。忍容性をみながら、1日10mg、その後1日5mgまで漸減する。
- L-アルギニン(1.5~2gを1日2回)とビタミンC(1000mgを1日2~3回経口投与)。
- マグネシウム(1日100~200mg)
- 低用量ナルトレキソン(1日1~4.5mg)
- オメガ3脂肪酸:EPA/DHAの組み合わせを1日1g(EPAとDHAの組み合わせ)から開始し、1日4g(活性型オメガ3脂肪酸)まで増量することを勧める。
- ナットウキナーゼ(100~200mg/2000~4000線溶単位を1日2回)。低リスクの患者には低用量アスピリン(1日81mg)を追加できる。
- N-アセチルシステイン(NAC)(600~1500mg/日)
- ヒスタミン遮断薬とマスト細胞安定剤によるマスト細胞活性化の治療
- シルデナフィルとL-アルギニン-L-シトルリンの併用または併用なし
- 日光および光バイオモジュレーション(PBM)
- スペルミジン:1日1000~2000mg(小麦胚芽抽出物)
- メラトニン(就寝前に2~6mgの徐放/延長放出)
- ARCマイクロカレント装置
- ブロメライン(500mgを1日2回)
- +/- N-アセチルシステイン(NAC)(600mgを1日2回)
- メチレンブルー(1日10~30mg)
- ニゲラサティバ(カプセル化オイル200~500mgを1日2回)
- 非侵襲的脳刺激(NIBS)
- レスベラトロールまたはフラボノイドの組み合わせ(400~500mg/日)
- ビタミンC点滴:週25gとビタミンC1000mg(1g)を1日2~3回経口投与する。
- プロバイオティクス/プレバイオティクス
- 行動修正、リラクゼーション療法、マインドフルネス療法、心理的サポート
- 迷走神経刺激およびニコチン作動薬
免責事項
本書は、主に医療従事者がワクチンで傷害を受けた患者に適切な医療を提供するためのものである。患者は新しい治療に着手する前に、必ず信頼できる医療従事者に相談すべきである。
定義
COVID-19ワクチン接種後症候群」の正式な定義は存在しないが、COVID-19ワクチンの接種と患者の臨床症状の発現開始または悪化との間に時間的相関があれば、症状が他の同時原因によって説明できない場合、COVID-19ワクチンによる傷害と診断するのに十分である。
Long-COVID/long-hauler症候群とポストワクチン症候群の症状や特徴にはかなりの重複があることに注意されたい。しかし、多くの臨床的特徴がポストワクチン症候群に特徴的であるように思われる;最も顕著なのは、ワクチン接種後に重篤な神経症状がより一般的にみられることである。さらに問題を複雑にしているのは、Long-COVID患者はワクチン接種も受けていることが多く、定義の問題をより困難にしていることである。
疫学
疾病管理センター(CDC)、国立衛生研究所(NIH)、食品医薬品局(FDA)、世界保健機関(WHO)は、特定のICD-10コードがあるにもかかわらず、COVID-19ワクチン接種後の傷害を特定の病状として認めていない(1)。不思議なことに、U12.9というコードはヨーロッパでは認められているが、米国では認められていない。この合併症の発生率を正確に分類し、記録した前向き研究はない。したがって、ポストワクチン症候群の本当の大きさは不明である。
死亡や重篤なワクチン傷害を含むCOVID-19ワクチン後の有害事象の真の発生率は不明である。このことは、米国、英国、イスラエル、その他多くの国の政府機関による意図的かつ故意のデータ操作(過少報告)によって複雑になっている(2, 3)。.
しかし、入手可能なデータは一貫して再現性があり、重篤な有害事象(SAE)の発生率は約8%であることを示している(2, 3)。最も重要なことは、CDCが管理するV-SAFEデータベースが8%のSAE発生率を示していることである(https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/vsafe.html, …icandecide.org/v-safe-data/。米国のワクチン接種集団に換算すると、これは約1800
主流の医学界がこの深刻な人道的災害を認識していないため、これらの患者は敬遠され、彼らが必要とし、当然受けるべき治療へのアクセスが拒否されている。さらに、これらの患者に関する臨床的、分子学的、病理学的データは限られており、この病態を治療するための情報を得ることはできない。したがって、ワクチン障害患者の管理に対する私たちのアプローチは、推定される病態機序、薬理学的原則、および医師と患者自身の臨床的観察に基づいている。
病因
スパイクプロテイン、特にS1セグメントがポストワクチン症候群を引き起こす主要な病因であると考えられる(図1参照)。(4-6)S1蛋白質は非常に毒性が強い。複数の病態生理学的プロセスが交錯し、重なり合いながら、ワクチン傷害の広大なスペクトルに寄与していると考えられる: (1, 7)
- 急性即時反応(数分から数時間以内)は、おそらく急性I型過敏症の結果である。
- 型過敏反応の結果であると考えられる。I型反応は、mRNA、ポリエチレングリコール(PEG)(8, 9)、またはナノ脂質粒子の他の成分に対するあらかじめ形成された抗体によるものと考えられる。さらに、PEGは複数の「補体成分」を活性化し、その活性化がアナフィラキシーと心血管系の虚脱の原因になっている可能性がある(9-11)。64,900人の医療従事者を対象としたプロスペクティブ研究で、初回のmRNAワクチン接種に対する反応を注意深くモニターしたところ、被験者の2.1%が急性アレルギー反応を報告したことがわかった(12)。
- ワクチン接種後(数時間から48時間以内)に起こる急性心筋炎/心臓突然死症候群は、特に若いアスリートに見られるが、スパイクプロテインによる代謝異常に反応して副腎髄質が産生する過剰なカテコールアミンによる「ストレス性心筋症」が原因である可能性がある。(13)
- 亜急性および慢性の心筋炎は、スパイクプロテインによって誘発された炎症反応の結果であると考えられる。(14, 15)
- ワクチンに関連した亜急性(数日)と慢性(数週間から数)の傷害は、S1誘発性の炎症反応、自己抗体の産生、凝固カスケードの活性化、二次的なウイルスの再活性化の重複した影響から生じていると考えられる。
- 炎症反応は、スパイクプロテインを介した単核球の活性化により、体内のほとんどすべての臓器で起こるが、特に脳、心臓、内分泌器官が関与している。
- Long-COVID患者やワクチン接種後の患者では、スパイクプロテインが15カ月も血中を循環している可能性がある(16-18)。スパイクプロテインはナチュラルキラー(NK)細胞の活性を阻害し、(19-22)細胞傷害性T細胞を阻害し、オートファジーを阻害する(23)。
- 脂質ナノ粒子(LNP)自体は、好中球の過剰浸潤、多様な炎症経路の活性化、様々な炎症性サイトカインやケモカインの産生によって証明されるように、非常に炎症性である(24-26)。
- スパイクプロテインに関連した神経学的症状である◦Neuro-COVIDは、神経炎症、(27)アミロイドやプリオンタンパクの産生、自己抗体、微小血管血栓症、ミトコンドリア機能障害などの複雑な相互作用に関連している。
図1 スパイク関連ワクチン誘発性疾患の複雑な病態生理
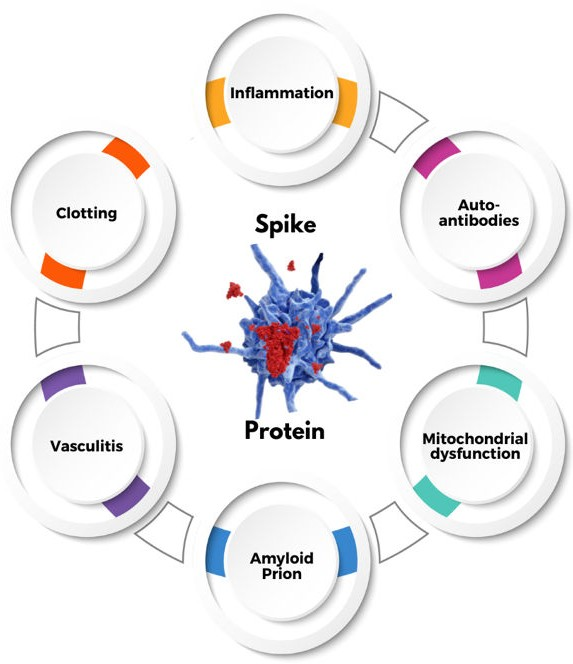
SARS-CoV-2のスパイクプロテインは、複数の内因性ヒト蛋白質と広範な配列相同性を持ち、免疫系を自己炎症性疾患や自己免疫性疾患の発症に向かわせる可能性がある(11)。スパイクプロテインの分子模倣の結果として、多様な自己抗体が報告されている。これらの自己抗体は、ギランバレー症候群(GBS)、横断性脊髄炎、免疫性血小板減少症、小繊維神経障害(SFN)/自律神経障害の原因と考えられている。(28-35)
これらの抗体の多くは、Gタンパク質共役型細胞膜レセプターに対するものである。抗ニューロナル抗体が無数の神経学的所見に関与している可能性が高い。SFN/自律神経障害は、ワクチン接種後の特徴的な障害であり、膨大な数の自己抗体と強く関連しているようだ。さらに自己抗体は、抗リン脂質症候群、全身性エリテマトーデス(SLE)、関節リウマチなど、多くの特異的症候群を引き起こす可能性がある。
スパイクプロテインは血栓形成性が高く、凝固カスケードを直接活性化する。さらに、凝固経路は単核球や血小板が産生する炎症性メディエーターを介して開始される。(6) 凝固カスケードの活性化は、大きな血栓(脳卒中や肺塞栓の原因)だけでなく、微小血栓(多くの臓器で微小梗塞を引き起こすが、特に脳)を引き起こす。新しいデータによると、ワクチンはアレルギー性疾患(湿疹、皮疹、喘息、皮膚や目のかゆみ、食物アレルギーなど)を誘発する可能性がある。マスト細胞活性化症候群(MCAS)との重複があり、2つの疾患の区別は明確ではない。(36, 37)しかし、MCASの定義によれば、MCASには同定可能な原因がなく、アレルゲン特異的IgEによるものではなく、マスト細胞のクローン性増殖も検出されない。(36)
最後に、免疫機能の変化により、休眠ウイルスや細菌性病原体の活性化が起こり、単純ヘルペス、帯状疱疹、エプスタインバーウイルス(EBV)、サイトメガロウイルス(CMV)感染の再活性化、ライム病やマイコプラズマの再活性化が起こることがある。(38-41)
ワクチン傷害患者の発症機序の根底にある共通因子は 「免疫調節障害」である。免疫機能不全の発症とその重症度は、おそらく以下のようないくつかの要因が交錯して生じている:
- 遺伝: ワクチン傷害を受けた患者の第一度近親者は、ワクチン傷害のリスクが非常に高いようだ。メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子変異を持つ患者(42)やエーラス・ダンロス症候群の患者は、傷害のリスクが高い可能性がある。MTHFR C677T多型は、最も一般的なMTHFR一塩基多型(SNP)であり、高ホモシステイン血症の最も一般的な遺伝的原因である(43)。ホモシステイン値の増加は、COVID-19患者の予後悪化と関連している。(44,45)ホモシステイン値の増加は、「スパイコパシー」に伴う微小血管障害や血栓性合併症を増強する可能性がある。(43, 46)
- mRNAの負荷と産生されるスパイクプロテインの量: (1)モデルナワクチンは100ugのmRNAを含有しているのに対し、ファイザーワクチンは30ug(5~11歳の小児では10ug)であると報告されているが、実際の濃度は大きく異なる可能性がある。
- 性別: ワクチンで傷害を受けた患者の約80%は女性である。さらに、エストロゲンによる治療は、事象/再発を悪化または促進させることが報告されている。女性は自己免疫疾患(特にSLE)のリスクが高いことが知られており、このこともこの所見を説明していると思われる。エストロゲンはグルココルチコイド受容体のシグナル伝達を阻害する。(47)さらに、エストロゲンはB細胞とT細胞の機能を調節する。
- 基礎にある栄養状態と併存疾患: 特定の既往症は、ワクチン接種後に免疫系がより反応しやすくなるようにプライミングしている可能性がある。これには、自己免疫疾患やライム病などの慢性炎症性疾患の既往がある患者が含まれる。ビタミンD、ビタミンB12、葉酸、マグネシウムなどの栄養素が欠乏しているなど、栄養状態が悪い患者は、傷害のリスクが高まる可能性がある。
COVIDワクチンによる合併症/傷害
コロナワクチンによる傷害については、3,000以上の査読付き論文が発表されている。COVID Vaccine Injuries、REACT19、Substackでこれらの研究へのリンクを見つけることができる。症状の一部を以下に示す:
- 心筋炎、心膜炎、ストレス心筋症(収縮帯壊死)
- たこつぼ心筋症
- 急性冠症候群
- 高血圧
- MIS-V、多系統炎症症候群
- 肺塞栓や脳卒中を含む血栓症(血栓促進状態)
- 脳静脈血栓症
- 血小板減少症
- 血栓性血小板減少性紫斑病
- 特発性血小板減少性紫斑病
- ヘノッホ・シェーンライン紫斑病
- 免疫介在性溶血
- 慢性基礎疾患/障害の再活性化および増悪
- 免疫異常
- 代謝異常(糖尿病)
- 月経不順
- 月経不順
- 無月経
- 自然流産
- 外陰および膣潰瘍
- 白血球破砕性血管炎、肉芽腫性血管炎、顕微鏡的多発血管炎を含む血管炎。
- ギラン・バレー症候群
- 急性脊髄炎
- 全身性エリテマトーデス
- ベル麻痺
- スティルス病
- スイーツ症候群
- 顔面神経麻痺
- 多発性硬化症
- 多発性関節痛/多発性関節炎
- クリオグロブリン血症
- リンパ節腫脹、局所および全身 ◦ アナフィラキシー
- アナフィラキシー
- アレルギー反応
- 脳内出血
- 脳卒中(血栓性脳卒中)
- 「ブレインフォグ」、認知機能低下、記憶喪失を含む全般的な神経症状。
- アルツハイマー病様症候群
- 急性多動性脳症
- 急性播種性脳脊髄炎
- 視神経脊髄炎
- 加齢臭と無嗅覚
- 失語症
- うつ病
- 新規発症のパニック障害
- 新規発症の精神病とせん妄
- 小繊維ニューロパチー
- 自律神経障害
- 体位性頻脈症候群(POTS症候群)
- 多発性単神経炎、ポリニューロパチー
- 急性炎症性神経障害
- 耳鳴り(重度、持続性)
- 感音性難聴
- 前庭炎
- 重度の頭痛および片頭痛
- 発作およびてんかん重積状態
- プリオン病、すなわち狂牛病
- 急性黄斑網膜症
- ぶどう膜炎
- 急性視神経障害
- 横紋筋融解症
- 角膜融解
- ヘルペス角膜炎
- 炎症性筋炎
- 免疫介在性肝炎
- 膵炎
- 急性腎障害
- ネフローゼ症候群
- ANCA 糸球体腎炎
- 発疹、蕁麻疹、バラ色粃糠疹を含む皮膚反応
- 尋常性天疱瘡
- 出血性水疱性壊疽性膿皮症
- 好酸球性皮膚症
- 円形脱毛症を含む脱毛症
- 乾癬
- 中毒性表皮壊死症
- 多形紅斑
- 血球貪食性組織球症
- 水痘帯状疱疹感染
- エプスタイン・バーウイルス再活性化
- CMV再活性化
- 単純ヘルペス再活性化
- 帯状疱疹髄膜炎
- ラムジーハント症候群
- 甲状腺炎
- トロサ・ハント症候群
- 急性好酸球性肺炎
- がんの再発
- 血管免疫芽球性T細胞リンパ腫を含む、新しい悪性腫瘍および珍しい悪性腫瘍
図2 ワクチン傷害は多症候性疾患である*。
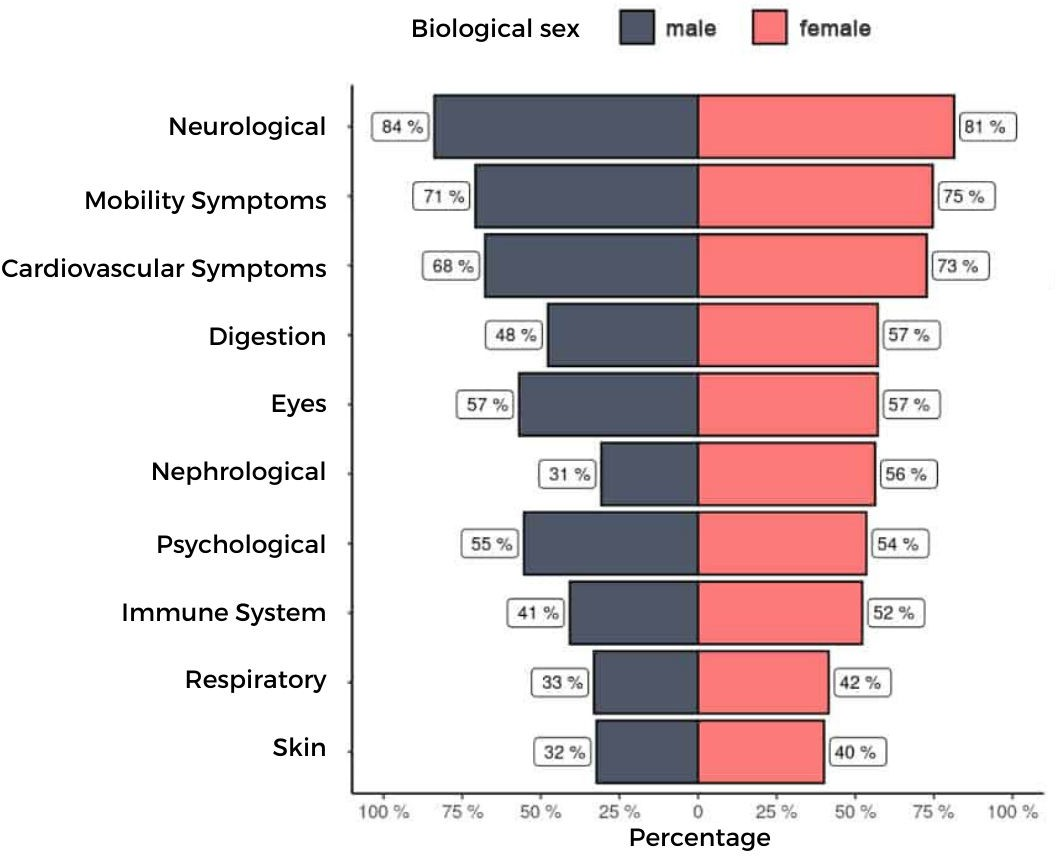
ポストワクチン症候群で記録された最も一般的な症状を図2に示す。平均して、患者は23の異なる症状を報告した。(PVSドイツ調査結果;React19/PVSドイツ react19.org/post-vaccine-syndrome-survey-results/ より許可を得て転載)。
治療アプローチ
ポストワクチン症候群の最適な管理には多くの原則が不可欠:
ポストワクチン症候群の最適な管理には、いくつかの原則が不可欠である。重要なことは、ポストワクチン症候群患者の管理について詳述した報告書がないことである。従って、私たちの治療法は、推定される病態機序、薬理学的原則、臨床観察、およびワクチン傷害患者からのフィードバックに基づいている。
ポストワクチン症候群の核となる問題は、慢性的な「免疫調節障害」である。主な治療目標は、免疫系を回復させ正常化させること、言い換えれば、身体が自然治癒するのを助けることである。私たちは、病状を悪化させる可能性のある免疫抑制剤の使用よりも、免疫系を弱め正常化させる免疫調節剤の使用と介入を推奨している。しかし、特定の自己免疫疾患を持つ患者には、免疫抑制剤の併用が適切な場合もある。
麻酔と手術についての注意:
オピオイド投与によりセロトニン症候群(SS)のリスクを高める可能性があるため、以下の薬物および/または栄養補助食品を使用する場合は、患者は麻酔チームに知らせるべきである:
- メチレンブルー
- クルクミン
- ニゲラサティバ
- 選択的セロトニン再取り込み阻害薬(SSRI)
治療戦略には2つの主要なアプローチがある。i)オートファジーを促進し、スパイクプロテインを細胞から除去すること、ii)スパイクプロテインの毒性/病原性を抑制することである。
治療は各患者の症状や症候に応じて個別化されなければならない。すべての患者が同じ介入に同じように反応するわけではない。このことは、各患者の特異的反応に応じて治療を個別化しなければならないことを示唆している。特異な所見として、ある介入(例えば高気圧酸素療法)がある患者には救命効果があるが、別の患者には全く効果がないということがある。
患者自身が対照となり、治療に対する反応によって治療計画を修正すべきである。患者にとって何が有効か、また有効でない介入を評価するために、一度に1つ(多くても2つ)の新しい介入を加えるべきである。
早期治療が重要である;治療が遅れると、治療に対する反応は減弱する可能性が高い。
患者は一次治療プロトコルから開始されるべきである;しかし、これは患者の特定の臨床的特徴に従って個別化されるべきである。一次治療プロトコルに対する反応によって、追加の治療介入を加えるか否かを決定すべきである。中心的治療に対する反応が不良な患者や重篤な難治性の患者では、第二選択治療を開始すべきである。

ポストワクチン症候群の患者は、いかなる種類のCOVID-19ワクチンも接種してはならない。同様に、Long-COVID患者はすべてのコロナワクチン接種を避けるべきである。
ポストワクチン症候群の患者は、COVID-19に罹らないようにできる限りのことをすべきである。これには予防プロトコル(FLCCCプロトコルを参照)が含まれる。
万が一ウイルスに感染した場合や感染が疑われる場合には、早期の治療が不可欠である(FLCCCプロトコルを参照)。COVID-19はワクチン傷害の症状を悪化させる可能性が高い。
ワクチンで傷害を受けた患者は、しばしば必死になってどんな薬や介入でも試してみようとする。残念ながら、悪徳業者はこのような非常に傷つきやすい患者を利用し、高価で証明されていない治療薬を売りつける。
患者は、非科学的で検証の不十分な「スパイク・プロテイン・デトックス」プログラムを避けるべきである。
高気圧酸素療法(HBOT)は、重度の神経学的傷害を負った症例や、急激な下降線を示す患者(下記参照)には考慮すべきである。
患者が臨床的な改善を示したら、さまざまな介入を一つずつ減らすか、中止すべきである。その後、より集中的でない維持療法を行う。
ベースライン検査
ワクチン接種後の患者は、しばしば広範な診断検査を受ける。これらの検査はほとんど役に立たず、通常は状況を混乱させ、不適切な治療介入につながる。このような検査は避けるべきである。そのような検査を受けることは避けるべきである。「結果が治療方針を変える場合にのみ検査を行う」という教訓を覚えておいてほしい。私たちは、4~6カ月に1回、臨床的適応があれば繰り返し行うべき、簡単で基本的なスクリーニング検査を推奨している。
- CBC(鑑別および血小板数)
- 肝機能検査を含む標準的な血液化学検査
- Dダイマー-血液凝固活性化のマーカーである。D-ダイマーが著明に上昇している患者は、おそらく遺伝性血栓症のスクリーニングを受けるべきである。
- CRP-進行中の炎症のマーカーとして(包括的な広範囲のサイトカイン/ケモカインパネルは不要であり、非常に費用がかかる。また、その結果によって治療法が変わることはない)。
- 早朝コルチゾール-自己免疫性副腎不全を発症する患者がいる )
- TSH-甲状腺疾患を除外する。
- ホモシステイン値(正常値5-15μmol/l)
- HbA1C-ワクチン傷害患者は糖尿病発症リスクが高い。
- 心疾患を除外するためにトロポニンとプロBNPを測定する。
CMV、EBV(初期抗原-D IgGまたは核抗原-IgG)、単純ヘルペス、HHV6およびマイコプラズマの血清検査/PCR-ウイルス/細菌の再活性化を除外する(治療効果が低い患者では、ライム(Bb)、バルトネラ、バベシアのダニ媒介性疾患を調べることが有用である) (41)
ビタミンDレベル(25OHビタミンD)
アレルギー体質の患者やワクチンに対する急性反応を経験した患者では、以下の検査が有用:好酸球数、IgE値、RAST検査、および/または皮膚テスト。MCASでは血清トリプターゼ、血清ヒスタミン、24時間尿N-メチルヒスタミンを考慮すべきである。(36)
ワクチン接種後間もなく深部静脈血栓症(DVT)および/または肺塞栓症を呈する患者では、遺伝性血栓症のスクリーニングが推奨される。(48)
自己抗体のスクリーニングは限定的である。全身性エリテマトーデスアンチコアグラント(B2ミクログロブリンなどが陽性の場合)とANA。ワクチン障害患者、特に自律神経機能障害/SFN患者では、G蛋白結合型細胞表面レセプター、ACE-2、神経細胞、ミエリン、その他の自己エピトープに対する広範な自己抗体が存在することが多い。これらの抗体の有無は、これらの患者の管理にはほとんど影響しない。
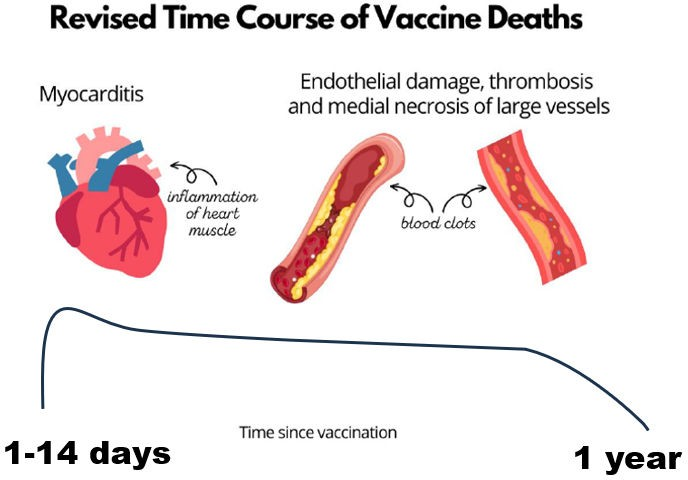
図3 COVID-19ワクチン接種後の心臓突然死の時間経過
ワクチン接種後の抗凝固療法と傷害を受けたワクチンの3つの臨床表現型
ワクチン接種後の患者における抗凝固療法の必要性は、複雑で議論のある問題である。病態生理学的および臨床症状が異なる3つの臨床表現型が存在する(図3参照)。
- 第一は、典型的な疲労、労作後倦怠感(PEM)、ブレインフォグ、その他複数の複雑な症状を特徴とする「典型的な」ワクチン接種後の多症候性症候群である(図2参照)。この症候群は、ポストワクチン・スパイク関連疾患の複雑な病態生理の一部として、微小血管炎症と微小血管血栓症によって特徴づけられる(図1参照)。
- 第二は、ワクチン最終接種後2週間以内(通常は最初の7日間)の心臓突然死である。初期の突然死は、カテコールアミン誘発性収縮帯壊死およびスパイク誘発性炎症性心筋炎(多くの場合、局所性心筋炎)に関連した不整脈死であると考えられる。
- 第3の表現型は、コロナワクチンの最終投与から1年後までに「突然死」する健康な患者である。この表現型の患者は通常、ポストワクチン症候群に特徴的な典型的症状を欠く。この症候群の病態は(政府機関によって否定されているため)研究されていないが、血栓症を合併した進行性のスパイク誘発性内皮炎の結果である可能性が高い。
心臓外科医であるガンドリー博士は、2回目のmRNA COVIDワクチンの2〜10週間後に566人の患者を対象にバイオマーカーに基づく心臓リスク評価スコア(PULS Cardiac Test、現在はSmartHealth Dx www.smarthealthdx.comが提供するSMARTVascular Dxとして利用可能)を実施し、このスコアを注射の3〜5カ月前に測定したPULSスコアと比較した(50)。PULSスコアは内皮炎症のマーカーである。この研究では、5年間の急性冠リスクスコア(ACS)が注射後のベースラインの11%から25%に上昇した。この研究は、mRNA 「注射」が内皮の炎症を進行させることを明確に示している。
さらに問題を複雑にしているのは、スパイク関連疾患の患者に発生する血栓(微小血栓とマクロ血栓)は、「通常の血栓」とは明らかに異なり、多くのユニークな特徴を持っていることである。これらの血栓はアミロイド様フィブリルを有するフィブリンに富み、線溶に対してより抵抗性である。免疫組織化学的染色により、血栓内に高濃度のスパイクプロテインが存在することが示された。このことは、スパイクプロテインが複数の機序によって凝固を活性化するだけでなく、フィブリンの構造を変化させ、アミロイド様フィブリルを形成することから重要である。
これらの情報に基づけば、抗凝固薬の使用や治療へのアプローチは、これら3つの表現型によって異なるだろうと直感的に思われる。抗凝固療法に対する暫定的なアプローチを以下に示す。医療従事者が使用できる様々な抗凝固薬の薬理学的特性について概説する。次に、多症候性ワクチン症候群の管理に対する一般的なアプローチについて概説する。
抗凝固薬の使用における最大のリスクは臨床的に重大な出血である。出血のリスクを増加させる要因は数多くある;(51-53)65歳以上(高齢は出血の主要な危険因子である)、高血圧、腎障害、糖尿病、脳卒中の既往、出血の既往、男性性などである。さらに、出血のリスクは抗凝固薬/抗血小板薬の種類が増えるほど高くなる。(52, 54)
抗血小板薬
アスピリン(ASA):
ASAは、血小板凝集の強力な促進因子であるトロンボキサンA2の産生に必要なシクロオキシゲナーゼ-1(COX-1)の活性部位を不可逆的にアセチル化することにより、臨床的に重要な抗血小板効果を発揮する。これらの効果は、1日75mg(およびそれ以上)の服用で得られる。主な副作用は出血である。出血は最も一般的に消化管で起こり、まれに致命的となる。出血は他の部位でも起こり、頭蓋内出血は最もまれ(1万人に約4人)だが、最も重篤である(症例致死率50%)。
クロピドグレル(プラビックス):
クロピドグレルは生体内で活性チオール代謝物への生体内変換を必要とする。この活性代謝物は血小板表面のADP受容体を不可逆的にブロックし、GPIIb/IIIa受容体複合体の活性化を阻害し、血小板凝集を抑制する。ASAと同様に、クロピドグレルによって遮断された血小板は残りの寿命(~7~10日間)の間影響を受ける。通常の用量は1日75mgである。
直接経口抗凝固薬(DOAC)
アピキサバン(エリキス):
遊離および血栓に結合した第Xa因子(FXa)を直接的、選択的、可逆的に阻害することにより、血小板の活性化とフィブリン血栓形成を阻害する。FXaは、第5a因子、カルシウムイオン、リン脂質からなるプロトロンビナーゼ複合体の一部として、プロトロンビンからトロンビンへの変換を触媒する。トロンビンは血小板を活性化し、フィブリノーゲンからフィブリンへの変換を触媒する。通常、1回2.5~5mgを1日2回服用する。
リバーロキサバン(イグザレルト):
作用機序はアピキサバンと類似している。通常、1回10~20mgを1日1回、夕方の食事と一緒に服用する。
経口線溶薬
ナットウキナーゼ:
ナットウキナーゼ(NK)は、納豆から精製・抽出されたセリンプロテアーゼである。納豆は、大豆を枯草菌で発酵させて作られる日本の伝統的な(チーズのような)食品である。(55-57)最近の研究で、納豆の多量摂取は心血管疾患による総死亡リスクの低下、特に虚血性心疾患による死亡リスクの低下と関連することが示された(58)。
ナットウキナーゼには強力な線溶活性、抗血栓活性、抗血小板活性がある。(55, 56, 59-62) NKはフィブリンを直接分解し、またtPAの遊離を増加させ、それに伴ってプラスミンの生成も増加させる。(63)さらに、NKはPAI-1の切断と不活性化を通して線溶を促進する。(57, 62) NKとアスピリンの抗血小板作用を比較した研究では、NKは試験管内試験および生体内試験で優れた抗血小板凝集作用と抗血栓作用を示し、コラーゲン活性化血小板からのトロンボキサンB2生成を阻害することが示された。(64)さらに、動物実験でもヒトでの研究でも、NKには降圧作用、抗動脈硬化作用、脂質低下作用、神経保護作用も認められている。(56, 62, 65)スパイク関連血栓症の患者にとって特に重要なのは、ナットウキナーゼがスパイクプロテインとアミロイド蛋白の両方を蛋白分解することである。(66)無作為化研究では、NKはスタチン(シンバスタチン)よりも頸動脈アテローム性動脈硬化を抑制する効果があることが証明された。(67)
Chenらは、高用量のNK(10 800 Fibrinolytic Units [FU]/日;〜500mg/日)が頸動脈内膜中膜の厚さと頸動脈プラークの大きさを減少させることを示した。(68)著者らは、NKとASAの相乗効果を報告している。
NKの経口投与は腸管で吸収されることが研究で示されている(65, 69)。 NKは、ほとんどのタンパク質と異なり、胃の強酸性胃液に強く、消化管の後半部で吸収される。
ナットウキナーゼの至適投与量は不明だが、100~200mg(2000~4000FU/日)を1日2回投与することが示唆されている。
ナットウキナーゼは優れた安全性プロファイルを有すると思われるが(68, 70)、出血の危険因子(高齢、腎不全、高血圧、ASA併用など)を有する患者では、まれに出血が報告されている(71, 72)。 納豆に含まれる高濃度のビタミンK2は、ワルファリンと併用した場合にINRを低下させる可能性がある。これは、製造過程でビタミンK2が除去されない場合、ナットウキナーゼサプリメントでも起こる可能性がある。妊娠中および授乳中の安全性および有効性に関する情報は不足している。
ルンブロキナーゼ:
ルンブロキナーゼはミミズから抽出した酵素群に由来する。酵素は主にミミズLumbricus rubellusから得られる。ルンブロキナーゼはナットウキナーゼと非常によく似た薬力学的特性を持つ。すなわち、フィブリン凝血塊を直接分解し、PAI-1活性を阻害し、t-PA活性を増強し、抗血小板活性を持ち、アミロイドをタンパク質分解する。(73-75) 推奨用量は300,000〜600,000IU/日(20〜40mg)である。ルンブロキナーゼは中国では急性虚血性脳卒中患者に広く使用されている。しかし、厳密にデザインされた研究が不足しているため、ルンブロキナーゼの安全性と有効性はほとんど不明である(76)。ナットウキナーゼの薬理学的、臨床的有効性、安全性は多くの実験的、臨床的研究で評価されているので、ルンブロキナーゼよりもナットウキナーゼの方が望ましい。
ワクチン接種後の表現型における抗凝固療法への暫定的アプローチ
詳細はI-PREVENT:ワクチン傷害を参照のこと。
「典型的な」ポストワクチン症候群
ナットウキナーゼ100-200mg(2000-4000FU)を1日2回投与することが推奨される。出血性合併症のリスクが低い患者には低用量アスピリン(ASA)(1日81mg)を追加することができる(危険因子を参照)。Pretoriusらは、Long-COVIDを有し、生体血液分析でフィブリンアミロイド微小血栓が認められた24人の患者における「3剤併用療法」の使用について報告している(77)。患者は1カ月間、1日1回の二重抗血小板療法(クロピドグレル75mg/アスピリン75mg)とアピキサバン5mgを1日2回投与された。その後、ASAとナットウキナーゼ単独療法が行われた。これらの著者は、”治療を受けた24症例はそれぞれ主症状が消失したと報告し、これはフィブリンアミロイド微小血栓と血小板病理スコアの減少にも反映された。”と報告した。ASAとナットウキナーゼの併用療法だけでは効果が不十分な出血リスクの低い患者(危険因子を参照)には、3剤併用療法を考慮することができる。しかし、3剤併用療法は、抗凝固療法の管理に精通した臨床医の直接の監督と監視のもとでのみ行うべきである。
早期の突然死
ワクチン接種後早期の心臓突然死は若い患者、特に男性にみられる症状である。この致死的な病態の予防に関する明確な指針がなく(この高リスク群ではワクチン接種を中止する以外)、最も問題となる表現型である。死亡の多くは身体活動中に起こり(スポーツ選手の突然死)、カテコールアミンの急上昇が介在している可能性がある(13)。そのため、ワクチン接種後少なくとも3週間は激しい身体活動を避けるべきである。マグネシウムの補給(マグネシウムの項を参照)は不整脈死のリスクを減少させる可能性がある。抗炎症剤(クルクミン、レスベラトロール、ニゲラサティバ、オメガ3脂肪酸など)の役割は不明である。
遅発性心臓死(「注射」から1年後まで)
理想的には、このような無症状の患者をリスク層別化し、中等度から高リスク群に予防的措置を開始すべきである。残念ながら、この破滅的な疾患は一般に認知されておらず、したがって研究もされていないため、リスク層別化を可能にするデータはない。しかし、この検査は高価であり、広く利用できるものではない。リスク層別化アプローチがない場合、以下の介入が急性心筋梗塞と突然死のリスクを低下させる可能性がある:(78)
- ナットウキナーゼ100-200mgを1日2回投与する
- ASA 81mg/日(出血リスクが低い場合)
- オメガ3脂肪酸を1日2~4g摂取する。
- レスベラトロールまたはフラボノイド配合サプリメント
- メラトニン 3~10mgを夜間に摂取する(徐放性)。
- ブロメライン 500mgを1日2回、N-アセチルシステイン(NAC)600mgを1日2回摂取する。
- ベルベリン 500~600mgを1日2回
- グリーン・ベース・ダイエット”-低炭水化物、高脂肪食(低オメガ6植物油)。
ポストワクチン遺症症候群の根底にある多数の複雑な病態生理学を考慮すると、また、特定の治療法の適応を示すバイオマーカーや検査が現在のところなく、困難であることから、私たちは、何が有効で何が無効かを決定するために、患者が一連の治療試験を受けるという治療法を提案する。
以下に提案する治療法は、1st、2nd、3rdラインとして順番に行われるが、私たちの臨床経験では、これは必ずしも臨床効果と相関しない。この問題について決定的な指針を得るためには、さらに多くの臨床研究が必要である。当面は、安全性、利用しやすさ、費用、機序の裏付けなどの評価とともに、臨床データの裏付けを組み合わせて、治療試験の順番を決めている。
個々の医師は、経験や、有効性と安全性の観点からの重要性の評価に従って、治療法を提供する順序を変えることができる。
私たちは、各患者が、「対照」となるように、時間的に区切られた患者に連続的な治療試験を行うことを提案する。臨床効果がないと判断された治療試験は中止すべきである。しかし、時間的に関連した識別可能な反応をもたらさない治療法でも、他の治療法の有効性を支持するために必要な場合もある(マグネシウム、ナットウキナーゼ、メラトニン、ヒドロキシクロロキンなど)。
ファーストライン(第一選択の治療法)※症状別ではない
「少しくらいの飢餓は、平均的な病人にとっては、最高の薬や最高の医者よりも効果がある。 -マーク・トウェイン(1835-1910)
断食は、免疫系の恒常性を促進し、ミトコンドリアの健康状態を改善し、幹細胞の生産を増加させる大きな効果がある。断食は、損傷したミトコンドリア(マイトファジー)、ミスフォールドしたタンパク質、異物タンパク質、損傷した細胞(オートファジー)の除去を促す。オートファジーはスパイクプロテインと、スパイクプロテインによって誘導されたミスフォールディングタンパク質を除去すると考えられる。
したがってオートファジーは、COVIDワクチンによって誘発される「スパイク症」を逆転させる上で重要な役割を果たすと考えられる。実際、オートファジーの活性化は、細胞内のスパイクプロテインを除去する唯一のメカニズムかもしれない。多くの理論的情報が、オートファジーの活性化がスパイクプロテインを除去する効果的な戦略であるという概念を支持している(79)。さらに、間欠的絶食はケトーシス状態を引き起こす可能性が高い。ケトーシスは、炎症性疾患や神経疾患の患者において、非常に有益な効果をもたらすことが証明されている(80-82)。
より詳しい情報については、FCCC Guide on intermittent Fasting and Healthy Eating Habitsを参照されたい。
COVID-19criticalcare.com/tools-and-guides/guide-to-intermittent-fasting/
イベルメクチン(IVM)
イベルメクチンと断食が相乗的に作用して、スパイクプロテインを体外に排出すると考えられる。イベルメクチンはスパイクプロテインに結合し、宿主による排除を助ける(83-88)。イベルメクチンはスパイクプロテインによる血球凝集を逆転させる。(89, 90) さらにイベルメクチンには強力な抗炎症作用がある(91-93)。イベルメクチンの試験は、第一選択の治療法に含めるべきである。
服用と投与
イベルメクチンは、吸収を高めるために食事と一緒に、または食事の直後に服用するのが最適である。
ワクチンで傷害を受けた患者は、i)イベルメクチン反応者とii)イベルメクチン非反応者の2つのカテゴリーに分類できるようだ。後者は治療が難しく、より積極的な治療が必要であるため、この区別は重要である。
私たちの共同研究ネットワークにおける最新の臨床経験に基づき、以下の治療法を提案する:
- 1日0.3mg/kgから治療を開始する。2~3週間後に改善の有無を再評価する。
- 改善が認められない場合は、投与を中止する。少数例だが、当初は使用による有益性を感じなかった患者が、IVMを中止すると症状の悪化を報告することに注意すること。このような患者にはイベルメクチンの連日投与を再開すべきである。
- 症状の改善または軽減が認められた場合、イベルメクチン反応性患者のかなりの割合が高用量でさらに大きな効果を報告していることから、通常用量を2倍(0.6mg/kg日)にして10日間の高用量試験を開始すべきである。
- 初回投与量を2倍に増量することでさらに効果が得られると患者が報告した場合は、0.6mg/kg/日の投与を継続する。
- もし患者が高用量でさらなる有益性を報告しない場合は、イベルメクチンを初期用量の1日0.3mg/kgに減量する。
- イベルメクチンが有効な患者には、回復を助けるために、長期にわたる慢性的な連日投与が必要な場合が多い。多くの患者において、イベルメクチンの連日投与を中止すると、悪化した症状が数日以内に再発することが多い。
- 離脱/中止-イベルメクチンの連日投与を含む治療レジメンで患者が臨床的に望ましい程度まで改善したら、イベルメクチンの減量および/または投与頻度の減少を試みる前に、少なくとも2カ月間は治療レジメンを維持する。症状が再発するため、多くの患者では離脱および/または中止は不可能である。
注意と禁忌
イベルメクチンは免疫抑制剤タクロリムスを服用している患者には禁忌である。ケルセチンとイベルメクチンの間の薬物相互作用の可能性があるため、これらの薬剤は同時に服用すべきではない(すなわち、朝晩ずらして服用すべきである)。妊娠中のイベルメクチンの安全性は不確かであるため、妊娠初期にはこの薬の服用を避けるべきである。(94)
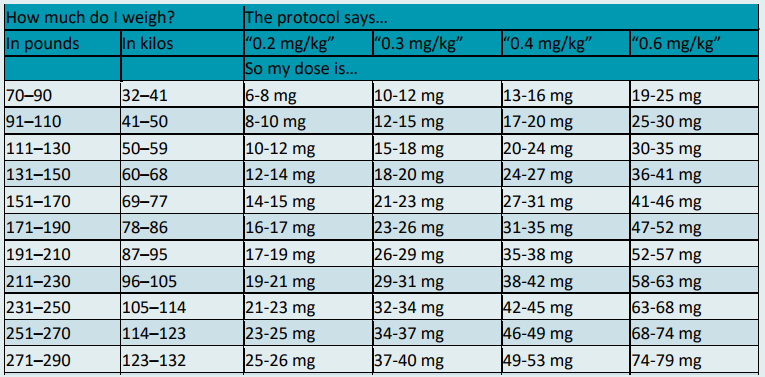
表1 イベルメクチン投与量の計算方法
イベルメクチンIvermectinの投与量は、体重とプロトコルまたはガイドに記載されている推奨量に基づいて、以下の表を用いて決定する。イベルメクチンIvermectinにはさまざまな強さ(例えば、3,6、12mg)と投与形態(錠剤、カプセル剤、点滴剤など)があることを念頭に置いて、投与量に基づいて、必要な錠剤やカプセルの数を決定する。錠剤は半分に割って服用することができるが、カプセルは半分に割ることができない。
例えば例えば、体重160kgの人が、1日に0.3mg/kgを服用する必要がある。彼女の主治医は3mgの錠剤を用意している。この表に基づけば、彼女の1日量は21-23mgである。
私の体重は?
COVIDが長く、ワクチン接種後の症状がある患者は、激しい労作後疲労や運動による症状の悪化に悩まされることが多い(95, 96)。有酸素運動は、これらの患者にとって最悪の治療介入の一つであると報告されている。
投与量と投与方法
私たちは、患者の心拍数を110BPM以下に保ちながら、症状を悪化させないような耐えられるレベルまで活動を緩やかにすることを推奨している。さらに、患者は症状が悪化する活動レベルを特定し、そのレベル以下にとどまることを目標とする必要がある。有酸素運動よりもストレッチや低レベルのレジスタンス運動が望ましい。また、ミトコンドリア機能を改善する対策、すなわちメラトニンや光生物調節も有効である。
メカニズム
慢性疲労症候群患者と同様、労作後疲労は、ミトコンドリア機能障害とATP産生増強能の低下が関係している可能性がある(95, 97, 98)。 Long-COVIDと労作後疲労を有する患者を対象とした最近の研究では、心機能と酸素供給は正常であるにもかかわらず、骨格筋に著しい。異常があることが示された(99,100)。 これらの研究は、筋繊維間の細胞外マトリックスにアミロイドが沈着し、酸化的リン酸化の低下とミトコンドリア機能障害を伴う、好気性の低い表現型への筋繊維の切り替えを示している。
L-アルギニンとビタミンC
投与量と投与方法
L-アルギニン1.5~2gを1日2回、ビタミンC1000mgを1日2~3回経口投与することを推奨する。
メカニズム
単盲検無作為化プラセボ対照試験において、参加者は1:1に無作為化され、1.66gのL-アルギニンと500mgのビタミンCの組み合わせまたはプラセボを28日間1日2回経口投与された。主要アウトカムは6分間歩行試験の歩行距離であった。(101)
28日後、L-アルギニン+ビタミンCは6分間歩行距離を増加させた(+30(40.5)m;プラセボ: +0
(75)m、p=0.001)、プラセボ(+1(6.6)kg、p=0.03)と比較して、握力(+3.4(7.5)kg)の大きな改善を誘導した。28日後、疲労が報告されたのは、活性群では2名(8.7%)、プラセボ群では21名(80.1%)であった(p<0.0001)。この研究結果は、L-アルギニンとビタミンCの併用療法の役割を調査した調査研究によっても支持されている(102)。
L-アルギニンは一酸化窒素合成酵素(NOS)による一酸化窒素(NO)産生に使われる基質である(103-105)。COVID-19急性感染症患者は血漿中のL-アルギニン濃度が低いことが証明されている(106, 107)。 さらに、COVID-19症候群は、内皮一酸化窒素合成酵素(eNOS)活性の抑制によって特徴づけられ、NOの欠乏を複雑にしている。(104)スパイクプロテイン自体がeNOS活性の阻害に大きな役割を果たしている可能性がある(108)。NOの欠乏は内皮機能障害と血栓性事象を引き起こす主要因である。さらに、NO-環状GMP経路の活性化は、活性化T細胞を調節し、サイトカイン放出を減少させ、血管修復を刺激する抗炎症作用を持つ。(109)さらに、L-アルギニンそのものが、正常なT細胞機能とマクロファージのM1-M2スイッチに重要である(103-105)。L-アルギニン/L-シトルリンサプリメントは、ホスホジエステラーゼ-5阻害剤(下記参照)と併用することで、相加的または相乗的な効果を発揮すると考えられる。
ビタミンCは、I型インターフェロンの合成を増加させるなど、重要な抗炎症作用、抗酸化作用、免疫増強作用がある(110-114)。経口ビタミンCは、マイクロバイオームにおける保護細菌集団の増殖を促進するのに役立つ。
カーディオ・ミラクルは、一酸化窒素(NO)産生を増加させるために配合された50種類以上の成分を含むサプリメントである。このサプリメントには、L-アルギニン、L-シトルリン、ビートルート(食物性硝酸塩を多く含む)、L-オルニチン、CoQ10、さらに果物と野菜の植物栄養素のブレンドが含まれている。
注意と禁忌
腎結石の既往歴のある患者にはビタミンCを避ける。
低用量ナルトレキソン(LDN)
LDNには抗炎症作用、鎮痛作用、神経調節作用があることが証明されている。(115, 116) O’Kelleyは、Long-COVID患者を対象としたbefore-after試験において、LDN(1-3mg)が安全で、疲労、幸福感を有意に改善し、胸痛や関節痛などの症状を軽減することを示した(117)。同様に、Bonillaらは、LDNの使用は、症状数の減少、臨床症状(疲労、労作後倦怠感、すっきりしない睡眠、異常な睡眠パターン)の改善、および機能的状態の改善と関連することを示した。(118)
用法・用量
1日1~4.5mgを投与する。1mg/日から開始し、必要に応じて4.5mg/日まで増量する。十分な効果を得るには2~3カ月かかる。
ナットウキナーゼ
用法・用量
100~200mg(2000~4000FU)を1日2回。低リスクの患者にはアスピリン/ASA 81mg/日を追加できる。
作用機序
ナットウキナーゼは非常に効果的な線溶および抗血小板薬であり、スパイク損傷患者の異常凝固を標的とする。加えて、ナットウキナーゼは細胞外のスパイクプロテインを溶解することが証明されており、ナットウキナーゼの抗凝固作用をさらに増強する可能性がある。(59, 64, 66)
マスト細胞活性化の治療
マスト細胞活性化症候群(MCAS)の治療に関する経験的試験は、査読付き文献と広範な臨床経験の両方によって支持されている(119-121)。H1およびH2受容体遮断薬とマスト細胞安定化薬の併用療法が望ましい。低ヒスタミン食も試行すべきである(https://www.healthline.com/health/low-histamine-dietと)(122)と(https://COVID-19criticalcare.com/tools-and-guides/histamines-and-gut-health)。
ヒスタミン遮断薬
- H1受容体遮断薬:ロラタジン10mg/日、セチリジン5~10mg/日、フェキソフェナジン180mg/日。
- H2受容体遮断薬:ファモチジン20mgを1日2回、忍容性をみながら投与する。
マスト細胞安定剤
- ケトチフェン:5mlに1mg。夜間に0.5mlから始める。強い催眠作用があるため、患者が慣れてきたら、0.5mlずつ5mlまで増量する。1日10ml(1mgを1日2回)まで増やせる患者もいる。ケトチフェンには抗ヒスタミン作用があり、マスト細胞安定化剤である。ケトチフェンは、消化管過敏症の患者に特に有用であろう。(124, 125)
- クロモリン(マスト細胞安定化薬)200mgを1日3回投与する。(123)
- 新規フラボノイドであるルテオリンは、強力なマスト細胞阻害剤であることが報告されている。(126-129) ルテオリン20-100mg/日が推奨される。
- ビタミンC;1000mgを1日2回:ビタミンCはアレルギー性疾患とMCASに強く推奨される。ビタミンCは免疫細胞機能を調節し、強力なヒスタミン阻害剤である。(130-132)
- ウコン(クルクミン);500mg/日:クルクミンはH1およびH2受容体を遮断し、マスト細胞の脱顆粒を制限することが報告されている。(133,134) クルクミンは水への溶解度が低く、体内への吸収が悪い。(135) そのため、クルクミンは伝統的に全脂肪牛乳と黒胡椒と一緒に摂取され、吸収を高めている。ナノクルクミン製剤や吸収を高めるように設計された製剤が奨励されている。(136-139)
- モンテルカスト10mg/日:この薬は一部の患者にうつ病を引き起こすことがあるので注意する。「マスト細胞安定化剤」としてのモンテルカストの有効性には疑問が呈されている。(36)
日光と光バイオモジュレーション(PBM)
太陽光には大きな治療効果がある。私たちの祖先は地球上を歩き回り、日常的に日光を浴びていた。(140)最近、BowenとAranyは、経頭蓋(ヘルメット)または全身の光バイオモジュレーション治療がCOVID-19のブレインフォグを改善することを証明した(141)。
服用と投与
患者には可能な限り(少なくとも週3回)、真昼に約30分間の日光を浴びることを勧める。真昼の散歩(疲労度以下)も有効な選択肢である。いずれの治療法も実行不可能で実用的でない場合、また紫外線照射を避けたい場合は、LEDパネルから放出される赤色および近赤外放射線を浴びることができる。この療法に興味のある人は、アリ・ウィッテン著の「The Ultimate Guide to Red Light Therapy」を読むことをお勧めする。(142)
複数の赤色光と赤外光を備えたLEDパネルが数多く市販されている(例:https://sunpowerled.com、/https://mitoredlight.com/、https://hoogahealth.com/、https://platinumtherapylights.com/。私たちは、40ドルのHooga HG24ハンドヘルド装置を使用した患者から好意的なフィードバックを得ている。患者が必要とする時間は2~10分(通常は5分前後)で、通常、週に3~4回、交互に行う。必要性の高い患者(例えば、脆弱な体質など)には毎日、まれに1日2回必要な場合もある。
LEDパネルの理論的な欠点は、660nmの赤色光と830nm/1070nmのNIR-Aを1~10nm幅でスパイク状に放射するため、太陽放射を模倣していないことである。対照的に、ThermaLight®電球(SaunaSpace® Saunas™ …sauna.space/)とTherabulb(https://www.therabulb.com/)は、太陽放射に近い放射スペ�
メカニズム
PBMは、低レベル光療法、赤色光療法、近赤外線光療法として文献に記載されている。太陽放射のスペクトル放射輝度は10nmから約3000nm、すなわち紫外線(10-400nm)、可視光線(400-700nm、赤色光600-700nm)、近赤外線(750-1500nm(NIR-A)、中赤外線(1500-3000nm(NIR-B)のスペクトルに及ぶ。
太陽光の波長の中で、NIR-A放射は最も深く組織に浸透し、最大23cmである。1000~1500nmのNIR-Aは組織を加熱するのに最適である。実際、1918年のインフルエンザ大流行の際には、「インフルエンザの野外治療」が重症患者に対する最も効果的な治療法であったようである(143)。マサチューセッツ州の外科医総長は、インフルエンザ肺炎の治療には「十分な空気と日光」が非常に効果的であったと報告している。彼は、「十分な空気と日光の価値が証明された後は、ほとんど薬は投与されなかった」と報告している。さらに彼は、「落胆していた医療スタッフは熱狂的になり、患者はついに良い結果をもたらすものが見つかったという自信をもって治療を受けた」とコメントしている。
より最近の大規模な前向き研究では、日光浴を避けることが全死因死亡の危険因子であることが証明された(144)。この研究では、日光浴を避ける人の死亡率は、日光浴が最も多いグループに比べて約2倍高かった。紫外線がビタミンD合成を促進する以外にも、赤色および近赤外線(NIR)は人間の生理機能に大きな影響を与え、特にミトコンドリア刺激剤として働き、ATP産生を増加させる。(145)
PBMの作用機序として最もよく研究されているのは、ミトコンドリア呼吸鎖の4番目のユニットであり、酸素を水に還元する最終的な役割を担うシトクロムcオキシダーゼの活性を高めることである。さらに、PBMの最も再現性のある効果のひとつは、全体的な炎症の軽減である。PBMは、活性化マクロファージにおけるM1表現型のマーカーを減少させることが示されている(145)。様々な動物モデルにおいて、反応性窒素種とプロスタグランジンの減少が多くの報告で示されている。さらに、PBMは幅広い転写因子を活性化し、細胞の生存率を向上させる。また、NIR光がミトコンドリアでのメラトニンの産生を増加させることも示唆されている(146)。Aguidaらは、ヒト細胞培養株において、赤外光がTLR-4依存性の炎症反応経路を顕著に減少させることを示した。(147)この研究では、赤外光照射により、NF-κBとAP1活性が著しく低下し、炎症性遺伝子の発現も著しく低下した。NIR-AおよびNIR-Bによって誘導される体温上昇は、必須細胞ストレス生存経路だけでなく、熱ショックタンパク質(オートファジーを増加させる)の産生を活性化する。
メラトニン
メラトニンには抗炎症作用と抗酸化作用があり、ミトコンドリア機能の強力な調節因子である。(148-152)
用法・用量
就寝前に2~6mgを徐放/徐放する。夜間750mcg(μg)~1mgから開始し、忍容性に応じて増量する。
注意事項および禁忌
代謝の遅い患者は、高用量で非常に不快で鮮明な夢を見ることがある。
ブロメライン
用法・用量
ブロメライン500mgを1日2回 +/- N-アセチルシステイン(NAC)600mgを1日2回。
作用機序
In vitroの研究では、ブロメラインがスパイクプロテインを切断することが証明されている(153-155)。この作用は、NACの添加によって増強されるようだ。(156)さらに、ブロメラインはVero E6細胞において、ACE-2とTMPRSS2の発現を用量と時間に依存して減少させることが証明された。(153)
ブロメラインは、NF-kBおよびシクロオキシゲナーゼ2(COX-2)の阻害を介して炎症性プロスタグランジンPGE-2をダウンレギュレーションし、抗炎症性PGE-1をアップレギュレーションすることにより、ユニークな免疫調節作用を示すことが実験的に証明されている(157)。
ブロメラインは、PGE-2とトロンボキサンA2のダウンレギュレーション、プラスミノーゲンからプラスミンへの変換の刺激による線溶促進、血小板凝集の防止により、用量依存的な抗凝固作用を有する。(157) Dr. Peter McCulloughは、ブロメラインとナットウキナーゼを含むワクチン傷害の治療法を提案している。(157, 158)
ニゲラ・サティバ
ニゲラ・サティバは南ヨーロッパ、北アフリカ、東南アジア原産の小低木である。ニゲラサティバの種子と油は、何千年もの間、医薬品として使用されてきた。
用法・用量
ニゲラ・サティバとして1回200~500mgのカプセル化オイルを1日2回服用する。
メカニズム
最も重要な活性成分はチモヒドロキノンである。ニゲラサティバには、抗菌、抗真菌、抗ウイルス(SARS-CoV-2)、抗炎症、抗酸化、免疫調節作用がある。(159, 160)
注意と禁忌
チモハイドロキノンはシクロスポリンとフェニトインの吸収を低下させることに注意すべきである。したがって、これらの薬剤を服用している患者は、ニゲラサティバの摂取を避けるべきである。(163) さらに、全身麻酔を受けたニゲラサティバ服用患者において、セロトニン症候群が2例報告されている(アヘン剤との相互作用の可能性が高い)。(164)
レスベラトロールまたは複合フラボノイド
レスベラトロールは植物の植物化学物質(フラボノイド)であり、顕著な生物学的特性をもっている(165-167)。最も重要なことは、オートファジーを活性化することである。(168, 169)
用法と用量
1日400~500mgを摂取する。レスベラトロールは、オートファジーの活性化において、時間制限摂食(間欠的絶食)の効果を増強する可能性がある。そのため、レスベラトロールは絶食中に摂取すべきであり、食事と一緒に摂取すべきではない。急性症状のある患者には、レスベラトロールを1回500mg、1日2回服用することが推奨される。回復した患者や予防・維持療法中の患者には、400~500mg/日で十分である。
メカニズム
レスベラトロールは、抗炎症作用、抗ウイルス作用(SARS-CoV-2)、抗酸化作用、抗凝固作用があり、マイクロバイオームにも有益な影響を及ぼす。レスベラトロールはスパイクプロテインとも結合し、オートファジーの促進を助ける。
レスベラトロールの生物学的特性の多くを持つ植物フラボノイドであるケルセチンは、レスベラトロールと相乗的に作用し、レスベラトロールの生物学的利用能を高める。(170-172)プテロスチルベンは、レスベラトロールと構造が似ているもう一つの植物性フラボノイドで、同様の生物学的特性を持つ。(173-175)しかし、プテロスチルベンのユニークな構造は、レスベラトロールよりも油溶性が高いため、吸収と細胞への取り込みが増加し、体外への排出速度が低下する。研究によると、プテロスチルベンはレスベラトロールの7倍の半減期を持ち、酸化ストレスの影響を軽減する生理活性が高い。したがって、レスベラトロールとケルセチンが配合され、理想的にはプテロスチルベンも配合された「高品質」サプリメントをお勧めする。
注意と禁忌
一般に、レスベラトロールの経口バイオアベイラビリティは低い。(176) しかし、イタドリ由来のトランス-レスベラトロールを含むバイオ強化製剤は、バイオアベイラビリティが改善されているようだ。
これらのフィトケミカルの妊娠中の安全性については、明らかにされていないため、摂取は避けるべきである。
ケルセチンとイベルメクチンの間には薬物相互作用の可能性があるため、これらの薬剤は同時に服用すべきではない(つまり、朝晩時間をずらして服用すべきである)。
ケルセチンの使用が甲状腺機能低下症と関連することはほとんどない。(177)この関連の臨床的影響は、甲状腺疾患の既往のある人や潜在性甲状腺症のある人に限られるかもしれない。甲状腺機能低下症の患者にはケルセチンを慎重に使用し、TSH値をモニターすべきである。
プロバイオティクス/プレバイオティクス
ポストワクチン症候群の患者は、一般的にビフィズス菌の減少を伴う重篤なディスバイオシスに陥っている。(178-180)
用法と用量
プレバイオティクスとプロバイオティクスの両方を含む、砂糖無添加のギリシャヨーグルトが推奨される。推奨されるプロバイオティクスには、Megasporebiotic(Microbiome labs)、TrueBifidoPro(US Enzymes)、yourgutplus+などがある。(181) さらに、グルコマンナン(こんにゃく根由来)および/またはチアシードの使用は、マイクロバイオームの正常化に必要な水溶性および不溶性食物繊維(プレバイオティクス)を提供する(182, 183)。
注意と禁忌
患者が中等度から重度の腸内細菌異常症および/または小腸細菌過剰増殖症(SBIO)を有している場合、プレバイオティクスは「悪玉菌に餌を与える」という好ましくない効果をもたらし、腸内細菌異常症の悪化を助長する可能性がある。プロバイオティクス単独や発酵食品は、常在菌や異常な腸内細菌を寄せ付けず、栄養を与える可能性が低い。ブランドにもよるが、プロ/プレバイオティクス製品の中には、炎症を促進する糖分を多く含むものもある。砂糖を添加していないブランドを探し、グルテンフリー、カゼインフリー、大豆フリーの製品を選ぶようにしよう。
迷走神経刺激とニコチン作動薬
スパイクプロテインには、S1上のRBDに「毒素様」ドメインがあり、コリン作動性系のα7ニコチン酸アセチルコリン受容体(α7 nAChR)に結合する神経毒NL-1と配列相同性があることが示されている(184-186)。神経毒NL-1は、α7 nAChRの阻害剤として知られる原型的なバンガロトキシンに類似した神経毒であり、高い結合親和性を持つ。ニコチン受容体はコリン作動性神経調節の主要な構造である。nACHRは、中枢神経系と自律神経系(迷走神経)内の神経細胞間情報伝達に不可欠な部分である。
迷走神経の機能障害は、スパイク関連損傷、特に自律神経失調症の患者によくみられる特徴である。これは、スパイクプロテインの抗コリン作用や迷走神経の炎症が関係している可能性がある。WooらはCOVID-19患者の死後迷走神経の病理組織学的特徴を調べ、主に単球からなる炎症細胞浸潤とともにSARS-CoV-2 RNAを検出した(187)。これらの著者らは、SARS-CoV-2が迷走神経の炎症に続いて自律神経機能障害を引き起こし、これがLong-COVIDで観察される自律神経失調症の一因になっている可能性があると結論づけた。
迷走神経の刺激には、抗炎症作用、鎮痛作用、抗うつ作用がある。これらの効果は、迷走神経が中枢と末梢の両方の機序を介して作用することによってもたらされる。非侵襲的迷走神経刺激には、さまざまな技術が用いられている。(188)経皮的耳介迷走神経刺激(taVNS)は、ヒトの耳を両側から支配する迷走神経の耳介枝を刺激するものである。189)同様に、Natelsonらによる小規模なパイロット研究では、Long-COVID患者14人中8人が、taVNSによる症状の改善を報告している。(190)
作動薬のリガンドであるニコチンは、nACHRに対してアセチルコリンの30倍もの親和性を示す(191)。そのため、ニコチンはスパイクプロテインをnAChRの付着から置き換え、その結果、コリン作動性シグナル伝達が損なわれなくなる可能性が示唆されている。(192)この観察は、喫煙がCOVID-19の重症度を低下させる傾向があるという所見を説明するかもしれない。(193)ポストCOVID-19症候群の患者をニコチンパッチで治療すると、症状がかなり改善することが報告されている。
(192)1-メチルニコチンアミド(1-MNA)は、ニコチン酸が代謝されるときに肝臓で産生される内因性物質である。1-MNAは抗炎症作用と抗血栓作用を示す。
(194) Long-COVID患者を対象に行われた無作為化試験では、1-MNAを投与された患者は、6分間歩行試験で有意な改善を示し、疲労が有意に軽減した。(194)
補助/セカンドライン治療 ※重要な順に列挙
高気圧酸素療法(HBOT)
(195-203) HBOTには強力な抗炎症作用があり、炎症性サイトカインを減少させ、IL-10を増加させる。さらに、HBOTはマクロファージをM2表現型に偏向させ、ミトコンドリア機能を改善する。驚くべきことに、これらの効果を媒介するのは、溶存酸素濃度の上昇よりもむしろ圧力の上昇である。HBOTは、酸素を含む場合と含まない場合の両方で、さまざまな圧力で行われる。酸素を加えると臨床反応が増大する。最大臨床反応は、高圧チャンバー(通常2.4気圧に達する)を使用して100%酸素を60~90分間投与することで達成される。HBOTを低圧チャンバー(1.5気圧以下)で酸素を補充せずに実施した場合、臨床反応は認められるものの、臨床的プラトーに達するまでに必要なセッション数が多くなるため、臨床反応は著しく低下する。
Zilberman-Itskovichらは、Long-COVID患者73人を対象に、HBOTの効果を評価する無作為化偽薬対照二重盲検試験を行った(204)。HBOT患者も偽薬患者も、マルチプレースチャンバーで1日40回(週5回)のセッションを受けた。HBOTのプロトコルはマスクによる100%酸素を2気圧で90分間吸入するものであった。HBOT群では、全体的な認知機能、注意力、遂行機能に有意な改善がみられ、エネルギー領域、精神症状、疼痛レベルにも改善がみられた。臨床的転帰は、脳MRIの灌流および微細構造変化の有意な改善と関連していた。一般に、HBOTの治療期間は臨床的反応に基づき、少なくとも40回、効果が頭打ちになるまで継続すべきである。10回行っても臨床的に効果が認められない場合は、HBOTは治療失敗と考えるべきである。この療法は、ロジスティクスの問題とコストによって制限されている。ポータブルの低圧チャンバーをレンタルしている会社が多数あり、購入も可能である。(https://www.oxyhealth.com/vitaeris-320.html, summit-to-sea.com/, www.ahahyperbarics.com/)。
三重抗凝固療法
Long-COVIDは、静脈循環、動脈循環、微小循環に関与する血栓現象を特徴とする。Long-COVIDにおける血栓症のメカニズムはまだ完全には解明されていない(205)。しかし、ウイルススパイクプロテインとRNAは、患者が急性COVIDから回復した数ヵ月後に検出されることがあり、この所見は持続的な血栓性炎症と微小血栓の発生に関与している可能性がある。(206)継続する血管内皮障害は、血小板の接着と凝固を促進し、臓器機能の障害をもたらす。
さらに、血栓症は血管炎をさらに悪化させる
Pretoriusらは、Long-COVID患者の血漿には大きな異常アミロイド微小塊が含まれていることを証明した(207-210)。さらに、これらの研究では、様々な炎症性分子がこれらの患者の上清中と可溶化血栓中の両方で有意に増加していた。
Long-COVIDの予防や治療における抗凝固薬の役割については議論のあるところである(205, 206, 211, 212)。しかし、抗凝固療法は凝固促進物質の放出や除去を防ぎ、血管内皮を障害から守り、血栓性後遺症を軽減し、Long-COVID患者の症状を改善することができる(212)。しかし、この戦略を支持する臨床データは限られている。Pretoriusらは、Long-COVIDを有し、生体血液分析でフィブリンアミロイド微小血栓が認められた24人の患者における「3剤併用療法」の使用について報告している(77)。患者は1カ月間、1日1回の二重抗血小板療法(クロピドグレル75mg/アスピリン75mg)とアピキサバン5mgを1日2回投与された。その後、ASAとナットウキナーゼ単独療法が行われた。これらの著者は、”治療を受けた24症例はそれぞれ主症状が消失したと報告し、これはフィブリンアミロイド微小血栓と血小板病理スコアの減少にも反映された。”と報告した。ASAとナットウキナーゼの併用療法だけでは効果が不十分な出血リスクの低い患者には、3剤併用療法を考慮することができる。しかし、3剤併用療法は、抗凝固療法の管理に精通した臨床医の直接の監督と監視のもとでのみ行うべきである。
ビタミンD(4000-5000単位/日)とビタミンK2(100mcg/日)
ビタミンDの投与量はベースラインのビタミンDレベルに応じて調節すべきである。しかし、ビタミンD 4000-5000単位/日とビタミンK2 100mcg/日が妥当な開始用量である。
マグネシウム
1日100~200mgから開始し、忍容性に応じて1日300mg(女性)~400mgまで増量することが推奨される。治療のエンドポイントとしては、RBC-Magが正常範囲の上限(4.2~6.8mg/dLから約6.0ng/dL)になることである。サプリメントの形で摂取できるマグネシウムには、バイオアベイラビリティが異なる少なくとも11の種類がある。一般に、マグネシウムの有機塩は無機塩よりも溶解度が高く、生物学的利用能が高い。(213)クエン酸マグネシウムは、塩の形で広く使用されているマグネシウムの一種であり、便秘の治療によく勧められる。酸化マグネシウムとクエン酸マグネシウム化合物は、医師によって一般的に処方されるが、生物学的利用能が低い。(214)リンゴ酸マグネシウム、タウリン酸マグネシウム、グリシン酸マグネシウム、L-スレオニン酸マグネシウムは生物学的利用能が高く、赤血球マグネシウム濃度を容易に上昇させる。タウリン酸マグネシウムとL-スレオニン酸マグネシウムは、脳細胞のマグネシウム濃度を著しく上昇させるので、うつ病やアルツハイマー病の治療に用いられる。(214, 215) 栄養補助食品や医薬品からマグネシウムを大量に摂取すると、下痢、吐き気、腹部のけいれんを起こすことがある。
オメガ3脂肪酸
EPA/DHAの組み合わせを推奨し、初期量は1g/日(EPAとDHAの組み合わせ)、最大4g/日(活性型オメガ3脂肪酸)まで増やす。オメガ3脂肪酸は抗炎症作用と心臓保護作用を持ち、レゾルビン産生を誘導することで炎症の解消に重要な役割を果たす。(216,217)さらに、オメガ3脂肪酸は、内皮機能を改善し、血管の炎症を抑制し、血栓症を減少させ、活性酸素種の産生を抑制することで、強力な血管保護作用をもたらすと考えられている。(218)魚類、特に天然のアトランティックサーモン(またはアラスカサーモン)は、オメガ3脂肪酸のよい供給源である。オメガ3系サプリメントには、Vascepa™(イコサペントエチル;エイコサペンタエン酸[EPA]のエチルエステル)、Lovaza™(EPAとドコサヘキサエン酸[DHA]のエチルエステルの組み合わせ)のほか、EPA/DHAの組み合わせを含む「通常の魚油サプリメント」がある。報告されているオメガ3脂肪酸の心血管および抗炎症作用が、主にEPAによるものなのか(すなわち、製薬会社のマーケティング)、EPAとDHAの組み合わせによるものなのかは不明である。(219-226)しかし、現在では、「EPAとDHAは異なるメディエーターに代謝され、心血管保護(および炎症)に関しては同等に重要である」ということが広く認識されている(223)。このデータに基づき、私たちはEPA/DHAの組み合わせを提案する。初期用量は1g/日(EPAとDHAの組み合わせ)で、最大4g/日(活性オメガ3脂肪酸)まで増加させる。
N-アセチルシステイン(NAC)
600-1500mg/日(227-229) NACは還元型グルタチオンの前駆体である。NACは細胞に浸透し、そこで脱アセチル化されてL-システインとなり、GSH合成を促進する。(229)幅広い抗酸化、抗炎症、免疫調整メカニズムに基づき、NACの経口投与は、ワクチン傷害の治療においてアジュバントの役割を果たす可能性が高い。いくつかの研究で、NACは腸でよく吸収され、NACの補充はGSHレベルの上昇に効果的であることが示された。
グルタチオンの経口摂取は吸収が悪く、一般に推奨されていない(230, 231)。 しかし、アセチルグルタチオンはグルタチオンよりも親油性で、細胞にそのまま取り込まれるほどであり、細胞内のGSHレベルを速やかに上昇させることが示されている。アセチルグルタチオン、NAC、ビタミンCを配合したサプリメントは、グルタチオンの生物学的利用能を高める可能性がある。さらに、リポソーム型グルタチオンは、組織レベル、抗酸化能、免疫機能を高めることが実証されている。(232)
シルデナフィルとL-アルギニン/L-シトルリンの併用
(233-238) シルデナフィルは1回25~100mgを1日2~3回、L-アルギニン/L-シトルリン粉末を1日2回服用する。血栓や灌流不良を伴う微小血管疾患だけでなく、ブレインフォグにも役立つ可能性がある。クルクミン、レスベラトロール、EGGG、バルプロ酸はすべて、ホスホジエステラーゼ5(PDE5)阻害剤を増強することは注目に値する。
スペルミジン
1日1000~2000mg(小麦胚芽抽出物)。スペルミジンは天然に存在するポリアミンで、レスベラトロールと同様、抗炎症作用と抗酸化作用がある。ミトコンドリア機能を維持し、心血管疾患や全死因死亡率を低下させ、寿命を延ばすことが示されている(239, 240)。さらに、レスベラトロールと同様に、スペルミジンもオートファジーを促進する。しかし、レスベラトロールとスペルミジンは異なる代謝経路でオートファジーを活性化するため、相加効果や相乗効果があると考えられる。(241)小麦胚芽、キノコ類、グレープフルーツ、リンゴ、マンゴーは、スペルミジンの高い天然供給源である。(242) 小麦胚芽のサプリメントには、バイオアベイラビリティの高いスペルミジンが多量に含まれている。1日1000~2000mgの小麦胚芽エキスの摂取が推奨されている。がん細胞はポリアミン代謝を調節していることが報告されているため、悪性腫瘍のある患者ではスペルミジンの摂取は避けたほうがよい。(243) さらに、虚血性脳卒中のリスクが高い60歳以上の男性では、スペルミジンは避けるべきである。(244)
アークマイクロカレント装置
マイクロカレントは、非侵襲的で安全な電気療法であり、一連の感覚下電流(1mA以下)を流すもので、人体が内因的に生成する電流と同程度の大きさである。感覚下生体電流は、神経系シグナル伝達、筋成長、リモデリングを含む生理学的機能を最適化することにより、成長、適応、組織修復に影響を与える。(245) ARCマイクロカレント装置は被験者の下肢に装着され、3時間の交互サイクルを経る。ワクチンで傷ついた患者からの逸話的報告によると、この装置によって症状が著しく改善されることが示唆されている。この装置が全身的な効果をもたらす生理学的メカニズムは、やや不明である。
メチレンブルー
低用量メチレンブルー(LDMB)は、ブレインフォグやその他の神経症状を有する患者に対する治療法の選択肢である。
投与量と投与方法
1日10~30mgを投与する。至適投与量は非常に個別化されており、各患者が自分に適した投与量を見つける必要がある。患者および/または医療提供者は、高品質で不純物のない医薬品グレードのメチレンブルーを購入することが重要である。患者は、1%メチレンブルー溶液(例:https://www.bphchem.com/product/methylene-blue-1-usp-grade-50-ml-1-drop-contains-0-5-mg-ofmethylene-blue/)、1%溶液への再構成が必要な粉末状のMB(例:CZTLからhttps://cztl.bz/?ref=Lwr85)、またはMB Buccal Trouches(https://troscriptions.com/products/)(口や歯が青く染まる;この影響を避けるため、Trouchesは飲み込むことができる)を購入することができる。
1%メチレンブルー溶液は、1mlの溶液中に10mgのMBを含む(および0.5mg/滴)。1%MB溶液は、1gのメチレンブルーを100mlの水に混ぜて調製する。投与にはスポイトボトルを使用する-1%溶液1滴はメチレンブルーとして約0.5mgである)。
LDMBの投与:最初の1週間は、1回5mg(0.5ml)を1日2回から開始する。1日最大30mg(3ml)に達するまで、2~3日ごとに徐々に増量する(症状、すなわち疲労の改善および/または認知機能の改善を目安に)。体を「リセット」させるため、毎週7日目は休薬する。
メカニズム
メチレンブルー(MB)には、ワクチン傷害を受けた患者に有益となりうる生物学的特性がいくつかある。MBはマイトファジー(ミトコンドリアの自食作用)を誘導し、抗炎症作用、抗酸化作用、神経保護作用、抗ウイルス作用を持つ。(246,247)2013年の研究では、メチレンブルーによる神経保護は、少なくとも部分的には、AMPKシグナル伝達の活性化によるマクロオートファジーによって媒介されることがわかった。(248)
MBはBBBを容易に通過し、神経細胞のミトコンドリアに優先的に入る。MBは脳へのバイオアベイラビリティが高く、脳組織レベルは血清レベルの10倍である(249, 250)。低用量メチレンブルー(LDMB)は、電子伝達鎖に電子を供与することにより、ミトコンドリアの呼吸を刺激する。MBは電子を複合体Iから複合体IIIに直接振り向けることができ、電子の漏出とそれに続く活性酸素の産生を避けることができる。
MBと光バイオモジュレーション(PBM)は、ミトコンドリア機能、酸化的損傷、炎症に対して同様の有益な効果を示す。そのため、MBによる治療はしばしばPBM療法と併用される。(251, 252). しかし、PBMとMBは異なるメカニズムで有益な効果を発揮するため、これら2つの治療法を併用することで、治療成績が相乗的に改善することが期待される。MBとPBMによる治療により、脳内ミトコンドリア機能と神経学的機能が改善されることは、多くの研究で示されている(250, 251, 253)。
注意と禁忌
LDMBは、尿を青色または青緑色にする。患者によっては、Herx反応を経験することがある。Herx反応は、疲労、吐き気、頭痛、筋肉痛を引き起こすことがある。ヘルクス反応を経験した場合は、プロトコルを48時間中止し、その後ゆっくりと再開する。
妊娠中または授乳中の方はMBを服用しないこと
MBは強力なモノアミン酸化酵素阻害薬(MAOI)であり、SSRIと併用すると、生命を脅かす緊急事態であるセロトニン症候群を増強する可能性がある。この併用は強く避けること。フルボキサミン(FLUVOXAMINE)、フルオエキセチン(FLUOEXETINE)、ブプロピオン(BUPROPION)、その他のSSRI-NDRI(ノルエピネピン・ドパミン再取り込み阻害薬)をMBと併用しないこと。
MBは血中セロトニン濃度を上昇させることにより、ヒドロコドン酒石酸塩の毒性を増加させる。この併用は避けるべきである。
グルコース-6-リン酸デヒドロゲン欠乏症(G6PD)の患者は、溶血性貧血を引き起こす可能性があるため、MBによる治療を受けるべきでない。
経頭蓋直流電流刺激や経頭蓋磁気刺激を用いた非侵襲的脳刺激(NIBS)は、Long-COVID患者や他の神経疾患患者の認知機能を改善することが証明されている(254-261)。NIBSは痛みがなく、きわめて安全で、投与も容易である。NIBSは、多くのPhysical Medicine and Rehabilitation Center(例えば、https://www.hopkinsmedicine.org/physical_medicine_rehabilitation/services/programs/brainstimulation/treatment.html 参照)で提供されている認知療法である。患者は、家庭用にFDA認可の装置を購入することもできる(例:https://www.fisherwallace.com)。
ビタミンCの静脈注射
毎週25g、ビタミンC1000mg(1g)を1日2~3回経口投与する。高用量のビタミンCの静脈内投与は静脈に対して「苛性」であるため、2~4時間かけてゆっくりと投与する必要がある。
さらに、患者の忍容性を評価するため、初回投与量は7.5~15gとする。1日総投与量は8~12gで忍容性は良好だが、慢性的な高用量投与は腎結石の発生と関連しているため、治療期間は制限すべきである。耐容性に応じてビタミンCの静脈内投与を中止する。
行動修正、リラクゼーション療法、マインドフルネス療法
(262)、心理的サポートは、患者の全体的な幸福と精神的健康の改善に役立つ可能性がある。(263)自殺はワクチン傷害患者における現実的な問題である。サポートグループや精神衛生の専門家との相談が重要である。太極拳は中国の伝統的な武術の一つであり、COVIDを含む疾患の予防と治療に有効であることが示されている(264, 265)。 ヨガには免疫調整作用があり、ワクチン傷害患者に有益である可能性がある。(266)
サードライン治療
低マグニチュード機械的刺激療法(LMMSまたは全身振動)
Low Magnitude Mechanical Stimulation
低周波(0.3~0.4G)、高周波(32~40Hz)の機械的刺激は、さまざまな医学的障害をもつ患者において、骨密度を増加させるだけでなく、全般的な健康の指標を増加させることが実証されている。(267)この介入は、代謝および免疫学的効果に加え、骨髄幹細胞を動員すると推測されている。ヒトの場合、比較的高い共振周波数で振動するプラットフォームの上に立つことで、足から低倍率の加速度が加えられる。これらのパラメータは非常に安全で、痛みもなく、投与も簡単だ。この療法は、理学療法センターとリハビリテーション・センターで提供されているが、非侵襲的脳刺激(NIBS)と同様に、家庭用に装置を購入することもできるhttps://www.juvent.com/health/)。
ピロロキノリンキノン、グリコリン脂質、NADH、その他の栄養素を含む「ミトコンドリア・エネルギー・オプティマイザー」
(Life Extension Energy Optimizer、Restorative Solutions Mitochondrial Nutrition PQQ、Researched Nutritionals ATP 360®およびATP Fuel®、Pure Encapsulations Mitochondria-ATPなど)(268-274)。CoQ10は推奨されない;二重盲検ランダム化比較試験において、高用量のCoQ10はプラセボと比較して、Long-COVIDに関連した症状の数や重症度を減少させなかった。(275)
低用量コルチコステロイド
プレドニン10~15mg/日を3週間投与する。忍容性をみながら、10mg/日、5mg/日と漸減する。
その他の可能性のある治療法(さらなる評価が必要)
プラスマフェレーシス
プラスマフェレーシスは、重症COVID患者の全身サイトカインレベル、凝固障害、免疫反応性を改善し、死亡率に利益をもたらす可能性がある。(276-283)Kiprovらは、Long-COVID患者における劇的な臨床的改善の症例報告を発表している。(284)この報告では、患者の炎症性マクロファージのマーカーは減少し、ナチュラルキラー細胞や細胞傷害性CD8 T細胞を含むリンパ球のマーカーは増加した。さらに、プラスマフェレシスによって自己抗体が除去され、これらの患者の凝固障害が改善されたと考えられる。私たちは、この治療法で治療されたワクチン傷害患者において、神経症状、特にSFNとブレインフォグが著明に改善したという逸話的報告を知っている。しかし、これは限られた高価な治療法であり、それ自体に合併症がないわけではない。さらに、臨床効果の持続性を明らかにする必要がある。プラズマフェレーシス/血漿交換は、ワクチン接種後の重度神経障害患者に対する治療法の選択肢だが、この治療法を広く推奨するためには、さらなるデータが必要である。
免疫グロブリン静注療法(IVIG)
ワクチン傷害の治療におけるIVIGの役割は不明である。一般集団のワクチン傷害患者におけるIVIGに対する反応はまちまちであり、長期的な改善を示す患者はほとんどいない。初期に改善がみられた患者の多くは2〜3週間で再発する。また、効果がないと報告する患者もいれば、悪化したと思われる患者もいる。非中和性抗SARS-CoV-2抗体や抗ACE-2抗体などが存在するため、IVIGが抗体依存性免疫増強(ADE)を引き起こし、症状を重度に悪化させる可能性がある。
しかし、ギランバレー症候群、横紋筋炎、免疫性血小板減少症などの特定の自己免疫症候群ではIVIGが推奨される。これらの患者には、免疫調節療法の中心的治療法を併用すべきである。小繊維神経障害患者を登録したRCTでは、IVIGは無効であることが証明された(285)。多くの患者がIVIGに初期反応を示したという事実は、この疾患の多くの側面が自己抗体によるものであるという考え方を支持している。IVIGはあらかじめ形成された抗体を除去するが、B細胞による継続的な抗体産生を防ぐことはできない。したがって、反応は短命に終わる可能性が高く、自己抗体の産生を制限する介入(中核的な免疫調節療法)が必要となる。
バルプロ酸
(286,287)デパコート、250mgを1日2-3回服用する。バルプロ酸には抗炎症作用があり、マクロファージをM2表現型に偏向させる。(288)ヒストン脱アセチル化酵素(HDAC)阻害剤は神経再生のために研究されている。さらに、バルプロ酸には重要な抗凝固作用と抗血小板作用があり(289)、熱ショックタンパク質の誘導物質でもある(290)。 バルプロ酸は神経症状に有効である。特に認知機能障害のある患者では、脳容積の減少が懸念されるため、治療は6~9カ月以内にとどめるべきである。(291)脳虚血/低酸素モデルにおいて、レスベラトロールはバルプロ酸の神経保護作用を著しく増強した。(292)さらに、レスベラトロールはバルプロ酸の毒性を逆転させることが報告されている(293, 294)。これらのデータは、レスベラトロール(500mg〜1000mgを1日2回)をバルプロ酸を処方された患者に推奨すべきであることを示唆している。
誘発性温熱療法と寒冷水治療
Long-COVID患者やワクチン傷害患者におけるサウナ入浴や寒冷療法(冷水シャワー、冷水浴)の役割は不明である(295, 296)。 定期的なサウナ入浴は、全死因死亡率や心血管死亡率を低下させ、寿命を延ばし、運動能力を向上させ、神経精神疾患患者の転帰を改善することが証明されている。(297-301) 誘発性高温熱療法は、熱ショックタンパク質の発現を増加させ、オートファジーを活性化する。さらに、温熱療法は細胞ストレス経路の発現を増加させ、抗酸化作用と抗炎症作用を持ち、ミトコンドリア機能を改善する。(295)サウナ入浴は、有酸素運動と非常によく似た生理学的効果(心拍数、脳卒中量、心拍出量の増加)を持つ。(302,303)Long-COVID患者やワクチン障害者は運動不耐性(心拍出量を増加させることができない)であるため(304)、サウナ入浴は忍容性が低い可能性がある。しかし、サウナ入浴と高体温誘導は慢性心不全患者の内皮機能と心機能を改善することが示されている(305)。 さらに最近のメタアナリシスでは、サウナ入浴が慢性心不全患者の心機能を改善することが報告されている。(306)ワオン療法(赤外線ドライサウナ)は、慢性疲労症候群患者に有望な結果を示している(307, 308)。サウナ入浴に関心のある患者は、短時間(5〜10分)のセッションに対する耐性を判断し、耐容性に応じて時間を長くする(最大20分)ことを週に3〜4回行うべきである。同様に、ワクチンによる傷害に対する寒冷療法の役割は不明である。(309, 310)
ペントキシフィリン(PTX)
PTX ER、400mgを1日3回、重度の微小循環障害がある患者に考慮すべきである。PTXは非選択的ホスホジエステラーゼ薬で、抗炎症作用と抗酸化作用をもつ。加えて、PTXは赤血球の変形性を改善し、血液の粘性を低下させるので、ワクチンによる傷害で凝固障害の発症に関連する高粘性および赤血球の凝集亢進を緩和することができる。
マラビロク
300mgを1日2回経口投与する。6~8週間が経過し、上記の治療にもかかわらず重大な症状が持続する場合、この薬剤を考慮することができる。マラビロクは高価であり、重大な副作用や薬物相互作用のリスクがある。マラビロクはC-Cケモカイン受容体5型(CCR5)拮抗薬である。多くのLong-COVID患者やワクチン接種後の患者がマラビロクによる治療を受けているが、この薬剤の役割についてはさらなる評価が必要である。(311)
スルフォラファン(ブロッコリースプラウト粉末)5
00mcg-1gを1日2回服用する。スルフォラファンは、COVID、(312-314)長期コロナポストワクチン症候群の患者に多くの潜在的利益をもたらすが、この介入を支持する臨床データは限られている。スルフォラファンは、単球/マクロファージを標的とする免疫調節作用があり、慢性炎症状態における有益性を示唆している。(312-314)スルフォラファンは、ミクログリアが介在する神経炎症と酸化ストレスの軽減に有用なサプリメントである。さらに、よく知られているように、スルフォラファンはがんの予防に重要な役割を持つ。スルフォラファンの薬理学と至適投与量は複雑である。スルフォラファン自体は不安定である。サプリメントには2つの前駆体、グルコラファニンとミロシナーゼが含まれていなければならない。ブロッコリーの「エキス」は、ミロシナーゼ酵素の活性を完全に破壊する方法で製造されている。グルコラファニンとミロシナーゼの両方を最大限に保持し、同時に阻害物質を不活性化する。
タンポポ(Taraxacum officinale)
タンポポの根、花、葉には、抗炎症作用、抗酸化作用、高脂血症作用、抗菌作用、抗凝固作用を持つさまざまな植物化学物質が含まれている(317, 318)。 タンポポがスパイクプロテインの「解毒」に効果的であることは広く報告されている。In vitroの研究では、タンポポの葉エキスがSARS-CoV-2スパイクプロテインのACEレセプターへの結合を変化させることが証明された(319)。この効果は、スパイクプロテインへの結合というよりも、ACE-2レセプターの変化(結合)によるものであると思われる。従って、タンポポエキスが実際にスパイクプロテインと結合し、このタンパク質のクリアランスを増強するのかどうかは不明である。European Scientific Cooperative on Phytotherapyは、4-10g TID(20-30mg/mlをお湯で)の用量を推奨している(320)。肝臓や胆道疾患、胆管閉塞、胆石、胆管炎、活動性の消化性潰瘍のある患者には、タンポポエキスは禁忌とされていることに注意すべきである。(320)さらに、タンポポにはカリウムが豊富に含まれているので、腎不全の患者には慎重に使用すべきである。
免疫抑制療法;原則として、免疫抑制療法は避けるべきである。なぜなら、これらの薬剤はワクチン障害患者の免疫機能障害を悪化させ、免疫恒常性の回復を妨げる可能性があるからだ。免疫抑制療法は、自己免疫症候群が確立しており、他の治療介入に失敗した患者に適応されることがある。
ホモシステイン値が高い患者
ホモシステイン値が高い患者は、葉酸の最も生物学的に活性な形態である5-メチルテトラヒドロ葉酸(5-MTHF)800mgによる治療が有効である。(321) 葉酸のみの補充は、特にMTHFR多型を持つ患者では、逆説的にホモシステイン値を上昇させる。(321) さらに、B2(リボフラビン)とビタミンB6を含むビタミンB群、マグネシウム、ビタミンDを加えるべきである。(43)
疾患特異的治療補助薬
小繊維ニューロパチー(SFN)/自律神経障害
SFNは、ワクチンで傷害を受けた患者において、最も一般的で、最も永続的で、最も障害的な合併症の一つである。神経がすでに傷害され、炎症が起きてから症状が現れるため、治療や回復が困難な場合がある。この疾患を治療する単一の特効薬は存在せず、いくつかの治療法を組み合わせて順次試みることで、ある程度の効果が期待できる個別化された治療法を見つける必要がある。
- 低用量ナルトレキソン(LDN)はSFN治療において重要な役割を果たすと思われる。
- 三環系抗うつ薬(低用量から開始し、忍容性に応じて増量する)
- ガバペンチン:300mgを1日2回投与し、忍容性に応じて増量する。
- α-リポ酸:600mg/日(α-リポ酸は熱ショック蛋白の誘導物質である)。(322, 323)
- 亜鉛 1日25mg(元素状亜鉛)と亜鉛イオノフォアのケルセチンを併用する。SFNは自己免疫疾患であり、亜鉛欠乏は自己免疫疾患の発症と関連している。(324)
- マグネシウム;1日100~400mg:マグネシウムは重要な神経安定剤である。
- レスベラトロール;1日2回500mg:レスベラトロールには、重要な抗炎症作用と免疫調節作用がある。さらに、レスベラトロールはオートファジーを活性化する。
- カーディオ・ミラクル™とL-アルギニン/L-シトルリンのサプリメント カーディオ・ミラクルは、一酸化窒素(NO)の産生を高めるために配合された50種類以上の成分を含むサプリメントである。一酸化窒素を放出するトローチや錠剤も選択肢の一つである。NOはおそらく、微小血管の流れを改善し、神経を修復する。シルデナフィルとL-アルギニン-L-シトルリンの併用(233-238);シルデナフィルは1回25~100mgを1日2~3回、L-アルギニン/L-シトルリン粉末を1日2回服用する。
- オメガ3脂肪酸2~4g/日:オメガ3脂肪酸には重要な抗炎症作用と免疫調節作用がある。
- 近赤外線光バイオモジュレーション:PBMは、NO経路を介して神経障害を改善し、軸索とシュワン細胞のミトコンドリア機能を改善すると考えられる。(325, 326)
- 全身振動療法は、小繊維神経障害の症状を改善することが示されている。(327, 328)
- 体位性頻脈症候群-十分な水分補給を確保し、圧迫ストッキングまたは腹部バインダーの使用を考慮する。
- 体位性頻脈症候群-クロニジン:0.1mgを1日2回、忍容性をみながら投与する。
- 体位性頻脈症候群-フルドロコルチゾン:0.1~0.2mg/日または甘草根(アルドステロン様化合物であるグリチルリチン酸を有する)。
- 体位性頻脈症候群-ミドドリン:1回5~10mgを1日3回服用する。
- 高気圧酸素療法(HBOT)の試験
小繊維ニューロパチー/自律神経ニューロパチーの診断は臨床診断であることに注意すべきである。(28-35) この診断を下すために、複雑で高価な検査は必要ない。
SFNは複数の自己抗体と密接に関連している。これらの自己抗体の検査は、治療方針を変えるものではないので、臨床的に有用な目的はない。
全般的な神経症状/ブレインフォグ/疲労/視覚症状
- LDNは多くの神経症状の治療において極めて重要な役割を果たすようだ。
- メチレンブルー(上記に示す)および光生物調節。
- ニゲラサティバ:200~500mgを1日2回。
- 非侵襲的脳刺激(NIBS)は、「ブレインフォグ」、記憶障害、その他の認知的問題を有する患者に考慮すべきである。
- ノルエピネフリン:ドパミン再取り込み阻害薬であるブプロピオンは、がんおよびがんに関連しない疲労を有する患者において、疲労および「ブレインフォグ」を改善することが実証されている。推奨用量は1日150mgの徐放錠である。1カ月後には1日300mgまで慎重に増量できる。ブプロピオンはメチレンブルーとの併用禁忌である。
- オキシトシン経鼻投与:オキシトシンは視床下部で産生される非ペプチドで、さまざまな脳領域(特に扁桃体と海馬)で神経ペプチドとして作用し、末梢臓器ではホルモンおよびパラクリン物質として作用する。(329-331)オキシトシンは、社会的相互作用と結合におけるその役割から、俗に「愛のホルモン」と呼ばれている。(332)オキシトシンには強力な抗炎症作用と免疫調節作用があり、神経炎症を最小限に抑える上で重要な役割を果たしている可能性がある。さらに、オキシトシンは神経細胞の成長を刺激することが証明されている(330) オキシトシンはストレス反応の調節に重要な役割を果たしている。(333)オキシトシンはまた、片頭痛の予防と治療にも関与することが報告されている。(334,335)投与方法としては、経鼻投与が好ましいようだ。Martinsらは、健康なヒトのボランティアを対象に用量設定試験を行った。著者らは、扁桃体血流の変化を測定し、逆用量反応曲線を示し、低用量ほど血流が増加することを示した。最適用量は9~18IUであると報告している。このことから、1日2回、各鼻孔に1~2パフ(1パフあたり4IU)が最適であると考えられる(1日の総投与量は16~32IU)。オキシトシンは妊娠中は避けなければならない。オキシトシン点鼻スプレーは、12~15単位/0.1ml(スプレー)に調合し、最初の1週間は各鼻孔に2回ずつBID(1日8回)で受容体をアップレギュレートするために積極的に発症時に投与し、その後は1日1回各鼻孔に2回ずつ(4/d)で維持する。(336)オキシトシンはSL液またはロゼンジでも投与できる。
- スペルミジンとレスベラトロール:実験的研究では、スペルミジンが神経炎症を抑え、アミロイドタンパク質の蓄積を減少させ、認知機能を改善することが証明されている(337, 338)。(同様に、レスベラトロールはアルツハイマー病の予防と治療に有用であることが示されている。(169)
- バルプロ酸とペントキシフィリンはこれらの患者に有用であろう。
- フルボキサミン: 12.5mg/日の低用量から開始し、忍容性に応じて徐々に増量する。フルボキサミンで著明な改善を報告する患者がいる一方で、この薬物に対する忍容性が低い患者もいるようだ。フルオキセチン20mg/日も選択肢であり、三環系抗うつ薬もある(下記のうつ病のセクションを参照)。
- これらの症状はマスト細胞活性化症候群(MCAS)が介在している可能性がある;以下の具体的な治療法を参照のこと。
うつ病
うつ病の管理については、近刊予定のFLCCCモノグラフを参照のこと。
うつ病はLong-COVIDおよびワクチン接種後の患者における深刻な問題であり、残念ながら自殺も珍しくない。(339-341)うつ病の既往歴のある患者および/またはSSRIを服用している患者は、重篤なうつ病のリスクが特に高いようだ。
- SSRIの長期服用は、セロトニン受容体や細胞内メッセンジャー経路、遺伝的・エピジェネティックな影響に長期的に影響を及ぼすため、一般的には推奨されていない。(342,343)ほとんどのSSRI/SNRI薬、特にセルトラリン、フルボキサミン、パロキセチン、ベンラファキシン、デュロキセチンは、躁病、自傷行為、自殺、怒りの爆発、身体的暴力、殺人念慮、殺人に進展する可能性のある重篤な不安と関連していることに注意すべきである。(344-347)したがって、抗うつ薬で治療を受けている患者は、これらの重篤な有害反応の発現について綿密な監視が必要である。
- ワクチン接種、COVID-19、亜鉛レベル、うつ病の間には相互作用があるようだ。(348-351)COVID-19感染とコロナワクチンは亜鉛レベルの低下につながる可能性がある。亜鉛欠乏はうつ病のリスク上昇と関連している。亜鉛による治療には抗うつ効果があり、SSRI薬物療法と相乗的に作用することが示されている。(352) そのため、亜鉛イオノフォアであるケルセチンとともに、亜鉛を1日25mg(元素として)摂取することが推奨されている。(351)
- 経頭蓋直流電流刺激や経頭蓋磁気刺激を用いた非侵襲的脳刺激(NIBS)は、うつ病の治療に非常に有効であることが証明されている(353-357)。実際、Fisher Wallace Stimulator®はうつ病、不安、不眠症の治療薬としてFDAの認可を受けている。NIBSは痛みがなく、きわめて安全で、投与も簡単だ。NIBSは、多くの理学療法センターやリハビリテーションセンターで行われている治療法として認められている。患者は、家庭用にFDA認可の装置を購入することもできる(https://www.fisherwallace.com/)。
- メチレンブルー(上記の用量)は、うつ病患者に有益であることが証明されている。(358, 359) MBと一緒にフルボキサミン、フルオキセチン、ブプロピオン、その他のSSRI-NDRIを服用しないこと。
- 光バイオモジュレーションとサウナ入浴はうつ病の治療に非常に有効であることが示されている。(300, 360-362)
- 実験モデルでは、Nigella sativaがうつ病の治療に関与することが示されている。(363)
- 腸内細菌叢の変化/ディスバイオーシスは不安やうつ病と関連しており、プロバイオティクスの使用は気分の改善に関連している(364-368)。 SARS-CoV-2感染者やワクチン接種者には腸内細菌叢異常症がみられるため、プレバイオティクスやプロバイオティクスの使用が推奨されている。(179, 180, 369, 370) プレバイオティクスとプロバイオティクス入りの無糖ギリシャヨーグルトが推奨される。推奨されるプロバイオティクスは、Megasporebiotic(Microbiome labs)、TrueBifidoPro(US Enzymes)、yourgutplus+などである。(181) さらに、グルコマンナン(こんにゃく根由来)および/またはチアシードを使用することで、マイクロバイオームの正常化に必要な水溶性および不溶性食物繊維を摂取することができる。(182, 183, 371)患者が中等度から重度の腸内細菌異常症および/または小腸細菌過剰増殖症(SBIO)を患っている場合、プレバイオティクスは「悪玉菌に餌を与える」という好ましくない効果をもたらし、腸内細菌異常症の悪化を助長する可能性がある。プロバイオティクス単独および/または発酵食品は、常在細菌や異常な腸内細菌を寄せ付けず、栄養を与える可能性が低い。
DICが高値の患者や血栓症のエビデンスがある患者
- 抗凝固療法のセクションを参照のこと。抗凝固療法の積極性を決定するため、患者の出血リスクを評価する必要がある。
- これらの患者は、少なくとも3カ月間はDOACまたはクマジンで治療し、その後、抗凝固療法を継続するかどうかを再評価すべきである。
- 出血のリスクが高くない限り、ASA 81mg/日を継続すべきである。
- 出血のリスクが高くない限り、ナットウキナーゼ100~200mgを1日2回投与することが推奨される。
- 選択された患者には3重抗凝固療法を考慮すべきである。(77) 治療期間は1カ月以内とする。三重抗凝固療法は重篤な出血のリスクを高める;この合併症に関して患者にカウンセリングを行うべきである。
- 著明な微小血管疾患/血栓症を有する患者では、ペントキシフィリンとシルデナフィルの併用療法を試みるべきである。(372, 373)
ワクチン誘発性心筋炎/心膜炎
- ACE阻害薬/ARBとカルベジロールを併用し、心機能の進行性低下を予防/制限する。
- 心膜炎患者におけるコルヒチン-0.6mg/日の経口投与;必要に応じて0.6mgを1日2回に増量する。患者が下痢を発症した場合は減量する。白血球数をモニターする。腎障害がある場合は投与量を減らす。
- 重篤な不整脈のリスクを軽減するためにマグネシウムを投与する(上記の用量を参照のこと)。
コエンザイムQ(CoQ)200~400mg/日
- オメガ3脂肪酸-EPA/DHA 2~4g/日 (378-380) 耐容性に応じて徐々に増量する。
- 抗炎症作用と抗酸化作用を持つレスベラトロールとフラバノイドの併用。
- 持続的な胸痛やその他の心疾患の徴候や症状が認められた場合は、心臓専門医または救急外来に紹介する。
ヘルペスウイルス再活性化症候群
- バルトレックス(Valtrex);500~1000mgを1日2回、7~10日間(アシクロビルも代替薬である)。(381)
- スピロノラクトン 50~100mg/日(382)。スピロノラクトンは、ウイルスのカプシド抗原合成とカプシド形成を阻害することにより、エプスタイン・バー・ウイルスに対して抗ウイルス作用を示す。スピロノラクトンは他のヘルペスウイルスに対しても抗ウイルス作用を示す可能性が高い。
- L-リジン;1000mgを1日2回 (383, 384)
- バルプロ酸;デパコート、250mgを1日2~3回。バルプロ酸はHSV-1、HSV-2、HZV、CMV、EBVに対して活性がある。(385-387)
- 亜鉛40mgを1日1回投与する
- ケルセチン 「フィトソーム」500mgを1日2回(抗ウイルス特性と亜鉛イオノフォア) (390)
耳鳴り
ポストワクチン症候群で頻繁に報告される合併症である。
耳鳴りは、対応する外部音響刺激がない場合の音の感覚を指し、したがって幻聴現象に分類される。耳鳴りの感覚は、通常、ブーン、ヒスノイズ、リンギングといった形のない音響的なものである。耳鳴りは一側性または両側性に局在することがあるが、頭部に出現することもある。(391)
患者は、基礎疾患を除外するために、耳鼻咽喉科専門医または聴覚専門医によって評価されるのが理想的である。
この障害を引き起こす疾患を管理するために、以下のような多くの治療アプローチが存在する: (391-393)
- 認知行動療法 (394)
- 耳鳴り再訓練療法、補聴器、音響療法、聴覚知覚訓練、反復経頭蓋磁気刺激などの専門療法。(391)
- 多くの薬理学的薬剤が耳鳴りの治療に使用されている。カルバマゼピンを含む抗けいれん薬は、一般的に期待外れであった。以下の薬剤は、ある程度の臨床的有用性を示している。
- 三環系抗うつ薬、特にノルトリプチリンとアミトリプチリン:(395, 396) さらに、SSRIのセルトラリンもある程度の有効性を示している。(397)
- クロナゼパムやその他のベンゾジアゼピン系薬剤:これらの薬は一時的な緩和をもたらすかもしれないが、依存性の問題があるため、長期使用は推奨されない。(398)
- メラトニンを就寝時に2~6mg徐放する。(399)
- オキシトシン点鼻薬 オキシトシンは、いくつかの神経回路、特に視床下部と扁桃体に影響を及ぼす神経伝達物質として作用する。(331)オキシトシン点鼻スプレーは、耳鳴りの治療に有望な結果を示している(1日2回、それぞれの鼻孔に1回ずつ噴霧する) (400)オキシトシンは妊娠中は避けなければならない。オキシトシン点鼻スプレーは、12~15単位/0.1ml(スプレー)に調合し、最初の1週間は各鼻孔に2回ずつBID(1日8回)で受容体をアップレギュレートするために積極的に発症時に投与し、その後は1日1回各鼻孔に2回ずつ(4/d)で維持する。(336)オキシトシンは、SL液またはロゼンジを介して投与することもできる。
- 非侵襲的脳刺激(NIBS)は、治療抵抗性の耳鳴りをコントロールするのに有効であることが証明されている。(260, 261)
味覚・嗅覚の喪失
嗅覚と味覚の喪失は、post-COVIDの患者やワクチンで傷害を受けた患者にとって厄介な症状である。味覚の喪失は通常、嗅覚の喪失に続く。嗅球への直接傷害を含む複数のメカニズムが嗅覚消失を説明する可能性がある。(401)無嗅覚症は特に治療が難しい症状である。(402)
- オキシトシン点鼻薬:オキシトシン受容体は、大脳辺縁構造と同様に、嗅覚ニューロン上に高発現している。オキシトシン点鼻スプレーは精神分裂病患者の嗅覚を改善することが証明されている。1日2回、各鼻孔に1パフずつ、合計1日16IUの投与が推奨されている(403)。 オキシトシンは妊娠中は避けなければならない。
- 嗅覚訓練は、ウイルス感染後の嗅覚喪失患者にとって、嗅覚を部分的に回復させる有望な治療法のようである(404)。
- 鼻用コルチコステロイドは効果がないようで、無嗅覚症の治療には推奨されない。(405)
ベル麻痺/顔面知覚麻痺/視覚の問題
- 低用量ナルトレキソン:1mg/日から開始し、必要に応じて4.5mg/日まで増量する。十分な効果が出るまで2~3カ月かかる。
- 低用量コルチコステロイド:10~15mg/日のプレドニゾンを3週間投与する。耐容性に応じて10mg/日、5mg/日と漸減する。
- 仕事量、ストレス、軽い運動を2~3カ月間減らす
脱毛症(抜け毛)
COVID-19感染、長期コロナポストワクチン症候群に関連して、3種類の脱毛症が報告されている。(406)
男性型脱毛症(男性型脱毛症の悪化)
円形脱毛症は自己免疫疾患であり、通常、予測不可能な斑状の脱毛をもたらす。ほとんどの場合、毛髪は4分の1程度の小さな斑点状に抜ける。円形脱毛症の治療法は現在のところない。動物における予備研究では、ケルセチンが円形脱毛症の進行を防ぎ、発毛を促進する可能性があることがわかっている。(407, 408)
特に頭皮の毛髪が一時的に薄くなる。退行性毛髪症は可逆的な病態で、ストレスの多い体験の後に毛髪が抜ける。ストレスによって大量の毛包が休止期に入る。数ヶ月以内に、それらの毛は抜け落ちてしまう。この症状は主に女性にみられ、炎症性メディエーターの発現増加に関係している可能性がある。毛髪は通常再び成長するため、特別な治療は必要ない。
- 光バイオモジュレーション治療は、発毛を促すのに非常に効果的であるようだ。(409, 410)
- オメガ3脂肪酸(Vascepa)、ビタミンD、ビタミンC、亜鉛を含む栄養補助食品は、発毛促進に有用である。(411-413)
- ミノキシジル外用剤は発毛を促進する可能性がある。(414) フィナステリド2.5mgを1日1回投与することは、男女ともに選択可能である(415)。
- バルプロ酸外用剤は発毛を促進することが示されている。(416, 417)
文献
- 1. Blaylock RL. COVID Update: What is the truth? Surgical Neurology International. 2022;13:167.
- 2. Rose J. A report on the U.S. Vaccine Adverse Events Reporting System (VAERS) of the COVID-19 messenger ribonucleic acid 9mRNA) biologicals. Science, Public Health Policy, and Law. 2021;2:59-80.
- 3. Neil M, Fenton N, Smalley J, Craig C, Guetzkow J, Rose J. Latest statistics on England mortality data suggest systematic mis-categorisation of vaccine status and uncertain effectiveness of Covid-19 vaccination. Research Gate. 2021.
- 4. Dickerman BA, Madenci AL, Gerlovin H, Kurgansky KE, Wise JK, Muniz MJ, et al. Comparative safety of BNT162b2 and mRNA-1273 vaccines in a Nationwide Cohort of US veterans. JAMA Intern. Med. 2022;182:739-46.
- 5. Colunga Biancatelli RM, Solopov P, Sharlow E, Lazo J, Marik PE, Catravas J. The SARS-CoV-2 spike protein subunit 1 induces COVID-19 like acute lung injury in K18-hACE2 transgenic mice and barrier dysfunction in human endothelial cells. Am. J. Physiol. Lung. Cell. Mol. Physiol. 2021;321:L477-L84.
- 6. Marik P, Iglesias J, Varon J, Kory P. A Scoping Review of the pathophysiology of COVID-19. International Journal of Immunopathology and Pharmacology. 2021.
- 7. Seneff S, Nigh G, Kyriakopoulos AM, McCullough PA. Innate immune suppression by SARS-C-V-2 mRNA vaccinations: The role of G-quadruplexes, exosomes and microRNAs. Food & Chemical Toxicology. 2022;164:113008.
- 8. Chen BM, Cheng TL, Roffler SR. Polyethylene glycol immunogenicity: Theorectical, clinical and practical aspects of anti-polyethylene glycol antibodies. ASC Nano. 2021;15:14022-48.
- 9. Mohamed M, Lila AS, Shimizu T, Alaaeldin E, Hussein A, Sarhan HA, Szebeni J. PEGylated liposomes: immunological responses. Science and Technology of Advanced Materials. 2019;20:710-24.
- 10. Hamad I, Hunter AC, Szebeni J, Moghimi SM. Poly (ethylene glycol)s generate complement activation products in human serum through increased alternative pathway turnover and a MASP-2 dependnet process. Molecular Immunology. 2008;46:225-32.
- 11. Seneff S, Nigh G. Worse than the disease? Reviewing some possible unintended consequences of the mRNA vavvines against COVID-19. International Journal of Vaccine Theory, Practice, and Research. 2021;2:38-79.
- 12. Blumenthal KG, Robinson LB, Camargo CA, Shenoy ES, Banerji A, Landman AB. Acute allergic reactions to mRNA COVID-19 vaccines. JAMA. 2022;325:1562-4.
- 13. Cadegiani FA. Catecholamines are the key trigger of mRNA SARS-CoV-2 and mRNA COVID-19 vaccine-induced myocarditis: a compelling hypothesis supprted by epidemiological, anatomopathological, molecular and physiological findings. Cureus. 2022;14:e27883.
- 14. Schauer J, Buddhe S, Gulhane A, Sagiv E. Persistent cardiac MRI findings in a cohort of adolescents with post COVID-19 mRNA vaccine myopericarditis. J. Pediatr. 2022.
- 15. Verma AK, Lavine KJ, Lin CY. Myocarditis after COVID-19 mRNA vaccination. N. Engl. J. Med. 2022;385:1332-4.
- 16. Roltgen K, Nielsen SC, Silva O, Younes SF, Yang F, Wirz OF. Immune imprinting, breadth of variant recognition, and germinal center response in human SARS-CoV-2 infection and vaccination. Cell. 2022;185:1-16.
- 17. Swank Z, Senussi Y, Alter G, Walt DR. Persistent circulating SARS-CoV-2 spike is associated with post-acute COVID-19 sequelae. medRxiv. 2022.
- 18. Patterson BK, Francisco EB, Yogendra R, Long E, Pise A, Hall E, et al. Persistence of SARS CoV-2 S1 protein in CD16+ monocytes in post-acute sequelae of COVID-19 (PASC) up to 15 months post-infection. Front. Immunol. 2022;12:746021.
- 19. Bortolotti D, Gentili V, Rizzo S, Rotola A, Rizzo R. SARS-CoV-2 Spike 1 protein controls natural killer cell activation via the HLA-E/NKG2A pathway. Cell. 2020;9:1975.
- 20. Gallardo-Zapata J, Maldonado-Bernal C. Natural killer cell exhaustion in SARS-CoV-2 infection. Innate Immunity. 2022;28:1-10.
- 21. Lee MJ, Leong MW, Rustagi A, Beck A, Zeng L, Holmes S. SARS-CoV-2 escapes direct NK cell killing through Nsp1-mediated downreglaion of ligands NKG2D. bioRxiv. 2022.
- 22. van Eeden C, Khqn L, Osman MS, Tevaert JW. Natural killer cell dysfunction and its role in COVID-19. Int. J. Mol. Sci. 2020;21:6351.
- 23. Gassen NC, Papies J, Bajaj T, Dethloff F, Emanuel J, Weckmann K, Heinz DE. Analysis of SARS- CoV-2 controlled autophagy reveals spermidine, MK-2206 and niclosamide as putative antiviral therapeutics. bioRxiv. 2020.
- 24. Verbeke R, Lentacker I, Smedt SC, DeWitte H. Three decades of messenger RNA vaccine development. Nanotoday. 2019;28:100766.
- 25. Parhiz H, Brenner JS, Patel PN, Papp TE, Li Q, Shi R. Added to pre-existing inflammation, mRNA- lipid nanoparticles induce inflammation exacerbations (IE). Journal of Controlled Release. 2022;344:50- 61.
- 26. Ndeupen S, Qin Z, Jacobsen S, Bouteau A, Estanbouli H, Igyarto BZ. The mRNA-LNP platform’s lipid nanoparticle component used in preclinical vaccine studies is highly inflammatory. iScience. 2021;24:103479.
- 27. Olajide O, Iwuanyanwu VU, Adegbola OD, Al-Hindawi AA. SARS-CoV-2 spike glycoprotein S1 induces neuroinflammation in BV-2 microglia. Molecular Neurobiology. 2022;59:45-458.
- 28. Oaklander AL, Mills AJ, Kelley M, Toran MK. Peripheral neuropathy evaluations of patients with prolonged long COVID. Neurol. Neuroimmunol. Neuroinflamm. 2022;9:e1146.
- 29. Burakgazi AZ. Small-fiber neuropathy possibly associated with COVID-19. Case Rep. Neurol. 2022;14:208-12.
- 30. Shouman K, Vanichkachorn G, Chesire WP, Suarez MD, Shelly S. Autonomic dysfunction following COVID-19 infection: an early experience. Clinical Autonomic Research. 2021;31:385-94.
- 31. Hinduja A, Moutairou A, Calvet JH. Sudomotor dysfunction in patients recovered from COVID-
- 19. Clinical Neurophysiology. 2021;51:193-6.
- 32. Abdelnour L, Abdalla ME, Babiker S. COVID 19 infection presenting as motor peripheral neuropathy. Journal of the Formosan Medical Association. 2020;119:1119-20.
- 33. Abrams RM, Simpson DM, Navis A, Jette N, Zhou L. Small fiber neuropathy associated with SARS- CoV-2 infection. Muscle & Nerve. 2021.
- 34. Zhou L, Shin S. Small fiber neuropathy. Practical Neurology. 2021:36.
- 35. Bednarik J, Bursova S, Dusek L, Sommer C. Etiology of small-fiber neuropathy. Journal of the Peripheral Nervous System. 2009;14:177-83.
- 36. Theoharides TC, Tsilioni I, Ren H. Recent advances in our understanding of mast cell activation- or should it be mast cell mediator disorders? Expert Rev. Clin. Immunol. 2019;15:639-56.
- 37. Weinstock LB, Brook JB, Walters AS, Goris A, Afrin LB, Molderings GJ. Mast cell activation symptoms are prevalent in Long-COVID. International Journal of Infectious Diseases. 2021;112:217-26.
- 38. Gold JE, Okyay R, Licht WE, Hurley DJ. Investigation of Long COVID prevalence and its relationship to Epstein-Barr Virus reactivation. Pathogens. 2021;10:763.
- 39. Chen T, Song J, Liu H, Zheng H, Chen C. Positive Epstein-Barr virus detection in coronavirus disease 2019 (COVID-19) patients. Scientific Reports. 2021;11:10902.
- 40. Le Balc’h P, Pinceaux K, Pronier C, Seguin P, Reizine F. Herpes simplex virus and cytomegalovirus reactivations among severe COVID-19 patients. Crit. Care. 2020;24:530.
- 41. Peluso MJ, Deveau TM, Munter SE, Ryder D, Buck A, Lu S, Goldberg SA. Evidence of recent Epstein-Barr virus reactivation in individuals experiencing Long Covid. medRxiv. 2022.
- 42. Pont G, Pastorino L, Manfredini M, Ozben T, Oliva G, Kaleci S. COVID-19 spreading across world correlates with C677T allele of the methelenetetarhydrofolate reductase (MTHFR) geneprevalence. J. Clin. Lab. Anal. 2021;35:e23798.
- 43. Karst M, Hollenhorst J, Achenbach J. Life-threatening course in coronavirus disease 2019 (COVID-19): Is there a link to methylenetetrahydrofolic acid reductase (MTHFR) polymorphism and hyperhomocysteinemia? Medical Hypotheses. 2020;114:110234.
- 44. Carpene G, Negrini D, Henry BM, Montagnana L, Lippi G. Homocysteine in coronavirus disease (COVID-19): a systematic literature review. Diagnosis. 2022.
- 45. Ponti G, Roli L, Oliva G, Manfredini M, Trenti T, Kaleci S, et al. Homocysteine (Hcy) assessment to predict outcomes of hospitalized COVID-19 patients: a multicenter study on 313 Covid-19 patients. Clin. Chem. Lab. Med. 2021;59:e354-e7.
- 46. Abu-Farha M, Al-Sabah S, Hammad MM, Hebbar P, John SE, Taher I, Mohammad A. Prognostic genetic markers for thrombosis in COVID-19 patients: A focused analysis on D-Dimer, homocysteine and thromboembolism. Fronteirs in Pharmacology. 2020;11:587451.
- 47. Duma D, Collins JB, Chou JW, Cidlowski JA. Sexually dimorphic actions of glucocorticoids provide a link to inflammatory diseases with gender differences in prevalence. Science Signaling. 2010;3(143):ra74.
- 48. Atoui A, Jarrah K, Al Mahmassani L, Bou-Fakhredin R, Taher AT. Deep venous thrombosis and pulmonary embolism after COVID-19 mRNA vaccination. Ann. Hematol. 2022;101:1111-3.
- 49. Tomassetti F, Nuccetelli M, Sarubbi S, Gisone F, Ciotti M. Evaluation of S-RBD and high specificity ACE-2 binding antibodies on SARS-CoV-2 patients after six months from infection. International Immunopharmacology. 2021;99:108013.
- 50. Gundry SR. Observational findings of PULS cardiac test findings for inflammatory markers in patients receiving mRNA vaccines. Circulation. 2021;144 (suppl. 1):A10712.
- 51. Decousus H, Tapson VF, Bergmann JF, Chong BH, Froehlich JB, Kakkar AK, et al. Factors at admission associated with bleeding risk in medical patients: findings from the IMPROVE investigators. Chest. 2011;139(1):69-79.
- 52. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS- BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest. 2010;138(5):1093-100.
- 53. Whitlock EP, Burda BU, Williams SB, Evans CV. Bleeding risks with aspirin use for primary prevention in adults: A systematic review for the U.S. Preventive Services Task Force. Ann. Intern. Med. 2016;164:826-35.
- 54. Dans AL, Connolly SJ, Wallentin L, Yang S, Nakamya J, Brueckmann M, et al. Concomitant use of antiplatelet therapy with dabigatran or warfarin in the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) trial. Circulation. 2013;127(5):634-40.
- 55. Sumi H, Hamada H, Tsushima H, Mihara H, Muraki H. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular food in Japanese diet. Experientia. 1987;43:1110-1.
- 56. Weng Y, Yao J, Sparks S, Wang KY. Nattokinase: An oral antitrombotic agent for the prevention of cardiovascular disease. Int. J. Mol. Sci. 2017;18:523.
- 57. Dabbagh F, Negahdaripour M, Berenjian A, Behfar A, Mohammadi F, Zamani M. Nattokinase: production and application. Applied Microbiology and Biotechnology. 2014;98:9199-206.
- 58. Nagata C, Wada K, Tamura T, Konishi K, Goto Y, Koda S, Tsuji M. Dietary soy and natto intake and cardiovascular disease mortality in Japanese adults: the Takayama study. Am. J. Clin. Nutr. 2017;105:426-631.
- 59. Sumi H, Hamada H, Nakanishi K, Hiratani H. Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase. Acta. Haematol. 1990;84:139-43.
- 60. Hsia CH, Shen MC, Lin JS, Wen YK, Hwang KL, Cham TM. Nattokinase decreases plasma levels of fibrinogen, factor VII, and factor VIII in human subjects. Nutrition Research. 2009;29:190-6.
- 61. Kurosawa Y, Nirengi S, Homma T, Esaki K, Ohta M. A single-dose of oral nattokinase potentiates thrombolysis and anti-coagulation profiles. Scientific Reports. 2015;5:11601.
- 62. Chen H, McGowan EM, Ren N, Lal S, Nassif N, Qu X, Lin Y. Nattokinase: A promising alternative in prevention and treatment of cardiovascular diseases. Biomarker Insights. 2018;13:1-8.
- 63. Yatagai C, Maruyama M, Kawahara T, Sumi H. Nattokinase-promoted tissue plasminogen activator release form human cells. Pathoyphysiol. Haemost. Thromb. 2009;36:227-32.
- 64. Jang JY, Kim TS, Cai J, Kim J, Kim Y, Shin K. Nattokinase improves blood flow by inhibiting platelet aggregation and thrombus formation. Lab. Anim. Res. 2013;29:221-5.
- 65. Fujita M, Ohnishi K, Takaoka S, Ogaswara K, Fukuyama R, Nakamuta H. Antihypertensive effects of continuous oral administraion of nattokinase and its fragment in spontaneously hypertensive rats. Biol. Pharm. Bull. 2011;34:1696-701.
- 66. Tanikawa T, Kiba Y, Yu J, Hsu K, Chen S, Ishii A, Suzuki R. Degradative effect of Nattokinase on spike protein of SARS-CoV-2. Molecules. 2022;27:5405.
- 67. Ren NN, Chen HJ, Li Y, Megowan GW, Lin YG. A clinical study on the effect of nattokinase on carotid artery atherosclerosis and hyperlipidemia [Chinese, Abstract in English]. Zhonghua Yi Vue Za Zhi. 2017;97:2038-42.
- 68. Chen H, Chen J, Zhang F, Li Y, Wang R, Zheng Q. Effective management of atherosclerosis progress and hyperlipidemia with nattokinase: A clinical study with 1,1062 participants. Front. Cardiovasc. Med. 2022;9:964977.
- 69. Fujita M, Hong K, Ito Y, Misawa S, Takeuchi N, Kariya K, Nishimuro S. Transport of nattokinase across the rat intestinal tract. Biol. Pharm. Bull. 1995;18:1194-6.
- 70. Gallelli G, Di Mizio G, Palleria C, Siniscalchi A, Rubino P. Data recorded in real life support the safety of Nattokinase in patients with vascular diseases. Nutrients. 2021;13:2031.
- 71. Ramachandran L, Aqeel A, Jafri A, Sidhu Y, Djirdeh TM. Nattokinase-associated hemoperitoneum in an elderly woman. Cureus. 2022;13:e20074.
- 72. Chnag YY, Liu JS, Lai SL, Wu HS, Lan MY. Cerebellar hemorrhage provoked by combinaed use of nattokinase and aspirin in a patient with cerebral microbleeds. Inter. Med. 2008;47:467-9.
- 73. Metkar SK, Girigoswami A, Vijayashree R, Girigoswami K. Attenuation of subcutaneous insulin induced amyloid mass in vivo using lumbrokinase and serratiopeptidase. International Journal of Biological Macromolecules. 2020;163:128-34.
- 74. Metkar SK, Girigoswami A, Murugesan R, Girigoswami K. Lumbrokinase for degradation and reduction of amyloid fibriles associated with amyloidosis. Journal of Applied Biomedicine. 2017;15:96- 104.
- 75. Metkar SK, Girigoswami A, Bondage DD, Shinde UG, Girigoswami K. The potential of lumbrokinase and serratiopeptidase for the degradation of AB 1-42 peptide – an invitro and insilico approach. International Journal of Neuroscience. 2022.
- 76. Chen Y, Liu Y, Zhang J, Zhou K, Zhang X, Dai H. Efficacy and safety of lumbrokinase plus aspirin versus aspirin alone for acute ischemic stroke (LUCENT): study protocl for a multicenter randomized controlled trial. Trials. 2022;23:285.
- 77. Pretorius E, Venter C, Laubshder G, Kotze M, Moremi K. Combined triple treatment of fibrin amyloid microclots and platelet pathology in individuals with long COVID/Post -acute sequelae of COVID-19 (PASC) can resolve their persistent symptoms. Research Square. 2021.
- 78. Gundry SR, Epstein J. Improvement in vascular reactivity by institution of a “green-Based” diet with supplemental fish oil and polyphenolic compounds, grape seed extract and Pycnogenol. Arteriosclerosis, Thrombosis and Vascular Biology. 2012;32:A310.
- 79. Halma MT, Saleeby Y, Marik PE. Exploring autophagy in treating spike protein-related pathology. Endocrine and Metabolic Science. 2024.
- 80. Pietrzak D, Kasperek K, Rękawek P, Piątkowska-Chmiel I. The Therapeutic Role of Ketogenic Diet in Neurological Disorders. Nutrients. 2022;14(9).
- 81. Rosenbaum M, Hall KD, Guo J, Ravussin E, Mayer LS, Reitman ML, et al. Glucose and Lipid Homeostasis and Inflammation in Humans Following an Isocaloric Ketogenic Diet. Obesity (Silver Spring). 2019;27(6):971-81.
- 82. Ji J, Fotros D, Sohouli MH, Velu P, Fatahi S, Liu Y. The effect of a ketogenic diet on inflammation- related markers: a systematic review and meta-analysis of randomized controlled trials. Nutr Rev. 2024.
- 83. Saha JK, Raihan MJ. The binding mechanism of ivermectin and levosalbutamol with spike protein of SARS-CoV-2. Struct Chem. 2021;32(5):1985-92.
- 84. Kaur H, Shekhar N, Sharma S, Sarma P, Prakash A, Medhi B. Ivermectin as a potential drug for treatment of COVID-19: an in-sync review with clinical and computational attributes. Pharmacol Rep. 2021;73(3):736-49.
- 85. Dasgupta J, Sen U, Bakshi A, Dasgupta A, Manna K, Saha C. Nsp7 and spike glycoprotein of SARS- CoV-2 are envisaged as potential targets of vitamin D and ivermectin. Preprints. 2020.
- 86. Aminpour M, Cannariato M, Preto J, Safaeerdebili E, Moracchiato A, Doria D. In Silico Analysis of the Multi-Targeted Mode of Action of Ivermectin and Related Compounds. Computation. 2022;10:51.
- 87. Choudhury A, Das NC, Patra R, Bhattacharya M, Ghosh P. Exploring the binding efficacy of ivermectin against key proteins of SARS-CoV-2 pathogenesis: an in silico approach. Future Virology. 2021;16:277-91.
- 88. Lehrer S, Rheinstein PH. Ivermectin docks to the SARS-CoV-2 spike receptor-binding domain attached to ACE2. In Vivo. 2020;34:3023-6.
- 89. Scheim DE, Vottero P, Santin AD, Hirsh AG. Sialylated Glycan Bindings from SARS-CoV-2 Spike Protein to Blood and Endothelial Cells Govern the Severe Morbidities of COVID-19. Int J Mol Sci. 2023;24(23).
- 90. Boschi C, Scheim DE, Bancod A, Militello M, Le Bideau M, Colson P, Fantini J. SARS-CoV-2 spike protein induces hemagglutination: Implications for COVID-19 morbidities and therapeutics and for vaccine adverse effects. International Journal of Molecular Sciences. 2023;23:15480.
- 91. Ci X, Li H, Yu Q, Zhang X, Yu L, Chen N, et al. Avermectin exerts anti-inflammatory effect by downregulating the nuclear transcription factor kappa-B and mitogen activated protein kinase pathway. Fundamental & Clinical Pharmacology. 2009;23:449-55.
- 92. DiNicolantonio JJ, Barroso-Arranda J, McCarty M. Ivermectin may be a clinically useful anti- inflammatory agent for late-stage COVID-19. Open Heart. 2020;7:e001350.
- 93. Yan S, Ci X, Chen N, Chen C, Li X, Chu X, Li J. Anti-inflammatory effects of ivermectin in mouse model of allergic asthma. Inflamm. Res. 2011;60:589-96.
- 94. Nicolas P, Maia MF, Bassat Q, Kobylinski KC, Monteiro W. Safety of oral ivermectin during pregnancy: a systematic review and meta-analysis. Lancet Glob. Health. 2020;8:e92-e100.
- 95. Poenaru S, Abdallah SJ, Corrales-Medina V, Cowan J. COVID-19 and post-infectious myalgic encephalomyelitis/chronic fatigue syndrome: a narrative review. Ther. Adv. Infectious Dis. 2021;8:1-16.
- 96. Raman B, Cassar MP, Tunnicliffe EM, Filippini N, Griffanti L, Okell T, et al. Medium-term effects of SARS-CoV-2 infection on multiple vital organs, exercise capacity, cognition, quality of life and mental health, post hospital discharge. EClinicalMedicine. 2022;31:100683.
- 97. Booth NE, Myhill S, McLaren-Howard J. Mitochondrial dysfunction and the pathophysiology of Myalgic Encephalolyelitis/Chronic Fatigue Syndrome (ME/CFS_. Int. J. Clin. Exp. Med. 2012;5:208-20.
- 98. Wood E, Hall KH, Tate W. Role of mitochondria, oxidative stress and the response to antioxidants in myalgic enecphalomyelitis/Chronic fatigue syndrome: A possible approach to SARS-CoV- 2 ‘long-haulers’? Chronic Diseases and Translational Medicine. 2021;7:14-26.
- 99. Appelman B, Charlton BT, Goulding RP, Kerkhoff TJ, Breedveld EA, Noort W, et al. Muscle abnormalities worsen after post-exertional malaise in long COVID. Nat Commun. 2024;15(1):17.
- 100. Colosio M, Brocca L, Gatti MF, Neri M, Crea E, Cadile F, et al. Structural and functional impairments of skeletal muscle in patients with postacute sequelae of SARS-CoV-2 infection. J Appl Physiol (1985). 2023;135(4):902-17.
- 101. Tosato M, Calvani R, Picca A, Ciciarello F, Galluzzo V, Coelho-Júnior HJ, et al. Effects of l-Arginine Plus Vitamin C Supplementation on Physical Performance, Endothelial Function, and Persistent Fatigue in Adults with Long COVID: A Single-Blind Randomized Controlled Trial. Nutrients. 2022;14(23).
- 102. Izzo R, Trimarco V, Mone P, Aloè T, Capra Marzani M, Diana A, et al. Combining L-Arginine with vitamin C improves long-COVID symptoms: The LINCOLN Survey. Pharmacol Res. 2022;183:106360.
- 103. Hurson M, Regan MC, Kirk SJ, Wasserkrug HL, Barbul A. Metabolic effects of arginine in a healthy elderly population. JPEN. 1995;19(3):227-30.
- 104. Gambardella J, Khondkar W, Morelli MB, Wang X, Santulli G, Trimarco V. Arginine and Endothelial Function. Biomedicines. 2020;8(8).
- 105. Wu G, Meininger CJ, McNeal CJ, Bazer FW, Rhoads JM. Role of L-Arginine in Nitric Oxide Synthesis and Health in Humans. Adv Exp Med Biol. 2021;1332:167-87.
- 106. Adebayo A, Varzideh F, Wilson S, Donkor K, Mone P, Lombardi A. L-Arginine and COVID-19: An update. Nutrients. 2021;13:3951.
- 107. Rees CA, Rostad CA, Mantus G, Anderson EJ, Jaggi P, Ochoa JB, Basu RK. Altered amino acid profile in patients with SARS-CoV-2 infection. PNAS. 2021;118:e2101708118.
- 108. Lei Y, Zhang J, Schiavon CR, He M, Chen L, Shen H, et al. SARS-CoV-2 spike protein impairs endothelial function via downregulating of ACE 2. Circulation Research. 2022;128:1323-6.
- 109. Martí ILAA, Reith W. Arginine-dependent immune responses. Cell Mol Life Sci. 2021;78(13):5303-24.
- 110. Marik PE. Hydrocortisone, Ascorbic Acid and Thiamine (HAT therapy) for the treatment of sepsis. Focus on ascorbic acid. Nutrients. 2018;10:1762.
- 111. Marik PE. Vitamin C for the treatment of sepsis: The scientific rationale. Pharmacol. Therapeut. 2018;189:63-70.
- 112. Colunga Biancatelli RM, Berrill M, Marik PE. The antiviral properties of vitamin C. Expert Rev. Anti Infect. Ther. 2020;18:99-101.
- 113. Miranda-Massari JR, Toro AP, Loh D, Rodriguez JR, Borges RM. The effects of vitamin C on the multiple pathological stages of COVID-19. Life. 2021;11:1341.
- 114. Holford P, Carr AC, Zawari M, Vizcaychipi MP. Vitamin C intervention for Critical COVID-19: A pragmatic review of the current level of evidence. Life. 2021;11:1166.
- 115. Younger J, Parkitny L, McLain D. The use of low-dose naltrexone (LDN) as a novel anti- inflammatory treatment for chronic pain. Clin. Rheumatol. 2014;33:451-9.
- 116. Toljan K, Vrooman B. Low-dose naltrexone (LDN) – Review of therapeutic utilization. Med. Sci. 2018;6:82.
- 117. O’Kelly B, Vidal L, McHugh T, Woo J, Avramovic G, Lambert JS. Safety and efficacy of low dose naltrexone in a long covid cohort; an interventional pre-post study. Brain Behav Immun Health. 2022;24:100485.
- 118. Bonilla H, Tian L, Marconi VC, Shafer R, McComsey GA, Miglis M, et al. Low-dose naltrexone use for the management of post-acute sequelae of COVID-19. Int Immunopharmacol. 2023;124(Pt B):110966.
- 119. Arun S, Storan A, Myers B. Mast cell activation syndrome and the link with long COVID. Br J Hosp Med (Lond). 2022;83(7):1-10.
- 120. Sumantri S, Rengganis I. Immunological dysfunction and mast cell activation syndrome in long COVID. Asia Pac Allergy. 2023;13(1):50-3.
- 121. Weinstock LB, Brook JB, Walters AS, Goris A, Afrin LB, Molderings GJ. Mast cell activation symptoms are prevalent in Long-COVID. Int J Infect Dis. 2021;112:217-26.
- 122. Comas-Basté O, Sánchez-Pérez S, Veciana-Nogués MT, Latorre-Moratalla M, Vidal-Carou MDC. Histamine Intolerance: The Current State of the Art. Biomolecules. 2020;10(8).
- 123. Castells M, Butterfield J. Mast Cell Activation Syndrome and Mastocytosis: Initial Treatment Options and Long-Term Management. J Allergy Clin Immunol Pract. 2019;7(4):1097-106.
- 124. Klooker TK, Braak B, Koopman KE, Welting O, Wouters MM, Schemann M. The mast cell stabiliser ketotifen decreases visceral hypersensitivity and improves intestinal symptoms in patients with irritable bowel syndrome. Gut. 2010;59:1213-21.
- 125. Wang J, Wang Y, Zhou H, Gu W, Wang X, Yang J. Clinical efficacy and safety of ketotifen in treating irritable bowel syndrome with diarrhea. European Journal of Gastroenterology & Hepatology. 2020;32:706-12.
- 126. Weng Z, Patel AB, Panagiotidou S, Theoharides TC. The novel flavone tetramethoxyluteolin is a potent inhibitor of human mast cells. J. Allergy Clin. Immunol. 2015;135:1044-52.
- 127. Patel AB, Theoharides TC. Methoxyluteolin inhibits neuropeptide-stimulated proinflammatory mediator release via mTOR activation from human mast cells. J. Pharmacol. Exp. Ther. 2017;361:462-71.
- 128. Theoharides TC. COVID-19, pulmonary mast cells, cytokine storms, and beneficial actions of luteolin. Biofactors. 2020;46:306-8.
- 129. Theoharides TT, Cholevas C, Polyzoidis K, Poliotis A. Long-COVID syndrome-associated brain fog and chemofog: Luteolin to the rescue. Biofactors. 2021;47:232-41.
- 130. Johnston CS. The antihistamine action of ascorbic acid. Sub-Cellular Biochemistry. 1996;25:189- 213.
- 131. Johnston CS, Martin LJ, Cai X. Antihistamine effect of supplemental ascorbic acid and neutrophil chemotaxis. J. Am. Coll. Nutr. 1992;11(2):172-6.
- 132. Johnston CS, Solomon RE, Corte C. Vitamin C depletion is associated with alterations in blood histamine and plasma free carnitine in adults. J. Am. Coll. Nutr. 1996;15(6):586-91.
- 133. Jacob A, Wu R, Zhou M, Wang P. Mechanism of the anti-inflammatory effect of Curcumin: PPAR- gamma activation. PPAR Research. 2007;2007:89369.
- 134. Kakavas S, Karayiannis D, Mastora Z. The complex interplay between immunonutrition, mast cells, and histamine signaling in COVID-19. Nutrients. 2021;13:3458.
- 135. Kunnumakkara AB, Harsha C, Banik K, Vikkurthi R, Sailo BL, Bordoloi D. Is curcumin bioavailability a problem in humans: Lessons from clinical trials. Expert Opinion on Drug Metabolism & Toxicology. 2019;15:705-33.
- 136. Moballegh Nasery M, Abadi B, Poormoghadam D, Zarrabi A, Keyhanvar P, Tavakol S, Sethi G. Curcumin delivery mediated by bio-based nanoparticles: A review. Molecules. 2020;25:689.
- 137. Valizadeh H, Danshina S, Gencer MZ, Ammari A, Sadeghi A, Aslani S. Nano-curcumin therapy, a promising method in modulating inflammatory cytokines in COVID-19 patients. International Immunopharmacology. 2020;89:107088.
- 138. Ahmadi R, Salari S, Reihani H, Eslami S. Oral nano-curcumin formulation efficacy in the management of mild to moderate outpatient COVID-19: A randomized triple-blind placebo-controlled clinical trial. Food Science & Nutrition. 2021;9:4068-75.
- 139. Rahimi HR, Nedaeinia R, Shamloo AS, Nikdoust S. Novel delivery system for natural products: Nano-curcumin formulations. AJP. 2016;6:383.
- 140. Heiskanen V, Pfiffner M, Partonen T. Sunlight and health; shifting the focus from vitamin D3 to photobiomodulation by red and near-infrared light. Ageing Research Reviews. 2022;61:101089.
- 141. Bowen R, Arany PR. Use of either transcranial or whole-body photobiomodulation treatments improves COVID-19 brain fog. J Biophotonics. 2023;16(8):e202200391.
- 142. Whitten A. The Ultimate guide to red light therapy: Archangel Ink; 2018.
- 143. Hobday RA, Cason JW. The open-air treatment of pandemic influenza. Am. J. Public Health. 2022;99 Suppl.2:S236-S42.
- 144. Lindqvist PG, Epstein E, Landin-Olsson M, Ingvar C, Nielsen K, stenbeck M, Olsson H. Avoidance of sun exposure is a risk factor for all-cause mortality: results form the Melanoma in Southern Sweden cohort. Journal of Internal Medicine. 2014;276:77-86.
- 145. Hamblin MR. Mechanisms and application of the anti-inflammatory effects of photobiomodulation. AIMS Biophys. 2017;4:337-61.
- 146. Yeager RL, Oleske DA, Sanders RA, Eells JT, Henshel DS. Melatonin as a principal component of red light therapy. Medical Hypotheses. 2007;69:372-6.
- 147. Aguida B, Pooam M, Ahmad M, Jourdan N. Infrared light therapy relieves TLR-4 dependent hyper-inflammation of the type induced by COVID-19. Communicative & Integrative Biology. 2021;14(1):200.
- 148. Molina-Carballo A, Palacios-Lopez R, Jerez-Calero A, Agil A. Protective effect of melatonin administration against SARS-CoV-2 infection: A systematic review. Current Issues in Molecular Biology. 2022;44:31-45.
- 149. Hasan ZT, AlAtrakji MQ, Mehuaiden AK. The effect of melatonin on thrombosis, sepsis and mortality rate in COVID-19 patients. International Journal of Infectious Diseases. 2022;114:79-84.
- 150. Reiter RJ, Sharma R, Ma Q, Liu C, Manucha W, Abreu-Gonzalez P. Plasticity of glucose metabolism in activated immune cells: advantages for melatonin inhibition of COVID-19 disease. Melatonin Res. 2020;3:362-79.
- 151. Reiter RR, Sharma R, Castillo R, Marik PE, Rodriguez AD, Cardinali DP. Coronavirus- 19,Monocyte/Macrophage glycolysis and inhibition by melatonin. J. SARS-CoV2 COVID. 2021;2:29-31.
- 152. Colunga Biancatelli RM, Berrill M, Mohammed YH, Marik PE. Melatonin for the treatment of sepsis: the scientific rationale. J. Thorac. Dis. 2020;12 (Suppl 1):S54-S65.
- 153. Reid PM, Borgstahl GE, Radhakrishnan P. Bromelain inhibits SARS-CoV-2 infection via targeting ACE-2, TMPRSS2, and spike protein. Clin. Transl. Med. 2021;11:e281.
- 154. Tallei TE, Yelnetty A, Idroes R, Emran TB, Sippi W. An analysis based on molecular docking and molecular dynamics simulation study of Bromelain as anti-SARS-CoV-2 variants. Front. Pharmacol. 2021;12:717757.
- 155. Sagar S, Rathinavel AK, Lutz WE, Struble LR, Khurana S. Bromelain in hibits SARS-CoV-2 infection in VeroE6 cells. bioRxiv. 2020.
- 156. Akhter J, Queromes G, Pillai K, Badar S, Frobert E, Valle SJ. The combination of bromelain and acetylcysteine (BromAc) synergistically inactivates SARS-CoV-2. Viruses. 2021;13:425.
- 157. McCullough PA, Proctor BC, Wynn C. Clinical Rationale for SARS-CoV-2 Base Spike Protein Detoxification in Post COVID-19 and Vaccine Injury Syndromes. Journal of American Phyicians and Surgeons. 2023;28:90-3.
- 158. Hulscher N, Procter BC, Wynn C, McCullough PA. Clinical Approach to Post-acute Sequelae After COVID-19 Infection and Vaccination. Cureus. 2023;15(11):e49204.
- 159. Islam MT, Guha B, Hosen S, Alam T, Shahadat S. Nigellalogy: A review on Nigella Sativa. MOJ Bioequiv. Availab. 2017;3:00056.
- 160. Ashraf S, Ashraf S, Ashraf M, Imran MA, Kalsoom L, Siddiqui UN, Farooq I. Honey and Nigella sativa against COVID-19 in Pakistan (HNS-COVID-PK): A multi-center placebo-controlled randomized clinical trial. medRxiv. 2021.
- 161. Barbash IJ, Davis BS, Yabes JG, Seymour CW, Angus DC, Kahn JM. Treatment patterns and clinical outcomes after the introduction of the Medicare Sepsis Performance Measure (SEP-1). Ann. Intern. Med. 2021.
- 162. Fakhar-e-Alam Kulyar M, Li R, Mehmood K, Waqas M, Li K, Li J. Potential influence of Nagella sativa (Black cumin) in reinforcing immune system: A hope to decelerate the COVID-19 pandemic. Phytomedicine. 2021;85:153277.
- 163. Hannan MA. Black Cumin (Nigella sativa L.): A Comprehensive Review on Phytochemistry, Health Benefits, Molecular Pharmacology, and Safety. Nutrients. 2021;13(6).
- 164. Warner ME, Naranjo J, Pollard EM, Weingarten TN, Warner MA. Serotonergic medications, herbal supplements, and perioperative serotonin syndrome. Can. J. Anaesth. 2017;64:940-6.
- 165. Gligorijevic N, Stanic-Vucinic D, Radomirovic M, Stajadinovic M, Khulal U, Nedic O. Role of resveratrol in prevention and control of cardiovascular disorders and cardiovascular complications related to COVID-19 disease: Mode of action and approaches explored to increase its bioavailability. Molecules. 2021;26:2834.
- 166. Pandey P, Rane JS, Chatterjee A, Kumar A, Khan R, Prakash A, Ray S. Targeting SARS-CoV-2 spike protein of COVID-19 with naturally occuring phytochemicals: an in silico study for drug development. Journal of Biomolecular Structure and Dynamics. 2020.
- 167. de Sa Coutinho D, Pacheco MT, Frozza RL, Bernardi A. Anti-inflammatory effects of resveratrol: Mechanistic insights. International Journal of Molecular Sciences. 2018;19:1812.
- 168. Park D, Jeong H, Lee MN, Koh A, Kwon O, Yang YR, et al. Resveratrol induces autophagy by directly inhibiting mTOR through ATP competition. Scientific Reports. 2016;6:21772.
- 169. Kou X, Chen N. Resveratrol and natural autophagy regulator for prevention and treatment of Alzheimers disease. Nutrients. 2017;9:927.
- 170. De Santi C, Pietrabissa A, Spisni R, Mosca F, Pacifici GM. Sulphation of resveratrol, a natural compound present in wine, and its inhibition by natural flavonoids. Xenobiotica. 2000;30:857-66.
- 171. Yang JY, Della-Fera MA, Rayalam S, Ambati S, Hartzell DL, Park HJ, Baile CA. Enhanced inhibition of adipogenesis and induction of apoptosis in 3T3-L1 adipocytes with combinations of resveratrol and quercetin. Life Sciences. 2008;82:1032-9.
- 172. Saeedi-Boroujeni A, Mahmoudian-Sani MR. Anti-inflammatory potential of Quercetin in COVID- 19 treatment. J. Inflamm. 2021;18:3.
- 173. Chan EW, Wong CW, Tan YH, Foo JP, Wong SK. Resveratrol and pterostilbene: A comparative overview of their chemistry, biosynthesis, plant sources and pharmacological properties. Journal of Applied Pharmaceutical Science. 2019;9:124-9.
- 174. Chang J, Rimando A, Pallas M, Camins A, Porquet D, Reeves J, Smith MA. Low-dose pterostilbene, but not resveratrol, is a potent neuromodulator in aging and Alzheimers’s disease. Neurobiology of Aging. 2012;33:2062-71.
- 175. Liu Y, You Y, Lu J, Chen X, Yang Z. Recent advances in synthesis, bioactivity, and pharmacokinetics of Pterostilbene an important analog of resveratrol. Molecules. 2020;25:5166.
- 176. Walle T. Bioavailability of resveratrol. Annals of the New York Academy of Sciences. 2011;1215:9-15.
- 177. Sathyapalan T, Manuchehri AM, Thatcher NJ, Rigby AS, Chapman T. The effect of soy phytoestrogen supplementation on thyroid status and cardiovascular risk markers in patients with subclinical hypothyroidism: A randomized, double-blind, crossover study. J. Clin. Endocrinol. Metab. 2020;96:1422-49.
- 178. Gutierrez-Castrellon P, Gandara-Marti T, Abreu AT, Nieto-Rufino CD, Lopez-Orduna E. Probiotic improves symptomatic and viral clearance in Covid-19 outpatients: a randomized, quadruple-blinded, placebo-conttrolled trial. GUT Microbes. 2022;14:e2018899.
- 179. Zuo T, Wu X, Wen W, Lan P. Gut microbiome alterations in COVID-19. Genomics, Proteomics & Bioinformatics. 2021.
- 180. Chen Y, Gu S, Chen Y, Lu H, Shi D, Guo J. Six-month follow-up of gut microbiota richness in patients with COVID-19. Gut. 2021.
- 181. Thomas R, Aldous J, Forsyth R, Chater A, Williams M. The inflence of a blend of probiotic Lactobacillus and prebiotic inulin on the duration and severity of symptoms among individuals with COVID-19. Infect. Dis. Diag. Treat. 2022;5:12.
- 182. Mao YH, Xu Y, Zhao FS, Wang ZM, Zhao M. Protective effects of konjac glucomannan on gut microbiome with antibiotic perturbation in mice. Carbohydrate Polymers. 2022;290:119476.
- 183. de Falco B, Amato M, Lanzotti V. Chia seeds products: an overview. Phytochemistry Reviews. 2017;16:745-60.
- 184. Parry PI, Lefringhausen A, Turni C, Neil CJ, Cosford R, Hudson NJ, Gillespie J. ‘Spikeopathy’: COVID-19 Spike Protein Is Pathogenic, from Both Virus and Vaccine mRNA. Biomedicines. 2023;11(8).
- 185. Changeux JP, Amoura Z, Rey FA, Miyara M. A nicotinic hypothesis for Covid-19 with preventive and therapeutic implications. C R Biol. 2020;343(1):33-9.
- 186. O’Brien BCV, Weber L, Hueffer K, Weltzin MM. SARS-CoV-2 spike ectodomain targets α7 nicotinic acetylcholine receptors. J Biol Chem. 2023;299(5):104707.
- 187. Woo MS, Shafiq M, Fitzek A, Dottermusch M, Altmeppen H, Mohammadi B, et al. Vagus nerve inflammation contributes to dysautonomia in COVID-19. Acta Neuropathol. 2023;146(3):387-94.
- 188. Yap JYY, Keatch C, Lambert E, Woods W, Stoddart PR, Kameneva T. Critical Review of Transcutaneous Vagus Nerve Stimulation: Challenges for Translation to Clinical Practice. Front Neurosci. 2020;14:284.
- 189. Badran BW, Huffman SM, Dancy M, Austelle CW, Bikson M, Kautz SA, George MS. A pilot randomized controlled trial of supervised, at-home, self-administered transcutaneous auricular vagus nerve stimulation (taVNS) to manage long COVID symptoms. Bioelectron Med. 2022;8(1):13.
- 190. Natelson BH, Blate M, Soto T. Transcutaneous vagus nerve stimulation in the treatment of Long Covid-Chronic Fatigue Syndrome. medrxiv. 2022.
- 191. Gotti C, Zoli M, Clementi F. Brain nicotinic acetylcholine receptors: native subtypes and their relevance. Trends Pharmacol Sci. 2006;27(9):482-91.
- 192. Leitzke M. Is the post-COVID-19 syndrome a severe impairment of acetylcholine-orchestrated neuromodulation that responds to nicotine administration? Bioelectron Med. 2023;9(1):2.
- 193. Farsalinos K, Bagos PG, Giannouchos T, Niaura R, Barbouni A, Poulas K. Smoking prevalence among hospitalized COVID-19 patients and its association with disease severity and mortality: an expanded re-analysis of a recent publication. Harm Reduct J. 2021;18(1):9.
- 194. Chudzik M, Burzyńska M, Kapusta J. Use of 1-MNA to Improve Exercise Tolerance and Fatigue in Patients after COVID-19. Nutrients. 2022;14(15).
- 195. Robbins T, Gonevski M, Clark C, Sharma K, Magar A. Hyperbaric oxygen therapy for the treatment of long COVID: early evaluation of a highly promising intervention. Clinical Medicine. 2021;21:e629-e32.
- 196. Oliaei S, Mehrtak M, Karimi A, Noori T, Shojaei A, Dadras O. The effects of hyperbaric oxygen therapy (HBOT) on coronavirus disease-2019 (COVID-19): a systematic review. Eur. J. Med. Res. 2021;26:96.
- 197. Senniappan K, Jeyabalan S, Rangappa P, Kanchi M. Hyperbaric oxygen therapy: Can it be a novel supportive therap in COVID-19? Indian Journal of Anaesthesia. 2020;64:835-41.
- 198. Kjellberg A, De Maio A, Lindholm P. Can hyperbaric oxygen safely serve as an inti-inflammatory treatment for COVID-19? Medical Hypotheses. 2020;144:110224.
- 199. Hadanny A, Abbott S, Suzin G, Bechor Y, Efrati S. Effect of hyperbaric oxygen therapy on chronic neurocognitive deficits of post-traumatic brain injury patients: retrospective analysis. BMJ Open. 2018;8:e023387.
- 200. Han CH, Zhang PX, Xu WG, Li RP. Polarization of macrophages in the blood after decompression in mice. 7. 2017(236):240.
- 201. De Maio A, Hightower LE. COVID-19, acute respiratory distress syndrome (ARDS), and hyperbaric oxygen therapy (HBOT): what is the link? Cell Stress & Chaperones. 2020;25:717-20.
- 202. Buras JA, Holt D, Orlow D, Belikoff B, Pavildes S, Reenstra WR. Hyperbaric oxygen protects from sepsis mortality via an interleukin-10-dependent mechanism. Crit. Care Med. 2006;34:2624-9.
- 203. Tezgin D, Giardina C, Perdrizet GA, Hightower LE. The effect of hyperbaric oxygen on mitochondrial and glycolytic energy metabolism: the caloristasis concept. Cell Stress and Chaperones. 2020;25:667-77.
- 204. Zilberman-Itskovich S, Catalogna M, Sasson E, Hadanny A, Lang E, Finci S, et al. Hyperbaric oxygen therapy improves neurocognitive functions and symptoms of post-COVID condition: randomized controlled trial. Scientific Reports. 2022;12:11252.
- 205. Violi F, Harenberg J, Pignatelli P, Cammisotto V. COVID-19 and Long-COVID Thrombosis: From Clinical and Basic Science to Therapeutics. Thromb Haemost. 2023.
- 206. Iba T, Connors JM, Levy JH. What Role Does Microthrombosis Play in Long COVID? Semin Thromb Hemost. 2023.
- 207. Kell DB, Laubscher GJ, Pretorius E. A central role for amyloid fibrin microclots in long COVID/PASC: origins and therapeutic implications. Biochemical Journal. 2022;479:537-59.
- 208. Kruger A, Vlok M, Turner S, Venter C, Laubscher GJ, Kell DB, Pretorius E. Proteomics of fibrin amyloid microclots in long COVID/post-acute sequelae of COVID-19 (PASC) shows many entrapped pro- inflammatory molecules that may also contribute to a failed fibrinolytic system. Cardiovascular Diabetology. 2022;21:190.
- 209. Pretorius E, Vlok M, Venter C, Bezuidenhout JA, Kell DB. Persistent clotting protein pathology in Long COVID/Post-Acute Sequelae of COVID-19 (PASC) is accompanied by increased levels of antiplasmin. Cardiovasc. Diabetol. 2021;20:172.
- 210. Turner S, Naidoo CA, Usher TJ, Kruger A, Venter C, Kell DB, Pretorius E. Increased levels of inflammatory molecules in blood of Long COVID patients point to a thrombotic endotheliitis. medRxiv. 2022.
- 211. Davelaar J, Jessurun N, Schaap G, Bode C, Vonkeman H. The effect of corticosteroids, antibiotics, and anticoagulants on the development of post-COVID-19 syndrome in COVID-19 hospitalized patients
- 6 months after discharge: a retrospective follow up study. Clin Exp Med. 2023;23(8):4881-8.
- 212. Wang C, Yu C, Jing H, Wu X, Novakovic VA, Xie R, Shi J. Long COVID: The Nature of Thrombotic Sequelae Determines the Necessity of Early Anticoagulation. Front Cell Infect Microbiol. 2022;12:861703.
- 213. Rylander R. Bioavailability of magnesium salts – A review. Journal of Pharmacy and Nutrition Sciences. 2014;4:57-9.
- 214. Uysal N, Kizildag S, Yuce Z, Guvendi G, Kandis S, Koc B, Ates M. Timeline (Bioavailability) of magnesium compounds in hours: Which magnesium compound works best? Biological Trace Element Research. 2018.
- 215. Li W, Yu J, Liu Y, Huang X, Abumaria N, Zhu Y, et al. Elevation of brain magnesium prevents synaptic loss and reverses cognitive deficits in Alzheimer’s disease mouse model. Molecular Brain. 2014;7:65.
- 216. Lee CR, Zeldin DC. Resolvin infectious inflammation by targeting the host response. N. Engl. J. Med. 2015;373:2183-5.
- 217. Serhan CN. Novel pro-resolving lipid mediators in inflammation are leads for resolution physiology. Nature. 2014;510:92-101.
- 218. Kosmopoulos A, Bhatt L, Meglis G, Verma R, Pan Y. A randomized trial of Icosapent Ethyl in ambulatory patients with COVID-19. iScience. 2021;24:103040.
- 219. Yokoyama M, Origasa H, Matsuzaki M, Matsuzawa Y, Saito Y, Ishikawa Y, et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomised open-label, blinded endpoint analysis. Lancet. 2007;369(9567):1090-8.
- 220. Harris WS. Understanding why REDUCE-It was positive-mechanistic overview of eicosapentaenoic acid. Progress in Cardiovascular Diseases. 2019;62:401-5.
- 221. Bhatt D, Steg PG, Miller M, Brinton EA, Jacobson TA, Ketchum SB, Doyle RT. Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia. N. Engl. J. Med. 2019;380:11.
- 222. Kastelstein JJ, Stroes ES. FISHing for the miracle of eicosapentaenoic acid. N. Engl. J. Med. 2019;380:89-91.
- 223. Guo XF, Li KL, Li JM, Li D. Effects of EPA and DHA on blood pressure and inflammatory factors: a meta-analysis of randomized controlled trials. Clinical Reviews in Food Science and Nutrition. 2019;59:3380-93.
- 224. von Schacky C. Importance of EPA and DHA blood levels in brain structure and funcion. Nutrients. 2021;13:1074.
- 225. Cottin SC, Sanders TA, Hall WL. The differential effects of EPA and DHA on cardiovascular risk factors. Proceeding of the Nutrition Society. 2011;70:215-31.
- 226. Allaire J, Couture P, Leclerc M, Charest A, Marin J. A randomized, crossover, head to head comparison of eicosapentaenoic acid and docosahexaenoic acid supplementation to reduce inflammation markers in men and women: the Comparing PA to DHA (ComparED) study. Am. J. Clin. Nutr. 2016;104:280-7.
- 227. Izquierdo JL, Soriano JB, Gonzalez Y, Lumbreras S. Use of N-Acetylcysteine at high doses as an oral treatment for patients with COVID-19. Science Progress. 2022;105.
- 228. Shi Z, Puyo CA. N-Acetylcysteine to combat COVID-19: an evidence review. Therapeutics and Clinical Risk Management. 2020;16:1047-55.
- 229. De Flora S, Balansky R, La Maestra S. Rationale for the use of N-acetylcysteine in both prevention and adjuvant therapy of COVID-19. FASEB J. 2020.
- 230. Schmitt B, Vicenzi M, Garrel C, Denis FM. Effects of N-acetylcysteine, oral glutathione (GSH) and a novel sublingual for of GSH on oxidative stress markers: A comparative crossover study. Redox Biology. 2015;6:198-205.
- 231. Allen J, Bradley RD. Effects of oral glutathione supplementation on systemic oxidative stress biomarkers in human volunteers. Journal of Alternative & Complementary Medicine. 2011;17:827-33.
- 232. Sinha R, Sinha I, Calcagnotto A, Trushin N, Haley JS. Oral supplementation with liposomal glutathione elevates body stores of glutathione and markers of immune function. Eur. J. Clin. Nutr. 2018;72:105-11.
- 233. Santamarina MG, Boisier D, Contreras R, Baque M, Volpacchio M. COVID-19: a hypothesis regarding the ventilation-perfusion mismatch. Crit. Care. 2020;24:395.
- 234. Mario L, Roberto M, Marta L, Teresa CM, Laura M. Hypothesis of COVID-19 therapy with sildenafil. International Journal of Preventive Medicine. 2020;11:76.
- 235. Santamarina MG, Beddings I, Martinez Lomakin F, Boisier Riscal D. Sildenafil for treating patients with COVID-19 and perfusion mismatch: a pilot randomized trial. Crit. Care. 2022;26:1.
- 236. Kniotek M, Boguska A. Sildenafil can affect innate and adaptive immune system in both experimental animals and patients. Journal of Immunology Research. 2017;2017:4541958.
- 237. Isidori AM, Giannetta E, Pofi R, Venneri MA, Gianfrilli D, Campolo F. Targeting the NO-cGMP- PDE5 pathoway in COVID-19 infection. The DEDALO project. Andrology. 2021;9:33-8.
- 238. Al-kuraishy HM, Ali-Gareeb AI, Al-Niemi MS, Buhadily AK. COVID-19 and phosphodiesterase enzyme type 5 inhibitors. J. Microsc. Ultrastruct. 2022;8:141-5.
- 239. Madeo F, Eisenberg T, Pietrocola F, Kroemer G. Spermidine in health and disease. Science. 2018;359:410.
- 240. Eisenberg T, Abdellatif M, Schroeder S, Primessnig U, Stekovic S, Pendl T, et al. Cardioprotection and lifespan extension by natural polyamine spermidine. Nat. Med. 2016;22:1428-38.
- 241. Morselli E, Marino G, Bennetzen MV, Eisenberg T, Megalou E, Schroeder S, Cabrera S. Spermidine and resveratrol induce autophagy by distinct pathways converging on the acetylproteome. J. Cell. Biol. 2022;192:615-29.
- 242. Kiechl S, Pechlaner R, Willeit P, Notdurfier M, Paulweber B, Willeit K, et al. Higher spermidine intake is linked to lower mortality: a prospective population-based study. Am. J. Clin. Nutr. 2018;108:371-80.
- 243. Nowotarski SL, Woster PM, Casero RA. Polyamines and cancer: implications for chemoprevention and chemotherapy. Expert Rev. Mol. Med. 2014.
- 244. Zheng L, Xie Y, Sun Z, Zhang R, Ma Y, Xu J, Zheng J. Serum spermidine in relation to risk of stroke: A multilevel study. Front. Nutr. 2022;9:843616.
- 245. Kolimechkov S, Seijo M, Swaine I, Thirkell J, Colado JC, Naclerio F. Physiological effects of microcurrent and its application for maximising acute responses and chronic adaptations to exercise. Eur J Appl Physiol. 2023;123(3):451-65.
- 246. Di Y, He YL, Zhao T, Huang X, Wu KW, liu SH, et al. Methylene blue reduces acute cerebral ischemic injury via the induction of mitophagy. Mol. Med. 2015;21:420-9.
- 247. Jiang Z, Watts LT, Huang S, Shen Q, Rodriguez P, Chen C. The effects of methylene blue on autophagy and apoptosis in MRI-defined normal tissue, ischemic penumbra and ischemic core. PloS ONE. 2015;10:e0131929.
- 248. XIe L, Li W, Winters A, Yuan F, Jin K, Yang S. Methylene blue induces macroautophagy through 5′ adenosine monophosphate-activated protein kinase pathway to protect neurons from serum deprivation. Fronteirs in Cellular Neuroscience. 2013;7:56.
- 249. Peter C, Hongwan D, Kupfer A, Lauterburg BH. Pharmacokinetics and organ distribution of intravenous and oral methylene blue. Eur. J. Clin. Pharmacol. 2000;56:247-50.
- 250. Tucker D, Lu Y, Zhang Q. From mitochondrial function to neuroprotection – An emerging role for methylene blue. Mol. Neurobiol. 2018;55:5137-53.
- 251. Yang L, Youngblood H, Wu C, Zhang Q. Mitochondria as a target for neuroprotection: role of methylene blue and photobiomodulation. Translational Neurodegeneration. 2020;9:19.
- 252. Gonzalez-Lima F, Auchter A. Protection against neurodegeneration with low-dose methylene blue and near-infrared light. Fronteirs in Cellular Neuroscience. 2015;9:179.
- 253. Rojas JC, Bruchey AK, Gonzalez-Lima F. Neurometabolic mechanisms for memory enhancement and neuroprotection of methylene blue. Prog. Neurobiol. 2012;96:32-45.
- 254. Sabel BA, Flammer J, Merabet LB. Residual vision activation and the brain-eye-vascular triad: Dysregulation, plasticity and restoration in low vision and blindness – a review. Restorative Neurology and Neuroscience. 2018;36:767-91.
- 255. Siegert A, Diedrich L, Antal A. New methods, old brains – A systematic review on the effects of tDCS on cognition of elderly people. Fronteirs in Human Neuroscience. 2021;15:730134.
- 256. Teselink J, Bawa KK, Koo GK, Sankhe K, Liu CS, Oh P. Efficacy of non-invasive brain stimulation on global cognition and neuropsychiatric symptoms in Alzheimer’s disease and mild cognitive impairement: A meta-analysis and systematic review. Ageing Research Reviews. 2021;72:101499.
- 257. Sabel BA, Zhou W, Huber F, Schmidt F, Sabel K. Non-invasive brain microcurrent stimulation therapy of long-COVID-19 reduces vascular dysregulation and improves visial and cognitive impairement. Restorative Neurology and Neuroscience. 2021;39:393-408.
- 258. Ahorsu DK, Adjaottor ES, Lam BY. Intervention effect of non-invasive brain stimulation on cognitive functions among people with traumatic brain injury: A systematic review and meta-analysis. Brain Sci. 2021;11:840.
- 259. Finisguerra A, Borgatti R, Urgesi C. Non-invasive brain stimulation for the rehabilitation of children and adolescents with neurodevelopmental disorders: A systematic review. Fronteirs in Psychology. 2019;10:135.
- 260. Chen JJ, Zeng BS, Wu CN, Stubbs B, Carvalho AF, Su KP. Association of central noninvasive brain stimulation interventions with efficacy and safety in tinnitus management. A meta-analysis. JAMA Otolaryngol. Head Neck Surg. 2020;146:801-9.
- 261. Chen JJ, Zeng BY, Lui CC, Chen TY, Chen YW, Tseng PT. Pfizer-BioNTech COVID-19 vaccine- associated tinnitus and treatment with transcranial magnetic stimulation. QJM. 2022.
- 262. Sanabria-Mazo JP, Montero-Marin J, Feliu-Soler A, Gasion V, Navarro-Gil M. Mindfulness-based program plus amygdala and inusla retraining (MAIR) for the treatment of women with fibromyalgia: A pilot ramdomized controlled trial. J. Clin. Med. 2020;9:3246.
- 263. Yong SJ. Long-haul COVID-19: Putative pathophysiology, risk factors, and treatments. medRxiv. 2020.
- 264. Shu C, Feng S, Cui Q, Cheng S, Wang Y. Impact of Tai Chi on CRP, TNF-alpha and IL-6 in inflammation: a systematic review and meta-analysis. Ann. Palliat. Med. 2021;10:7468-6478.
- 265. Zhang Z, Ren JG, Guo JL, An L, Li S, Zhang ZC. Effects of Tai Chi and Qigong on rehabilitation after COVID-19: a protocl for systematic review and meta-analysis. BMJ Open. 2022;12:e059067.
- 266. Falkenberg RI, Eising C, Peters ML. Yoga and immune system functioning: a systematic review of randomized controlled trials. J. Behav. Med. 2018;41:467-82.
- 267. Mogil RJ, Kaste SC, Ferry RJ, Hudson MM, Howell CR. Effect of low-magnitude, high-frequency mechanical stimulation on BMD among young childhood cancer survivors. A randomized clinical trial. JAMA Oncol. 2016;2:908-15.
- 268. Misra HS, rajpurohit YS, Khairnar NP. Pyrroloquinoline-quinone and its versatile roles in biological processes. J. Biosci. 2012;37:312-25.
- 269. Akagawa M, Nakano M, Ikemoto K. Recent progress in studies on the health benefits of pyrroloquinoline quinone. Bioscience, Biotenchnology, and Biochemistry. 2016;80:13-22.
- 270. Hamilton D, Jensen GS. Nutraceutical support of mitochondrial function associated with reduction of long-term fatigue and inflammation. Alternative Therapies in Health & Medicine. 2021;27:8-18.
- 271. Nicolson GL, Settineri R, Ellithorpe R. Lipid replacement therapy with a glycopholipid formulation of NADH and CoQ10 significantl reduces fatigue in intractable chronic fatiguing illnesses and chronic lyme disease patients. International Journal of Clinical Medicine. 2012;3:163-70.
- 272. Chowanadisiai W, Bauerly KA, Tchaparian E, Wong A, Rucker RB. Pyrroloquinoline quinone stimulates mitochondrial biogenesis through cAMP response element-binding protein phosphorylation and increased PGC-1alpha expression. J. Biol. Chem. 2010;285:142-52.
- 273. Nicolson GL, Settineri R. Lipid replacement therapy: a functional food approach with new formulations for reducing cellular oxidative damage, cancer-associated fatigue and the adverse effects of cancer therapy. Functional Foods in Health and Disease. 2011;1:135-60.
- 274. Nicolson GL, Rosenblatt S, de Mattos GF, Settineri R, Breeding PC, Ash ME. Clinical uses of membrane lipid replacement supplements in restoring membrane function and reducing fatigue in chronic disease and cancer. Discoveries. 2016;4:e54.
- 275. Hansen KS, Mogensen TH, Agergaard J, Schiøttz-Christensen B, Østergaard L, Vibholm LK, Leth S. High-dose coenzyme Q10 therapy versus placebo in patients with post COVID-19 condition: a randomized, phase 2, crossover trial. Lancet Reg Health Eur. 2023;24:100539.
- 276. Jamme M, Mazeraud A. Plasmapheresis efficiency in Coronavirus disease 2019: More related to what you add and not what you take away? Crit. Care Med. 2021.
- 277. Patidar GK, Land KJ, Vrielink H, Dann EJ, Spitalnik SL. Understanding the role of therapeutic plasma exchange in COVID-19: preliminary guidance and practices. Vox Sanguinis. 2021.
- 278. Hashemian SM, Shafigh N, Afzal G, Jamaati H, Tabarsi P, Marjani M. Plasmapheresis reduces cytokine and immune cell levels in COVID-19 patients with acute respiratory distress syndrome (ARDS). Pulmonary. 2021;27:486-92.
- 279. Balagholi S, Dabbaghi R, Eshghi P, Mousavi SA, Heshmati F, Mohammadi S. Potential of therapeutic plasmapharesis in treatment of COVID-19 patients: immunopathogenesis and coagulopathy. Transfusion and Apheresis Science. 2020;59:102993.
- 280. Keith P, Day M, Perkins L, Moyer L, Hewitt K, Wells A. A novel treatment approach to the novel coronavirus: an argument for the use of therapeutic plasma exchange for fulminant COVID-19. Crit. Care. 2020;24:128.
- 281. Morath C, Weigand MA, Zeier M, Speer C, Tiwari-Heckler S. Plasma exchange in critically ill COVID-19 patients. Crit. Care. 2020;24:481.
- 282. Fernandez J, Gratacos-Gines J, Olivas P, Costa M, Nieto S, Mateo D. Plasma exchange: An effective rescue therapy in critically ill patients with Coronavirus Disease 2019 infection. Crit. Care Med. 2020.
- 283. Gucyetmez B, Atalan HK, Sertdemir I, Cakir U, Telci L. Therapeutic plasma exchange in patients with COVID-19 pneumonia in intensive care unit: a retrospective study. Crit. Care. 2020;24:492.
- 284. Kiprov DD, Herskowitz A, Kim D, Lieb M, Liu C, Watanabe E. Case report. Therapeutic and immunomodulatory effects of plasmapheresis in long-haul COVID. F1000Research. 2022;10:1189.
- 285. Geerts M, de Greef BT, Sopacua M, Faber CG. Intravenous immunoglobulin therapy in patients with painful idiopathic small fiber neuropathy. Neurology. 2022;96:e2534-e45.
- 286. Pitt B, Sutton NR, Wang Z, Holinstat M. Potential repurposing of the HDAC inhibitor valproic acid for patients with COVID-19. Eur. J. Pharmacol. 2021;898:173988.
- 287. Unal G, Turan B, Balcioglu YH. Immunopharmacological management of COVID-19: Potential therapeutic role of valproic acid. Medical Hypotheses. 2020;14:109891.
- 288. Wu C, Li A, Leng Y, Kang J. Histone deacetylase inhibition by sodium valproate regulates polarization of macrophage subsets. DNA and Cell Biology. 2012;31:592-9.
- 289. Larsson P, Alwis I, Niego B, Glise L, Daglas M, Jackson SP. Valproic acid selectively increases vascular endothelial tissue -type plasminogen activator production and reduces thrombus formation in the mouse. J. Thromb. Haemost. 2016;14:2496-508.
- 290. Koriyama Y, Sugitani K, Ogai K, Kato S. Heat shock protein 70 induction by valproic acid delays photoreceptor cell death ny N-methyl-N-nitrosurea in mice. J. Neurochem. 2014;130:707-19.
- 291. Fleisher AS, Truran D, Mai JT, Langbaum JB, Aisen PS, Cummings JL. Chronic divalproex sodium use and brain atrophy in Alzheimers disease. Neurology. 2011;77:1263-71.
- 292. Faggi L, Pignataro G, Parrella E, Porrini V, Cepparulo P, Cuomo O, et al. Synergistic association of valproate and resveratrol reduces brain injury in ischemic stroke. Int. J. Mol. Sci. 2018;19:172.
- 293. Chen Y, Lin PX, Hsieh GL, Peng CC, Peng RY. The proteomic and genomic teratogenicity elicited by valproic acid is preventable with resveratrol and alpha-tocopherol. PloS ONE. 2014;9:e116534.
- 294. Santos-terra J, Deckmann I, Carello-Collar G, Nunes GD, Riesgo R, Gottfried C. Resveratrol prevents cytoarchitectural and interneuronal alterations in the valproic acid model of autism. Int. J. Mol. Sci. 2022;23:4075.
- 295. Cohen M. Turning up the heat on COVID-19: heat as a therapeutic intervention. F1000Research. 2020;9:292.
- 296. Ramirez FE, Sanchez A, Pirskanen AT. Hydrothermotherapy in prevention and treatment of mild to moderate cases of COVID-19. Medical Hypotheses. 2021;146:110363.
- 297. Hussain J, Cohen M. Clinical effects of regular dry sauna bathing: A systematic review. Evidence- Based Complementary and Alternative Medicine. 2018;2018:1857413.
- 298. Laukkanen JA, Laukkanen T, Kunustor SK. Cardiovascular and other health benefits of sauna bathing: A review of the evidence. Mayo Clin. Proc. 2018;93:1111-21.
- 299. Laukkanen T, Khan H, Zaccardi F, Laukkanen JA. Association between sauna bathing and fatal cardiovascular and all-cuase mortality. JAMA Intern. Med. 2015;175:542-8.
- 300. Janssen CW, Lowry CA, Mehl MR, Allen JJ, Kelly KL. Whole-body hyperthermia for the treatment of major depressive disorder.A randomized Clinical Trial. JAMA Psychiatry. 2016;73:789-95.
- 301. Laukkanen T, Kunutsor S, Kauhanen J, Laukkanen JA. Sauna bathing is inversely associated with dementia and Alzheimer’s disease in middle-aged Finnish men. Age & Ageing. 2017;46:245-9.
- 302. Kunutsor SK, Khan H, Laukkanen T, Laukkanen JA. Joint associations of sauna bathing and cardiorespiratory fitness on cardiovascular and all-cause mortality risk: a long-term prospective cohort study. Annals of Medicine. 2018;50:139-46.
- 303. Scoon GS, Hopkins WG, Mayhew S, Cotter JD. Effect of post-exercise sauna bathing on the endurance performance of competitive male runners. Journal of Science and Medicine in Sport. 2007;10:259-62.
- 304. Brown JT, Saigal A, Karia N, Patel RK, Razvi Y, Steeden JA. Ongoing exercise intolerance following COVID-19: A magnetic resonance-Augmented Cardiopulmonary excercise Test Study. J. Am. Heart Assoc. 2022;11:e024207.
- 305. Kihara T, Biro S, Imamura M, Yoshifuku S, Takasaki K, Ideda Y. Repeated sauna treatment improves vascular endothelial and cardiac function in patients with chronic heart failure. J. Am. Coll. Cardiol. 2002;39:754-9.
- 306. Kallstrom M, Soveri I, Oldgren J, LaukkANEN j, Ichiki T, tEI c. Effects of sauna bath on heart failure: A systematic review and meta-analysis. Clinical Cardiology. 2018;41:1491-501.
- 307. Amano K, Yanagihori R, tEI c. Waon therapyis effective as the treatment of myalgic encephalomyelitis/Chronic fatigue syndrome. J. Jpn. Soc. Balneol. Climatol. Phys. Med. 2015;78:285-302.
- 308. Soejima Y, Munemoto T, Masuda A, Uwatoko Y, Miyata M, tEI c. Effects of Waon therapy on chronic fatigue syndrome: A pilot study. Intern. Med. 2015;54:333-8.
- 309. Shevchuk N. Adapted cold shower as a potential treatment for depression. Medical Hypotheses. 2008;70:995-1001.
- 310. Mooventhan A, Nivethitha L. Scientific evidence-based effects of hydrotherapy on various systems of the body. North American Journal of Medical Sciences. 2014;6:199-209.
- 311. Patterson B, Yogendra R, Guevara-Coto J, Osgood E, Bream J, Parikh P. Targeting the monocytic- endothelial-platelet axis with maraviroc and pravastatin as a therapeutic option to treat long COVID/Post-acute sequelae of COVID (PASC). Research Square. 2022.
- 312. Houghton CA, Fassett RG, Coombes JS. Sulforane: translational research from laboratory bench to clinic. Nutrition Reviews. 2013;71:709-26.
- 313. Kim JK, Park SU. Current potential health benefits of sulforaphane. EXCLI Journal. 2016;15:571-7.
- 314. Mokhtari RB, Baluch N, Homayouni TS, Kumar S, Yeger H. The role of sulforaphane in cancer chemoprevention and health benefits: a mini-review. J. Cell Commun. Signal. 2018;12:91-101.
- 315. Clarke JD, Hsu A, Riedl K, Bella D, Stevens JF, Ho E. Bioavailability and inter-conversion of sulforaphane and erucin in human subjects consuming broccoli sprouts or broccoli supplement in a cross-over study design. Pharmacol. Res. 2011;64:456-63.
- 316. Khandouzi N, Shidfar F, Rajab A, Rahideh T, Hosseini P, Taheri MM. The effects of Ginger on fasting blood sugar, hemoglobin A1C, Apolipoprotein B, Apolipoprotein A-1 and malondialdehyde in type 2 diabetic patients. Iranian Journal of Pharmaceutical Research. 2015;14:131-40.
- 317. Gonzalez-Castejon M, Visioli F, Rodrigues-Casado A. Diverse biological activities of dandelion. Nutrition Reviews. 2012;70:534-47.
- 318. Olas B. New perspectives on the effect of dandelion, its food products and other preparations on the cardiovascular system and its diseases. Nutrients. 2022;14:1350.
- 319. Tran HT, Gigl M, Le NP, Dawid C, Lamy E. In Vitro effect of Taraxacum officinale leaf aqueous extract on the interaction between ACE2 cell surface receptor and SARS-CoV-2 spike protein D614 and four mutants. Pharmaceuticals. 2021;14:1055.
- 320. “Taraxaci folium” and “taraxaci radix”. Monography on the Medicinal Uses of Plant Drugs. End.ed. ed. Stuttgart, Germany: Thieme; 2003:499-504.
- 321. Servy EJ, Jacquesson-Fournols L, Cohen M, Menezo YJ. MTHFR isoforms carriers. 5-MTHF (5- methyl tetrahydrofolate) vs folic acid: a key to pregnancy outcome: a case series. Journal of Assisted Reproduction and Genetics. 2018;35:1431-5.
- 322. Kinnunen S, Hyyppa S, Oksala N, Laaksonen DE, Hannila ML, Sen CK. alpha-Lipoic acid supplementation enhances heat shock protein production and decreases post excercise lactic acid concentrations in excercised standardbred trotters. Research in Veterinary Science. 2009;87:462-7.
- 323. Elbadawy AM, Elmoniem RO, Elsayed AM. Alpha lipoic acid and diabetes mellitus: potential effects onperipheral neuropathy and different metabolic parameters. Alexandria Journal of Medicine. 2021;57:113-20.
- 324. Sanna A, Firinu D, Zavattari P, Valera P. Zinc status and autoimmunity: A systematic review and meta-analysis. Nutrients. 2018;10:68.
- 325. Anju M, Maiya AG, Hande M. Low level laser therapy for patietns with painful diabetic peripheral neuropathy – A systematic review. Diabetes & Metabolic Syndrome: Clinical Research & Reviews. 2019;13:2667-70.
- 326. Leonard DR, Farooqi MH, Myers S. Restoration of sensation, reduced pain, and improved balance in subjects with diabetic peripheral neuropathy. A double-blind, randomized, placebo-controlled study with monochromatic near-infrared treatment. Diabetes Care. 2004;27:168-72.
- 327. Hong J, Barnes MJ, Kessler NJ. Case study: Use of vibration therapy in the treatment of diabetic peripheral small fiber neuropathy. International Journal of Diabetes Mellitus. 2015;3:72-5.
- 328. Kessler NJ, Hong J. Whole body vibration therapy for painful diabetic peripheral neuropathy: A Pilot study. Journal of Bodywork & Movement Therapies. 2013;17:518-22.
- 329. Diep PT, Buemann B, Uvnas-Moberg K. Oxytocin, a possible treatment for COVID-19? everything to gain, nothing to lose. Clinical Neuropsychiatry. 2020;17:192-5.
- 330. Leuner B, Caponiti JM, Gould E. Oxytocin stimulates adult neurogenesis even under conditions of stress and elevated glucocorticoids. Hippocampus. 2012;22:861-8.
- 331. Lee HJ, Macbeth AH, Pagani J, Young WS. Oxytocin: the great facilitator of life. Prog. Neurobiol. 2009;88:127-51.
- 332. MacDonald K, McDonald TM. The peptide that binds: A systematic review of oxytocin and its prosocial effects in humans. Harv. Rev. Psychiatry. 2010;18:1-21.
- 333. Matsushita H, Latt HM, Koga Y, Nishiki T, Matsui H. Oxytocin and stress: Neural mechanisms, stress-related disorders,and therapeutic approaches. Neuroscience. 2019;417:1-10.
- 334. Tzabazis A, Kori S, Mechanic J, Miller J, Pascual C, Carson D. Oxytocin and migraine headache. Headache. 2017;57:64-75.
- 335. Krause DN, Warfvinge K, Haanes KA, Edvinsson L. Hormonal influences in migraine – interactions of oestrogen, oxytocin and CGRP. Nature Reviews Neurology. 2021;17:621-33.
- 336. Horn S, Bathgate R, Lioutas C, Bracken K, Ivell R. Bovine endometrial epithelial cells as a model system to study oxytocin receptor regulation. Human Reproduction Update. 1998;4:605-14.
- 337. Freitag K, Sterczyk N, Wendlinger S, Schulz J, Ralser M, Fleck L, et al. Spermidine reduces neuroinflammation and soluble amyloid beta in an Alzheimer’s disease mouse model. Journal of Neuroinflammation. 2022;19:172.
- 338. Schroeder S, Hofer S, Zimmermann A, Pechlaner R, Pendl T, Bergmann M, Ristic S. Dietary spermidine improves cognitive function. Cell Resports. 2021;35:108985.
- 339. Blaylock RL. Vaccines, depression, and neurodegeneration after age 50 years: another reason to avoid the recommended vaccines. Medical Veritas. 2008;5:1742-7.
- 340. Pappa S, Barmparessou Z, Sakka E, Sakkas N, Pappas A. Depression, Insomnia and post- traumatic stress disorder in COVID-19 survivors: Role of gender and impact on quality of life. J. Pers. Med. 2022;12:486.
- 341. Porter C, Favara M, Scott D, Craske MG, Stein A. Impact of the COVID-19 pandemic on anxiety and depression symptoms of young people in the Global South: evidence from a four-country cohort study. medRxiv. 2021.
- 342. Lau T, Horschitz S, Berger S, Bartsch D, Schloss P. Antidepressant-induced internalization of the serotonin transporter in serotonergic neurons. FASEB J. 2008;22:1702-14.
- 343. Renoir T. Selective serotonin reuptake inhibitor antidepressant treatment discontinuation syndrome: a review of the clinical evidence and the possible mechanisms involved. 4. 2013(45).
- 344. Hengartner MP, Ploderi M. Newer-generation antidepressants and suicide risk in randomized controlled trials: A re-analysis of the FDA database. Psychother. Psychosom. 2019;88:247-8.
- 345. Hengartner MP, Amendola S, Kaminski JA. Suicide risk with selective serotonin reuptake inhibitors and other new-generation antidepressants in adults: a systematic review and meta-analysis of observational studies. J. Epidemiol. Community Health. 2021;75:523-30.
- 346. Breggin PR. Fluvoxamine as a cuase of stimulation, mania and agression with a critical analysis of the FDA-approved label. International Journal of Risk & Safety Mediciine. 2001;14:71-86.
- 347. Antidepressants and Violence: the Numbers, RxISK. August17, 2015. rxisk. org/antidepressants-and-violence-the-numbers/: RxISK; 2022.
- 348. Levenson CW. Zinc: The new antidepressant? Nutrition Reviews. 2006;64:39-42.
- 349. Nowak G, Szewczyk B, Pilc A. Zinc and depression. An update. Pharmacological Reports. 2005;57:713-8.
- 350. Cereda G, Ciappolino V, Boscutti A, Cantu F, Enrico P, Oldani L. Zinc as a neuroprotective nutrient for COVID-19-related neuropsychiatric manifestations: A literature review. Adv. Nutr. 2022;13:66-79.
- 351. Ahmed A, Ghit A, Houjak A, Elkazzaz M. Role of zinc and zinc ionophores in brain health and depression especially during the COVID-19 pandemic. In: Palmero S, Olivier B, eds. COVID-19 Pandemic, mental health and neuroscience- New Scenarios for understanding and treatment: IntechOpen; 2022.
- 352. Ranjbar E, Kasaei MS, Mohammad-Shirazi M, Shams J, Mostafavi SA. Effects of zinc supplementation in patients with major depression: A randomized clinical trial. Iranian J. Psychiatry. 2013;8:73-9.
- 353. Liu S, Sheng J, Li B, Zhang X. Recent advances in non-invasive brain stimulation for major depressive disorder. Fronteirs in Human Neuroscience. 2017;11:526.
- 354. Brononi AR, Sampaio-Junior B, Moffa AH, Aparicio L, Gordon P, Klein I, Rios RM. Noninvasive brain stimulation in psychiatric disorders: a primer. Brazilian Journal of Psychiatry. 2019;4:70-81.
- 355. Dunlop K, Hanlon CA, Downar J. Noninvasive brain stimulation treatments for addiction and major depression. Annals of the New York Academy of Sciences. 2017;1394:31-54.
- 356. Mutz J, Edgcumbe DR, Brunoni AR, Fu CH. Efficacy and acceptability of non-invasive brain stimulation for the treatment of adult unipolar and bipolar depression: A systematic review and meta- analysis of randomised sham-controlled trials. Neuroscience and Biohevioral Reviews. 2018;92:291-303.
- 357. McClure D, Greenman SC, Koppulu SS, Varvara M, Yaseen ZS, Galynker II. A pilot study of safety and efficacy of cranial electrotherapy stimulation in treatment of bipolar II depression. J. Nerv. Ment. Dis. 2015;203:827-35.
- 358. Alda M, Mckinnon M, Blagdon R, Garnham J, MacLellan S, Hajek T. Methylene blue treatment for residual symptoms of bipolar disorder: randomised crossover study. British Journal of Psychiatry. 2017;210:54-60.
- 359. Naylor GJ, Smith AH, Connelly P. A controlled trial of Methylene Blue in severe depressive illness. Biological Psychiatry. 1987;22:657-9.
- 360. Askalsky P, Losifescu DV. Transcranial photobiomodulation for the management of depression: Current perspectives. Neuropsychiatric Disease and Treatment. 2019;15:3255-72.
- 361. Benedetti F, Colombo C, Barbini B, Campori E, Smeraldi E. Morning sunlight reduces length of hospitalization in bipolar depression. J. Affective Disorders. 2001;62:221-3.
- 362. Schiffer F, Johnston AL, Ravichandran C, Polcari A, Teicher MH, Webb RH. Psychological benefits 2 and 4 weeks after a single treatment with near infrared light to the forehead: a pilot study of 10 patients with major depression and anxiety. Behavioral and Brain Function. 2009;5:46.
- 363. Safhi MM, Qumayri HM, Masmali AU, Siddiqui R, Alam MF. Thymoquinone and fluoxetine alleviate depression via attenuating oxidative damage and inflammatory markers in type-2 diabetic rats. Archives of Physiology & Biochemistry. 2019;125(2):150-5.
- 364. Forster JA, McVey Neufeld KA. Gut-brain axis: how the microbiome influences anxiety and depression. Trends in Neurosciences. 2013;38:305-12.
- 365. Lach G, Schellekens H, Dinan TG, Cryan JF. Anxiety, depression and the microbiome: A role for Gut peptides. Neurotherapeutics. 2018;15:36-59.
- 366. Sharon G. Human Gut Microbiota from Autism Spectrum Disorder Promote Behavioral Symptoms in Mice. Cell. 2019;177(6):1600-18.
- 367. Benton D, Williams C, Brown A. Impact of consumng a milk drink containing a probiotic on mood and cognition. Eur. J. Clin. Nutr. 2007;61:355-61.
- 368. Rao AV, Bested AC, Beaulne TM, Katzman MA, Iorio C, Berardi JM, Logan AC. A randomized, double-blind, placebo-controlled pilot study of a probioic in emotional symptoms of chronic fatigue syndrome. Gut Pathogens. 2009;1:6.
- 369. Din AU, Mazhar M, Waseem M, Ahmad w, Bibi A. SARS-CoV-2 microbiome dysbiosis linked disorders and possible probiotic role. Biomedicine & Pharmacotherapy. 2021;133:110947.
- 370. Hazan S, Stollman N, Bozkurt H, Dave S, Daniels J, Borody TJ. Lost microbes of COVID-19: Bifidobacterium, Faecalibacterium depletion and loss of microbiome diversity associated with SARS-CoV- 2 infection severity. BMJ Open Gastroenterology. 2022;9:e000871.
- 371. Zhang Y, Zhao Y, Yang W, Song G, Zhong P, Ren Y. Structural complexity of Konjac glucomannan and its derivatives governs the diversity and outputs of gut microbiota. Carbohydrate Polymers. 2022;292:119639.
- 372. Mostafa-Hedeab G, Al-kuraishy HM, Al-Gareeb AA, Jeandet P, Saaad HM, El-Saber Batiha G. A raising dawn of pentoxifylline in the management of inflammatory disorders in Covid-19. Inflammopharmacology. 2022.
- 373. Ng WK, Rosenblatt Y, Brock GB, O’Gorman DB, Gan BS. Phosphodiesterase inhibitors in vascular ischemia: A case report and review of their use in ischemic conditions. Can. J. Plast. Surg. 2010;18:e5-e9.
- 374. Yang YK. Coenzyme Q10 treatment of cardiovascular disorders of ageing including heart failure, hypertension and endothelial dysfunction. Clinica Chimica Acta. 2015;450:83-9.
- 375. Yuan S, Schmidt HM, Wood KC, Straub AC. CoenzymeQ in cellular redox regulaion and clinical heart failure. Free Radical Biology and Medicine. 2021;167:321-34.
- 376. Yin YJ, Zeng SL, Li YW, Wu Z, Huang DJ. The effect of coenzyme Q10 plus trimetazidine on acute viral myocarditis treatment. Am. J. Transl. Res. 2021;13:13854-61.
- 377. Gutierrez-Mariscal FM, de al Cruz-Ares S, Torres-Pena JD, Alcala-Diaz JF. Coenzyme Q10 and cardiovascular diseases. Antioxidants. 2021;10:906.
- 378. Sakamoto A, Saotome M, Iguchi K, Maekawa Y. Marine-derived omega-3 polyunsaturated fatty acids and heart failure: Current understnading for basic to clinical relevance. Int. J. Mol. Sci. 2019;20:4025.
- 379. Toko H, Morita H, Katakura M, Hashimoto M, Ko T, Bujo S, et al. Omega-3 fatty acid prevents the development of heart failure by chnaging fatty acid composition in the heart. Scientific Reports. 2020;10:15553.
- 380. Liu J, Meng Q, Zheng L, Yu P, HU H, Zhuang R, et al. Effect of omega-3 polyunsaturated fatty acids on left ventricular remodeling in chronic heart failure: a systematic review and meta-analysis. Br. J. Nutr. 2022.
- 381. Usami O, Saitoh H, Ashino Y, Hattori T. Acyclovir reduces the duration of fever in patients with infectious mononucleosis-like illness. Tohoku J. Experi. Med. 2013;229:137-42.
- 382. Verma D, Thompson J, Swaminathan S. Spironolactone blocks Epstein-Barr virus production by inhibiting EBV SM protein function. PNAS. 2016;113:3609-14.
- 383. Griffith RS, Wlash DE, Myrmel KH, Thompson RW. Sucess of L-Lysine therapy in frequently recurrent Herpes simplex infection. Treatment and prophylaxis. Dermatologica. 1987;175:183-90.
- 384. Griffith RS, Norins AL, Kagan C. A multicentered study of Lysine therapy in Herpes simplex infection. Dermatologica. 1978;156:257-67.
- 385. Andreu S, Ripa I, Bello-Morales R, Lopez-Guerrero JA. Valproic acid and its amidic deratives as new antivirals against Alphaherpesviruses. Viruses. 2020;12:1356.
- 386. Gorres KL, Daigle D, Mohanram S, Mcinerney GE, Lyons DE. Valpromide inhibits ltic cycle reactivation of Epstein-Barr Virus. mBio. 2016;7:e00113-e6.
- 387. Ornaghi S, Davis JN, Gorres KL, Miller G, Paidas MJ. Mood stabilizers inhibit cytomegalovirus infection. Virology. 2016;499:121-35.
- 388. Berg K, Bolt G, Andersen H, Owen TC. Zinc potentiates the antiviral action of human IFN-alpha tenfold. J. Interferon Cytokine Res. 2001;21:471-4.
- 389. Skalny AV, Rink L, Ajsuvakova OP, Aschner M, Gritsenko VA. Zinc and respiratory tract infections: Perspectives for COVID-19. Int. J. Mol. Med. 2020;46:17-26.
- 390. Dabbagh-Bazarbachi H, Clergeaud G, Quesada IM, Ortiz M, O’Sullivan CK. Zinc ionophore activity of Quercetin and Epigallocatechin-gallate:From Hepa 1-6 cells to a liposome model. J. Agric. Food Chem. 2014;62:8085-93.
- 391. Langguth B. Treatment of tinnitus. Curr. Opin. Otolaryngol. Head Neck Surg. 2015;23:361-8.
- 392. Langguth B. Pharmacological approaches to the treatment of tinnitus. Drug Discovery Today. 2010;15:300-5.
- 393. Langguth B, Elgoyhen AB, Cederroth CR. Therapeutic approaches to the treatment of tinnitus. Ann. Rev. Pharmacol. Toxicol. 2019;59:291-313.
- 394. MartinezDevesda P, Waddell A, Perera R, Theodoulou M. Cognitive behavioral therapy for tinnitus (Review). Cochrane Database of Syst. Rev. 2007(CD005233).
- 395. Sullivan M, Katon W, Russo J, Dobie R, Sakai C. A randomized trial of nortriptyline for severe chronic tinnitus effects on depression, disability, and tinnitus symptoms. Archives of Internal Medicine. 1993;153:2251-9.
- 396. Bayar N, Boke B, Turan E, Belgin E. Efficacy of amitriptyline in the treatment of subjective tinnitus. Journal of Otolaryngology. 2001;30:300-3.
- 397. Zoger S, Svedlund J, Holgers KM. The effects of sertraline on severe tinnitus suffering – A randomized, double-blind, placebo-controlled study. J. Clin. Psychopharmacology. 2006;26:32-9.
- 398. Bahmad FM, Venosa AR, Oliveira CA. Benzodiazepines and GABAergics in treating severe disabling tinnitus of predominantly cochlear origin. 12. 2006(140):144.
- 399. Hosseinzadeh A, Kamrava SK, Moore BC, Reiter RJ, Ghaznavi HK. Molecular aspects of melatonin treatment in tinnitus: A review. Current Drug Targets. 2019;20:1112-28.
- 400. Azevedo AA, Figueirdo rR, Elgoyhen AB, Langguth B, Schlee W. Tinnitus treatment with oxytocin: A pilot study. Front. Neurol. 2017;8:494.
- 401. Han AY, Mukdad L, Long JL, Lopez IA. Anosmia in COVID-19: Mechanisms and significance. Chemical senses. 2020;45:423-8.
- 402. Boesveldt S, Postma EM, Boak D, Schopf V, Martens J, Duffy VB. Anosmia – A clinical review. Chemical senses. 2017;42:513-23.
- 403. Lee MR, Wehring HJ, McMahon RP, Cascella N, Liu F, Bellack A, Strauss GP. Effects of adjunctive intranasal oxytocin on olfactory identification and clinical symptoms in schizophrenia: Results from a randomized double blind placebo controlled pilot study. Schizophr. Ews. 2013;145:110-5.
- 404. Sorokowaka A, Drechsler E, Karwowski M, Hummel T. Effects of olfactory training: a meta- analysis. Rhinology. 2017;55:17-26.
- 405. Rashid RA, Zgair A, Al-Ani R. Effect of nasal corticosteroid in the treatment of anosmia due to COVID-19: A randomised double-blind placebo-controlled study. American Journal of Otolaryngology- Head and Neck Medicine and Surgery. 2021;42:103033.
- 406. Nguyen B, Tosti A. Alopecia in COVID-19: Systematic review and meta-analysis. JAAD International. 2022;7:67-77.
- 407. Darwin E, Hirt PA, Fertig R, Doliner B, Delcanto G. Alopecia areata: Review of epidemiology, clinical features, pathogenesis, and new treatment options. International Journal of Trichology. 2018;10:51-60.
- 408. Wikramanayake TC, Villasante AC, Mauro LM, Perez CI, Jimenez JJ. Prevention and treatment of alopecia areata with quercetin in the C3H/HeJ mouse model. Cell Stress and Chaperones. 2012;17:267- 74.
- 409. Hamblin MR. Photobiomodulation for the management of alopecia: mechanisms of action, patient selection and perspectives. Clinical, Cosmetic and Investigational Dermatology. 2019;12:669-78.
- 410. Torres AE, Lim HW. Photobiomodulation for the management of hair loss. Photodermatol. Photoimmunol. Photomed. 2021;37:91-8.
- 411. Nichols AJ, Hughs OB, Canazza A, Zaiac M. An open-label evaluator blinded study of the efficacy and safety of a new nutritional supplement in androgenic alopecia: A pilot study. Journal of Clinical and Aesthetic Dermatology. 2017;10:52.
- 412. Karatas F, Sahin S, sever AR, Altundag K. Management of hair loss assocaited with endocrine therapy in patients with breast cancer: an overview. SpringerPlus. 2016;5:585.
- 413. Harvey CJ. Combined diet and supplementation therapy resolves alopecia areata in apaediatric patient: A case study. Cureus. 2020;12:e11371.
- 414. Stoehr JR, Choi JN, Colavincenzo M, Vanderweil S. Off-label use of topical minoxidil in alopecia: A review. Am. J. Clin. Dermatol. 2019;20:237-50.
- 415. Gupta AK, Venkataraman M, Talukder M, Bamimore MA. Finasteride for hair loss: a review. Journal of Dermatological Treatment. 2021.
- 416. Jo SJ, Shin H, Park YW, PPaik SH, Park WS, Shin HJ. Topical valproic acid increases the hair count in male patients with androgenic alopecia: A randomized, comparative, clinical feasibility study using phototrichogram analysis. Journal of Dermatology. 2014;41:285-91.
- 417. Lee SH, Yoon J, Shin SH, Zahoor M, Kim HJ, Park PJ, Min DS. Valproic acid induces hair regeneration in murine model and activates alkaline phosphatase activity in human dermal papilla cells. PloS ONE. 2012;7:e34152.
