コンテンツ
pubmed.ncbi.nlm.nih.gov/33682604/
2020年8月10日受理 2021年1月22日受理
オンライン公開:2021年03月07日
概要
パンデミック重症急性呼吸器新型コロナウイルス型(SARS-CoV-2)の感染力は、周囲温度が低いほど高まることが指摘されている。これは、SARS-CoV-2を含むほとんどの呼吸器系ウイルスが、体温より低い温度(例:33℃ vs 37℃)でよりよく複製されることと関係があると思われる。
また、SARS-CoV-2には熱に弱いという固有の性質がある。植物に感染するウイルスの90%はポジティブセンスの一本鎖リボ核酸(+ssRNA)ウイルスであり、この特徴はSARS-CoV-2にも共通している。
したがって、温和な温度での温熱療法(1~2時間)の適度なサイクル(8~12時間ごと)が提案されているCOVID-19の患者に対して、熱を用いた介入(温熱療法または温和な温度での温熱療法)を行うことが想定される。
しかし、安全性および機序上の懸念があり、温熱療法の使用は、すでに重症から重篤なCOVID-19に進行した患者の治療ではなく、疾患の進行を防ぐために軽度から中等度のCOVID-19患者にのみ制限される可能性がある。
ここでは、SARS-CoV-2の熱感受性ウイルスの特徴、ウイルスのクリアランスを助けるために高温で増強される可能性のある宿主機構、および潜在的リスクを考慮しながらCOVID-19患者の治療法として温熱療法を検討する方法について概説している。
世界保健機関(WHO)が2020年3月11日にコロナウイルス症(COVID-19)をパンデミックと宣言して以来、パンデミックの重症急性呼吸器新型コロナウイルス(SARS-CoV-2)の熱に対する感受性が議論されている。
周囲の温度と湿度が低いと、ウイルスの感染が有利になると考えられている。ある初期の報告では、中国の都市におけるSARS-CoV-2の感染率の上昇と低い周囲温度および湿度との間に関連性がないことが判明した。
[1YaoY,PanJ,LiuZ, et al.]中国都市におけるCOVID-19の感染と気温や紫外線の関連はない。Eur Respir J.2020;55(5):2000517.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]
しかし、拡張データの再解析により、温度が感染率の上昇と関連している可能性が示唆された。
[2RanJ,ZhaoS,HanL, et al.気温とCOVID-19感染率の関連性を探るための再解析:中国154都市を対象とした生態学的調査。Eur Respir J.2020;56(2):2001253.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
世界的に周囲の気温や湿度が高くなると、ウイルスの感染が減少することを指摘する研究項目が増えている
[3SajadiMM,HabibzadehP,VintzileosA, et al.新型コロナウイルス感染症(COVID-19)の潜在的な広がりと季節性を推定するための気温、湿度、緯度解析。
JAMA Netw Open.2020;3(6):e2011834.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],4WuY、JingW、LiuJ et al.166 カ国におけるCOVID-19の毎日の新規患者数と新規死亡数に対する気温と湿度の影響。Sci Total Environ.2020;729:1-7.[Crossref],[Web of Science ®],[Google Scholar]]。
フェイスマスクの効果は、上気道の温度と湿度の上昇に一部起因するとさえ考えられている。
[5GuptaD.”Therapeutic” facemasks”.Med Hypotheses.2020;143(162):109855.[Crossref],[PubMed],[Google Scholar]]。
*
SARS-CoV-2の高温に対する感受性は、感染ダイナミクスを超えた意味を持つ可能性がある。この意味で、COVID-19の特定の患者群に温熱療法を早期に適用すれば、重症化するのを抑制できる可能性があり、それによって、安全性と有効性が十分に証明された薬剤やワクチンがまだ存在しないこのパンデミックと闘うことができる。
COVID-19のためのシンプルで安価でアクセスしやすい治療薬を開発することが優先されるべきである。恵まれない人々や貧困に苦しむ人々が、医薬品の恩恵を受けるのは最後になるかもしれないからだ。
[6BassiLL,HwendaL. COVID-19: time to plan for prompt universal access to diagnostics and treatments.Lancet Glob Heal.2020;8(6):e756-7-e757.[Web of Science ®],[Google Scholar]]。
*
以下では、SARS-CoV-2などの呼吸器系ウイルスが熱に対して感受性が高いという知見、熱を加えることでウイルスが排出され病気の進行を抑えられるメカニズム、そしてCOVID-19患者においてリスクを考慮しながら実施可能な温熱療法について紹介する。
SARS-CoV-2の特徴と熱に対する感受性
種SARS-CoV-2は、コロナウイルス科、ベータコロナウイルス属に属する[7GorbalenyaAE,BakerSC,BaricRS, et al.種重症急性呼吸器症候群関連コロナウイルス:2019-nCoVを分類し、SARS-CoV-2と命名する。
Nat Microbiol.2020;25(4):536-544.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
コロナウイルスは、約30キロベース(kb)のポジティブセンス一本鎖リボ核酸(+ssRNA)ゲノムを持ち、これは非分節化、3′ポリアデニル化、5′キャップ開始断片を有する
[8ChenY,LiuQ,GuoD. Emerging Coronaviruses: Genome structure, replication, and pathogenesis.「新興コロナウイルス:ゲノム構造、複製、病原性」J Med Virol.2020;92(4):418-423.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
このウイルスの最初の配列決定のゲノムの1つは、6つの市長オープンリーディングフレーム(ORF)で構成されていた[9ZhouP,YangXL,WangXG, et al.コウモリに由来すると思われる新型コロナウイルスに関連する肺炎の発生。
Nature.Crossref],[PubMed],[Web of Science ®],[Google Scholar]],
ORF1aとORF1b はコロナウイルスによく見られるものである
[8ChenY,LiuQ,GuoD. Emerging Coronaviruses: Genome structure, replication, and pathogenesis.コロナウイルスの発生、増殖、病原性。J Med Virol.2020;92(4):418-423.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]] は、主にウイルスRNAの処理と複製(ウイルスRNAゲノムのコピーを増やすプロセス)に関わる16の非構造タンパク質(nsp)と、主にウイルスに形を与え、細胞への侵入を導く4つの主要構造タンパク質、スパイク(S)、膜(M)、エンベロープ(E)、核酸(N)タンパク質に対するORFであった。
SARS-CoV-2ゲノムのその他のORFは以下の通りである。3a、6,7a、7b、および 8[9ZhouP,YangXL,WangXG, et al.コウモリに由来すると思われる新型コロナウイルスに関連した肺炎の発生。
Nature.2020;579(7798):270-273.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
*
N タンパク質は RNA 結合タンパク質であり、ウイルス RNAの複製と翻訳(ウイルスタンパク質の合成)に適した RNA 構造を維持する重要な役割を担っている[10KangS,YangM,HongZ, et al.SARS-CoV-2 ヌクレオカプシドタンパク質 RNA 結合ドメインの結晶構造から、ユニークな薬剤標的部位の可能性が明らかになった。
Acta Pharm Sin B.2020;10(7):1228-1238.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
SARS-CoVのNタンパク質は、SARS-CoV-2のNタンパク質と90.3%の相同性を有する
[11TiloccaB,SoggiuA,SanguinettiM, et al.SARS-CoV-2 ヌクレオカプシドタンパク質のエピトープを分類学的に近縁のコロナウイルスと比較した計算機による解析。Microbes Infect.2020;22(4-5):188-194.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]], 35 ℃でアンフォールドを開始し、55 ℃で完全変性に達する(融解温度 [Tm] = 43℃)[12WangY、WuX、WangY et al.SARSウイルスのヌクレオカプシドタンパク質の低安定性。Biochemistry.2004;43(34):11103-11108.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
SARS-CoV、SARS-CoV-2ともに温度依存的に熱に弱いことが知られており、56 ℃で10分以上インキュベートすると感染力を完全に失う
[13DuanS-M,ZhaoX-S,WenR-F, et al.SARS コロナウイルスのヒト検体および環境中での安定性と、加熱および紫外線照射に対する感受性。
Biomed Environ Sci.2003;16(3):246-255.[PubMed],[Web of Science ®],[Google Scholar],14ChinAWH、ChuJTS、PereraMRA et al. SARS-CoV-2の異なる環境条件下での安定性。Lancet Microbe.2020;1(1):e10.[Crossref],[PubMed],[Google Scholar]],
これはNタンパク質の変性温度より1°C高いだけである。さらに最近、SARS-CoV-2 RNAポリメラーゼのnsp8およびnsp12サブユニットは、SARS-CoVの対応するもの(それぞれ48.7および45.2℃)よりも低いTm(それぞれ45.4および43.6℃)を有することが示された
[15PengQ、PengR、YuanB et al.SARS-CoV-2由来のnsp12-nsp7-nsp8コアポリメラーゼ複合体の構造および生化学的特性評価。Cell Rep.2020;31(11):107774.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]],
これは、ヒトへの感染力を高める一方で、耐熱性を低くするための適応である可能性もある。さらに、コロナウイルスの熱不活性化の予測モデルは、不活性化がタンパク質の変性に従うことを支持しており、宿主外の熱変性によるウイルスの3ログ不活性化に要する時間は、35℃で9.4時間、40℃で4時間と予測された
[16YapTF、LiuZ、ShvedaRA et al.コロナウイルスの温度依存性不活性化に関する予測モデル。Appl Phys Lett.2020;117(6):060601.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
*
ほとんどの呼吸器ウイルスは特に熱に弱く、下気道と比較して上気道で見られる低温(すなわち、33℃対37℃)でより大きな複製と感染力を持つ
[17FoxmanEF、StorerJA、FitzgeraldME et al.風邪のウイルスに対する温度依存性の自然防衛は、マウスの気道細胞では暖かい温度でウイルスの複製を制限する。Proc Natl Acad Sci USA.2015;112(3):827-832.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],18HolwerdaM、KellyJ、LaloliL et al.
このような場合、「痒み」、「痒み止め」の4種類の方法がある。
Viruses.2019;11(4):377-374.[Crossref],[Web of Science ®],[Google Scholar]]。
これは一見、SARS-CoV-2の場合、ヒト気道上皮細胞(AEC)において37℃と比較して33℃でより効率的に複製される
[19PhilipV,GultomM,SteinerS, et al.SARS-CoV-2とSARS-CoVのヒト呼吸器上皮における温度依存性の異なるウイルス-宿主ダイナミクス。bioRxiv 2020.04.27.062315.doi. org/10.1101/2020.04.27.062315[Crossref],[Google Scholar]]。
例えば、SARS-CoV-2のSタンパク質のシュードウイルス粒子への組み込みは、33℃に対して37℃で減少する
[20LaporteM,StevaertA,RaeymaekersV, et al.SARS-CoV-2 and other human coronavirus spike proteins are fine-tuned towards temperature and proteases of the human airways. bioRxiv. 2020.11.09.374603; doi:doi.org/10.1101/2020.11.09.374603[Google Scholar]].
温度の上昇は、AECにおける抗ウイルス防御応答遺伝子の発現の増加、およびI型とIII型のインターフェロン(IFN)のレベルの上昇を通じて、ライノウイルスの複製を抑制することが知られている
[17FoxmanEF,StorerJA,FitzgeraldME, et al.風邪のウイルスに対する温度依存性の自然防衛は、マウスの気道細胞の暖かい温度でウイルス複製を制限する。
Proc Natl Acad Sci USA.2015;112(3):827-832.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]], および、感染細胞の早期アポトーシスとリボヌクレアーゼL(RNAseL)活性の強化(IFNによるその既知の発現増加とは無関係)を誘発するウイルスの二本鎖RNA(dsRNA)中間体に依存するIFN非依存性機構を介して[21FoxmanEF、StorerJA、VanajaK et al.2つのインターフェロン非依存性二本鎖RNA誘導型宿主防御戦略は、暖かい温度で感冒ウイルスを抑制する。Proc Natl Acad Sci U S A.2016;113(30):8496-8501.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
RNA干渉(RNAi)は、IFNと非IFNの両方に依存し、SARS-CoV-2感染に関連する可能性のある、高温で強化される第3のdsRNA依存性メカニズムである可能性があり、これについては別の小見出しで説明する。
*
宿主におけるコロナウイルスの熱不活性化は未解明であるが、ヒトにおいて障害を起こさずに長時間の滅菌温度に到達できる可能性は低い。したがって、単なる熱力学的効果によってSARS-CoV-2を不活性化することは不可能であろう。しかしながら、軽度の熱力学的効果は、呼吸器系ウイルスのクリアランスにおいて、特に、COVID-19において低い初期のIFN型およびIII型応答が疾患の進行と関連しているので、速やかに行われれば、温度の上昇の既知の生物学的効果と相乗的に作用し得る。
[22Blanco-Melo D,Nilsson-Payant BE,LiuWC,et al.SARS-CoV-2に対する宿主応答の不均衡がCOVID-19の発症を促す。Cell.2020;181(5):1036-1045.e9.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],23HadjadjJ、YatimN、BarnabeiL et al. COVID-19重症患者におけるI型インターフェロン活性および炎症反応の障害。Science.2020;369(6504):718-724.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
タンパク質合成とオルガネラ輸送における温度の影響
細胞は、特定の温度で最も効率的に機能を発揮するように適応している。例えば、マウスやヒトの精巣は、中核体温よりも低い温度(すなわち、34 °C vs 37 °C)に曝される。マウスの精巣を34℃、37℃、40℃に1時間暴露したところ、34℃と比較して37℃では約25%、40℃では約50%のタンパク質合成が減少した
[24中村真一、ホールPF. 体温がラット精巣の精子におけるタンパク質生合成を抑制する機構。J Biol Chem.1980;255(7):2907-2913.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]]。
メッセンジャーRNA(mRNA)と呼ばれるRNAの鋳型は、通常、細胞のリボソームによってアミノ酸をタンパク質に組み立てるために使われるが、リボソームはタンパク質合成を促進するためにポリリボソームにグループ化することができる。中村とHallの研究では、温度依存的なポリリボソームの減少が、タンパク質合成の低下に関連していることが明らかになった。42 °CにさらされたHeLa細胞でも、ポリリボソームの分解が起こり、タンパク質合成が低下した。
[25McCormickW,PenmanS. Regulation of protein synthesis in HeLa cells: Translation at elevated temperatures.J Mol Biol.1969;39(2):315-333.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
*
リボソームは、リボソームRNA(rRNA)とタンパク質から構成されている。42 ℃にさらされた細胞は、多様なメカニズムによって、1 時間後には rRNAの生産をわずか 3%にまでほぼ停止させるのが特徴である
[26SadisS,HickeyE,WeberLA. HeLa 細胞におけるRNA 代謝に対する熱衝撃の影響。J Cell Physiol.1988;135(3):377-386.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],27ZhaoZ、DammertMA、HoppeS et al.
熱ショックは、TIF-IAの不活性化とヌクレオソームポジショニングのlncRNA依存的変化によりrRNA合成を抑制する。
Nucleic Acids Res.2016;44(17):8144-8152.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]の通りである。
これにより、エネルギーを保存するためにタンパク質の翻訳が著しく減少する。42℃で変化する他のメカニズムは、特定のmRNAの十分なプロセシングである。
[28ShalgiR,HurtJA,LindquistS, et al.転写後スプライシングの広範な阻害は、熱ショック後の細胞トランスクリプトームを形成する。Cell Rep.2014;7(5):1362-1370.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]とポリアデニレーション(RNAにポリ(A)テールを付加し、RNAをより安定かつ効率的に講義するプロセス)の阻害[29Di GiammartinoDC,ShiY,ManleyJL.
PARP1は、熱ショック時にPAPを抑制し、ポリアデニレーションを抑制する。
Mol Cell.2013;49(1):7-17.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。コロナウイルスRNAゲノムのポリアデニレーションは、翻訳と複製の強化を通じてウイルスの生存を促進することが知られている[30PengYH,LinCH,LinCN, et al.コロナウイルスのポリアデニレーションにおける6量体AGUAAAとポリ(A)テールの役割の特性化。PLoS One.2016;11(10):e0165077-13.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]に記載されている。
まとめると、タンパク質合成とウイルスRNAのポリアデニレーションの阻害は、SARS-CoV-2の感染性を潜在的かつ大幅に減衰させる可能性がある。
*
その病原性の一部として、SARS-CoV-2感染細胞では細胞小器官がリモデリングされている。これらの細胞における細胞骨格の再配列を抑制することで、ウイルス粒子の産生を抑制できることが示されている
[31CorteseM,LeeJ-Y,CerikanB, et al.統合的イメージングにより、SARS-CoV-2が細胞内形態の再構築を誘導していることが明らかになった。Cell Host Microbe.2020;28(6):853-866.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]の通り。ハイパーサーミア[32PawlikA,NowakJM,GrzankaD, et al.参照]の両方が原因である。
高熱は、p53 欠損 H1299 肺がん細胞において細胞骨格の変化と有糸分裂のカタストロフィを誘発する。
Acta Histochem.2013;115(1):8-15.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]] and radiotherapy[33Jasińska-KoniorK,WiechećO,SarnaM, et al.
アクチン細胞骨格の再配列による低LET陽子線後のメラノーマ細胞の弾力性の増加。
Sci Rep.2019;9(1):1-11.[Crossref],[PubMed],[Google Scholar]] は、細胞骨格ダイナミクスを変更する可能性があり、それらの共同使用はSARS-CoV-2感染性を低下させる可能性がある。
*
さらに、SARS-CoV-2はリソソーム輸送を変化させ、新しいビリオンを放出させる。リソソームが脱酸され、リソソーム酵素が不活性化されることにより、SARS-CoV-2感染は抗原処理と提示に障害をもたらす
[34GhoshS、Dellibovi-RaghebTA、KervielA et al.]。β-コロナウイルスは、生合成分泌経路の代わりにリソソームを用いて排出する。Cell.2020;183(6):1520-1516.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
リソソームの酸性化は温度の上昇とともに起こる
[35MaoG-J,LiangZ-Z,GaoG-Q, et al.熱中症時のリソソーム pH モニタリングのための光安定性の高い Si-Rhodamine ベースの近赤外蛍光プローブ。Anal Chim Acta.2019;1092:117-125.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]],
したがって、温熱療法は、新たに組み立てられたウイルス粒子の放出を制限し、免疫系の細胞による抗原認識を強化することができる。
ハイパーサーミアと免疫反応
免疫系は多様な刺激によって誘導されることが特徴であり、まだ十分に解明されていない個々の要因に応じて、いくつかの反応経路が考えられる。発熱域の温度(38-41℃)は、自然免疫反応と適応免疫反応の両方を含む多様なレベルで免疫反応を変化させることができる
[36-38HurwitzMD. ハイパーサーミアと免疫療法:臨床の機会。Int J Hyperthermia.2019;36(sup1):4-9.[Taylor & Francis Online],[Google Scholar]GazelD,YılmazM. Are infectious diseases and microbiology new fields for thermal therapy research?Int J Hyperthermia.2018;34(7):918-924.[Taylor & Francis Online],[Web of Science ®],[Google Scholar]LinC,ChenJ. Regulation of immune cell trafficking by febrile temperatures.Int J Hyperthermia.2019;36(sup1):17-21.[Taylor & Francis Online],[Google Scholar]]。
*
温度上昇(42℃)や他の細胞ストレスの誘発により、遺伝子発現プロファイルの劇的な変化が見られ、ストレス応答タンパク質(誤って高温にさらされた細胞で発見されたため、熱ショックタンパク質[HSP]とも呼ばれる)が増加する。HSPは、免疫調節を介して細胞を保護することが知られているメカニズムの一つである。
ストレス反応の強化は、敗血症後の急性肺障害への進行を抑制すると考えられている[39WheelerDS,WongHR. 熱ショック反応と急性肺障害。Free Radic Biol Med.2007;42(1):1-14.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]] HSP70経路は、SARS-CoV-2感染後の過炎症を抑制できる主要機構の1つである[40、RébéC,GhiringhelliF,GarridoC. Hyperthermia-mediated Heat Shock Factor (HSF)/Heat Shock Protein (HSP) 70 pathway Can dampen the cytokine storm during SARS-CoV-2 infection?Br J Pharmacol.2020;1-7.doi. org/10.1111/bph.15343[Web of Science ®],[Google Scholar]]。
HSPを利用して感染力を高めるウイルス(すなわち、ヒトパピローマウイルス[HPV]、アデノウイルス、デングウイルス)もあれば、HSPの量が多いと停止するウイルス(すなわち、インフルエンザウイルス、ヒト免疫不全ウイルス[HIV])もある
[41BolhassaniA,AgiE. Heat shock proteins in infection.日本学術振興会特別研究員。
Clin Chim Acta.2019;498(July):90-100.[Crossref],[PubMed],[Google Scholar]].SARS-CoVは、そのSタンパク質を介してストレス応答を調節する洗練されたメカニズムを持っている[42ChanCP,SiuKL,ChinKT, et al.重症急性呼吸器症候群コロナウイルスのスパイクプロテインによるunfolded protein responseの調節。
J Virol.2006;80(18):9279-9287.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]とE タンパク質[43DeDiegoML,Nieto-TorresJL,Jiménez-GuardeñoJM, et al. Severe acute respiratory syndrome coronavirus envelope protein regulates cell stress response and apoptosis(重症急性呼吸器症候群コロナウイルスエンベロープタンパク質は、細胞のストレス応答とアポトーシスを制御する)。
PLoS Pathog.2011;7(10):e1002315.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
SARS-CoVからEタンパク質を除去すると、感染力が弱くなることがわかった。このように、ストレス応答はSARS-CoVの感染性を促進するというよりも、むしろ感染性に影響を与えることがほとんどであり、ウイルスがストレス応答を調節する機構を進化させた理由を説明することができるだろう。
*
前述のように、SARS-CoV-2はオルガネラの輸送を阻害することで、免疫細胞の抗原処理を変化させる。SARS-CoV-2のもう一つの病態生理学的特徴は、スフィンゴミエリナーゼ活性を増強し、それによって、ウイルス感染性を促進する酵素(カテプシンD、タンパク質ホスファターゼおよびキナーゼ)のアンカーとして働くセラミドに富む膜ドメインを増加させることである
[44CarpinteiroA,EdwardsMJ,HoffmannM, et al.酸性スフィンゴミエリナーゼの薬理学的阻害は、上皮細胞によるSARS-CoV-2の取り込みを阻止する。Cell Reports Med.2020;1(8):100142.[Crossref],[PubMed],[Google Scholar]]。
軽度の温熱療法中、HSPは熱に反応して細胞膜を安定化させるためにセラミドに富むドメインに輸送・固定される。HSP70の表層露出により、細胞はマクロファージやナチュラルキラー(NK)細胞によって認識される
[45FabriJHTM、de SáNP、MalavaziI et al.真核生物における熱適応時のスフィンゴ糖脂質の動態と役割。Crossref],[PubMed],[Google Scholar]],
これにより、温熱療法が抗原提示を促進する第2のメカニズムを構成することができる。NKおよびT CD8+ MHCクラスI制限細胞の細胞傷害性は、軽度の温熱療法下でも増加する
[46KappelM,StadeagerC,TvedeN, et al.ナチュラルキラー細胞活性、試験管内試験増殖反応、および血液単核細胞亜集団に対する生体内試験温熱療法の影響。Clin Exp Immunol.1991;84(1):175-180.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],47ShenR-N,LuL,YoungP, et al.
臍帯血と成人血液細胞のナチュラルキラー細胞活性、リンパ球活性化キラー細胞活性、レクチン依存性細胞傷害性に及ぼす高温の影響。
Int J Radiat Oncol Biol Phys.1994;29(4):821-826.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
*
発熱域の温度はまた、免疫細胞の輸送を促進し、それによって感染時の免疫監視を改善する
[38LinC,ChenJ. Regulation of immune cell trafficking by febrile temperatures.Int J Hyperthermia.2019;36(sup1):17-21.[Taylor & Francis Online],[Google Scholar]]。
樹状細胞(DC)は、ナイーブCD8+ Tリンパ球への抗原提示能力の向上とサイトカイン産生、特にTNF-αの増加を伴う二次リンパ系器官への移動・勧誘の増加を示す
[48KnippertzI,SteinMF,DörrieJ, et al.軽度の温熱療法は、ヒト単球由来樹状細胞の機能を強化し、ワクチン接種戦略への応用の可能性を提供する。Int J Hyperthermia.2011;27(6):591-603.[Taylor & Francis Online],[Web of Science ®],[Google Scholar]]。
これらの温度下では、DCにおいて遺伝子発現が変化し、転写後修飾、タンパク質フォールディング、細胞死/生存、移動に関わる43の遺伝子がアップレギュレーション、24の遺伝子がダウンレギュレーションする
[49LisoA、CastellaniS、MassenzioF et al.Liso A, Castellani S, Massenzio F, et al.Hyperthermiaに曝露されたヒト単球由来樹状細胞は、異なる遺伝子発現プロファイルとIGFBP6の選択的なアップレギュレーションを示す。Oncotarget.2017;8(37):60826-60840.[Crossref],[PubMed],[Google Scholar]],
また、インターロイキン(IL)-12産生[50PengJC,HydeC,PaiS, et al.TLR アゴニストでプライムした単球由来 DC は、高熱条件下で、CD40 依存的にIL-12p70を分泌する。
J Immunother.2006;29(6):606-615.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]],
これは免疫応答をTh1表現型に偏らせる可能性がある
[51Hatzfeld-CharbonnierAS,LasekA,CasteraL, et al.抗腫瘍ワクチンの免疫療法的可能性を持つ、ヒト単球由来樹状細胞機能に対する熱ストレスの影響。J Leukoc Biol.2007;81(5):1179-1187.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],52UmarD、DasA、GuptaS et al.は、熱ストレスの影響を受けている。このような場合、「痒い」「痛い」Proc Natl Acad Sci USA.2020;117(36):22357-22366.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
Th1細胞はサイトカインを産生し、自然免疫細胞をリクルートすることができるため、早期のTh1免疫応答は重要である
[53SetteA,CrottyS. Adaptive immunity to SARS-CoV-2 and COVID-19.Cell.2021;1-20.doi.org/10.1016/j.cell.2021.01.007.[PubMed],[Web of Science ®],[Google Scholar]],
これはCOVD-19における迅速なウイルスクリアランスと軽症化と関連している
[54TanAT,LinsterM,TanCW, et al.
SARS-CoV-2 特異的 T 細胞の早期誘導は、COVID-19 患者における迅速なウイルスクリアランスおよび軽症と関連する。
Cell Reports.2021;1-9.doi.org/10.1016/j.celrep.2021.108728.[Web of Science ®],[Google Scholar]]。
注目すべきは、SARS-CoV-2感染後に軽症である小児は、IL-17AおよびIFN-γのレベルが優位に増加するが、成人は通常そうではなく、おそらくTh17細胞の保護的役割を反映している
[55PierceCA,Preston-HurlburtP,DaiY, et al.入院中の小児および成人患者におけるSARS-CoV-2 感染に対する免疫反応。Sci Transl Med.2020;12(564):1-17.[Crossref],[Web of Science ®],[Google Scholar]]。
IL-22の産生能力は、SARS-CoV-2感染後の組織修復に重要である可能性がある
[53SetteA,CrottyS. Adaptive immunity to SARS-CoV-2 and COVID-19.Cell.2021;1-20.doi.org/10.1016/j.cell.2021.01.007.[PubMed],[Web of Science ®],[Google Scholar]]。
したがって、38.5~39.5℃の温度は試験管内試験でTh17の分化を促進し、IL-17とIL-22の産生が増加するため、感染後にTh17適合反応を示さないCOVID-19の成人には温熱療法が特に有用であると考えられる
[56WangX、NiL、WanS et al.発熱温度は、ヘルパーT細胞17細胞の分化と病原性を決定的に制御する。Immunity.2020;52(2):328-341.e5.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
*
COVID-19の重症化の特徴の1つは、重症化した患者が、IL-1β、IL-6、IL-8、TNF-αの血清レベルの上昇によって特徴づけられる高炎症状態(サイトカインストームとしても知られている)を起こすことであり、これは生存率の低下と関連している
[57Del ValleDM,Kim-SchulzeS,HuangHH, et al.炎症性サイトカインシグネチャーは、COVID-19の重症度と生存率を予測する。Nat Med.2020;26(10):1636-1643.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],58LeeSJ,ChannappanavarR,KannegantiTD.
コロナウイルス:自然免疫、インフラマソーム活性化、炎症性細胞死、およびサイトカイン。
Trends Immunol.2020;41(12):1083-1099.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]に記載されている。
さらに、炎症性サイトカインは、フィブリノーゲン産生を増加させ(IL-6を介して)、急速な血栓形成を促進する(IL-8、IL-1β、IL-6を介して)ことにより、血栓症に寄与する
[59DavalosD,AkassoglouK. Fibrinogen as a key regulator of inflammation in disease.(疾患における炎症の重要な制御因子としてのフィブリノーゲン)]。Semin Immunopathol.2012;34(1):43-62.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],60BesterJ,MatshailweC,PretoriusE. Simultaneous presence of hypercoagulation and increased clot lysis time due to IL-1β、IL-6およびIL-8.Cytokine.2018;110:237-242.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]],
COVID-19の高凝固性を「thromboinflammation」と特定するに至った理由である[61ConnorsJM,LevyJH.COVID-19のトロンボインフレーメーションと凝固性亢進。
J Thromb Haemost.2020;18(7):1559-1561.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]の通りである。
細胞を熱(41℃、15分という短時間)にさらすことによる炎症性遺伝子発現のダウンレギュレーションは、核因子κ-light-chain-enhancer of activated B cells(NF-κB)およびマイトジェン活性化タンパク質キナーゼ(MAPK)p38を最大20時間抑制する結果となるので、この意味において温熱療法は有用となりうる[62StuhlmeierKM. 短期間の温熱療法は、マイトジェン活性化プロテインキナーゼp38の活性化を防ぐ。
Exp Gerontol.2009;44(6-7):406-412.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
さらに、健康なドナーからの単核血球を39℃に曝露した後、リンパ球は、フローサイトメトリーによって決定されるリンパ球のサブタイプの偏りなしに数を拡大し、IL-1β、IL-6およびIFN-γのレベルが減少する
[63KappelM、DiamantM、HansenMB、KlokkerM、他 et al.血液単核細胞サブセットの増殖反応に対する試験管内温熱療法の効果、およびインターロイキン1および6、腫瘍壊死因子-アルファおよびインターフェロン-ガンマの検出。Immunology.1991;73(3):304-308.[PubMed],[Web of Science ®],[Google Scholar]]。
*
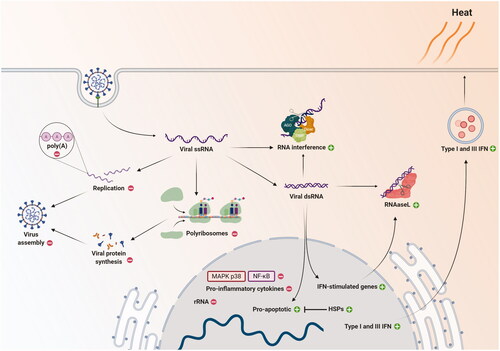
温熱療法がSARS-CoV-2の病態を変化させることができる、これまでに議論されてきた統合的な細胞メカニズムを図1に示す。
*
図1 一本鎖RNA(ssRNA)ウイルス感染後の細胞レベルにおける温熱療法の潜在的効果
細胞内に侵入したウイルス粒子は組み立てられず、一本鎖RNA(ssRNA)が自由に残って、ウイルスのタンパク質合成と複製を行う。二本鎖RNA(dsRNA)中間体は、RNA干渉装置とリボヌクレアーゼL(RNAseL)によって、ウイルスRNAの分解に利用され、dsRNAはアポトーシス促進遺伝子やインターフェロン(IFN)刺激遺伝子の発現を促進する。
熱にさらされると、ウイルスRNAの分解、熱ショックタンパク質(HSP)の発現、IFN刺激遺伝子、タイプIおよびIII IFNの放出、感染細胞のプロアポトーシス機構が増加(緑の丸に+記号)する可能性がある。温度が高いと、ウイルス複製、ウイルスRNAポリアデニレーション(poly[A])、リボソームRNA(rRNA)合成、ポリリボソーム形成、ウイルスアセンブリー、およびNF-κB(活性化B細胞)およびp38(MAPK)阻害による炎症性サイトカイン発現が抑制される(赤丸、-記号)。
植物と哺乳類のRNA干渉(RNAi)
植物や無脊椎動物は、ウイルスに対する多様な防御機構を進化させてきた。植物における感染の90%はssRNAウイルスが引き起こす[64VoinnetO. ウイルスに対する植物の免疫システムとしてのRNAサイレンシング。
Trends Genet.2001;17(8):449-459.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]]。
植物は、高等脊椎動物のような抗体や強固で複雑な細胞性免疫系に依存しないにもかかわらず、ウイルス感染に対して、主にRNA分子をエフェクターとして用いる適応反応を発達させてきた
[64VoinnetO. ウイルスに対する植物免疫システムとしてのRNAサイレンシング。Trends Genet.2001;17(8):449-459.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],65WaterhousePM,WangM,LoughT. Gene silencing as an adaptive defense against viruses.(ウイルスに対する適応的防御としての遺伝子サイレンシング).Nature.2001;411(6839):834-842.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
*
RNAiの抗ウイルス作用は主に2つあると考えられている。1.ウイルスの二本鎖RNA生成物を約22ヌクレオチド長のウイルス由来の低分子干渉RNA(vsiRNA)に処理することでウイルスの複製を阻害する。2.RNAi機構を通じて相補的なウイルスRNAに採用されたvsiRNAは、ウイルス転写物の切断を促進し、それによってウイルスタンパク質の生成を制限する[66GantierMP. 哺乳類細胞における二本鎖RNAの処理:直接的な抗ウイルスの役割?
J Interferon Cytokine Res.2014;34(6):469-477.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
RNAi機構はほとんどの真核生物に存在し、ウイルスやトランスポーザブルエレメントに対する初期の防御要素として進化的にみなされており、現代の真核生物の最後の共通祖先に存在した可能性が高い
[67CeruttiH,Casas-MollanoJA. RNAを介したサイレンシングの起源と機能について:原生生物からヒトまで。Curr Genet.2006;50(2):81-99.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]]。
それにもかかわらず、異なる真核生物におけるその役割は、進化の後半に分岐した可能性がある[68ShabalinaSA,KooninEV. 真核生物のRNA干渉の起源と進化。真核生物のRNA干渉の起源と進化(Trends Ecol Evol.2008;23(10):578-587.
*
RNAウイルスに対する同様の防御機構が哺乳類にも存在し、(IFN応答が支配的なため)関連性があるかどうかは、長い間論争になっていた。病原性ウイルスには、RNAiのウイルス抑制因子(VSR)として働く数多くのウイルスタンパク質が同定されている)。
VSRが存在すると、これらのタンパク質を欠損したウイルスと比較して、より大きな感染力を持つことになる。哺乳類における抗ウイルスRNAiに関する当初の議論は、vsiRNAに関する知見が一貫していなかったことに起因しており、ウイルスRNAの分解産物ではないかとの見方もあった。
しかし、マウス胚性幹細胞(mESC)やベビーハムスター腎臓21(BHK-21)細胞に感染した野田村ウイルス(NoV)のVSR B2タンパク質がない場合のvsiRNAの生成を調べたところ、分解物とは明確に区別された
[69LiY、LuJ、HanY et al.RNA干渉は哺乳類における抗ウイルス免疫機構として機能する。Science.2013;342(6155):231-234.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],70MaillardPV、CiaudoC、MarchaisA et al. 哺乳類細胞における抗ウイルスRNA干渉。Science.2013;342(6155):235-238.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
*
表1 RNA干渉のウイルス抑制因子(VSR)としての役割を持つウイルス性タンパク質a。
アルゴノートタンパク質(AGO)は、植物および無脊椎動物において、RNAiを介した抗ウイルス防御の重要なエフェクターである[64VoinnetO. ウイルスに対する植物の免疫システムとしてのRNAサイレンシング。
Trends Genet.2001;17(8):449-459.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]]。
マウスとヒトにコードされる4つのAGOのうち、AGO2は当初、試験管内試験での触媒活性が証明され、特性評価も良かったため、哺乳類の抗ウイルスRNAiの候補として最も研究されたが、相反する結果が得られている。vsiRNAの同定に成功したのは、4つのAGOすべてと異所的に発現した誘導性ヒトAGO2を枯渇させたmESCにNoVを感染させ、ウイルス力価を低下させた結果である
[70MaillardPV、CiaudoC、MarchaisA et al.哺乳類細胞における抗ウイルス RNA 干渉。Science.2013;342(6155):235-238.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
このグループによるその後の研究では、哺乳類における強固なIFN応答が抗ウイルスRNAiを覆い隠す可能性が示唆された。これは、mESCとは逆にIFNに効率的に応答するマウス胚性線維芽細胞(MEFs)において行われた
[71MaillardPV,Van der VeenAG,Deddouche-GrassS, et al.タイプIインターフェロン経路の不活性化により、哺乳類細胞における長鎖二本鎖RNAを介したRNA干渉が明らかになった。Embo J.2016;35(23):2505-2518.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
*
これらの知見は、CRISPR/Cas9によってRIG-1およびMDA5-IFN発現を誘導する2つのパターン受容体を欠損させたHeLa細胞を用いた2つの研究によって疑問視された
[72SchusterS,TholenLE,OverheulGJ, et al.
細胞質二本鎖RNAセンサーの欠失は、ヒト細胞におけるウイルス性小干渉RNA産生を明らかにしない。
mSphere.2017;2(4):1-9.[Crossref],[Web of Science ®],[Google Scholar]] and AGO2[73SchusterS,OverheulGJ,BauerL, et al.
ヒト細胞におけるArgonaute 2のウイルス性small RNA産生および抗ウイルス機能の証拠はない。
Sci Rep.2019;9(1):1-11.[Crossref],[PubMed],[Google Scholar]]。
シンドビスウイルス、YFV17D、コクサッキーウイルスB3(後者の研究では脳心筋炎ウイルス[EMCV]も含まれている)に感染した後、検出可能なvsiRNAもRNAiによる抗ウイルス活性におけるヒトAGO2の役割も確認されなかった。
哺乳類におけるRNAiに対する証拠に加え、異なる分類群におけるAGOの系統的比較は、このアプローチによって唯一のmiRNAクラスのAGOが同定されたことから、脊椎動物においてRNAi抗ウイルス機能が欠如していることを示唆している
[74WynantN,SantosD,Vanden BroeckJ. The evolution of animal Argonautes: Evidence for the absence of antiviral AGO Argonautes in vertebrates.Sci Rep.2017;7(1):1-13.[Crossref],[PubMed],[Google Scholar]]。
しかし、ヒトAGOの系統的比較により、AGOの機能適応は進化的距離と直接相関しないことが示されている[75HauptmannJ,KaterL,LöfflerP, et al.触媒的なヒトAgo4の生成により、RNA切断に重要な構造要素が特定された。
RNA.2014;20(10):1532-1538.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
*
最近、AGO4が哺乳類の抗ウイルスRNAiに関与するアルゴノートであると提唱された。体細胞株(すなわち、HeLa)は、AGO4の発現が低いことで知られている
[76PetriS,DueckA,LehmannG, et al.増加したsiRNA二重鎖の安定性は、オフターゲットの減少およびオンターゲット効果の上昇と相関している。
RNA.2011;17(4):737-749.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]],
これは雄マウスの生殖腺で高発現している[77ModzelewskiAJ、HolmesRJ、HilzS et al.AGO4 は、雄マウスの生殖細胞において減数分裂への参入を制御し、性染色体のサイレンシングに影響を与える。
Dev Cell.2012;23(2):251-264.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]とIFN 産生自然免疫マウス細胞[78AdiliaghdamF、BasavappaM、SaundersTL et al.]。哺乳類の抗ウイルス防御におけるアルゴノート4の必要性。Cell Rep.2020;30(6):1690-1701.e4.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
注目すべきは、AGO4はSARS-CoV-2に感染したヒト気道上皮細胞、およびCOVID-19患者の特定の末梢血細胞で少なくとも中程度の発現が見られることである(図2)。
Adiliaghdamらによる研究では、AGO4は、SARS-CoV-2に感染したヒト気道上皮細胞や、COVID-19患者の末梢血細胞の一部で少なくとも中程度の発現が確認されている(図2)。AGO4 は、IFN 依存型とIFN 非依存型の両方の抗ウイルス機構を有することが明らかになった。
A型インフルエンザウイルス(FLUAV)、EMCV、水疱性口内炎ウイルス(VSV)の感染後、AGO4ノックアウトマクロファージ、樹状細胞、MEFsにおいて、高いウイルス力価およびウイルスRNAが検出された。AGO4欠損マクロファージでは、ウイルス感染後に低レベルのIFN-βが検出され、FLUAV感染後にvsiRNAが検出され、NS1欠損FLUAV感染後にvsiRNAのレベルが高くなり、ウイルス量が高くなった。AGO4欠損マウスは、FLUAV感染後のウイルス力価およびウイルス誘発性病態がより大きかった。
*
図2 SARS-CoV-2を感染させたヒト気道上皮細胞、およびCOVID-19患者の末梢血細胞におけるアルゴノート4(AGO4)の発現量
ヒト気管支上皮細胞(青棒)およびヒト気道上皮細胞株(紫棒)をSARS-CoV-2に試験管内試験感染させた後、AGO4が少なくとも中程度発現した細胞(DESeq2 で正規化した発現値が、80 以上と定義)[22Blanco-MeloD、Nilsson-PayantBE、LiuWC et al.]。
SARS-CoV-2に対する宿主応答の不均衡が、COVID-19の発生を促進する。Cell.2020;181(5):1036-1045.e9.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]], およびCOVID-19患者から回収した末梢血細胞(赤い棒)から[96WilkAJ、RustagiA、ZhaoNQ et al.重篤なCOVID-19 患者における末梢免疫応答の単一細胞アトラス(A single-cell atlas of the peripheral immune response in patients with severe COVID-19).Nat Med.2020;26(7):1070-1076.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
発現量はimmgen.orgより取得。略号肺胞底腺癌由来ヒト気道上皮細胞株(A549 + ACE2)、肺腺癌由来ヒト気道上皮細胞株(Calu3)、cluster of differentiation 8 positive memory T cell (CD8+ M T cell)、cluster of differentiation 8 positive monocyte (CD8+ M T cell),cluster of differentiation 14 positive monocyte (CD14+ Mo), cluster of differentiation 16 positive monocyte (CD16+ Mo), developing neutrophil (Dev neutrophil), eosinophil (Eo), normal human bronchial epithelial cell (NHBE), stem cell (SC).*発生中の好中球は、好中球顆粒タンパク質(すなわち、ELANE、MPO、LTF、CTSG、LCN2、およびMMP8)を発現しているが、正規の好中球マーカー(すなわち、FCGR3BおよびCXCR2)を発現しない末梢免疫細胞である。
哺乳類におけるRNAiの重要性を示す証拠については、他で広くレビューされている[66GantierMP. 哺乳類細胞における二本鎖RNAの処理:直接的な抗ウイルス的役割?
J Interferon Cytokine Res.2014;34(6):469-477.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],79MaillardPV,VeenAG,PoirierEZ, et al.
ウイルスをスライスしてダイシングする:哺乳類における抗ウイルスRNA干渉.Embo J.2019;38(8):1-13.[Crossref],[Web of Science ®],[Google Scholar]].
哺乳類における抗ウイルスRNAiの存在を取捨選択することも確認することも、現在のところ不可能である。しかし、SARS-CoV-2 Nタンパク質、SARS-CoV Nおよび7aタンパク質が潜在的なVSRとして同定されたことにより、SARS-CoV-2感染の病因における潜在的役割についてさらなる調査が必要である。SARS-CoV-2の病原体におけるRNAiの潜在的重要性については、Karjee S.,et al.によってより包括的に概観されている。
[80KarjeeS,MukherjeeSK. RNAiサプレッサー:SARS-CoVの隠れた武器。J Biosci.2020;45(1):1-6.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
AEC、1型および2型肺細胞、肺胞マクロファージなど、疾患の初期にSARS-CoV-2に感染することが知られている細胞における抗ウイルスRNAiに取り組む研究は、大きな関連性を持つ可能性がある。
最近、重症のCOVID-19を発症して死亡した患者の気管を免疫染色したところ、SARS-CoV-2とリンパ球の共局在化が認められ、SARS-CoV-2は直接メカニズムによってリンパ球を破壊することができることが判明した。図2に示したように、リンパ球はAGO4をあまり発現していないのが特徴である。
SARS-CoV-2感染におけるRNAiの役割をより深く理解することは、温熱療法が植物の抗ウイルスRNAiを強化することが知られているので、COVID-19における熱ベースの治療法の開発に向けて重要であろう。
*
高温にさらされた植物細胞は、主にRNA サイレンシング機構の強化により、ssRNA ウイルス感染に対してより抵抗性が高いことが観察されている
[81ChellappanP,VanitharaniR,OgbeF, et al.植物におけるジェミニウイルス誘発 RNA サイレンシングに対する温度の影響。Plant Physiol.2005;138(4):1828-1841.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],82ZhangX,ZhangX,SinghJ, et al.
カブクリンクルウイルスに感染したシロイヌナズナの温度依存的な生存は、DCL2、AGO2、HEN1を必要とするRNAサイレンシングに基づく防御に依存する。
J Virol.2012;86(12):6847-6854.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]に記載されている。
Apple stem grooving virus (ssRNA + virus)に感染した植物の試験管内試験培養において、温熱療法はRNAサイレンシング経路の遺伝子の発現を上昇させ、vsiRNAの生成を増加させ、ウイルスRNAの蓄積を阻害することが示された
[83LiuJ,ZhangXJ,YangYK, et al.Apple stem grooving virusに感染した試験管内試験培養のPyrus pyrifoliaのシュートチップにおける高温処理に対するウイルス由来の小干渉RNAの特性評価。Virol J.2016;13(1):1-11.[Crossref],[PubMed],[Google Scholar]]。
温熱療法の抗ウイルス活性の他の提案されたメカニズムは、ウイルス複製の阻害、ウイルスRNAの分解、ウイルス感染に対する抵抗性に関与する主要遺伝子のマイクロRNA(miRNA)媒介制御である
[84WangMR、CuiZH、LiJW et al.植物ウイルス撲滅のための試験管内温熱療法に基づく方法 Plant Methods.2018;14(1):1-18.[Crossref],[PubMed],[Google Scholar]]。
ヒトにおける温熱療法
温熱療法とは、熱の移動により身体の一部または全身の温度分布が一定時間変化し、宿主にダメージを与えることなく、所望の生理的効果や病原体・異常細胞の排除を促進させるものと定義することができる。ここでは、温度の低下(=凍結療法)ではなく、穏やかな温度上昇の効果を指している。この意味で、温熱療法は温和なハイパーサーミア(39~42℃)と互換性がある。ハイパーサーミアではなく温熱療法という用語を用いたのは、植物におけるウイルス病の治療に用いられる用語との一貫性のため、およびがん治療におけるハイパーサーミア(43℃以上)の望ましい効果である細胞へのダメージを回避することの重要性を強調するためである。
*
ハイパーサーミアは、増殖性病変(すなわち、がんおよびその他の非がん性腫瘍)の治療における使用について広く研究されており、習慣的に望ましい熱量-43℃での累積相当分(CEM43)または熱切除(>45℃)[85DewhirstMW、VujaskovicZ、JonesE et al.温熱療法の生物学的根拠を再設定する。
Int J Hyperthermia.2005;21(8):779-790.[Taylor & Francis Online],[Web of Science ®],[Google Scholar]] –
これらの細胞を殺すためには、通常、そうでなければ正常組織に大きな損傷を引き起こすのに十分な高さである
[86YarmolenkoPS,MoonEJ,LandonC, et al.]。正常組織への熱損傷の閾値:最新情報。Int J Hyperthermia.2011;27(4):320-343.[Taylor & Francis Online],[Web of Science ®],[Google Scholar]]。
免疫反応に有利な熱効果は、発熱域の温度(38-41℃)で起こる[87ChenQ,FisherDT,ClancyKA, et al.
発熱域の熱ストレスは、インターロイキン6のトランスシグナル機構を介して、高内皮静脈を通過するリンパ球のトラフィッキングを促進する。
Nat Immunol.2006;7(12):1299-1308.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],88TulapurkarME,AsiegbuBR,SinghIS, et al.
発熱域での高熱は、ヒト肺上皮 A549 細胞において、曝露温度に比例して HSP72の発現を誘導するが、HSF-1 DNA 結合活性には比例しない。
Cell Stress Chaperones.2009;14(5):499-508.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]],
一方、がん細胞のストレス応答と免疫原性の増強はヒートショック温度(41-43 ℃)で起こる。
非生理的温度(≥43 °C)では細胞毒性作用の増大が起こる[89鳥越俊太郎、田村優子、佐藤直樹熱ショックタンパク質と免疫:免疫調節のためのハイパーサーミアの応用.Int J Hyperthermia.2009;25(8):610-616.[Taylor & Francis Online],[Web of Science ®],[Google Scholar],90ZhangHG,MehtaK,CohenP, et al.免疫制御におけるハイパーサーミア:温度の話。
Cancer Lett.2008;271(2):191-204.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
*
局所温熱療法は、リウマチ性疾患の治療に用いられていた。温熱療法は、関節リウマチにおける疾患活動性の客観的指標(関節の腫れ、痛み、薬の服用、可動域、握力、手の機能)を変更しないが、その安全性プロファイル(患者に害を与えない)により、補助手段として推奨されている
[91WelchV,BrosseauL,CasimiroL, et al.関節リウマチの治療のための温熱療法。Cochrane Database Syst Rev.2002;2002(2):CD002826.[Google Scholar]]。
変形性関節症における凍結療法は、患者にとって有益な治療法としてほとんど研究されているが、熱による温熱療法は、行われた小規模な臨床研究によって支持されていない。変形性関節症における温熱療法の臨床研究は少ない
[92BrosseauL、YongeK、WelchV et al.変形性関節症の治療に対する温熱療法。Cochrane Database Syst Rev.2003;2003(4):CD004522.[Google Scholar]]。
局所温熱療法は、より高い温度が影響を受けた関節におけるI型IFN応答を強化するので、ウイルス性関節炎の患者にとって特に有用であり得る
[93ProwNA、TangB、GardnerJ et al.低い温度は、I 型インターフェロン活性を低下させ、アルファウイルス関節炎を促進する。PLoS Pathog.2017;13(12):e1006788-25.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]];
この仮説に取り組むには、ヒトでの臨床研究が必要である。局所温熱療法は、I型およびII型IFNとIFN依存性シグナル伝達経路を増加させる能力があるため、ウイルス性疾患の治療において重要な役割を持つ可能性がある
[94ZhuL. l,GaoXH,QiR, et al.局所温熱療法は、尖圭コンジローマにおいて内因性インターフェロン依存性経路による抗ウイルス活性を誘発することができた。
Antiviral Res.2010;88(2):187-192.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
COVID-19における温熱療法
COVID-19の疾患進行の決定要因は、まだ完全には明らかにされていない。しかし、年齢、併存疾患、男性、貧困(貧困の相関関係)、および特定の民族グループが増加する個人は、致命的な転帰をとるリスクが高いことが分かっている
[95WilliamsonEJ,WalkerAJ,BhaskaranK, et al.OpenSAFELYを用いたCOVID-19関連の死亡に関連する因子。Nature.2020;584(7821):430-436.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]の通り。
生物学的な観点から、より大きなウイルス負荷および差動宿主反応(I型およびIII型IFNの低下、炎症性サイトカインおよびケモカインの産生の増加)は、重症および重症COVID-19の特徴である
[22Blanco-Melo D,Nilsson-Payant BE,LiuWC,et al.SARS-CoV-2に対する宿主応答の不均衡が、COVID-19の発症を促す。Cell.2020;181(5):1036-1045.e9.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],23HadjadjJ、YatimN、BarnabeiL et al. COVID-19重症患者におけるI型インターフェロン活性および炎症反応の障害。Science.2020;369(6504):718-724.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],96WilkAJ,RustagiA,ZhaoNQ, et al.Nat Med.2020;26(7):1070-1076.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
*
臨床パラメータにより、COVID-19の患者は以下のように分類される。無症状または前症状(症状がない)、軽度(病気の症状、肺炎の有無、評価時に酸素補給の必要がない)、中等度(肺炎、息切れ、進行の危険因子、評価時に酸素補給の必要がない)、重度(肺の50%以上に影響を及ぼす肺炎、呼吸の加速、または酸素補給を必要とするその他の臨床的証拠)、および重症(急性呼吸器疾患、評価時に酸素補給の必要がない)。
重症(肺の50%以上に影響を及ぼす肺炎、呼吸促進、または酸素補給を必要とするその他の臨床的証拠)、および重症(急性呼吸困難症候群(ARDS)、急性肺損傷(ALI)、敗血症性ショック、または多臓器不全)
[97WuZ,McGooganJM. Characteristics of and important lessons from the Coronavirus disease 2019 (COVID-19) outbreak in China: Summary of a report of 72314 cases from the Chinese Center for Disease Control and Prevention(中国疾病予防センターからの72314例の報告の概要).JAMA.2020;323(13):1239.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],98GandhiRT,LynchJB,del RioC. Mild or moderate COVID-19.中国でのコロナウイルス感染症の発生とその教訓。N Engl J Med.2020;383(18):1757-1766.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]。
COVID-19のすべての患者がこれらの各ステージを進行するわけではなく、個々の患者の臨床症状や経過は非常に多様である。図3は、これらのステージを、症状発現から目的のアウトカム発現までの日数の中央値を用いて、疾患進行の連続体として表したものであり、この概念化は介入研究のデザインに有用であると考えられる。
*
図3 症候性COVID-19a患者の進行順序におけるイベント
死亡または回復の2つの結果のいずれかを伴う重症COVID-19に進行する平均的な患者の進行順序における、症状発現(0日目)から関心のある事象の最初の出現(ボックス)までの日数の中央値(横線)。
潜伏期間(感染から症状発現までの時間、破線)の中央値は4日[112GuanW,NiZ,HuY, et al.中国における新型コロナウイルス感染症の臨床的特徴。N Engl J Med.2020;382(18):1708-1720.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]], これは前症状期間(-4日目から0日目、横線矢印)に相当する。
各臨床ステージの仮想的な進行順序と発症までのおおよその中央値を赤いグラデーションのついた水平矢印で表した:軽症(発症:0日目)、中等症(発症:5日目)、重症(発症:6日目)、重症、回復期(発症:16日目)aすべての患者がこれらの臨床ステージを進行または通過するわけではない。
また、症状の種類や医学的評価時の発症からの日数は、記述的な臨床研究において四分位範囲が広いことが示すように、非常に多様である。個々の症状発現、肺炎、初診、入院、退院までの日数の中央値は、COVID-19が軽度または重度に分類された患者のデータである
[113GaythorpeK,ImaiN,Cuomo-DannenburgG, et al.COVID-19の症状進行 [インターネット]。Imperial College London.London;2020[2020 Mar 11; vols 2020-03-11]。Available from:spiral.imperial.ac.uk/handle/10044/1/77344.[Google Scholar]]。
機械換気、集中治療室(ICU)入室、多臓器不全、血栓塞栓イベント、死亡までの日数の中央値は、重症COVID-19に進行した患者のものである[114GuptaS、HayekSS、WangW et al.米国におけるコロナウイルス感染症2019の重症患者の死亡に関連する因子。
JAMA Intern Med.2020;180(11):1436-1411.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
抗ウイルス作用のメカニズムを持つ治療薬は、病気の初期に投与された場合に最も大きな影響を与えるだろうし、合併症(すなわち、多臓器不全や血栓塞栓イベント)を予防するための介入は、あまり早くない段階でも有効である可能性がある
[99CaoW,LiT. COVID-19: towards understanding of pathogenesis.Cell Res.2020;30(5):367-369.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]]に記載されている。
したがって、早期介入は、ウイルスへの曝露前(予防的o予防的)、既知または潜在的なウイルスへの曝露後(前症状期)、または症状発現後すぐに-できれば症状発現から5日未満の軽度から中程度のCOVID-19の患者で-開始すべきである
[100LipsitchM,PerlmanS,WaldorMK. 軽症の進行を防ぐためのCOVID-19 治療法のテスト。Lancet Infect Dis.2020;20(12):1367.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
ほとんどの患者は、早い段階(症状発現後約2日)で初診を受けるが、病気の拡大を防ぐことを第一に考え、対症療法を処方して帰宅させることが多いようだ。臨床研究の大半は、重症から重症のCOVID-19の入院患者に対する潜在的な介入の研究に集中しており、最も恩恵を受ける可能性のある患者にそのような介入を行う絶好の機会を失っている可能性がある。
*
温熱療法の潜在的な抗ウイルス効果は、COVID-19の初期段階(軽症から中等症)の患者にとって有益であると考えられる。さらに、体温が36 °C未満または39.5 °C以上で入院することは死亡率の上昇と関連しているため、重症から重症のCOVID-19患者に対して温熱療法を実施することにはリスクがある
[101TharakanS,NomotoK,MiyashitaS, et al.COVID-19 患者における体温と死亡率の相関。Crit Care.2020;24(1):298.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]],
体温の厳格な管理は、重症患者において特に重要である[102WalterEJ,Hanna-JummaS,CarrarettoM, et al.発熱の病態生理学的基礎と結果 Crit Care.2016;20(1):1-10.[Crossref],[PubMed],[Google Scholar]],
そして発熱域の高熱は、細菌性肺炎の動物モデルにおいて肺損傷と死亡率を増加させることが分かっている[103HasdayJD、ShahN、MackowiakPA et al. 発
熱、高体温、および肺:それはすべて文脈とタイミングに関するものである。
Trans Am Clin Climatol Assoc.2011;122:34-47。
温熱療法の早期のタイミングは、潜在的なリスクを回避しながら、望ましい免疫効果のバランスをとるための鍵となり得る
[104SinghIS,HasdayJD. 発熱、高体温、熱ショック反応。Int J Hyperthermia.2013;29(5):423-435.[Taylor & Francis Online],[Web of Science ®],[Google Scholar]]。
さらに、COVID-19患者における温熱療法の利点を最大化する最適な時間であるという仮説があるため、有効な軽度の温熱療法の短時間(1〜2時間)の適度なサイクル(8〜12時間ごと)は、免疫系に望ましい効果をもたらし、潜在的な有害事象を抑えるのに十分かもしれない
[105GuihurA,RebeaudME,FauvetB, et al.COVID-19患者の呼吸器系を保護する潜在的メカニズムとしての中等度発熱サイクル。Front Med.2020;7(September):1-8.[Google Scholar]]。
しかし、この仮説はまだ臨床試験で検証されていない。
COVID-19における温熱療法+放射線療法
先に述べたように、温熱療法と放射線療法は、その治療効果を達成するメカニズムの多くが類似しているか、または互いに増強し合うため、SARS-CoV-2感染に対する相乗効果を発揮する可能性がある。温熱療法は、放射線療法や化学療法と並んで、がんの補助療法として主に研究されている
[106DunneM,RegenoldM,AllenC. Hyperthermia can alter tumor physiology and improve chemo-therapy efficacy and radio-therapy efficacy.Adv Drug Deliv Rev.2020;163-164:98-124.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],107van LeeuwenCM、CrezeeJ、OeiAL et al.放射線治療とハイパーサーミアの時間間隔が計画等価放射線量に及ぼす影響。Int J Hyperthermia.2018;34(7):901-909.[Taylor & Francis Online],[Web of Science ®],[Google Scholar]]。
他の著者は、COVID-19における放射線治療の根拠を徹底的に検証している
[108LiJJ.放射線治療によるコロナウイルス誘発性急性呼吸窮迫症候群の緩和。iScience.2020;23(6):101215.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],109KooshaF,Pourbagheri-SigaroodiA,BakhshandehM, et al.COVID-19誘発性肺疾患に対する低線量放射線治療(LD-RT):検討する価値のあるアプローチ。Int J Radiat Biol.2020;0(0):1-24.[Taylor & Francis Online],[Google Scholar]].
予備的な報告では、低線量放射線療法はCOVID-19の患者に対して安全であり、有用な治療手段となり得ることが判明している
[110HessCB、BuchwaldZS、StokesW et al.COVID-19肺炎に対する低線量全肺照射:登録済み臨床試験の計画的7日目中間解析。Cancer.2020;126(23):5109-5113.[Crossref],[PubMed],[Web of Science ®],[Google Scholar],111AmeriA、RahnamaN、BozorgmehrR et al.COVID-19肺炎に対する低線量全肺照射。ショートコースの結果 Int J Radiation Oncol Biol Phys.2020;108(5):1134-1139.[Crossref],[PubMed],[Web of Science ®],[Google Scholar]].
軽度の温熱療法と低線量放射線治療の併用は、COVID-19の患者にとって有益な治療法となりうる可能性がある。
結論と展望
異なる種に感染するある種のウイルスは熱に弱く、感染した宿主は温度の上昇によってウイルスのクリアランスを促進することができるという証拠がある。SARS-CoV-2は特に熱に弱いと考えられるが、どの程度かはまだ分かっていない。
特定の細胞の温度を上げることで、ウイルスのクリアランスが促進され、病気の進行を遅らせることができるかもしれない。しかし、この仮説は前臨床試験や臨床試験でまだ検討されていない。これらの問題に取り組むことで、COVID-19の疾病メカニズムに関する知識が広がり、ウイルス性疾患の予防や治療のための熱を用いた治療薬の開発が可能になる可能性がある。もし、温熱療法がウイルス性呼吸器疾患への介入に成功すれば、現在のCOVID-19の流行の影響を軽減する方法を見つけただけでなく、将来の新興感染症の流行に対応できる重要なツールを見つけたことになる。
*
残念ながら、この原稿を書いた時点まで、異なる生理的温度(33℃と37℃)でのSARS-CoV-2の複製ダイナミクスを比較した研究は1つしか発表されていない。したがって、今後の研究では、SARS-CoV-2の複製および感染性が、より高い生理的温度および耐熱温度(すなわち、33℃および37〜42℃の温度で、1℃の勾配をつけて感染細胞をインキュベートすること)で有効に低下するかどうか、ならびに感染細胞においてこれらの温度で促進または抑制される特定のプロセス(遺伝子発現、I型およびIII型IFN生産、炎症性サイトカイン生産、RNA干渉、ウイルスタンパク質合成、ウイルスRNA複製)について検討できる可能性がある。
動物モデル、ひいてはヒトの患者に適用すべき適切な温度の用量と頻度を確立するためには、熱への曝露時間と有意な効果を観察するための曝露頻度が重要であろう。前臨床モデルでのこれらの疑問に対する回答には時間がかかるかもしれないが、温熱療法は、将来起こりうる新型ウイルスの発生を含め、多様なウイルス性疾患の治療に有効である可能性があるため、これらの疑問に答えることは重要なことだろう。
*
前臨床試験で明確な答えが得られず、長い時間がかかるかもしれないが、温熱療法は、リスクが少なく、安価な機器を使用することで試みられる可能性がある。温熱パッドは安全で安価であることが特徴である。しかし、皮膚とパッドの接触界面で43℃までの温度に達することができても、目的の細胞への熱の浸透は低いか無視できる程度である可能性がある。
皮膚細胞や血管系の局所温度を上昇させることで、有意な全身的効果が得られるかどうかは、今後調査されるべきであろう。また、磁気共鳴分光法(MRS)やイメージング(MRI)などの手法により、生体内の組織への熱浸透の特性をよりよく把握し、局所温熱療法により深部臓器の温度を大きく変化させることが可能かどうかを評価することができる。
*
局所温熱療法を行うヒートパッドを用いた臨床研究は、最近ウイルスに暴露された患者や、軽い症状で病気の初期に診察を受ける患者を対象に試みることができる。このような研究では、主な成果として疾患の進行を評価することができる。温熱療法の最適な方法を導く明確な前臨床試験がない場合、確立された用量と頻度は、熱への曝露の多さと患者の忍容性および介入への愛着のバランスをとるべきである。蒸し器は、リスクが低く低コストな他の機器であり、これらの考慮事項の下で研究することも可能である。
*
COVID-19の重症患者における温熱療法は、厳密な臨床監視のもと、施設の倫理・安全委員会の評価を経て初めて実施することができる。このことは、潜在的なリスクは少ないとはいえ、軽度から中等度の患者における評価の可能性にも当てはまる。
しかし、パンデミックの影響を強く受けた地域で、病院の稼働率が高い場合、これらの患者の入院は不可能かもしれない。このような状況下でも、病気の進行を防ぐための外来での臨床研究は可能であり、より臨床的な関連性と適用性の高いエビデンスを提供できるかもしれない。
最後に、温熱療法は一般的に重症患者には試みるべきではないが、体外式全身温熱療法は、他の治療法が存在しない限り、COVID-19重症患者を対象にいずれ慎重に検討される可能性がある。