コンテンツ
Specialized pro-resolving mediator SPM
関連記事

SPM・レゾルビン
link.springer.com/article/10.1007%2Fs10555-020-09889-4
レゾルビンなどのSPMは、マクロファージが媒介する断片のクリアランスを刺激し、プロ炎症性サイトカインの産生に対抗する。SPMおよびその脂質前駆体は、免疫抑制性ではなく、インフルエンザの設定でナノグラム用量で抗ウイルス活性を示す。
SPMはまた、抗ウイルスB細胞抗体およびリンパ球活性を促進し、COVID-19の治療におけるそれらの潜在的な使用を強調している。可溶性エポキシドヒドロラーゼ(sEH)阻害剤は、アラキドン酸由来のエポキシエコスサトリエン酸(EET)を安定化させ、このEETはまた、プロレゾルビンメディエーターの産生を促進し、抗炎症プロセスを活性化し、サイトカインの嵐を防ぐことによって炎症のレゾルビンを刺激する。レゾルビンおよびEETの両方はまた、病的血栓症を減衰させ、COVID-19感染の重要な病理として浮上している血栓除去を促進する。
したがって、SPMおよびsEH阻害剤の両方は、COVID-19における炎症の解消を促進し、それにより、急性呼吸窮迫症候群(ARDS)および頑健なウイルス誘発性炎症に関連する他の生命を脅かす合併症を減少させる可能性がある。
COVID-19患者では禁忌であるかもしれないいくつかの抗炎症剤とは対照的に、SPMおよびsEHIは、有意に低用量で作用し、免疫抑制性ではない。
さらに、NSAIDsやCOX-2阻害薬のような従来の抗炎症剤は、エイコサノイドストームを制限する一方で、それらが分解能メディエーターを産生するエイコサノイド経路を無差別に阻害し、それによって能動的な分解能を妨げるため、「分解能毒性」となる可能性がある。
分解メディエーターの産生を阻害することは、COVID-19誘導性組織傷害および感染症の進行を促進する可能性がある。多くの炎症性疾患モデルで実証されているように、内因性の炎症収束機構を選択的に促進することは、従来の抗炎症剤と比較して、より効果的に炎症性滲出物を除去し、組織の恒常性への復帰を促進することになる。
炎症を炎症収束するメディエーターでCOVID-19を管理? 視点と可能性
www.sciencedirect.com/science/article/pii/S0306987720307611
SPMの肺疾患への役割
SPMは積極的に感染性炎症の炎症収束を刺激し、動物疾患モデルでは臓器保護効果があるため、特殊なプロ炎症収束メディエーター(SPM)は、この肺疾患の管理に新たな役割を果たす可能性がある。
SPMは、アラキドン酸、エイコサペンタエン酸、n-3ドコサペンタエン酸、ドコサヘキサエン酸(DHA)を含む必須脂肪酸の立体選択的な酵素変換を介して形成される自然免疫の細胞によって生成される。SPMは、リポキシン、レゾルビン、プロテイン、およびマルシンの4つのファミリーにグループ化されている。
これらの内因性メディエーターは、宿主の炎症性サイトカインやケモカインの産生を抑制し、好中球の輸送を制限し、マクロファージのアポトーシス細胞の貪食、細菌の殺傷、Gタンパク質共役受容体(GPCR)を介した細胞ゴミの刺激など、炎症反応メカニズムの炎症収束を積極的に強化するために宿主の応答を調節する基本的な生理的特性を共有している。
時間的変動
マウスを用いた実験では、プロ炎症性(プロスタグランジンやロイコトリエン)やSPMを時間的に同定して、マウス腹膜大腸菌感染症の滲出白血球トラフィッキングとメディエーターメタボロリピドミクスの量と種類を決定している。
例えば、特定のSPMは、感染の間に時間的に異なる制御を受けており、それらは抗炎症性であり、封じ込めを強化し、細菌のクリアランスのための抗生物質の要件を低下させることが示されている。
これらのメディエーターの解毒促進作用は、肺炎におけるそれらの役割によって例証される。レゾルビン、プロテイン、リポキシンはそれぞれ、アレルギー性気道炎症や細菌性およびウイルス性の感染症のマウスモデルにおいて、炎症収束を促進する役割を持っている。
ARDS
最近の結果は、SPM が ARDS における AFC を制御して肺機能を保護していることを示している。肺へのダメージは免疫系の活性化につながり、これはいくつかの炎症性タンパク質や好中球の肺胞空間への流入の放出につながるだけでなく、リポキシン、レゾルビン、プロテキン、およびマルシンなどのプロ分解能脂質メディエーターの局所的な生合成にもつながる。
Cillonizらは、マウスモデルを用いてインフルエンザAウイルスのウイルス性を調べ、再構築された1918年H1N1ウイルスと鳥類H5N1ウイルス(ベトナム/1203)との感染に対する宿主の転写応答を比較した。
その結果、肺外への播種は、リポキシンの白血球勧誘に対する解毒促進作用と炎症性サイトカイン誘導に対するカウンターレギュレーションに関与する遺伝子のダウンレギュレーションと関連しており、リポキシンの解毒促進作用の喪失はインフルエンザAウイルスの病原性の増大と関連している可能性があることが明らかになった。
これらの知見は、この感染症におけるSPMの保護的役割を示唆しており、おそらくウイルス感染時にアップレギュレーションされるプロ炎症性サイトカインの減少およびカウンターレギュレーションに関連していると考えられる。
治療の観点からは、これらのプロレゾルビンメディエーターは免疫抑制剤ではないため、感染性炎症、または他の全身性炎症状態の治療に使用するためのステロイドよりも実質的に有利であることに注意することが重要である。
アスピリン
アセチルサリチル酸をトリガーとするリポキシンおよびレゾルビンのエピマーは、これらのプロレゾリューション作用を共有し、同じ細胞内経路で作用する。
この作用はアスピリンに特有のものであり、これらのメディエーターの内因性生合成をトリガーとしない非ステロイド性抗炎症薬とは共有されていない。
プロテキンD1
SPMであるプロテキンD1(別名ニューロプロテキンD1)がRNA輸出機械を介してインフルエンザウイルスの複製を著しく減衰させることを報告した。このSPMの産生は重症インフルエンザ時に減少し、PD1はH5N1ウイルスの病原性と逆相関した。重要なことに,このSPMを用いた治療は,既知の抗ウイルス薬では死を防ぐことができない条件下でも,マウスの重症インフルエンザの生存率と病理学的性質の両方を改善した。
肺ウイルス感染症を治療するためのレゾルビンベースの治療法の活用 COVID-19に未来は何を提供できるか?
要約
炎症は一般的に感染症の文脈では保護反応であると考えられている。しかし、炎症反応の変化は、感染者における疾患の一因となる可能性がある。炎症の収束を促進する複数のメディエーターが記述されている。
全体的に、SPMは、炎症反応を減少させ、感染に対処する宿主の正常またはそれ以上の能力を提供する傾向がある。肺では、SPM分子またはそれらの増加を促進する戦略は、炎症および肺損傷を減少させ、細菌またはウイルスの負担の制御を容易にする傾向があるようである。
本研究では,酵素的・非酵素的に強力な炎症収束作用を有するメディエーター(Specialized pro-resolving mediator; SPM)の抗炎症作用,プロレゾリューション作用,抗血栓作用,抗微生物作用が,COVID-19患者の末期治療に有用である可能性を示唆している。
本文
一般的な考察 炎症は、一般的に感染症の文脈では保護反応であると考えられている(Tavares et al 2017)。実際、炎症反応は、微生物を封じ込め、適応免疫応答に適切な共刺激を提供するために必要である。これらの役割の明確な例は、通常、播種性細菌感染症で死亡する好中球減少症の個体に見られる(Gustinetti & Mikulska, 2016)。高齢者や癌治療を受けている人など、炎症反応を起こすことができない個体は、ワクチンに反応しないことが多い。
しかしながら、改変された(減少した、誤った、過剰な、全身的な、または改変された)炎症性応答が、感染した個体における疾患に寄与し得ることは明らかである(Tavares et al 2016)。上述したように、炎症性応答の不在または減少は、微生物の拡散および死につながる可能性がある。
細菌性敗血症は、誤配置(感染部位ではなく全身性)、過剰(循環中の大量のメディエーター)、および変質(重症患者で見られるメディエーターは、重症患者で見られるメディエーターとは異なる可能性がある)炎症性応答が起こる症候群の好ましい例である。
我々は以前に、この変化した炎症反応を飼いならすことが、重症感染症患者において有益である可能性があることを論じてきた(Costa, et al., 2013; Garcia et al., 2010)。
このレビューでは、重度の感染症のための補助的治療(抗菌薬への)を提供する手段として、炎症収束性メディエーターを利用することの可能性を主張する。
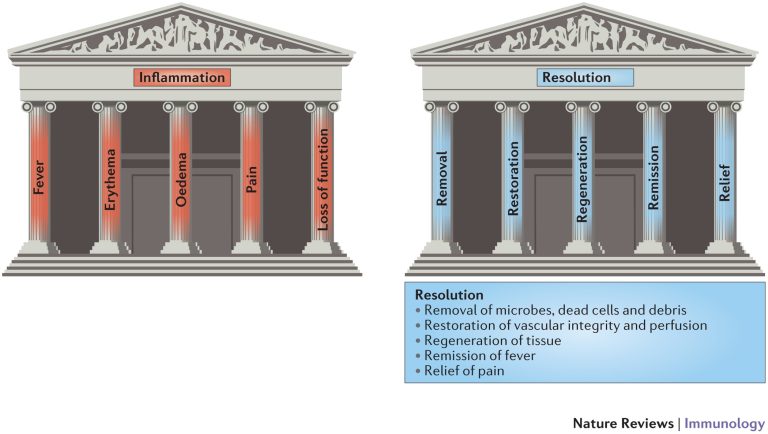
炎症収束性は、簡単に言えば、組織内の顆粒球蓄積のピークから、リクルートされた炎症性細胞の完全なクリアランスまでの期間と定義される(Sugimoto, et al. 基本的には、炎症収束性は、炎症部位における顆粒球の蓄積を逆戻りさせ、組織内の細胞および分子応答を再プログラムし、組織の再生および修復にさらに影響を与えることに寄与する。
組織は、炎症前の状態に逆戻りしない傾向がある。以前に考えられていたように、細胞の組成と表現型の観点から、しかし、その後の炎症反応の重症度に影響を与える「適応された恒常性」の状態を達成する(Feehan & Gilroy, 2019)。炎症収束性は、いわゆるメディエーターによって媒介される。
これらは、非常に多様な化学的性質を有する分子であり、それらの受容体に作用することにより、炎症収束性および組織の適応された恒常性につながるイベントのカスケードを誘導する(Sugimoto et al., 2019)(図1)。
炎症を治療するために消炎を使用する可能性は、関節リウマチのような複雑でしばしば慢性的な炎症性疾患と戦うための新しい戦略として、消炎を修正し、「消炎を軌道に戻す」ことに基づく「消炎薬理学」という概念につながっている(Perretti et al 2015)。細菌、ウイルスおよび真菌感染の文脈で炎症収束性メディエーターの役割および効果を評価する研究がいくつか行われてきた。全体的に、ほとんどの研究は、消炎が、感染中に炎症反応を減少させ、感染に対処するための宿主の正常またはそれ以上の能力を提供する傾向があることを示唆している。
例えば、原虫寄生虫Leishmania brasiliensisへの感染の文脈では、プロ分解分子AnnexinA1(AnxA1)は、感染中に積極的に発現し、その不在は、より強い炎症性応答および病変を炎症収束する遅延能力と関連している(Oliveira et al 2017)。
同様に、AnxA1、LXA4およびRvD1の受容体であるFPR2/ALXは、受容体の非存在下では病変の重症度が悪化した敗血症において非冗長的な役割を有することが見出された(Gobbetti et al 2014)。
肺感染時のプロ炎症収束ベース戦略の効果
以下、肺における炎症および感染をシミュレートした実験モデルの文脈で、炎症のメディエーターの効果をレビューする。
肺感染症中の炎症収束性に基づく戦略の効果 いくつかのプロ炎症収束分子は、喘息、線維化および感染症を含む肺疾患をシミュレートしたモデルにおいて、炎症および傷害を効果的に減少させることが示されている。
喘息の文脈において、過酸化水素(Reis et al 2015)、アンジオテンシン-(1-7)(Magalhaes et al 2018)、AnxA1(Bandeira-Melo et al 2005)およびリポキシンA4(Levy et al 2007)の局所的または全身的投与は、肺における好酸球の浸潤を減少させ、そして一般的に、気道機能の変化を減少させることが示されている。
同様に、SPMは、ブレオマイシン誘発性肺線維症(Damazo et al 2011;Rago et al 2019)および珪肺症(Trentin et al 2015)における炎症、傷害および線維化を減少させる。いくつかの研究では、肺における細菌感染の文脈において、SPMの投与またはそれらの遺伝的欠失の影響が検討されている。
例えば、PDE4阻害剤ロリプラムの投与は、肺炎球菌肺炎モデルにおいて、肺および気道への好中球のリクルートを減少させ、肺傷害を減少させた。また、気道内のサイトカインレベルの低下も認められたが、細菌負荷の低下は認められなかった(Tavares et al 2016)。
注目すべきは、ロリプラムとセフトリアキソンの併用投与は、炎症、肺損傷、細菌負担、貪食を減少させ、肺炎球菌肺炎の生存率を改善したことである。ロリプラムの効果は、AnxA1の局所レベルの上昇によるものと思われた(Tavares et al 2016)。
これは、AnxA1がサイクリックAMP上昇剤およびサイクリックAMP模倣薬のプロ分解特性を媒介したことを示唆する我々の研究と一致している(Lima et al 2017)。
興味深いことに、AnxA1およびFpr2KOマウスは、肺炎球菌感染性肺炎に対して非常に感受性が高く、制御不能な炎症、細菌播種の増加、肺バリアの完全性の喪失、および肺機能障害を表示した。さらに、AnxA1ペプチドミメティックアネキシン1-(2-26)での治療は、マクロファージ貪食を増加させることにより、気道の炎症、肺障害、および細菌負荷を減少させた(Machado et al 2020)。
同様に、FFA2受容体(短鎖脂肪酸-SCFAの受容体)の欠失は、細菌の制御されていない増殖と炎症反応の増加の両方に関連して、クレブシエラ肺炎菌感染症に対する感受性の増加をもたらした。GPR43リガンド、アセテートを用いた治療は、細菌肺の間に保護された。
AT-RvD1による早期治療は、生体内試験(in vivo)で大腸菌および緑膿菌のクリアランスを強化した。これは、細菌粒子の貪食能の強化、および生体内試験(in vivo)での肺炎時の好中球クリアランスの加速と関連していた(Abdulnour et al 2016)。したがって、プロ分解分子またはそれらの増加を促進する戦略(サイクリックAMP上昇剤など)による治療は、炎症および肺損傷を減少させ、細菌感染後の微生物制御を容易にする傾向があるように思われる。
このことがすべてのプロレゾリューション分子に有効かどうか、その比較効果、1つ以上の薬剤を使用した場合に相乗効果があるかどうかは、まだ明らかにされていない。また、肺のウイルス感染症、特にインフルエンザの感染症との関連性を評価した研究もいくつかある。
エレガントな研究では、森田ら(2013)は、脂質メディエーターであるプロテインD1(PD1)が重症インフルエンザ中に抑制され、PD1レベルがH5N1ウイルスの病原性と逆相関していることを発見した(Morita et al. PD1治療はマウスの重症インフルエンザの生存率と肺障害を改善し、RNA輸出機械を介したインフルエンザウイルスの複製を著しく減衰させた。
これは、H5N1(VN/1203)の株がH1N1(1918パンデミックウイルス)よりもマウスにおいてより病原性が高いことを示した以前の知見と一致しており、その理由の一部は、リポキシン媒介の抗炎症応答の阻害とともに、プロ炎症性分子の構成要素の早期および持続的なアップレギュレーションによるものである(Cilloniz et al 2010)。
インフルエンザAウイルス(IAV)H1N1(株PR8)は、AnxA1/FPR2軸の使用により、その複製および伝播を増強したことが示されている(Ampomah et al 2018;Arora et al 2016)。実際、後者の研究は、IAV感染中のANXA1およびFPR2発現の調節が、その感染性を増強するためのウイルス戦略である可能性があることを明確に示している。
しかしながら、IAV H1N1感染(株PR8)に先立つマウスへのAnxA1の投与は、IAVによって誘導される肺傷害を有意に減衰させ、有意に改善された生存率、呼吸器内のウイルス複製の障害を伴った。
AnxA1前処理動物における肺胞マクロファージの拡大と関連して、呼吸器管、および重症度の低い肺損傷が減少した(Schloer et al 2019)。少なくとも1つの研究は、インフルエンザ以外の肺ウイルス感染症の文脈でのプロレゾナンス分子の役割を評価している。
5-リポキシゲナーゼ(5-LOX)欠損マウスを呼吸器呼吸器同期ウイルス(RSV)に感染させると、肺の病理学が増強された。リポキシンA4およびレゾルビンE1の産生を介して、おそらく5-LOX経路は、交互に活性化されたマクロファージの誘導および気管支炎の誘導に必要であるように思われた(Shirey et al 2014)。
興味深いことに、特化されたプロレゾルビン脂質メディエーター(SPM)17-HDHAは、マウスの生きたH1N1インフルエンザ感染に対して、体液性応答を増加させ、より大きな保護効果を提供することが見出され、それゆえ、消炎シグナルと適応免疫系との間の生物学的リンクを提供する(Ramon et al 2014)。
実際、LXB4は、潜在的なワクチンアジュバントとして機能するために、COX-2を介してメモリーB細胞の活性化を高めることが示された(Kim et al., 2018)。以前のインフルエンザ感染は、S. pneumoniaeによって引き起こされるような後続の肺細菌感染へのリスクを増加させることが知られている。実際、インフルエンザ後の細菌感染は、毎年のインフルエンザ流行後の死亡者数のかなりの数を占めているようである。
インフルエンザH3N2(株A/HKx31)およびS. pneumoniaeとの肺の共感染モデルにおいて、Wangら(2017)は、外因性アスピリンをトリガーとするRvD1の投与が、肺における肺炎球菌のより迅速なクリアランスを促進し、同時に、感染した気管支から肺の遠位領域への過剰な白血球の走化性を制限することにより、肺炎の重症度を低下させることを示した(Wang et al 2017)。
より最近では、インフルエンザAウイルス感染時の腸内細菌叢の摂動が、S. pneumoniaeによる呼吸器系細菌の超感染を有利にすることを示した。機械論的には、優勢な短鎖脂肪酸(SCFA)アセテートの産生の減少が、インフルエンザ感染の促進効果を説明するように思われた。
実際、アセテートを用いた治療は細菌負荷、肺負荷を減少させた。病理学、および二重感染マウスの生存率を改善した(Sencio et al 2020)。
肺感染の文脈における消炎の全体的な効果は、宿主が感染に対処する能力を妨げることなく、抗菌および抗ウイルス防御の増強および炎症反応の阻害であることは明らかである。
ここで注意すべき点がある。少なくとも1つの研究では、消炎は、宿主を二次感染に素因する可能性のある局所免疫抑制の長期化した段階を誘発しうることが示されている(Newson et al 2017)。
COVID-19と炎症収束
2019年末以降、世界は、中国で初めて検出された新しいコロナウイルスであるSARSCoV2によるパンデミックに振り回されている。
SARS-CoV2感染はCOVID-19と名付けられた疾患を引き起こし、その主な臨床症状は肺の炎症と傷害である。ほとんどのウイルス感染症と同様に、この疾患は、ウイルスの複製が著しい初期段階を経て、炎症段階に移行することを特徴としている。
多くの肺のウイルス感染症とは対照的に、COVID-19病は、有意な全身炎症(サイトカインストーム)と、心臓や腎臓を含む肺以外の臓器の損傷を特徴としている。また、重大な凝固障害もある(Moore et al 2020)。
ウイルスを標的とすることは、COVID-19の最初の段階では合理的なアプローチであるが、過剰な炎症および過剰な凝固の段階で宿主応答を調節することは、新たな治療機会を提供するかもしれない。
他の肺感染症の文脈においてそれらの保護的役割が知られているため、プロレゾリューションに基づく治療法を利用することは、COVID-19の文脈においてユニークな新しい治療戦略を提供する可能性があることを主張する。
図2に示すように、好中球のリクルートおよび活性化の減少、病原体クリアランスの強化、および過剰の予防を含む、COVID-19の文脈で有用であるかもしれないSPMの多くの実証された効果がある 本記事は著作権によって保護されている。
疾患から回復した患者は、末梢血単球におけるAnxA1のアップレギュレーションを有していた(Wen et al 2020)、ウェルレスポンダーにおける炎症反応のカウンターレギュレーションを示唆している。
これらのデータは、それらの患者におけるAnxA1レベルを測定することにより、より大きなコホートで検証されるべきであるが、これらの初期データは、AnxA1の発現の低下、および潜在的に他のプロレゾリューション分子が、重度のCOVID-19患者における転帰の悪化に寄与している可能性を示唆している。
炎症収束前活性を示す3つの分子-AnxA1、アンジオテンシン(1-7)およびプラスミン-は、COVID-19に関連して特に有用であるかもしれない。上述したように、AnxA1発現は、回復したマウスにおいて増加し(Tavares et al 2016)、AnxA1ペプチドミメティックの投与は、重症肺炎球菌性肺炎(Machado et al 2020)および重症インフルエンザを改善した。
回復したCOVID-19患者における発現の増加を示すデータとともに、これらのデータは、AnxA1レベルの回復が重症COVID-19患者の治療に有用である可能性を示唆している。
ACE2は、SARS-CoV-2が細胞に侵入するための最も重要な受容体であるように思われる。この酵素は、内因性のプロレゾリューションメディエーターであるアンジオテンシン-(1-7)を生成する(Barroso et al 2017; Magalhaes et al 2018)。
我々は、Ang-(1-7)が肺の炎症の間にプロ炎症収束作用を提示し(Magalhaes et al 2018)、腎臓、心臓および肺の疾患において保護されたことを示した(レビュー:(Simões E Silva, Silveira, Ferreira, & Teixeira, 2013)。実際、ACE2のレベルの低下は、ACE2/Ang-(1-7)調節/保護軸を親炎症性アンジオテンシンII/AT1Rの方に曲げることにより、SARS-CoV誘発肺損傷を増加させ、この効果はAT1受容体をブロックすることにより減衰させることができた(Kuba et al 2005)。
COVID-19の文脈でこの経路が欠損しているかどうか、そして与えられたAng-(1-7)ペプチドによる保護軸の活性化、またはAT1Rをブロックすることによるプロ炎症性経路の阻害が、疾患を制御するための保護的アプローチを構成するかどうかについては、まだ検証されていない。
敗血症患者においても観察される、血栓形成の亢進および線溶の抑制/消費を伴う過剰な凝固反応は、COVID-19患者の重要な特徴である(Moore et al 2020)。これに関連して、線溶タンパク質であるプラスミンが消炎を促進することを示している(Sugimoto et al. SARS-CoV-2は、プラスミノーゲン/プラスミンの細胞リプログラミング作用によって標的化され得るマクロファージ活性化症候群を誘導する(Sugimoto et al., 2017; Vago et al., 2019)。
実際、凍結乾燥プラスミノーゲンの噴霧吸入で処置された重症COVID-19患者は、改善された肺病変および低酸素症を呈した(Wu et al 2020)。生理的な凝固の間、白血球の抗菌応答を増強する免疫溶媒のクラスターのアップレギュレーションが存在する(Norris、Libreros、Chiang、及びSerhan、2017)。
免疫溶媒RvD4の投与は、病理学的血栓症の重症度を減衰させた(Cherpokova et al 2019)。したがって、プラスミンなどのプロレゾリューションベースの治療薬の特性を探索することにより、将来的には、高炎症反応、凝固および組織損傷などのCOVID-19のいくつかの特徴のより良い制御を提供することができるかもしれない。
まとめ
ウイルスの複製・侵入を標的とした薬剤の開発は、疾患の初期段階では合理的な治療法であるが、疾患の進行段階ではそれほど有用ではないかもしれない。
最近、消炎薬理学(Perretti et al 2015)という用語が提案され、新規な消炎ベースの治療薬を介して消炎の内因性回路の活性化を探求する治療戦略を記述するために、消炎薬理学が提案された。
抗炎症療法ではなく、炎症収束を薬理学的に誘導することは、免疫抑制を引き起こさず、少なくとも補助療法として、感染症を治療するための有望なツールである(図2)。
ここで議論されるように、いくつかのプロ分解分子は、ウイルスまたは細菌感染症をクリアするために大きな能力を提示し、本記事は著作権によって保護されている。
彼らの抗炎症/プロ炎症収束性能力に役立つ細胞の破片。
この拡大する分野での将来は大きな期待に値するものであり、COVID-19を含む感染症に起因する過剰な炎症を治療するためには、プロ炎症収束性に基づく治療法が抗炎症療法よりも優れたアプローチであるという概念を証明するために、さらなる検証が必要である。
プロテキンファミリーは、特殊なプロレゾル化メディエーターである
www.frontiersin.org/articles/10.3389/fphar.2018.01582/full
肥満と糖尿病をターゲットとした革新的なアプローチを可能にする強力な免疫溶媒
西洋型の食事とライフスタイルは、慢性疾患の発症に重要な役割を果たしているが、まだ正確な細胞と生体分子のメカニズムにはほとんど洞察が出てきていない。バランスの悪い食生活は肥満や糖尿病の原因となることが知られている。オメガ6とオメガ3の多価不飽和脂肪酸の十分な量と適切なバランスは、健康の維持のための鍵となる。
炎症の消炎は、現在、正確に制御され、特殊なプロ消炎メディエーターのスーパーファミリーによって制御された生物合成的に積極的に駆動されるプロセスであることが広まっている。
特殊なプロ消炎メディエーターは、オメガ-6およびオメガ-3多価不飽和脂肪酸の両方から生合成され、別個のG共役タンパク質受容体に作用する消炎アゴニストである。これらのメディエーターは、低ナノモルからピコモルの範囲のEC50値を持つ強力な抗炎症性および分解促進作用を示する。
プロテオリン(PD)ファミリーは、2つのオメガ3多価不飽和脂肪酸ドコサヘキサエン酸(DHA)とn-3ドコサペンタエン酸(n-3 DPA)から生合成される。PDのすべてが抗炎症剤とプロ消炎剤として興味深いバイオアクションを表示する。
本総説では、肥満や抗糖尿病効果に重点を置いたプロリボルビングメディエーターであるPDファミリーのバイオアクション、G共役型蛋白質受容体の薬理学、生合成、薬理化学について解説する。
これらの疾患に対する創薬や薬理化学の取り組みを可能にするためには、それぞれのメディエーターの構造、立体化学的な生合成、機能の確認のために、立体選択的な有機全合成が必要である。本研究室では、現在進行中の取り組みと現在の知見を紹介する。
はじめに
急性炎症反応における脂質メディエーター。
制御されない炎症と好中球応答
肥満と糖尿病は、誤った食生活、タバコの使用、アルコール摂取、鎮静的なライフスタイルの増加により、西洋社会で非常に普及している2つの病態である(Leonard, 2008)。これらの要因の中で、一般的な医学的見解は、食事がこれらの疾患の発生率と死亡率を増加させる重要な要因であるというものである(Leonard, 2008)。赤身の肉や加工食品を多く含む欧米型の食事、すなわち、貧弱でプロ炎症性の食事の摂取量が多いと、急性または慢性の炎症に発展する可能性がある(Carrear-Bastos et al 2011)。このタイプの食事は、オメガ6が多く、オメガ3 PUFAがむしろ少ない(Simopoulos, 2006)。
炎症に関与する分子、細胞および薬理学的プロセスの研究は、そのようなPUFAは、炎症プロセスに参加する強力な酸素化脂質メディエーターに生合成的に変換されることを明らかにした(Cotran et al 1999)。急性炎症反応は、外国の侵略者を封じ込めるために宿主保護的であり、健康状態では、自己制限的である(Malawista et al 2008)。
制御されていない場合、慢性炎症は、肥満および糖尿病を含む多数の疾患をもたらす可能性がある(Serhan, 2004)。いずれの疾患においても、炎症の末梢血マーカーは、親炎症性の西洋式食事を摂取した後に高いレベルで存在する(Calder, 2017)。
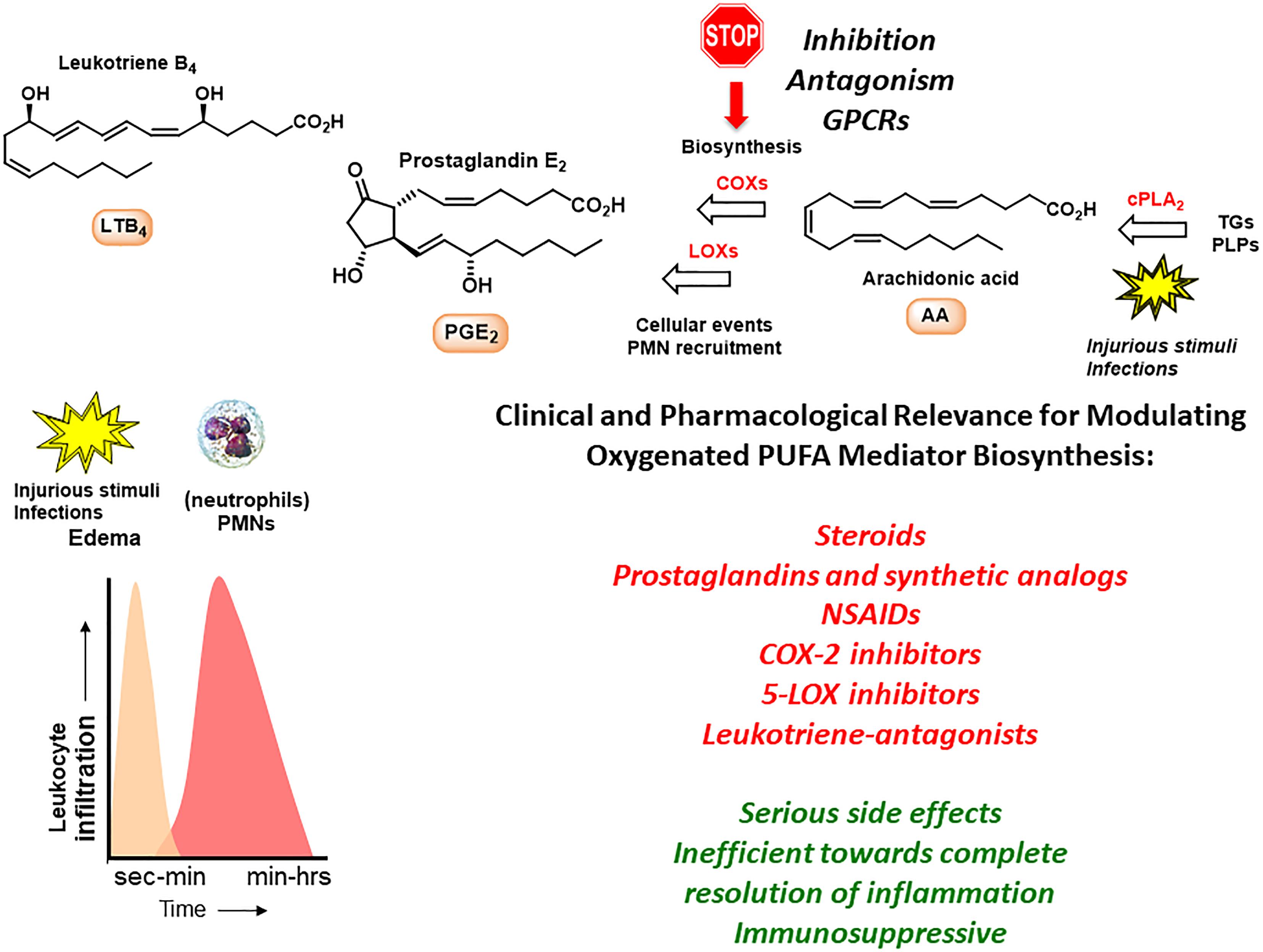
炎症の生体分子理解に関するサミュエルソンらによる研究により、過剰に形成されるとプロ炎症性メディエーターとして作用するPG、LT、トロンボキサンが同定された(サミュエルソン、2012)。例としては、COXがPGを形成する一方で、LOXの存在下でオメガ6 PUFA AAから立体選択的に生合成されるLT B4およびC4が挙げられる(Samuelsson et al 1987)。
AAはまた、LX A4(LXA4)およびLX B4(LXB4)(Serhan、1997)という名前の抗炎症性およびプロ分解性脂質メディエーターの生合成に関与している。LT、PGおよびLXは、個々のGPCRを介して作用し、好中球(多形核白血球、PMN)を活性化することにより、初期の事象および炎症反応の開始において重要な役割を果たす(Samuelsonson et al 1987;Serhan、1997)。
PMNは炎症部位への最初の細胞応答者であり、外来の侵入者を中和して排除することを目的としている。炎症反応の間、PGとLTの生合成は数秒から数分で起こり、時間とともに増加する(図1;Samuelsson et al 1987;Serhan、1997;Buckley et al 2014)。
図1
図1 アラキドン酸が関与する炎症反応と生合成経路の概要 アラキドン酸が関与する炎症反応と生合成経路の概要。
TGs、トリグリセリド; PLPs、ホスホリピッド。
いくつかの薬剤は、慢性的な状態をターゲットとし、炎症性マーカーからの効果を減衰させることに向かって働く開発されている。コルチゾールなどのステロイドが最初のリードを提供したが、その後、LTおよびPGがいくつかの抗炎症薬の開発のためのリード化合物として使用されている(Samuelsson, 2012)。LXはまた、創薬努力の話題にもなっている(Petasis et al 2005; Fetterman and Zdanowicz、2009)。
抗炎症薬の例は、2つの非選択的COX阻害剤イブプロフェンとアセチルサリチル酸、選択的COX-2阻害剤セレコキシブ、ロイコトリエン拮抗剤モンテルカストと5-LOX阻害剤ジレトンである(Samuelsson、2012)。
炎症過程における食事性オメガ3脂肪酸の有益な役割。
専門的なプロ消炎メディエーターと消炎の生合成
オメガ3 PUFAs EPA、n-3 DPA、およびDHAは、脂肪の多い魚やいくつかの栄養補助食品に豊富に、肥満や糖尿病の予防を含むいくつかの健康上の利点に起因している(Cotran et al 1999)。これらのPUFAは、ヒトでは非常に限られた量しかde novoで生産されないため、我々の食生活から得なければならないので、必須である(Simopoulos, 2006; Calder, 2017)。これらのPUFAsがこれらの疾患の調節に表示されるアクションの細胞、薬理学的および生化学的モードは、まだ調査中である。
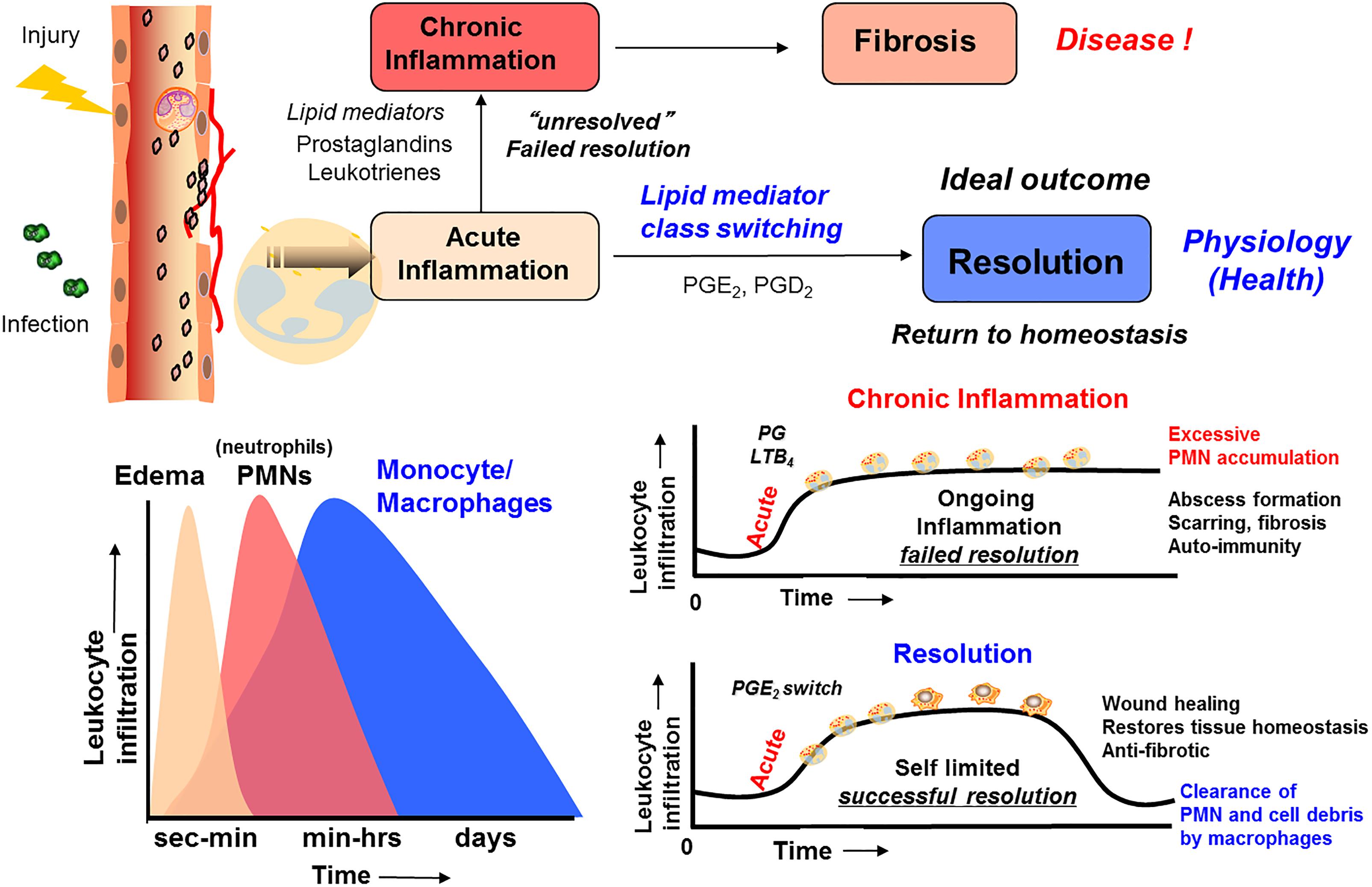
注目すべきことに、それは以前に、宿主の応答は、炎症収束の間、受動的であり(Bannenberg et al 2005;SerhanおよびSavill、2005;Gordon、2016)、そしてエイコサノイド(LT B4、PG)(Bannenberg et al 2005;SerhanおよびSavill、2005)、補体産物(Ward、2010)ケモカイン、およびサイトカインは、これらのメディエーターのすべてが単に組織内で時間の経過とともに希釈されて、PMNを局所的な組織部位に向けた(Medzhitov、2015)と考えられていた(図2)。
この希釈は、その後、PMNの追加的なリクルートを制限し、最終的には組織が生理機能を回復することを可能にするであろう(Bannenberg et al 2005)。
しかしながら、多くの研究は、AAから生合成されたLXが、SPMのPMN流入特性のための強力で活性なストップシグナルとして機能することを示している(Takano et al 1998; Serhan et al 2000)ことから、分解能応答が生物合成的に活性なプロセスであることを示している(SerhanおよびSavill、2005)。
図2
図2. 恒常性復帰に関与する必須脂質メディエータースイッチの概要。
脂身魚に豊富に含まれ、栄養補助食品にも使用されているオメガ3系PUFAであるEPAとDHAは、多くの健康効果と関連している(Calder, 2017)。SPMは、広い範囲の臨床適応症におけるそのような肯定的な主張のための分子的基礎を構成する可能性がある。
証拠は、自己限定的な炎症反応の間にプロ分解SPMの生合成のスイッチが起こることを示す詳細な細胞および生化学的メカニズムについて、過去20年にわたって提供されてきた(図2;Levy et al 2001)。この活性な生合成は時間とともに増加する。
プロ分解性SPMオートアコイドの生合成におけるスイッチは、炎症がどのようにして内包された炎症性滲出液中の新たな恒常性を取り戻すために、炎症の分解がどのようにして起こり、完了するのかについて、細胞的、生化学的、および詳細な酵素的機序学的説明を提供する(図2、3;Bannenberg et al 2005)。
この恒常性への復帰に関わる分子的、生化学的、細胞的事象をカタバシスと呼んでいる(Serhan and Savill, 2005)。模式的な概要については、図3を参照してほしい。
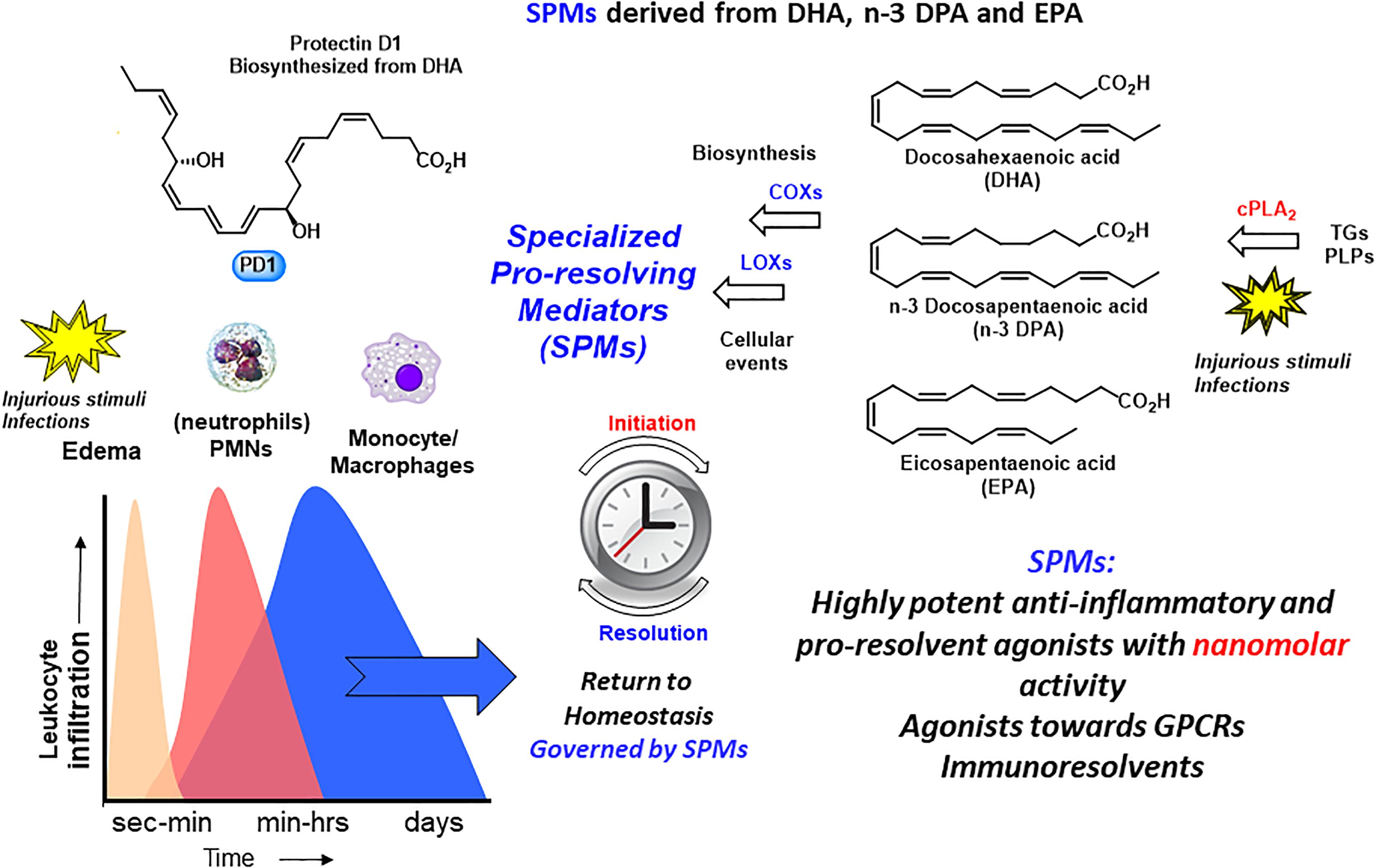
分解分泌ホスホリパーゼcPLA2-IIDおよびZPLA2-IIIが刺激されると(Takano et al 1998)、PUFAs EPA、DHAおよびn-3 DPAがリン脂質から放出され、特定の臓器でSPMの生合成生産を可能にする(図4; Levy et al 2001)。
滲出液中では、未エステル化オメガ-3 PUFAは、SPMへの酵素変換のために浮腫タンパク質を介して血液から送達され(春日 et al 2008)、したがって、細胞滲出液のさらなる拡張を終了させるためのSPM生合成のための基質の利用可能性のための新規なメカニズムを提供する(Murakami et al 2015)。
図3
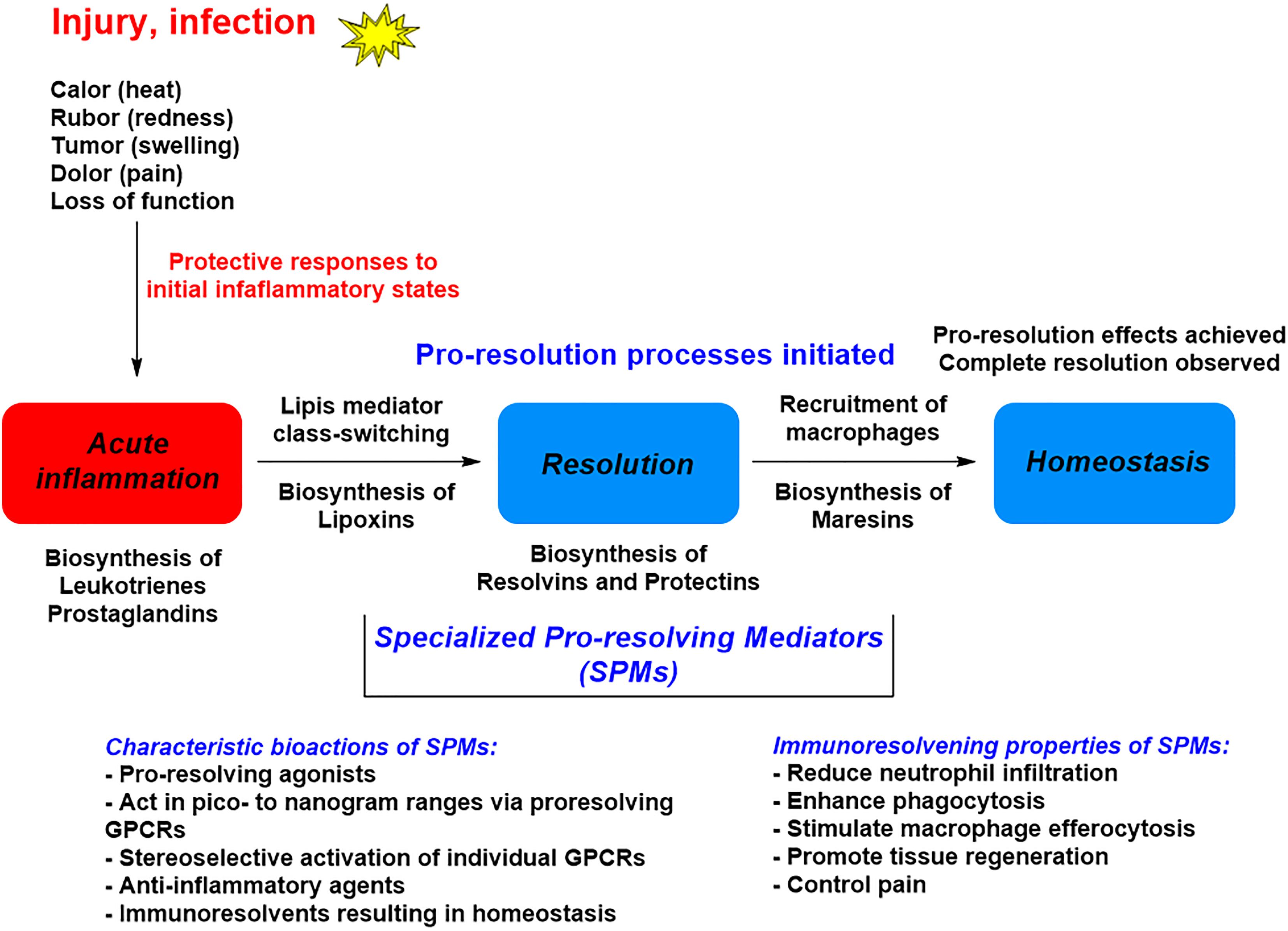
図3. EPAとDHAからのSPM生合成に関わる脂質メディエータークラススイッチの概要。
図4
図4. 特化型プロ分解メディエーターとその生合成形成の概要。
TGsはトリグリセリド、PLPはホスホリピッド。
特殊なプロ分解メディエーターは、Gタンパク質結合型受容体に作用する分解アゴニストである。
SPM は、生体内で強力なナノモルアゴニスト作用を示し、それは立体選択的であり、個々の GPCR のリガンドとして作用する (Serhan and Chiang, 2013)。1つまたは複数のGPCRの活性化は、SPMの強力な生理活性を実行する細胞機能を誘導する。
PD1の受容体に関する初期の研究では、構造にも依存する細胞型特異的な活性が明らかになった(Levy et al., 2007)。放射線標識されたPD1を用いて、白血球に対する特異的な結合が観察された(Marcheselli et al. PD1がGPR37に対するシグナリング応答を引き出すことの同定は、Bangら(2018)によって非常に最近報告された。
これらの研究者らはまた、マクロファージにおけるGPR37活性化がファゴサイトーシスを増加させ、サイトカイン放出を変化させ、炎症性疼痛の消炎を促進したことを報告した。
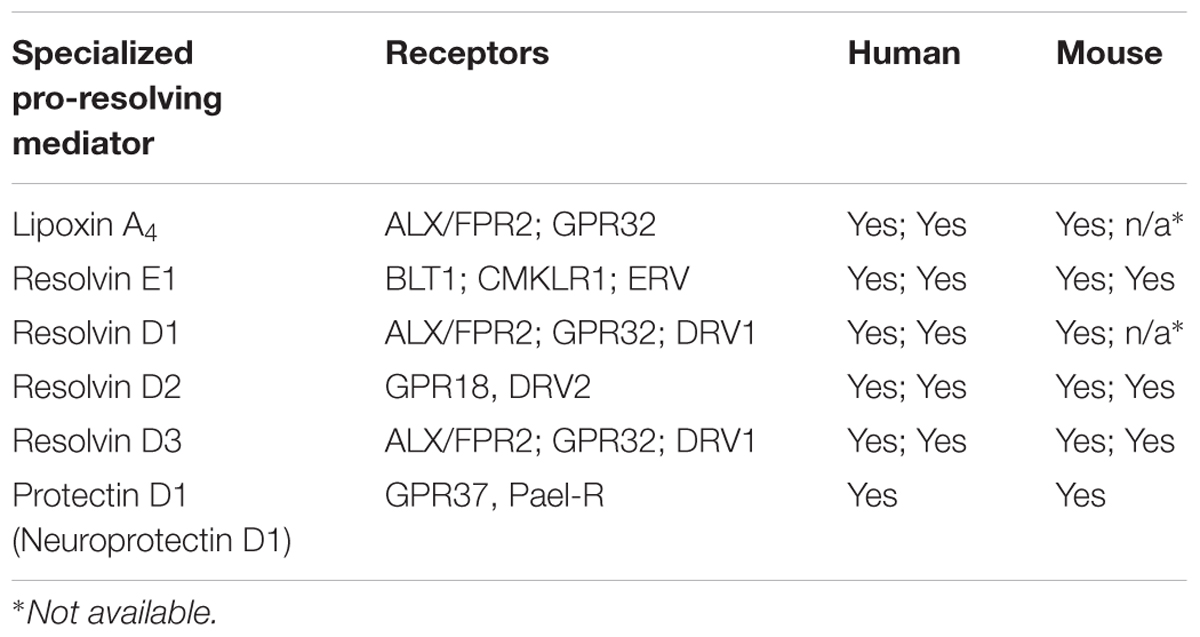
表1は、実験動物モデルにおいて、SPMが生体内試験(in vivo)で炎症の収束を喚起するために活性化する既知のGPCRを列挙したものである。
したがって、PD1は痛みのシグナル伝達を直接制御するニューロン上の受容体をさらに持っている可能性がある。
表1
表1. 特化されたプロレゾル化メディエーターのための報告された受容体
SPMのプロテインファミリー
前述のように、炎症の消炎は、生化学的メディエーターと受容体シグナル伝達経路によって制御された生合成的に活性化されたプロセスであると考えられている。Serhanグループは、脂質メディエータープロテオミクス、メタボロリピドミクス(LC/MS-MS)、自己制限炎症性滲出液中の細胞トラフィッキングを採用して、SPMの3つの新しいファミリーを同定した(Serhan et al 2002年、2009;Hong et al 2003;Dalli et al 2013年、2014年、2015a,b;Ramon et al 2016)レゾルビン(resolution phase interaction products)、PDs、およびmaresins(炎症の消炎におけるマクロファージメディエーター)の造語を採用した。
各ファミリーは構造的に異なり、n-3必須脂肪酸のEPA、n-3 DPA、またはDHAから生合成される(図5;Serhan et al 2002、2009;Hong et al 2003;Dalli et al 2013、2014、2015a,b;Ramon et al 2016)。
PDは、LX、レゾルビン、マレシン、およびスルフィド抱合体RCTRs、PCTRs、およびMCTRs(組織再生におけるマレシン抱合体)とともに、メディエーターのスーパーファミリーに属する(図5)。これらのPDは、共役トリエンを持ち、17HpDHA中間体の酵素生産から生合成が開始されるため、他のSPMとは構造的に異なる。
図5
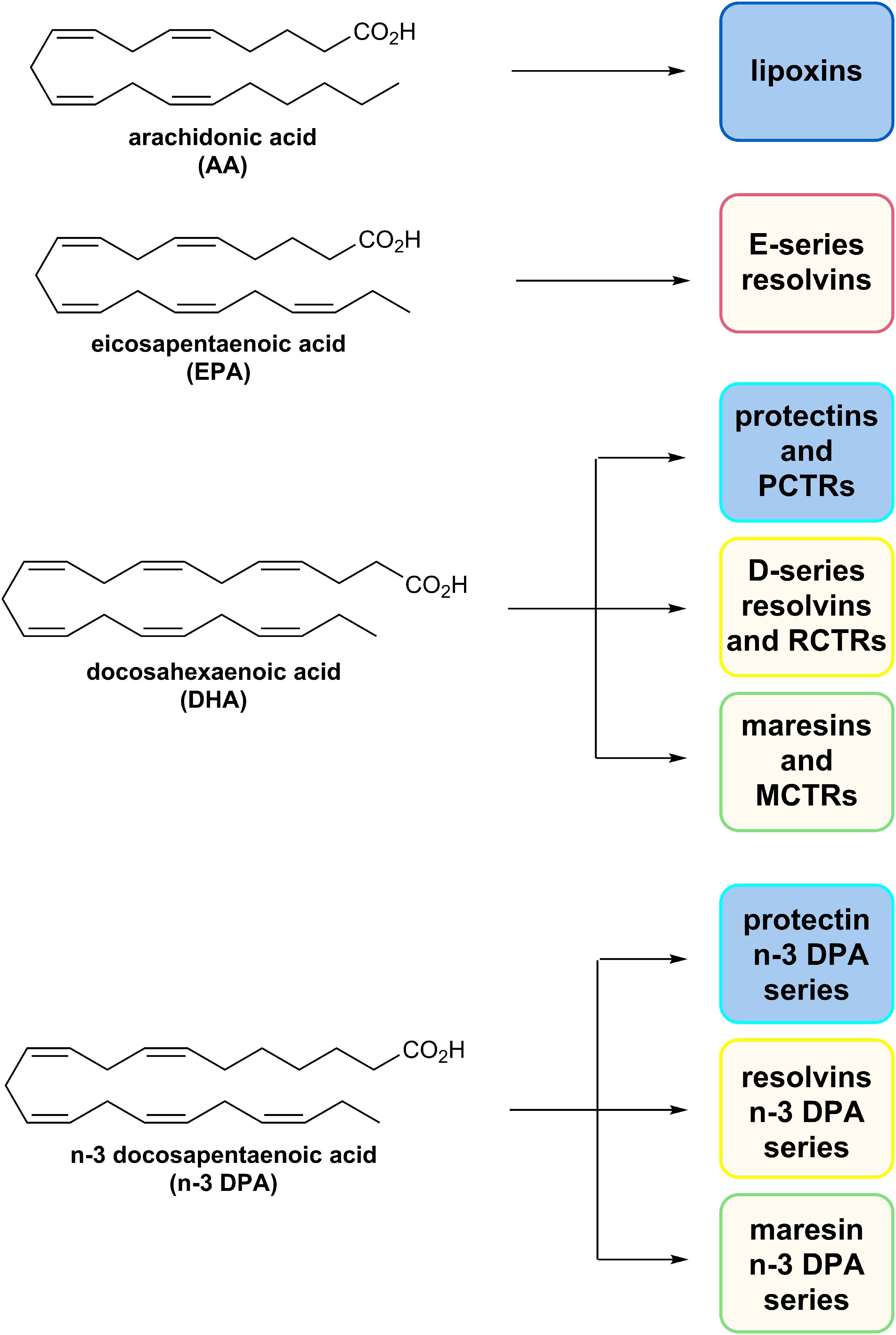
図5。AA、EPA、DHA、およびn-3 DPAの化学構造と、これらのPUFAから生合成されるSPMの個々のファミリーの概要。
プロテインのプロ分解作用と抗炎症作用
SPMのプロテインファミリーは、消炎のリードとして生物医学のコミュニティから大きな関心を集めている(Serhan, 2014; FullertonおよびGilroy, 2016; DalliおよびSerhan, 2018)。
炎症の消炎におけるPDの正確な細胞イベント、生化学的経路および分子機構は、薬剤開発を可能にする薬理学および薬理化学において関心を集めている(Serhan, 2014; FullertonおよびGilroy, 2016; DalliおよびSerhan, 2018)。
PD1n-3 DPAは、PMNに加えて、マクロファージ(Serhan et al 2006;DalliおよびSerhan、2012)および好酸球(Yamada et al 2011;Katakura et al 2015)によって産生され、その産生は重症喘息患者では減少する(Miyata et al 2013)。
PD1が神経系で産生される場合、NPD1という名称は、網膜、脳、および痛みの誘導における強力な保護作用の場所を表すために使用される(Bazan et al 2010; Marcheselli et al 2010; AsatryanおよびBazan、2017)。
腹膜炎を有するマウスにおいて、わずか1 ngのPD1がPMN浸潤を約40%減少させたことから、驚くべき強力な解離促進作用が観察された(Serhan et al., 2006)。
AT-PD1
オメガ-6 AA由来のLXおよびそれらのアスピリンをトリガーとした15-エピマーのヒト15-LOXによって媒介される生合成経路は、十分に確立されており、研究されている(Serhan, 1997)。PD1/NPD1は、15-LOXによって17S配置で主に生合成されるが、COX-2のアスピリンアセチル化は、炭素数17の位置で主にR配置でヒドロペルオキシド中間体を生成する。
このエピマーヒドロペルオキシドは、17Rエピマー17R-PD1に変換され、これがAT-PD1と呼ばれる(Serhan et al 2002、2011)。R-エピマーは、S-エピマーPD1よりも作用時間が長く、最も可能性が高いのは、酸素化PUFAの代謝におけるエイコサノイドオキシドレダクターゼ酵素のS構成アルコールに対する立体化学的な選好性によるものである(Serhan et al 2011)。
AT-PD1はまた、強力な分解促進作用および抗炎症作用だけでなく、神経保護特性も表示する(Serhan et al 2002、2011)。
PD1のさらなる代謝産物である22-OH-PD1とその合成アナログである22-F-PD1。薬用化学の取り組み
一度局所的に産生されたPD1のさらなる代謝は、ヒトの生体内では研究されていないが、ある研究では、PD1の炭素原子番号22(C-22)でのω-酸化によって形成された22-OH-PD1(図6)と名付けられた代謝物が報告されている(Serhan et al 2002)。この代謝物は、全合成によって調製された(Tungen et al 2014)。
マウスにおける生体内試験(in vivo)実験では、22-OH-PD1が強力なプロ分解活性および抗炎症活性を示したことが明らかになった(Tungen et al 2014)。さらなる研究が必要であるが、PD1のさらなる代謝経路は、他のSPMのいくつかと同様に、エイコサ酸化還元酵素を介して媒介されている可能性が高い(SerhanおよびPetasis、2011)。
22-OH-PD1が示したエフェロサイトーシスおよびファゴサイトーシスに対するナノモル範囲の強力な生体内試験(in vivo)プロレゾリューション作用は、図6に示されている合成アナログ22-F-PD1を調製することへの関心を駆り立てた(Tungen et al., 2018)。
大腸菌感染後に100 ng/マウスで腹腔内注射を介して投与すると、22-F-PD1は、PMNリクルートを減少させ、マクロファージ貪食を増強し、PD1と同様のレベルで細菌負荷を減少させた(Tungen et al., 2018)。
全体的に、これらの結果は、合成アナログおよびputative薬理化学剤22-F-PD1が、ネイティブPD1と同様の強力な抗炎症作用およびプロ分解作用の両方を示したことを検証した。マクロファージの貪食およびエフェロサイトーシスは、いずれも創薬および臨床開発において関心の高い重要なプロレゾリューション生物学的作用である(Serhan et al 2002)。
新規プロテキンPD1n-3 DPA
最近、米国ボストンのDalli、ColasおよびSerhanは、n-3 DPAもまた、それぞれがSPMの新規ファミリーに対応する強力な生理活性メディエーターの生合成のための基質であることを実証した(Dalli et al 2013)。
ヒトにおけるオメガ3 PUFA生合成の中間体として評価されている間、このPUFAはまた、22個の炭素および5個の二重結合を有するSPMの前駆体であることは興味深い(Dalli et al 2013; Aursnes et al 2014a)。
これらのn-3免疫溶媒は、3つのサブファミリーresolvinsn-3 DPA、PDn-3 DPA、およびmaresinn-3 DPAのそれぞれが、ヒト被験者で同定されたような強力なプロレゾリューション作用を示す(Aursnes et al 2014a; Markworth et al 2016; Gobbetti et al 2017; Hansen et al 2017)に属する(図5)。
マウスあたり10 ngを使用して合成材料を投与すると、ザイモサンAチャレンジ後の腹膜炎中に好中球のリクルートが有意に減少した(Aursnes et al 2014a)。これらのバイオアクションは、PD1によって示されたものに匹敵するものであった。さらに、PD1n-3 DPAの合成物質は、ピコ〜ナノモルの範囲でヒトマクロファージの貪食およびエフェロサイトーシスを刺激した。
全体的に、これらの結果は、PD1n-3 DPAが強力な抗炎症作用とプロ分解作用の両方を示していることを確認し、このSPMの強力な免疫溶媒特性を確認した(Aursnes et al 2014a)。PD1n-3 DPAおよびRvD5n-3 DPAの強力な保護バイオアクションは、マウス大腸炎において、および内皮へのヒトPMN接着を減少させることにおいて実証された(Gobbetti et al 2017)。
別の最近の研究では、PD1n-3 DPAは神経炎症の消炎を促進し、神経炎症反応の著しい遅延のためにてんかん発生を強力に停止させる(Frigerio et al 2018)。これらの研究はまた、PD1n-3 DPAが神経炎症を調節することを報告した最初の研究でもある(Frigerio et al 2018)。
最近Dalliらは、n-3 DPA PDの生合成経路がヒト単球の分化を調節し、マクロファージの表現型、エフェロサイトーシス、および細菌のファゴサイトーシスを変化させることを発見した(Pistorius et al 2018)。
組織再生におけるプロテイン結合体。PCTR1、PCTR2およびPCTR3
2014年および2015年に、強力な組織再生特性を有し、抗炎症性およびプロレゾリューションバイオアクションを有する3つの新しいクラスのSPMが発見され、解明された(Dalli et al 2013年、2014)。
図6にPCTR1の化学構造を示すが、この新規SPMは炭素原子16にスルフィド結合を有する新規ペプチド共役PDに属し、マウスの大腸菌感染症およびヒト脾臓の自己消炎から同定された。
PCTR1は感染性炎症の消炎を増強し、ヒトM2マクロファージによって産生される(Dalli et al 2015b)。さらに、PCTR1は、0.001〜10nMの範囲で、ヒト単球およびマクロファージの遊走を強力にかつ用量依存的に促進した(Dalli et al 2015b)。
さらに、PCTR1はマクロファージおよび単球の遊走を増加させ、マクロファージのエフェロサイトーシスを増強し、プラナリアにおける組織再生を促進した(Dalli et al 2015b)。また、自己修復感染時にPCTR1が時間的に制御されることも報告されている。
炎症のピーク時には、PCTR1は大腸菌のマクロファージのリクルートとファゴサイトーシスを増強し、PMN浸潤を減少させ、PGを含む炎症開始脂質メディエーターをカウンターレギュレートした(Dalli et al 2015b)。これらの知見は、PCTR1が、細菌感染時に重要な抗炎症およびプロレゾナンスプロセスを調節する強力な単球およびマクロファージアゴニストであることを実証した。
肥満および糖尿病におけるプロテイン
前述のように、プロ炎症性の西洋型の食事は、オメガ-6およびオメガ-3 PUFAから生合成されたものを含む、炎症性の細胞および生体分子マーカーの増加レベルをもたらす(Simopoulos、2006)。低悪性度タイプの炎症に関連した脂肪組織質量の拡大は、食事および栄養の過剰摂取とともに観察されてきた。
脂肪組織のこの慢性的で未消炎の炎症は有害であり、糖尿病、インスリン抵抗性および非アルコール性脂肪肝疾患、西洋社会におけるすべての増加する悪病につながる可能性がある(Clària et al 2017)。白色脂肪組織は、代謝およびエネルギーの恒常性のバランスをとる上で重要な役割を果たしている(Clària et al 2017)。このバランスは、AA、EPA、およびDHAによって影響を受ける。
この設定では、Clàriaらは、EPAおよびDHAの上昇レベルを与えられた白色脂肪組織におけるSPM生合成に関する最初の調査を報告した(Gonzales-Periz et al 2006年、2009;Clària et al 2017)。
これらの研究は、DHAの食餌増幅の結果、PD1およびその前駆体である17S-HpDHAの生合成が増加し(Gonzales-Periz et al 2006)、生体内試験(in vivo)では酵素的に17S-HDHAに還元されることを示した(SerhanおよびPetasis、2011)。
トランザクティベーションアッセイを用いて、17S-HDHAはPPARγアゴニストであることが示された(Gonzales-Periz et al 2006)。グリタゾンなどのいくつかのPPARγ-アゴニストが抗糖尿病薬として開発されているので、この知見は興味深いものである(Gonzales-Periz et al 2006; Clària et al 2017)。Clàriaらはまた、DHAの投与が、プロ炎症性PGおよびLT B4(LTB4)の存在を減少させることを実証した(Gonzales-Periz et al 2006)。
合成17-HDHAは、肝細胞における遺伝毒性および酸化的損傷を停止し、マクロファージにおける5-LOX発現を減少させた。
さらなる研究では、これらの著者らは、炎症を起こした白色脂肪組織および肥満マウスにおいて、SPMの生合成形成が著しく抑制されたことを報告した(Gonzales-Periz et al 2009)。
PD1とRvD1は、LC/MS-MSメタボロリピドミクス解析に基づいて、DHA由来のSPMが支配的であることが報告された。また、白色脂肪組織においてインスリン抵抗性の低下が観察されたことも報告されており、これは全身のエネルギーバランスの重要な調節因子であるアデノシン一リン酸およびアディポネクチンのリン酸化の開始と並行して観察された(Gonzales-Periz et al 2009)。
これらの研究者らが末梢血管疾患患者の白色脂肪組織を使用した場合にも、生合成プロセスの偏りが観察された。これらの患者では、白色脂肪組織の炎症状態が著しく変化している(Clària et al 2013)。
肥満と糖尿病の設定内では、これらの観察は、それがオメガ3 PUFAの摂取量の増加がSPMの生合成を高めることが報告されているので、オメガ3 PUFAの減少した組織レベルに起因する可能性がある(マス et al 2012)。定量化されたSPMの減少レベルはまた、SPMのさらなる不活性代謝物への変換に続いて、強化された異化や代謝によって説明することができる。
興味深いことに、肥満の脂肪組織では、エイコサノイド酸化還元酵素(15-PG-デヒドロゲナーゼ)の発現が著しく上昇している(Gonzales-Periz et al 2009)。この酵素は、白色脂肪組織においても発生する、RvD1およびRvD2からの17-オキソ-RvD1および7-オキソ-RvD2のそれぞれの代謝形成に関与している(SerhanおよびPetasis、2011)(Clària et al 2012)。
LC/MS-MSの結果は、化合物の絶対配置に関する情報がなくても、割り当てられた構造を支持した。彼らはマウスだけでなく、糖尿病を持つ肥満患者の血清を用いて実験を行った。13-DHAHLAと名付けられた新規化合物は、SPMよりもはるかに高い濃度で抗炎症特性を示した(Kuda et al. これらの著者らはまた、13-DHAHLAが、インターロイキン-6、腫瘍壊死因子-α、およびPGなどのいくつかのプロ炎症性マーカーの増加を阻害することを見出した。
さらに、13-DHAHLAは、試験管内試験(in vitro)骨髄由来マクロファージアッセイにおいて誘導されたザイモサンAのファゴサイトーシスを増強した(Kuda et al 2016)。
注目すべきことに、PDXは白色脂肪組織の炎症を解消しなかった(White et al 2014)。
しかしながら、マウスを用いた生体内試験(in vivo)研究では、PD1およびPDXの両方がPPARγ転写活性を調節することができることが示された(White et al 2015)。
肥満・糖尿病におけるSPM療法の概要と今後の方向性
炎症の枢要徴候:calor、rubor、腫瘍、dolor、およびfunctio laesaは、PGのような化学的メディエーターによって生理学的に媒介され、従来のNSAIDsによって効果的に制御される(VaneおよびBotting、2001)。これらの薬剤は、望ましくない副作用を与える。
炎症関連疾患である肥満や糖尿病の増加を考えると、新しい治療法やメカニズムが、すべての臓器で過剰なPMNとそれらの大群によって作成された過剰な炎症と巻き添え組織の損傷を制御するために模索されていることが最重要である(Cotran et al 1999)。
活性な内因性の解離プログラムおよび新規な解離メディエーターの証拠は、免疫抑制性ではなく、むしろ解離を刺激する免疫溶媒およびプロ解離メディエーターアゴニストとして機能するであろう新しい治療アプローチのための約束を保持している(Morris et al 2009;Serhan、2014;Perretti、2015;Serhan et al 2015;DuvallおよびLevy、2016;FullertonおよびGilroy、2016;Serhan、2017;Vik et al 2017;DalliおよびSerhan、2018)。
炎症に対する現在の治療法は有効であり得るが、これらの多くは最終的には免疫抑制剤となり、感染の機会を開くことになる。EPA、DHAおよびn-3 DPAは、プロ分解脂質メディエーターを形成するために展示されているEPA、DHAおよびn-3 DPAの明確な特性は、少なくとも部分的には、これらのオメガ3 PUFAsに関連付けられている確立された健康効果を説明することができるかもしれない。
これらの強力な脂質メディエーターの生合成経路はまた、アスピリンの存在下でCOX-2が個々のSPMの代謝的に長く持続するエピマーを生合成するので、アスピリンの正の効果のいくつかを説明することができるかもしれない(SerhanおよびPetasis、2011; Serhan et al 2011)。これらのエピマーはまた、強力なプロ分解性および抗炎症性を示す。
SPM の異なるファミリーは、キラル、二級アルコール、共役 E および Z 二重結合の両方の形でのいくつかの立体創成中心の存在により、高い構造的複雑性を示し、それらの生化学的起源、機能、および個々の GPCR に対する立体特異的なバイオアクションを反映している。
このように、SPM を使用する際には、習得した知識と細心の注意を払わなければならない。このような精緻な作業を怠ると、SPM が持つ分解能アゴニストとしての正しい刺激的な化学構造や強力な生物学的作用を明らかにすることはできない。
健康における前駆体としてのPUFAおよびその酵素的酸素化生成物の役割を細胞および分子レベルで解明することは、現在の関心事である(Serhan, 2017)。今日までに、約80種類の生物学的に活性なDHA由来の代謝物が、様々な生物学的役割を持って記載されている。
今日のところ、PDのような内因性SPMのみが、低ナノモル範囲の生体内で強力なプロ分解性および抗炎症性バイオアクションの両方を表示することを強調することが重要である。したがって、PDは、炎症の消炎に基づく薬剤開発に向けて現在調査中の最もエキサイティングな低分子の一つである
したがって、これらのSPMを分解能アゴニストとして、あるいは糖尿病や肥満を標的とした薬剤開発に向けた薬理学的バイオテンプレートとして使用する場合には注意が必要である(Tabas and Glass, 2013)。
承認されている医薬品の大部分は、炎症状態に関与する特定の生物学的経路を阻害、遮断、または拮抗するために開発されてきた(Vane and Botting, 2001)。したがって、炎症性メカニズムは、肥満および糖尿病を含むいくつかの疾患の中心となっている。
炎症の消炎の生物学の背後にある生化学的、遺伝的、分子的、細胞的メカニズムの詳細な解明は、炎症プロセスの理解に新たなパラダイムをもたらした。これらの介在メカニズムの理解が深まるにつれ、”消炎薬理学 “の中の薬剤にも関心が集まるようになるであろう。
そのような候補の例としては、肥満および糖尿病に対するプロ分解能および抗炎症性GPCRアゴニスティック特性を示す合成低分子模倣薬(CorminboeufおよびLeroy、2014;Vik et al 2017)が考えられる(OhおよびOlefsky、2016)。
さらに、SPM生合成の活性化剤またはエイコサノイド酸化還元酵素(15-PG-デヒドロゲナーゼ)の阻害剤もまた、「分解能薬理学」ファーマコピア内の将来の可能性の一部であるかもしれない。
重要なことに、SPMは非常に強力なGPCRアゴニストであり、承認されているすべての薬剤の約40%がこの受容体クラスを活性化している。
プロ炎症性PGおよびLTがもたらした薬剤開発の努力に基づき、同定された受容体の数が増加していることと相まって、将来の薬剤開発の努力が促進されるべきである(Gilroy et al 2004;TabasおよびGlass、2013;CorminboeufおよびLeroy、2014;DuvallおよびLevy、2016;Vik et al 2017)。
しかし、そのような将来の努力は、プロ炎症性メディエーターおよびその生物学的役割(Samuelsson, 2012)に基づく過去の薬物開発の成功と同様に、基礎的な生物医学研究に依存している。
我々は、「消炎薬理学」の開発と、SPMに関連する基礎研究から得られる刺激的な新しい知見が、肥満や糖尿病の治療のための革新的なアプローチを可能にし、進化し続けることを期待している。