コンテンツ
Could Histamine H1 Receptor Antagonists Be Used for Treating COVID-19?
www.mdpi.com/1422-0067/22/11/5672/htm
Received: 2021年5月8日 / 改訂: 2021年5月20日 / 受理: 2021年5月25日 / 発行: 2021年5月26日
概要
COVID-19は世界的に急速にパンデミックしており、広範かつ長期的な健康問題を引き起こしている。SARS-CoV-2の感染を抑制し,COVID-19患者の予後を改善する治療法の確立が急務となっている。重症のCOVID-19患者には、バランスの悪い肺の炎症が共通して見られるため、肺の炎症を抑えることで、臨床症状が改善することは間違いない。ヒスタミンH1受容体(H1受容体)拮抗薬は、アレルギー疾患の治療薬として広く処方されているが、最近では抗SARS-CoV-2薬としても大きな期待が寄せられていることが明らかになった。ここでは、SARS-CoV-2感染対策におけるH1受容体拮抗薬の新たな利用法について簡単にまとめた。また、SARS-CoV-2に対するH1受容体拮抗薬の潜在的な抗ウイルスメカニズムについても述べる。最後に,COVID-19の管理におけるH1受容体拮抗薬の使用の機会と課題について議論する。
キーワード
COVID-19;NF-κBシグナル;H1受容体拮抗薬;治療;薬剤
1. はじめに
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)を原因とする新興呼吸器疾患である新型コロナウイルス019(COVID-19)は、急速に世界的な健康問題につながり、世界的なパンデミックとなっている。世界の多くの地域でロックダウンモードを余儀なくされ、莫大な経済的損失と人的被害をもたらしている。COVID-19の患者のほとんどは無症状か軽度の症状を示するが、中には重度の肺障害に進行し、最終的に多臓器不全を発症するケースもある[1,2]。
SARS-CoV-2は、一本鎖のポジティブセンスRNAウイルス(++ssRNA)である[3]。SARS-CoV-2のゲノムは,SARS-CoVおよびMERS-CoVのゲノムと82%の配列同一性を有している。SARS-CoV-2には,スパイク(S),エンベロープ(E),膜(M),ヌクレオカプシド(N)の4つの構造タンパク質が同定されている。これらのタンパク質の配列は、SARS-CoVやMERS-CoVのものともよく似ている[4]。ウイルスの構造タンパク質は、ウイルスのライフサイクルを決定する上で重要な役割を果たしており、治療の標的となる可能性がある[5]。SARS-CoV-2は、SARS-CoVのアンジオテンシン変換酵素2(ACE2)受容体を介して侵入し、膜貫通型セリンプロテアーゼ(TMPRSS2)を介してSタンパク質のプライミングを行う。細胞内に侵入したSARS-CoV-2は、その後エンドソームに取り込まれ、リソソーム膜と融合する。最終的に、SARS-CoV-2ウイルスはエキソサイトーシスによって細胞外に放出される(図1)[6]。SARS-CoV-2に感染すると、重篤な呼吸器系の病態や肺の損傷を引き起こすことがある[7]。肺損傷の重症度は、SARS-CoV-2感染時のマクロファージによるサイトカイン・ストームの産生と相関している。死亡リスクの高いCOVID-19患者では、IL-2,IL-10,G脳脊髄液、IP-10,MCP-1,IL-7,TNF-α、MIP-1Aなどのサイトカインが高濃度に分泌されていた[1]。これと並行して、COVID-19の死後の肺生検では、血管周囲および中隔のマスト細胞の濃度上昇が認められた[8]。肥満細胞は、ヒスタミンなどの炎症性メディエーターを合成・分泌する細胞である。SARS-CoV-2感染におけるマスト細胞の役割については、しばしば議論されてきた[9,10,11,12]。SARS-CoV-2感染時にマスト細胞が活性化して放出されるヒスタミンが、肺損傷の重症化に寄与しているかどうかは、まだ解明されていない[13,14]。
図1 SARS-CoV-2のライフサイクルと関連する阻害剤を示す模式図
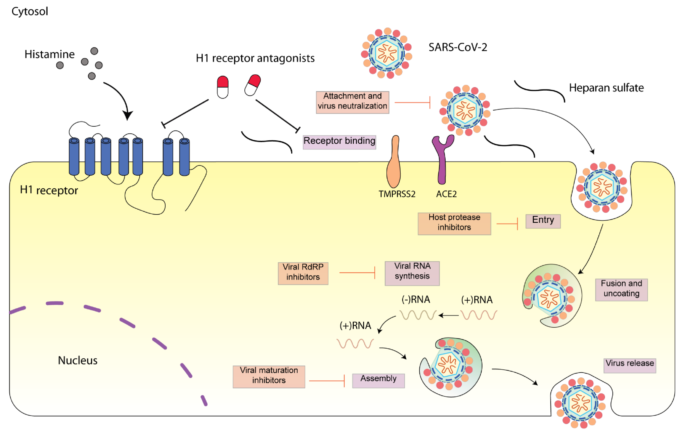
SARS-CoV-2の細胞侵入は、TMPRSS2によって促進されるスパイクSタンパク質のACE2への結合から始まる。SARS-CoV-2はエンドサイトーシスを経て細胞内に侵入し、リソソームの酸性環境下でウイルスのコーティングが解除される。その後、SARS-CoV-2のRNAが放出され、続いて、ウイルスゲノムとウイルスタンパク質が再生される。そして、ウイルスの構成要素が組み立てられ、エキソサイトーシスを介して放出される[15]。各ステップは、関連する阻害剤によって標的とすることができる。H1受容体拮抗薬は,H1受容体を介して,あるいはACE2受容体を介して,SARS-CoV-2を阻害することができる。SARS-CoV-2スパイクタンパク質は、その受容体結合ドメイン(RBD)を介して、細胞内のヘパラン硫酸とACE2の両方と相互作用する[16]。H1受容体アンタゴニストは、ヘパラン硫酸とスパイクタンパクの相互作用を破壊し、SARS-CoV-2の侵入を阻害する可能性がある。
ほとんどの場合、SARS-CoV-2による過剰な肺の炎症反応は自己完結的であるが、一部の患者では、年齢や動脈性高血圧症や糖尿病などの併存疾患が危険因子として認められ、バランスが取れず、非完結的である。その結果、これらの患者は入院が必要となり、適切な管理が必要となる。炎症反応とそれに伴う肺損傷の緩和を考慮して、COVID-19患者には抗炎症剤(非ステロイド性抗炎症剤(NSAIDs)またはコルチコステロイド)が様々な治療法で投与されている[17,18]。しかし、COVID-19患者におけるそれらの臨床使用に関しては、議論が存在する[19,20]。例えば、COVID-19の痛みや発熱の治療に使用される市販薬のイブプロフェンは、ACE2レベルを上昇させることがわかっている[21]。コルチコステロイドに関しては、最近の研究で、特に重症のCOVID-19患者(すなわち、呼吸困難を伴うICUに入院した患者)に対して低用量のデキサメタゾンを投与すると、患者の生存率が有意に向上することが示された[22]。それにもかかわらず、COVID-19患者の免疫力を低下させる可能性がある[23,24,25]。
ヒスタミンとその受容体は、さまざまなアレルギー疾患の進行に重要な役割を果たしている[26]。特に、ヒスタミンH1受容体(H1受容体)は、アレルギー性肺反応を制御することが報告されており、したがって、その拮抗薬は気道炎症の治療に使用されている[27]。気道の炎症を媒介するだけでなく,我々の最近の実験では,喘息症状の治療に用いられている古典的なH1受容体拮抗薬であるデプトロピンが,E型肝炎ウイルスの複製を強力に阻害することが確認されている[28]。また,H1受容体拮抗薬がさまざまなRNAウイルスの感染を抑制することも明らかになってきている[29,30]。この総説では,SARS-CoV-2感染に対抗するためのH1受容体拮抗薬の新しい利用法について簡単にまとめている。また、SARS-CoV-2に対するH1受容体拮抗薬の潜在的な抗ウイルスメカニズムについても議論する。
2. COVID-19への薬剤再利用
抗ウイルス剤の開発や効果的なワクチン戦略にもかかわらず、ウイルス性疾患は依然として人間の健康にとって重要な脅威であり、特に人獣共通感染症のリザーバーが継続的に新しいウイルスの亜種を生み出している[31]。一連のウイルス感染症の中でも最も新しいSARS-CoV-2感染症は、現在、人類の健康に対する重要な脅威として浮上している。しかし,この病気に対して承認された特別な治療法はない。そのため、COVID-19に使用できる薬剤を発見するために、薬剤の再利用(リポジショニングまたは再発見とも呼ばれる)が注目されている。この戦略は、本来の適応症とは異なる医療用途で薬剤を試験することにより、従来の薬剤開発プロセスを短縮するものである。
現在までに、いくつかのヌクレオチドアナログがCOVID-19患者の治療に再利用されており(表1)その中には、ヌクレオチドアナログのレムデシビル、ファビピラビル、リバビリン、ソホスブビルなどが含まれている。米国ワシントンDCの35歳のCOVID-19患者では、入院7日目にレムデシビルを静注したところ、翌日までの健康状態が著しく改善された[32]。中国で行われた非盲検対照試験では、ピラジネカルボキサミド誘導体であるファビピラビルがSARS-CoV-2の複製を強力に阻害することが示された[33]。リバビリンは,広域抗ウイルス剤で,C型肝炎ウイルスやE型肝炎ウイルスの治療に,IFNαとの併用または単剤で使用されるグアノシンアナログである[28,34]。最近では,COVID-19治療において,リバビリンをインターフェロンαやロピナビル・リトナビルと併用することが推奨されている。しかし、COVID-19に対するリバビリンの効果については議論の余地があり、さらに確認する必要がある[35]。最近、分子ドッキングの結果、ソホスブビルがSARS-CoV-2のRNA依存性RNAポリメラーゼ(RdRP)を阻害する可能性が示唆された[36]。ヌクレオチドアナログは,ウイルスのRdRPを直接標的とすることでウイルスの複製を効率的に阻害することができるが,ヌクレオチドアナログの長期使用は,ミトコンドリアのDNAポリメラーゼを阻害することで重大なオフターゲット効果を発揮する可能性があり[37],薬剤耐性が生じる可能性もある[38]。さらに,C型肝炎[39]やインフルエンザ[40]などで明らかになっているように,直接作用型抗ウイルス剤の有効性は低下している。
表1 COVID-19に再利用される可能性のあるいくつかの抗ウイルス剤の作用機序
| 薬 | 行動様式 | 参考資料 |
|---|---|---|
| レムデシビル | ウイルス RNA 依存性 RNA ポリメラーゼ (RdRp) に結合し、ウイルス RNA の転写を終了します。 | [ 41 ] |
| ヒドロキシクロロキン | エンドソームの pH を上昇させ、SARS-CoV-2 の宿主細胞膜との融合を抑制します。 | [ 42 ] |
| ロピナビル/リトナビル | ポリタンパク質を RNA 依存性 RNA ポリメラーゼおよびヘリカーゼに切断するために必要なタンパク質 3CLpro を阻害します。 | [ 43 ] |
| ウミフェノビル | リン脂質の水素結合ネットワークを妨害することにより、ウイルスの細胞/エンドソームへの融合をブロックします | [ 44 ] |
| ファビピラビル | RdRp の保存的触媒ドメインを破壊し、ヌクレオチドの取り込みを中断します。 | [ 45 ] |
| シクロスポリン | カルシニューリンではなくシクロフィリンを標的とする | [ 46 ] |
| 組換えヒト ACE2 | ウイルス細胞の侵入をブロック | [ 47 ] |
| オセルタミビル | ウイルスのエキソサイトーシスを妨げる | [ 48 ] |
| ソフォスブビル | ウイルス RNA 依存性 RNA ポリメラーゼ (RdRp) に結合します。 | [ 49 ] |
| バリノマイシン | S期キナーゼ関連タンパク質を阻害 | [ 47 ] |
| バリシチニブ | ウイルス侵入とサイトカインストームの両方を標的に | [ 50 ] |
| ゾタチフィン | 宿主の翻訳機械を介した cap 依存性 mRNA の翻訳を阻害します。 | [ 51 ] |
| ヘパリン | ウイルスのスパイクタンパク質と細胞受容体の相互作用を阻害し、ウイルスの侵入をブロックします | [ 16、52 ] |
I型インターフェロン(IFN)は、強力な抗ウイルス活性を持つサイトカインとしてよく知られており、ウイルスを直接標的とするのではなく、自然免疫を活性化することで作用する。しかし、IFNは重度のCOVID-19に進行する際に炎症反応を悪化させるようなので[53]、IFN治療のタイミングと投与期間は慎重に検討する必要がある。さらに、IFNsの投与は、ACE2受容体の発現を増加させることで、実際に細胞性SARS-CoV-2の侵入を増加させる可能性がある[54,55]。
ヒドロキシクロロキンは、マラリアや一部の自己免疫疾患の治療に使用されていた。アフリカミドリザルの腎臓細胞モデルにおいて、ヒドロキシクロロキンがSARS-CoV-2を強力に阻害することが示された。しかし、最近の研究では、肺由来の上皮細胞であるCalu-3細胞では、ヒドロキシクロロキンはほとんど抗ウイルス活性を示さないことが明らかになった[46]。さらに、ヒドロキシクロロキンは、ヒト気道上皮を再構成したモデルやヒト臨床試験において、抗SARS-CoV-2効果を発揮することができなかった[56,57]。効果がないだけでなく、ヒドロキシクロロキンを使いすぎると、細胞のリソソーム親和性のために、網膜、肝臓、心筋細胞などの複数の組織損傷を引き起こす可能性がある[58,59]。そのため、COVID-19の患者には、単独または他の抗ウイルス剤との併用で、高用量のヒドロキシクロロキンは推奨されなかった。
パンデミックの発生以来、COVID-19患者の治療にはロピナビル/リトナビルが広く使用されていた[60]。しかし、最近の研究では、入院中のCOVID-19患者に対してロピナビル・リトナビルはほとんど効果がないことが示された[43,61]。ロピナビル/リトナビルに加えて、ウミフェノビルとオセルタミビルもCOVID-19患者に緊急に使用されている。しかし、COVID-19に対するこれらの薬剤の有効性については議論の余地があり、特に最近の臨床試験では、COVID-19にこれらの薬剤を使用することの利点を示すことができなかったことを考えると、議論の余地がある[62,63]。
低分子量ヘパリン(LMWH)の適用は、COVID-19患者の中には肺血栓塞栓症を起こす者がいることが報告されており、疾患の後期には肺線維症などの重篤な障害に進行する可能性があることに由来している。重症のCOVID-19患者の血栓塞栓症の予防には、LMWHの使用が推奨されている。メカニズム的には、SARS-CoV-2の細胞侵入ステップは、ウイルスのスパイクタンパク質とヘパラン硫酸の相互作用に依存していると考えられている。この相互作用は、ヘパリンや合成ヘパリン類似物質によって阻害され、ウイルスの侵入を阻止することができる。また、COVID-19患者の治療にヘパリンを使用することによる副作用も報告されている。例えば、ヘパリンの使用は、10~15%の重大な出血のリスクと関連していることがわかっている[52]。
Tocilizumabは、低酸素状態と全身性の炎症を伴う入院中のCOVID-19患者の生存率とその他の臨床転帰を改善することが報告されている[64]。しかし、最近の無作為化患者研究では、トシリズマブは、機械的換気という複合的なアウトカムを発症する可能性を減少させることができたものの、患者の生存率を改善することはできなかった[65]。また、ヤヌス関連キナーゼ(JAK)アイソフォーム1および2(JAK1およびJAK2)の阻害剤であるバリシチニブも、SARS-CoV-2に対して優れた抑制効果を示した。2020年3月~4月に601名の患者を対象に実施された臨床試験では、中等度重症のSARS-CoV-2肺炎患者83名にバリシチニブが投与された。この研究では、高齢者の大規模コホートにおいて、バリシチニブが死亡率を71%減少させたことが示された[50]。最近では,FDAに承認されている約3000種類の薬剤を対象としたスクリーニングの結果,Huh7.5細胞(IC50:0.87μM)とCalu-3細胞(IC50:3.7μM)の両方において,シクロスポリンがSARS-CoV-2に対してマイクロモルのIC50を示すことが明らかになった[46]。
3. ヒスタミンとCOVID-19
マスト細胞は、寄生虫、細菌、ウイルスなどの感染を防ぐために重要な役割を果たしている。興味深いことに、SARS-CoV-2侵入の2つの主要な宿主因子であるACE2受容体とTMPRSS2は、マスト細胞にも発現していた[12]。SARS-CoV-2に感染すると、マスト細胞が活性化され、ヒスタミンなどの炎症性メディエーターが放出される[13]。ヒスタミンは、肺、皮膚、消化管などに多く存在する内因性の生体アミンで、炎症反応を媒介する。ヒスタミン受容体は,Gタンパク質共役型受容体(GPCR)の一種であり,4種類のヒスタミン受容体(H1受容体,H2受容体,H3受容体,H4受容体)が同定されている[26]。H1受容体は,中枢神経系だけでなく末梢組織にも発現しており,いくつかのアレルギー反応を媒介していることがわかっている[26]。H2受容体は,胃組織に多く発現しており,胃酸の分泌を促進し,消化管の運動を司っている[66]。H3受容体は、主に中枢神経系に発現しており、末梢神経系にはあまり発現していないが、様々な神経伝達物質の放出を制御している[67]。H4受容体は、骨髄や白血球に豊富に存在し、マスト細胞の走化性を制御している[26]。
COVID-19患者の最大20%は、肺の炎症反応が亢進した結果、重篤な臨床経過をたどる。この肺の炎症は、SARS-CoV-2感染時のヒスタミン放出と関連している[13](図2A)。H1受容体は,7つの膜貫通ドメインと細胞外のNH2末端のグリコシル化ドメインを含むGαq/11受容体である。H1受容体へのヒスタミンの結合は,肺の炎症を制御することが確認されている[68]。ヒトでは、Th2サイトカインレベルは、喘息で観察される炎症反応と密接に関係している。以前の研究では、アレルゲンチャレンジを受けたH1R-/-マウスは、WTマウスに比べて肺のTh2サイトカインレベルが低いことが示され、H1Rを介したTh2細胞のアレルギー性炎症部位へのリクルートが重要な役割を果たしていることが示唆された[68]。さらに、ヒスタミンはH1受容体を介してTh1型反応を増強するが、ヒスタミンによるTh1およびTh2反応の抑制はH2受容体を介して観察されることが明らかになった。したがって,H1受容体の遮断はインターフェロンγの放出を抑制することができ,SARS-CoV-2感染による炎症の抑制に有効であると考えられた[69].
図 2. SARS-CoV-2に対するH1受容体拮抗薬の潜在的な抗ウイルスメカニズム

SARS-CoV-2に感染すると、ヒスタミンが放出され(A)NF-κBシグナルが活性化され(B)炎症反応が亢進してその複製が促進される[81]。ヒスタミンを介したNF-κBシグナルは、上流のホスホリパーゼC(PLC)やプロテインキナーゼC(PKC)の活性化と関連している[82]。ヒスタミンによるNF-κBの活性化は、H1受容体アンタゴニストによってブロックすることができる[83]。H1受容体拮抗薬は、H1受容体依存的または非依存的なメカニズムでNF-κBシグナルを阻害する可能性がある[84]。
4. H1受容体アンタゴニストによるSARS-CoV-2の阻害
4.1. In VitroおよびIn Silico研究
H1受容体拮抗薬は、抗SARS-CoV-2薬として有望であるという新たな証拠が報告されている。H1受容体拮抗薬であるドキセピンは、SARS-CoV-2スパイク偽ウイルスがACE2-HEK293T細胞に侵入するのを防ぎ、感染率を25.82%減少させた[71]。ドキセピンの抗ウイルス効果は、セロトニンとノルエピネフリンの再取り込みの阻害に依存している可能性があり[72]、さらなる検討が必要である。ヒドロキシジン、ジフェンヒドラミン、アゼラスチンは、SARS-CoV-2の表面糖タンパク質をシュードタイプしたレンチウイルスを用いてACE2を発現したHEK293細胞に感染させたモデルにおいて、SARS-CoV-2に対して直接的な抗ウイルス活性を示すことが示された[73]。また、クレマスチンやクロペラスチンなどの承認薬も、Vero細胞におけるSARS-CoV-2を強力に阻害することが示された[51]。エバスチンとメキタジンは、Vero細胞でSARS-CoV-2をそれぞれ6.92および7.28μMのIC50値で阻害した[74]。注目すべきは,エバスチンの抗ウイルス活性は細胞型に依存しており,Vero細胞での抗SARS-CoV-2効果はHuh7.5細胞の10倍であったことである[46]。ロラタジンは,花粉症などのアレルギー疾患の治療薬として処方されているH1受容体拮抗薬である。最近,ロラタジンは,Caco-2細胞においてSARS-CoV-2を15.13μMのIC50で阻害することが報告された[75]。また,デスロラタジンは,ACE2過剰発現HEK293T細胞におけるSARS-CoV-2疑似型ウイルスの侵入を阻止することができ,デスロラタジンの抗ウイルス作用はロラタジンと比較して強かった[76]。さらに、クレミゾール塩酸塩は、Caco-2細胞におけるSARS-CoV-2(BavPat1株)を阻害することが明らかになった[77]。プロメタジンとテルフェナジンは、呼吸器上皮におけるSARS-CoV-2のエンドサイトーシスを阻害することが示唆されている[78]。第2世代のH1受容体拮抗薬であるルパタジンもCOVID-19に再利用されている[79,80]。肺上皮細胞におけるSARS-CoV-2に対するH1受容体拮抗薬の抗ウイルス効果を確認するには、さらなる研究が必要である(図2)。
4.2. 患者レベルの研究
最近の疫学研究では,H1受容体拮抗薬を服用している患者はSARS-CoV-2感染に対する耐性が高いことが報告されている[73]。さらに、スペインのタラゴナ地方で行われた観察研究(50歳以上の79,083人)では、H1受容体拮抗薬服用群のSARS-CoV-2感染リスク(PCR陽性率)が有意に低いことが示されている[85]。そのほか、H1受容体拮抗薬に加えてアジスロマイシンを投与することで、SARS-CoV-2に感染した高齢者の重症化を防ぐことができた[86]。セチリジン塩酸塩は、第二世代のH1受容体拮抗薬である。最近、セチリジンとファモチジンでH1/H2受容体をブロックすると、COVID-19患者の肺症状が緩和されることが示された。肺症状の緩和は、おそらくヒスタミンを介したサイトカインストームを最小化する役割に起因すると考えられている[87]。セチリジン以外にも、ロラタジン(1日10mg)とトリアムシノロン0.1%クリームの外用を併用することで、54歳の女性のCOVID-19感染の初期症状である発疹が完全に消失したという症例報告がある[88]。その他の完了済みおよび進行中の臨床試験を表2に示する。
表2 COVID-19に再利用されたヒスタミン(H1/H2)受容体拮抗薬の例。
| 薬 | 投与量 | 臨床試験 |
|---|---|---|
| シプロヘプタジン | 4mgを1日3回、10日間 | NCT04876573 |
| ファモチジン & N-アセチルシステイン | N-アセチルシステイン 600~1800 mg 1 日 3 回; ファモチジン 20~80mg 1日3回 | NCT04545008 |
| セレコキシブ & ファモチジン + レムデシビル | 80 mg を 1 日 4 回 7 日間、その後 40 mg を 1 日 2 回 14 日間コース | NCT04488081 |
| セチリジン & ファモチジン | セチリジン10mgを1日1回、ファモチジン20mgを1日2回10日間 | NCT04836806 |
| ファモチジン | 80mgを1日3回、最長14日間 | NCT04724720 |
上記の証拠を総合すると、H1受容体拮抗薬の再利用は、現在の状況下で新しい治療法を提供する有望な手段であることがわかる。さらに、H1受容体拮抗薬が一般的かつ安全に使用されていることを考慮すると、一般の人々のSARS-CoV-2感染のリスクを低下させるための魅力的な予防的候補であると考えられる。
5. 他のヒスタミン受容体拮抗薬の役割
H1受容体拮抗薬と同様に,H2受容体拮抗薬もHCVやHIVを含む様々なウイルスを抑制する可能性がある[89]。分子ドッキングの結果,H2受容体拮抗薬(シメチジン,ファモチジン,ニザチジン,ラニチジン)がSARS-CoV-2の構造タンパク質に結合できることがわかった。さらに、ファモチジンとシメチジンは、ニザチジンとラニチジンに比べて、ウイルスタンパク質に結合しやすいことがわかった。さらに、キナーゼエンリッチメント解析により、ERK、SMAD、MAPKなどの遺伝子がSARS-CoV-2に対するファモチジンとシメチジンの抗ウイルス活性に関与していることが予測された[89]。in silicoモデリングに加えて、以前のレトロスペクティブコホート研究では、ファモチジンによる治療が死亡リスクの低下と強く関連していることが示されている[90]。COVID-19(NCT04834752)では、これらのH2受容体拮抗薬が陽性率や臨床結果に及ぼす影響を評価するため、別のレトロスペクティブ・スタディが進行中である。最近では、非ランダム化非対照臨床試験で、セチリジンとファモチジンの併用治療が良好な予後に有効であることが示唆された[87]。実際、SARS-CoV-2感染症に対するファモチジンの有効性については、一貫した結果が得られていない。入院中のCOVID-19患者を対象としたケーススタディでは、ファモチジンの使用によりCOVID-19の臨床症状が一晩で緩和されることが示された[14]。しかし、試験管内試験の研究では、多能性幹細胞由来のヒト腸管オルガノイドモデルにおいて、ファモチジンはSARS-CoV-2感染を抑制できないことが明らかになった[91]。注目すべきは、COVID-19の症状の改善が高用量のファモチジンの経口投与と関連していることである。COVID-19患者10名に高用量経口ファモチジンを11日間投与した(80mgを1日3回投与)。治療後、すべての患者は、末梢酸素飽和度の増加など、COVID-19の臨床症状の改善を示した[92]。しかし、ファモチジンは消化管での吸収や分布容積が小さいため、静脈内投与が推奨されていた。また、ファモチジンは多くの国で安全な薬剤として一般的に使用されているが、この薬剤の服用中にせん妄の増加が観察された[93]。これらを総合すると、COVID-19患者におけるファモチジンの有効性と投与経路について、さらに評価する必要がある。H2受容体の他に、H4受容体もCOVID-19の潜在的な標的として同定された[94]。H1受容体拮抗薬とH4受容体拮抗薬を併用することで、SARS-CoV-2による肺の炎症をより効果的に抑えることが示唆されている[90]。
6. H1受容体拮抗薬の抗SARS-CoV-2メカニズムの可能性
前臨床データによると,H1受容体拮抗薬は,エボラ/マールブルグウイルス[95]やC型肝炎ウイルス(HCV)[96]のウイルス侵入を制限することが示唆されているが,これらの抗ウイルス作用を説明する分子経路はまだほとんど不明である.例えば、ジフェニル-ピペラジン類(例:クロルシクリジン、シクリジン、ヒドロキシジン)シクロヘプテン-ピペリジン類(例:シプロヘプタジン、ケトチフェン、ロラタジン、デスロラタジン)フェノチアジン類(例:メキタジン、トリメプラジン)は、HCVの細胞侵入を阻害することがわかっている。興味深いことに、これらの薬剤の潜在的な抗HCVメカニズムは、H1受容体とは独立していると思われる[97]。
6.1. SARS-CoV-2感染の初期段階への介入
HCVやエボラと同様に,H1受容体拮抗薬は,ウイルス複製の初期段階への介入を介してSARS-CoV-2の感染を抑制する可能性もある。H1受容体拮抗薬は,ACE2と結合することで,SARS-CoV-2が細胞宿主に侵入するのを防ぐ可能性がある[73].さらに、H1受容体拮抗薬は、SARS-CoV-2の複製の初期段階に関与する小胞体常駐シャペロンタンパク質であるシグマ受容体-1(ヒドロキシジンおよびジフェンヒドラミン)と結合することで、SARS-CoV-2の感染を阻害することが示された[51,73]。ヘパリンは、ヘパラン硫酸を含むグリコサミノグリカン分子に属する。ウイルス侵入の際、SARS-CoV-2のスパイクタンパク質は、細胞内のヘパラン硫酸とACE2の両方と相互作用することが明らかになっている[16]。したがって、外因性かつ競合的なヘパリン模倣薬によってヘパラン硫酸とスパイクタンパク質の間の相互作用を阻害すれば、SARS-CoV-2ウイルスが細胞内に侵入するのを制限することができ、その結果、炎症反応を抑制することができる[98]。ヒスタミンは、ヘパラン硫酸に結合する能力があることが示されている[99,100]。H1受容体アンタゴニストが媒介する抗SARS-CoV-2活性へのヘパラン硫酸の関与を調べることは興味深いことである。
H1受容体とは異なり、H2受容体拮抗薬の抗SARS-CoV-2メカニズムとしては、ファモチジンによるType 2膜貫通型セリンプロテアーゼ(TMPRSS2)と3-chymotrypsin-like protease(3CLpro)の阻害が提案されている[101]。しかし、最近の研究では、COVID-19の症状を和らげるファモチジンの主な作用機序は、H2受容体活性に対するオンターゲット効果に起因しており、競合法によって決定される他のヒスタミン受容体とは独立している可能性が高いことが明らかになった[14]。最近では、ファモチジンとシメチジンが、NSP3,NSP7/8複合体、NSP9などの非構造タンパク質を阻害することで、SARS-CoV-2の複製を抑制することが、分子ドッキングの結果から示唆されている[89]。ファモチジンの抗SARS-CoV-2活性の作用機序については、さらに明らかにする必要がある。
6.2. H1受容体アンタゴニストによるNF-κBを介した抗ウイルス作用
H1受容体にヒスタミンが結合すると,細胞内の炎症が活性化されることが知られている。この活性化は,ホスホリパーゼC(PLC)[82],プロテインキナーゼC(PKC),およびNF-κBのシグナル伝達経路によって媒介された(図2B)[102].我々の最近の実験結果では,デプトロピンがHEVの複製を強力に阻害することが示された。デプトロピンの抗HEV作用は,NF-κB活性の阻害を必要とし,H1受容体には依存しないと考えられている[28]。興味深いことに、肺上皮細胞におけるNF-κBの活性化は、SARS-CoV-2の伝播を促進することがわかっており、H1受容体拮抗薬は、肺上皮細胞におけるNF-κBの活性化を抑制することができた[81,84]。以上のことから、H1受容体拮抗薬がSARS-CoV-2を抑制するメカニズムとして、NF-κBに対する抑制作用が考えられると推測される[28]。なお、H1受容体拮抗薬は、H1受容体依存性および非依存性のメカニズムでNF-κBを阻害することができる[84]。H1受容体拮抗薬が媒介する抗SARS-CoV-2効果におけるH1受容体とNF-κBシグナル経路の関与は興味深く、さらなる検討が必要である。
6.3. その他の抗ウイルス機構の可能性
H1受容体拮抗薬が抗ウイルス作用を発揮するという観察結果は、H1受容体の生理作用が主にアレルギー性炎症に限定されているという従来の見解よりもはるかに広い範囲に及ぶという最近の観察結果ともよく一致する。内因性ヒスタミンは、H1受容体の活性化を介して肝臓でオレイルエタノールアミドの生合成を刺激し、肝臓のケト化を調節する[103]。疫学的証拠および前臨床研究によると、H1受容体拮抗薬は、食物摂取量、体重、および肥満の増加と関連することが示されている[104]。また,H1受容体は,細胞の代謝制御にも重要な役割を果たしていることが示された。マウスのH1受容体を遺伝的に欠失させると、腹部の脂肪率が上昇し、耐糖能異常が生じる[105]。代謝と免疫反応は,細胞宿主をウイルスの感染から守る2つの基本的な生物学的プロセスである。興味深いことに、H1受容体は、アレルギー反応を制御するという役割を超えて、自然免疫を調節することができると提唱されている[106]。したがって、H1受容体のアンタゴニストによる遮断は、代謝と免疫反応のクロストークを介して、SARS-CoV-2の複製に影響を与える可能性がある。
7. 機会と課題
H1受容体拮抗薬をCOVID-19の治療に応用することには様々な利点がある。まず、これらの薬剤は比較的安価であり、容易に使用することができる。第二に、慢性的な炎症が病態の主要な原因ではないかもしれないが、H1受容体拮抗薬を使用することで、炎症を抑えるという自然な役割により、患者の転帰を改善することができる。しかし、第一世代のH1受容体拮抗薬は、厳密にはH1受容体に選択的ではないことにも注意が必要である。H1受容体拮抗薬は、血液脳関門を通過する能力があるため、ドパミン作動性およびコリン作動性の反応のスペクトルに寄与し、中枢神経系に重大な副作用をもたらす[107]。さらに、H1受容体拮抗薬は、心筋チャネルを調節することができるため、鎮静、不眠、多動などの幅広い副作用を引き起こす[108]。その上、H1受容体拮抗薬は、発作感受性の増加と関連している[109]。したがって、ほとんどの場合、H1受容体拮抗薬は、てんかんまたは熱性発作を持つCOVID-19患者に処方することは推奨されない。COVID-19におけるH1受容体拮抗薬の臨床使用を妨げるもう一つの要因は、これらの薬剤による自然免疫応答の障害である[110]。
上述したように、ロラタジンとデスロラタジンの両方がSARS-CoV-2感染を抑制することができた。これらの薬剤は、H1受容体への選択性が高く、中枢神経系への副作用が少ない新世代のH1受容体拮抗薬である。また、ヒスタミンによる肺の炎症を抑えるだけでなく、他の多くの炎症活動を抑制することができるため[76]、COVID-19の過剰な炎症反応を緩和するための理想的な薬剤であると言える。全体として、H1受容体拮抗薬がウイルス性疾患を治療できることを記述した研究がある中で、最近の知見は、COVID-19の治療における根本的な抗ウイルスメカニズムとH1受容体拮抗薬の利点の理解に一歩近づいたと言えるであろう。今後、H1受容体拮抗薬を抗ウイルス剤として使用することにより、ヒスタミン受容体に対する本質的な作用を超えて、H1受容体拮抗薬がどのように作用するのかについての理解がさらに進み、COVID-19患者の実際の治療にも影響を与える可能性があると考えられる。

