Contents
Alzheimer’s Disease: Assessing the Role of Spirochetes, Biofilms, the Immune System, and Amyloid-β with Regard to Potential Treatment and Prevention
www.ncbi.nlm.nih.gov/pmc/articles/PMC5008232/
関連記事
要旨
アルツハイマー病はスピロヘータによって引き起こされる感染症であり、これらのスピロヘータはバイオフィルムを形成し、自然免疫系を惹きつける。
自然免疫系のファーストレスポンスであるToll様受容体2は、NF-κBとTNF-αの両方を生成し、これらはバイオフィルム内のスピロヘータを殺そうとするが、「スライム」を貫通することはできない。
NF-κB は、それ自体が抗微生物であるアミロイドβ(アミロイドβ)の生成にも関与している。アミロイドβもバイオフィルムを透過することができず、その蓄積が脳神経回路の破壊を引き起こす。
ペニシリンによる治療法(三次梅毒と同様、アルツハイマー病との比較対象)が概説されているが、バイオフィルム分散剤の追加が必要である。
キーワード
アミロイドβ, バイオフィルム, 自然免疫, スピロケテス, 治療法
アルツハイマー病の脳内でスピロヘータが発見されているところでは、それは感染症と考えられているかもしれない;これは最初に、そして最も重要な考慮事項である[1, 2]。また、慢性疾患であり、バイオフィルム関連疾患[3]であり、自己免疫疾患[4]でもある。さらに、衰弱する病気であり、社会的に破壊的な病気であり、非常に高価な病気であり、最後には致命的な病気である[5]。このレビューでは、この疾患のバイオフィルム部分と自己免疫反応に焦点を当てる。また、この最も不合理な疾患のための合理的な治療概念にも触れる。
アルツハイマー病の感染性は、スピロヘータ(歯科用およびライムの両方)が罹患した患者の脳内に存在することが示されたときに明らかにされた [1]。歯科用微生物は、歯垢が破壊され、歯科処置に続く菌血症が発生する時期に口腔内から移動する;すなわち、いつでも血液が見られる。海馬(これはアルツハイマー病における脳関与の初期部位である)は後咽頭から約4cmである。
ライムボレルリアは、多毛性紅斑病変に続く二次病期に血流を介して脳に移動する[6]。この二次性期は、発熱、筋痛、関節痛などの全身症状を特徴とする。スピロヘータは神経組織に親和性があり、血液脳関門を容易に通過する [7]。
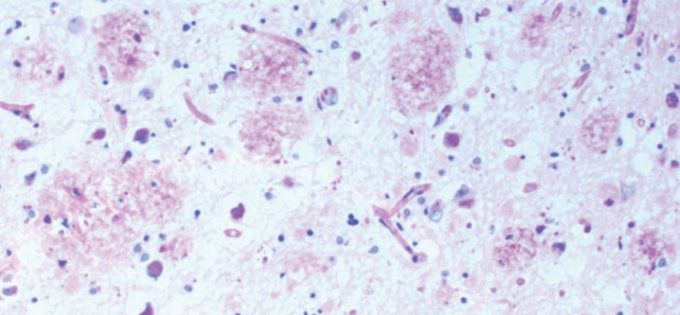
スピロヘータが脳内に入ると、(非常にゆっくりではあるが)付着し、分裂し[8]、増殖する。定足数に達すると、スピロヘータはバイオフィルムを紡ぎ始める(図1)[9]。これは、直径0.3ミクロンの約150個のスピロヘータ細胞に相当する(定足数に達するには、二次元培養プレート上に10個の細胞が必要である)。非常に遅い分裂のため、1つのバイオフィルムを作るのに十分な生物を蓄積するのに約2年かかる。バイオフィルムは、生物を「スライム」で包むことで、生物を保護し、生物の生存を確保するための反応である(図2)。
図1 バイオフィルムからなる海馬プラーク

アルツハイマー病脳斑:バイオフィルムの多糖類をPASでピンク色に染色。PAS 10X。Allenら[8]より。
図2 代表的なバイオフィルム(スライム)

“スライム “は肉眼での代表的なバイオフィルムを表す。Allenら[8]より。
他の疾患の他の生物は、異なる刺激を受けるとバイオフィルムを形成することがある。これらの刺激には、湿疹や癜風に見られるように、塩分や水が含まれる [10, 11]。低用量の抗生物質および定足数センシングは、乾癬 [12] および関節炎 [4] に見られる。さらに、高温およびアルコールや他の化学物質への曝露は、バイオフィルムを促進する [13]。
バイオフィルムが付着して形成された後のある時点で、自然免疫系が活性化され、バイオフィルムを破壊しようとする [8]。スピロヘータは弱いグラム陰性であるにもかかわらず、Toll様受容体2(TLR 2)が細胞外多糖類スライムに取り込まれた生物に対する最初の応答体であることが示されている(図3)[8]。TLR 2自体は、最近、バイオフィルム内の生物によって産生される「カーリ」繊維に引き寄せられることが示されている[14]。これらの繊維は、バイオマスの蛋白質部分の主要な構成要素であり、免疫原性を有するだけでなく、バイオフィルムの付着においても重要である。通常、TLR 2ではなくToll様受容体4がグラム陰性生物に反応する。
図3 アルツハイマー病患者の海馬におけるTLR 2

TLR 2(CD 282)が茶色く染色されている(活性化を表す)10倍。Allenら[8]より。
TLR 2は、骨髄分化経路D88(MyD88)によって生成される腫瘍壊死因子-α(TNF-α)によって主に死滅する。TLR 2は微生物をコーティングし(図4)核内因子-κB(NF-κB)とTNF-αの両方を生成する。これは、生物がプランクトン性(浮遊性)であり、バイオフィルム内ではない場合に殺傷に利用されるプロセスである。TLR 2もTNF-αもバイオフィルムを貫通することはできず、その結果、TNF-αが代わりに周囲の神経組織を破壊すると理論化されている[8]。
図4 カンジダ症のTLR2が酵母を被覆する
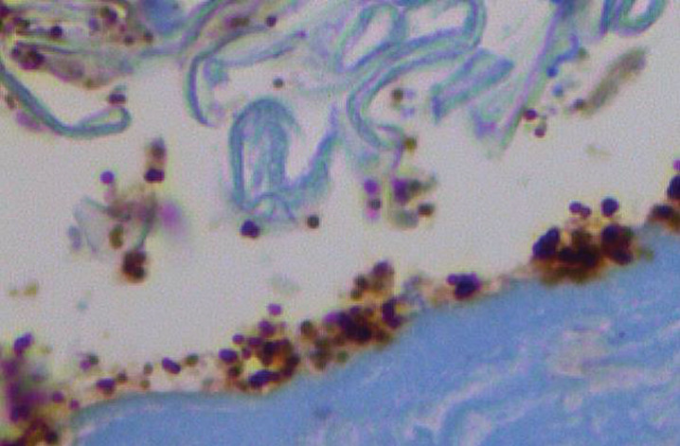
カンジダ症では活性化されたTLR 2が角質層中の酵母を被覆しているが、対照のTLR 2の位置は表皮基底層(CD 282)40Xである。Allenら[8]より。
ほぼ全ての生物はバイオフィルムを作る。前述したように、これらのバイオフィルムは、化学的、免疫学的、またはその他の有害物質から、その中に生息する微生物を保護する。バイオフィルムの大部分は、細胞外の多糖類で構成されている。バイオフィルムの内側と外側にはキュリー繊維があり、他のアミロイド繊維が入っている場合もあり、その目的は多糖類のインフラストラクチャーとして機能することである。また、バイオフィルム内には、微生物自身と同様に、DNAおよび水チャネルも存在する[15, 16]。
一般的に使用されている抗生物質はいずれもバイオフィルムを透過しない。また、自然免疫系でも適応免疫系でも、免疫分子はいずれも透過することができない。
通常、B細胞、免疫グロブリン、T細胞とそれらのサイトカインを含む適応免疫系は、血液脳関門によって脳から排除されている。つまり、外傷性脳損傷がその障壁を破壊するまでは、その時点でBリンパ球とIgGが大脳に殺到する[17]。これらの免疫原は、補体、補欠、キラーT細胞、サイトカイン(TNF-αなどを含む)で殺する。アルツハイマー病のプラーク周辺の脳組織の殺傷は、適応免疫系の方がはるかに早く、はるかに破壊的である。これが、脳血管事故後3年以内にアルツハイマー病が発症する理由であることは間違いないが、通常、発症には30~50年かかる。さらに、それはおそらく慢性外傷性脳症(CTE)が多くの脳震盪[8]の後に非常に急速に進行している理由のほとんどである。脳震盪は、絵的にも実質的にもエクシモシスと考えられ、出血性脳血管事故に匹敵する。CTEは現在、頭部外傷が頻繁に発生するナショナルフットボールリーグの惨劇である。
アミロイドβ(アミロイドβ)の役割の解明は困難を極めている。アミロイドβはアルツハイマー病の定数であり、実際には、それは多くの人が病原性であると考えられていた。しかし、アミロイドβは最近になって抗菌性であることが示され [18] 、さらに最近になってその形成への経路が明らかにされた [19, 20] この経路(図5)は、TLR 2によって活性化されたMyD88経路に由来する。TLR 2によって生成されたTNF-αは、TNF-α変換酵素(TACE)と共役してαセクレターゼとなり、アミロイド前駆体タンパク質(APP)を分裂させてアミロイドαを作る。同じMyD88経路で生成されたNF-kBは、アミロイドβ変換酵素(BACE)とともに、APPを切断するβおよびγセクレターゼを活性化する。その後、APPはアミロイドβとなり、バイオフィルムを攻撃する(図6,7)7)が、バイオフィルムを貫通することはできない。その結果、APPはバイオフィルムを包み込み、その蓄積によって脳の神経回路を破壊してしまうのである。
図5 アミロイドβの発生のために考えられる経路

MyD88経路を介したアミロイドβおよびAαの産生のための模式図。Allenら[8]より。
図6

アルツハイマー病プラーク中のアミロイドβはPAS(バイオフィルム)と共局在している。PAS染色とアミロイドβ免疫染色の組み合わせ;バイオフィルムとアミロイドβ40Xの共局在化を示す。Allenら[8]より。
図7 アミロイドβ(左)とバイオフィルム(右)で染色されたアルツハイマー病の同一プラーク

左はコンゴ赤、右はバイオフィルムのFISH解析(Cy5赤ラベル)全く同じプラーク内のアミロイドβとバイオフィルムを示す。暗い部分は水の流れを示しており、バイオフィルムでは常に見られる。Alan MacDonald, M.D.は親切にもこの図を提供してくれた。
これは、自己免疫の本質、すなわち体が自分自身を攻撃していることである。その過程で、周囲の組織が破壊される。このようなケースは、湿疹のブドウ球菌や乾癬の連鎖球菌によって生成されるバイオフィルムの場合である;これらのバイオフィルムは、自然免疫システムを呼び出すと、組織破壊の全プロセスが動きに設定されている[4]。彼らは心の完全な破壊につながるので、アルツハイマー病の結果は、しかし、はるかに悲惨である。
アルツハイマー病の任意の治療は、これらのバイオフィルムを考慮しなければならない。そのような治療への道筋は、以前に梅毒の治療によって設定されている。梅毒は、その第三次形態(一般的な心神耗弱性麻痺)では、アルツハイマー病と全く同じ病態を持つことが示されている。どちらも同じプラーク、神経原線維のもつれ、アミロイドβ、タウタンパク質が存在している。
病態が同じで、両疾患がスピロヘータによって引き起こされ、スピロヘータがペニシリンに敏感である場合、合理的なアプローチは、梅毒と同じ治療スケジュールに従うことであろう[21]。この治療法では、第三次梅毒の発症前であればいつでもペニシリンの投与は治癒的である。アルツハイマー病についても同様のことが合理的に言える;三次疾患の発症前であればいつでもペニシリンを投与しても治癒する。ライム病は、梅毒と最も密接に関連しており、シャンクレに相当する進行性紅斑を呈する。ほとんどの場合、チャンクレ1回に対してマダニに咬まれた1回であるため、治療は合理的に同じになる可能性がある[7]。歯科生物の場合、曝露は継続的に行われるため、治療は患者の歯の健康状態に合わせて行う必要がある。ある状況では年に1~2回(あるいはそれ以上の頻度で)ペニシリンを投与することが想像できる(CTE?同じことが、アルツハイマー病のAPOE ɛ4遺伝子を持っているアルツハイマー病の “プレ “患者の5%のために言われる可能性がある。CTEは遺伝性疾患を模倣している。それは、任意の神経損傷は不可逆的であることを述べなければならない;したがって、この疾患コースの早期治療の重要性と緊急性。
認知症の初期段階にある患者の治療には、ペニシリン以上のものが必要であり、バイオフィルムを分散させる薬剤も必要である[22]。幸いなことに、そのような薬剤があり、多くの薬剤がすでにアルツハイマー病患者に採用されている。これらの薬剤には、フラン(シタロプラム)チオフェン(オランザピン)ピペリジン(ドネペジル)ピロール(アゾール)[25]ピロール(アゾール)[26]およびリファンピン[27]がある。例えば、ドネパジルは、抗コリンエステラーゼ阻害剤であるかもしれないが、バイオフィルムの分散作用もあるので、短期的には役立つかもしれないが、長期的には有害である。その分散作用は、潜在的に多くのプラークを作ることになるであろう。同じことがハロペリドールについても言えるかもしれない。
具体的には、初期の認知症に対しては、ペニシリンを点滴または内服(内服は1.2ムーを隔週3回投与)プロベネシド500mg2日分(排泄物を減少させてペニシリンの血清中濃度を上昇させるため)シタロプラム20mg1日分、リファンピン500mg2日分などの投与が考えられる。これらは他の薬剤の使用により調整することができる。これはいずれも成文化されていないが、現在の治療法は、スピロヘータを殺さずにバイオフィルムを分散させているため、有害である可能性が高い。以前のバイオフィルム内のすべてのスピロヘータは新しいバイオフィルムを作ることができるので、これは考えられる限り多くのより多くのバイオフィルムにつながるだろう。
他の主要な考慮事項は、それ自体でペニシリンとアルツハイマー病のための「潜在的な」段階で治療することである。おそらく、これは潜伏梅毒の治療に似ていると思われる。また、関節インプラントのために行われているのと同じように、歯科手術の前に治療することも重要である。その結果、歯科手術の場合は脳に到達する前に、潜伏期の梅毒の場合は脳にダメージを与える(バイオフィルムを作る)前に生物を治療することになる。梅毒は、その存在が血清検査で明らかになるので、実は違うのである。しかし、血清学的検査がアルツハイマー病に利用できるようになるまでは、本明細書で提案されているような治療が合理的であるように思われる。また、医療費の面でも、認知症患者の継続的なケアにかかる費用の面でも、比較的安価である。
アルツハイマー病の話は、その後、自然免疫系を活性化するバイオフィルムを作るスピロシェットの1つである。最初の応答者はTLR 2であり、TLR 2はNF-kBとTNF-αを生成するだけでなく、バイオフィルムに包まれたスピロヘータを殺す試みで組織を損傷するだけでなく、アミロイドβの生産につながる。これらはすべて認知症につながる。バイオフィルム分散剤を併用した殺菌性抗生物質による治療が最も合理的であるように思われるが、前に述べたように、神経学的損傷は不可逆的である。したがって、この疾患の経過の早期に治療することが最も重要である。