2022年12月30日
著:チャールズ・ピラー
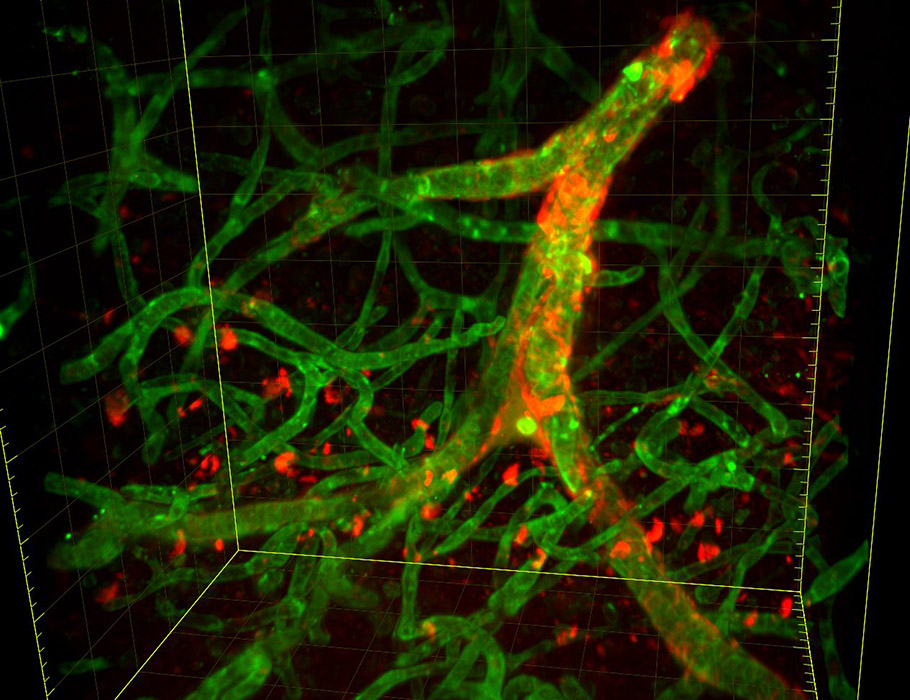
脳アミロイド血管症(βアミロイドの沈着(赤色)が血管の平滑筋(緑色)に取って代わる病態)を有するアルツハイマー病患者は、レカネマブと抗凝固剤を同時に服用すると、特に脳出血を起こしやすい。
今年初め、アルツハイマー病の進行を遅らせるために開発された有望な抗体の開発元が、現在進行中の実験薬の治験参加者に与えた重要な警告を強化した。日本のバイオテクノロジー企業であるエーザイは、血栓治療薬と並行してこの抗体を服用すると、致命的な脳出血のリスクが高まることを警告した。Science誌が入手した7月14日付けのインフォームド・コンセントの改訂版は、最近明らかになったレカネマブと血液凝固阻止剤の同時服用中に劇的な脳出血に見舞われた2人の死亡に、この抗体は関与していないという同社の主張を覆すものである。
この書式変更は、エーザイとその臨床試験パートナーが、最新の警告を試験参加者にどれだけ効果的に伝えたか、また、米国食品医薬品局(FDA)が2023年1月6日までに販売を承認する可能性があるとしている製品のリスクについて、同社がどれだけ透明性を保ってきたかについても疑問を投げかけるものである。
レカネマブ試験を実施する研究者に配布された同意書の改訂版では、血栓を抑える薬と抗体を併用することで死亡する可能性があることを参加者に伝えている。「レカネマブ)治療による大脳出血の全体的なリスクは低いのだが、血栓予防薬を服用している人ではリスクが高くなる。このリスクは100人に1人以上、100人に5人未満と推定される。「脳内出血は、特に血栓を予防する薬を服用している場合、重篤で死に至ることもある。本試験への参加を継続するか否かを決定する前に、治験責任医師と脳内出血のリスクを検討することが重要である」
血液凝固に作用する抗凝固剤やその他の薬剤は、アルツハイマー病患者を含む高齢者を苦しめる様々な病気に対して一般的に処方されている。そして、強力な血栓溶解剤であるtPAは、エーザイの試験でレカネマブを投与されたイリノイ州の女性が9月に経験したような脳卒中に対する標準的な治療法である、とサイエンス誌は以前報告した。彼女の夫によれば、彼女が病院に運ばれた後、主治医はこの薬に関する情報が掲載されたウェブサイトをチェックし、そこで読んだ情報に基づいて、tPAの注入は比較的リスクが小さいと判断したとのことである。
しかし、妻はすぐに叫び出し、発作を起こし、人工呼吸器をつけられ、数日後に死亡した。検死の結果、大量の脳出血が発見された。(家族のプライバシーを守るため、サイエンス社は女性とその夫の名前を伏せている)。
今年初め、このイリノイ州の女性は、レカネマブの臨床試験の同意書に署名し、抗体投与とプラセボ投与に無作為に割り付けられた。その同意書にはtPAの使用に関する直接的な警告はなかった。この同意書の抗凝固薬に関する文言も、特定の組み入れ基準を満たせばすべての試験参加者がレカネマブの投与を選択できる延長フェーズ用に書かれた改訂版よりも不吉なものではなかった。改訂版の文言がより強いものであったのとは対照的に、旧版には次のように記されていた:
「血栓を予防する薬と(レカネマブは)どちらも脳内出血のわずかなリスクを伴うので、出血のリスクについて治験責任医師と話し合う必要がある」
臨床試験の延長段階にある247の施設すべてが、最新の血栓症治療薬の警告を参加者に伝えたかどうか、あるいはどれだけ早く伝えたかは不明である。イリノイ州の女性の夫は、署名入りの最新の同意書を見つけることができなかった。
STAT誌は10月、心臓の病気で抗凝固剤を服用していた80代後半の男性も、延長段階で抗体投与中に脳出血を起こして死亡したと報じた。しかし、それは6月のことで、サイエンス社が入手した同意書の改訂日よりも前のことである。
サイエンス誌が今月初めに明らかにした延長試験参加者の3人目の死亡例では、7月25日にフロリダ州の女性が、新しい抗凝固剤の警告がないバージョンの同意書に署名した。そして9月、彼女は脳卒中のような症状を経験した後、抗凝固剤ヘパリンの最小限の投与を受けた。(この同意書とこの女性の医療記録は、この女性の娘から提供されたもので、家族のプライバシーを守るために名前は伏せられている)。
Science誌のためにこの女性の記録を再検討した神経科医は、ヘパリンが彼女の死に大きく寄与したとは考えず、抗体だけが原因であるとした。しかし、何人かの科学者は、彼女のケースと他のケースを合わせると、米国の規制当局は、たとえレカネマブを承認するとしても、レカネマブに関連する潜在的なリスクを消費者に明らかにすべきであると述べている。
カルガリー大学の神経科医であるエリック・スミス氏は、「さらなるエビデンスが得られるまでは、現時点では最高レベルの警告(レカネマブと血液凝固阻止剤の併用に関する『黒枠』の警告)が適切と思われる」と言う。スミス氏はエーザイのパートナーであるバイオジェン社のコンサルタントをしたことがあり、両社が開発したアデュカヌマブ(Aduhelmとして販売)と呼ばれる抗アミロイド抗体の臨床試験にも携わったことがある。
エーザイは、レカネマブ試験に関するこれまでで最も詳細な結果を発表した11月の学術集会で、プレゼンテーションのスライドに、延長相の患者について「抗凝固薬の併用による脳出血のリスク増加に関するインフォームド・コンセントの文言付きで、抗凝固療法の継続が許可された。」と記載した。
同社はScience誌の質問に対し、同意書を変更した時期や理由、延長試験参加者のうち何人が更新された警告を受け取り署名したかについて、直接回答しなかった。エーザイの広報担当者はScience誌の取材に対し、同社、独立した専門家、FDA、その他の規制当局により、臨床試験から得られた安全性情報が評価されていると述べた。エーザイは、インフォームド・コンセントの改訂(バイオセーフティ・ボードによる承認が必要)を含む「重要な安全性情報を、治験責任医師や患者だけでなく、これらすべての関係者に速やかに伝達する」と声明は述べている。「エーザイは、当グループの試験で使用されたインフォームド・コンセントは、lecanemabに関連する既知のリスクを正確に記述していると確信している。
スミスは、エーザイのレカネマブ臨床試験の同意書の取り扱いについて特にコメントを避けた。しかし、「一般的に、会社はすべての潜在的リスクについて可能な限りオープンで透明であることがより良い結果をもたらす」と述べた。
さらにスミスは「医師と患者が、将来この治療法がFDAによって承認された場合に、その使用について重要な決定を下すために必要なすべての情報を得ることができるように、これらのリスクの頻度と性質を理解することに投資すべきである」と付け加えた。スミスは、フロリダの症例の医療記録を検討し、レカネマブが明らかにこの女性の死に関与していると結論づけた数人の科学者の一人である。
レカネマブは、他の多くの実験的アルツハイマー病治療薬と同様、βアミロイドを標的としている。βアミロイドは、アルツハイマー病患者の脳細胞の外側にあるタンパク質の塊である。このようなタンパク質の沈着は一見健康な人の脳にも見られるが、多くの神経科学者によれば、βアミロイドのある形態が脳細胞を死滅させるプロセスを引き起こし、衰弱性痴呆や死を引き起こすという説を支持する証拠が多数あるとのこと。
そのため、いわゆるアミロイド仮説の支持者たちは、アルツハイマーの初期症状を持つ約1800人を対象とした、最近終了した第3相レカネマブ試験の結果に興奮したのである。この抗体の点滴を受けた人は、プラセボを投与された人よりも平均して27%認知機能が低下した。
しかし、そのような違いが患者に感じられるかどうかについては、神経科医の間でも意見が分かれている。また、65歳未満、女性、APOE4(アルツハイマー病の発症リスクを高める遺伝子変異)を2つ持っている人という3つの重要なサブグループでは、統計的に有意な効果は認められなかった。
それでも、多くの科学者たちは、多くのアルツハイマー病患者がレカネマブを試すために潜在的に深刻な健康リスクを受け入れるだろうと述べており、コア試験では、この抗体はアデュカヌマブや他のアミロイド標的薬よりも脳の腫れや出血が少なかったようだ。同社はまた、コア試験における治療群とプラセボ群の死亡率は同等であったと報告している。しかし、各死亡の詳細は明らかにされておらず、一部の外部の科学者をいらだたせている。
一部の神経科医がレカネマブとの関連性を指摘し、メディアで報道された非盲検延長期間中の3件の臨床試験死亡事故は、FDAによる承認が広く期待されているこの薬について、アルツハイマー病の専門家の間に懸念を呼び起こした。FDAがレカネマブについて十分な精査を行なわないのではないかと心配する声もある。批評家によれば、FDAはその有効性に疑問があるにもかかわらず、この高価な治療薬を承認したとのことである。そして昨日、米国下院の委員会は報告書を発表し、「FDAのアデュヘルムの審査と承認は非典型的な手順で行われ、FDA自身のガイダンスから逸脱していた」と指摘した。その中で、FDAとバイオジェン社が不適切に協力し、FDAが抗体の安全性と有効性を検討するために外部アドバイザーを招聘した。
ペンシルバニア大学ペンシルバニア・メモリーセンターの共同責任者であるジェイソン・カーラウィッシュは、レカネマブを取り巻く熱狂は正当なものだと言う。しかし、彼の同僚の多くは、血液凝固阻止剤を服用している人にはこの抗体を処方しないだろう、とカーラウィッシュは言う。
マウントサイナイ医科大学アイカーン校の神経科医で神経科学者のサム・ガンディ氏は、アルツハイマー病患者によく見られる脳アミロイド血管症(CAA)の患者についても心配している。レカネマブを投与される可能性のある患者のCAAを診断することは、主要医療センターから遠く離れた地域の医師にとっては困難な課題である、と彼は指摘する。この病態は、レカネマブのような抗アミロイド薬との併用で脳腫脹や出血を起こしやすくし、抗体と抗凝固剤を併用するリスクを助長する。
FDAがレカネマブを承認したとしても、その使用に条件を加える可能性がある。例えば、黒枠警告ラベルを要求することに加えて、FDAはレカネマブを「重大な安全性懸念」のある医薬品のためのFDAのリスク評価・緩和戦略(REMS)プログラムに登録することを要求することができる。REMSは、新薬を処方する医師が副作用を注意深く監視し、FDAに報告すること、その薬剤を適格な医療環境で投与すること、医師が危険な副作用の可能性を高める可能性のある状態(今回のCAAのような)を患者に検査する方法について研修を受けることを要求することができる。
REMSは、「リスクがあると広く受け入れられている薬剤が、可能な限り安全な方法で使用される」ことを保証するのに役立つだろう、とKarlawishは言う。彼は、「FDAはその仕事をする必要がある」と付け加え、REMSの指定にどのような特徴を含めるべきか、専門家諮問委員会を設置し、レカネマブとの抗凝固剤の同時使用に黒枠警告(通常、死亡のリスクを示す)を付けるべきかどうかのガイダンスを含め、意見を求めるという。
抗凝固薬、tPA、抗血小板薬など、脳出血を引き起こす、あるいは脳出血のリスクを増加させる可能性のあるすべての薬物について、黒枠警告の必要性を評価すべきであるというのがガンディ氏の意見である。彼はまた、レカネマブの投与を受ける可能性のある患者に遺伝子検査を行い、APOE4のステータスを確実に把握させることを支持している。レカネマブ試験の完了したコアフェーズでは、この遺伝子変異を少なくとも1コピー持っている参加者は、脳の腫脹と出血の割合が非常に高かった。
エーザイは、レカネマブの安全性を評価する際、すべての重篤な有害事象を考慮すると述べている。エーザイは、製品ラベルに警告を記載すべきかどうか、あるいはFDAが承認した場合、この薬剤をREMSプログラムに含めるべきかどうかについてのScience誌の質問には回答しなかった。
