コンテンツ
www.ncbi.nlm.nih.gov/pmc/articles/PMC7846099/
Endocrinology. 2021 Mar; 162(3): bqaa171.
2020年9月23日オンライン公開
フレデリック・S・フォム・サール1,ローラ・N・ヴァンデンバーグ2
「害の証拠から公衆衛生政策へ」を参照。トンネルの先に光はあるのか?への回答。「Update on the Health Effects of bisphenol A: Overwhelming Evidence of Harm”” in volume 162, bqaa203.
論文「有害性の証拠から公衆衛生政策へ。トンネルの先に光はあるのか?への回答。「ビスフェノールAの健康影響に関する最新情報:有害性の圧倒的な証拠」(162巻、bqaa203)。
要旨
1997 年、内分泌学者による最初の 生体内試験 ビスフェノール A(BPA)研究は、妊娠マウスに BPA を投与すると、2μg/kg/day という低用量で雄の子孫に生殖に関する悪影響が生じることを報告した。その後,数千件の研究により、低用量のBPAを投与した動物に悪影響があることが報告されている。また、100 件以上の疫学調査において、動物実験と同様に BPA と疾患・機能障害の関連性が示唆されているにもかかわらず、規制当局は BPA の安全性を主張し続けている。そこで、CLARITY-BPA試験では、従来の毒性評価項目と最新の仮説に基づく疾患関連評価項目を同じ動物群で評価するように設計された。その結果,最低用量(2.5μg/kg/day)では、毒性,機序の両エンドポイントにおいて様々な有害事象が報告され、独立した専門家から、最低有害事象レベル(LOAEL)を現在の5万μg/kg/dayから2万倍に引き下げるべきとの意見が出された。内分泌学会のメンバーが、食品医薬品局(FDA)の仮定は内分泌学の基本原則に反すると批判したにもかかわらず、FDAは生物学的に妥当でないとしてすべての低用量データを拒否した。彼らの判断は4つの誤った仮定に依存している。すなわち、用量反応は単調でなければならない、影響がない閾値が存在する、男女とも同様の反応を示さなければならない、毒性学的ガイドラインの研究のみが有効である、などである。このレビューでは、20 年以上にわたる BPA 研究の詳細と、規制当局のアプローチと内分泌科学との間に存在する溝を明らかにしている。最終的に、CLARITY-BPAは、従来の毒性評価方法が内分泌かく乱化学物質の評価には不十分である理由に光を当てた。
キーワード 非単調な用量反応、閾値、バイオモニタリング、低用量、ガイドライン研究、内分泌かく乱物質
ビスフェノールA(BPA; CAS# 80-05-7)は、世界的に生産量の多い化学物質の一つであり、様々な製品に使用され、米国をはじめとするほぼ全ての人が暴露されていることから、過去20年以上にわたり、最も研究が進んだ内分泌かく乱化学物質(EDC)の一つになっている(1)。このミニレビューの第一の目的は、低用量のBPAがもたらす無数の健康被害に関する論争の錯覚の歴史と、バイオモニタリング研究のデータではなく、暴露モデルに基づいて予測されたヒトの暴露範囲内でBPAが影響を引き起こすことは不可能であると予測された歴史を簡単に紹介することである。この捏造された論争は、プラスチック業界が引き起こしたものであり、その後,規制当局が、何千もの機構的な試験管内試験実験や低用量動物実験,100以上の疫学調査から得られた有意な知見を無視して、永続させている。
本検討では、BPA の低用量とは、環境保護庁(EPA)/食品医薬品局(FDA)が定めた最低有害影響レベル(LOAEL)(2)以下の用量を指し、BPA の経口投与の LOAEL は現在 50 000μg/kg/dayであった。この LOAEL 未満の用量で有意な副作用が認められた場合,ヒトの日常的な曝露に対する「安全」量(FDA では ADI(acceptable daily intake)用量,EPA では参照用量と呼ばれる)の算出が下がるが、米国では現在この想定安全量を 50µg/kg/day と定めている。この想定安全量は、LOAELの1000倍低い量を生涯にわたって毎日経口摂取しても影響がないと仮定して算出されている(3)。
第二の目的は、最近の産学連携プログラム(CLARITY-BPA:Consortium Linking Academic and Regulatory Insights on BPA Toxicity)の結果を含め、低用量の BPA がヒトに及ぼす健康被害に関するエビデンスの現状をレビューすることである。CLARITY-BPAは、BPAの安全性に関して、ガイドラインに沿った研究(FDAによる規制研究)と、学術研究者が同じコホートからランダムに選んだ動物の組織を用いて行った仮説に基づくエンドポイントの結果を直接比較するもので 2012年に特別に作成されたものである。この共同研究は、米国環境保健科学研究所(NIEHS)が、FDAの国立毒性学研究センター(NCTR)が製造したラットの組織を用いて遺伝子やタンパク質の発現、エピジェネティックマーカー、形態分析、神経内分泌や行動の反応を調べる14の学術プログラムに資金を提供したものである。本試験は、GLP(Good Laboratory Practice)に準拠したプロトコルで実施され、品質管理および詳細な記録の保存が保証されており、FDAの基準に従って規制当局の判断に使用することが可能である(4)。
CLARITY-BPA プログラムの終了時には、FDA と NIEHS の研究者との契約により、FDA のガイ ドライン試験と研究者の知見を統合し、新たな BPA リスク評価に使用するためのコンセンサス出版が予定され ていた。しかし、FDAは、CLARITY-BPA研究の毒性学的ガイドライン部分を終了した直後,ピアレビューを受ける前に、BPAを「安全」であると宣言した(5)。しかし、CLARITY-BPA試験に参加した学術研究者の大多数は、FDAの発表した結論に同意していなかった(6)。独立した学術研究者の大多数は、学術研究者の研究とFDAのガイドライン研究のデータを統合した上で、FDAの許容一日摂取量(安全量)は、現在の推定「安全」量よりも2万倍低くあるべきと結論づけた(7)。残念ながら、FDAが学術研究者との共同作業を完了し、CLARITY-BPAの発足時に合意された成果であるコンセンサス出版物を作成する見込みはない。
BPAの安全性をめぐる論争は、連邦機関や化学企業に勤める規制毒性学者と、内分泌学の原理を学んだ科学者との間の深い溝を露呈することになった。内分泌学の原則とは、「低用量」効果や非単調な用量反応、ホルモンの性特異的・組織特異的作用の存在などを理解することだ。環境EDCによるホルモンの作用と内分泌機能の破壊を理解するために必要なのは、これらの内分泌学の原則である。複数の内分泌学会の科学的声明とポジションペーパーが、このレビューで議論するEDCの文献と論争をレビューしている(8-10)。また、内分泌学者による他のレビューでは、内分泌かく乱分野が内分泌学の下位分野として含まれる根拠を示すことが試みられている(11-13)。
内分泌かく乱化学物質であるBPAについて
BPAは、1936年にエストロゲン活性があることが発見され、雌ラットに注射すると膣上皮の角化を誘導することが示された。当時、化学者はエストロゲン化合物の構造特性を明らかにしようとしており(14)これは現在も続けられている(15)。BPAは、2個のベンゼン環と2個の(4,4′)-OH置換基を持ち、エストロゲン受容体(ER)αとERβの両方の結合ポケットに適合している(16)。BPAの作用機序として最も研究されているのはエストロゲン活性であるが(11, 17)その内分泌作用の機序はもっと複雑である(18)。BPAは核内ERアゴニストであるだけでなく、膜内ER(mER)Gタンパク質共役型受容体30(GPR30/GPER)のアゴニストでもあり、非常に低濃度でこれらの受容体を介して非天然迅速シグナル伝達カスケードを活性化できる(図1)(23-25)。BPAは甲状腺ホルモン受容体のアンタゴニストであり、3,5,3′-トリヨードサイロニンの正常な結合を阻害し(26,27),酵母レポーターアッセイのデータに基づいて、適度な抗アンドロゲン活性が報告されている(28)。また、BPAはエストロゲン関連受容体γ(29)やアリール炭化水素受容体(30)など、いくつかのオーファン受容体にも結合する。このようにBPAの影響を受ける受容体やシグナル伝達経路が多いことから、米国国立毒性プログラム(NTP)は、300以上の化学物質の中から3番目に高い毒性優先度指数(Toxicological Priority Index)を付与している(31)。さらに最近のKey Characteristicsのアプローチでは、BPAがEDCの10個の特性のうち9個を誘発することが明らかにされた(32)。さらに、BPAの第2相代謝物(BPA-グルクロニド,BPA-硫酸)はERアゴニストではないが、微量に生成する代謝物(4-メチル-2,4-ビス(4-ヒドロキシフェニル)ペント-1-エン;MBP)はBPAの約1000倍の生物活性を有していることが明らかになった。BPAからMBPに代謝されると、2つのフェノール環の間隔が広がり、MBPとERαおよびERβの接触は、BPAに比べてよりエストラジオール17βに近いものとなる(33)。
図1 BPAとエストロゲン受容体サブタイプとの相互作用
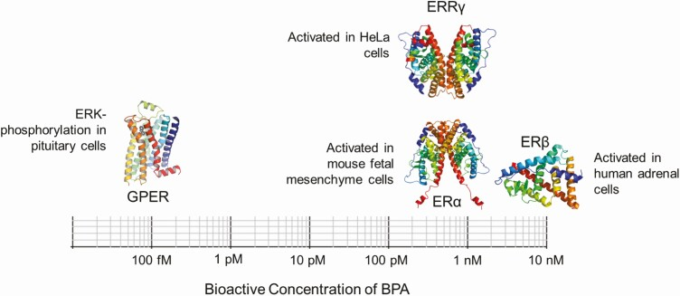
GPER(19),エストロゲン関連受容体γ(ERRγ)(20),ERα(21),ERβ(22)の各サブタイプを介して作用するBPAの生理活性濃度と、その効果が観察された細胞種を示している
BPAのERαに対するKd値は約370 nMであり(11)この受容体に対するエストラジオール17βのKd値よりも約3700倍低いため、BPAはしばしば「弱い」エストロゲンと呼ばれる。しかし、BPA(あるいは他のホルモン受容体作動薬)の効能は、特定の組織の特定の受容体サブタイプに対するリガンドの親和性とは等しくないため、この表現は誤りである。例えば、エストラジオール17βの生理的範囲は、ERαのKd(〜100 pM)よりも最大100倍低い(1〜10 pM、エストラジオール濃度と受容体占有率の間に高い比例関係がある)し、MCF-7細胞増殖の50%有効濃度(EC50)は、受容体占有率が約1%〜3%のときである(11)。
BPAは1〜10 nM(0.23-2.3 ng/mL)の範囲でMCF-7細胞の増殖を刺激し、1〜10 nMのBPA濃度で、初代培養の胎児尿生殖洞間充織のEsr1(ERα)およびアンドロゲン受容体Ar mRNA両方の転写活性を開始する(21, 34)。しかし、ヒトの血清中BPA濃度は1~10 nM程度であり(1),新しい直接測定法を用いた最近の知見では、尿中BPA濃度を測定する間接測定法を用いた過去の報告より、実際のBPA曝露量が有意に高いことが示されている(35)。さらに、マウスなどの母体曝露による胎児期の曝露では、はるかに低い血清BPA濃度が生物活性を示す(36-38)。また、マウス,アカゲザル,ヒトの経口投与によるBPAのトキシコキネティクスは類似している(39)。
ホルモンはそれ自身の受容体を制御することにより、それ自身に対する感受性を調節する(例えば、受容体のアップレギュレーションとダウンレギュレーション)。低用量では一般に受容体数が増加するが、高用量では抑制的になる(34, 38)。エストロゲンは他のホルモン系や酵素を調節するため、エストロゲン関連化学物質は多面的な影響を及ぼす。例えば、BPAはエストロゲンに対する組織の反応を変化させ(ERの発現を変化させる)プロゲステロン、アンドロゲン、オキシトシンなどの他のホルモンに対する反応も変化させる(34, 38, 40)。BPAはまた、アンドロゲンをエストロゲンに変換する酵素であるアロマターゼの活性を調節し、BPAと細胞内エストラジオールのダブルヒットを作り出す(例えば、BPAは胎児の前立腺間充織においてアロマターゼ活性と細胞内エストラジオールを増加させる(41, 42))。低用量のBPAは、マウス胎児の前立腺間充織におけるアンドロゲン受容体遺伝子の発現を増加させ、前立腺アンドロゲン受容体の永久的なアップレギュレーションを引き起こし、その結果、アンドロゲンに対する感受性が増加する(34, 43)。BPAおよび他のエストロゲン化学物質は、マウス胎児前立腺の基底細胞過形成を誘発するようであり(44)ラットではBPA処理により背外側前立腺幹細胞のコミットメントが基底細胞前駆細胞に移行し、発癌のリスクが増加する(45)。さらに、BPAの代謝物であるMBPは、性ホルモン結合グロブリンに結合するため、血中を循環するアンドロゲンおよびエストロゲンの遊離(生理活性)状態と結合状態の比率を乱す可能性がある。また、MBPはアンドロゲン受容体やプロゲステロン受容体にも結合し、それらの活性を阻害する(46)。
1950年代、BPAモノマーのエストロゲン活性を気にすることなく、ドイツのバイエル社と米国のゼネラルエレクトリック社の化学者は、BPAベースのポリマーであるポリカーボネートの製造に成功し、1958年に初めて市場に登場した(47)。1963年にFDAは、安全性に関する情報が公表されていないにもかかわらず、BPAを食品接触材料に使用することを承認した(48)。現在でもBPAは、再利用可能な食品保存容器や食品・飲料容器の裏地に使用されるエポキシ樹脂など、多くの消費者製品に使用されているポリカーボネート樹脂の構成成分である(49, 50)。BPAは、他の種類のプラスチック(ポリアクリレート、ポリアリレート、ポリエーテルイミド、ポリエステル、ポリエステル-スチレン、ポリスルホン、ポリエチレンテトラフタレート、ポリ塩化ビニルなど)にも酸化防止剤や硬化剤、安定剤として日常的に添加されている(51)。未重合(遊離)のBPAは、感熱紙表面の顕色剤,化粧品やパーソナルケア製品,医療機器やスポーツ用品,玩具,衣料品などに使用されている(52, 53)。BPAの人体への暴露は世界中で記録されており(54-56),大多数の人が複数の原因から1日に何度もこの化学物質に暴露されていることが示されている(57, 58)。
BPAの年間生産量が非常に多いこと(推定約100億kg)を考慮すると、BPAが主要な環境汚染物質でもあることは驚くには当たらない。米国地質調査所の報告によると、米国の埋立地からの浸出液から検出されたBPAの最大量は6.4 mg/Lであった(59)。また、埋立地の浸出物に関する別の研究では、日本で検出されたエストロゲン活性の84%がBPAであり(60),埋立地浸出物中のエストロゲン活性のほぼ全てがBPAであるとした米国の研究(61)と一致していた。
BPAに関する数千件の研究により、低用量でも有害であることが示されている
1997年、Nagelら(62)は、BPAが、エストラジオールとテストステロンの血中輸送に関与する高親和性血漿結合タンパク質である性ホルモン結合グロブリンへの結合が限定的であり、血中の遊離BPAの割合が増加することを見いだした(63)。この知見は、乳がん細胞MCF7におけるERα結合試験から得られた情報と合わせて、妊娠中の雌CD-1マウスに2μg/kg/日のBPAを経口投与すると、雄の子孫に前立腺肥大が生じ(62,63)さらに成熟期の雄子孫の他の生殖補助器官に悪影響があるという最初のBPA「少量」投与の知見をもたらすに至った(64)。このように、内分泌学者による BPA の最初の学術研究は、EPA や FDA が想定する LOAEL(50,000µg/kg/day) の 25,000 倍低い 2µg/kg/day の用量で悪影響が発生することを明らかにした(3)。
BPAに関するこれらの初期研究の後,2000年から2020年にかけて、この化学物質に関する数千件の研究が発表され、広範な健康被害に対するBPAの影響が記述されている。2005年以前は115件であったBPAの有害作用を報告する論文が 2011年には500件以上、そして2017年には1000件以上と、毎年指数関数的に増加している(図2)。幅広い分野の科学者、多くは通常、環境化学物質を調査しないような分野の科学者が、BPAが様々な臓器やシステムに影響を与えるかどうかを評価した。全体として、この広範な文献は、BPAが最も一般的な非感染性慢性疾患の多くに広く影響を及ぼし、正常な免疫機能の破壊が媒介因子であると考えられることを示している(67, 68)。
図2 2018年9月時点の動物実験(数千件)およびヒト疫学研究(100件以上)のビスフェノールA(BPA)の引用数に関するデータ
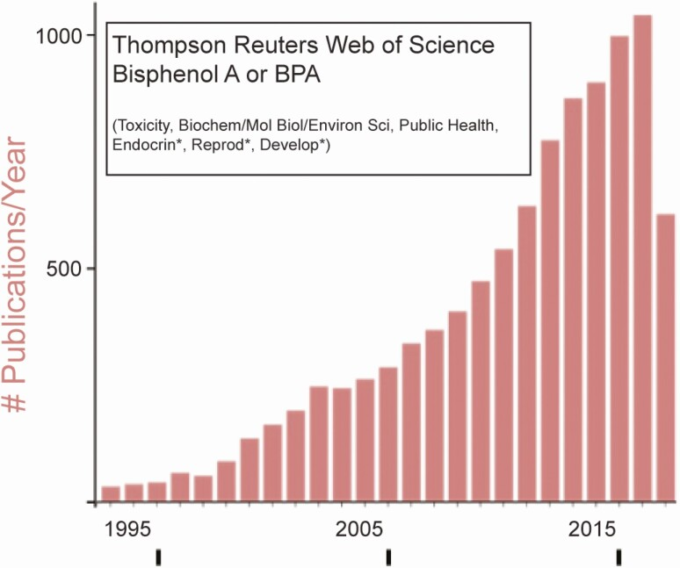
数値には試験管内試験のメカニズム研究は含まれていない。図は、Consortium Linking Academic and Regulatory Insights on BPA Toxicity(CLARITY-BPA)のガイドライン部分からの知見について、FDAのウェビナーで発表されたもの(66)より。FDA 2018 ビスフェノールA(BPA)。Toxicology and pharmacokinetic data to inform on-going safety assessments(継続的な安全性評価に情報を提供するための毒性学および薬物動態学データ)。FDA Grand Rounds, K.B. Delclos, September 13, 2018. …www.fda.gov/science-research/about-science-research-fda/bisphenol-toxicology-and-pharmacokenetic-dat (public domain)。
多くの包括的なレビューが、健康被害と暴露の推定に関するBPA文献の広さと深さを異なる時期に検討してきた。2007年には、一連の5つの文献レビュー(69-73)と、NIEHS主催のワークショップによるチャペルヒル合意声明が、「低用量のBPAへの出生前および/または新生児暴露は、実験動物の前立腺、乳房、精巣、乳腺、体格、脳の構造と化学、行動において組織変化を生じる」強い証拠があると結論付けた(74)。また、ヒトの健康状態や実験動物の知見を網羅し、同様の結論を導いている他のレビューも 2007 年以降に発表されている(13,38,67,75-79)。
ここでは、低レベルの BPA 暴露が動物実験とヒト実験の両方で健康への悪影響を及ぼすことを強調するいくつかの事例を示す(表 1)。前述した前立腺への影響は、周産期のBPA曝露が、成人のホルモン曝露に対する前立腺の感受性を高め、水腎症に伴う尿道閉塞(図3Aおよび3B)(80,81)前立腺炎、前立腺上皮過形成(図3C)さらに前立腺上皮内新生物(82)の発生率を高めることを示す研究にまで拡大してきた。) さらに後述するように、BPAの前立腺幹細胞への影響もPrinsらにより報告されている(45)。
表1.動物実験およびヒト疫学研究で報告された有害事象のリスト
| 結果 | 実験動物で観察 | 疫学研究における協会 |
|---|---|---|
| 代謝性疾患 | ||
| 肥満 | √ | √ |
| 耐糖能異常 | √ | √ |
| 2型糖尿病 | √ | √ |
| 高血圧 | √ | √ |
| 心血管疾患/機能障害 | √ | √ |
| 肝機能の変化 | √ | √ |
| 副腎過形成 | √ | |
| 神経および行動への影響 | ||
| 脳構造の性特異的変化 | √ | |
| エストロゲン作用の変化 | √ | |
| 攻撃的/攻撃的な行動 | √ | √ |
| 学習/記憶障害 | √ | √ |
| 男性の生殖 | ||
| 性欲減退 | √ | |
| 精子数、精子の質の変化 | √ | √ |
| 精原細胞の異常 | √ | |
| 尿道膀胱閉塞症と水腎症 | √ | |
| 減少した血清テストステロン | √ | |
| 前立腺肥大症、化生、新生物 | √ | |
| 女性の生殖 | ||
| 子宮筋腫 | √ | |
| 卵巣嚢胞、多嚢胞性卵巣症候群 | √ | √ |
| 染色体異常、卵母細胞 | √ | |
| 思春期の早期発症 | √ | √ |
| 乳腺の発達、過形成 | √ | |
| 乳がん | √ | |
| 発情周期/月経周期の混乱 | √ | |
| 血清エストラジオールの減少 | √ | |
| 流産のリスク | √ |
図3 発育期または成体におけるBPA曝露による悪影響
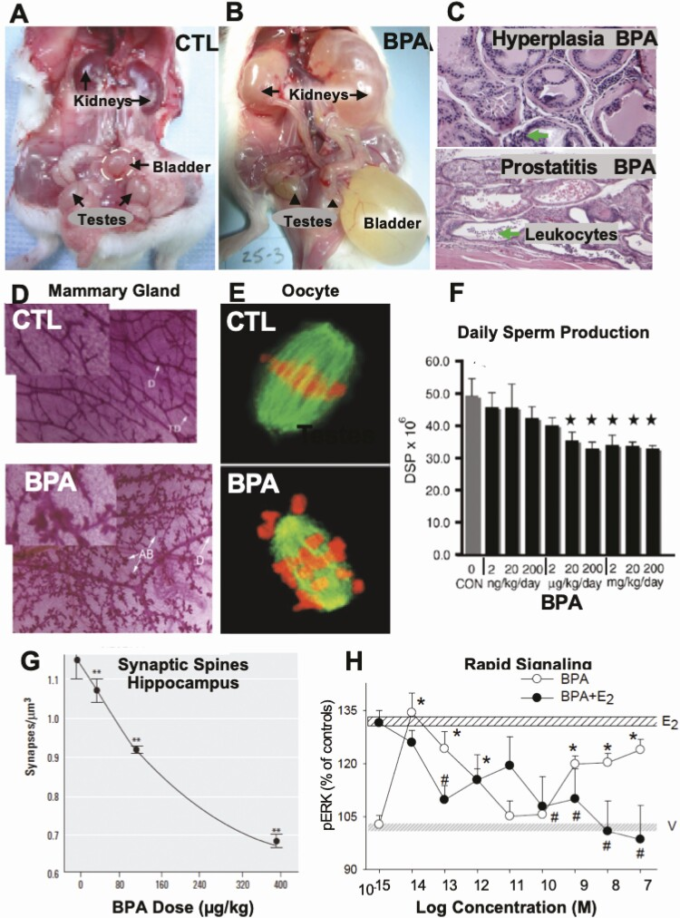
(A) 成体対照(CTL)車両のみ曝露した成体雄マウス。 (B) 成体雄マウスに20 µg/kg/日のBPAを周産期に投与し、成体になってから生理的に適切な量のテストステロンとエストラジオールをシラスティックカプセル経由で投与(セカンドヒット)し、一緒に閉塞性排泄障害と水腎症を引き起こした。(C)上皮過形成と前立腺炎(矢印)を示す(B)の同じBPA処理雄の背外側前立腺;から:Taylor JA, Jones MB, Besch-Williford CL, Berendzen AF, Ricke WA, vom Saal FS 2020 Interactive Effects of Perinatal BPA or diethylstilbestrol and Adult Testosterone and Estradiol Exposure on Adult Urethral Obstruction and Bladder, Kidney, and Prostate Pathology in Male Mice. Int J Mol Sci 21:3902 (オープンアクセス). (D) Alzet浸透圧ポンプからの0.25 µg BPA/kg/日への周産期曝露による乳管(D)終末管(TD)および肺胞芽(AB)の著しい増加を示す成雌マウスの全マウント乳腺;出典:Vandenberg LN, Maffini MV, Schaeberle CM, er al 2008 Xenoestrogen bisphenol-A への周産期曝露は成体 CD-1 マウスに乳管内過形成を誘発した。Reprod Toxicol 26:210-219, (オープンアクセス). (E) 無傷のマウス卵子の共焦点画像で、減数分裂紡錘体(緑)と染色体(赤)を免疫染色で可視化したもの。ポリカーボネート製ケージや水筒から溶出するBPAに曝露した雌マウスの正常なメタフェースI(CTL)構成と代表的な減数分裂異常;Hunt PA, Koehler KE, Susiarjo M, er al 2003 Bisphenol A exposure causes meiotic aneuploidy in the female mouse. Curr Biol 13:546-53,(オープンアクセス)。(BPAを6日間摂取させた雄成虫の1日当たりの精子生産量の減少(20μg BPA/kg/day以上で有意な効果[*])坂上真一、大迫聡、石村理、他 2001 Bisphenol A affects spermatogenesis in the adult rat even at a low dose. J Occupational Health 43:185-190,出版社からの許可を得て掲載。(G) 成体雌ラットにおけるエストロゲン刺激による海馬のシナプス棘形成のBPAによる阻害(40μg/kg/日以上);MacLusky NJ, Hajszan T, Leranth C 2005 The environmental estrogen bisphenol A inhibits estradiol-induced hippocampal synaptogenesis. Environ Health Perspect 113:675-679, (パブリックドメイン). (H)ラット下垂体細胞において、10-14から10-7Mまでの用量のBPAを投与した後、または1nMのエストラジオール-17βと組み合わせて投与した後の細胞外シグナル制御キナーゼ(pERK1/2)の急激なリン酸化は、BPA単独の10-14Mでの有意な刺激効果(*)に始まる広い用量範囲で振動および作動性/作動性効果を示す(0.01 pM = 2.3 fM)。 01 pM = 2.3 fg/mL BPA)およびBPAを1 nM(0.27 pg/mL 17β-エストラジオール)と共に投与した場合には抗エストロゲン効果も示された;Jeng YJ, Watson CS 2011 生理的エストロゲンと異種アンドロゲンの組み合わせは、ラット下垂体細胞のERKリン酸化プロファイルを変える。Environ Health Perspect 119:104-112, (パブリックドメイン).
もう1つの例は乳腺からであり、周産期発生におけるBPA曝露が、μg/kg/日あるいはng/kg/日の用量で、ネズミの乳腺形態(図3D)を変え、ホルモンおよび発癌物質に対する乳腺の反応性を高める(83-85)ことが多くの研究で示されている((75,86)において総説あり)。BPAは、胎児間充織のER活性化を介して乳腺に作用し、間質区画の脂肪細胞などの遺伝子発現や発生を変化させ、胎児乳腺上皮の成長を促進することがメカニズム研究で明らかにされている(87-90)。さらに、少なくとも1件の研究では、BPAが感受性の高いラット系統の乳腺に癌(腺癌を含む)を誘発することが示唆されており、完全な発癌性物質であることを示す証拠となっている(91)。
第三の例は、女性の生殖器官であり、BPA は子宮上皮(92)や卵巣に悪影響を及ぼすことが指摘されている。実際、多くの研究が、BPAが卵胞の成熟と減数分裂を変化させ、ステロイド生成を阻害し、卵子の質を低下させることを示している(77, 93, 94)。驚くべきことに、卵巣に関する研究の多くは、ポリカーボネート製の動物用ケージやボトルから、雌マウスの生殖機能を変化させるに十分なレベルのBPAが溶出することを示した研究(95-97)によって刺激され、プラスチック製品からのBPA溶出は常に「低すぎる」ため健康状態に影響しないと考えられていた古い考えに挑戦することになった(図3E)。さらに、周産期の非常に低用量の BPA の暴露(25ng/kg/日)は、マウスの生殖能力と産卵能力の両方を含む生涯の生殖 成功率を低下させ、有害事象を明確に示した研究(98)。
BPAが発生初期に卵母細胞に影響を与え、成熟期に再び影響を与えることは、雄の生殖細胞の破壊によっても反映される。BPAは、マウスの胎生期に精子幹細胞の分化を破壊し(99)その結果、成人期に精子の生産が減少する(64)。さらに、エストラジオールやエストロゲン製剤の影響と同様に、成人期にBPAに曝露すると、脳-下垂体-精巣軸の阻害とテストステロンの減少に関連して、精子形成が著しく低下する(図3F)(100)(101)。
また、BPAは、脳の構造、機能、行動、および下垂体機能に対して無数の影響を及ぼす。重要なことは、BPAの影響は一般的に男性と女性で異なる(そして多くの場合、正反対である)ことである(102)。これは、男性と女性ではホルモンプロファイルが著しく異なること、およびホルモンが脳の発達において性差のある役割を果たすことがよく知られていることから、予想されることである(103)。特にBPAは、エストロゲン活性を有する他の多くの環境化学物質とともに、選択的エストロゲン受容体モジュレーターと呼ばれている。これは、よく研究されているタモキシフェンなどの他の選択的エストロゲン受容体モジュレーターと同様に、用量と調査された組織の両方に基づいて効果が異なるためである(13)。例えば、乳腺や前立腺では、低用量のBPAはERアゴニストとして作用するが、ラットやサルの海馬や前頭前野では、BPAは抗エストロゲン活性を持ち(104, 105)認知症と短期記憶の喪失に関連するシナプス棘のエストロゲン刺激を抑制する(図3G)ことにつながる (106) 。BPAの迅速作用は、ERK1/2経路を活性化するGタンパク質関連受容体(GPR30/GPER)を介することも示されており、迅速シグナル伝達経路を介してBPAはエストラジオールと等価であることが多くの研究により示されている(107)。BPAはまた、ラット下垂体細胞においてアゴニスト/アンタゴニストの混合型エストロゲン活性を示し(図3H)10-14Mまたは2.3fg/mLという低濃度のBPAで著しい効果が生じる(19)。
最後に、BPA の代謝性疾患への影響について多くの研究がなされており(67),肝臓(108),脂肪組織,膵臓への影響(耐糖能異常など)(37,67,109)が示されている。また、BPA は、脂肪細胞の機能や体重を調節するホルモンに変化をもたらす(37)。後述するように、BPAのインスリンホメオスタシスへの影響を媒介する細胞内経路は、広範な研究により明らかにされている(110, 111)。多くの研究で、BPA の代謝結果に対する影響には性差があることが示されている(67)。
論争を巻き起こす 化学業界によるBPAの初期研究
BPAの初期の研究で、発育期の男性生殖器系への影響が報告されたが(62)プラスチック産業が資金提供した2つの研究によってすぐに反論された(112, 113)。しかし、これらの研究は、BPAの影響を示さないだけでなく、陽性対照であるジエチルスチルベストロールの影響も示さないため、その後NTP審査委員会により否定された(114)。
雄の生殖系に詳しい別の研究者が、低用量のBPAおよびジエチルスチルベストロールの出生前曝露によりマウスの前立腺に有意な影響があるという知見を再現したとき(43)この独自の再現によりBPAに関する論争が終結したと考えられた(116)。その後のPrinsらによる研究では、BPAが前立腺のエピジェネティックなプログラミングや前立腺前駆細胞に影響を及ぼすことが示され、早期のBPA曝露が前立腺がんのリスクを高めると結論付けられている(45)。しかし、化学業界と米国FDAの代表者は、BPAは低用量では影響がないとして、信用されなくなった研究を参照し続けている。一方、BPAの売上高は2020年に200億米ドルを超えると推定されている(117, 118)。
BPAの安全性については、BPA製造に利害関係のある団体が資金を提供した追加的な研究が、論争に寄与している。その1つは、1990年代後半に化学企業の出資で設立された化学工業毒性研究所(CIIT)という組織で実施されたものである。著者ら(119)は、他のげっ歯類モデルよりもエストロゲン化学物質に対する感受性が低いCD-SDというラット系統を用いて、妊娠中および授乳中のラットに異なる用量のBPAを飲料水経由で投与した(65)。この研究は、Society of Toxicologyの会合で、次のようなタイトルで最初に発表された。この研究は、毒性学会で「『低用量のBPAの周産期曝露がSprague-Dawleyラットの雄の子孫に及ぼす影響』(120)」というタイトルで発表されたが、そのタイトルは次のように変化していた。2000年にCIITが発表される頃には、「Effect of different sampling designs on outcome of endocrine disruptor studies」(サンプリングデザインの違いが内分泌攪乱物質研究の結果に与える影響)というタイトルになっていた(119)。
2000年には、BPAをはじめとする内分泌かく乱化学物質の「低用量」効果をめぐって、化学企業が「ありえない」と主張するNTP/NIEHS主催の会合が開催された(121)。この会議に参加した科学者たちは、NTP低用量ピアレビュー統計小委員会の審査を受けるために、生データを提出した。CIIT研究に関して、NTPパネルは、BPAの影響がないという著者の結論は「『欠陥がある』『非論理的』『誤解を招く』」であり、10,1000,10000μg/kg/日量のBPAの周産期曝露により成人前立腺サイズが統計的に有意に増加したと述べた(121);pp. A-86, A-89-A-91). また、Elswick ら(119)は、BPA の影響を示す結果が、モデル化した 1 仔の数に関するアプローチの違いによる「偽陽性」である可能性を指摘し、肯定的な結果を割り引いた。具体的には、Elswick らは、1 匹の仔鯨につき、1 頭の雄をサンプリングすることで、偽陽性 の知見を得たと提案した。NTP統計委員会は次のように述べている。「一腹の仔の数が少ない(それによって変動が大きくなる)ために、統計的に有意な所見(偽陽性所見)が増加すると示唆することは非論理的である」。(121), p. A-90)と述べている。
NTPの低線量報告書にはパブリックコメントの欄があり、そこではアメリカ化学工業協会が、エルズウィックらの研究では統計的に有意な影響は見られなかったという誤った主張をし、NTPの統計学者による結論と直接矛盾している(121), p. C-89)。これは、化学業界が資金提供した研究のデータをめぐって論争を起こした例であり、研究著者によって導かれた結論の妥当性を判断するためには、データの詳細な調査が必要であることを思い起こさせるものである(122)。
論争を続ける 化学業界と規制当局による追加研究
BPA の安全性を評価する上で、化学メーカーが実施する試験と EPA や FDA などの規制当局が評価する試験との間に、別の問題があることが、業界出資の追加試験から明らかになった。世界の規制当局は、化学物質が有害かどうかを判断する際、通常、「ガイドライン」研究の結果に依拠している。GLPプロトコルを用いたガイドライン試験は、1900年代初頭に開発された確立された方法に従っており、その多くはほとんど逸脱していないが、化学物質を投与し、事前に設定されたエンドポイントに対する影響を定量化する(123,124)。ガイドラインに準拠したGLP試験で一般的に評価される結果は、規制毒性学の観点から「有害作用」であると認められているが(例えば、臓器重量、組織病理学、血液学パラメータの変化)多くの疾患や内分泌関連機能障害に関連する兆候については検討されていない(125, 126)。
最初のガイドラインGLP苦情研究は、商業動物実験会社であるRTIで行われ、プラスチック産業のロビー活動部門が資金を提供した(127)。この研究の重要な批判は、CD-SD ラット(65)の使用と陽性対照の欠如であり、多くの規制毒性学研究に影響を与えるこの問題は、以前のレビューと批評の対象であった(115,128)。本試験の発表後,RTI 施設でポリカーボネート製ケージ(重合 BPA)の焼却による放火が発生し、試験室や餌が汚染されたことが報告された。化学業界が集めた審査委員会は、この汚染は問題ないと判断したが、研究の解釈を複雑にしている。
Tylら(129)が行った2番目の研究は、同じくプラスチック産業が資金提供したもので、CD-1マウスを用いてより広い範囲のBPA用量の影響を調べたものである。この研究では、ポジティブコントロールとして、100μg/kg/dayの17β-エストラジオールを経口投与した。これは非常に高い用量であるだけでなく、17β-エストラジオールの経口生理活性は限られているため、経口投与の場合には、17β-エストラジオールの10倍以上の経口活性を有する17α-エチニルエストラジオールがポジティブコントロールとして通常使用されている(124)。このガイドラインに沿ったGLP準拠の試験でも、BPAの低用量影響は認められなかったと報告されている。しかし、この試験にはいくつかの奇妙な点があった(129)。まず、14週齢のナイーブコントロールの雄の前立腺重量は約72mgで、通常の14週齢のCD-1雄の前立腺(約42mg(34))のほぼ2倍であり、典型的な9カ月齢のCD-1マウスの前立腺(34)よりも大きいことが判明した。この研究の著者は後に、前立腺がこれほど大きかった理由は、オスの検査が14週齢ではなく、高齢のオスで行われたためであると述べているが(123)この食い違いは解決されてはいない。この研究で用いられた第二の奇妙なアプローチは、エストロゲン化学物質に対する感受性が非常に高く、BPAへの発達期の曝露によって肥大化すると考えられる前立腺前部の重量(80)を、BPAやエストラジオールなどのエストロゲン化学物質に胎児期に曝露すると、5α-還元酵素活性が永久に減少するため、BPAなどのエストロゲン化学物質によってサイズが縮小する精嚢とともに計量することである(64,130)。しかし、Tyl ら(129)の研究では、低用量による体重増加や高用量による体重減少について、非線形データに適した方法で検討されていない。その結果,BPA の体重に対する用量依存的な影響は認められないとした。
これらの事例から、試験の質を判断する際に、試験ガイドラインやGLP規制の遵守に依存することの限界が浮き彫りになった。しかし、FDA などの規制当局は、GLP に準拠していない研究を規制対象から除外し、代わりに RTI の 2 件の欠陥研究を用いて BPA の安全性を結論付けている(131)。このGLPへの過度の依存は、本来、不正やデータ操作を防ぐために設計されたものであるが、36人の科学者が共著した出版物で批判にさらされている(124)。
同様の疑問のある結論は、規制当局に勤務する科学者の出版物にも記されている。欧州食品安全機関の2008年の決定では、同機関は次のように述べている。「新生児におけるBPAのホルモン不活性化抱合体への生体内変換は十分に可能である」(132)と述べている。これは、科学的文献から得られた実際のデータがない発言であり、欧州食品安全機関の「ヒト胎児が遊離BPAに暴露されることは無視できる」という声明が正しくないことが示されている(35, 133)。さらに、米国 FDA の NCTR は、BPA のトキシコキネティクス(様々な曝露経路を経て体内に取り込まれた後,どのように体内から排泄されるか)に着目した研究を多数発表している。2010年にFDAが発表した論文には、「サルのアグリコン(非抱合型)BPAの内部暴露指標に年齢による変化は見られなかった」(134)とあるが、論文中のデータは、新生児アカゲザルのBPA代謝が成体と比較して明らかに4倍程度減少しており、この代謝の年齢による変化は、マウスやラットのデータと同様である(39, 135, 136)。
CLARITY-BPA 試験の予備データ収集のために実施された別の試験では、FDA の著者らは、陰性対照ラットが BPA に汚染されていることを報告した。血清中の非共役 BPA は、未処理の陰性対照と最大 80μg BPA/kg/day まで投与した動物の間で差がなかった(137).しかし、著者らは、これらの動物ではBPAの低用量効果が見られないことから、BPA汚染は重要でないと結論づけた(138)。
このように、米国 NIH やフランス INRA などの学術・政府系研究機関による数千件の試験結果と、産業界や規制当局の研 究所による数件のガイドライン試験結果の間に乖離があることが、BPA の評価において火種となった。2005 年以前に発表された 115 件の BPA 研究を評価したところ、産業界が資金提供した研究の 100%が安全であると結論付けているのに対し、学術的な研究の 90%以上が低用量の BPA で有害であると結論づけている(65)。また、ガイドラインで評価されるエンドポイントは、仮説に基づいた学術的な研究で評価される疾患関連性の高いアウトカムと比較して、何桁も感度が低いことが懸念された(例えば、(44, 142))。
プラスチックメーカーは、BPAが健康被害をもたらすことを否定するために、さらにいくつかの手段を用いた。その多くは、タバコ、鉛塗料などの汚染産業が、有害な化学物質や産業プロセスを規制から守るために用いた方法と一致している(143, 144)。そのひとつは、化学業界が、さまざまな業界のスポンサーから資金提供を受けているハーバード・リスク分析センターに、BPAに関する発表論文のごく一部をレビューさせるというものである。その結果、BPAの曝露量はごくわずかであり、健康への影響はないと結論づけられたが、報告書の公表は数年遅れた。このため、一部の委員からは、報告書が発表されるまでに多くの追加研究が発表され、結論が妥当でなくなったとの批判があった(65, 145)。
ヒトへの曝露 BPAのバイオモニタリングと疫学
BPA曝露による健康被害をめぐる論争が続く中、もう一つの論争が浮上した。BPA の健康被害に関する論争が続く中で、もう一つの論争が生じた。すなわち、ヒトは実際に問題になるほどの量の BPA に曝露されているのか、という論争である。これは、動物実験で低用量と高用量のどちらが有害であるかを議論する一方で、ヒトでの曝露量を定量化することが課題となっていた。なぜなら、BPA とその主要代謝物(BPA-グルクロニドおよび BPA-硫酸)は、世界中の尿検体から十分に検出されているにもかかわらず(1),産業界の研究者や当時の FDA 科学者は、BPA が有害であることを認めるには、未抱合(生物活性)の血中濃度を測定しなければならないと主張した(134, 146)。ヒト血清中に高濃度の未変化体 BPA が検出された場合,FDA や業界出資の研究者は、製品中に BPA が存在することから、血清中の BPA 濃度は経口曝露モデルによる 1μg/kg/day 以下という業界や FDA の推定値と一致しないため、汚染されたと考えた(134, 147)。しかし、この「汚染」仮説は、ヒトのバイオモニタリング研究において、非共役 BPA の生物学的活性レベルが検出された根拠として反論された(122)。
そこで、NIEHS の資金提供により、ヒト血清中の BPA の盲検ラウンドロビン分析が実施され、汚染論争が直接的に検証された。この手法により、vom Saal 研究所や UCSF の Gerona 研究所を含む 3 つのグループが、ヒト血清中の非共役 BPA を汚染なく正確に定量できることを実証した(148)。FDA の実験室は、当初ラウンドロビンに参加していたが、その後,FDA の実験室(および動物施設)が BPA 汚染の問題を抱えていることが発表された(137)。一方,ヒトのバイオモニタリング試料については、汚染仮説が継続された。米国疾病管理予防センター(CDC)の研究者は、CDC が BPA などの化学物質のコンタミネーションフリーアッセイを達成したと発表しているにもかかわらず、BPA の汚染がバイオモニタリング研究にとって「捉えどころのない実験室の課題」であるとする論文を発表している(149)。
なぜ、ヒト試料中の BPA の測定値と BPA 摂取量の推定値との間にこのような乖離があったのだろうか?疫学研究の多くは尿中の総BPA(非抱合体+BPA代謝物)を測定しているため、FDAは食品や食品包装からのBPA曝露に着目し、投与経路を仮定して血中の生理活性BPA量をモデル化した。しかし、CDC の National Health and Nutrition Examination Survey(NHANES)のデータ(57)や、ボランティアから 1 週間かけて採取した全尿検体の分析(58)からは、1 日に複数回 BPA に曝露されることが示唆されており、1 回だけ経口投与したネズミの動物実験では、ヒトへの曝露をモデル化できない可能性があ る。しかし、経口投与には多くの問題点があり、その点については他の文献で詳細に検討されている(150)。胃内投与はストレスホルモンを増加させ、口腔内での吸収をバイパスする(152)。また、1 日 1 回の経口投与では、BPA を含む感熱記録紙の取り扱い(154, 155)や化粧品の使用(156)による曝露が予想される経皮吸収(153)後の毒性動態が顕著に異なることは考慮されていない。また、BPA の代謝は経口投与に比べて制限されており(153),一日中レシートを扱うレジ係の BPA 暴露量増加の一因になっている可能性がある(157, 158)。
ヒト試料中の BPA 濃度に関する論争は続いている。最近の研究(35)では、CDCがNHANESで用いた間接的な分析法は、BPAとその代謝物を直接分析するために新たに入手可能な真正な標準物質を用いており、(尿中の)BPA濃度が170倍と劇的に過小評価されることが示された。これまでのところ、CDC は、BPA や他のフェノール化合物について、現在では真正な標準物質が存在する間接的な測定法の使用を再評価する意向を示さないままである。しかし、間接分析法に基づくデータを用いて、曝露量の少ない人から多い人へとランク付けする疫学者の定性的アプローチは、直接分析法でも依然として正確であることが示された(159)。重要なことは、間接分析法を用いた疫学研究で調査された集団の中で、最も高い暴露範囲にある人々は、実際には、以前の間接分析法に基づいて報告されたよりも劇的に高い暴露を経験していたかもしれないということだ。
さらに、現在のヒトの曝露量から有害性が予測されるかどうかについては、NHANES コホートにおける BPA の高曝露量とその後の 10 年間の死亡率上昇との関連を示唆する最近の研究(160)を含む、BPA に関する 100 件以上の疫学研究(10,75,76)によって対処可能であると考えられる。BPA に関する疫学研究の多くは横断的なデザインであり、BPA 暴露と疾病の因果関係を結論づけることは困難であったが、現在では、母親の BPA 暴露が子供の不安,うつ、多動,攻撃性(161),成人の代謝性疾患(162),人工生殖技術を用いた女性の不妊治療成績などと関連することが数十の前向きコホート研究によって裏付けられている(75,163)。
BPAの論争 BPAの論争:どのような量でも安全か?
BPAは、数千のげっ歯類,数百の霊長類およびヒトでの研究により、動物では疾病の原因となり、ヒトでは疾病と関連することが示されており、BPAが化学物質の安全規制に関する論争の「火種」となっている理由は明らかであろう。多くの研究がそうでないことを示唆しているのに、なぜ規制当局は、現在の人体曝露レベルにおいてBPAが安全であると結論づけることができるのだろうか?FDAがBPAの曝露量を低いと主張するのは、化学物質のリスク評価において、リスク=ハザード×曝露量であり、曝露量を低いとすることで、上記のようなBPAのハザードに関する膨大な文献を無視し、リスクを無視できることを正当化するためであると考えられる。
問題1:学術的な低用量研究を無視したガイドライン研究への依存
まず、米国FDAや米国環境保護庁(EPA)および世界各国の規制当局が、どのように安全性を判断しているかを知ることが重要である。前述のように、規制当局は化学物質の評価において、GLPに準拠したガイドライン研究の結果にほぼ全面的に依拠しており、大多数の学術研究機関で行われているような非ガイドライン研究はほとんど価値がないとみなされ、したがって多くのリスク決定から排除されている。その理由は多岐にわたり、管轄区域によっても異なるが、この決定を導く包括的な哲学は、ガイドライン研究で収集されたデータは再現性があり信頼できるため、異なる規制当局間で同様に解釈されるだろうという仮定である(125, 126, 164)。重要なことは、ガイドライン研究は通常、人間の被曝に関連するレベルとは全く関係のない、非常に高い毒性量を調査していることだ。このため、内分泌かく乱物質としての BPA に着目した研究(62)が始まる前のガイドライン研究では、最も低い用量が 50,000µg/kg/day であった(3)。しかし、この仮定が、BPA に限らず、すでに影響を及ぼす濃度で作用しているホルモンのプロセスを破壊する EDC に対して無効であるかどうかを判断する研究は行われていない(18, 165)。
問題2:線形用量反応モデルは非単調な用量反応データを無視する
「安全な」曝露量を推定するための線形用量モデルの使用は、内分泌学者と規制毒性学者の間で主要な論争の種として浮上している問題である。線形モデルが適切であるという前提は、用量反応関係は単調であると予想されるという1500年代初頭に定式化されたドグマへの信頼に基づくものである。これはしばしば「用量が毒を作る」と訳され、例えば、より高い用量はより大きな反応を引き起こすはずである(166)。このリスク評価の基本的な仮定は、ホルモン,ホルモン活性薬物,BPAなどのEDCでは誤りである(13)。
1つの問題は、規制当局が非単調性のような現象を受け入れるためには、その基礎となるメカニズムが分かっている必要があることだ。これは、非単調な用量反応を媒介するメカニズムについて一般に多く知られているにもかかわらず、科学におけるどの問題も完全に満たすことができない基準である(表2)。過去15年間に発表されたNadalらの研究(25, 109, 110)により、低用量(1 nM)のBPAがグルコース誘発性インスリン分泌を変化させる分子メカニズムが明らかにされた。ERβを介した作用により、低用量BPA(1 nM)はカルシウムチャネルをコードする遺伝子の転写を減少させ、初代培養のマウス膵臓β細胞からのカルシウム流入を減少させる(図4A)。しかし、高用量(100 nM)のBPAは、ERαを介したPI3Kの活性化を介して作用し、その結果、カルシウムチャネルを活性化し、低用量のBPAとは相対的にカルシウム流入に反対の効果を及ぼす(図4B)(25)。このように、100 nMのBPAでは、ERβを介したカルシウム流入の減少とERαを介したカルシウム流入の増加という2つのメカニズムが同時に活性化されるが、1 nMのBPAではERβを介したメカニズムのみが活性化される。したがって、カルシウム流入の非単調な反応は、2つの異なるERサブタイプが関与する2つの異なる分子メカニズムの結果であり、それぞれがBPAに単調に反応する(図4C)。単一の結果(β細胞へのカルシウムの侵入)については、高用量のBPAで陰性対照レベルとの差がないことから、影響がない(副作用のない用量である)と結論付けることができるが、メカニズムレベルでは、低用量および高用量のBPAの両方で、細胞活性に著しい破壊があることが分かった。
表2 非単調な用量反応を引き起こすメカニズムの例
| メカニズムの種類 | 例 | 参考文献 |
|---|---|---|
| 共通のエンドポイントに作用する重複する単調な応答 | BPAに応答した膵臓β細胞におけるカルシウム流入のERβ媒介性減少およびカルシウム流入のERα媒介性増加 | (25,167)_ _ |
| 筋細胞におけるカルシウム処理のERαを介した抑制とErβを介した刺激 | ||
| 低用量刺激、高用量毒性 | 低用量では、乳がん細胞はERアゴニストに反応して増殖しますが、高用量では、これらのERアゴニストは細胞毒性を示します。結果が細胞数の場合、逆U字型の関係があります | (11) |
| 受容体の発現が異なる混合細胞集団 | 子宮や乳腺などの内分泌組織には混合細胞集団があり、その中にはERαを発現するもの、ERβを発現するもの、両方を発現するものがあります。子宮内では、ERαを介したエストロゲン作用は細胞増殖を促進しますが、ERβを介した作用はアポトーシスを促進します。 | (168) |
| 異なる親和性で複数の受容体に結合する化合物 | BPAは、非常に低濃度でmERおよびGPERに結合し、やや高濃度で核内ERに結合し、さらに高濃度で他の核内受容体に結合します。したがって、高用量での効果は、複数の受容体からのシグナル伝達の統合を説明することができます | (169) |
| 受容体発現の変化 | ホルモン(およびEDC)は、自身の受容体の発現を変化させる可能性があります。ホルモンが受容体の発現をダウンレギュレートする場合、より高い用量で、応答できる受容体は少なくなります | (170) |
| 受容体脱感作 | Gタンパク質共役型受容体は、ペプチドホルモン(FSH、ゴナドトロピン、グルカゴンなど)が継続的に結合すると脱感作される可能性があります | (171) |
図4 非単調な用量反応(NMDR)関係のメカニズム

(A)低用量(1 nM)のBPAは、ERβを介してCacna1eの発現を低下させ、11 mMグルコース存在下で初代培養中のマウス膵臓β細胞へのカルシウム侵入を減少させる。(B)100 nMのBPAはERαを介して、PI3K依存的にカルシウム電流を増強する。 oz M, er al)。 Molecular mechanisms involved in the non-monotonic effect of bisphenol-a on Ca2+ entry in mouse pancreatic β-cell. Sci Rep. 2017;7(1):11770, (オープンアクセス)。(C)高用量でこれらの2つの経路を介して作用するBPAが、低用量でERβのみを介して作用することの結果として、β細胞へのカルシウム侵入について非単調な用量反応曲線が出現する。パネルCは、Angel Nadal博士の許可を得て提供したものである。(D)卵巣摘出した雌にシラスティックカプセルを介して17β-エストラジオールを(低用量から高用量まで)投与したときのラット子宮におけるエストロゲン受容体のアップレギュレーションとダウンレギュレーション(Medlock KL, Lyttle CR, Kelepouris N, Newman ED, Sheehan DM 1991 Estradiol down-regulation of the rat uterine estrogen receptor)」より。Proc Soc Exp Biol Med 196:293-300,出版社からの許可を得て掲載している。(E)エストラジオールの用量が生理的範囲(10pM)から生理的範囲以上(100pM)に増加するにつれて、初代培養のマウス胎児前立腺間葉系細胞におけるグルコース代謝に関与する8遺伝子のアップレギュレーションおよびダウンレギュレーション;出典: Taylor JA, Richter CA, Suzuki A, er al 2012 Dose-Related Estrogen Effects on Gene Expression in Fetal Mouse Prostate Mesenchymal Cells. PLoS One 7(10) e48311, (オープンアクセス). (F)高用量ではなく、低用量におけるBPAの受容体特異性。BPAは、投与量の増加に伴い、受容体のクロストークと呼ばれる異なる受容体に結合し、その結果、非単調な用量反応関係が生じる可能性がある。
このような非単調な反応のメカニズムは、他にも明らかにされている。例えば、ラット子宮において、低用量のエストラジオールはERの発現を増加させるが、高用量ではERの発現を減少させる(図4D)(172)。マウス胎仔尿路性器洞間充織においても、エストラジオールに応答して遺伝子活性のアップレギュレーションとダウンレギュレーションを示す非単調な応答が初代培養で示されている(図4E)(173)。最後に、幅広い濃度で行われた様々な研究のデータから、受容体のクロストークの結果として非単調な用量反応が観察されている。BPAは非常に低濃度でGPR30/GPERに結合し、細胞内シグナル伝達を迅速に行う。次にBPAの濃度が上昇すると核内ERに結合し、さらに高濃度でアンドロゲン受容体、最後に甲状腺受容体に結合し、その転写活性を変えるが、これは調べた組織により異なる(図4F)。
このようにBPAは、化学物質のリスク評価の前提である「BPAなどの毒性物質には影響がない閾値がある」という前提の妥当性を脅かす戦場となる化学物質となった。しかし、すでに想定される閾値を超えて作用しているホルモン系の破壊には閾値が存在しない(174, 175)。予想通り、規制当局も化学企業も、この可能性を受け入れていない。
問題3:研究規模の要件が正当化されない
リスク評価における学術研究の利用を妨げるもう一つの重大な問題は、FDAがリスク評価に含まれる研究のグループ/サンプルサイズに関する基準を設定していることだ。NIHの「NIH Guide for the Care and Use of Animals in NIH-funded research」は、研究者が統計的有意性を得るために必要な最小数の動物を使用することを保証し、それは検出力分析によって正当化されなければならない。対照的に、規制当局の意思決定に用いられるガイドライン研究では、収集されるデータの多くがカテゴリー(状態の有無)であるため、多くの場合、大きなサンプルサイズ(n = 20-50/用量、性別ごと)が設定される。ガイドライン研究のサンプルサイズはあらかじめ設定されており、検出力分析を用いて算出されるものではない。
検出力分析に基づいて選択されていない任意のグループサイズの数字を設定することで、規制当局が使用するアプローチは、連邦政府が資金を提供する学術研究者が従う倫理基準に違反している。さらに、ガイドライン研究では、検出力分析を行わずにあらかじめ設定されたサンプルサイズを使用するため、これらの研究は検出力が過剰または不足する可能性があることを意味する。このように、すべての研究が1群につき任意の数の動物を用いなければならないとすることは、結局、動物実験に関するNIHの規制の制約を受けない産業界によって行われた、あるいは産業界が資金を提供した研究に決定を偏らせる。奇妙なことに、FDAが行った動物実験もNIH動物使用ガイドラインに違反している。
BPAに関する明確性を得るための失敗
このミニレビューでは、BPAの人体への影響について、20年以上にわたって論争が続いていることを紹介している。最近,これらの問題のいくつかを解決するために、CLARITY-BPA 研究のような大規模なイニシアチブが実施された。冒頭で述べたように、CLARITY-BPA試験は、ガイドライン研究と、BPAや他のエストロゲンEDCに感受性のあることが既に示されている追加的なアウトカムを組み合わせて設計されたものである。
CLARITY-BPA試験で使用される共有手法の設計は困難であった。例えば、NTPのCD-1マウスモデルよりもエストロゲンホルモンに感受性の低いNCTRラット系統を使用することに、学術研究者は深い懸念を表明した(65)。驚くべきことに、NTPとFDAは当初、エストロゲン活性の陽性対照を含めるという要求に抵抗したが、多くの議論の末、この目的のために17α-エチニルエストラジオール(2低用量)が選択された。BPAの経口投与については、特にFDAがナイーブ陰性対照(拘束も経口投与もしていないラット)を入れないため、意見が分かれた。また、上述のように、研究の途中で、FDAの研究所がネズミのコロニーにおけるBPA汚染のコントロールに苦労していることが明らかになり(137)CLARITY-BPAの動物も汚染されている可能性が懸念された。しかし、FDAはバイオモニタリングプロトコルを放棄し、CLARITY-BPAの数匹の動物についてBPA濃度をテストしたことを報告しただけで、この疑問はほとんど解決されなかった(4, 6)。
CLARITY-BPA試験では、妊娠6日目から出生後21日目まで、あるいは出生後組織採取までの間に、BPAを経口投与した動物(最初は妊娠中の母親から、出生後は直接子供へ)が対象となった。BPA投与群は2.5,25,250,2500,または25 000μg/kg/day、ポジティブコントロールである17α-エチニルエストラジオール投与群は0.05または0.5μg/kg/dayを投与した。これらの17α-エチニルエストラジオールの用量は、一般に、より「強力な」エストロゲンと考えられているため、BPAの投与量よりも低い。経口避妊薬において、女性の生殖能力を抑制するのに十分な17α-エチニルエストラジオールの用量は約0.5μg/kg/日であり、マウスの研究では17α-エチニルエストラジオールの用量0.05μg/kg/日とそれより下で効果が観察される(176-178)。CLARITY-BPAは、1歳または2歳で安楽死させたが、研究者が評価した特定のエンドポイントについては、より早い年齢で安楽死させたサブセットを使用した。1歳および2歳時に測定された代表的な結果は、FDAが実施したガイドライン研究のエンドポイント(例:臓器重量、病理組織学、臨床化学測定)であった。また、これらの年齢やそれ以下の年齢で測定された結果は、最新の分子・遺伝学的、組織化学的、エピジェネティック、神経内分泌、行動学的実験方法など、学術研究者が選択したものである(その他のレビューについては、(7,179-181)参照のこと)。
FDA と学会参加者との合意形成が困難であったこと、汚染の有無に関する課題、さらに学会参加者が要求する群数 を満たせなかったこと(45)一部の学会研究で見られた動物の体重の偏り(181)などの課題にもかかわらず、 CLARITY-BPA 試験はいくつかの重要な結果を示した(図 5)。CLARITY-BPA 試験では、重要な結果が得られた(図 5)。 5μg/kg/day(乳腺,肝臓,腎臓,雄性生殖器),25μg/kg/day(雌性生殖器,腎臓,甲状腺),250μg/kg/day(甲状腺,肝臓,腎臓,下垂体および脾臓)。2500μg/kg/day(女性生殖器、甲状腺、精巣、肝臓、腎臓、副腎、膵臓)25 000μg/kg/day(卵巣、女性生殖器、下垂体、男性生殖器)である。学術的な研究者からも同様に、すべての用量群で BPA の影響が報告されており、臓器や結果による違いや、性差による影響も認められている(7, 180)。
図5 CLARITY-BPA 試験で報告された BPA の有意な影響
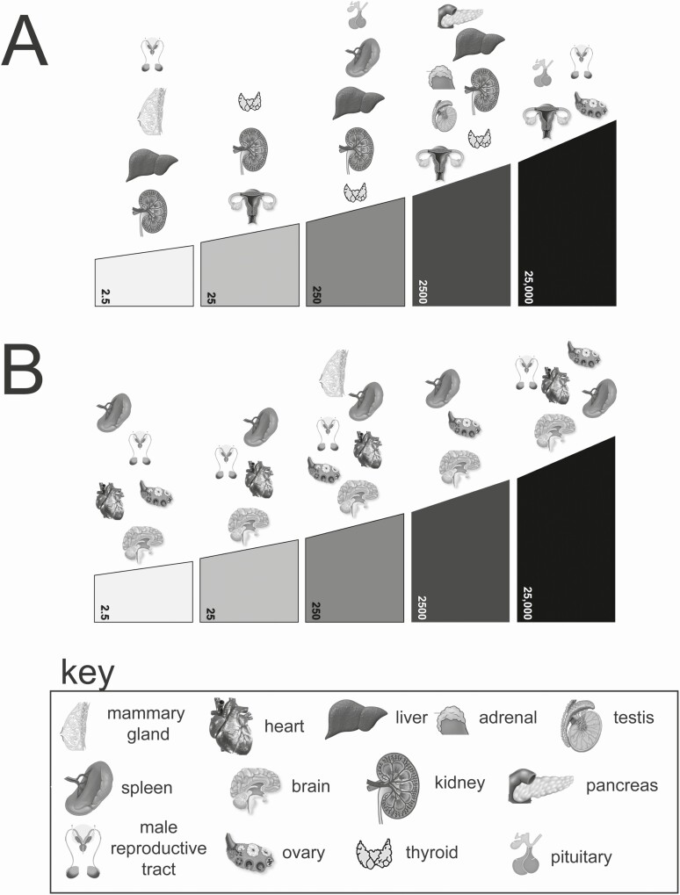
(A)FDAが実施したコア・ガイドライン研究の影響のまとめ、(B)学術研究の影響のまとめ。の存在は、その臓器における1つ以上の測定値について、示された用量で、同時に行われた陰性対照と比較して有意差があることを示している。
CLARITY-BPA のデータからより広い結論を得るために、最新の数学的・統計学的アプローチを用いた 2 つの重要な研究がある。1 つ目の研究では、乳腺成長パラメータの反復測定が非単調な用量反応を示し、Montevil ら(182)は、この非単調な反応がランダム効果ではないことを数学的に証明した。また、BPA の低用量域では乳腺の成長パラメータが増加するという一貫したパターンが出現し、低用量と高用量の反応の区切りは、25 μg/kg/day の用量群の間にあることが繰り返し示された(182)。また、CLARITY-BPA の各研究者が実施した研究間の統計的相関から、異なる研究者によ る治療群の盲検評価による臓器間作用のパターンが明らかになった。この数学的解析は、最低用量(2.5μg/kg/day)でも BPA の影響が非ランダムであることを示唆しており、生物学的にありえないとして FDA が否定するべきものではない(7)。
CLARITY-BPA では、ガイドラインと学術研究の双方で 2.5µg/kg/day で有害事象が一貫して確認され、さらに、この低用量での動物への影響が多数発表されていることから、学術共同研究者はこの用量を LOAEL とすべきと結論づけた(7)。2.5µg/kg/day を LOAEL とし、動物間変動(10 倍),ヒト間変動(10 倍),無影響レベル(NOAEL)ではなく LOAEL を使用すること(10 倍)を考慮して 1000 倍の線形安全係数補正を行うと、1 日摂取許容量は 2.5 ng/kg/day となる(図 6)(7).これは、1980年代に設定された現在のADIである50μg/kg/dayに対して、FDAのADI量が2万倍もシフトしていることを意味する(3, 179)。また、いくつかの先行研究では、2.5μg/kg/日以下の用量でBPAの影響が示されている(例えば、脳と行動(183),乳腺の発達(184),女性の生殖(98)など)ことに注意する必要がある。したがって、ADIを2.5 ng/kg/dayにシフトしても、公衆衛生を十分に保護できない可能性は否定できない。
図6 新旧LOAELからの参照用量(または1日摂取許容量)の算出
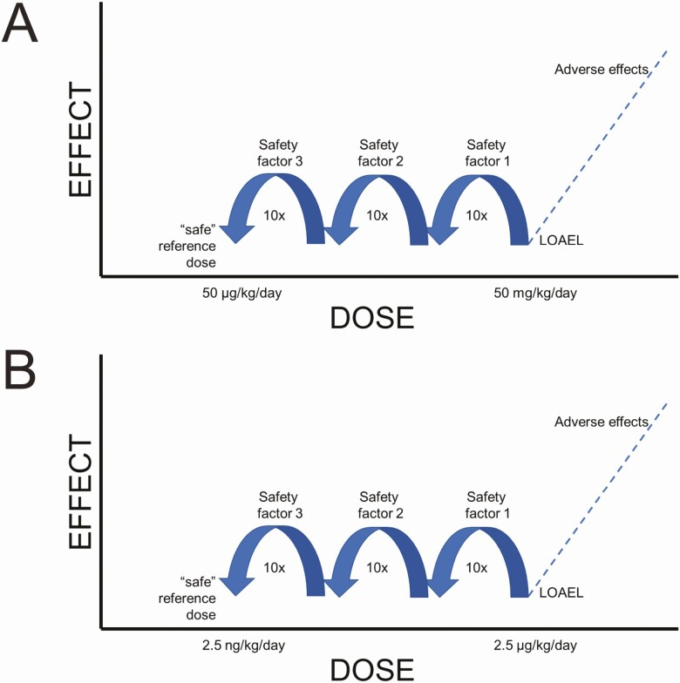
(A)CLARITY-BPA試験以前は、ガイドライン研究から算出されるLOAELは50 000μg/kg/dayであった。B)CLARITY-BPA試験では、FDAが評価したガイドラインエンドポイントでも影響が認められたため、2.5μg/kg/dayで新参照量/ADIとなる。
悲しいことに、ガイドライン試験とCLARITY-BPAの学術研究者が行った試験の両方で、極低用量群に認められた重大な副作用は、生物学的に妥当でないとしてFDAに拒否された。FDAは、用量反応関係が必ずしも単調でないこと、すべての組織で影響が一貫していないこと、これらの仮定はいずれも既知のホルモン作用のメカニズムと一致しないことを理由に、この結論を導き出した。さらに、FDAの著者らは次のように述べている。「しかし、特に病理組織学的エンドポイントに適用される低ストリンジェンシー検定では、ビヒクル対照と統計的に有意な差があったが、これらの影響はBPAによる病変と一致する首尾一貫したもっともらしいパターンを示さなかった。..証拠の重み付けアプローチに基づき、我々はコア試験データが試験用量範囲の下限におけるBPA曝露のもっともらしい危険性を示唆しないと結論付けた」(6) 。低用量での影響が高用量での影響と異なるというFDAの結論は、FDAのガイドライン研究とCLARITY-BPAにおける研究者の所見の両方において、多くのエンドポイントや臓器に渡る所見の一貫性と明確に矛盾している(7)。重要なことは、単調な反応が生じたことを証明することは数学的に容易であるが、非単調な用量反応を実験における「ノイズ」と区別できると主張することはより困難であることである(37,166,185)。しかし、フランスの食品・環境・労働衛生安全庁(ANSES)を含む他の規制機関は、EDCについて非単調な用量反応が生物学的にもっともらしいと認めている(186)。さらに、ANSESは、観察された非単調な線量反応の強さと妥当性を評価するための枠組みを提案している。
CLARITY-BPA 試験で観察された BPA の影響に対する FDA のアプローチには、FDA 自身の研究部分(例えばガイドライン研究)を含めて、まだ多くの欠陥がある。例えば、FDAは、BPA暴露動物と同時に経口投与した陰性対照動物との有意差を無視するために、「過去の対照」(例えば、過去の実験で実際に経口投与しなかった陰性対照)との比較に依存した(7,187)。このような非科学的なやり方は、特にCLARITY-BPAのデータを「過去の対照」と比較した結果、CLARITY-BPA試験ラットは、この系統のラットを用いた、経口投与でない過去の研究とは多くの点で大きく異なっていることが示されたため、問題視されたのである。このことは、低用量の外因性エストロゲンへの曝露が雌の思春期を早めることを示した他の多くの研究(188)と一致し、BPAについても同様であった(189)。
BPA の安全性.BPAの安全性:20年前にわからなかったことが今わかっているのか?
CLARITY-BPA試験は、低用量BPAの影響に関する重要な疑問点を解決するための新しいアプローチであった。CLARITY-BPA試験は、低用量のBPAの影響に関する重要な問題を解決するための新しいアプローチであり、従来のガイドライン研究と仮説に基づいたアウトカムを組み合わせた研究デザインにより、学術研究者が評価するエンドポイントが、より幅広い環境化学物質の安全性を評価するために、より感度が高く、おそらくより適切であるかどうかを研究者が評価できるようにしたものであった。最終的に、ガイドラインと学術研究の結果は、専門家グループが10年以上前に出した結論と、それ以前の10年間の研究で示されたことを確認するものであった。具体的には、低用量の BPA が有害とされる結果に影響を及ぼすこと(74),これらの影響は、化学物質のリスク評価の根幹をなす仮定に疑問を投げかけ、規制毒性学者が受け入れようとする用量よりはるかに低い用量で発生することである。
CLARITY-BPA研究は、数百万ドルの費用と数年にわたる作業を必要としたが、内分泌学の基本原則に反する古いアプローチと仮定に基づくFDAの規制当局の見解を変えることはなかった。しかし、同様のデザイン(「仮説駆動型」のエンドポイントを追加したガイドライン研究)を用いた他の研究でも、CLARITY-BPAの学術参加者と同様の結論が出ている:(190)デンマーク国立食品研究所の研究者が行った研究では、低用量のBPAが神経行動,男性および女性の乳腺,精子数に影響を与え、ガイドラインエンドポイントには比較的少ない影響を与えた(191,192)。さらに、別のグループは、アカゲザルの妊娠中の BPA 暴露の影響を調べた研究の組織を共有し、母体と胎児血清中の BPA の分析(151)とともに、さまざまな胎児組織における多数の悪影響が確認された(193-199)。
連邦法では、FDAの食品安全担当部門(CFSAN)が食品添加物の安全性を評価することが義務づけられており、21 CFR §170.3(i)で「安全または安全とは、その物質が意図した使用条件の下では有害ではないことが有能な科学者の心の中で合理的に確実であること」と定義されている。FDAの科学諮問委員会は 2008年のBPAのリスクアセスメントを学術的研究の考慮不足を理由に却下した(200)。
BPAから他のEDCへ より広範な教訓
BPAは、低用量効果や非単調な用量反応を理解するために、過去20年間に最も研究されたEDCの1つである。実際,BPAのメカニズム研究は、非単調性反応の原因となる重要な分子メカニズムを明らかにし、これらの反応がどのように現れるかを科学者に伝えるだけでなく(表2),これらの反応は生物学的にありえないというFDAの仮定にも対抗している。非単調な用量反応は多くのEDCで報告されており、この研究は、非単調な反応を否定する前に、より良い数学的・統計的アプローチを用いるよう、様々な分野の科学者に問いかけている(37)。
EPA/FDAのLOAELをはるかに下回る用量でBPAの悪影響が確認されたことは、規制当局が「安全」な曝露レベルを推定するために用いるアプローチに強い疑問を投げかけるものである。このことは、BPAに限らず、すべての化学物質に当てはまる可能性がある。化学物質のリスク評価手法や前提条件を擁護する規制毒性学者と、ホルモンの作用機序やBPAなどのEDCに精通する内分泌学者との論争は、20年以上にわたって続いている(165)。内分泌学会は、EDCの安全性評価のアプローチを規定すべき内分泌学的原則と、規制当局がEDCの危険性を推定するために用いてきたアプローチの欠陥を明らかにした多くのポジションステートメントを発表している(8-10, 201)。
同様に、CLARITY-BPA研究は、デンマーク国立食品研究所の研究とともに、ガイドラインのエンドポイントと最新の仮説に基づいた結果を比較することを可能にするものである。これらの研究で明らかなことは、学術研究機関が評価する疾患関連アウトカムは感度が高く、有害作用を表しているということだ。CLARITY-BPAで試みられたような共同アプローチが必要であり、単一の研究所ではCLARITY-BPAの学術的協力者のような幅広い専門性を持つことができないためである。
重要なことは、CLARITY-BPA試験における17α-エチニルエストラジオールの陽性対照の評価が、規制当局や業界の科学者が主張する「ガイドライン研究は再現性があるので信頼できる」という典型的な主張に異議を唱えるものであることである(123)。CLARITY-BPA試験における17α-エチニルエストラジオールの効果は、この化学物質に関する以前のガイドライン試験における効果(またはその欠如)と大きく異なっていた(179)。
また、BPAの話は、1500年代に作られた時代遅れの仮定やアプローチが、ホルモン作用の基本原則に反しているにもかかわらず、化学物質のリスク評価でいまだに使われていることを物語っている。このように、化学物質のリスク評価に関するFDAの立場には、3つの大きな論点がある。
- FDAのような規制機関は、次のような立場をとっている。「観察された影響が毒性学的に適切である(すなわち有害である)ためには、明確な用量反応が見られるべきである(例えば、被験物質の用量を増やすと、被験者に観察された影響が増加する)」(202)すなわち、用量反応関係が単調である場合にのみ「適切な」用量反応曲線が生じるという立場である。しかし、ホルモンや受容体と相互作用する薬物、BPAなどのEDCでは、非単調な用量反応関係が一般的である(13, 203)。
- リスク評価では、毒物の影響がない閾値が存在することが中核的な前提となっている。この閾値の仮定には、実験データ(174)や理論的根拠(175)から異論がある。このFDAの仮定は、BPAには影響が生じない用量が存在するという結論につながり、BPAの安全性を推定する上で大きな誤差をもたらす(11)。しかし、CLARITY-BPA試験では、最低量のBPAでも副作用があり、さらに低用量(ng/kg)でも乳腺の発達を阻害することが示されている(184, 204)。内分泌学会の会員による上記の声明は、BPAだけでなく、すでに想定される閾値を超えたホルモンシステムを破壊する他の多くの環境汚染物質についても、逆作用の閾値を仮定することが否定されるべき理由を再確認している。
- DAは、ある影響を有害とみなすためには、「観察された影響は試験種の両性で起こるべきである」と主張している(202)。この前提の奇妙な点は、雌雄の内分泌系の機能が異なり、それが胎児期の性分化の過程(130)思春期のホルモンの推移、女性では月経周期が確立するが男性では生殖可能期間を通じて確立しないこと、女性の閉経後の変化や男性のホルモンの年齢変化により老化時のホルモンの差異が生じること(205,206)などに影響を及ぼすことだ。BPAのようなEDCは男女で異なるホルモンの背景に影響を与えるので、統計的に有意な結果を生物学的に意味のあるものとして受け入れるために、EDCに対する反応が男女で同じでなければならないというのは非論理的である。実際、低用量のBPAを胎児に投与した場合、雄ネズミと雌ネズミの反応は、通常、異なるだけでなく、多くの場合、正反対である(38, 102)。
残念ながら、BPAから学ぶべき教訓はもう1つある。それは、「惜しい代物」の問題である(207)。世間で懸念が高まり、BPAを含む製品から消費者パターンがシフトするにつれて、「BPAフリー」製品の販売が増加している。これらの製品の多くにはビスフェノール類似物質が含まれている。このように、有害な化学物質を、BPS や BPF などの同様に有害な類似化合物で代替する「もぐらたたき」的なアプローチが行われてきた(208, 209)。これらの類似化合物について検討した研究の数ははるかに少ないが、これらの化学物質の一部も、BPAと同様の低用量で有害であることを示す十分な証拠がある(210-213)。
結論
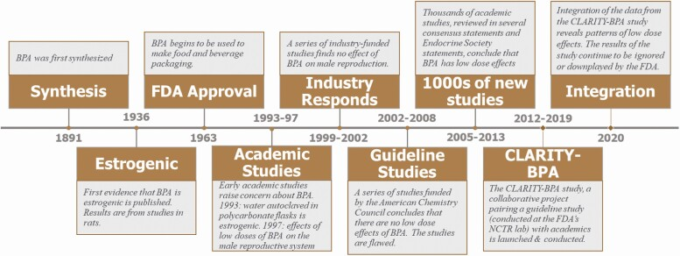
20 年以上の間に、BPA の影響に関する科学的知見は飛躍的に増加した(図 2 と and7)。すなわち、低用量の BPA はホルモン感受性臓器を変化させ、ヒトの様々な非感染性疾患と関連することが、ヒトの試験結果か ら明らかになり、動物実験と 試験管内試験 のメカニズム研究で得られた多くの知見により裏付けられている。ADIを2万倍に引き下げるには、フランスで既に実施されているように、米国では食品接触物中のBPAを排除する必要があるかもしれない。しかし 2010年にFDAは、BPAが1963年に意図された使用条件下で有害でないという合理的な確実性の基準(21 CFR 177.1580)を満たすと判断したことにより、BPAを含む製品の識別を産業に要求する能力さえ放棄したことを認めている(48)。FDAは、米国における食品および食品/飲料包装の安全性を確保する責任を放棄した]のであり、FDAはBPAなどの化学物質を安全と宣言することを産業界に許し続けている(214-216)。
図7.BPAの歴史における主な動きを年表にしたもの
謝辞
図4Cを提供し、膵臓β細胞機能に対するBPAの影響についての考察に意見を提供してくれたAngel Nadal博士に感謝する。
財政的支援 米国国立衛生研究所環境保健科学研究所の支援(L.N.V.への賞金番号U01ES026140およびF.S.v.S.へのUO1ES020952)により、著者らは謝意を表した。この原稿の内容は、著者のみが責任を負うものであり、必ずしもNational Institutes of HealthまたはUniversity of Massachusettsの公式見解を示すものではない。
用語解説
略語
- ADI 許容一日摂取量
- BPA ビスフェノールA
- CDC 米国疾病管理予防センター(Centers for Disease Control and Prevention
- CIIT 化学工業毒性研究所
- EC50 50%有効濃度
- EDC 内分泌かく乱化学物質(Endocrine Disrupting Chemical
- ER エストロゲン受容体
- EPA 環境保護庁
- FDA 食品医薬品局
- GLP Good Laboratory Practice(優良試験所基準
- GPR Gタンパク質共役型受容体
- LOAEL 最も低い有害事象の観察レベル
- MBP 4-メチル-2,4-ビス(4-ヒドロキシフェニル)ペント-1-エン
- NCTR 国立毒性学研究センター
- NHANES 国民健康・栄養調査(National Health and Nutrition Examination Survey
- NIEHS 国立環境保健科学院
- NTP National Toxicology Program(国立毒性プログラム)

