コンテンツ
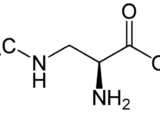
L-セリンの役割
L-セリンは非必須アミノ酸のひとつとして分類される。しかし、脊椎動物は特定の状況下では必要な量を合成することができないため、条件付き非必須アミノ酸とも考えられている。
重要なアミノ酸の前駆体
L-セリンは哺乳動物の中枢神経系において、3-ホスホグリン酸から生合成され、アミノ酸であるグリシン、システインの合成にも前駆体として用いられる。
タンパク質合成におけるその役割に加えて、L-セリンは、ホスファチジルセリン、スフィンゴミエリン、グリシン、含硫アミノ酸、およびD-セリンを含む多数の必須化合物の前駆体でもある。
L-セリン欠乏
一般的に加齢によって血漿中のL-セリンは減少することが示されている。
www.ncbi.nlm.nih.gov/pubmed/23463425
L-セリンは多発神経障害の治療に使用されてきた歴史がある。魚鱗癬(ぎょりんせん)などの症状を示す進行性多発ニューロパチーを示す少女の低いLセリン濃度が報告されており、3週間のL-セリン投与によってこれらの症状が改善された。 (Catsman-Berrevoets et al. 1997)
ニューロン栄養因子
L-セリンは、神経活性物質であるD-セリン、3- PGDH、PSATの代謝前駆物質として中枢神経系の重要な機能に関わる。
L−セリンは強力なニューロン栄養因子として機能し、細胞の生存、成長、分化および樹状突起伸長、分岐およびシナプス形成を強く促進する。
神経栄養因子
L-セリンは強力な神経栄養因子として機能するため、その欠乏は脳発達に有害な影響を及ぼす。L-セリンが欠乏すると小頭症、認知機能障害などで生じる脳の構造的な変化を説明することができるかもしれない。
グリシンおよびD-セリンの欠乏による神経調節不全、ホスファチジルセリン、スフィンゴミエリン生合成の欠陥では、脳白質の変化をもたらす可能性がある。
link.springer.com/article/10.1007/s10545-016-9921-5
スフィンゴ脂質・ホスファチジルセリン合成
L-セリン添加は、培養ニューロンの生存を改善し、濃度依存的にニューロンの伸張と分岐を増加させることが示されている。このニューロンへの作用は、L-セリンがスフィンゴ脂質、ホスファチジルセリン合成を維持する建築ブロックの役割に起因している。
refhub.elsevier.com/S1096-7192(16)30053-1/rf0045
L-セリンはASCトランスポーターを介して血液脳関門を透過する。
www.ncbi.nlm.nih.gov/pubmed/3116007/
リン酸化の主要部位
L−セリン残基がリン酸化のための主要部位として作用し、その可逆反応は細胞機能および恒常性にとって必須であることから、細胞内で十分な濃度のL−セリンを維持することは重要であると考えらている。
リン酸化機能不全と疾患
生理学的にはタンパク質のリン酸化部位において多くの重要な役割を果たしており、L-セリンを合成する代謝酵素の変異はさまざまなヒトの病気に関与している。
リン酸残基の付加または除去は、細胞周期、アポトーシス、成長、シグナル伝達を含む多様な機能を有する。
アミノ酸残基は、L-セリン残基に95%以上、L-スレオニン残基に3〜4%、L-チロシン残基に1%未満の割合で存在する。(Nestler and Greengard 1999)
神経変性疾患のリン酸化調節不全
www.ncbi.nlm.nih.gov/pmc/articles/PMC4026737/
神経毒BMAA
en.wikipedia.org/wiki/Beta-Methylamino-L-alanine
indeep.jp/alzheimer-and-als-cause-bmaa-poisonous-algae/
L-セリンが神経保護作用を有すると考えられている理由のひとつは、BMAA(β-N-メチルアミノ-1-アラニン)の阻害作用にある。
www.ncbi.nlm.nih.gov/pubmed/24086518/
www.sciencedirect.com/science/article/abs/pii/S0304389418310021
結果にばらつきがあるのは、様々なシアノバクテリアが存在する水域環境の異なる場所から採取されたサンプルであることなど、いくつかの要因が考えられる。また、アミノ酸の抽出方法が異なることや、BMAAとその異性体が遊離分子またはタンパク質に結合した状態で検出されるという事実にも起因していると考えられる。抽出方法や選択した分析法によって選択性が異なり,場合によっては性能が低いこともある。選択性の低い分析法の一例として、HPLC-FLDが挙げられる。この分析法では、蛍光性を持たせるためにアミノ酸を誘導体化する必要がある。誘導体化は偽陽性を引き起こす可能性があり、HILICクロマトグラフィーを使用すると、誘導体化されていないBMAAとその異性体であるBAMAを区別することができない。環境試料中の有害アミノ酸を適切に検出・定量するためには、さらなる検討が必要であることは明らかである。
チャモロ族の高いALS有病率
グアムに住むチャモロ族の伝統的な食事にはBMAAが含まれている。戦後の調査でチャモロ族のALS(筋萎縮性側索硬化症)の有病率が一般的な発症率の50~100倍あったことがわかり、これは当初遺伝環境であると疑われていた。
www.ncbi.nlm.nih.gov/pubmed/14612559/
www.ncbi.nlm.nih.gov/pubmed/16457975/
その後の研究で、ソテツの根に寄生するシアノバクテリアが産生するBMAAが高い有病率の要因として浮上してきた。しかし、ソテツの粉に含まれるBMAAは低濃度であることから、BMAAが生物濃縮された食品を摂取していることが疑われた。
さらなる研究で、ソテツの粉を食べるオオコウモリ(flying fox)一匹にはソテツの粉1トン分と同量のBMAAが含まれていることが示され、インタビューからチャモロ族の何人かはオオコウモリをを食べる習慣があることがわかった。
www.ncbi.nlm.nih.gov/pmc/articles/PMC263822/
www.ncbi.nlm.nih.gov/pmc/articles/PMC3297012/
ヒトにおけるALS,PD,ADなどの神経変性疾患の発症にBMAAが関与しているとの仮説は検証されていない
ALSで死亡したチャモロ島の患者の脳組織や、ADが確認された患者の脳では、BMAAの同定・定量に効率的な分析方法が用いられていたにもかかわらず、BMAAは確認されなかった。一方、BanackとMurchは、ALS/PDCで死亡したチャモロ人の神経変性患者の脳組織にBMAAが存在することを報告している。他の研究では,ADおよびPDC患者のヒト中枢神経系でBMAAを検出できなかった。多くの研究が,BMAAが興奮毒性を引き起こすと結論づけている
最近,BMAAのタンパク質誤取り込み仮説の妥当性が疑問視されており、毒性の主なメカニズムは興奮毒性であり,タンパク質の折り畳みを妨げる特定の酵素の阻害が起こる可能性が示唆されている.
BMAAの発生に関する矛盾した報告には、環境要因が影響している可能性がある。シアノバクテリアによる細胞性BMAAの産生は、窒素欠乏などの外的要因に依存する可能性が示されているが、培地中の窒素の存在がBMAA産生に影響を与えなかった別の研究ではそのようなことはなかった
BMAA供給源
海洋食物の生物濃縮
www.ncbi.nlm.nih.gov/pubmed/29324084
シアノバクテリア
BMAAは海洋、淡水、陸上の環境でシアノバクテリアによって生産される。シアノバクテリアに汚染された湖付近に住む人々のALSリスクが高まることも、研究によって示されている。
BMAAは窒素が不足している環境において蓄積が増加する。
貝・フカヒレ・水生生物
水生生物や地衣類、フカヒレなどにも存在する。
BMAAは貝にも蓄積すると考えられている。(Masseret et al, 2013)
現在、BMAAは世界中でさまざまな生態系や生息地で発生していることが知られている。
シアノバクテリア由来のサプリメント(スピルリナ)
www.sciencedirect.com/science/article/abs/pii/S0304389418310021
Arthrospiraは水生の糸状シアノバクテリアであり,最適な生育温度は〜℃の範囲にある。そのため,温暖な気候条件で栽培され,通常の商業名「スピルリナ」で栄養補助食品として利用されている。しかし、この呼称はしばしば混乱を招く。したがって、商業的に栽培され、スピルリナとして販売されているすべての食用形態は、実際にはArthrospira属に属し、本文中ではArthrospiraベースの製品として定義されていることを指摘しておくことが重要である。
いくつかのArthrospira属の種は、様々な果物、野菜、ハーブを含む「グリーン・ドリンク」サプリメントに頻繁に取り入れられている。これらの種は一般的に無毒であると考えられており,一方で,水産養殖や家禽産業で使用されている.しかし、適切な品質管理システムを欠いた自然の水環境で培養すると、水域に存在する毒素を産生するシアノバクテリア種によって、クトロスピラをベースにした製品が汚染される可能性がある。
Arthrospiraをベースとした製品の摂取は、横紋筋融解症と呼ばれる人間の生命を脅かす疾患と関連しており、これは筋肉細胞の内容物を全身循環に放出することにつながる。別のArthrospiraベースの製品は、肝毒性作用が疑われているが、その数年後、この種の製品は肝保護作用があると主張され、C型肝炎による慢性肝感染にプラスの効果を示した。したがって、Arthrospiraをベースにした製品は人間の消費に対して安全であると結論づけられた。一方、悪影響は、培養や抽出の際に生産物を汚染する可能性のある他のシアノバクテリアによって引き起こされる可能性がある。
世界中の管理された貯水池から収穫されるArthrospiraベースの製品とは異なり、Aphanizomenon flosaquaeは、米国オレゴン州のLake Klamathで高密度の自然ブルームを形成し、そこから収穫され、独占的に採取されている。「AFA」や「Klamath Algae」としてよく販売されている。製品の安全性を確保するため、クラマス湖では定期的な毒性学的検査が行われているが、それにもかかわらず、生産が湖の開放的な自然環境で行われているという事実は、他のシアノバクテリア種による偶発的な汚染を引き起こす可能性がある。典型的な例としては、Aphanizomenon flosaquaeと共存するシアノバクテリア種Microcystis aeruginosaによる汚染が挙げられる
シアノバクテリア由来の食品サプリメントにおけるBMAA、DAB、AEGの出現については、ほとんど研究が行われていない。BMAAは、最初の研究では、テストしたつの製品のうちつの製品で.-.μg g-の濃度範囲で検出され、番目の研究では、商業メーカーからのつの原材料サンプルで最大ng g-が検出された(表)。一方、Arthrospiraベースの製品におけるBMAAの分析に関しては、いくつかの研究で否定的な結果が報告されている。また、Arthrospira fusiformis粉末および中国のスピルリナ施設で製造された錠剤の形をしたArthrospiraベースの製品には、検出可能な量のBMAAが含まれておらず、メソッドのバリデーションおよび定量化のための負のコントロールおよびシアノバクテリアマトリックスとして使用できると主張されている。
BMAA とその異性体が混入した場合、藍藻由来の食品サプリメントは、人間の健康に対する脅威となる可能性がある。残念ながら、ほとんどの栄養補助食品は、医薬品ではなく食品として分類されているため、品質管理があまり厳しくない[195]。これらの製品は、医師の処方箋や免許証を必要とせず、インターネットで購入できる状態で、世界規模で販売されている。生産者が示唆しているように、これらの製品が人間によって頻繁に、より大量に、より長期間にわたって消費されているという事実は、消費者がシアノバクテリアの毒素に危機的にさらされるリスクが高まっていることを示している。
BMAAの毒性メカニズム
複数の作用メカニズム
継続的な食事からの摂取によってBMAAに暴露することがわかっている。BMAAが運動ニューロンの機能不全および死を引き起こすメカニズムは完全には理解されていないが、現在の研究は複数の作用メカニズムがあることを示唆している。
www.ncbi.nlm.nih.gov/pubmed/17098435
受容体の興奮毒素
BMAAは、NMDA、カルシウム依存性AMPA、およびカイニン酸受容体などのグルタミン酸受容体に対する興奮毒素として作用する可能性がある。
www.ncbi.nlm.nih.gov/pubmed/2551452
タンパク質ミスフォールディング
ヒトの細胞は神経毒であるBMAAをL–セリンと誤って取り込む可能性がある。
www.ncbi.nlm.nih.gov/pubmed/24086518
誤って取り込まれたBMAAは、アルツハイマー病、パーキンソン病、レビー小体型認知症などの神経変性疾患に見られるタンパク質変性を引き起こす可能性がある。
journals.plos.org/plosone/article?id=10.1371/journal.pone.0075376
これまでの実験でL-セリンがBMAAの誤った取り込みを防ぎ、細胞死を防ぐ可能性が示唆されている。
海馬、神経伝達への影響
BMAA暴露は、タンパク質生合成を撹乱させる。典型的には海馬と関連している。神経伝達に関連するアミノ酸代謝経路、特にアラニン、アスパラギン、グルタミン酸代謝、さらにアルギニン-プロリン代謝に有意な撹乱が生じた。これらの撹乱作用は、急性興奮毒性、酸化ストレスと関連していないことが実証されている。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5383692/
タウリンの減少
タウリンは、細胞容積に調節によりストレスを防ぐ重要な役割を果たし、GABA受容体へのパーシャルアゴニストとして作用することで神経保護作用をもつ。
タウリンはBMAA暴露のラット脳において減少することが示されている。これはBMAAによるNMDA受容体の活性化により、タウリンの流出またはタウリンの生合成が阻害されることが原因である可能性が示唆されている。
www.ncbi.nlm.nih.gov/pubmed/23392930/
ALSのシアノバクテリア/BMAA仮説
www.tandfonline.com/doi/abs/10.3109/17482960903286009?journalCode=iafd19
L-セリンと神経変性
セリン輸送障害
セリンは神経細胞に浸透することができないため、セリン輸送障害を抱えている場合、外部からのセリン補給は無駄になる可能性がある。しかし高いセリン濃度では、特異性の低いアミノ酸トランスポーターを使ってニューロンに浸透する可能性がある。
onlinelibrary.wiley.com/doi/abs/10.1111/cge.12637
PGDH・PAST・PSP
セリン生合成において3つのセリン生合成酵素、PGDH、PSAT、またはPSPのうちの1つが欠乏するとセリン生合成経路の障害をもたらす。
セリンは食事、タンパク質およびリン脂質の分解、グリシンからの直接合成によって合成されるが、セリン生合成経路に欠陥がありそれを補うことができないと、脳を含むどの臓器においてもセリン欠乏を生じえる。
ASCT1
ASCT1の機能不全のは、ニューロンへのセリン輸送障害を引き起こし、ニューロンのセリン欠乏症を引き起こす。
タウのリン酸化不全
BMAAによるタウの過剰リン酸化
BMAA関与が疑われるグアムのパーキンソン病患者のPP2A活性の減少およびタウの過剰リン酸化が見出された。BMAA処置はラット脳においてPP2Acのリン酸化増加が観察された。
www.ncbi.nlm.nih.gov/pubmed/24395787
リン酸化の調節不全は、アルツハイマー病(AD)、前頭側頭葉変性症(FTLD)、運動ニューロン疾患を伴う前頭側頭葉変性症(FTLDMND)、前頭側頭葉変性(FTLD-U)を含むヒトの進行性神経変性疾患と関連している。
L-セリンがアミノ酸プールに存在する場合、通常のタンパク質合成中に非タンパク質アミノ酸による置換を受けやすい。L-セリンの補給が、BMAAによる神経毒からの神経保護において補助の役割を果たす可能性がある。
癌細胞の増殖への影響
外因的に投与されるL-セリンは、セリン合成経路に依存しない癌細胞の増殖を促進する傾向がある。
www.ncbi.nlm.nih.gov/pubmed/27634448
細胞増殖は高レベルのセリンを必要とし、胚性幹細胞および癌細胞のPHGDHおよびPSAT1の発現の増加によって、複製の増加が維持される。
www.sciencedirect.com/science/article/pii/S2211124714003477
www.nature.com/articles/nature10350
www.nature.com/articles/cddis2013393
molecular-cancer.biomedcentral.com/articles/10.1186/1476-4598-7-14
腫瘍抑制タンパク質p53とセリン
www.ncbi.nlm.nih.gov/pubmed/23242140
L-セリンの神経保護作用
BMAAとは異なる神経保護効果
L-セリンは、動物および細胞培養モデルの両方においてL-BMAA誘導性神経毒性に対して保護的であることが示されている。加えて、L-セリンが選択的にタンパク質ジスルフィドイソメラーゼ(PDI)タンパク質翻訳、ミスフォールディングタンパク質のリフォールディングに関与するERシャペロンを増加させる。
これはL-セリンの新しい神経保護メカニズムを示しており、神経変性疾患の治療薬としての可能性を示唆する。
www.ncbi.nlm.nih.gov/pubmed/28975502
インビトロでニワトリのニューロンを用いた初期の研究では、L−セリンがニューロンの長さおよび分岐を増加させることが示された。(savoca et al,1995)
ニューロンの生存
L-セリンおよびグリシンは、タンパク質合成の基質として作用する以外に、ニューロンの生存を支えるのに不可欠な役割を果たす可能性がある。
www.ncbi.nlm.nih.gov/pubmed/27161889
スフィンゴ脂質
セリンによって合成されるスフィンゴ脂質は、重要な部分を構成する角質層の細胞外脂質は、皮膚バリア機能において主要な役割を果たす。
www.sciencedirect.com/science/article/pii/S0014579306010155
生存率の向上
17日齢のラット胚の大脳皮質からニューロンをプレーティングし、L-セリンおよびグリシンの非存在下で培養すると、細胞が徐々に変性していく。しかし、グリシンと組み合わせてL-セリンまたはL-セリンを添加すると、生存率は有意に向上した。(Yang et al, 2000)
ALS
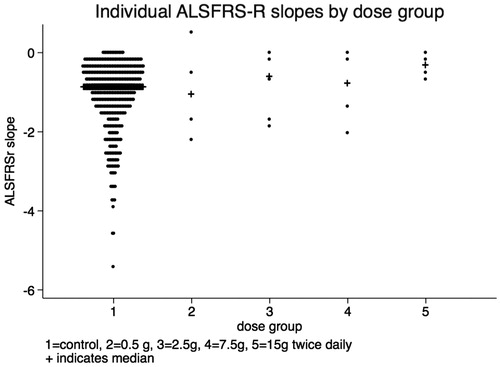
第一相臨床試験 ALS患者に対するL-セリンの安全性
患者(n= 20)は1、5、15、30 g /日のL-セリンを6ヶ月間投与
高用量郡での少数の患者で副作用(膨満感、吐き気、食欲の喪失)
www.ncbi.nlm.nih.gov/pubmed/27589995
図1. ALSFRS-Rの補正前の傾きを投与量別に比較したもの
アルツハイマー病
2017年FDAはアルツハイマー病患者へのL-セリン投与(15g×2回/日)第二相a臨床試験を承認。現在承認試験中にある。
アルツハイマー病マウスモデルにおいて、アストロサイトのグルコース利用減少が、L-セリン産生を減少させることが示されている。L-セリンは、主にアストロサイトにおいて産生され、その生合成経路はアルツハイマー病患者で変化させる。L-セリンの投与はマウスの記憶機能を回復させることを実証した。
www.sciencedaily.com/releases/2020/03/200303113357.htm
L-セリンの概日リズム調整作用
L-セリン投与は、この作用はGABA-A受容体を介してマウスの光誘発性の概日リズム位相シフトを増強した。L-セリン単独(その他のアミノ酸も含む)ではこの増強作用を示されず、光暴露と組み合わせることによってその効果が示された。またL-セリンは視交叉上核(SCN)の時計遺伝子(Per2、Bmal1)発現の長期的な変化を誘導する。
被験者へのL-セリン投与量3g
www.ncbi.nlm.nih.gov/pubmed/29070712
九州大学(日本語)
www.kyushu-u.ac.jp/ja/researches/view/186
L-セリンの供給源
L-セリンの供給源は、食事、デノボ合成、細胞内タンパク質の分解によるL-セリンのリサイクルがある。
www.ncbi.nlm.nih.gov/pmc/articles/PMC1223326/
www.ncbi.nlm.nih.gov/pubmed/22566694
アミノ酸サプリメント
L-セリンを使ったヒトの臨床試験がFDAによって承認されており、L-セリンは一般的に安全であることが支持されている。
L-セリンとグリシン
L-セリンとグリシンの補給は、いくつかの研究で患者のてんかん発作、生活の質などの改善をもたらした。
しかし精神運動および精神遅滞にはL-セリン治療は影響を及ぼさなかった。
www.ncbi.nlm.nih.gov/pubmed/8758134
www.ncbi.nlm.nih.gov/pmc/articles/PMC3026672/
食事(大宜味村の長寿)
100歳以上の長寿の多い沖縄大宜味村では,L-セリンが豊富な伝統的食品が食されている。
豆腐(大豆発酵)、枝豆、海藻、サツマイモ、豚肉が、もっとも頻繁に消費される。
Lセリンの食事からの摂取量は平均するとアメリカ人の2.5gに対して、大宜味村人々は8g以上(3~4倍)の量を摂取している。L-セリンが神経保護物質として作用していると考えられている。
大宜味で食べられる食品 TOP25
- 黄金シークワーサージュース(くがに) 162mg
- ミフシグサ (白米) 128mg
- ツルレイシ(ゴーヤ) 64mg
- 豆腐 2351mg
- ワカメ 771mg
- 真昆布 391mg
- 枝豆 1670mg
- さつまいも 480mg
- オオバアオサ 138mg
- ヨモギ 805mg
- ひじき 339mg
- 豚肉 1799mg
- サンシチソウ 649mg
- あおさ(ヒトエグサ) 138mg
- イバラノリ 196mg
- オゴノリ 253mg
- オキナワモズク 74mg
- マフノリ(フヌイ) 353mg
- ツノマタ(海藻) 52mg
- エゾミル(海藻) 512mg
- マクリ(海藻) 135mg
- ソテツ 455mg
- カツオ
www.ncbi.nlm.nih.gov/pmc/articles/PMC5343079/
PGDH欠乏症への投与量
小児期のPGDH欠乏症児童へのL-セリン投与(100〜150 mg / kg /日)は、発作、行動、および学校の成績を改善する。
onlinelibrary.wiley.com/doi/abs/10.1111/cge.12445
軽度の症状を示す患者では120-150 mg / kg /日
いくつかの研究では 200〜300 mg / kg /日、グリシン200〜700 mg / kg /日のL-セリンを投与することで発作の減少、痙縮の減少、白質量の増加を示した。
www.thieme-connect.de/products/ejournals/abstract/10.1055/s-2000-12944

