Contents
www.sciencedirect.com/science/article/abs/pii/S0304389418310021
著者 Korina Manolidi, Theodoros M. Triantis, Triantafyllos Kaloudis, Anastasia Hiskia
受信日 2018年4月
主な内容
- BMAAおよびその最も一般的な異性体であるDABとAEGの神経毒性
- シアノバクテリアの培養液および環境サンプル中のBMAA/DAB/AEGの存在
- シアノバクテリア由来の栄養補助食品中の神経毒アミノ酸の存在
- サンプル調製、分析方法、バリデーションデータに関する豊富な情報
- 不十分な分析方法と結合画分による結果の不一致
概要
藍藻は、水域や陸域に広く分布する光合成微生物である。藍藻は栄養価が高いことから栄養補助食品として工業的にも栽培されているが、藍藻はシアノトキシンと呼ばれる毒性のある二次代謝産物を幅広く生産することが知られている。シアノバクテリアが生産するBMAA(β-メチルアミノ-L-アラニン)とその最も一般的な構造異性体であるDAB(2,4-ジアミノ酪酸)およびAEG(N-2-アミノエチルグリシン)は、神経変性疾患との関連が指摘されている非タンパク性アミノ酸である。これらのアミノ酸にさらされる可能性があるのは、シアノバクテリアを原料とする食品サプリメントの摂取である。
本レビューでは、シアノバクテリアおよびシアノバクテリア由来の食品サプリメントにおけるBMAA、DAB、AEGの出現に関する既存の報告を批判的に論じている。報告された結果の不一致は、適用された異なる抽出・分析方法の性能や、化合物の可溶性と結合性の画分の決定に関する曖昧さに起因することが示されている。このレビューの重要な点は、神経毒アミノ酸の人の摂取に対する認識を深めることであり、栄養補助食品に関する文献に示された結果は、さらなる研究、品質管理、および食品中のシアノトキシンに関するガイドラインの作成を促進することである。
キーワード
BMAA; DAB/AEG; シアノバクテリア; 栄養補助食品; 分析法
ABBREVIATIONS
- AAA アミノ酸分析装置
- ACN アセトニトリル
- AD アルツハイマー型認知症
- AEG Ν-(2-Aminoethyl)glycine
- ALS 筋萎縮性側索硬化症(Amyotrophic lateral sclerosis)
- 筋萎縮性側索硬化症-パーキンソン病認知症
- ALS/PDC 複合体
- AQC 6-アミノキノリル-ヒドロキシスクシンイミディルカルバメート
- ADHD 注意欠陥多動性障害
- BEH エチレン架橋型ハイブリッド
- BGA 藍藻類(Blue-Green Algae)
- BMAA β-N-メチルアミノ-L-アラニン
- BAMA β-Amino -N -methylalanine
- CE キャピラリー電気泳動
- CRM 認証標準物質
- DAB 2,4-ジアミノ酪酸(2,4-Diaminobutyric acid
- DNS 塩化ダンシル
- Dw 乾燥重量
- EFSA 欧州食品安全機関
- FLD 蛍光検出器
- FMOC フルオロニルメチルオキシカルボニルクロライド(Fluorenylmethyloxycarbonyl chloride
- GABA γ-アミノ酪酸(γ-Aminobutyric acid
- GC ガスクロマトグラフィー
- HESI 加熱エレクトロスプレー・イオン化
- HILIC 親水性相互作用液体クロマトグラフィー
- HPLC 高速液体クロマトグラフィー
- HRMS 高分解能質量分析計
- インジェクション インジェクション
- LC 液体クロマトグラフィー
- LC50 人口の半分に対する致死濃度
- LD50 人口の半分に対する致死量
- LLE 液-液抽出
- LOAEL 観察された有害作用の最小値
- LOD 検出限界
- LOQ 定量化の限界
- MCX 混合陽イオン交換
- MeOH メタノール
- MRM マルチプルリアクションモニタリング
- MS 質量分析計
- MS/MS タンデム型質量分析計
- Ν.Α. 入手不可
- N.D. 検出されず
- OTC オルニチントランスカルバミラーゼ
- P-B タンパク質結合型
- F クロロホルム酸プロピル
- PCX ポリマーカチオン交換
- PD パーキンソン病
- PDC パーキンソン病痴呆症複合体
- RP-RRHT 逆相高速分解ハイスループット
- SCX 強力なカチオン交換
- SPE 固相抽出
- TCA トリクロロ酢酸
- TDI 1日あたりの許容摂取量
- UHPLC 超高性能液体クロマトグラフィー
- UPLC 超高速液体クロマトグラフィー(Ultra Performance Liquid Chromatography
- WHO 世界保健機関
1. はじめに
藍藻は古代の光合成微生物で、淡水、汽水域、河口域、海洋、陸域など様々な生態系に広く存在している[1-3]。藍藻は、水温、光照射、高濃度の栄養塩(N、P)などの好条件が揃うと、急速に増殖してブルームを形成する[2,4]。シアノバクテリアの大規模なブルームの発生は、気候条件の緩やかな変化や富栄養化を促進する人為的活動によって増加すると予想されている[5-7]。
シアノバクテリアは、シアノトキシンと呼ばれる有毒な二次代謝産物を放出することができ、人の健康や生態系に大きな脅威を与えている[2, 8-10]。シアノトキシンは、主に肝毒性を持つ環状ペプチド(ミクロシスチン、ノジュラリン)[2]、皮膚毒性や神経毒性を持つアルカロイド(シリンドロスペルモプシン、アナトキシン、サキシトキシン)[4, 11]、様々な毒性(細胞毒性、神経毒性、皮膚毒性、肝毒性)を持つリポポリサッカライド[12]、非タンパク性アミノ酸[13]など、幅広い化学物質から構成されている。
BMAA(β-N-メチルアミノ-L-アラニン)は、筋萎縮性側索硬化症(ALS)、パーキンソン病(PD)、アルツハイマー病(AD)などの進行性神経変性疾患の病因に関連している可能性があり、特に注目されている非タンパク性アミノ酸である[14]。
BMAAの最も一般的な構造異性体はDAB(2,4-diaminobutyric acid)とAEG(Ν-(2-aminoethyl)glycine)であり,これらは環境中にも存在し,神経毒性を引き起こす可能性がある[3, 15]。
BMAAの急性および慢性毒性については,動物モデルを用いた研究が行われているが[16, 17],ヒトにおけるALS,PD,ADなどの神経変性疾患の発症にBMAAが関与しているとの仮説は検証されていない[18]。
BMAAの他の異性体として,β-アミノ-メチルアラニン(BAMA),2,3-ジアミノブタン酸,3,4-ジアミノブタン酸,3-アミノ-2-(アミノメチル)プロパン酸,2,3-ジアミノ-2-メチルプロパン酸などが提案されているが[19],これらの特定の化合物の毒性や発生に関する情報は限られている[19-21].
人間はいくつかの経路でBMAAとその異性体に曝される可能性がある。
- (a)水環境で発生したシアノバクテリア・ブルームとの直接接触(経皮)
- (b)水性毒素を含む風で飛ばされたエアロゾルの吸入による間接暴露、
- (c)シアノバクテリア・ブルームにさらされた高次栄養レベルの生物(例:魚介類)やシアノバクテリアの摂取、
- (d)主にスピルリナ(Arthrospira属)アファニゾメノン(Aphanizomenon)ノストック(Nostoc)などのシアノバクテリアを含む栄養補助食品の摂取 [22-25]。
神経毒アミノ酸およびその異性体の様々な生息地における存在、特に環境試料中の濃度レベルについては、報告されたデータの信頼性に問題があるため、まだ完全には解明されていない[26]。文献には様々な結果が示されているが,その主な理由は,BMAAの異なる画分,すなわち,遊離またはタンパク質に結合した画分の測定に異なる分析技術が用いられていることである[27, 28]。これらの違いを明らかにするために、比較研究が行われている[30-33]が、それにもかかわらず、適用された分析法の性能に焦点を当てたさらなる評価研究が必要である。
以前のレビューでは、サンプルの前処理と分析に使用される分析技術に関する情報が提供されている[26, 34, 35]。神経毒性のあるアミノ酸のヒトへの暴露に関する情報は,最近発表されている[18, 35-38]。それにもかかわらず、食品マトリックスは魚介類に限られており、藍藻類を使った食品サプリメントに関する情報は限られている。
本レビューの目的は、シアノバクテリアおよびシアノバクテリア由来の食品サプリメントに含まれる神経毒性アミノ酸 BMAA およびその異性体である DAB と AEG の存在に関連する過去および現在の研究を紹介することである。特に本レビューでは、シアノバクテリアバイオマスの抽出と分析、および様々な水生生息地(淡水、汽水域、河口域、海洋)に由来するシアノバクテリアからなる栄養補助食品に関する文献の最新の概要を提供することを目的としている。適用されている分析方法は、分析上の課題に関連して提示されている。使用した技術やプロトコル、分析したシアノバクテリア、各研究の定量的な結果に関する情報を提供している。藍藻由来の栄養補助食品に関連する研究から得られた結果をまとめ、議論することで、栄養補助食品に含まれるこれらのアミノ酸の人間の摂取量に対する認識を高め、BMAA源への人間の曝露に対するリスク評価を促進することを目的としている。
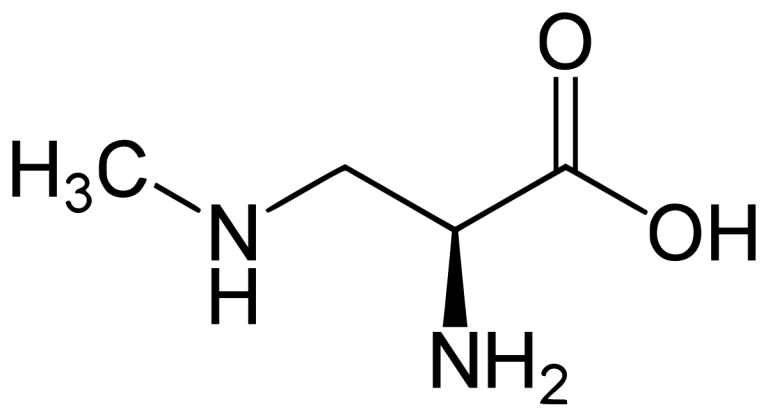
2. BMAA,DABおよびAEGの物理化学的特性
図1を挿入(印刷では白黒表示)
BMAAは、分子量118.13gmol-1の非タンパク性アミノ酸(生物の遺伝暗号に含まれていない)である。カルボキシル基とアミノ基を持つα炭素からなり、メチルアミノの側鎖を持つ(図1)。極性があり,親水性でオクタノール-水分配係数が低い[39]。BMAAは塩基性アミノ酸で,pKa(酸解離定数)は2.1(カルボキシル基),6.6および9.8(アミノ基),等電点(pI)は8.1である[40-42]。BMAAは,遊離型とタンパク質結合型の両方が存在する可能性があり[43],遊離型とタンパク質結合型の比率は1:60から 1:120の間であることが示されている[44]。最近では,BMAAの新たな画分(可溶性結合型)がさまざまなサンプルに存在することが報告されている[33, 43]。DABは極性のある塩基性アミノ酸であり,pKa値はそれぞれ8.41と10.42と高いが[45],オクタノール-水分配係数の値は類似している[39, 46]。DABとAEGは,BMAAと類似したフラグメンテーションパターンを有しており,どちらもタンパク質に遊離または結合した状態で検出されることがある[33, 45, 47]。AEGの結合型は,シアノバクテリアを主な供給源とする食物網の高次のレベルの生物で発生することが報告されており,シアノトキシンのバイオマニフィケーションの可能性を示唆している[48]。AEGは,他の2つのアミノ酸と比較して,アキラルである。
3.BMAA,DABおよびAEGの毒性
BMAAは進行性の神経変性疾患の原因になると言われている。毒性研究によると、特定の条件下で、BMAAが神経細胞のタンパク質(主に小脳)に誤って取り込まれる可能性があり[49-52]、神経細胞の損傷[53-56]、タンパク質のミスフォールディング[49]、酸化ストレス[57, 58]を引き起こすことが示唆されている。しかし,最近,BMAAのタンパク質誤取り込み仮説の妥当性が疑問視されており[59-61],毒性の主なメカニズムは興奮毒性であり,タンパク質の折り畳みを妨げる特定の酵素の阻害が起こる可能性が示唆されている.
BMAAは,神経変性疾患である筋萎縮性側索硬化症-パーキンソン病-認知症複合体(ALS-PDC)の原因物質である可能性が示唆されている[53, 55, 62]。ALS-PDCは,神経変性疾患であるALS,PD,ADと共通する多くの臨床的および神経病理学的側面を有している[63]。ALS-PDCは,太平洋のマリアナ諸島にあるグアムの先住民チャモロ人の間で初めて観察され[40],ソテツの種子を粉にしたトルティーヤや団子,ソテツの種子を食べるオオコウモリなど,BMAAを含む食品の摂取が原因であると主張された[64-66]。
遊離型およびタンパク質結合型のBMAAの生物蓄積は、元々、ソテツの種子に含まれる自由に生きているシアノバクテリアから共生しているシアノバクテリア、さらにオオコウモリへと、食物連鎖に沿って濃度が増加するという形で、グアマンの生態系で報告されている[67, 68]。フライングフォックスは、ソテツの種子を食べていたこととは別に、同時にチャモロの先住民の高級食材でもあった[67, 69, 70]。グアムのチャモロ人ALS/PDC患者の脳組織では、シアノバクテリアから遊離したBMAAが10,000倍にもなっていることが報告されている[67]。また、BMAAは主にタンパク質に結合した形で存在することも示されている[68]。BMAAの移行とバイオマニフィケーションは、グアムの熱帯陸生生態系の外側に位置する温帯水生生態系のような他の生態系でも報告されている[24]。
BMAAの神経毒性[17, 18, 71-75]とその生物学的役割[76]に焦点を当てた出版物がいくつかあり、BMAAの毒性の様々な分子的側面[71]や、疫学的側面や曝露の可能性のある経路を含むより一般的な問題[72, 73]について議論されている。
ヒヨコ、ラット、マウス、サルを対象とした多くの生体内試験研究[40, 54, 64, 77-85]や、脳組織を対象とした研究[86]では、行動、神経化学、神経病理学的変化が指摘されているが、他の研究では、BMAAを注射しても毒性学的影響はないことが示されている[87-90]。また,成体のC57BL/6マウスに,L-BMAA,ミクロシスチン-LR,またはそれらの混合物を5日間反復投与しても,認知機能に悪影響を及ぼすことはなかった[91].ALSで死亡したチャモロ島の患者の脳組織[92]や、ADが確認された患者の脳[93]では、BMAAの同定・定量に効率的な分析方法が用いられていたにもかかわらず、BMAAは確認されなかった。一方、BanackとMurch[94]は、ALS/PDCで死亡したチャモロ人の神経変性患者の脳組織にBMAAが存在することを報告している。他の研究では,ADおよびPDC患者のヒト中枢神経系でBMAAを検出できなかった[95-99].多くの研究が,BMAAが興奮毒性を引き起こすと結論づけている[53, 55, 57, 62, 81, 100-106].
曝露によるリスクを定量化するために,BMAAの致死量と損傷量を決定する努力がなされてきた。解離した脊髄の培養では,30μMの低濃度のBMAAで運動ニューロンの喪失が観察され[55],50%の水生動物種に対するBMAAの致死量は10~5000μg L-1の間で変化している[107]一方,10μMのBMAAは他の神経毒化合物の存在下で神経細胞を損傷するのに十分であると報告されている[53]。
BMAAは、ALSの長い潜伏期間が観察されることから、「slow toxin」[108]と呼ばれている[22, 68]。グアムからの移住者は、グアムを離れてから34年後にALSを発症しており、30年以上の潜伏期間があることを示唆している[109-111]。おそらく、BMAAが生体内でタンパク質に取り込まれることが原因であろう[112]。同様に、グアムに移住した住民は、移住してから最大29年後に発症した[113]。
BMAAに関連する真の危険性に関するコンセンサスが得られていないため、神経毒への慢性的な暴露に関連するリスクは決定されていない[71]。ほとんどの研究はBMAAの急性作用を扱っているが、ALSのようなヒトの神経変性疾患とBMAAとの関係を調査した長期研究は限られている[114]。さらに,BMAAの投与経路として脳室内,耳介内,あるいは心筋内への直接注入を選択した場合,高用量の化合物を脳組織内に投与することが可能である[18].最近の研究では,BMAAの急性毒性がマウスで試験され,BMAAを腹腔内投与した場合,マウス集団の半数に対するBMAAの推定致死量(LD50)は3 mg g-1体重(bw),最少観察有害影響レベル(LOAEL)は2 mg g-1体重(bw)であった[16]。有意な副作用が観察されているが,このようなデータをBMAAの環境暴露の主要経路である経口投与に外挿することは困難である。BMAAの潜在的な健康上の脅威を評価するためには、環境に適したレベルのBMAAを経口投与した場合の新たな調査を行う必要がある。また、環境に起因するヒトの神経変性疾患へのBMAAの関与を明らかにするためには、長期的な研究が必要である。いずれの場合も、BMAAの測定は、信頼性の高い有効な分析法を用いて行う必要がある(7項参照)。
BMAAの最も支配的な構造異性体の一つであるDABは、いくつかの研究で神経毒性があるとされている[27, 115-118]。ラットを用いた毒性試験では,DABは強い神経毒性を示し,1kgあたり7mMの皮下投与で,過敏性,後肢の虚弱,震え,痙攣などの行動を起こし,その後,痙攣を起こして死亡することが示されている[15, 119-122]。DABは,神経衰弱や神経興奮に関連する神経細胞の損失の病因に寄与する可能性が示唆されている[56, 62, 123]。DABは,腫瘍,神経節,肝臓などの細胞に速やかに吸収されることが示されている[119, 124, 125]。小脳や大脳皮質の神経節細胞は,DABに曝露されると,縮んだり細胞分裂を起こしたりして,局所的な変性を示した[15, 119, 125]。DABの取り込みは,肝酵素であるオルニチントランスカルバミラーゼ(OTC)を阻害し,尿素サイクルが乱れることでアンモニア中毒を引き起こすため,肝障害を引き起こすことが示唆されている[15, 126]。さらに,DABの肝臓への蓄積が報告されており[15],神経毒性のほかに肝毒性もあるのではないかと考えられている[127]。DABの神経毒性には、DABとGABA(γ-aminobutyric acid)との相互作用が重要な役割を果たしているようである。GABAは、哺乳類の中枢神経系における主要な抑制性神経伝達物質であり、神経系全体の神経細胞の興奮性を低下させる主な役割を果たしている。ヒトでは、GABAは筋緊張の調節にも直接関与している[128]。DABは,血液脳関門を通過して脳内に浸透し,その結果,脳内でGABAが増加する[121, 129, 130]。DABの神経毒性は,DABとGABAのシナプス後受容体との相互作用に関連することが示唆されている[131]。また,DABの毒性は,DABの脱炭酸生成物であるジアミノプロパンに起因するとされている[121]。
AEGのようなBMAAの他の異性体の毒性については,ほとんど研究されていない。Artemia salina(水生動物)に対する毒性試験では,AEGの人口の半分に対する致死濃度(LC50)は,24時間暴露で100 mg mL-1以上,96時間暴露で8.8 mg mL-1以上となり,時間および用量依存的に作用することが示された[3]。AEGのこれらの結果は,以前の毒性研究[107]で報告されたBMAAのLC50の値と比較すると,AEGはBMAAよりも約10,000倍も毒性が低いことがわかる。AEGの未知の毒性は,他の研究でも報告されており[21, 132],したがって,その潜在的な毒性作用をさらに調査する必要があることを示唆している。
しかし,世界保健機関(WHO)や欧州食品安全機関(EFSA)からは,飲料水,魚介類,魚類,藻類食品サプリメント(スピルリナを含む)に含まれるBMAAとその異性体に関する公式な規制・ガイドラインは提案されていない[37].
4. シアノバクテリアにおけるBMAA, DAB, AEGの存在。
BMAAはもともと、自由に生きるシアノバクテリアを含む裸子植物Cycas circinalisの種子から単離されたが[40]、その後、ソテツの木であるCycas micronesicaの根に共生するNostoc属のシアノバクテリアによって生産されていることが発見された[67]。他のいくつかの研究では、BMAAが、淡水[22, 133-136]、汽水[22, 135]、海洋[22, 30, 136]、河口[136, 137]の水生環境や、陸上の生息地から分離されたNostoc sp.によって生産されることが示されている[22, 68]。報告されている濃度は,乾燥重量(dw)で0.2 μg g-1から 1.7 mg g-1の間で変化している(能力1)。しかし,他の研究では,高い選択性と感度を持つ分析方法を用いたにもかかわらず,Nostoc属のシアノバクテリアからBMAAを検出することができなかった[45, 132]。

Coxら[22]がシアノバクテリアのすべてのグループによるBMAAの生産を報告した2005年以降、かなりの数の研究が、培養コレクションやフィールドサンプルにおけるこの神経毒の存在を扱っている。具体的には,Oscillatoria属,Pseudanabaena属,Anabaena属,Planktothrix属,Cyanodictyon属,Limnothrix属,Nodularia属,Myxosarcina属,Leptolyngbya属,Microcoleus属,Phormidium属,Synechococcus属に属するシアノバクテリアの菌株培養でBMAAが検出されている[27, 136-139]。また,BMAAは,淡水,汽水域,海水域で繁殖するMicrocystis,Aphanizomenon,Anabaena,Pseudanabaena,Planktothrix,Nodularia,Oscillatoria,Gomphosphaeriaといったシアノバクテリア属の藻類のサンプルからも報告されている[24, 140]。陽性試料中のBMAA濃度は、フィールド試料では1 ng g-1~276 μg g-1 dw、シアノバクテリア培養液では20 ng g-1~6.4 mg g-1 dwの範囲で値が異なる。シアノバクテリア培養物のサンプルで測定されたBMAA質量分率の範囲が広いのは、分析に異なる方法が使用されていることや、シアノバクテリアが様々な生息地に由来することに起因すると考えられる。一方,BMAAは,淡水や汽水域から採取したシアノバクテリアのサンプルや,Microcystis属の培養シアノバクテリア株からは検出されないことが報告されている[27, 32, 45, 132, 141], Cylindrospermopsis [27, 141], Anabaena and Aphanizomenon [27, 32, 33], Synechocystis [22, 27, 132, 139], Leptolyngbya, Symploca, Synechococcus and Calothrix [33, 132, 139]属の培養シアノバクテリア株からは検出されなかった。
BMAAの発生に関する矛盾した報告には、環境要因が影響している可能性がある。シアノバクテリアによる細胞性BMAAの産生は、窒素欠乏などの外的要因に依存する可能性が示されているが[142]、培地中の窒素の存在がBMAA産生に影響を与えなかった別の研究ではそのようなことはなかった[136]。最後に,BMAAはシアノバクテリア(原核生物)だけではなく,珪藻や渦鞭毛藻(真核生物)でも生産されることが報告されている[143-145]。

DABは,シアノバクテリアなどの原核生物と真核生物の両方に広く存在している[115]。DABは,ポリミキシンA,サーキュリン,コリスチンなどの細菌代謝物の成分として最初に同定されたが[146, 147],その後,顕花植物の一種(Polygonatum multiflorum)の根茎[148],他の被子植物の一種(Lathyrus latifolius)[120],マメ科植物[120, 149]など,いくつかの真核生物でも同定されるようになった。DABはウシの脳でも発見され[150]、何年も後にソテツの種子でも発見された[151]。2008年に初めてシアノバクテリアやブルーム中のDABの分析が行われたが[152]、どのサンプルからもDABは検出されなかった。それ以降,いくつかの研究で,淡水[45],都市水域から採取したシアノバクテリアのスカム[29],実験室で培養したサンプルやブルーム[32, 127]など,異なる生息地のシアノバクテリアのサンプルからDABが報告されている。DABは、Chroococcales、Oscillatoriales、Nostocalesのシアノバクテリア目が優占する砂漠環境(地殻、湧水)で持続的に検出されている[3, 31, 118, 153]。D Bは、CylindrospermopsisやAnabaena [27]、icrocystis [27, 32, 45, 132]、Nodularia [27, 127]、Synechocystis [27, 132]などの他のシアノバクテリアでも確認された。Leptolyngbya and Aphanizomenon [127], Nostoc [45], Symploca, Synechococcus and Calothrix [132]の濃度は70 ng g-1 [27]から56 μg g-1 [32]の間で変化したdw. 一方,ある研究では,LeptolyngbyaシアノバクテリアからDABを検出できなかった[21]。また,別の研究では,検証実験でDAB標準物質を使用したにもかかわらず,AphanizomenonとNodulariaのブルームサンプルの分析に関して,DABの検出に関する情報が得られなかった[24]。
EGは,淡水,海水,温泉に由来するシアノバクテリアから検出されている[19, 48]。また,DABと同様,AEGもカタールの砂漠に生息するシアノバクテリアの痂皮から発見されている[3, 118]。AEGを産生する藍藻は、Synechocystis、Chroococcidiopsis、Oscillatoria、Lyngbya、Nodularia、Anabaena、Fischerella、Phormidium、Anabaenopsis、Chroococcales、Leptolyngbya、Synechococcus、Nostocであり、その濃度は10 ng g-1から34 μg g-1であることが報告されている[48]。興味深いことに、AEGは遊離型でのみ検出され、結合型は軸性シアノバクテリア株では検出されなかった。
最近では、最古の極地シアノバクテリアサンプルであるスコット船長の「ディスカバリー」国立南極探検隊(1901-1904)で採取された南極シアノバクテリアマットの分析により、南極での人間活動以前にBMAA、DAB、AEGが存在していたことが示された[154]。
以上を考慮すると、BMAAとその異性体であるDABとAEGは、多くのシアノバクテリア種によって、特定の条件下で、多くの水生環境で生産され、BMAAはシアノバクテリアの5つのセクション(シアノバクテリアの形態学的グループ[22, 155])すべての代表者によって生産されると思われる。しかし,この結果は慎重に一般化すべきである。シアノバクテリアのサンプルの分析に異なる方法が使用され,ほとんどのケースで検証データが含まれていなかったため,結果が一致しないことが多いからである[26]。提示された濃度の結果に矛盾が生じるもう一つの理由は、BMAAとその異性体は、遊離型とタンパク質結合型という異なる形態で発見される可能性があり、それらの決定に別の誤差要因をもたらすことである[27-29]。その上,最近導入されたBMAAの可溶性結合画分[33, 43]は,以前の研究では考慮されていなかった。
環境試料中のBMAAの存在を判定するために、Faassen[26]は一連の異なる基準を用いて、報告されているいくつかの分析方法の品質を評価した。その結果、シアノバクテリア培養液では0.73 μg g-1 dw、フィールドサンプルでは4~42 μg g-1 dwのシアノバクテリア陽性サンプル中の濃度で、BMAAが正しく測定されていることを示す説得力のある証拠を提供したのは、9つの研究のみであった。Lanceら[35]は、野外および培養シアノバクテリアサンプルに関する最近の別の研究において、いくつかの質的・量的基準を満たす分析方法で得られた発表結果のみを考慮した。この方法では、2.3 ng g-1から42 μg g-1 dwシアノバクテリアバイオマスまでの非常に限られたデータが信頼できるものとして報告された。これらの研究は、信頼できると考えられる分析方法を使用することで有効な結果が得られることを示しているが、方法の品質基準は必ずしも包括的に定義されなかった。
シアノトキシンの分析には分析法のバリデーションが必須であり、性能基準は使用目的に応じて設定する必要がある[156]。最近提案された分析法[33, 152]は性能要件をかなり高いレベルで満たしているが、さらなるバリデーションが必要である(例:BMAA異性体のm/zイオン比、異なる濃度レベルでのバリデーション、許容できる性能基準の定義など)。その結果、検証済みの方法を用いた環境試料中のBMAAの出現に関するデータが不足しており、新たなモニタリング研究が必要となっている。
表1参照
5. 食品添加物中のBMAA,DAB,AEGの出現率
過去数年にわたり、シアノバクテリアからなる有機栄養補助食品は、しばしば「アオコ」(BGA)として取引されており、ストレス解消、体重減少、解毒、気分の改善などの有益な健康効果や、抗炎症、抗酸化、抗がん性などの特性があると考えられ、アスリート、妊娠中または授乳中の女性、ベジタリアンの間で消費が増加している[157-162]。BGA製品はまた、注意欠陥多動性障害(ADHD)の治療薬として子供たちに使用されている[163]。BGAサプリメントは、必須アミノ酸や脂肪酸、ミネラル、光合成色素、多糖類を含み、鉄分が豊富であるため、貧血を回復させることが報告されている[164-167]。しかし、これらの製品を消費すると、胃腸障害を引き起こす可能性があるという報告がある[168]。
藻類栄養補助食品の製造に使用される最も一般的なシアノバクテリアは,スピルリナ(Arthrospira),アファニゾメノン(Aphanizomenon),ノストック(Nostoc)である[157, 169, 170]。

Arthrospiraは水生の糸状シアノバクテリアであり[169],最適な生育温度は35〜38℃の範囲にある。そのため,温暖な気候条件で栽培され,通常の商業名「スピルリナ」で栄養補助食品として利用されている[171]。しかし、この呼称はしばしば混乱を招く。したがって、商業的に栽培され、スピルリナとして販売されているすべての食用形態は、実際にはArthrospira属に属し、本文中ではArthrospiraベースの製品として定義されていることを指摘しておくことが重要である。いくつかのArthrospira属の種は、様々な果物、野菜、ハーブを含む「グリーン・ドリンク」サプリメントに頻繁に取り入れられている[25]。これらの種は一般的に無毒であると考えられており[172],一方で,水産養殖や家禽産業で使用されている[173, 174].しかし、適切な品質管理システムを欠いた自然の水環境で培養すると、水域に存在する毒素を産生するシアノバクテリア種によって、クトロスピラをベースにした製品が汚染される可能性がある[172]。Arthrospiraをベースとした製品の摂取は、横紋筋融解症と呼ばれる人間の生命を脅かす疾患と関連しており、これは筋肉細胞の内容物を全身循環に放出することにつながる[175]。別のArthrospiraベースの製品は、肝毒性作用が疑われているが[176]、その数年後、この種の製品は肝保護作用があると主張され、C型肝炎による慢性肝感染にプラスの効果を示した[177]。したがって、Arthrospiraをベースにした製品は人間の消費に対して安全であると結論づけられた。一方、悪影響は、培養や抽出の際に生産物を汚染する可能性のある他のシアノバクテリアによって引き起こされる可能性がある。
Aphanizomenon flosaquaeは、栄養補助食品の生産にも使用されている[172, 178]。
世界中の管理された貯水池から収穫されるArthrospiraベースの製品とは異なり、Aphanizomenon flosaquaeは、米国オレゴン州のLake Klamathで高密度の自然ブルームを形成し、そこから収穫され、独占的に採取されている。「AFA」や「Klamath Algae」としてよく販売されている[178]。製品の安全性を確保するため、クラマス湖では定期的な毒性学的検査が行われているが[179]、それにもかかわらず、生産が湖の開放的な自然環境で行われているという事実は、他のシアノバクテリア種による偶発的な汚染を引き起こす可能性がある[180]。典型的な例としては、Aphanizomenon flosaquaeと共存するシアノバクテリア種Microcystis aeruginosaによる汚染が挙げられる[168]。
最後に、Nostoc属の種は栄養補助食品として流通している可能性があり[170]、Nostoc属の種の中には全食品として使用されているものもある。Nostoc flagelliforme(Berkeley et Curtis)は、中国で約2,000年前(晋の時代 – .D.265-316)から食品の珍味として使用されている[181]。これはノストック科の黒い糸状のシアノバクテリアで、世界中の乾燥した砂漠の草原、湿度が限られた地域、裸地や丘陵に生育する[182]。髪の毛のように見えることから、中国語では「ファサイ」と呼ばれ、文字通り「髪の毛の野菜」を意味するが、発音は「幸運になる、金持ちになる」という意味の別の言葉を指している。その結果、Nostoc flagelliformeは幸運のシンボルともなっている[181]。Nostocの別の食用種であるNostoc sphaeroides(Kützing)もまた、伝統的な中国料理でサラダやスープの材料として使用されてきた[183]。冬季には、中国の水田などの様々な水生環境で、球状のコロニーを形成して生息している[184]。シアノバクテリアの栄養学的・薬学的価値は以前から報告されており、Nostoc sphaeroidesは、炎症、細菌、ウイルス、腫瘍、癌を治療し、消化を助け、免疫系を高める能力があることが知られている[183-187]。Nostoc commune(Vaucher ex Bornet et Flahault)は、食品への添加物やメインディッシュとして使用されていたが[133]、一部の地域ではNostoc flagelliformeと共棲している[181]。食物繊維が豊富に含まれていることが報告されており、シアノバクテリウムはラットの血清コレステロール値を低下させると結論づけられている[188]。ヒトでの効果については、さらに調査する必要がある。
シアノバクテリア由来の食品サプリメントにおけるBMAA、DAB、AEGの出現については、ほとんど研究が行われていない。BMAAは、最初の研究では、テストした5つの製品のうち4つの製品で0.13-0.74μg g-1の濃度範囲で検出され[189]、2番目の研究では、商業メーカーからの4つの原材料サンプルで最大70ng g-1が検出された(表2)。一方、Arthrospiraベースの製品におけるBMAAの分析に関しては、いくつかの研究で否定的な結果が報告されている[25, 27, 152, 172]。また、Arthrospira fusiformis粉末[139]および中国のスピルリナ施設で製造された錠剤の形をしたArthrospiraベースの製品[21]には、検出可能な量のBMAAが含まれておらず、メソッドのバリデーションおよび定量化のための負のコントロールおよびシアノバクテリアマトリックスとして使用できると主張されている。レッサーフラミンゴの羽毛の抽出物には微量のBMAAが検出され,DABは3.5~8.5 μg g-1の濃度で存在した[191]。レッサーフラミンゴ(Phoeniconaias minor)は、主にArthrospiraを中心としたシアノバクテリアを主要な食料源として利用することが知られている[192-194]。
表2を挿入
Bは、Arthrospiraベースの製品について実施された7つの研究のうち2つの研究で検出され(表2)試験したすべてのサンプルにおいて、最初の研究では9.32~107.06μg g-1,2番目の研究では最大80ng g-1の間で濃度が変化した[189]。なお,2件目の研究[190]では,質量分析法や定量用に選択したイオン遷移の違いにより,異なる結果が得られている.別の比較研究[25]では,6-アミノキノリル-N-ヒドロキシスクシンイミジルカルバメート(AQC)で誘導体化したDABが,試験した10種類のArthrospira由来の製品のうち10種類で,0.490~2.493 μg g-1の濃度範囲で検出されたのに対し,誘導体化していないDABはいずれの試料でも検出されなかったという矛盾した結果が得られた。この不一致は,誘導体化工程の追加だけでなく,使用した分析技術にも起因すると考えられる。DABは,Hydrophilic Interaction Liquid Chromatography coupled to tandem Mass Spectrometry(HILIC-MS/MS)を用いた研究のいずれにおいても検出されなかった[25, 27, 152, 190]。AEGは、いくつかの研究[25, 189, 190]において,0.14~6.48 μg g-1の濃度範囲で検出された。
Aphanizomenon flosaquaeの栄養補助食品に含まれるBMAAとDABを分析した研究は1件しか報告されておらず[172],両化合物について肯定的な結果が得られた。しかし、定量的な結果が得られたのはBMAAのみで、試験した4種類のサプリメントのうち2種類では0.04および0.55μg g-1の濃度であった。ホールフードとして使用されるNostoc種についても同様である。ペルーの7つの異なる市場から採取したNostoc communeの球状コロニーにBMAAが100%含まれていることを報告した研究は1件のみで、その濃度は2.04〜21.51μg g-1の間であった[133]。しかし,使用された方法は十分に検証されておらず,DABやBMAAの他の異性体に関する情報は提供されていなかった。
BGA製品中のBMAAを調査した別の研究では、いずれのサンプルからもBMAAが検出されなかったが、分析したシアノバクテリアの種は特定されていない[23]。
BMAA とその異性体が混入した場合、藍藻由来の食品サプリメントは、人間の健康に対する脅威となる可能性がある。残念ながら、ほとんどの栄養補助食品は、医薬品ではなく食品として分類されているため、品質管理があまり厳しくない[195]。これらの製品は、医師の処方箋や免許証を必要とせず、インターネットで購入できる状態で、世界規模で販売されている。生産者が示唆しているように、これらの製品が人間によって頻繁に、より大量に、より長期間にわたって消費されているという事実は、消費者がシアノバクテリアの毒素に危機的にさらされるリスクが高まっていることを示している[157]。
BGAサプリメントに含まれるミクロシスチン-LRの暫定的な耐容一日摂取量(TDI)は、成人で1日あたり0.04μgミクロシスチン-LR kg-1 bwである[168]。このTDI値を用いて、Gilroyら[168]はBGAサプリメントに含まれるMCの暫定的な許容レベルを1μg g-1 dwと算出し、オレゴン州保健局はBGA製品の規制基準としてこれを採用した。規制基準は、一般的に合意された分析性能基準がある場合にのみ意味を持つ。このような食品サプリメントに含まれるBMAAについては、規制基準が提案されていない [37]が、その分析の性能基準は、農薬などの物質や食品中の残留物など、規制に含まれる他の有機汚染物質のために確立された基準に概ね従うべきである [196, 197]。 表2に含まれるほとんどの方法は、程度の差こそあれ検証されているものの、意図された用途に対して必ずしも適切ではない [156, 198]。この観点から、シアノバクテリア食品サプリメント中のBMAAと異性体の存在を確実に評価するためには、適切に検証された方法と集中的なモニタリングプログラムの両方が必要である。
6. シアノバクテリアおよび食品サプリメント中の BMAA, DAB, AEG のサンプル調製法
BMAAとその異性体は、遊離型、タンパク質結合型、またはその他の不特定多数の形態として細胞基質中に存在する可能性がある[43]。これらの不定形を解明するための用語は,Faassenらによってよく提案されている[33]「遊離」BMAAはまずマトリックスから抽出され、結合BMAAは「可溶性結合」画分として溶液中に見出されるか、「析出結合」BMAAとして抽出中に析出する。結合画分は以下の方法で回収できる。
酸加水分解によって回収することができる[33, 43]。析出結合画分は通常、タンパク質結合またはタンパク質関連BMAAと呼ばれるが、BMAAとタンパク質との関連性についてはさらに調査する必要がある。「総BMAA」は、すべての画分の合計である。したがって,結果に誤ったポジティブまたはネガティブなバイアスがかからないようにするためには,各基質からのアミノ酸の抽出方法を適切に選択することが重要である[33]。 シアノバクテリアのブルームサンプル,実験室のシアノバクテリア培養液,または食品サプリメントからBMAAとその異性体を抽出するには,いくつかのステップが必要である。サンプルの前処理の最初のステップは,サンプルから水分を除去するためにシアノバクテリアの塊を凍結乾燥させることである[199]。凍結乾燥したサンプル,または乾燥した形で市販されている製品の場合は生の粉末から,適切な溶媒,通常は水に0.1~0.3のトリクロロ酢酸(TCA)を用いて,遊離のBMAAを抽出する[22, 23, 27-30, 32, 33, 48, 68, 132-135, 137-141, 152, 200-202](表1および2)。また,塩酸(HCl)[138, 141],アセトニトリル(ACN)[152],メタノール(eOH)[19, 21, 45, 127, 135, 139, 152, 203],クエン酸で酸性化した水(pH~4)[172]など,他の溶媒も使用されている。結合アミノ酸および全アミノ酸は,HCl 6M [3, 19, 21, 22, 27-33, 45, 48, 68, 127, 133, 135-137, 140, 152, 153, 190, 200, 201, 203, 204]またはHCl 12M [134]を用いて,抽出後に残ったタンパク質ペレットを加水分解した後,または凍結乾燥したサンプルから直接採取した。他の研究では、BMAAのタンパク質結合型を抽出するために、2%チオグリコール酸[138, 200]、6M HClで加水分解する前の90% MeOH[203]、6M NaOH[48]など、異なる溶媒を使用している。
BMは細胞内に存在する[19, 203]。凍結融解(または凍結乾燥)を1~3回繰り返すことが、細胞の破壊に最も適した技術であると思われるが、これは通常、超音波処理や超音波加工によって支援される[19, 21, 68, 127, 202]。凍結融解や超音波処理は、シアノバクテリアのサンプルの抽出/加水分解の前または後に行うことができる。
抽出物は通常、直接分析されるか[3, 22, 27-33, 48, 133, 135, 137, 138, 140, 152, 153, 201, 203, 204]、分析の前にSPEでさらにクリーンアップされることもある。この目的のために,様々なイオン交換SPEカートリッジが使用されている。例えば,MCX [45, 134, 136, 141, 202]は混合モードのポリマー吸着剤で,BMAAサンプルの前処理に最もよく使用されているが,他の材料も使用されており,強カチオン交換(SCX)[23,172,200],ポリマーカチオン交換(PCX)[132],C18 [23, 68],C8/SCXのハイブリッド[19, 21, 24, 127,
139, 205]. ある研究では,SCXによる洗浄だけでは妨害成分が除去されなかったため,BGAサプリメントの抽出物をまずC18カートリッジで通過させ,さらにSCX SPEカートリッジで洗浄した[23]。別の研究では,前述のハイブリッド8/SCXカートリッジを用いたSPEの前に,追加の精製ステップとしてクロロホルムによる液液抽出(LLE)を行った[21]。非極性化合物はクロロホルムに結合するため,除去することができる[206]。サンプルの精製は,誤った結果を避けるための重要なステップであると考えられる。HILIC-MS/MSで分析した場合,遊離BMAAを含む未精製のTCA抽出物は,マトリックスサプレッションの原因となることが報告されている[207]。
7. シアノバクテリアおよび食品サプリメント中のBMAA, DAB, AEGの分析方法
BMAAとその異性体は、非常に類似した特性を持つ小さな極性分子であり、ラン藻サンプル中に様々な濃度レベルで、遊離毒素として、またはタンパク質に結合した状態で存在する可能性があるため、ラン藻培養液や食品サプリメント中のBMAAの分析は困難な課題である[33, 43]。最も重要なことは,BMAAの構造異性体が共溶出し,BMAAと誤認される可能性があることである[115, 152]。そのため,複雑なマトリックス中での化合物の分離と定量は困難であり,そのため,しばしば議論を呼ぶ結果が文献に報告されている[45]。さらに、シアノバクテリア由来の食品に含まれるBMAA、DAB、AEGの分析は、栄養補助食品として広く利用されているにもかかわらず、ほとんど研究されていない(Table 2)。
図2を挿入(印刷では白黒に)シアノバクテリアおよびシアノバクテリア由来の食品サプリメントに含まれる、その異性体(表1,2,図2)。蛍光検出器付き液体クロマトグラフィー(HPLC-FLD)は,18本の分析カラムを用いて誘導体化されたBMAAの定量に用いられている[22, 30-32, 133, 135, 140, 201, 203, 204]。前述の研究では,この種の化合物に最も一般的に使用されているAQCを誘導体化剤として用いた。BGA製品に関するある研究では,同じ手法を用いているが,FMOC(フルオレニルメチルオキシカルボニルクロライド)で誘導体化したBMAAを使用している[23]。
BMAAの検出と定量には,様々な分析法が適用されており,[30, 133],AAA(アミノ酸分析装置)[30, 31],1H NMR(核磁気共鳴)[205]などがある。
主にAQCで誘導体化されたアミノ酸の分析には,UHPLC -UV(超高速液体クロマトグラフィー)や-UV(キャピラリー電気泳動)[137]などの他の分析システムも使用されている。液体クロマトグラフィー質量分析計(LC-MS)およびトリプル四重極質量分析計(LC-MS/MS)を用いて,シアノバクテリアのサンプル中の誘導体化されたBMAAおよびその異性体を分析した。ある研究では,クロロホルム酸プロピルで誘導体化した遊離およびタンパク質結合BMAAの測定に,質量分析に結合したガスクロマトグラフィー(GC-MS)を適用し,27のシアノバクテリアサンプル中19のBMAAを検出することに成功している[138]。
BMAAとその異性体には発色団や蛍光団が存在しないため,UV-vis検出器や蛍光検出器で検出するためには,誘導体化が必要となる[203]。特にAQC剤を用いた誘導体化は,分子量が増加した安定な蛍光性誘導体によってBMAAを他の化合物と区別できるなど,一定の利点があると主張されている[21, 27, 115, 127]。
しかし,HPLC-FLDで分析する場合,誘導体化によって複雑なシアノバクテリアマトリックス中のBMAAを誤認する可能性がある。なぜなら,多くの化合物がAQCカルバミン酸試薬と反応し,結果にばらつきや不確実性を与える可能性があるからである[27]。さらに,類似した性質を持つ他の天然アミノ酸が誘導体化されたBMAAと共溶出する可能性もある[32]。これは、構造がわずかに異なる低分子に同じ大きな蛍光部位が付加されることで、通常は分離しにくい化合物になることを考えれば当然のことである。したがって,HPLC-FLDは,非タンパク性アミノ酸を含む複雑な生体マトリックス中のアミノ酸分析,特に分析対象物が低濃度で存在する場合には,不確実な方法であると考えられる。
一方,質量分析法(特にLC-MS/MS)は,保持時間とは別に,特徴的なトランジションを利用して試料中の分析対象物を同定できるため,より選択性の高い分析法である。高分解能の質量分析計の場合、正確な質量は分析対象物の同定に非常に役立つ。さらに、検出限界(LOD)はHPLC-FLD法で得られるものよりも低い[32]。LC-MSは,BMAA分析法の改良を目的とした比較研究[30, 133, 200, 204]で主に使用されている。LC-MS/MSは主にシアノバクテリアサンプルのBMAA分析に適用されており,C18 [19, 21, 24, 28, 30, 127, 140,189],Zorbax Eclipse AAA [32]などの異なる分析カラムや,明確に指定されていないカラムが使用されている[31, 133]。さらに,UHPLC-MS/MS技術を用いた多くの研究では,アミノ酸分析用のC18カラムとAQC誘導体化ケミストリーを統合した組み合わせを選択している[3, 48, 139, 153]。
二重標識されたアミノ酸はより疎水性が高いため,スプレー中の飛沫と空気の界面に移動しやすく,その後,気相に移行してESIの応答性が向上することになる。誘導体化剤の部位が追加された分析物は,ノイズが同定を妨げる可能性のある低質量領域から高質量領域にシフトするため,S/N比が向上し,分析法の感度が高まる[21]。最近の研究[172]では,高分解能質量分析法(HRMS)を用いて,Aphanizomenon flosaquae栄養補助食品に含まれるダンシル誘導体化BMAAおよびDABの分析に成功した。
最近、過少誘導体化されたBMAAの分析に最もよく用いられている分析法は、HILICベースのクロマトグラフィーとタンデム質量分析法(HILIC-MS/MS)である。以前の研究[115]とは異なり,HILIC-MS/MS分析は,誘導体化を避けることができる一方で,LODが低く,BMAAの分析において最も正確で高感度な方法であることが報告されている[32]。Zic-HILICカラムは,シアノバクテリアやArthrospira由来の製品に含まれるBMAAの分析に,ほとんどの研究で使用されている[29, 32, 33, 132, 136, 152, 202]。HILIC RP-Amide分析カラムも同様に使用されている[25, 45, 134, 141, 190]。Zic-HILICまたはAmideカラムで分離を行った場合、陰性および陽性の結果が得られ、検出限界も同様に報告されている(乾燥重量で与えられている)。UHPLC-MS/MSおよびHILIC-MS/MSを用いた2つの比較研究[134, 190]では,淡水の軸性藍藻培養において,Zic-HILICカラムではBMAAが検出されなかったのに対し,Amideカラムでは陽性結果が得られたと報告されている[134]。BMAAとBAMAの共溶出が以前に報告されているように,HILICクロマトグラフィーはすべての神経毒アミノ酸に選択的ではないことに留意すべきである[47]。両異性体は,MS/MSにおいて同じ特徴的なフラグメンテーションパターンを有している。両者がサンプル中に存在する場合,それぞれに適切なMRMトランジションを選択したとしても,両者を区別することはできない。
環境試料中のBMAAの同定および定量には,異なる分析法の使用が重要な役割を果たしており,文献に見られる結果のばらつきに大きく寄与している。例えば、毒素濃度はグラム単位の乾燥重量で表されているにもかかわらず、LODはカラム上の分析物の量、1回の注入量、または1回の体積で表されるなど、メソッドバリデーション結果の報告に関するさまざまなアプローチによって混乱が生じている(Table 1)[22, 24, 30, 31, 48, 68, 127, 133-135, 137, 138, 140, 200, 201, 203-205]。
また,IUPAC,USEPA,USP/FDAなどの規制機関によってLODの定義が異なるため,さらなる混乱が生じている[189]。
メソッドの性能特性の評価は,トラブルシューティング,メソッドのバリデーション,またはサンプル調製手順などの特定の問題に対処するために設計された共同演習によって達成することができる.この観点から,CYANOCOSTネットワーク(COST Action ES 1105)によって開始され,Wageningen大学で組織された共同試験では,BMAA分析のためのさまざまなLC-MS/MSベースのメソッドの有効性と比較可能性をテストすることを目的とした[33]。3種類の異なるサンプル(動物組織,脳組織,シアノバクテリアサンプル)を準備し,適切なプロトコルを用いて,真度および中間精度評価のための内部標準としてD3-BMAAを用いて,過小評価およびAQC誘導体化LC-MS/MS分析を行った。得られた結果によると,シアノバクテリウムLeptolyngbyaを除き,過誘導体化BMAAの分析に用いた方法は高い精度(D3-BMAAの平均回収率80%)と精度(RSD 10%)を示した。内部標準物質の回収率を用いてポジティブコントロール(ソテツの種子)の全BMAA濃度を測定したところ、ばらつきが大きく(RSD 21-32%)D3-BMAAは結合したBMAAの放出量の測定に適した指標ではないことがわかった。誘導体化したLC-MS/MS分析の場合、D3-BMAAの回収率はすべてのサンプルマトリックスで10%以下であり、誘導体化法のワークアッププロトコルで内部標準物質の大幅な損失が発生したことを示している。AQC誘導体化LC-MS/MS法のBMAA分析において,異なるサンプル処理プロトコルを用いた別の研究でも,十分な回収率が得られている[189]。前述の共同研究は,異なるLC-MS/MS分析法の利点と欠点の相互理解に大きく貢献し,研究室間の比較,ひいては分析法の調和への道を開くものとなった。BMAA分析用の認証標準物質(CRM)の調製が困難であること、例えばBMAAがタンパク質と結合した形で存在することなどが、研究室間研究の実施にさらなる制限をもたらしている。
いずれにしても、選択された方法は、特定のアプリケーションのニーズを満たすために適切に検証される必要がある。例えば、シアノバクテリア株におけるBMAAとその異性体の存在に関する定性的な研究では、主に選択性とLOD/LOQに焦点を当てることができる。定量的な結果が必要な場合は、通常、真度(バイアス、精度)精度、測定範囲などのメソッドの性能を評価するために、より詳細な研究が必要となる。[198]. 藍藻類を用いた食品サプリメントのバリデーション手順では、さらなる性能基準を採用する必要がある。特に LC-MS/MS 法については、動物製品中の残留物の分析に関連する欧州委員会決定 2002/657/EC から性能パラメータを採用することができる[197]。この決定によると、同定には少なくとも3つまたは4つの「同定ポイント」が必要で、これは1つのプレカーサーイオンと2つのドーターイオンをモニターすることで得られる。
さらに、相対的なイオン強度、精度、真度、検出能力に関する基準も記載されている。
さらにメソッドの性能基準は、食品中の残留農薬分析に言及しているSANTE/11813/2017ガイドラインで採用することができる。この場合、イオン比の最大許容値±30%で少なくとも2つのプロダクトイオンをモニターする必要がある[196]。バリデーション基準を満たすことができない場合には、意図された用途に対して許容できる性能を示す、利用可能な最善の技術を採用して分析を行うべきである。
8. 結論
シアノバクテリアやシアノバクテリア由来の食品サプリメントに含まれるBMAAとその異性体の存在については、議論のある結果が発表されている。神経毒アミノ酸であるBMAAとその最も一般的な構造異性体であるDABとAEGが、あらゆる種類の水生生息地由来のシアノバクテリアのブルーム・サンドカルチャーに存在することが報告されている。検出される濃度にはばらつきがあり、ng g-1, dwから数mg g-1 dwの範囲の値を示している。一方で、同じシアノバクテリアから神経毒が検出されなかった研究も数多くある。rthrospira、Aphanizomenon、Nostocの各シアノバクテリアが生産する栄養補助食品についても同様である。このように結果にばらつきがあるのは、様々なシアノバクテリアが存在する水域環境の異なる場所から採取されたサンプルであることなど、いくつかの要因が考えられる。また、アミノ酸の抽出方法が異なることや、BMAAとその異性体が遊離分子またはタンパク質に結合した状態で検出されるという事実にも起因していると考えられる。抽出方法や選択した分析法によって選択性が異なり,場合によっては性能が低いこともある。選択性の低い分析法の一例として、HPLC-FLDが挙げられる。この分析法では、蛍光性を持たせるためにアミノ酸を誘導体化する必要がある。誘導体化は偽陽性を引き起こす可能性があり、HILICクロマトグラフィーを使用すると、誘導体化されていないBMAAとその異性体であるBAMAを区別することができない。環境試料中の有害アミノ酸を適切に検出・定量するためには、さらなる検討が必要であることは明らかである。

シアノバクテリア中のBMAAの存在を評価するためには、報告されている分析法の品質を、意図された使用目的のために確立された性能パラメータに従って評価する必要がある。既存の研究ではこれらの問題が議論されているが、適用された方法の品質基準は必ずしも適切に定義されなかった。食品中の残留農薬や動物性食品中の残留農薬の分析のためのバリデーションガイドラインは、BMAAの分析にも採用されるべきである。さらに、実験室間での研究により、食品サプリメントの品質管理における相対的な分析法の適用性を検証することができる。
藍藻類を原料とする栄養補助食品の消費が増加しているが、その中にBMAAとDABが含まれているという事実を考慮すると、藍藻類を原料とする栄養補助食品の研究をさらに進めるとともに、バルクおよび最終製品の適切な品質管理が必要である。最も重要なことは、適切な法律上のガイドラインを作成するために、サプリメントに含まれるBMAAとその異性体について、規制当局の認識を高めることである。