コンテンツ
オンラインで公開2020年12月1日
ハイライト
- 薬物の再利用はCOVID-19の治療法を迅速に見つけるのに役立つかもしれない。
- I型インターフェロンはSARS-CoV-2に対する防御に重要な役割を果たしている。
- インターフェロンを誘導する抗ウイルス剤は、COVID-19の管理に潜在的に役立つかもしれない。
- それらの利点とリスクは評価されるべきである。
- 重篤な副作用のため候補とされていないものもある。
要旨
コロナウイルス病2019(COVID-19)は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって発生する感染症である。パンデミックの緊急性とこの病気のための有効な治療法の欠如を考えると、薬物の再利用は、解決策を見つけるための道を開く可能性がある。すでに抗ウイルス剤として同定されている化合物を試験するために、多くの研究が進められている。
一方、SARS-CoV-2に対する免疫応答の生成には、I型インターフェロンの誘導が重要な役割を果たしていることが明らかになっている。したがって、インターフェロンとそのシグナル伝達経路を誘発することが可能な抗ウイルス剤は、COVID-19の治療に合理的に有益であると考えられた。
これに基づいて、drugvirusと呼ばれる抗ウイルス剤のデータベースを使用して、いくつかの抗ウイルス剤を導き出し、その後、インターフェロン誘導との関連性を検索した。調査されたリストには、抗生物質、免疫抑制剤、抗がん剤、非ステロイド性抗炎症薬(NSAID)カルシウムチャネル遮断剤などの異なるカテゴリーの薬剤が含まれていた。今回の結果は、COVID-19の治療薬候補を見つけるのに役立つ可能性がある。
しかし、全身的なアプローチを考慮した精密な試験により、それぞれの利点とリスクを考慮に入れる必要がある。また、これらの薬剤の中には副作用がその利点を上回るものもあるが、そのメカニズムや構造を考慮することで、将来の新薬設計のヒントになるかもしれない。さらに、これらの薬剤が持つ抗ウイルス作用やIFN修飾機構は、SARS-CoV-2に対する相乗効果につながる可能性があり、今後の検討が必要である。
1. 序論
コロナウイルス感染症2019(COVID-19)のパンデミックは世界的な脅威を喚起し、予防・治療戦略の必要性が高まっている。感染源である重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、脂質二重膜エンベロープに囲まれたポジティブセンスの一本鎖RNAウイルス群であるコロナウイルスファミリーの一員である。このエンベロープはスパイク糖タンパク質で構成されており、ウイルスの宿主細胞への侵入を最終的に可能にするウイルスの病原性と細胞受容体認識機構を担っている[1]。コロナウイルスは主に人獣共通感染症を引き起こし、アルファコロナウイルス、ベータコロナウイルス、デルタコロナウイルス、ガンマコロナウイルスの4つの属に分類される[2]。SARS-CoV-2は、重症急性呼吸器症候群コロナウイルス(SARS-CoV)や中東呼吸器症候群コロナウイルス(MERS-CoV)と同様の臨床症状を引き起こす新規のベータコロナウイルス属である[3]。
複数の研究により、様々な段階のウイルス感染に対する効果的な適応免疫応答におけるインターフェロン(IFN)の重要性が明らかにされている。コロナウイルス感染における抗ウイルス免疫応答の誘導におけるIFNの重要な役割も十分に確立されている[4]。I型インターフェロン(IFN-II)は、免疫細胞、特に抗原提示細胞(APC)ナチュラルキラー細胞(NK)T細胞、およびB細胞の誘導に大きく寄与する[5]。IFN-IIは、I型インターフェロン受容体(IFNAR)に統合されたシグナル伝達機構を介してウイルスの複製を制限するのに不可欠であるが、COVID-19患者の血液および肺組織サンプルでは、低レベルのIFNが検出されており [6], [7]、SARS-CoV-2のIFN-II誘導に対する抑制効果が示唆されている [8]。さらに、調節性T細胞(Treg)の細胞数は、SARS-CoV-2患者における感染の重症度と逆相関することが示された[9]。
IFN-Iの早期導入はウイルスの複製を抑制するが、コロナウイルスは様々な回避機構によりIFN-I産生を遅らせ、結果として高いウイルス負荷をもたらすと考えられる。これは結果として、IFNを介した抗ウイルス反応の誘導が遅くなり、ウイルス負荷の制御や抑制に役立たないだけでなく、組織の損傷や炎症反応を引き起こす可能性がある[10]。これに関連して、中国で行われたレトロスペクティブコホート研究では、吸入エアゾール化されたIFN-α2bの早期投与は、患者の死亡率の低下と入院期間の短縮に関連していた。一方、吸入されたIFN-α2bの投与が遅れると、入院期間が長くなるだけでなく、患者の死亡率も増加した[11]。また、英国の9施設で行われたMonkらの研究では、COVID-19患者48人に吸入式ネブライザーIFN-β1a(SNG001)を投与したところ、OSCI(臨床的改善のための順序尺度)尺度によると、15日目または16日目にプラセボ群よりも大きな改善を示した[12]。
さらに、コロナウイルスの発症機序とIFNを介した抗ウイルス反応に拮抗する能力との間には明確な一致が見られ、これはウイルスの急速な複製とその後の炎症性過剰反応と免疫系の調節障害との関係があると考えられた [13], [14]。しかし、COVID-19の死亡率がMERSやSARSに比べて低いのは、SARS-CoV-2のIFN拮抗作用が弱いためかもしれない[15]。特筆すべきは、様々な研究で高齢者ではIFNを介した抗ウイルス反応が低下していることが明らかにされており[16]、これが高齢者の予後不良の原因となっている可能性がある。さらに、アフリカ系アメリカ人のSARS-CoV-2に対する感受性の高さは、ウイルスRNAに対するIFN-I産生の低下と相関している可能性が示唆された [17]。
I型およびII型IFNによるJAK/STAT誘導の定型的なシグナル伝達経路は、以前の研究で十分に確立されていた[18]。簡潔に言うと、IFN-I媒介シグナル伝達経路では、IFNARはIFN-Iに結合してヤヌスキナーゼ1(JAK1)およびチロシンキナーゼ2(TYK2)誘導をもたらし、その結果、転写因子シグナル変換器および転写因子活性化因子1(STAT1)および転写因子2(STAT2)をリン酸化する。これらのリン酸化された因子は核内に移動し、そこでインターフェロン調節因子9(IRF9)と会合してインターフェロン刺激遺伝子因子3(ISGF3)を構成する。ISGF3は最終的にインターフェロン刺激遺伝子(ISG)の転写を誘導し、抗ウイルス免疫応答に重要な役割を果たしている[19]。
コロナウイルス感染症の病原性は、IFN媒介免疫応答を回避するウイルスの能力に大きく依存していることが示唆されている[20]。コロナウイルスは、IFN-I誘導を回避するための複数の回避機構を開発している[19]。SARS-CoV-2もまた、初代気管支細胞、感染細胞株、およびフェレットモデルにおける十分なIFN-I/3産生の欠如によって示唆されるように、同様の回避機構を開発した可能性がある[7]。コロナウイルスはパターン認識タンパク質(PRP)を回避するが、これは炎症性反応やIFNを媒介とする抗ウイルス反応の誘導に関与している。SARS-CoV-1は二重膜小胞を形成し、ウイルスのdsRNAを隠している[21]。さらに、いくつかのウイルス非構造タンパク質(すなわち、nsp10,nsp13,nsp14,およびnsp16)は、グアノシンキャップを付加し、5′末端にメチル化を加えることによってウイルスRNAを修飾し、受容体感知機構を阻害する [22], [23]。コロナウイルスはまた、IRF3や膜タンパク質(Mタンパク質)に干渉する機構を開発してきた。また、コロナウイルスはアクセサリータンパク質(オープンリーディングフレーム4a(ORF4a)ORF4b、ORF5)にも干渉し、MERS-CoVにおけるIRF3のリン酸化と転座を抑制することができる[24]。SARS-CoV-1は、ORF3bとORF6とヌクレオカプシドタンパク(Nタンパク質)によってIRF3の機能を阻害する[25]、[26]。ヒトコロナウイルスはまた、IFNARおよびインターフェロン-ラムダ受容体(IFNLR)シグナル伝達経路を遮断し、免疫系回避機構の一部としてISGエフェクター機能を抑制することができる[27], [28]。これらのメカニズムは最終的にはIFN産生に拮抗し、SARS-CoV-2によって引き起こされるIFN媒介応答遅延においても同様の役割を果たす可能性がある。最近発表された、SARS-CoV-2による生命を脅かす肺炎で入院した重症SARS-CoV-2患者に関する世界的な研究では、生命を脅かすインフルエンザ患者またはインフルエンザ感受性に直結した患者において13の変異遺伝子座が同定されたが、そのすべてがTLR3-、TLR7-、およびTLR9依存性のIFN-I誘導および増幅経路で役割を果たしていた。この研究の結果、17~77 歳の生命を脅かす SARS-CoV-2 患者の少なくとも 3.5%が、TLR3 および TLR7 依存性 IFN-I の誘導および増幅経路に関与する 13 の候補遺伝子座のうち 8 つの遺伝子座において既知または新規の遺伝的欠損を有していることが確認された。これらの変異は、既知の変異として自律神経劣性(AR)IRF7およびIFNAR1欠損、または自律神経優性(AD)TLR3,TICAM1,TBK1,IRF3欠損、および新規変異としてAD UNC93B1,IRF7,IFNAR1,IFNAR2欠損であった。最終的に、これらの結果は、IFN-Iの誘導および増幅経路におけるこれらの遺伝子の役割を示しており、したがって、SARS-CoV-2の制御におけるIFN-Iの役割を強調している[29]。重症のSARS-CoV-2患者における別の欠陥もまた、IFN-Iに対する自己抗体の中和に関する研究で報告されており、生命を脅かすCOVID-19肺炎患者の少なくとも10%がIFN-Iに対する自己抗体を保有していたことが示されている。この研究はまた、早期のIFN-α療法は有効な解決策にはならないかもしれないと結論づけ、この患者群ではIFN-βに対する自己抗体がまれであることから、これらの患者における潜在的な治療候補として注射またはネブライザーによるIFN-β療法を提案している[30]。
IFN投与は抗ウイルス免疫応答を興奮させるための世界的に受け入れられている治療戦略であるが、コロナウイルス感染例におけるIFN療法はかなり議論の余地のある結果をもたらすようである。感染のかなり初期の段階でのIFN療法は効果的な結果をもたらすようであるが、重症または後期の段階では有害な結果を示している[31], [32]。最近の研究では、SARS-CoV-2に対する予防薬としてIFN-Iの有効性が報告されている[15]。
近年、医薬品のリポジショニングは、従来の創薬手法に比べて開発コストが大幅に削減され、開発期間も短縮されることから、ますます魅力的なテーマとなっている[33]。COVID-19の発生以来、抗ウイルス活性を有する認可された薬剤や十分に研究されている薬剤を再利用して、本疾患の治療法を見出す試みが数多く行われてきた。
本研究の目的は,COVID-19治療薬のリポジショニング候補として,いくつかの抗ウイルス薬を簡単にレビューし,その作用機序とIFNsへの影響について議論することである。
2. 方法
本研究では、これらの従来薬の抗ウイルス効果とIFNシグナル伝達への影響との関係を探るために、drugvirus Webサーバ(http://drugvirus.info/)を利用した(2020年5月23日時点のデータベース更新)。本サイトでは、ブロードスペクトラム抗ウイルス剤(BSAA)とその標的ウイルスを中心としたデータを、対話的な探索のための主要なリソースとして提供している[34]。各薬剤の名称と「インターフェロン」,「ISG」,「STAT3」,「mTOR」,「SARS」などのIFN関連キーワードをPubMedデータベースで検索し,IFNシグナル伝達経路との関連性やSARS-CoVに対する効果の可能性を探った。
3. 所見の概要
我々の検索結果によると、drugvirusサーバー上に存在するいくつかの様々なカテゴリーの薬剤がIFNシグナル伝達経路と相関していることが示された。これらの薬剤には、抗生物質、抗がん剤、免疫抑制剤、非ステロイド性抗炎症剤(NSAID)およびカルシウムチャネル遮断剤(いくつかは表1に示されている)が含まれており、それらの利点とリスクは、全身的なアプローチを考慮した正確な研究によって考慮されるべきである[35]。このリストの複数の化合物はすでにCOVID-19の臨床試験に参加しているが、いくつかは論争の対象となっている[36]。以下では、研究された化合物について、その由来に基づいて、合成化合物と天然化合物の2つの主要なクラスに分けて議論する。
表1 抗ウイルス剤のIFN誘導効果の概要
臨床試験データは2020年9月17日に収集された。以下の薬剤の分子構造をクラスの代表として示している;例えば、アミノグリコシド系の場合はネオマイシン、アントラサイクリン系の場合はイダルビシン、スタチン系の場合はシンバスタチン。すべての構造はPubChem [37]から引用している。
| ドラッグ/ドラッグクラス | 分子構造 | 治療カテゴリー | 抗ウイルス活性 | COVID-19関連の研究 | 参照。 | |
|---|---|---|---|---|---|---|
| 1 | アジスロマイシン |
 |
抗生物質 | IFNAR1複合体への結合およびISGF3のアップレギュレーション/ IFNタイプIシグナル伝達の増強 | 特にアジスロマイシン/ヒドロキシクロロキンの効果の増幅に関する112の臨床試験 | [38]、[39]、[40]、[41]、[42] |
| 2 | アミノグリコシド |
 |
抗生物質 | ISG誘導、プロモーターRNAへの結合を介して複製を抑制する | 何もデータが見つかりなかった | [38]、[43]、[44] |
| 3 | ニタゾキサニド |
 |
殺虫剤 | IFNシグナル伝達、オートファジー促進 | アジスロマイシンまたはヒドロキシクロロキンと組み合わせた20の臨床試験/細胞培養におけるSARS-CoV-2の阻害 | [38]、[45]、[46]、[47]、[48]、[49]、[50] |
| 4 | ニクロサミド |
 |
駆虫薬 | SARS-CoV 3CLプロテアーゼの阻害、ウイルス侵入の防止 | 6つの臨床試験が登録されている。/オートファジーとウイルス複製の阻害剤として提案されている | [45]、[51]、[52]、[53] |
| 5 | イトラコナゾール |
 |
抗真菌剤 | ラノステロール14α-デメチラーゼ阻害、IFN A / Bの増加 | 何もデータが見つかりなかった。 | [38]、[54] |
| 6 | リバビリン |
 |
抗ウイルス薬 | イノシン一リン酸デヒドロゲナーゼ/ RdRp拮抗作用の阻害/エラーの大惨事を引き起こす | でCOVID-19療法/推奨のRdRpアンタゴニストとして提案in silicoにおける研究/十二の臨床試験が登録されている | [45]、[52]、[55]、[56] |
| 7 | アントラサイクリン |
 |
抗生物質 | ISRE活性の増強、RNAおよびDNA合成の阻害 | イダルビシンは、in silico研究により、SARS-CoV-2エンドリボヌクレアーゼの強力な阻害剤として示唆された。 | [38]、[57]、[58]、[59]、[60] |
| 8 | タモキシフェン |
 |
抗腫瘍性 | 多段階炎症抑制剤 | イソトレチノインと組み合わせた1つの臨床試験 | [45]、[52]、[61] |
| 9 | ゲフィチニブ |
 |
EGFR阻害剤 | NF-kB経路とウイルス複製の阻害 | 何もデータが見つかりなかった | [38]、[62] |
| 10 | トラメチニブ |
 |
マルチキナーゼ阻害剤 | IRF1およびIFN-κの誘導 | 何もデータが見つかりなかった | [45]、[63] |
| 11 | ゲムシタビン |
 |
抗がん剤 | DNA合成阻害 | AI分析によりプラスの効果があると予測 | [38]、[64]、[65] |
| 12 | オバトクラックス |
 |
抗がん剤 | ウイルスのエンドサイトーシス取り込みの抑制 | 何もデータが見つかりなかった | [38]、[66] |
| 13 | シロリムス |
 |
免疫抑制剤 | 侵入阻害剤、CCR5のダウンレギュレーション | インタラクトームベースのバイオインフォマティクス研究で提案された/ 6つの臨床試験が登録されている | [38]、[52]、[67]、[68] |
| 14 | ミコフェノール酸 |
 |
免疫抑制剤 | ISGのアップレギュレーション | ドッキング研究により、SARS-CoV-2のエンベロープタンパク質およびヌクレオカプシドリンタンパク質に対して最も強力な化合物として認識されている | [45]、[69]、[70] |
| 15 | アスピリン |
 |
NSAID | COX-2阻害、p38MAPKおよびMEK1 / 2活性化 | 14の臨床試験が登録されている | [38]、[52]、[71] |
| 16 | インドメタシン |
 |
NSAID | 2 ‘、5’-OASの産生、Th1応答の増強、ウイルスRNA合成ブロック | 2つの臨床試験が登録されている。 サイトカインストームのない陽性SARS-CoV-2患者での使用に賛成 |
[38]、[52]、[72]、[73] |
| 17 | メトホルミン |
 |
抗高血糖 | 細胞のインスリン感受性/ JAK / STAT経路活性化の促進 | アセチルCoAカルボキシラーゼα遺伝子の干渉物質としてのin silicoの提案 | [38]、[74]、[75]、[76] |
| 18 | フルオキセチン |
 |
抗うつ薬 | JAK / STAT1アクティベーション | 2つの臨床試験が登録されている | [38]、[52]、[77] |
| 19 | ベラパミル |
 |
カルシウムチャネル遮断薬 | 細胞侵入阻害 | 3つの臨床試験が登録されている | [38]、[52]、[78] |
| 20 | スタチン |
 |
抗高コレステロール血症 | プレニル化阻害、細胞間融合の減少 | 11件の臨床試験が登録されている/免疫調節効果と心血管障害のために効果的であると仮定されている。心血管疾患の病歴のある患者での使用が推奨される | [45]、[52]、[79]、[80]、[81] |
| 21 | カフェイン |
 |
中枢神経系刺激剤 | COX-2,HSP90,およびRas-ERK阻害 | 4つの臨床試験が登録されている | [45]、[52]、[82] |
| 22 | グリチルリチン |
 |
抗炎症薬 | ROS形成、NF-κB、JNK、およびp38MAPKのダウンレギュレーション | ACE2結合、炎症性サイトカインのダウンレギュレーション、およびROS蓄積阻害のため、潜在的な薬剤として提案されている | [45]、[83]、[84] |
| 23 | ベルベリン |
 |
防腐剤 | Th1応答とIFN-γの刺激 | 1つの臨床試験が登録されている | [45]、[85]、[86] |
2′、5′-OAS:2′-5′-オリゴアダデニル酸合成酵素/ACE:アンジオテンシン変換酵素/CoA:コエンザイムA/COVID-19:コロナウイルス病2019/COX:シクロオキシゲナーゼ/ERK:細胞外シグナル調節キナーゼ/HSP90:熱ショックタンパク質90/IFN:インターフェロン/IFNAR.I型インターフェロン受容体/IRF:インターフェロン制御因子/ISG:インターフェロン刺激遺伝子因子/ISGF:インターフェロン刺激遺伝子因子/ISRE:インターフェロン刺激応答エレメント/JAK:ヤヌス菌キナーゼ/MEK:マイトジェン活性化蛋白質キナーゼ/NF-κB:核内因子-κB/RdRp. RNA依存性RNAポリメラーゼ/ROS:活性酸素/SARS-CoV:重症急性呼吸器症候群コロナウイルス病/STAT:転写のトランスデューサーおよびアクチベーター/Th.Tヘルパー細胞。
4. 合成化合物
本節では、化学的に合成された薬剤をレビューし、その薬理学的分類に基づいてさらに分類する。
4.1. 抗感染症薬
4.1.1. アジスロマイシン
抗生物質は、長年にわたり細菌感染症の治療に使用されてきた。しかし,抗生物質の中には抗ウイルス効果を有するものもあり,例えばマクロライドは,大きなラクトン環(12〜16原子)からなる抗生物質の一種である。マクロライドは、細菌のリボソームの50Sサブユニットに結合して細菌のタンパク質合成を阻害することで抗菌効果を発揮する。マクロライドの様々なウイルスに対する抗ウイルス活性が多くの研究で報告されている[87]。マクロライドの抗ウイルス作用機序は明らかではないが、考えられるメカニズムとしては、IFNAR1複合体に結合し、STAT1/2,IRF7,IRF9,そして最終的にはISGF3の産生を誘導することであると考えられている(図1)[40]。異なるマクロライドがウイルス性呼吸器感染症に有用である可能性があることを示す証拠がいくつかある。例えば、クラリスロマイシンは、インフルエンザウイルス感染症の治療において有望であることが見出された。また、ロイコマイシンA3はインフルエンザウイルスに対しても活性であり、IFN-α産生を増強した[88]。
図1 インターフェロンシグナル伝達経路に対する可能性のある抗SARS-CoV-2薬剤の作用機序
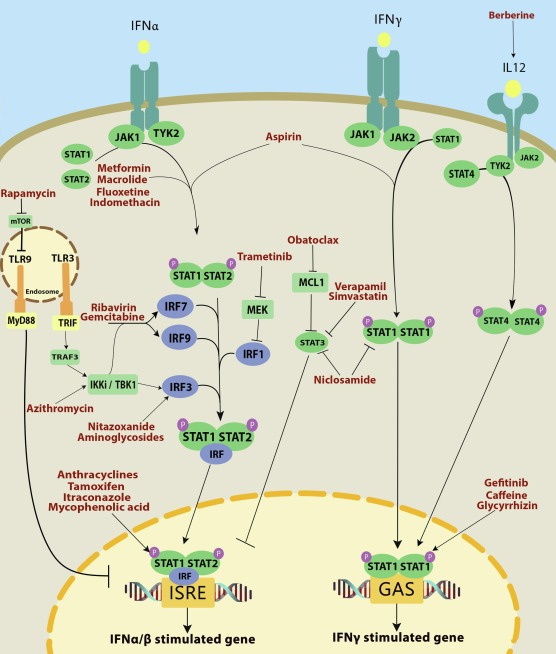
マクロライドとしてのアジスロマイシンは、IFN-Iシグナル伝達を増強することにより、ライノウイルス(ライノウイルス1Bおよびライノウイルス16)を阻害することができた。さらに、アジスロマイシンは、未知のメカニズムでエボラウイルスの細胞侵入をブロックした。アジスロマイシンは、ジカウイルスの感染も抑制することができた [39], [40]。アジスロマイシンとスピラマイシンはともにエンテロウイルスA71に対して抗ウイルス効果を示した [89]。
インフルエンザA H1N1の最も重篤な症例は、通常、二次的な細菌感染を伴う。コホート研究において、Ishaquiらは、インフルエンザA H1N1の治療において、アジスロマイシンとオセルタミビルの併用はオセルタミビル単独よりも有益であることを示した[90]。試験管内試験研究では、アジスロマイシンがH1N1ウイルスの宿主細胞への内部化をブロックし、新たに芽生えたウイルスの内分泌活性を不活性化することが実証された。アジスロマイシンの単回の経鼻投与により、マウスの肺におけるウイルス負荷が減少した[7]。
アジスロマイシンの抗ウイルス機序としては、理論的には、IκB-キナーゼ(IKK)IKK-ι/ε、および TANK-結合キナーゼ1(TBK-1)シグナル伝達経路の活性化による IRF 刺激(図 1)またはインターロイキン(IL)-28 および IL-29 受容体複合体への作用のいずれかであると考えられる[40]。アジスロマイシンは、気管支上皮細胞の抗ウイルスタンパク質として、I型およびIII型IFN(IFN-βおよびIFNλ1)メラノーマ分化関連タンパク質5(MDA5)トール様受容体3(TLR3)レチノイド誘導性遺伝子I(RIG-I)およびRIG-I様ヘリカーゼを誘導し、ウイルス負荷を低減させることができる[39]、[87]、[91]。さらに、アジスロマイシンはIL-28およびIL-29の発現を増加させた。興味深いことに、アジスロマイシンはマクロファージのオートファジーを阻害することができる。アジスロマイシンは、IFIH1,DDX58,およびIFITM3,MX1,RASD2などのISGを含む病原体認識受容体(PRR)をアップレギュレートすることが示されており、アジスロマイシンはウイルス感染に対する細胞の感受性を改善する可能性があることを示唆している[39]。アジスロマイシンは、ライノウイルス誘発性のIFNおよびISG発現も増加させる可能性がある[40]。アジスロマイシンによるIFN-β誘導は、MDA5受容体を介して媒介されると考えられている[92]。
ACE2に加えて、SARS-CoV-2は他の特異的結合受容体を有するようである。CD147(細胞外マトリックスメタロプロテアーゼ・インデューサー(EMMPRIN)とも呼ばれる)は、SARS-CoV-2の内在化の別のルートであるかもしれない。アジスロマイシンは、ウイルスとCD147のリガンド/レセプター相互作用を阻害する可能性が示唆されている[93]。
さらに、マクロライドがサイトカインの放出を阻害することで抗炎症効果を発揮することを示す証拠がいくつかある[87]。Linらは、アジスロマイシンがIL-12,IL-10,IL-6,IFN-γ、腫瘍壊死因子α(TNF-α)などの炎症性サイトカインの産生を減少させることを証明した。したがって、アジスロマイシンは炎症性疾患の治療のための免疫調節剤として提案された[94]。別の研究では、アジスロマイシンは、単球におけるTヘルパー細胞1(Th1)およびTh2ケモカインであるIFN-γ誘導性プロテイン10(IP-10)およびミエロイド樹状細胞(mDC)をそれぞれ抑制することにより炎症を緩和することが示された。このような抑制は、マイトジェン活性化プロテインキナーゼ(MAPK)-JNK/細胞外シグナル調節キナーゼ(ERK)および核因子κB(NF-κB)p65シグナル伝達経路の阻害によって引き起こされる[95]。マウスを用いた実験では、アジスロマイシンの予防的投与により、気道炎症、サイトカインレベル(IFN-γ、IL-5,IL-6)呼吸器合胞性ウイルス感染症(RSV)後の死亡率が減少した[96]。
アジスロマイシンの試験管内試験抗ウイルス機能とCOVID-19に対するヒドロキシクロロキンとの併用による薬理学的効果が証明された[97]。Vero細胞を用いた試験管内試験実験では、これら、2つの薬剤がSARS-CoV-2に対して相乗効果を示すことが示された[98]。
80人のCOVID-19患者を対象とした臨床試験では、ヒドロキシクロロキンとアジスロマイシンを併用して治療した症例では、臨床状態が改善され、疾患の伝染性が低下した[42]。アジスロマイシンとヒドロキシクロロキンの相乗効果は、別のCOVID-19試験でも示されている[41]。しかし、Molinaらの研究では、この組み合わせを使用しても患者の改善は認められなかったと主張している[99]。
2020年9月17日までに、アジスロマイシンまたは他の薬剤との併用によるCOVID-19の有効性に関する112件の試験がclinicaltrials.govに登録されている(表1)ので、COVID-19の治療にアジスロマイシンを使用する際の知見が得られることが期待される。
4.1.2. アミノグリコシド
抗ウイルス活性を持つ抗生物質のもう一つのクラスはアミノグリコシドであり、アミノ修飾糖である。アミノグリコシドは、原核生物のリボソームの30Sサブユニットに結合し、誤翻訳および早期終結を引き起こすことにより、抗菌効果を媒介している。異なるアミノグリコシドの抗ウイルス活性は、インフルエンザAウイルス、ジカウイルス、単純ヘルペスウイルス-2 (HSV-2)に対して示されている [43], [44]。
Kimらは、アミノグリコシド、特にネオマイシンBがインフルエンザウイルスのプロモーターRNAに結合し、その複製を抑制することを示した[44]。ネオマイシン、ネオマイシンA、カナマイシン、シソマイシン、カスガマイシンを含む5種類のアミノグリコシドの局所投与は、IFN-I経路遺伝子やISGのアップレギュレーションを介して、膣および鼻粘膜において抗HSV-2および抗インフルエンザA効果を有することが証明された。アミノグリコシドに誘導されたISG発現は、RNAおよびDNAウイルスの両方に対して有意な保護を引き起こす可能性がある。ネオマイシンの効果は投与部位に限定されていたが、この薬剤の単回の経鼻投与でISGの発現亢進が十分に認められた。カスガマイシンは、ヒト単球におけるインフルエンザAウイルスの複製を有意に減少させ、polyI:Cに類似したISGの発現を増加させることができた[43]。
研究により、TLR3,TIRドメイン含有アダプター誘導インターフェロン-ß(TRIF)およびIRF3/7がアミノグリコシド投与後のISG誘導を媒介する最も重要なシグナル伝達分子であることが証明された(図1)。アミノグリコシド含有上皮細胞のファゴサイトーシスにより、RNA結合アミノグリコシドがエンドソームに蓄積され、膣樹状細胞のTLR3活性化につながった[43]。
現在のアミノグリコシドの免疫賦活効果は必要以上に低いことが判明したため、その誘導体が検討された。アミノグリコシド誘導体の中には、ホスファチジルイノシトールホスホリパーゼCの活性化によるISG、インターフェロン誘導性タンパク質、プロ炎症性サイトカインの誘導により免疫賦活効果を示すものがあった[100], [101]。
以上のことから、アミノグリコシドの予防的使用は、広範囲のウイルスに対する宿主の抵抗力を向上させる。しかし、アミノグリコシドの投与は、特に予防的な方法では推奨されず、副作用のためさらなる調査が必要です[43]。
4.1.3. ニタゾキサニド
ニタゾキサニド(NTZ)(チアゾリド系)は、FDA(食品医薬品局)に認可された広汎な非変異原性医薬品であり、入手性が高く、原虫や嫌気性腸管寄生虫(クリプトスポリジウム・パルバム、ジアルジア・ラムリアなど)に対して伝統的に使用されてきた。最近の原生動物および嫌気性細菌の研究では,嫌気性エネルギー代謝に不可欠な酵素であるピルビン酸フェロキシン酸化還元酵素(PFOR)の阻害に成功していることが示されている[102]。また,抗寄生虫作用の他にも,IFN シグナルを介したヘパシウイルスやアストロウイルスの除菌やオートファジー促進作用が証明されている [47], [48] 。
免疫系への影響については、mTORC1シグナルは可逆的に阻害するが、mTORC2シグナルは阻害しなかった。mTORC1とmTORC2の両方にmTOR触媒サブユニットが存在することから、間接的にmTORのキナーゼ活性を阻害し、上流のmTORC1制御経路に影響を与える可能性があると考えられる[103]。NTZ はマウスマクロファージからの IL-6 産生を抑制することが報告されている[104]。また、NTZ は IRF3 により誘導された IFNβレポーター活性を用量依存的に増強し、1AB で誘発された RIG-I 過剰発現細胞においても IFN-I 活性を増強した。さらに、MAVS過剰発現細胞では、他の細胞刺激が存在しない場合でも、IFN-I誘導転写因子であるISG、IFI27,Mx1,IFITM3,IFN-β LUC活性が増強された[105]。
さらに、末梢血単核細胞(PBMCs)における TNF-α、IL-2,IL-4,IL-5,IL-6,IL-8,IL-10 などの炎症性サイトカインの産生を抑制した [106]。最近の研究では、NTZ がインフルエンザウイルスに引き金を引かれた PBMCs において、宿主の線維芽細胞による IFN-Is(αおよびβ)の分泌を促進することが明らかにされている [107]。
NTZは,MERS-CoVをはじめとするコロナウイルスに対する試験管内試験活性を示すことが報告されている[106].また,急性非合併性インフルエンザ患者にNTZ 600 mgを1日2回,5日間経口投与したところ,軽度の副作用で症状が改善したことが報告されている[108]。現在までに,アジスロマイシン,ヒドロキシクロロキン(NCT04341493),その他の薬剤と併用しているSARS-CoV2に対する有効性を評価する臨床試験が世界各地で約20件実施されている(表1)[46],[49]。
4.1.4. ニクロサミド
1960年、バイエル社の科学者たちは、ニコロサミドがヒトのサナダ虫(セストダ)感染症に有効であることを発見し、1962年にヨメサン®として米国外でヒト用として発売された [109], [110]。FDAは1982年にニコロサミドをヒトのサナダムシ感染症の治療薬として承認した。また、世界保健機関(WHO)の必須医薬品リストにも記載されている[111]。何百万人もの人々が安全にニコロサミドで治療されてきた。その膨大な使用にもかかわらず、作用機序は明確に確立されておらず、酸化的リン酸化のアンカップリングが関与していると述べられていた[112]。最近では、ニコロサミドが多機能薬であり、いくつかの生物学的プロセスやシグナル伝達経路を制御したり、予防したりすることが可能であるというエビデンスが増えてきており、蠕虫症以外の疾患に対する新規治療薬としての可能性が示唆されている。その用途の候補としては、広くしっかりと証明された抗がん作用が挙げられる[113]。
より詳細には、本剤は STAT3 の活性化、核内転座およびトランアクティブ化を強く阻害したが、STAT1 や STAT5,Src キナーゼ、上流の JAK1,JAK2,または他の受容体チロシンキナーゼなどの密接に関連するタンパク質には明らかな影響は認められなかった。さらに、ニコロサミドは、STAT3標的遺伝子の転写を抑制し、細胞増殖を抑制し、STAT3が実質的に活性化した癌細胞のアポトーシスおよび細胞周期停止を誘導した[114]。ヒト関節リウマチ線維芽細胞様滑膜細胞(RA-FLS)を用いた 試験管内試験 試験では、ニコロサミドは TNF-αによって誘導される IFN-c, IL-1b, IL-6, IL-8, IL-17A の産生を抑制することが示されたが、これは NF-κB シグナル伝達経路によって調節されている可能性があり、ERK のリン酸化や JNK の抗炎症作用がニコロサミドの影響を受けている可能性が示唆された。ニクロサミドは、リポ多糖(LPS)によって誘導される炎症性サイトカイン(IL-6, IL-12, TNF-α)やケモカイン(RANTES, MIP-1a, MCP-1)の発現を強力に抑制した。本研究では、ニコロサミドは、TNF-αを刺激したRA-FLSにより、用量依存的にIFN-c、IL-1b、IL-6,IL-8,およびIL-17Aの生成をダウンレギュレートすることが明らかになった[115]。また、前立腺癌DU145細胞において、STAT3のリン酸化と核内転位を阻害することにより、STAT3転写活性をダウンレギュレートすることで、強力なSTAT3阻害作用を示した(図1)[116]。別の研究では、ニコロサミドによるmTORC1の抑制は、リソソソームの機能障害を介して引き起こされることが示唆されている。リソソソームの分解機能は、リソソソームの透過性とpH勾配の変化を介してニコロサミドによって阻害されると考えられている[114]。
Wuらは、ある濃度のニコロサミドがSARS-CoVの複製を抑制し、ウイルス抗原の合成を完全に破壊することを発見した[117]。SARS-CoVの細胞毒性効果は、低濃度のニコロサミド(1μM)で停止した。さらに、それは0.1μM未満のEC50値でVero E6細胞におけるSARS-CoVの複製をブロックした[118]。SARS-CoVの3CLプロテアーゼは、レプリカーゼポリプロテインの処理に重要な役割を持つことが確認されており、抗SARS薬の開発のための主要なターゲットとなる可能性がある[119], [120]。50μMまでの濃度での研究では、SARS-CoV 3CLプロテアーゼに対する明確な阻害効果は認められなかったため、その効果については他の説明があるかもしれない[51]。
Gassenらは、E3リガーゼS-phase kinase-associated protein 2(SKP2)がベクリン1(BECN1)のリジン-48結合ポリユビキチン化を行い、そのプロテアソーム分解を引き起こすことを報告している。SKP2を抑制することでBECN1レベルが上昇し、オートファジーが促進され、MERS-CoVの複製が効果的に抑制された。ニクロサミドは感染後48時間でMERS-CoVの複製を最大1000倍まで阻害した。10μMの濃度では、ニコロサミドはBECN1レベルとオートファジー関連14(ATG14)のオリゴマー化を増加させ、オートリゾソームの数を2倍以上に増加させ、MERS-CoVに感染した細胞のオートファジーフラックスに影響を与えた[121]。このように、ニコロサミドの多能性を考えれば、更なる作用機序の可能性も否定できない(表1 )。
4.1.5. イトラコナゾール
イトラコナゾールはトリアゾール系抗真菌薬の一種であり、ブラストミセス症、ヒストプラズマ症、クリプトコッカス髄膜炎およびアスペルギルス症に対して有用である。イトラコナゾールの主な作用機序には、チトクロームP450依存性酵素である14α-デメチラーゼとの相互作用が含まれており、エルゴステロール合成を阻害することが知られている[38]。
最近の研究によると、イトラコナゾールは、自然免疫応答を促進し、エルゴステロール生合成に重要なチトクロームP450依存性酵素であるラノステロール14α-デメチラーゼを阻害することで、インフルエンザAウイルス感染症に有効であることが明らかになった(哺乳類および真菌類細胞の両方)。この阻害の結果、IFN-αおよびIFN-βの両方のレベルがイトラコナゾールに応答して上昇した[54]。
上記の情報に基づいて、イトラコナゾールは潜在的なIFN誘導剤と考えられ、おそらくSARS-CoV-2に対して有効であると考えられる。
4.1.6. リバビリン
リバビリンはグアニシンヌクレオシドアナログであり、広範な抗ウイルス剤として機能する。HCV、E型肝炎ウイルス、RSV、および出血熱ウイルスは、リバビリンによって抑制できるウイルスの一部である[122]。その抗ウイルス活性は、以下の特徴による。1)グアノシン合成のde novo経路で働くイノシン一リン酸脱水素酵素を競合的に阻害する、2)エラーカタストロフィーを引き起こす変異原として作用する、3)特にHCVに対しては、HCV-RNA-RNA依存性RNAポリメラーゼ(RdRp)の基質として作用し、早期終結をもたらす、4)マクロファージおよびTヘルパーサイトカイン産生、Th1/Th2バランス、およびISGs発現の増加を調節することにより免疫系を調節する[55], [56]。
リバビリンはIFN-αシグナル伝達を増強し[122]、それによりSTAT1/3のリン酸化を増強することを示す証拠が増えている。また、リバビリンは、MxA、抗ウイルスタンパク質の発現増加につながるIFN-α-JAK/STATシグナル伝達経路を活性化する。Mxタンパク質は、小胞のトランスロケーションに関与している。この活性は、ウイルス核カプシドを細胞の分解場所にトラフィッキングする役割を担っていると考えられている。このように、MxAはRNAウイルスの複製を阻害すると考えられている[55]。
リバビリンがHCVの主要な治療法であるため、ほとんどの研究ではそれらの相関関係に焦点が当てられてきた。リバビリンは肝細胞におけるIFN-α受容体の発現をアップレギュレートすることが示された[55]。さらに、リバビリンとIFN-αの併用療法は、より強力な抗ウイルス反応を示した[123]。興味深いことに、Testoniらは、リバビリンがRSAD、CXCL10,IFI27などの前活性化ISGの異常なレベルをダウンレギュレーションしたと主張している。このエピジェネティックなダウンレギュレーションは、IFN-αに対する肝臓の感受性を高めた[122]。
一部の研究者は、リバビリンの広範な活性、複数の直接的な抗ウイルス機序、Tヘルパー1の分極、およびウイルスに対するT細胞応答を促進するためのウイルスのランダム変異誘発の誘導のために、COVID-19パンデミックを制御するためにリバビリンを提案した(表1)。リバビリンは高用量でもSARS-CoVを完全に減少させることはできないが,その使用はウイルス負荷の低減に役立つ。リバビリンとIFN-ßがSARS-CoVの複製を阻害することは注目すべきことであった。さらに、リバビリンとIFN-αの併用は、サウジアラビアでのMERS-CoVパンデミックの際に良好な結果を示した [124], [125], [126]。また、リバビリンはSARS-CoV-2のRdRpに強固に結合することがドッキング試験で示されており、有望な薬剤となる可能性がある[127]。
4.2. 抗悪性腫瘍剤および免疫調節剤
4.2.1. アントラサイクリン類
アントラサイクリン系薬剤は、ある種のストレプトマイセス菌から抽出された抗生物質および化学療法剤の一種であり、様々な種類の癌の治療に使用されている。アントラサイクリンは、腫瘍細胞を根絶するための様々な一般的なメカニズムを持っている。これらのメカニズムには、フリーラジカルの産生、隣接するDNAまたはRNAの塩基対間のインターカレーション、トポイソメラーゼII阻害、および細胞膜の変化が含まれる [128]。
いくつかの研究で、アントラサイクリンの抗ウイルス効果が報告されている。Holtzmanらは、IFNシグナル伝達経路を誘導する成分を認識するために、ハイスループットスクリーニング(HTS)[58]と名付けられた新しいスクリーニング技術を用いて、多くの承認された化合物および薬剤を2つの研究でスクリーニングした。そのうちの1つの研究では、イダルビシン、ドキソルビシン、エピルビシン、ダウノルビシンを含むいくつかのアントラサイクリン系薬剤が試験された[129]が、同様の効果を示し、インターフェロン刺激応答エレメント(ISRE)活性の顕著な増強を示した。さらに、ISREおよびIFNシグナル伝達経路の活性化に必要なイダルビシンの濃度が低いため、イダルビシンによるトポイソメラーゼ阻害効果および細胞毒性の増強は報告されていない;しかしながら、この薬剤の高用量では細胞毒性効果が現れるであろう。アントラサイクリン系薬剤は、RNAとDNAの合成を阻害することにより、細胞の複製を阻害する。さらに、イダルビシンの抗ウイルス機構として知られているI型IFNシグナル伝達経路を活性化する。これにより、ウイルス感染症に対する宿主の免疫系を改善する(表1)。イダルビシン及び他のアントラサイクリン系薬剤に関するこれらの情報によれば、これらの薬剤は、ウイルス感染症の予防薬として使用することができる[57], [58], [59]。
4.2.2. タモキシフェン
タモキシフェンは、選択的エストロゲン受容体モジュレーター(SERM)として1977年にFDAによって承認された低分子薬である。腫瘍細胞のアポトーシスを促進し、腫瘍細胞の増殖を抑制する。タモキシフェンは、早期乳がんの治療、および手術または他のがん治療後の再発がんのリスクを減少させるために使用される [130], [131]。
いくつかの試験管内研究に基づき、タモキシフェンはHSV、C型肝炎ウイルス(HCV)ヒト免疫不全ウイルス(HIV)エボラウイルスに 対する抗ウイルス効果を持っている。これらの研究は、タモキシフェンが異なるメカニズムでこれらのウイルスの複製を抑制することを示している。HIV では、タモキシフェンはプロテインキナーゼ C(PKC)や NF-κB 経路の他の標的との相互作用を阻害する可能性がある。しかし、現在では、より効率的な治療薬が開発されている。さらに、HIV と HCV に対するタモキシフェンの効果に関する研究に基づき、タモキシフェンは、ウイルスの付着、注入、複製、排 出などの炎症のすべての段階でウイルスを防ぐことができると考えられている。タモキシフェンのこのような多段階の炎症抑制活性は、HSV-1 に対しても示されている [61]。別の研究では、タモキシフェンの前処理は小水疱性口内炎ウイルス(VSV)に 対してかなりの抑制効果があった。タモキシフェンはまた、IFN-Isを誘導することも示されている[132]。乳がんを対象とした研究に基づき、タモキシフェン治療はISGの発現を刺激する可能性もある(図1)[133]。
4.2.3. ゲフィチニブ
上皮成長因子受容体(EGFR)の選択的阻害薬であるゲフィチニブは、非小細胞肺がん(NSCLC)の治療薬として米国および一部の国で承認された。ゲフィチニブは、アデノシン三リン酸(ATP)と競合してチロシンキナーゼ活性を阻害し、この酵素へのATP結合を阻害する[134]、[135]。
Mosqueraらは、デングウイルス(DENV)感染に対するゲフィチニブの抗ウイルス効果を報告した。彼らは、ゲフィチニブとEGFRの両方がNF-κB経路を阻害できることを示した。ゲフィチニブはウイルスの複製を減少させ、DENV感染した単球に反応して産生される抗ウイルス性サイトカインのレベルも減少させた[62]。
一方、ゲフィチニブはウイルス性小細胞肺がんにおいて、INF-γやIL-6の循環を増加させることが示された。さらに、ゲフィチニブによるウイルス感染症に対する自然免疫の誘導に重要な役割を持つNKを増加させた[136], [137]。
4.2.4. トラメチニブ
トラメチニブは、マイトジェン活性化プロテインキナーゼ1(MEK1)およびMEK2の阻害を通じて作用する抗がん剤である。 メキニスト®またはトラメチニブは2013年にFDAにより承認された。この薬剤は、BRAF遺伝子の欠損によって生じる転移性メラノーマの治療に使用される[138]。
トラメチニブの抗ウイルス活性は明らかである。トラメチニブとコビメチニブ(別のMEK阻害剤)の投与はEGFR-ERK経路を活性化することが示されている。これは、IRF1の減少に続いてIFN-I発現の減少を引き起こす。EGFR-ERK経路におけるMEKの役割を考えると、MEK阻害剤は、この経路を阻害することでIRF1およびIFN-κを誘導し、STAT1の活性化につながる。その結果、炎症性ケモカインの誘導および抗ウイルス遺伝子のアップレギュレーションは、I型IFN発現につながる[63]。
ゲフィチニブやトラメチニブに加えて、欧州のCLL(慢性リンパ性白血病)研究イニシアティブが実施した臨床試験では、別のチロシンキナーゼ阻害剤であるイブルチニブを投与されているCLL患者において、COVID-19の入院率が他の治療法よりも低かったことが示されている[139]。このことから、イブルチニブは、重篤な病状のCOVID-19患者における過剰に活性化された免疫系の調節のための潜在的な治療法として示唆される可能性がある。
4.2.5. ゲムシタビン
ゲムシタビン(2′、2′-ジフルオロデオキシシチジン、dFdC)は、肺がん[140]または膵臓がん[141]に適応のある化学療法薬である。その抗がん作用は、ゲムシタビンの代謝物がDNAに関与することにより、自然のDNA合成を阻害することに起因することがほとんどである。さらに、ゲムシタビンは、その主要酵素であるチミジル酸合成酵素(TS)を阻害することにより、チミジンの新規合成を阻害する[142], [143]。
ゲムシタビンは、IFIT1,IRF7,IRF9CXCL10,DDX58という複数のISGの産生を誘導する(図1)。代謝酵素を直接不活性化するか、あるいはヌクレオチドプールを改変することで、シグナルが発生し、最終的にはキナーゼや転写因子を介して、ISG群のプロモーター上のいくつかのシス作用エレメントに到達する可能性があると考えられる。いくつかの最近の研究によれば、このシグナルは、少なくともゲムシタビンについては、IFNによって誘導されるJAK/STAT経路の主要な転写複合体として、STAT1/2-IRF9(ISGF3)に依存する可能性は低い。ゲムシタビン治療時には、IFN-αによって誘導されることがほとんどだったTyr701でのSTAT1のリン酸化は起こらなかった。さらに、ゲムシタビンで誘導されたDDX58 mRNAのアップレギュレーションは、IRF9のノックダウンでは変化しなかった。これは、同じ条件下でIFN-αによって誘導されたDDX58 mRNAのアップレギュレーションの明らかな抑制についての知見に反していた。ISGの活性化がピリミジン生合成の阻害によって媒介されるかどうかを決定するためには、さらなる研究が必要である[144], [145], [146]。すべてを考慮すると、JAK1またはSTAT1が活性化されていないのにISGが誘導されたという報告もある[147]。ある研究によると、ゲムシタビンのような同定されたDNA合成阻害剤は、少なくとも1つのコロナウイルスに対して活性を示し、これらの薬剤がコロナウイルスに対して抗ウイルス効果を示す可能性を示唆している[64]。しかし、ゲムシタビンのコロナウイルス、特にSARS-CoV-2に対する影響を評価するためには、より多くの研究が必要である。
4.2.6. オバトクラックス
オバトクラックスは、内在性アポトーシス経路の活性化によりアポトーシスを亢進させるBH3模倣化合物クラスの薬剤である。現在、白血病、リンパ腫、骨髄線維症、肥満細胞症を対象とした第Ⅱ相臨床試験が行われている。オバトクラックスは、Bcl-2ファミリー(Bcl-2,Bcl-w、Bcl-XL、Mcl-1,A1/Bfl-1 [148])に拮抗し、アポトーシスを抑制する。
BH3模倣作用の他に、内在性アポトーシス経路の鍵となるエフェクターであるBakやBaxが存在しない細胞においても実質的な機能性を維持している。オバトクラックスに関するいくつかの研究では、ZIKVによって媒介されるIFIT1,IFIT2,IFIT3,および抗ウイルス応答(自然免疫系、IFN α/βシグナル伝達、RIG-I、およびMDA5経路、RNA結合、DNA代謝過程、クロマチンリモデリング、および細胞周期)に関与する他の細胞遺伝子の転写を成功裏にブロックすることが示されている[19]。
オバトクラックスはまた、抗ウイルスIFN-βおよび-γの産生を抑制した。それは、おそらく、骨髄性白血病細胞分化1タンパク質(Mcl-1)-タイプIシグナル伝達軸の阻害を介して、細胞抗ウイルス応答の活性化を抑制した。これは、IFN-I応答を調節するSTAT3シグナル伝達経路のMcl-1介在性調節を介して可能である(図1)。また、網膜色素上皮(RPE)細胞におけるWSN媒介のプロ炎症性IP10,IL-6,IL8,CXCL1,CCL2,およびCCL5の産生を抑制した[152]。インフルエンザ、ジカウイルス、黄熱病ウイルス(YFV)西ナイルウイルス(WNV)ジュニンウイルス(JUNV)シンドビスウイルス(SINV)ラッサ・マンマレナウイルス(LASV)リンパ絨毛膜炎ウイルス(LCMV)に対して試験管内試験で有効であった[66]、[153]、[154]、[155]。オバトクラックスは、細胞内に誘導されたMcl-1を標的とすることで、ウイルスの細胞内取り込みを抑制した [66]。免疫調節作用および抗ウイルス作用を考慮すると、SARS-CoV-2に対するオバトク ラックスの効果を決定するためには、さらなる研究が必要であると考えられる。
4.2.7. マイコフェノール酸
マイコフェノール酸(MPA)のエステルプロドラッグであるマイコフェノレートモフェチル(MMF)は、主にいくつかの標準的な免疫抑制レジメンにおいて有効な免疫抑制剤と考えられている[156]。経口投与されると、腸内および血液中のエステラーゼによって加水分解され、MPAが放出され、これはイノシン一リン酸脱水素酵素(IMPDH)の効率的な選択的非競合的阻害剤である[157]。
MPAは、Tリンパ球およびHuh7細胞株において、ISG発現(IRF1,2,3,4,5,7,インターフェロン誘導性タンパク質35(IFI35)インターフェロン誘導性膜貫通タンパク質1(IFITM1)およびインターフェロン刺激性エキソヌクレアーゼ遺伝子20 kDa(ISG20))に対して何らかの効果を示した。ISREプロモーター要素は、IFNによるほとんどのISGの発現調節因子である。したがって、ISGsの発現に対するこのMPAの効果は、CD4 + T細胞によるIL-17産生を減衰させる能力に由来する。MPAとタクロリムスの免疫調節効果に関する1つの研究では、Th17関連の反応を抑制する能力が観察された。MPAはタクロリムスよりもIL-17を強く抑制するようである[69], [158]。
MPAは、試験管内試験試験6件、生体内試験試験2件、臨床観察試験1件を含むいくつかの試験において、抗ウイルス活性を有することから、MERS-CoVの治療薬候補として検討されてきた。試験管内試験試験では,MPAがMERS-CoVおよびSARS-CoVのパパイン様プロテアーゼを標的とすることが明らかになった。さらに,MPAは低いIC50 [159], [160], [161], [162], [163], [164]で強力にウイルスを阻害した。MPAはまた、IFN-βと組み合わせて投与された。このレジメンは、ヒトMERSに類似した重篤な疾患を示すマーモセットで試験され、その結果、より重篤な、あるいは致命的な転帰を伴う高ウイルス力価が得られた[165]。不満足なことに、研究者も述べているように、MPAはMERS患者にとって有益というよりも有害であったようである。この点では、MPA単剤療法は臨床の場では評価されていない[166]。ある研究では、8人のMERS-CoV患者にMPAが投与され、そのうち7人にはIFN-βも適応とされた[167]。リバビリンとIFN-α、ステロイド、抗生物質という異なる抗ウイルス剤を投与された患者と比較して、急性生理学的および慢性健康評価II(APACHE II)スコアは低かったが、すべての患者は生存していた。このように,これらの所見の解釈には注意が必要である。
以上のことから,MERSに対するMPAの試験管内試験試験では有望な結果が得られたが,生体内試験試験では,MPAの使用は有益というよりも有害であることが示唆され,コロナウイルス感染症では臨床的に有利とは言えないと考えられた。また、臨床試験は、MERS-CoV患者におけるMPAの有用性を確認するにはあまりにも限られたものであった。
4.2.8. シロリムス
ラパマイシン®またはシロリムスは、腎移植拒絶反応の予防薬として承認されているマクロライドである。腎毒性、虚血、自己免疫疾患、炎症性疾患など様々な疾患に使用されている。T細胞の活性化・増殖やサイトカイン産生を抑制することで作用する。さらに、シロリムスは、哺乳類のラパマイシン標的(mTOR)シグナル伝達経路の主要な阻害剤である[38]、[168]。Caoらの研究では、mTORシグナルの阻害はTLR9と骨髄分化一次応答88(MyD88)との相互作用をブロックし、その後IRF7を抑制し、IFN-α/βの産生を阻害することが証明されている(図1)。したがって、シロリムスは抗ウイルス遺伝子および抗炎症遺伝子の発現を抑制する[169]。PI3K-PKB-mTOR経路はE型肝炎ウイルス感染を制限し、mTOR阻害は感染を悪化させる[170]。Huangらは、sirolimusのH1N1およびH3N2インフルエンザウイルスに対する抗ウイルス活性は試験管内試験では報告していないが、治療ウィンドウが決定されれば、重症インフルエンザの救済療法として機能する可能性があると示唆している。一方、オセルタミビルに加えてアジュバントとして使用した場合、シロリムスが抗H1N1薬として有効であることを示した研究もある[171]。
シロリムスが免疫調節剤として機能することを示すいくつかの肯定的な証拠がある。シロリムスは、骨髄移植後のTh1およびTc1細胞のダウンレギュレーションにより、Th1/T細胞傷害性細胞1(Tc1)およびTh2/Tc2細胞のバランスを調節できることが示されている。したがって、ラパマイシンは、I型サイトカイン分泌の減少を介してT細胞サイトカインのモジュレーターとして提示されている[172]。シロリムスはまた、IFN-γおよびIL-4の産生を減少させた[173]。シロリムスとマイコフェノール酸の併用は、ERK/p38 MAPK経路の抑制を介して、細胞間接着分子1(ICAM-1)および誘導性一酸化窒素合成酵素(iNOS)を含む炎症性サイトカインを相乗的に阻害した[168]。
シロリムスは、ERK/MAPKおよびPI3K/AKT/mTORシグナル伝達経路の両方を調節し、これらはSARS-CoV-2と類似したウイルスであるMERS-CoVに対する宿主防御において重要な役割を果たすと考えられている。sirolimusの濃度を変えることで、mTORの阻害によりMERS-CoVの感染が試験管内試験で抑制された。しかし、mTORシグナルはMERS-CoV感染において中心的な役割を果たしている可能性がある[174]。
SARS-CoV-2受容体として知られるアンジオテンシン変換酵素2(ACE2)やCD26などの老化関連タンパク質が宿主細胞上に多く発現していることから、SARS-CoV-2の受容体が産生期の肺細胞表面に多く存在するのではないかと推測されている。また、タンパク質合成能力が向上しているため、IL-6などのSASP(senescence-associated secretory phenotype)と呼ばれる炎症性メディエーターを多く産生する。これが、高齢者のCOVID-19に対する感受性が高くなり、死亡率が高くなる理由と考えられる。COVID-19に対して肯定的な効果を示したアジスロマイシンとドキシサイクリンの両方が同様に抗老化作用を有することを考慮すると、シロリムスのような抗老化作用を有する薬剤がCOVID-19の治療薬として役立つ可能性があると考えられている[175]。
いくつかの研究では、老齢マウスをシロリムスまたはそのアナログなどのmTOR阻害剤で処置することで、老齢マウスの免疫系を若返らせ、インフルエンザワクチン接種に対する反応を強化できることが実証されている[176]。ヒトを対象とした研究では、重症のH1N1インフルエンザでは、ステロイドと一緒にシロリムスを投与することで症状が改善することが示された。しかし、シロリムスの全身投与には副作用があり、例えば、シロリムスの吸入により肺毒性が生じた。このように、ビグアナイド系薬剤は肺毒性を伴わないmTOR阻害剤と考えられる。興味深いことに、メトホルミンはこの薬物クラスのメンバーである[177]。ウイルスと宿主の相互作用に基づいて、バイオインフォマティクス研究により、抗SARS-CoV-2薬として機能する可能性のある16種類の薬剤のリストが提案され、その中にはsirolimusやダクチノマイシンとの併用薬も含まれている[68]。
4.3. 非ステロイド性抗炎症薬
4.3.1. アセチルサリチル酸(アスピリン)
アセチルサリチル酸(別名アスピリン)は、抗炎症・解熱剤として115年以上にわたり痛みや発熱の治療に使用されていた。また、血小板の凝集を抑制することで心筋梗塞や血栓性脳梗塞を予防することができる。
アスピリンは非選択的シクロオキシゲナーゼ阻害剤に分類される。いくつかの研究によると、その長期使用は、乳がん、肺がん、大腸がん、肝臓がん、前立腺がん、食道がん、皮膚がんなどのさまざまな種類のがんのリスクを低減する可能性がある。
アスピリンは、COX-1とCOX-2を非選択的に標的とすることで、プロスタグランジンの分泌を阻害する。アスピリンのアセチル基はCOX-1酵素のセリン残基と結合し、その永続的な阻害を引き起こす。その結果、プロスタグランジンのレベルが低下し、痛みが緩和される。同じプロセスは、プロスタグランジンE1の産生を阻害するアスピリンの解熱効果についても説明できる[38]。
Glatthaar-Saalmüllerらによると、アスピリンは、インフルエンザA(H1N1)ヒトライノウイルス14(HRV-14)およびヒトライノウイルス39(HRV-39)に対して有意に有効であった。また、炭酸脱水酵素9(CA9)ヒトライノウイルス1A(HRV-1A)およびヒトライノウイルス2(HRV-2)に対しても、用量依存的に顕著な抗ウイルス活性を示した。我々の知る限りでは、正確なメカニズムはまだ解明されていない[178]。
別の研究では、アスピリンは HCV 誘発性 COX-2 の mRNA およびタンパク質発現をダウンレギュレートしたが、これは NF-κB メカニズムとはおそらく独立したものであった。アスピリンはまた、ウイルスの複製を阻害したが、これは COX-2 の阻害と p38,MEK1/2,および MAPK の活性化に関連していた [71]。
以前の研究では、アスピリンはIFN-αとIFN-γの両方の産生を増強することが示された。IFN-γの増強は、プロスタグランジン合成の遮断に関連していた。対照的に、IFN-αの産生量はプロスタグランジン[179], [180]の影響を受けなかった。
他にもいくつかの証拠があり、IFN-αが誘発するSTAT1,JAK1,およびJAK2のリン酸化亢進におけるアスピリンの役割について言及しており、これはIFN-αの抗腫瘍機能の改善をもたらす(図1)[181]。
前述のように、アスピリンはプロスタグランジンの産生を阻害するため、COVID-19の症状を悪化させるのではないかと懸念されていた。FitzGeraldによると、PGE2,PGD2,およびプロスタサイクリン(PGI2)のようなプロスタグランジンは、炎症を増強し、かつ制限することができる。したがって、COVID-19治療におけるアスピリンの可能性のある役割について、さらなる調査が必要である[182]。
4.3.2. インドメタシン
インドメタシン(INDO)もNSAIDsの中では有名な部類に入るが、インドメタシンは1963年に発見され、1965年にFDAによって承認された。INDOの主な適応症は、投与経路によって分類することができる。経口剤は軽度から重度の関節リウマチの症状を緩和するために処方され、片頭痛もあるが、静脈内剤は特定の特徴を持つ未熟児の動脈管開放症(PDA)の治療に適用される。
INDOの鎮痛効果および抗炎症効果は、その作用機序によって定義することができ、それはCOX酵素の両方のアイソフォームの可逆的な阻害を含む。COX-1はほとんどの体組織に存在し、プロスタグランジンとトロンボキサンA2を分泌するが、COX-2は炎症や損傷に反応してのみ発現する。これらのアイソフォームの両方は、アラキドン酸のPGG2への変換およびPGG2のPGH2への変換の触媒に関与している。PGE2は、COX-2を介した経路でPGH2から産生され、炎症、疼痛、発熱の媒介に重要な役割を果たしている。抗解熱作用は、視床下部に作用し、末梢血流の増加と血管拡張につながる結果である可能性がある。
他のNSAIDsとは異なり、INDOはリン脂質からアラキドン酸の放出に関与するホスホリパーゼA2を抑制する[38]。
Andreoneらによると、INDOは、慢性HCVおよびHBV感染症において、顕著な抗ウイルス効果を有するIFN誘導タンパク質である2′、5′-OASの産生を高めることができた。さらに、INDOはHCVクリアランスに必要なTh1反応を亢進させ、HCVの持続性に関係するTh2反応を抑制した。これらのINDOの効果は、STAT 1のリン酸化を誘導することで、ISRE依存性の転写を劇的に高めることに関係している可能性がある[72]。
INDOの抗ウイルス活性もまた、SARS-CoVに対して検討され、有望な結果が得られた。INDOは、ウイルスRNA合成を選択的に阻害することにより、コロナウイルスの複製を阻害することが示された。しかし、さらなる研究が必要とされている。
この特別な抗ウイルス活性はCOXに依存しないことが強調された。1) NSAIDsの別のメンバーであるアスピリンは、この効果を模倣することができなかった。2) INDOが抗ウイルス活性を示した濃度は、COX遮断に必要な用量に適合していなかった。
最後に、SARS-CoVの複製を阻害する効果を持つ強力なIFN応答の誘導剤としてのINDOは、SARS-COV-2に対する免疫システムを強化するための潜在的な候補として考えられるかもしれない[183]。
4.4. その他の合成化合物
4.4.1. メトホルミン
現在、メトホルミンは、天然由来(Galega officinalis由来[184])であること、60年以上の使用経験があり、安全性が高いことから 2型糖尿病の第一選択の経口治療薬となっている。さらに、それは心血管疾患や癌の発生率にプラスの効果を発揮すると思われる[185]。
この薬剤は、電子輸送鎖の複合体I(NADH脱水素酵素)を阻害し、その後、AMP(アデノシン一リン酸)レベルを増加させ、AMP活性化プロテインキナーゼ(AMPK)誘導につながる可能性がある。メトホルミンの薬理作用は、主にAMPKへの作用を介していると考えられている[186]。AMPKの活性化は肝グルコース出力の抑制をもたらし、末梢細胞のインスリン抵抗性を低下させる[74]。
メトホルミンの効果は分子レベルでのばらつきがあり、それは用量、期間、急性または慢性投与に依存する[184]が、Marcucciらは、メトホルミンの効果は病理学的状態の文脈に関連しているとの見解を示した。彼らは、がんではメトホルミンは免疫賦活剤として働き、抗炎症性サイトカインを減少させ、M2マクロファージをM1マクロファージにシフトさせ、T細胞の抗腫瘍反応を刺激することを示唆している。一方、他のいくつかの疾患では、メトホルミンは、炎症性メディエーターの減少、抗炎症性サイトカインの増加、抗炎症性・免疫抑制性T細胞としてのTh2および調節性T細胞のアップレギュレーション、炎症性T細胞としてのTh1およびTh17のダウンレギュレーションを介して免疫系を抑制する[186]。さらに、炎症抑制は、単球ではNF-κB p65経路の抑制、マクロファージではTNF-αおよびIL-6産生の抑制を介して起こる可能性がある。さらに、メトホルミンによるAMPK活性化およびSTAT3阻害は、単球からマクロファージへの分化を阻害する[187]。これらの抗炎症作用とAMPK活性化のすべてが、メトホルミンをカロリー制限の擬態薬とし、全身と免疫系を若返らせる[188]。さらに、健康な人にメトホルミンを投与すると、抗炎症作用が誘導されることが示された[186]。これらすべてのデータを考慮すると、メトホルミンは免疫調節剤とみなすことができる。
IFN-βは、抗ウイルス応答に必要なエネルギーを供給するためにグルコース代謝を調節することで、細胞内の抗ウイルスタンパク質合成を含む抗ウイルス機構を刺激する。実験的に、細胞をIFN-βで処理した後、グルコースの頑健な取り込みが観察される。メトホルミンの抗ウイルス効果は、細胞が抗ウイルスタンパク質を合成することを可能にするインスリンに対する細胞の感受性を高めることによるものと考えられる。臨床研究では、IFN-β抗ウイルス活性に対するメトホルミンの相乗効果も証明されている[75]。
さらに、AMPKとIFNの間にはクロストークがあるが、これはまだ明らかにされていない。メトホルミンはSTAT1およびSTAT2の発現およびそれらのリン酸化を増加させることが示された。メトホルミンは宿主細胞の抗ウイルス機構のJAK-STATシグナル伝達経路を活性化する可能性があると結論づけられた。これらのデータを考慮して、Tsaiらは、メトホルミンがAMPK経路を介してIFN-Isの抗ウイルスシグナル伝達を活性化すると推論した[74]。
いくつかの研究では、喘息患者および糖尿病患者におけるメトホルミンの使用がハザードおよび増悪の割合を減少させたことが示されている。したがって、メトホルミンは、体重減少や肺炎に効果があることから、COVID-19を取得した肥満・糖尿病患者の補助療法として使用することができると考えられている[189]。また、メトホルミンはSARS-CoV-2の主要細胞受容体であるACE2との相互作用がなく、糖尿病患者への使用は安全であると主張されている。Cavaらは、ACE2に関連する重要な遺伝子との相互作用を介して、COVID-19に有用な薬剤を同定するためのin silico研究を行った。興味深いことに、メトホルミンはアセチル-CoAカルボキシラーゼα遺伝子との相互作用により脂肪酸合成を阻害するCOVID-19の治療薬候補である[76], [190]。
4.4.2. フルオキセチン
フルオキセチンは、選択的セロトニン再取り込み阻害薬(SSRI)であり、1987年に第2世代の抗うつ薬としてFDAの承認を取得した。強迫性障害を適応症とし、大うつ病や神経過食症の維持期と急性期の両方の治療に用いられている。
SSRIとして、その作用機序は、セロトニンのシナプス前再取り込みを阻害することが含まれている。これに続いて、脳のさまざまな部分で5-ヒドロキシトリプタミン(5-HT)のレベルが上昇する [38]。
フルオキセチンは、STAT-1およびPPAR-αの活性化を増加させることにより、細胞増殖抑制の過程でIFN-α調節因子として提案されている[191]。Youngらによると、フルオキセチンは、JNKおよびSTAT-1の活性化を介してIFN-α媒介の抗ウイルス作用を促進することで機能するHCVの阻害剤として成功している(図1)[77]。
一方、フルオキセチンの治療用血漿中濃度は、IFN-γ産生を顕著に減少させ、負の免疫調節作用を示した[192], [193]。
Sacreらは、IFN-αを介した抗ウイルス作用に対する正の効果とは対照的に、フルオキセチンは、(SARS-CoV-2などの)ssRNAウイルスの認識における2つの主要なPRRであるエンドソームTLR-3および-7の阻害剤であることを発見した。その結果、SARS-CoV-2に対するフルオキセチンの役割については、さらなる検討が必要とされている[20]。
4.4.3. ベラパミル
ベラパミルは、非ジヒドロピリジン系のカルシウム拮抗薬に属し、60年代初頭にこのクラスの最初の薬として導入された。主な適応症は狭心症、高血圧、心臓不整脈である。
ベラパミルは、心血管系に存在するL型カルシウムチャネルであるCav1.2のα-1サブユニットに結合する。その相互作用は周波数および電圧依存性であり、その結果、L型カルシウムチャネルを阻害する[38]。
ベラパミルの一般的な副作用は洞性徐脈である。その他の副作用には、肺水腫、重度の低血圧、第2度心房室ブロックなどがある[45]。
最近の研究では、ベラパミルや他のいくつかのイオンチャネル遮断薬が、エボラなどのフィロウイルスの細胞侵入を阻害することで、フィロウイルスに対して有用であることが明らかになった[78]。
Khakzadらによると、血清および気管支肺胞液(BALF)IFN-γのレベルは、感作マウスと比較してベラパミル投与マウスで顕著に上昇した[194]。対照的に、ベラパミルがIFN-γ産生を抑制することを示唆する他の研究もある[195]。さらに、ベラパミルは、STAT3シグナル伝達経路(図1)の抑制により、IFN-γ誘発性神経毒性を減少させることが明らかになった[196]。
4.4.4. スタチン類
β-ヒドロキシβ-メスリルグルタリル-コエンザイムA還元酵素(HMGCR)阻害薬(スタチン)は、肝臓におけるHMG-CoAのメバロン酸への変換とコレステロールの生合成を阻害する治療薬である。それらは高コレステロール血症の治療のために承認されている。さまざまなタイプのウイルスに対する多くのスタチン薬の抗ウイルス活性が報告されている。スタチンはまた、IFN-αの抗ウイルス活性を促進する[197]、[198]。さらに、いくつかの研究者は、次のパンデミックインフルエンザの治療と予防のためにスタチン系薬剤を提案している[81], [199]。スタチンは、細胞構造やウイルス複製に必要な環境を阻害することで、インフルエンザの予防的または治療的に投与できることが示唆されている。さらに、スタチンはインフルエンザを原因とする肺炎の死亡リスクを低下させることが証明されている[201]。
スタチン類の抗ウイルス活性は、HCV(プレニル化阻害を介して)HIV-1(シムバスタチンによるRhoの標的化を介して)RSV(ロバスタチンによる細胞間融合の減少を介して)およびポリオウイルスに対して証明されている[80], [81]。
スタチンは、抗炎症作用、内皮安定化作用、および抗酸化作用を示すことが知られている。スタチンは、NF-κB、MAPK、ペルオキシソーム増殖因子活性化受容体(PRAR)依存性経路を阻害し、多くの免疫細胞の活性化と増殖に影響を与えることが証明されている[202]。スタチン系薬剤の抗炎症作用は、白血球の接着を阻害し、サイトカイン産生を減少させることによるものであることが示唆されている[201]、[203]。さらに、コレステロール生合成の中間体であるファルネシルピロリン酸(FPP)とゲラニルゲラニルピロリン酸(GGP)の阻害もスタチン抗炎症作用のもう一つのメカニズムと考えられる。これら、2つの中間体の還元は、免疫応答を含む多くのシグナル伝達経路において極めて重要な「イソプレニル化小GTPase(Rho GTPase)シグナル伝達分子」を減少させる[200]、[204]。
いくつかの試験管内試験データによると、免疫細胞株に対するスタチンの抗炎症効果は、生理的な血中濃度よりも高い用量が必要であるとされている。しかし、投与経路としてのスタチンの吸入が抗炎症効果を高めることを示す証拠もある[200]。
例えば、フルバスタチンは、IFN-γ、TNF-α、IL-8を含むプロ炎症性サイトカインの発現を阻害することが示されている[81]。ラバスタチンは、IL-2,IL-4,およびIFN-γなどのT細胞サイトカインの産生を阻害し、NF-κBおよびアクチベータータンパク質1(AP-1)のシグナル伝達経路をダウンレギュレートし得ることが示された。また、ロバスタチンは、Th1/Th2のバランスを調節する可能性もあった[205]。シンバスタチンはまた、Th2サイトカイン[205]とリンパ球を抑制し、TNF-α、IL-2,およびIFN-γ産生を抑制した[206]。
シンバスタチンによる単球におけるIFN-α遊離およびphospho-STAT1の抑制は、IFNARの下流および上流のシグナル伝達に影響を与えることを示唆している(図1)[200]。さらに、シンバスタチンは、STAT1/3の阻害を介してIFN-γ誘導性シクロオキシゲナーゼ2(COX-2)を減少させることができる[207]。
SARS-CoV感染は、MyD88およびNF-κB発現を誘導し、COVID-19の主要な死因であるARDS(急性呼吸窮迫症候群)を引き起こす。スタチンはMyD88濃度を調節し、NF-κB活性化を低下させることが知られている。したがって、COVID-19を取得した心血管疾患または糖尿病患者でのスタチン使用が有用である可能性が示唆されている[208]。さらに、インフルエンザ、H1N1,エボラウイルス感染症の症状改善におけるスタチン治療の利点が証明されている。SARS-CoV-2がACE2を介して細胞内に入り、ACE2をダウンレギュレートすることを考えると、ACE2をアップレギュレートするスタチンの能力は、COVID-19治療に有利である可能性がある[79]。
また、いくつかの相反する報告もある。Guらは、シンバスタチンがATG5,LC3B、およびベクリン1の発現を増加させることにより気管支平滑筋細胞(BSMCs)のオートファジーを活性化し、これがオートファゴソームの形成と気道炎症の減少につながることを報告した。BSMCsにおけるこのオートファジーは、IFN-γの増加およびIL-4,IL-5,およびIL-13の減少と関連しており、Th1のアップレギュレーションおよびTh2サイトカインのダウンレギュレーションと並行していた[209]。
全体的に、スタチンは肺の高炎症反応とサイトカインストームの原因となる前炎症性因子を抑制できることが証明されている。このことは、スタチン類がCOVID-19の予防または治療の候補となることを示唆している(表1)[80]。
5. 天然化合物
5.1. カフェイン
カフェインは、コーヒーやカカオ豆、紅茶などに由来する成分で、メチルキサンチン系の薬物に分類される。主な適応症としては、未熟児の呼吸器疾患、痛みの緩和、眠気覚ましなどがある。
カフェインは、体のさまざまな部分で様々な機能を持って提示されている。残念ながら、その一般的および細胞作用の臨床的関連性は十分に理解されていない。示唆されているメカニズムには、ヌクレオチドホスホジエステラーゼ酵素の阻害、アデノシン受容体(A1,A2a、A2b、A3)拮抗への関与、および細胞におけるカルシウムハンドリングの調節が含まれる[38]。
Horriganらは、カフェインの免疫調節効果を調査した。彼らは、免疫系におけるカフェインの役割は用量依存性であり、その介入は主にアデノシン受容体とcAMP-ホスホジエステラーゼの拮抗によるものであると結論づけている[210]。
Tejらは、カフェイン治療が腫瘍の発生率と増殖率を劇的に低下させることを発見した。考えられるメカニズムは、アデノシンA2A受容体の拮抗に依存する。アデノシンがT細胞のA2A受容体を活性化すると、CTLの増殖、サイトカイン(TNF-αおよびIFN-γ)の産生、およびプログラムされた細胞死タンパク質1(PD-1)の発現が減少する[211]。
カフェインは、そのメカニズムはまだ不明であるが、複製を阻害することで抗HCV薬としていくつかの研究で言及されている。研究では、ヒートショックプロテイン90(HSP90)Ras-ERK、およびCOX-2などの特定のタンパク質の発現がカフェインによって細胞内で減少し、結果としてHCVの複製を阻害することが示唆されている[82]。
カフェインの長期消費はIFN-γ上昇をもたらすことを示唆する証拠もある[212]。したがって、カフェインは、SARS-COV-2の介入における更なる調査のターゲットと考えられる。
5.2. グリチルリチン
Glycyrrhiza glabra L. (Fam. Fabaceae)は甘草またはmulethiとして知られている[213]、その根はグリチルリチン(2-8%の乾燥重量)のかなりの含有量を持っている。グリチルリチンはオレナン型トリテルペノイドサポニン[214]であり、抗潰瘍作用、抗炎症作用、免疫調節作用、抗アレルギー作用など様々な薬効を持つ[215]。また、HIV[216]、[217]、SARS[218]に対しても有効である。グリチルリチンは、ウイルス感染による細胞内活性酸素種(ROS)の蓄積を阻害する[83]、[219]。グリチルリチンによる活性酸素の生成抑制は、ウイルスの複製に関係すると考えられているNF-kB、JNK、p38,レドックス感受性シグナル伝達活性を低下させ、ウイルスの複製を防ぐことにつながる[83]。
グリチルリチンの免疫調節効果は、毛細血管透過性の低下、IFN-γの増加、NK細胞やT細胞の活性化、補体応答の抑制によって発揮されることが示されている[220], [221]。ConA誘発マウス肝線維化モデルの研究では、グリチルリチン投与により、Th1,Tregs、Th2,およびTh17の浸潤が有意に減少することが示された。また、グリチルリチンは肝臓と脾臓におけるTh1/Th2とTreg/Th17の比率を増加させた[222]。乾癬患者の治療プロトコルにグリチルリチンを添加した場合、グリチルリチンを添加しない群と比較して、Th17細胞とIL-22の発現レベルが有意に低下することが観察された[223]。ある研究では、グリチルリチンは豚伝染性下痢ウイルス(PEDV)の感染を抑制し、高移動度グループボックス1(HMGB1)/TLR4 MAPK p38経路を介して炎症性サイトカインの分泌を減少させることができた[224]。グリチルリチンはHMGB1の競合的阻害を介して前炎症性サイトカインのmRNAレベルを低下させた。また、TLR4やRAGE(高度な糖化末端産物の受容体)とPEDVの感染による発病との関連も確認されている[225]。
最近の研究では、上気道感染症の治療におけるグリチルリチンの有用性が示されており、根粒菌は上気道粘膜免疫系の機能を改善した[226], [227]。グリチルリチンはまた、ウイルスの吸着と浸透を抑制した[228], [229]。多くの研究が行われているにもかかわらず、SARS-CoV2に対するグリチルリチンの効果はまだ明らかになっていない。
5.3. ベルベリン
ベルベリンは、中国のハーブである黄蓮をはじめとする多くの植物に由来するアルカロイドである。感染性の下痢や赤痢の治療のための抗菌剤として中国の伝統医学で一般的に使用されている。ベルベリンはまた、負の慢性強心作用、正の強心作用、抗不整脈作用、血管拡張作用を含む循環器系への影響も示されている[230]。さらに、それは抗糖尿病薬とみなされている。ベルベリンは解糖刺激を介してグルコース代謝を変化させ,グルコキナーゼ活性とインスリン分泌を亢進させ,肝グルコース新生と脂肪形成を阻害する。5′AMPKの活性化能力がその主な機能であると思われる[231]。ベルベリンはまた、いくつかの免疫調節作用を示す。ベルベリンはIL-12の分泌を刺激し,逆にIL-6の産生を抑制することでIFN-γの産生を促進し,抗原をプライミングしたCD4+T細胞のIL-4レベルを低下させた [85], [86]。ベルベリンは、CD4+ T細胞におけるTh1サイトカイン産生を刺激し、Th2を抑制する効果を示した[232]。別の研究では、ベルベリンはAP-1結合を阻害することにより、基底およびTPAを介したPGE2レベルとCOX-2発現を抑制することが示されている[233]。ベルベリンは、SARS-CoV-1(IC50 2 µg/mL)[234]、HSV、チクングニアウイルス(CHIKV)[235]、[236]、HCV[237]、インフルエンザウイルス[238]などの様々なウイルスに対して活性を示した。したがって、COVID-19への影響についての更なる調査が必要である。
6. 結論と今後の方向性
COVID-19の治療に利用可能な承認された治療薬はまだ存在せず、現在の治療法は、他のウイルス感染症で投与された以前に承認された抗ウイルス薬や実験研究に基づいた支持療法または薬物療法が中心となっている[239]。COVID-19の世界的パンデミックに関するもう一つの問題は、新規症例の有病率をコントロールするための利用可能なワクチンの欠如である。ヒトコロナウイルスに対する長期的な保護の性質に関する確固たる証拠は見つかっていないが、異なる種類のヒトコロナウイルスに関する過去の研究から収集されたデータは、ウイルス特異的抗体価が時間の経過とともに徐々に低下し、COVID-19に対する部分的で一時的な保護を確立するだけであることを示唆している[240], [241]。一方で、ワクチンの承認に必要な時間を考慮すると、開発および臨床試験のコストが大きい。そのため,今回レビューしたIFN修飾能を有する様々な抗ウイルス剤が,COVID-19治療への再利用を目的とした薬剤候補として注目されている。これらの薬剤の中には副作用がその利点を上回っているものもあるが,そのメカニズムや構造を研究することで,将来の新薬設計の手がかりが得られる可能性がある。さらに,これらの薬剤が有する抗ウイルス作用やIFN修飾作用は,SARS-CoV-2に対する相乗効果につながる可能性がある。このような可能性を評価するためには、さらなる研究が必要である。