Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC5334251/

要旨
プリオン病の有効な治療法はまだ確立されていないが、その病態の解明に向けて多くの進歩があり、そのため治療薬の研究が促進されている。最近,フルピルティン,キナクリン,ペントサン・ポリサルフェート,ドキシサイクリンなどの化合物が,プリオン病患者に対して試験的に使用されるようになった。それに伴い、compound B(compB)、INDシリーズ、anle138bなど、いくつかの抗プリオンのリード化合物が発見された。しかし、臨床試験が有意に有益な結果をもたらすにはまだ程遠く、動物におけるリード化合物研究の知見は新たな課題を浮き彫りにしている。これらの取り組みにより、より効果的な治療法を実現するために、改善やさらなる探求が必要な領域が浮き彫りになってきている。本研究では、プリオンに関連する治療研究の最近の進展を概観し、プリオン病の有意義な医療介入のために解決すべき基本的な科学的課題について議論する。
プリオン病は、ヒトや動物では伝達性海綿状脳症とも呼ばれ、現在でも不治の病で致死性の希少な神経変性疾患である。クロイツフェルト・ヤコブ病(CJD)(Creutzfeldt 1920; Jakob 1921)は最も代表的なヒトのプリオン病で、いくつかの臨床病理学的サブタイプからなる(Parchi et al.1999; Puoti et al.2012 )。CJDのほとんどの症例は、症状が現れてから亜急性進行性の疾患過程を示すため、患者が治療介入による有益な効果を受けることは困難である。本研究では、まず、プリオン病に対する医療介入の歴史について、臨床試験や最近の治療法開発の進展を含めて概説する。次に、最近の臨床試験や創薬研究によってもたらされた新しい知見を検討する。最後に、近い将来、プリオン病に対するより良い医療介入を実現するために、基礎科学の進歩が必要であることを論じる。
CJDへの治療介入の歴史的概観
図1は、CJDの治療法開発の年表である。CJDの実験的介入の歴史の初期(1990年以前)には、症例報告研究の中でCJD患者に(対症療法に加えて)予備的な実験的治療が行われることが時々あった。CJD患者の治療に使われた最初の薬剤は、アシクロビル(Davidら 1984; Newman 1984)、アマンタジン(Braham 1971; Norris 1972; Herishanu 1973; Sanders and Dunn 1973; Ratcliffeら 1975; Terzanoら 1983; Neriら 1984)、インターフェロン(Kovanenら 1980)およびビダラビン(Furlowら 1982)などの抗ウイルス薬であった。これらの薬剤はすべて、CJD病原体の伝達性の特徴に対処するために使用された。次に、抗うつ剤(Dervaux et al. 2001)、鎮痛剤(Otto et al. 2004)、抗けいれん剤(Imperiale et al. 2003)など、中枢神経系に影響を与える薬剤を対象としたものが、この疾患の脳症的特徴の治療に使用された。
図1 クロイツフェルト・ヤコブ病(CJD)に対する治療法開発の年表

BSE、牛海綿状脳症、WHO、世界保健機関、CNS、中枢神経系、PPS、ペントサン・ポリサルフェート
CJDの病原体としてプリオンが発見された後(Prusiner 1998)、多くの研究が、プリオンの不思議な性質をよりよく理解するために、異常プリオンタンパク質(PrPSc)の形成を阻害する化合物や生体材料、あるいはPrPScの分解を促進する化合物を主に研究してきた。同時に、変異型CJDの出現(Willら、1996年)と医原性CJDの蔓延(Nozakiら、2010年)という2つの悲劇的な出来事が、CJD治療薬の探索を加速させることになった。CJDをはじめとするヒトプリオン病は希少で早期診断が困難なため、2000年代半ばまでの実験的介入に関する報告は、症例報告や観察研究という形で、単一または少数の患者から得られたものがほとんどであった。しかし、治療薬の効果については、罹病期間にかなりのばらつきがあるため、明確な結論を出すことは非常に困難である。Stewartら(2008)は、このような報告を体系的にまとめ、すべての患者の疾病経過と治療を構造化された枠組みで、できれば無作為化比較試験で評価する必要があることを強調している。
エビデンスに基づく医療の流れとともに、近年、ドイツでのフルピルティン試験(Otto et al. 2004)、英国(Collinge et al. 2009)および米国(Geschwind et al. 2013)でのキナクリン試験、イタリアおよびフランスでのドキシサイクリン試験(Haïk et al. 2014)など、いくつかの臨床試験が、構造的な枠組みで実施されるようになってきている。表1にこれらの臨床試験とその結果をまとめ、次節で各試験の詳細を説明する。近年のCJD臨床試験は、臨床医や研究者による複数機関あるいは多国籍の共同研究であることに注目することが重要である。さらに、NPOの支援による患者やその家族による働きかけも、治療法開発の推進に役立っている。
表1.クロイツフェルト・ヤコブ病(CJD)患者を対象とした最近の実験的研究およびトランスレーショナル研究
| 国名 | 化合物 | 研究期間 | 報告書 | スタディタイプ | 結果 | 備考 |
|---|---|---|---|---|---|---|
| ドイツ | フルフィルティン | 1997-2001 | Otto et al. | 無作為化二重盲検試験;CJD患者28名 | 認知機能には効果があるが、生存には効果がない | プリオンに感染した細胞や動物を用いた前臨床試験は行っていない |
| 日本 | ピーピーエス | 2004-2007 | 坪井ほか 2009 | オープンな前向き観察;CJD患者11名 | 臨床的特徴の明らかな改善なし | 浸透圧ポンプ装置による化合物の脳室内持続注入 |
| イギリス | 2003-? | Newmanら2014年、他 | 症例報告(非組織的試験);変型CJD患者5名 | 4名の患者さんで生存期間を有意に延長 | ||
| イギリス | キナクリン | 2004-2007 | Collinge et al. | 非盲検患者選択試験(PRION-1);CJD患者107名 | 治療群と非治療群の死亡率に差はない | 本剤による脳の有害反応に起因する精神・神経症状の一過性の改善 |
| 米国 | 2005-2009 | Geschwind et al. | 二重盲検プラセボ対照、層別無作為化試験;CJD患者54名 | 薬物群とプラセボ群の生存率に有意差はない | ||
| イタリア | ドキシサイクリン | 2007-2010 | ハイックら 2014 | 二重盲検プラセボ対照無作為化試験;CJD患者121名 | 薬物群とプラセボ群の生存率に有意差はない | プリオン感染動物では、脳室内リポソーム投与でも効果はごくわずか |
PPS, ペントサン・ポリサルフェート。
CJD患者を対象とした最近の実験的およびトランスレーショナル研究
研究者は、in silicoスクリーニング、in vitroモデル、持続的にプリオンに感染した細胞モデル、プリオンに感染したネズミのモデルを用いて、抗プリオン薬や化合物を探すために多大な努力を払ってきた(Trevitt and Collinge 2006; Sim and Caughey 2009)。このセクションでは、CJD患者を対象に最近試験された薬剤と化合物に焦点を当てる。
フルピルティン
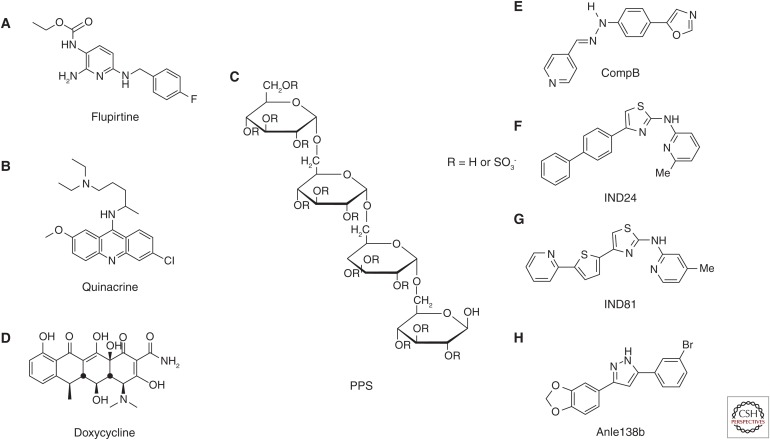
フルピルティン(図2A)は、中枢作用型の非オピオイド鎮痛剤で、in vitroで細胞保護活性があることが見出された(Raffa and Pergolizzi 2012)。この活性は、PrPScを想起させる毒性PrP 106-126凝集体に対する細胞生存性アッセイでも示された(Perovic et al.1997)。フルピルティンは、1997年にドイツで開始された28人のCJD患者を対象とした無作為化二重盲検臨床試験で確立された薬剤である(Otto et al.2004)。その結果、フルピルティンは認知機能に有益な効果をもたらすが、生存率には有意な効果をもたらさないことが結論づけられた(Ottoら、2004年)。
図2 最近臨床試験で使用されている化合物および最近開発された代表的なリード化合物の化学構造

臨床試験で使用されている化合物には、(A)フルピルティン、(B)キナクリン、(C)ペントサンポリスルフェート(PPS)、(D)ドキシサイクリンなどがある。代表的なリード化合物としては、(E)compB、(F)IND24、(G)IND81、(H)anle138bがある
キナクリン
Quinacrine(図2B)は、プリオン感染細胞モデルにおいてPrPScの形成を阻害することが発見された(Doh-ura et al 2000; Korth et al 2001)。その後、立体化学的研究(Ryou et al. 2003)、構造活性相関研究(Murakami-Kubo et al. 2004; Nguyen et al. キナクリンの三環式骨格の9位の窒素に結合する脂肪族側鎖は、プリオン感染細胞モデルで効力を発揮する重要な構造の1つである。しかしながら、キナクリン処理は、プリオン感染げっ歯類モデルにおいて、脳室内注入によって投与された場合でさえ、有益な効果を示さないことが判明した(Collinsら、2002;Barretら、2003)(Doh-uraら、2004)。また、Kocisko and Caughey(2006)は、米国食品医薬品局から認可されている抗マラリア薬で、血液脳関門を通過するメフロキンが無効であることを示した(Kocisko and Caughey 2006)。キナクリンがPrPScコンフォーマーの特定のサブセットを排除および/または修飾し、薬剤耐性PrPScコンフォーマーの生存(Ghaemmaghamiら、2009)または薬剤修飾PrPScコンフォーマーの選択的増幅(Bianら、2014)をもたらすことは、興味深い点である。
キナクリンは、キナクリン投与後に神経症状の急速な改善を暫定的に示した変異型CJD患者に関する広範なメディア報道後に登場した、いくつかの観察研究(Kobayashi et al.2003; Scoazec et al.2003; Benito-León 2004; Haïk et al.2004; Nakajima et al.2004; Satoh et al.2004; Bertrand et al.2005; Martínez-Lage et al.2005; Wroe et al.2006) でもCJD患者に使用されている。しかし、これらの研究結果には賛否両論があった。一部の患者で観察された精神・神経症状の暫定的な改善は、中枢神経系における副作用の一部とみなされ、その有害作用(肝毒性、骨髄形成不全など)のために多くの患者によって投薬が中止されたのである。2004年に英国で、キナクリンをオープンラベルで患者選択的に使用する大規模臨床試験(PRION-1試験)が開始され、散発性、医原性、変異株、家族性CJDの患者107名が対象となった(Collinge et al.) この研究では、治療群と未治療群の間で死亡率に差はなかったと結論づけている。2005年から2009年にかけて米国で行われたキナクリンの別の臨床試験では、二重盲検プラセボ対照、層別無作為化法で、キナクリンはプラセボと比較して散発性CJD患者の生存率を増加させないという結論に達した(Geschwind et al.2013年)。
ペントサン・ポリサルフェート(PPS)
FarquharとDickinson(1986)は、デキストラン硫酸やPPSなどの硫酸化糖鎖を末梢性プリオン感染動物に腹腔内または静脈内注射し、これらの化合物がリンパ系でのプリオン複製を阻害し、動物内の潜伏期間を延長することを発見した。その後、CaugheyおよびRaymond(1993)は、これらの硫酸化糖鎖が、正常(PrPC)または異常(PrPSc)プリオン-タンパク質アイソフォームと相互作用することによって、プリオン感染細胞におけるPrPSc形成を阻害することを報告した。ポリアニオン性高分子の別の例として、複合硫酸化フコシル化多糖である食用海藻フコイダンを経口投与すると、腸内プリオン感染動物の疾患発症を遅らせることも報告されている(Doh-ura et al.2007a)。
PPS(図2C)は、ヘパリン類似の性質を持つ硫酸化半合成多糖である。PPSは高電荷のポリマー構造であるため、経口あるいは非経口投与した場合、血液脳関門を通過することができない。この問題を解決するために、Doh-uraら(2004)は、輸液ポンプ装置を用いてPPSの脳室内投与を実施した。その結果、脳内にPrPScが蓄積した後に投与しても、PrPScの蓄積、神経変性変化、感染性を抑制し、その結果、脳内プリオン感染動物の寿命を延長させることができた。しかし、この方法で投与されたPPSは注入部位周辺に留まり、脳室系全体に拡散せず、特に病的変化があまり抑制されない対側脳への拡散が認められた。
その後、動物での脳室内投与結果をもとに、プリオン病患者への長期脳室内投与が行われるようになった。英国での高等裁判所の審理で変異型CJDに対するこの治療法が支持された後、5人の患者が脳室PPSで治療された(Toddら2005年、Whittleら2006年、Parryら2007年、Rainovら2007年、Boneら2008年、Newmanら2014年)。5人のPPS治療患者のうち4人は、未治療の患者よりも有意に長く生存していた。これら5人のPPS治療患者の生存期間は、16、45、84、105、および114カ月であった。しかし、変異型CJD患者の平均生存期間は17か月であり、未治療患者の最大生存期間は40か月であった(Newman et al.2014)。Newmanら(2014)は、CJD長期生存者の死後調査から、脳室PPSによる治療が脳の神経病理学的変化全体を軽減しないことを観察し、脳室PPSで治療したCJD患者の長期生存の理由は依然として不明だが、病態に対する治療の効果は排除できないと結論づけた。
一方、坪井ら(2009)は、散発性、家族性、医原性CJDの日本人患者11名に対して脳室PPS治療を行ったが、臨床的特徴に明らかな改善は見られなかったと結論付けている。これらの結果は、明らかに変異型CJDの結果と不一致であり、PPSの有効性が疾患のサブタイプによって異なる可能性を示唆している。Teradaら(2010)は、日本で脳室PPSを投与した散発性CJDの症例を報告し、脳内PrPSc量の減少を観察したが、全体的な神経病理学的変化は減少しなかったと述べている。また、本田ら(2012)は、日本で脳室PPSを投与した4例の神経病理所見を報告し、PPSがPrPScオリゴマーの蓄積やアストロサイトのタンパク質発現プロファイルを変化させる可能性を示唆する結果を得たと述べている。
ドキシサイクリン
CJD治療のためのドキシサイクリン(図2D)の発見は、アミロイド線維に結合し、全身性アミロイドーシス患者のアミロイド吸収を誘導する構造的に類似した分子、4′-ヨード-4′-デオキシドキソルビシンの研究とともに始まった。Tagliaviniら(1997)は、4′-ヨード-4′-デオキシ-ドキソルビシンと共インキュベートした場合、PrPScのプロテアーゼ耐性と感染性の両方が低下することを見いだした。ドキシサイクリン及び他のテトラサイクリン化合物は、その後の一連のin vitro及びin vivo研究によって、PrPScに対して同様の活性を有するが、毒性ははるかに低いことが示された(Tagliaviniら、2000;Forloniら、2002;Barretら、2003)。これらのアナログは、末梢または脳内投与されたプリオン感染動物の生存期間を延長することが示された(De Luigiら、2008年)。
相当数のCJD患者の観察研究に続いて、イタリアとフランスで、ドキシサイクリン対プラセボで治療した121人のCJD患者の多施設二重盲検ランダム化試験が行われた(Haïk et al.2014)。しかし、その結果は、どちらのグループの患者でも、生存率や疾患の進行に有意な差は見られなかった。研究者らは、疾患症状が最初に現れた後のドキシサイクリン経口投与による治療は、比較的効果が低いと推測している。実際、De Luigiら(2008)による動物実験では、ドキシサイクリンの脳室内リポソーム投与でさえ、動物が病気の徴候を示し始めてから投与すると、その効果は非常に限られたものであることが示された。現在、イタリアにおけるドキシサイクリンの別の臨床試験では、家族性プリオン病の一種である致死性家族性不眠症(FFI)に関連する遺伝子変異を有する者に対して予防治療を行っていると報告されている(Forloni et al.2015 )。しかし、FFIの動物モデルにおけるドキシサイクリンの有効性に関するデータは、これまで報告されていない。
治療法開発の最近の進歩
図3は、プリオンの伝播と考えられる治療標的を表したものである。治療標的には、PrPC発現の抑制、PrPC分解の促進、PrPC-PrPSc相互作用の抑制、PrPScオリゴマー形成の抑制、PrPSc分解の促進が含まれる。これらの標的はすべて、プリオンの謎めいた性質を理解するために、集中的に研究されてきた。これらの標的に加えて、いくつかの細胞因子が、PrPCを介したまたはPrPScによって誘発される神経変性過程における標的である可能性が示唆されている(Mouillet-Richardら、2000;Morenoら、2012;Pietriら、2013;Alleaume-Butauxら、2015)。一例として、成長停止およびDNA損傷誘導タンパク質であるGADD34が、真核生物翻訳開始因子2のαサブユニットの脱リン酸化を促進し、プリオン感染によって小胞体で引き起こされるアンフォールドタンパク質応答による翻訳抑制を逆転させることがin vivo研究で報告されている(Moreno et al.2012)。
図3 クロイツフェルト・ヤコブ病(CJD)治療薬のターゲットとなりうる分子の模式図
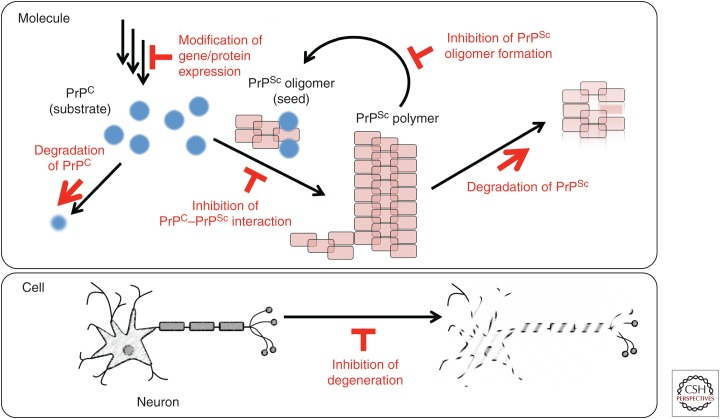
Prnpノックアウトマウスが見かけ上健康でプリオン感染に抵抗性を示すことが報告されて以来(Büelerら、1993)、これまでPrPCが治療薬開発の最も魅力的なターゲットとされてきた。Prnp欠損マウスでは、接種後4日以内に残存感染力が消失し、生体内で効率的にプリオンがクリアランスされていることが示された(Aguzzi and Zhu 2012)。さらに、Prnpの発現を条件付きでノックアウトすると、発症後でも疾患の進行が止まり、特定の脳機能が回復した(Mallucci et al.2002, 2003)。その後、Prnpの発現を抑制した遺伝子治療研究(Pfeiferら、2006;Whiteら、2008)やPrPCを標的とした免疫療法(Whiteら、2003;Songら、2008;Roettgerら、2013)などが報告されている。同時に、PrPCの発現を抑制する化合物も研究されている(Karapetyan et al.2013)。例えば、化合物タクロリムスは、非転写機構により膜および細胞内のPrPCレベルを低下させること(Karapetyan et al.2013)、カルシニューリン阻害剤として作用してプリオン感染動物の神経変性過程を抑制すること(Mukherjee et al.2010)、プリオン感染細胞と動物の両方でオートファジーを活性化すること(中垣 et al.2013)等が明らかにされている。
近年の構造化学および生物学の進歩により、PrPCの重要な構造的特徴の同定が可能となり、PrPCと被験物質との相互作用の調査が容易になり、合理的な薬物設計の指針となっている(Kuwata 2013; Baral et al.2014)。従って、Venkoら(2014)は、プリオン感染細胞ベースのアッセイを用いて、低分子有機化合物の構造活性相関を計算で解析し、まとめた。Kamatariら(2013)は、ドッキング研究の結果とプリオン感染細胞を用いたアッセイにおける設計化合物の抗プリオン活性を比較し、PrPSc形成を強力に阻害する化合物は、PrPCと結合するだけではなく、結合部位周辺の環境を変化させなければPrPC-PrPSc変換反応を抑制できないと結論付けている。最近、白井ら(2014)は、プリオン感染細胞ベースのアッセイにおける包括的なPrPC変異研究に基づいて、PrPScの構造モデルを提案した。PrPC-PrPScおよびPrPSc-PrPSc相互作用を構築するためのインターフェイスは、文献で強調されている。
逆に、PrPScの分解を促進することもまた、魅力的な標的戦略である。オートファジーはPrPScクリアランスを促進することが報告されており(Heisekeら、2010)、アステミゾール(Karapetyanら、2013)およびタクロリムス(中垣ら、2013)などのオートファジー関連の抗プリオン化合物は、プリオン感染動物において特定の効果を有すると報告されている。逆に、Marzoら(2013)は最近、4-hydroxytamoxifenがオートファジーとは無関係にPrPCとPrPScをリソゾームに運ぶことを報告し、PrPScクリアランスのリソゾーム分解経路の存在を示唆している。
最近開発された代表的なリード化合物
本項では、最近開発された代表的なリード化合物のうち、プリオン感染細胞において顕著なPrPSc形成阻害作用を示し、かつ経口投与により脳内プリオン感染動物において顕著な生存期間の延長を示す3種類に焦点を絞る。化合物には、compound B(compB)、INDシリーズ、anle138bが含まれる。これらの化合物は、いずれも芳香環が共役結合で連結された平面構造を有することが特徴である(Teruya and Doh-ura 2013)。
CompB
フェニルヒドラジン誘導体の4-(オキサゾール-5-イル)フェニル)-2-((ピリジン-4-イル)メチレン)ヒドラジンは、CompB(図2E)(川越ら 2004)と呼ばれ、脳内プリオン感染動物の経口投与で潜伏期間の延長効果が高く(川崎ら 2007)、脳血漿濃度比が2.6となることがわかっている。経口摂取10分後には、脳内に初回投与量の0.03%が認められた(Kawasaki et al.2007; Suzuki N, unpubl.)。さらに、compBはキナクリンの臨床使用の妨げとなる活性な排出系を有さない。これらの特徴を合わせると、compBはプリオン病の経口治療薬として適していると言える。compBを経口投与した場合、潜伏期間は無処置の対照マウスの68.5±5.9日から、飼料に0.2%(約300mg/kg/日)を投与したマウスでは154.3±19.9日に延長された。終末期においても,compBの経口投与により,脳のPrPScレベルおよび感染力価は著しく低く維持されていた。このようにcompBは治療薬として有望であるが、プリオン株依存的な有効性と、薬物相互作用を引き起こす可能性のある複数のP450アイソザイムに対する阻害活性という二つの欠点が克服されなければならない。さらに、アリールヒドラジン部位の高い不安定性(Hwu et al.2004)が、in vitroと比較してin vivoでの効力が制限される原因である可能性がある。マウスにおける効力および薬物動態は、他の者によって確認されている(Lu et al.2013)。Luら(2013)によれば、シッフ塩基加水分解によるcompBの分解は、毒性のある代謝物や発がん性物質を生成する可能性があるとのことだ。Luら(2013)は、compBがRMLプリオン株に感染した動物の生存期間を延長するが、最も一般的なCJDサブタイプであるMM1型散発性CJDのプリオンに感染した動物には効果がないことを示している。compBのプリオン株特異的な有効性に関するこれらのデータは、Kawasakiら(2007)のデータと一致するものである。
INDシリーズ
つの2-アミノチアゾール化合物、IND24(図2F、4-(ビフェニル-4-イル)-N-(6-メチルピリジン-2-イル)チアゾール-2-アミン)およびIND81(図2G、4-メチル-N-[4-[5-(2-ピリジニル)-2-チエニル]-2-チアゾリル]-2-アミンは、大規模細胞ベースのスクリーニング、広範囲な構造-活性相関研究および薬物動態分析(Ghaemmaghamiら2014)を通じて開発された。) 100万個の多様な化合物がELISAベースのアッセイを使用して分析され(Ghaemmaghamiら、2010)、2-アミノチアゾールの足場が抗プリオン活性を発揮することが明らかにされた。動物実験では、2-アミノチアゾール骨格を有する化合物は、ネズミ用に液体で適切に処方されると経口吸収され、in vitroの抗プリオン効力をはるかに超える定常脳内濃度を達成することが示された(Gallardo-Godoy et al.2011)。Liら(2013)は、良好なin vivo薬物動態プロファイルを維持するために、2-アミノチアゾール化合物の効力を改善した。IND24またはIND81を投与されたマウスは、最高用量である210 mg/kg/dでも副作用を示さなかった。その後、マウスにおけるIND24およびIND81の完全な薬物動態の調査(Silberら、2013)は、IND24が、スクレイピー由来のRMLおよびME7プリオンまたは慢性消耗病由来のプリオンに感染したマウスの生存を延長したが、MM1-およびVV2型散発性CJD由来のプリオンに対して有効でなかったことを示している(Berryら、2013)。
Anle138b
Anle138b(図2H、3-(1,3-ベンゾジオキソール-5-イル)-5-(3-ブロモフェニル)-1H-ピラゾール)は、200万の多様な薬剤類似化合物からなる一次ライブラリーと、その後の150化合物の集中ライブラリーで、オリゴマー形成の標的化を可能にする単一粒子分光法に基づく新しい手法である「強蛍光標的スキャン」(Bieschke他 2000; Bertsch他 2005)を含めた複合法を用いてスクリーニングした後に発見した(Wagner他2013年)。リード化合物であるanle138bは、compBと比較して、マウスにおける高い生存効果、優れた薬物動態特性(脳内での半減期が長い)、マウスプリオン(スクレイピーのRMLとME7、牛海綿状脳症の301C)および散発性CJDと変異株からのヒトプリオンなど試験したすべてのプリオン株に対する活性という3つの好ましい特徴を備えている。したがって、anle138bは、現時点ではプリオン病の治療薬として最も有望な薬剤候補であると考えられる。ただし、Berryら(2013)は、メチレンジオキシフェノール化合物が神経毒性または肝毒性をもたらすことが示されている(Murray 2000)ため、anle138bにメチレンジオキシフェノール基が存在することが問題となる可能性を暗示している。
ヒトと動物に対する治療研究からの洞察
計り知れない努力の結果、大規模な臨床試験を実施することが可能になったが、表1にまとめたように、CJD患者のためになるような有意義な成果はほとんど得られていない。病気の進行が速く、そのメカニズムが未だ謎に包まれているため、治療介入のタイミングが特に難しい。現時点では、治癒はおろか、QOLを保ったまま生涯生存するという目標には、まだ程遠い状況である。本節では、プリオン病に対する有意に有益な介入を実現するために解決すべき課題について論じる。
先制的介入
臨床試験が生存率の点で一般に失敗する主な理由の1つは、介入の遅れである。実際、プリオン感染動物への介入が遅れれば遅れるほど、抗プリオン化合物の生存期間延長効果は低くなる(Doh-ura et al.2004; Kawasaki et al.2007)。図4に示すように、プリオン病の治療介入に最も適した時期は、前臨床段階の非常に早い時期である。この段階では、指数関数的に蓄積されるプリオンの量は、症状的な疾患発症前に脳内でほぼプラトーに達するため、疾患発症を予防または遅延させる確率が最も高い(Prusiner 1987; Sandberg et al.2014)。その結果、先制的な介入のためには、適切な前臨床診断測定が必要となる。
図4 脳内プリオン蓄積の動態と医療介入のタイミングを示す模式図
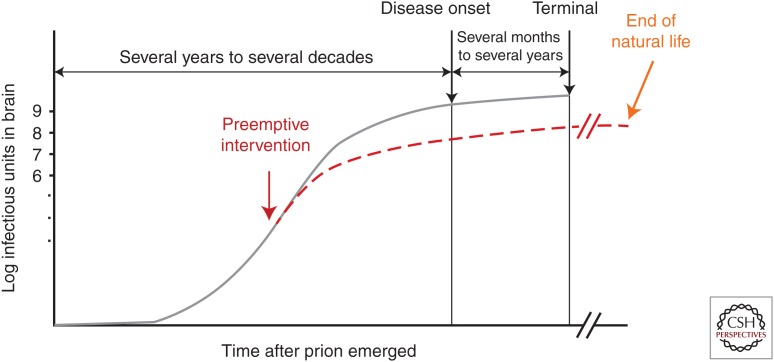
前臨床診断
現在のCJDの診断は、磁気共鳴画像、脳脊髄液分析、脳波検査の結果の組み合わせに依存している(Zerr 2009; Wang et al.2013)。さらに、脳脊髄液中の超微量のPrPScを検出する震動誘発変換分析などの新しい技術(Atarashi et al.2011; McGuire et al.2012; Sano et al. 2013; Cramm et al. 2015; Orrú et al. 2015)、鼻腔ブラッシング(Orrú et al. 2014)、尿(Moda et al. 2014)、または血液(Orrú and Caughey 2011; Orrú et al. 2012)により、早期診断の新しい可能性が示された。これらの近年の診断技術の進歩は、感度が89%~97%、特異度が100%と、目覚ましいものがある(Masters 2014; Moda et al.2014; Orrú et al.2014, 2015)。しかし、これらの技術は、健常なプリオンキャリアやCJDの素因を持つ人のごく初期の前臨床段階を診断するにはまだ不十分である可能性がある。高リスクの健常者を検出するためには、代替マーカーの発見を含め、この分野のさらなる進歩が必要である。
プリオン病は、感染から発症までの潜伏期間が長い。この病気は、どのプリオン病の場合でも、プリオンの素因を持つ人のある部分にしか発生しないらしいので、すでにプリオンに感染している人に必ず発生するのかどうかは、まだ不明である。プリオン病の遺伝的素因を評価するためにゲノムワイドな解析が行われているが、今のところPRNP以外の強力な遺伝的要因は開示されていない。PRNPの多くのミスセンスあるいは挿入型変異は、家族性タイプのプリオン病と関連している(Mastrianni 2010)。また、PRNPの多型コドン129は、kuru、変異型CJD、あるいは異所性CJDなどの後天性プリオン病のリスクと一部関連しているが(Collingeら 1991, 1996)、多型コドン127とコドン219はそれぞれkuru(Meadら 2009; Asanteら 2015)と散発性CJD(渋谷ら 1998)に耐性があるとされる。しかし、このようなPRNP多型を保有していても、その人が病気を発症するかしないかを示唆するものではない(Kobayashi et al.2015)。疾患と関連するPRNP変異を保有していても、必ずしもその人が必然的に疾患を発症することを意味しない。例えば、PRNPのコドン180にバリンからイソロイシンへの変異を有する患者は、本邦の遺伝性プリオン病患者で最も多い(40%)にもかかわらず、これまで家族歴が陽性であったという報告はない(Jin et al.2004)。従って、本疾患の感受性には、他の遺伝的要因や環境要因が強く影響していることが推定される。これらの因子を理解することは、健康でリスクの高い人を特定するために有用である。
単一化合物の限界
もう一つの問題は、抗プリオン化合物の株依存性であり、プリオンに感染した細胞や動物において薬剤耐性プリオンのコンフォマーが出現する(Kawasaki et al.2007; Ghaemmaghami et al.2009; Berry et al.2013; Miller-Vedam and Ghaemmaghami 2013)。この問題は、抗生物質、抗ウイルス剤、抗がん剤を用いた化学療法における同様の薬剤耐性現象から予測されている。しかし、株依存的な活性とそれに続く薬剤耐性プリオンのコンフォーマーの出現の分子メカニズムは、まだ解明されていない。最も有用な化合物(anle138b)が薬剤耐性プリオンの出現なしに病気の進行を止めることができないことを考えると、すべてのプリオン株を標的とする抗プリオン薬物療法の開示は、プリオン病の治療薬開発にとって極めて重要である。単剤治療の限界は、がんやウイルスの単剤治療でしばしば障害となる、体内の解毒システムの誘導に起因する。従って、癌や感染症の化学療法に関する豊富な知見を参考に、プリオン病に対しても異なる構造や標的を持つ薬剤の併用療法が検討されるべきであると考えられる。このようなアプローチの有効性は、プリオン感染げっ歯類で原理的に示されている(Kocisko et al.2006)。
複数のターゲットの組み合わせ
既に述べたように、in silico、in vitro、プリオン感染細胞モデル、プリオン感染動物スクリーニングの組み合わせにより、PrPSc形成阻害あるいはPrPSc分解促進に関する抗プリオン活性を有する化合物あるいは生体材料が多数発見されている(Sim and Caughey 2009; Teruya et al.2009)。これらのモデルのうち、プリオン感染細胞モデルは、Congo redとポリアニオン糖鎖が抗プリオン活性を有することが判明して以来、最も頻繁に利用されている(Caughey and Race 1992; Caughey and Raymond 1993)。実際、我々の研究グループは、プリオン感染細胞モデルを用いて、キナクリンやcompBを含む数十種類の抗プリオン化合物を同定してきた(Doh-ura et al. 2000, 2007b; Ishikawa et al. 2004, 2006; Murakami-Kubo et al. 2006; Kawatake et al. 2007; Nguyen et al. 2008, 2011; Hamanaka et al. 2011, 2015; Teruya and Doh-ura 2013; Nishizawa et al. 2014).しかし、これらの細胞モデルは、in vivoのプリオン感染神経細胞には完全に適合していない。持続的にプリオンに感染した細胞モデルはすべて有糸分裂を行い、蓄積したPrPScに対して不死身であるが、脳のプリオンに感染した神経細胞は有糸分裂を行い、蓄積したPrPScに対して脆弱であると推測される。従って、PrPScの生成・分解だけでなく、PrPScによる神経細胞死を評価するためには、より適切なプリオン感染細胞モデルが必要である。
神経変性に関しては、PrPScの蓄積および/または感染性のレベルは、神経学的悪化のレベルと並行していない(Prusiner 1987; Sandberg et al.2014)。さらに、PrPCのグリコシルホスファチジルイノシトールアンカーを欠くマウスの研究により、これらのマウスは、脳内に顕著なレベルのPrPScまたは感染性が存在するにもかかわらず非常に長期間生存することが示されている(Chesebro et al.2005年)。これらのデータは、PrPScによる神経変性過程に対する先制治療戦略の革新が、PrPScの形成を阻害したりその分解を促進したりする戦略と同等かそれ以上に重要であるかもしれないことを示唆している。前臨床試験の極めて早い段階で神経変性過程に対する最も効果的な治療法を導入することができれば、脳内のPrPSc濃度に関係なく、QOLを維持したまま生涯生存することも可能であろう。しかし、この希望的観測にはさらなる評価が必要である。
結びの言葉
プリオン病に対する大規模な臨床試験は、構造化されたフレームワークによって実現可能となり、いくつかの抗プリオン治療のリード候補が開発された。さらに、プリオン病原体やその病態の理解を深め、より高感度で特異的な診断法、より感受性の高い実験疾患モデル、より簡便な薬剤スクリーニング法を確立するための努力もなされている。しかしながら、発症後の医学的介入により、意味のある効果を得ることは、今のところ困難である。本当に有益な結果を得るためには、介入のタイミングを、PrPScや脳内感染力が低い、より早い前臨床病期に移行させることが必要である。また、プリオン特異的な神経変性機構の解明、プリオン病に対する感受性・抵抗性のある内因性・環境因子の同定、健常プリオンキャリアの診断用サロゲートマーカーの発見など、さらなる進展が必要である。これらの進歩は、最近の研究からもたらされる可能性があるが、引き続き革新的なアプローチや戦略が必要である。
謝辞
Byron Caughey博士の有益な示唆に感謝する。本研究は、文部科学省科学研究費補助金、厚生労働省科学研究費補助金、医薬基盤研究所、日本医療研究開発機構の補助金を受けて実施した。
