Contents
How Children Are Protected From COVID-19? A Historical, Clinical, and Pathophysiological Approach to Address COVID-19 Susceptibility
www.frontiersin.org/articles/10.3389/fimmu.2021.646894/full
11 June 2021
マグダレーナ・アンナ・マサルスカ1*、ハンス・ユルゲン・ゴーバー2
1ポーランド、ワルシャワ、国立老年・リウマチ・リハビリテーション研究所、病態生理学・免疫学部門
2オーストリア、リンツ、ケプラー大学病院 薬剤師科
概要
2020年初頭に新型コロナウイルス感染症(COVID-19)を引き起こす重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の発生と世界的な広がりは、中国南部、イラン、トルコ、イタリア北部など古代のシルクロードに属する地域で高い死亡率を伴っていた。しかし、子どもは世界的に見ても発病率が非常に低く、パンデミックを免れているようである。
小児や新生児が感染しないのは、適応免疫の特定の構成要素が発達初期に存在することを示唆している。IgMに属するネイティブ免疫グロブリンは、新生児や小児に豊富に存在し、自己抗原や変化した自己抗原を認識することが知られている。また、ウイルスのエンベロープにコードされ、感染細胞やストレス細胞の膜にもともと刷り込まれている内因性の「危険信号」を認識して、ウイルスを中和することができるかもしれない。
注目すべきは、COVID-19と、かつてのシルクロードの国々で地域特異的な有病率を示す自己免疫疾患であるベーチェット病患者の間で、重症の成人および小児患者に見られる血栓と血管炎の2つの症状が共通していることである。
分子機構や臨床指標から、活性酸素がCOVID-19の重症化のトリガー因子であることが示唆され、細菌に対する自然免疫防御との関連性が確立された。細菌性病原体による選択的圧力が、この古代の交易路の住民の遺伝子を細菌防御に有利に形成し、21世紀におけるCOVID-19の重症化を不利にした可能性がある。
はじめに
2020年3月11日、世界保健機関(WHO)は、コロノウイルス科の新種であるSARS-CoV-2の感染によって生じる疾患としてCOVID-19をパンデミックと宣言した(1)。重症例では、症状発現から約7日間で間質性肺炎と肺胞障害が現れ、急性呼吸窮迫症候群(ARDS)に至ることもある(2, 3)。ARDSは、サイトカインストームと呼ばれる炎症性サイトカイン、ケモカイン、造血成長因子(IFN-γ, IL-1β, IL-6, IL-7, IL-8, IL-2, TNF, CXCL10, CCL2, GM-CSF)の大量発現を特徴とする無秩序な免疫活性化を伴い(3-5)最終的に過炎症と多臓器疾患(6)となって死亡率の主要原因になっている(7)。敗血症性ショックと多臓器不全が最も多い直接の死因であり、Elezkurtajらが示すように、化膿性肺感染症によるものが多い(8)。
2020年12月23日現在、SARS-CoV-2は世界中で7800万人以上の感染原因となり、170万人以上の死者を出しているが、比較的小児での感染は報告されていない。成人の感染者とは対照的に、SARS-CoV-2感染が確認された小児の多くは、臨床経過が穏やかで、16%近くが感染症状を示さないようである(9)。2020年3月25日までに、イタリアは世界で2番目にCOVID-19の感染者数が多く、死亡者数も多かったが、小児は全人口の10%を占めるものの、18歳以下の小児は全体の1%に過ぎなかった。また、入院を必要とした患児は11%に過ぎず、死亡した患児はいなかった(10)。
SARS-CoV-2感染後の病勢は、2つの異なるメカニズムのチェックポイントで決定されるようである。第一に、臨床症状を引き起こすウイルス感染に対する宿主の感受性の差、第二に、サイトカインストームと死亡率に関連する疾患の深刻な悪化である。その結果、感染しやすさと死亡率は、それぞれ年齢と地域の問題であることが判明した。
2020年春のSARS-CoV-2初期パンデミックにおける小児のCOVID-19に対する免疫と地域による死亡率の違いから、我々は免疫学、ウイルス学、細胞生物学、歴史学、言語学など複数の観点からこれらの疑問に取り組むことになった。その結果、この総説で提案する2つの仮説が導き出された。
まず、小児におけるCOVID-19に関する現在の知見をまとめる。次に、SARS-CoV感染の細胞生物学に関するあまり知られていない事実と、スパイク蛋白に対するIgGを介した防御機構を説明することの困難さについて述べる。最後に、適応免疫の危険モデルに基づく我々の仮説を結論づける。次の2つの章では、ウイルス防御におけるB1 B細胞と天然IgMに関する現在の知見を明らかにし、これらがSARS-CoV-2のパンデミックにどのように適用されうるかを説明する。
最後の2つの章では、COVID-19に関連した死亡率における民族的および世界的な差異を理解することに重点を置いている。死亡率」と題したセクションで COVID-19ではなぜ一部の患者が人工呼吸器とサイトカインストームに見舞われるのか?」では、活性酸素の生成に関わる受容体、シグナル伝達タンパク質、酵素の役割とサイトカインストームとの関連について論じている。最後の章(活性酸素生成の遺伝学と人類の社会的・言語的進化)では、細菌防御に関連する多型と同時にCOVID-19感染症の転帰を決定する我々の仮説について説明する。
小児におけるCOVID-19の感受性と小児免疫の特異性
SARS-Cov-2感染症の小児は、成人と比較して症状が軽く、検査・放射線異常が少ない(11)。2003年のSARS 2012年のMERS-CoVのパンデミック時にも同様の観察結果が報告されている(12, 13)。研究によって異なるが、COVID-19の小児患者の最大35%は無症状である。無症状の小児がウイルスを感染させるかどうかは依然として不明であるが、無症状の小児でもSARS-CoV-2のウイルス量が多いことが示されている(14)。
SARS-Cov-2に感染した小児の多くは、重症度の低いCOVID-19を呈しているが 2020年4月、英国では非定型川崎病に類似した特徴を持つ症例が増加していると報告された(15)。最初に報告された入院小児8名のうち、6名がアフロカリビアン系、1名がアジア系と中東系で、そのうち5名はほとんどが肥満の男児であり、小児のCOVID-19感染しやすい民族的特徴は、COVID-19死亡リスクの高い成人群と似ていることが示唆された(16)。興味深いことに、入院治療中に8人中7人の小児で病原体が確認されなかったことから(15)ウイルス曝露によって引き起こされ、免疫学的にウイルスが除去された後も持続する自己保存性の炎症性疾患であることが示唆された。
最近、SARS-CoV-2のパンデミックが後退した地域で、川崎病に類似した病態に属する新しい小児多系統炎症症候群(MIS-C)が報告されている(17)。本症候群は、古典的な川崎病ではほとんど見られない炎症性ショック、消化器症状、凝固異常が顕著な特徴で、黒人またはヒスパニック系の年長児(本研究では平均年齢12歳)が多く罹患している。すべての小児がIgGおよびIgAクラスのSARS-CoV-2に対する抗体を保有しており、ほとんどの症例で循環IgMは認められなかった(18)。内皮、粘膜、免疫抗原に対するIgGおよびIgAクラスの自己抗体の検出と、好中球および単球のCD54およびCD64のアップレギュレーションは、炎症性自然免疫反応とともに自己反応性がMIS-Cの病因に重要である可能性を示唆している(18)。SARS-Cov-2感染に関連して小児に発症する2つの症候群、川崎様疾患とMIS-Cは、成人におけるCOVID-19感染の重症化要因の1つであることが示されている民族的背景を共有する小児が優先的に罹患するとされている。英国で行われたコホート研究では、患者の個人因子とCOVID-19による院内死亡のリスクとの関連を調査し、成人の主なリスク因子として、男性性、高齢、肥満、民族性(アジア・アフリカ系の人はリスクがかなり高い)が明らかにされた(16)。
小児のSARS-CoV-2感染が全体的に軽いとされる理由は不明であるが、最近のデータでは、10〜14歳以下の小児は成人よりもSARS-CoV-2の感染感受性が低く、青年は成人と同様の感受性を有するようである(19). 小児の無症状SARS-CoV-2感染の頻度は不明であるが、病原体伝播のドライバーとしての小児の役割は実在する可能性がある(20)。
COVID-19の報告症例に占める小児の割合は、4月の3%から8月には12%、9月には15%と大幅に上昇しているにもかかわらず(一方、検査小児は2020年4月から同程度)COVID-19による入院や死亡はまだ稀である(21). 小児は死亡者全体の0.07%を占め、この割合は調査期間中安定的に推移した(21)。
小児と成人の免疫機能の活性の違いは、生命を脅かす肺炎の発症から小児が保護されていることを説明することができる。小児は生理的にリンパ球の数が多く、これはSARS-Cov-2感染下でも持続する(22)。また、小児は成人と比較して、免疫活性化に伴い、IL-6(サイトカインストームの誘導に関与する主要なサイトカイン)などの炎症性サイトカインの産生が減少し、抗炎症性IL-10の産生が高くなることが示されている(23)。そのため、小児はARDSを発症しにくいと考えられる。小児期の頻繁なウイルス感染と定期的なワクチン接種により、自然免疫系と適応免疫系が常に活性化状態にあるため、その後の感染症に効果的に対抗できるのかもしれない(24)。重要なことは、75%以上の小児が4歳の誕生日を迎える前に季節性コロナウイルスに反応して血清変換することである(20)。季節性コロナウイルスとSARSに対する抗体の交差反応性は制限されているが、小児や若年層におけるSARS-CoV-2感染との戦いに役立っている(20)。
しかし、これらの説明はいずれも、小児における軽度のCOVID-19の提示のナゾを説得的に解明するものではない。COVID-19は罹患した母親の乳児でも発症しないことから、IgG、IgA、細胞傷害性CD8+T細胞以外の適応免疫機構が関与していると考えられるようになった。この機構を解明するためには、まずコロナウイルス感染の細胞生物学を理解する必要がある。
SARS-Cov-2感染のセルバイオロジー
コロナウイルス(Covs)は、ポジティブセンスの一本鎖RNAゲノムを持つエンベロープ型ウイルスである(25)。そのうちの3種類(SARS-CoV、MERS-CoV、SARS-CoV-2)は、男性に人獣共通感染症を引き起こすことが知られている(26)。ウイルスゲノムには、スパイク(S)タンパク質、ヌクレオカプシド(N)タンパク質、膜(M)タンパク質、エンベロープ(E)タンパク質という、構造的に完全なウイルス粒子を生成するのに必要な4つの主要構造タンパク質がコードされている。Sタンパク質の中には、宿主の標的受容体に結合する受容体結合ドメイン(RBD)があり、これがウイルスの宿主への侵入を可能にする。SARS-CoVのこれまでの研究から、ウイルスが気道および肺胞上皮細胞、血管内皮細胞、肺胞マクロファージを標的として、宿主細胞内に最初に侵入することが明らかにされている(27)。
コロナウイルスは、他のエンベロープ型ウイルスと異なり、小胞体ゴルジ体中間区画(ERGIC)に出芽し、そこから膜エンベロープを獲得する(25)。小胞体は、ER関連分解(ERAD)と呼ばれるプロセスでミスフォールドしたタンパク質を分解することができるが、ERADの能力を超えると、ミスフォールドしたタンパク質はERストレスおよびUnfolded-Protein Response(UPR)を引き起こす。UPRがさらに延長されると、アポトーシスが開始される。ウイルス感染もまたUPRを引き起こす可能性があり、宿主細胞は抗ウイルス戦略としてUPRを採用している(28)。興味深いことに、CoVのEタンパク質は、感染時にUPRを抑制することで抗アポトーシス機能を発揮し、ウイルスの増殖を継続させている(25)。
このように、ウイルスのエンベロープが宿主の小胞体から発生し、小胞体ストレスに応答していることから、古典的な自己-非自己モデルと危険信号に基づく別の抗原認識モデルを比較検討することにした。
適応免疫に関する古典的な考え方の限界
糖鎖修飾はタンパク質の最も重要な翻訳後修飾の一つであり、真核生物に特徴的である。ウイルスは、宿主細胞内での複製や組み立ての際に、宿主のグリコシル化機構を利用することが多い(29)。糖鎖は、宿主の免疫モニタリングに対して「自己」の全体像を示し、ウイルスのペプチドエピトープの保護膜として機能することがある(30)。SARS-CoVは、中和免疫グロブリンから逃れるために、受容体結合部位の糖鎖シールドのような機構は利用していないようである。むしろ、SARS-CoVのRBDを持つ組換えスパイクタンパク質断片は、試験した他の組換えスパイクタンパク質断片の中で最も高い免疫原性を示した(31, 32)。もし、SARS-CoV-2がこれまでのSARS-CoVと同じような性質を持つならば、中和モノクローナル抗体の治療法開発に役立つと思われる。しかし、ウイルスの拡散や変異に伴って出現するスパイクタンパク質の変化により、SARS-CoV-2はモノクローナル抗体に対して耐性を持つようになるかもしれない。さらに驚くべきことは、SARS-CoV感染で死亡した患者は、生存した患者(感染後20日目)に比べ、中和抗体活性のピークが早く(感染後15日目)達したという報告である(33)。さらに、ARDSに移行した患者の80%が抗ウイルスIgGへのセロコンバージョンに成功していることも、この矛盾に拍車をかけている(34)。Atyeoらは、患者の血清中の特異的なウイルス抗体のレベルと病気の転帰を相関させている(35)。彼らは、回復期の患者にはウイルスのスパイク蛋白に特異的な体液性応答が見られること、一方、死亡した患者ではヌクレオカプシド蛋白に対する抗体が上昇していることを報告している。同様に、SARS-CoV-2関連MIS-Cの小児は、重度のCOVID-19ターンオーバーを免れ、スパイク蛋白に対する特異的IgG抗体を産生するが、ヌクレオカプシド蛋白に対する抗体は産生されない(36).
SARS-Cov-2のクリアランスにおける天然Igmの推定上の役割
幼児や新生児がCOVID-19の発症から守られていること、記憶細胞やIgG産生などの適応免疫の面でナイーブであることから、IgMがその要因の可能性があると考えられている。特に、SARS-CoV-2に対する防御では、天然のIgMが重要な役割を担っていると思われる。天然型IgMは新生児に最も多く存在する免疫グロブリンであり、自己抗原を認識する高い潜在能力を有している。免疫系の適応部門が自己抗原や変化した自己抗原を認識する能力は、Polly Matzingerによって提唱された「危険仮説」の基本原理である(37)。その結果、感染細胞から飛び出したSARS-CoV-2粒子は、UPRの過程であらかじめ変化した宿主の膜に包まれているため、天然のIgMによって「変化した自己」として認識されることになる。アポトーシスの残骸やエクソソームが天然型IgMに認識され、貪食の準備をするのと同様に、SARS-CoV-2もウイルス粒子として、あるいは感染細胞として認識され、効果的に除去される(図1)。
図1 免疫防御の陽と陰
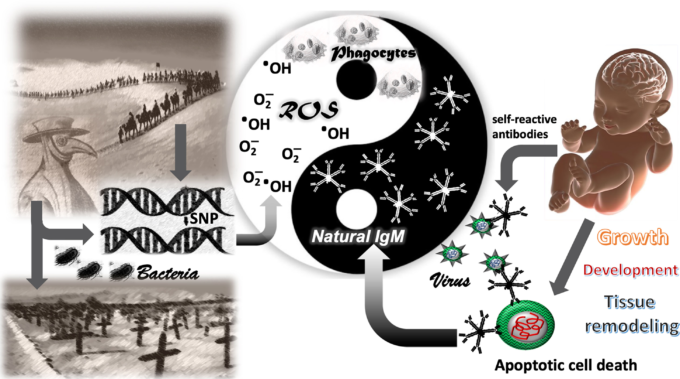
過去の細菌性病原体に対する防御に有利な遺伝的形質(ROSとIgM)は、21世紀のCOVID-19関連死亡率には脆弱なようである。左図は、細菌性病原体が、食細胞における活性酸素種(ROS)の生成など細菌防御を促進する遺伝子の一塩基多型(SNPs)をもつ個体を選択的に生存させることによって、ヒト集団のゲノムを形成していることを示している。右は新生児が本来持っている天然のIgMの高いポリクローナリティを示す。天然型IgMは変化した自己抗原を認識し、発達中の新生児においてアポトーシス細胞の除去に重要である。変化した自己抗原は、コロナウイルス科のウイルスエンベロープにも存在する。このように、炎症のない状態で、天然のIgMがアポトーシスを除去することで、炎症症状や疾患を伴わずにウイルスが中和される。活性酸素は、免疫防御の炎症と抗菌の部分を表し、漢方では陽と関連している。一方、天然型IgMは、組織のリモデリングに関与する免疫系の抗炎症・自己認識の部分を表し、中医学では「陰」と関連付けられている。
以下では、天然型IgMとそれに対応するB1 B細胞について概説し、ウイルス防御におけるそれらの既知の機能をまとめ、SARS-CoV-2致死感染に対する防御におけるそれらの推定上の役割について議論することにする。
ウイルス防御におけるB1 B細胞
B1 B細胞は、従来のB細胞、すなわちB2 B細胞よりも、生体の早い時期に生成される。マウスB1細胞のヒトでの類似体はCD45+CD27+CD70- B細胞サブセットで、ホスホリルコリン(PC)やdsDNAなどの非タンパク質抗原や自己抗原に反応し、ヒト臍帯血や成人の末梢免疫系で検出される (38). B1 B細胞は、出生前に胎児の肝臓で大量に生成され、幼児期には高い割合で存在し(B細胞の70-90%がCD5+)成人期には全末梢B細胞の10%以下に低下し、さらに年齢とともに減少していく(39)。
B1細胞は長寿で自己複製を行い、自然抗体(N抗体)の90%以上を産生するため、自然免疫系と適応免疫系の間の重要なリンクとなる(40, 41)。N抗体の重要な特性は、アポトーシスの残骸の除去、自己免疫および炎症反応の抑制、B細胞の発達の制御によって、免疫の恒常性を維持することである(41)。N抗体は、構造的に保存された抗原(自己および非自己の両方)を認識することにより、微生物に対する防御の第一線を形成する。
1999年、ウイルス抗原に特異的な天然抗体の同定を目的とした最初の研究以来、多くの研究が、ウイルス感染に対する防御に天然IgMの役割を確認した(42, 43)。ポリオ、インフルエンザ、狂犬病などの細胞障害性ウイルスに感染した場合、初期の中和抗体の存在は、致死的な疾患に対する防御に不可欠であり、それはしばしば神経組織におけるウイルスの複製と相関している(43)。B1細胞は胎児の肝臓から発生するため、新生児でも機能的に活性であり、B1細胞によるIgM産生はT細胞の活性化とは無関係であることから、適応免疫成熟期を通じて免疫防御に重要である(41)。ごく初期のB細胞は、新生児の生体の最初の防御を担っており、この防御は基本的に多反応性IgMで構成されているようである(45)。IgMは胎盤関門を通過できないので、respiratory syncytial virus (RSV) -IgMの存在は、新生児における広範な反応性N抗体の存在を反映しているのかもしれない(46)。
我々は、ウイルス免疫防御における同様のメカニズムが、新生児のSARS-Cov-2にも適用されると推測している。MERS-Covや以前のSARS-CoVとは対照的に、SARS-Cov-2に感染した妊婦は好ましくない妊娠経過をたどることはないようである(47)。さらに、SARS-CoV-2は受胎生成物、母乳、出生時の新生児鼻咽頭スワブサンプルからは検出されなかった(48)。COVID-19が確認された母親では、新生児の血清や咽頭ぬぐい液からはウイルスが検出されなかった(48, 49)。興味深いことに、SARS-CoV-2 IgG濃度は6人の乳児のうち5人で上昇し、SARS-CoV-2 IgM濃度の上昇は2人の乳児で観察された(49)。いずれの乳児もCOVID-19の症状を呈していなかったが、炎症性サイトカインIL-6の有意な上昇とAb濃度の上昇は、垂直感染の可能性を支持するものであった(49)。IgG Abは胎盤を通じて母体から胎児に受動的に伝播するが、IgMは高分子であるため伝播しない。IgG値の上昇は母体または乳児の感染を反映していると考えられるが、それらの新生児におけるIgM 抗体値の上昇は、RSV感染と同様にウイルスが胎盤を通過した後に乳児でIgMが産生されたことを示唆していると考えられる。
したがって、母親がSARS-Cov-2に感染している場合、新生児にIgM抗体が存在すれば、たとえ上昇がなくてもCOVID-19に対して十分に防御できる可能性がある。新生児が細菌抗原に暴露されると、抗原特異的N抗体の組成が著しく変化することから、N抗体を産生するB細胞のクローンレパートリーは、個体の生後の抗原履歴によって形成されると考えられる。このようにN抗体の反応性と抗ウイルス活性の可能性は、ウイルス由来の種と密接に関係しており、このことは人獣共通感染症において特に重要である(29)。
天然のIgm抗体(Ab)レパートリーとSARS-Cov-2感染に対する防御への影響
天然抗体は、そのほとんどがIgMアイソタイプであり、IgG、IgA、IgEアイソタイプはさらに少数である(41)。多反応性抗体は、リン脂質、酸化脂質、糖脂質、糖タンパク質などの系統的に保存された構造を認識し、結合する(41, 50)。現在のところ、IgMを分泌するB1細胞のプールは、発生過程で自己抗原を認識した際の正の選択によるものであることが示唆されている。自己抗原を認識するいくつかのIgMおよびIgA N抗体は、アポトーシス細胞の酸化脂質層中のホスファチジルコリン決定基などを認識し、肺炎球菌の細胞壁中の相同分子に結合することがわかった (38)。このように、N抗体のレパートリーは、幼少期から体内に存在する常在菌のコミュニティであるマイクロバイオームとの継続的な相互作用によって調節されている可能性がある。自己抗原と微生物抗原の間のN抗体の交差反応性は、ワクチン接種がAbの産生を促進し、その特異性を調節している可能性も示唆している。実際、酸化低密度リポ蛋白に対する交差反応性抗体(抗oxLDL Ab)の保護レベルは、肺炎球菌ワクチン接種後に有意に高くなるようである(51)。同様のメカニズムは、結核に対するCalmette-Guérin(BCG)ワクチン接種がCOVID-19の有病率と死亡率に負の相関があるという観察を支持するかもしれない(52)。
IgMは、その抗原結合多面性、10個の結合部位による高い活性、IgGに隠されている抗原にアクセスする能力、アポトーシス細胞の除去を促進する能力など、いくつかの異なる特性により、健康や病気におけるIgMの特異的な役割を支持している(42)。これらのユニークな特性により、「変化した」自己抗原の認識と除去が可能となる。この能力は、病原体上の共有分子の結合と関連しており、それによって炎症や組織損傷を制御する免疫恒常性に寄与している。実際、アポトーシス死の過程で細胞上に露出する自己抗原がいくつか知られており、それらは天然のIgMのサブセットによって認識される(38)。興味深いことに、アポトーシス細胞上に露出した酸化関連決定基を特異的に認識するIgMは、ヒトの新生児に非常に多く存在する(53, 54)。感染細胞を出たSARS-CoV-2粒子は、UPRの過程で修飾された宿主膜に覆われており、アポトーシス細胞の修飾に似ていることから、これらの粒子は「変化した自己」として天然のIgMに認識される可能性が非常に高いと考えられる。アポトーシスの残骸や変化した自己粒子が天然のIgMによって認識され、その後貪食の準備をするのと同じように、SARS-CoV-2はウイルス粒子または感染細胞として、子供の免疫系に多く存在するIgMによって認識・除去される可能性があると思われる。
天然型および誘導型IgMはともに高分子(5量体)であり、970 kDaという大きなサイズのため、血管と血管外の区画を容易に行き来できず、粘膜表面、母乳、血清などのポリIg受容体による産生または輸送部位に特異的に保持されている(55)。そのため、天然および誘導されたIgMは、全身だけでなく粘膜の病原体に対する初期の防御機構として働くことができる(56)。それらの抗体は、ヒトにおいて保存されており、細菌の細胞壁やカプセルに組み込まれた特殊なオリゴ糖を認識する(57)。興味深いことに、無菌マウスも通常の通常飼育マウスも血清IgM濃度は同程度であり、血清IgM濃度は外来抗原への曝露とは無関係であるという概念を支持している(42, 58)。さらに、雌マウスは雄マウスよりも有意に高いレベルの血清IgMを示す(57)。このようなオリゴ糖特異的な血清IgMの存在は、細菌感染時に雄マウスよりも雌マウスやその子孫を選択的に生存させることになる。IgM分泌細胞はエストロゲンによって制御されているようであり、エストロゲン駆動型抗体は母方から子孫に受け継がれ、乳児期に保護作用を発揮する(57)。このことは、COVID-19の重症化率が女性で低く、またCOVID関連疾患の重症化率が男子に比べて女子で低いことの理由かもしれない(10, 59)。
死亡率:なぜ一部の患者は人工呼吸器とCOVID-19のサイトカインストームに終止符を打つのか?
呼吸器系は、その大きな肺胞と粘膜表面、そして呼吸のたびに移動する何リットルもの空気のために、継続的な環境交換に関与し、微生物にさらされるすべての臓器の中で最も重要なものである。ガス交換と酸素供給におけるその本質的な役割のために、肺は抗菌防御を伴う炎症を制御する戦略を進化させる必要があった。上皮や粘膜の免疫細胞上に発現する複数の受容体は、免疫防御と炎症のバランスを調整するために、微生物病原体と直接相互作用する。SARS-CoV感染と早期に関連したこれらの受容体の一つは、肺におけるSARS-CoVおよびSARS-CoV-2の機能的受容体であることが証明されたI型膜タンパク質であるACE-2である(60)。ACE-2は、血管作動性ペプチドのカスケードを示すレニン-アンジオテンシン-アルドステロン系(RAAS)の成分で、血圧、創傷治癒、炎症などのヒト生理学の主要なプロセスを制御している(61)。ACE-2の重要な役割は、アンジオテンシンII(AngII)をアンジオテンシン(1-7)に変換することであり、この変換は抗酸化および抗炎症(抗血栓および抗線維化など)効果を持つことが示されている(62, 63)。
SARS-CoV-2感染におけるACE-2の役割は矛盾しているが、肺損傷患者においてACE-2の高レベル発現はむしろ有害であるとする発表文献の証拠が増えてきている(61)。ACE-2の発現は幼児期に高く、思春期にプラトーに達し、成人期には減少するが、男性では女性より早い(64)。エストロゲンやアンドロゲンはACE-2の発現を活性化するので、性ホルモンの減少が加齢に伴うACE-2の発現の減少に寄与していると推測される(64)。ACE-2の発現を年齢、性別、民族別に解析したところ、ACE-2の発現量はアジア人女性や若年層で高く、ACE-2の発現とSARS-CoV-2の重症化の間に負の相関があることが示唆された(64)。小児と比較して、高齢者はACE-2発現細胞や肺前駆細胞の数が減少しており、COVID-19から回復の見込みのない重症肺炎を発症しやすくなっている(65)。
このように、ACE-2を高発現している小児は、アンジオテンシンIIの蓄積とその有害な細胞毒性から守られ、アンジオテンシン-(1-7)によって発揮される抗炎症性の恩恵を受けているようである。
肺のウイルス防御と炎症に重要な役割を果たすもう一つの受容体は、レチノイン酸誘導性遺伝子(RIG)-Iで、様々なウイルスファミリーのRNAを認識する(66)。RIG-Iは、ウイルスRNAを認識すると、アダプター分子であるミトコンドリア抗ウイルスシグナル(MAVS)タンパク質と一緒に、インフラマソームの活性化につながるカスケードを引き起こし、最終的に抗ウイルスインターフェロンの発現に至る(67). 最近の研究では、SARS-CoV-2によるインフラマソームの過活性化がサイトカインストームの原因であることが示唆されている(68)。興味深いことに、インフラマソームとRIG-Iシグナルのアダプター分子は、ミトコンドリア外膜に存在する(67)。ミトコンドリアは、クレブスサイクルと脂質の代謝産物の供給に重要な役割を果たし、細胞の酸化還元平衡の維持に主要な責任を負う小器官である。RIG-IとウイルスRNAを介したインフラマソームの活性化のレベルは、ミトコンドリア関連アダプターMAVSのアップレギュレーションを通じて、活性酸素に依存している(69)(70)。気道および肺胞上皮細胞に発現するNADPHオキシダーゼ(NOX)ファミリーおよびデュアルオキシダーゼ(DUOX)ファミリーに属する複合マルチユニット酵素の活性は、ウイルスチャレンジに続く局所的な活性酸素の生成を触媒している(71)。
このレビューでは、高酸素圧下での補助換気によって引き起こされ、ACE-2のダウンレギュレーションとウイルス負荷によって促進された活性酸素の大量生産が、RIG-Iシグナル、悪化したインフラマソームの活性化と活性酸素の生産間の悪循環をもたらし、サイトカインストームに終わるという仮説が立てられる。COVID-19患者の補助換気は、病気の経過を変えないという証拠が蓄積されている(2, 72)。さらに、NOXとDUOXの継続的な活性のための制限要素である鉄は、活性酸素の蓄積とその細胞毒性を回避するために、フェリチンのアップレギュレーションによってその利用可能性を減少させることが必要である。実際、重症のCOVID患者は血清フェリチンが高値を示し(73-75)、高レベルの活性酸素を伴う炎症プロセスが示唆されている。
活性酸素生成の遺伝学と人類の社会学的・言語学的進化
活性酸素の生成における重要な調節チェックポイントは、マルチユニット酵素であるNOXとDUOXの活性と局在によって決定される。上気道の上皮細胞は数種類のNOXとDUOXのアイソフォームを発現しているが、肺胞上皮細胞、マクロファージ、血管内皮細胞はNOX2,NOX4の2種類のアイソフォームのみを発現している(76)。マクロファージと顆粒球は、細菌性病原体を除去するためにリソソームコンパートメントで十分なROSを生成するためにNOX2を必要とする。NOX2の機能が細菌防御に重要であることは、慢性肉芽腫性疾患(CGD)患者において明らかであり、NOX2の5つのサブユニットのいずれかに変異が確認されると、細菌感染に対する感受性が高くなり、低い生命予後をもたらす(77)。1980年代にCGDの原因としてNOXサブユニットの遺伝子変異が初めて報告されて以来、いくつかのNOXサブユニットや活性酸素の中和に関わる酵素の一塩基多型(SNP)が同定され、動脈硬化(78)II型糖尿病(79)糖尿病性腎症(79)血栓症(80)と関連していることが明らかにされている。しかし、関連するSNPsの他に、これらの研究に参加した患者の民族性に反映される遺伝的背景が、結果に大きな影響を与えるようである。興味深いことに、NOX1-4酵素に共通する小さなp22(phox)サブユニットは、他のすべての酵素サブユニットの集合と細胞内局在に重要な役割を果たし、ROS生成の機能的差異とともに高い多型性を示すことが見いだされた(81)。
活性酸素を中和し、アンジオテンシンIIを減少させるACE-2の役割と一致して、アンジオテンシンIIの持続的な高活性が、COVID-19で観察された臓器損傷の少なくとも一部であるという証拠がある(82, 83)。SARS-CoV-2は、細胞侵入にACE-2を利用した後、ACE-2の発現を低下させ、その結果、アンジオテンシンIIの無反応な蓄積と局所的なRAAS活性化をもたらす(84, 85)。血漿中アンジオテンシンIIのレベルは、COVID-19患者の肺損傷の程度および総ウイルス量と相関している(83)。
1950年代に抗生物質が発明され、広く使用されるようになる以前は、細菌感染が人類の主要な死因であった(86)。細菌とその宿主適応能力は、生殖年齢に達する前の若い個体に免疫機能に対する選択圧を維持することによって、数千年にわたり人類の進化を形成してきたのである。活性酸素の生成や中和、あるいは食細胞における細胞内局在の機能差に関連する遺伝子の多型は、抗生物質以前の時代の生存とその後の遺伝的継承に大きな影響を与えた可能性がある(図1)。人類の歴史において、人々は自分たちの生活を支え、向上させてくれる地域に移動し、定住した。シルクロードに代表される古代の交易路は、東南アジアと南ヨーロッパを結ぶ1,500年にわたる定住のための経済ベルトを提供した。このルートでは、多様な民族的・遺伝的背景を持つ人々の移動に伴い、ネズミや寄生虫、病原体などが発生した。このように、シルクロードのような古代の交易路では、複数の民族の遺伝的背景が融合し、細菌への曝露が激化する中で、細菌免疫防御のための遺伝子変異が生成・選択された可能性がある。今日まで、原因不明の自己免疫性血管炎であるベーチェット病の有病率は、シルクロードの国々に沿っていることから(87)、このルートにおいて明確な免疫学的形質の選択過程があったことが示唆されている。ベーチェット病と重症COVID-19の間には、血管炎や血栓症といった異なる症状を引き起こす素因があることは注目に値する。興味深いことに、炎症性疾患を引き起こし、永続させる主要なサイトカインの一つであるGM-CSFの変異は、ベーチェット病様疾患発症のリスクアレルの一つであることが示された(88)。血栓症は、病状の悪化したCOVID-19患者で頻繁に観察され(89)、川崎病に似た血管炎は、SARS-CoV-2との接触が疑われた後に、特に小児で観察された(90)。2020年初頭、COVID-19による死亡率が高い国や地域、あるいはSARS-CoV-2の感染率が高い状態が続いている国を地図上で結ぶと、イラン、トルコ、イタリア北部、中国南部などかつてのシルクロードの一部となる国や地域が挙げられる。COVID-19の震源地である武漢は、古代シルクロードの始まりである広州から1000km弱の距離にあり、両都市ともパンデミック時の死亡率が異常に高いことに悩まされた(2, 91)。一方,フランスとスイス南部は,人類史上長い期間にわたって北イタリアと言語的,文化的,経済的なつながりを共有してきた。両地域はCOVID-19に関連した死亡率の影響を大きく受けている(92)。カナダでも同様で、フランス語圏のケベック州だけがCOVID-19による死亡率の影響を強く受けている。
したがって、我々は、古代、シルクロードに沿った1,500年の間に、酸化還元平衡に影響を与える明確な遺伝形質が、その地域の住民の中に形成されたという仮説を提案したい。これらの遺伝的形質が、過去には殺菌活性酸素の適切な産生によって細菌性病原体に対する防御に役立っていたのと同様に、同じ遺伝的形質が、21世紀には図1に示すようにCOVID-19関連死亡率に対して脆弱であることを証明しているのである。
考察
COVID-19の病態は肺疾患をはるかに超えており、これまでに報告された他のウイルス性肺炎とは似て非なるものである(23)。治療法を探るには、COVID-19を炎症性疾患における肺、血液、内皮の機能不全の複雑な相互作用としてとらえる必要がある。このような絡み合ったメカニズムを解明するためには、臨床結果が大きく異なる小児と若年成人を対象とした医学者の研究が大きな意味を持つ。
COVID-19については、これまでに膨大な臨床データや基礎科学の結果が発表されているが、重症化するメカニズム、地域や民族による死亡率の違い、小児や若年者がほとんど発症しない理由などは不明である。本総説では、歴史的経緯、現在の臨床データ、あまり知られていない免疫の要素を統合して、これらの疑問に答えるアプローチを行った。その結果、乳幼児、小児、若年者は、内在性の自己抗原によってウイルス粒子や感染細胞を認識する天然IgMのポリクローナリティにより、SARS-CoV-2から保護されていることを危険モデルとして提案する。成人にみられるCOVID-19の重症度の違いは、細菌防御機構の遺伝学的なルーツがあり、高酸素圧下での人工呼吸との組み合わせでCOVID-19の有害性が明らかになると思われる。
この仮説を検証するために、IgM抗体反応や活性酸素代謝に関わる遺伝子に注目し、川崎病様疾患およびMIS-Cの小児の遺伝子解析を行うことを提案する。さらに、ビタミンCなどの抗酸化作用を有する栄養補助食品の使用について、COVID-19の疾患転帰に及ぼす潜在的影響を評価するために、レトロスペクティブな解析とプロスペクティブな研究が必要であると思われる。SARS-CoV-2感染の重症度と活性酸素代謝に関与する遺伝子の一塩基多型との相関の検索は、我々の仮説を検証することになる。
最近の臨床観察は我々の仮説を支持している。生物学的疾患修飾性抗リウマチ薬(bDMARDs)のような免疫調整剤がSARS-CoV-2感染の予後に影響を与えるかどうかは今のところ不明であるが、bDMARDs治療がCOVID-19の予後悪化と相関しないことが個々の事例から報告されている(93)。また、欧州リウマチ連盟(EULAR)のガイドラインでは、リウマチ患者には免疫調節療法を継続することが推奨されている(94)。しかし、最近、2例の死亡例が報告されたため、免疫介在性疾患患者にB細胞枯渇性bDMARDであるリツキシマブ(RTX)を使用する際には、若干の注意が必要である(95)。この観察は、リツキシマブ治療を受けた2人の重症COVID-19肺炎患者におけるSARS-CoV-2ウイルス血症の持続とウイルス消失の兆候のない死亡に関する報告によって裏付けられている(96)。SARS-CoV-2に感染したIRD患者のためのドイツ全国登録からの驚くべきデータは、RTXで治療された患者の61%が入院を必要とし、50%が人工呼吸を必要としたことを示している(97)。実際、RTX投与の結果、IgM濃度が非常に低くなっており、これはCOVID-19に対する防御免疫にIgMが重要な役割を担っているという我々の仮説を支持するものと考えられる(98)。さらに,アガマグロブリン血症患者におけるCOVID-19の軽度の臨床経過は,COVID-19の重症化あるいは致死的経過から身を守るのはIgGでないことを示唆している(99).
結論と治療介入の可能性について
COVID-19関連死亡の主要因としての活性酸素に関する我々の仮説から結論づけると、リソソームコンパートメントにおける活性酸素を標的とする両親媒性の抗酸化剤の使用が提案される。穏やかな鎮静剤であるメラトニンは、抗酸化剤と両親媒性の特性を共有し、さらに副作用の可能性も低い(100)。抗酸化作用と細胞保護作用によるCOVID-19治療のもう一つの選択肢は、ヒトに最も多く存在する遊離アミノ酸であるタウリンかもしれない(101)。タウリンは、次亜塩素酸の解毒など、酸化ストレスに関連する炎症プロセスを制御し、その結果、毒性の低い、抗炎症性のタウリン・クロラミンを形成する。我々は、活性酸素代謝に関連する遺伝子の多型を同定することにより、感染者の重症化しやすい潜在的な感受性を推定し、疾患の初期にIgMに富む免疫グロブリン製剤を静脈内投与する臨床試験を行うことを提案する。